Задачи по химии на массовую долю с решением – Задачи на тему «массовая доля вещества в растворе».
Задачи на тему «массовая доля вещества в растворе».
Раствором называют гомогенную смесь двух или более компонентов.
Вещества, смешением которых получен раствор, называют его компонентами.
Среди компонентов раствора различают растворенное вещество, которое может быть не одно, и растворитель. Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
Иногда понятие растворитель может быть применимо в равной степени к любому из компонентов. Например, это касается тех растворов, которые получены смешением двух или более жидкостей, идеально растворимых друг в друге. Так, в частности, в растворе, состоящем из спирта и воды, растворителем может быть назван как спирт, так и вода. Однако чаще всего в отношении водосодержащих растворов традиционно растворителем принято называть воду, а растворенным веществом — второй компонент.
В качестве количественной характеристики состава раствора чаще всего используют такое понятие, как
где ω(в-ва) – массовая доля вещества, содержащегося в растворе (г), m(в-ва) – масса вещества, содержащегося в растворе (г), m(р-ра) – масса раствора (г).
Из формулы (1) следует, что массовая доля может принимать значения от 0 до 1, то есть составляет доли единицы. В связи с этим массовую долю можно также выражать в процентах (%), причем именно в таком формате она фигурирует практически во всех задачах. Массовая доля, выраженная в процентах, рассчитывается по формуле, схожей с формулой (1) с той лишь разницей, что отношение массы растворенного вещества к массе всего раствора умножают на 100%:
Для раствора, состоящего только из двух компонентов, могут быть соответственно рассчитаны массовые доли растворенного вещества ω(р.в.) и массовая доля растворителя ω(растворителя).
Массовую долю растворенного вещества называют также концентрацией раствора.Для двухкомпонентного раствора его масса складывается из масс растворенного вещества и растворителя:
Также в случае двухкомпонентного раствора сумма массовых долей растворенного вещества и растворителя всегда составляет 100%:
Очевидно, что, помимо записанных выше формул, следует знать и все те формулы, которые напрямую из них математически выводятся. Например:
Также необходимо помнить формулу, связывающую массу, объем и плотность вещества:
m = ρ∙V
а также обязательно нужно знать, что плотность воды равна 1 г/мл. По этой причине объем воды в миллилитрах численно равен массе воды в граммах. Например, 10 мл воды имеют массу 10 г, 200 мл — 200 г и т.д.
Для того чтобы успешно решать задачи, помимо знания указанных выше формул, крайне важно довести до автоматизма навыки их применения. Достичь этого можно только прорешиванием большого количества разнообразных задач. Задачи из реальных экзаменов ЕГЭ на тему «Расчеты с использованием понятия «массовая доля вещества в растворе»» можно порешать здесь.
Примеры задач на растворы
Пример 1
Рассчитайте массовую долю нитрата калия в растворе, полученном смешением 5 г соли и 20 г воды.
Решение:
Растворенным веществом в нашем случае является нитрат калия, а растворителем — вода. Поэтому формулы (2) и (3) могут быть записаны соответственно как:
Из условия m(KNO3) = 5 г, а m(Н2O) = 20 г, следовательно:
Пример 2
Какую массу воды необходимо добавить к 20 г глюкозы для получения 10%-ного раствора глюкозы.
Решение:
Из условий задачи следует, что растворенным веществом является глюкоза, а растворителем — вода. Тогда формула (4) может быть записана в нашем случае так:
Из условия мы знаем массовую долю (концентрацию) глюкозы и саму массу глюкозы. Обозначив массу воды как x г, мы можем записать на основе формулы выше следующее равносильное ей уравнение:
Решая это уравнение находим x:
т.е. m(H2O) = x г = 180 г
Ответ: m(H2O) = 180 г
Пример 3
150 г 15%-ного раствора хлорида натрия смешали со 100 г 20%-ного раствора этой же соли. Какова массовая доля соли в полученном растворе? Ответ укажите с точностью до целых.
Решение:
Для решения задач на приготовление растворов удобно использовать следующую таблицу:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | |||
mр-ра | |||
ωр.в. |
где mр.в., mр-ра и ωр.в. — значения массы растворенного вещества, массы раствора и массовой доли растворенного вещества соответственно, индивидуальные для каждого из растворов.
Из условия мы знаем, что:
m(1)р-ра = 150 г,
ω(1)р.в. = 15%,
m(2)р-ра = 100 г,
ω(1)р.в. = 20%,
Вставим все эти значения в таблицу, получим:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | |||
mр-ра | 150 г | 100 г | |
ωр.в. | 15% | 20% | искомая величина |
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ωр.в. = 100% ∙ mр.в./mр-ра , mр.в. = mр-ра ∙ ωр.в./100% , mр-ра = 100% ∙ mр.в. /ωр.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ωр.в., зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m(2)р.в. = m(2)р-ра ∙ ω(2)р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 22,5 г | 20 г | |
mр-ра | 150 г | 100 г | |
ωр.в. | 15% | 20% | искомая величина |
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m(3)р.в. и m(3)р-ра):
m(3)р.в. = m(1)р.в. + m(2)р.в. = 22,5 г + 20 г = 42,5 г
m(3)р-ра = m(1)р-ра + m(2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 22,5 г | 20 г | 42,5 г |
mр-ра | 150 г | 100 г | 250 г |
ωр.в. | 15% | 20% | искомая величина |
Вот теперь мы вплотную подобрались к расчету искомой величины ω(3)р.в.. В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω(3)р.в. = 100% ∙ m(3)р.в./m(3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
mдоб.(H2O) = Vдоб.(H2O) ∙ ρ(H2O) = 50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 0 г | ||
mр-ра | 200 г | 50 г | |
ωр.в. | 15% | 0% | искомая величина |
В первом столбце известны два значения, значит можем посчитать третье:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в./100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m(3)р-ра = m(1)р-ра + m(2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 30 г | 0 г | |
mр-ра | 200 г | 50 г | 250 г |
ωр.в. | 15% | 0% | искомая величина |
Теперь стали известны два значения в первой строке, значит можем посчитать значение m(3)р.в. в третьей ячейке:
m(3)р.в. = m(1)р.в. + m(2)р.в. = 30 г + 0 г = 30 г
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 30 г | 0 г | 30 г |
mр-ра | 200 г | 50 г | 250 г |
ωр.в. | 15% | 0% | искомая величина |
Теперь можем рассчитать массовую долю в третьем растворе:
ω(3)р.в. = 30/250 ∙ 100% = 12%.
scienceforyou.ru
Примеры решения типовых задач на массовую долю растворённого вещества в растворе
Важно знать! Как научиться решать задачи по химии.
Задача 3.1.
Решение. Из w = mв-ва / mр-ра находим массу хлорида натрия:
mв-ва = w • mр-ра = 0,1 • 250 г = 25 г NaCl
Поскольку mр-ра = mв-ва + mр-ля, то получаем:
m(Н20) = mр-ра — mв-ва = 250 г — 25 г = 225 г Н20.
Задача 3.2. Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение. Поскольку w = mв-ва / (V • ρ), то получаем:
mв-ва = w • V • ρ = 0,262 • 400 мл • 1,13 г/мл = 118 г
Задача 3.3. К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение. Находим массу соли в исходном растворе:
mсоли = w • mр-ра = 0,14 • 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
mр-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = mсоли / mр-ра = 28 г / 280 г = 0,100.
Задача 3.4. Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение. Для первого раствора имеем:
w1 = 0,78 и ρ1 = 1,70 г/мл.
Для второго раствора имеем:
V2 = 500 мл, w2 = 0,12 и ρ2 = 1,08 г/мл.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w2 = m2 / (V2 • ρ2) имеем:
m2 = w2 • V2 • ρ2 = 0,12 • 500 мл • 1,08 г/мл = 64,8 г.
Масса вещества в первом растворе также равна m2 = 64,8 г. Находим
объем первого раствора. Из w1 = m1 / (V1 • ρ1) имеем:
V1= m1 / (w1 • ρ1) = 64,8 г / (0,78 • 1,70 г/мл) = 48,9 мл.
Задача 3.5. Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение. Для первого раствора имеем:
w1 = 0,0465 и ρ1 = 1,05 г/мл.
Для второго раствора имеем:
V2 = 50 мл, w2 = 0,30 и ρ2 = 1,33 г/мл.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w2 = m2 / (V2 • ρ2) имеем:
m2 = w2 • V2 • ρ2 = 0,30 • 50 мл • 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m2 = 19,95 г.
Находим объем первого раствора. Из w1 = m1 / (V1 • ρ1) имеем:
V1= m1 / (w1 • ρ1) = 19,95 г / (0,0465 • 1,05 г/мл) = 409 мл.
Коэффициент растворимости (растворимость) — максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор — это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6. Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение. В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
mр-ра = mводы + mсоли = 100 г + 8,6 г = 108,6 г,
а массовая доля соли в растворе равна:
w = mсоли / mр-ра = 8,6 г / 108,6 г = 0,0792.
Задача 3.7. Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение. Пусть растворимость соли равна х г в 100 г воды.
Тогда масса раствора равна:
mр-ра = mводы + mсоли = (х + 100) г,
а массовая доля равна:
w = mсоли / mр-ра = х / (100 + х) = 0,256.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г на 100 г воды.
Молярная концентрация с — отношение количества растворенного вещества v (моль) к объему раствора V (в литрах), с = v(моль) / V(л), с = mв-ва / (М • V(л)).
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8. Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение. Для растворов с молярной концентрацией имеем:
с = m / (М • V),
где с — молярная концентрация,
m — масса вещества,
М — молярная масса вещества,
V — объем раствора в литрах.
Отсюда
m = с • М • V(л) = 2 моль/л • 56 г/моль • 4 л = 448 г КОН.
Задача 3.9. Сколько мл 98%-ного раствора Н2SO4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w1 = m1 / (V1(мл) • ρ1).
Необходимо найти объем этого раствора V1(мл) = m1 / (w1 • ρ1).
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с2 = m2 / (М • V2(л)) и m2 = с2 • М • V2(л).
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V1(мл) = m / (w1 • ρ1) = (с2 • М • V2) / (w1 • ρ1) = (0,25 моль/л • 98 г/моль • 1,5 л) / (0,98 • 1,84 г/мл) = 20,4 мл.
[Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 11 класс» / М.А. Рябов]
Решение задач на растворы (массовая доля). Массовая доля. Расчеты по химическим формулам. Задачи по химии.
Видео ютуб канала «День знаний»
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
Решение типовых задач по химии
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
CHEM-MIND.com- НОВОСТИ
- Новости
Алгоритм обучения для подготовки к ЕГЭ по химии
НовостиОтветы в тестах вновь правильно отображаются!
НовостиТехнические проблемы
НовостиНовый раздел на сайте
НовостиС 8 марта
- Новости
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
Разбор задания №11 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
- ТЕСТЫ
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам
Тесты по темам
Тест №40 «Высокомолекулярные соединения»
Тесты по темамТест №39 «Химия и проблемы охраны окружающей среды»
Тесты по темамТест №38 «Общие научные принципы химического производства»
Тесты по темамТест №37 «Химическая лаборатория»
- ВсеВариаты ЕГЭТесты по заданиямТесты по темам
Тесты по темам
- СТАТЬИ
- Статьи
Решение типовых задач по химии
- Статьи
www.chem-mind.com
Задачи на массовую долю вещества в растворе
13-Фев-2013 | комментариев 20 | Лолита Окольнова
Есть очень простая формула массовой доли — масса части разделить на массу целого, но в задачах на нахождение массовой доли в растворах есть несколько небольших, но очень существенных нюансов.
Давайте рассмотрим несколько примеров задач на эту тему.
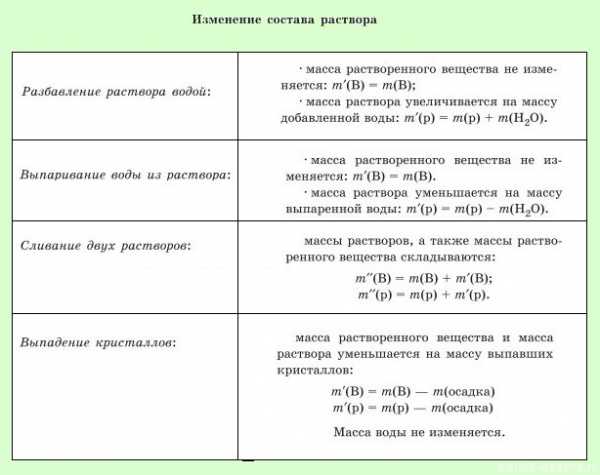
1. Выделение газа из среды реакции:
В задачу закралась опечатка — дан нитрат калия, а получают карбонат натрия… давайте сделаем расчет на натрий.
Запишем реакцию: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O
В результате реакции выделяется углекислый газ — CO2. Обозначим массу полученной соли m,
n(NaNO3)= m\Mr = m\ 85 моль.
Тогда, по уравнению реакции количество азотной кислоты будет равно количеству соли:
n(HNO3) = n (NaNO3)= m \85 моль.
m(HNO3)= Mr•n = 63 •m \85 г
Это количество вещества, вступившего в реакцию, нам дано, что это количество соответствует 6.3 %, значит, масса 100% — масса раствора азотной кислоты равна 63 •m •100\(6.3 •85) г
Формула массовой доли вещества в растворе:
m(вещества)=m(NaNO3)=63 •m \85 гА масса всего раствора будет слагаться из масс реагентов и надо вычесть массу выделившегося газа:
m( раствора HNO3) + m(Na2CO3)- m(CO2)
m(раствора)= 63 •m •100\(6.3 •85) + 106• m\ 2•85 — 44•m\ 2•85 = 1031•m\85 г
w=m(HNO3) \ m(раствора) =63 •m \1031• m = 0,0611 или 6.11%
Важно понимать, что происходит при протекании заданной реакции — если выделяется газ, то он уходит из среды раствора, значит, при вычислении массовой доли надо вычесть массу газа из массы раствора.
2. Выпадение осадка:
Реакция: NaCl + AgNO3 = AgCl↓ + NaNO3
В ходе реакции выпадает осадок, значит, при расчете массовой доли, надо будет вычесть массу осадка из массы раствора.
m(NaCl)= m(раствора) • w = 117 • 0.05 = 5,85 г
n(NaCl)= m\Mr=5,85\58,5=0.1 моль
m(AgNO3)=m(раствора) • w=127.5 • 0.02 = 2,55 г
n(AgNO3)= m\Mr=2,55\170 = 0,015 моль
Т.к. количество молей двух реагентов не одинаковое, то надо решить, какое вещество дано в недостатке и по этому количеству молей рассчитать количество полученной соли.
NaCl + AgNO3 = AgCl↓ + NaNO3
0.1 моль 0.015 моль -> 0.015 моль
Очевидно, что хлорид натрия у нас в избытке, значит, считаем по нитрату серебра — n(AgCl)=n(AgNO3 )=0.015 моль.
m(AgCl)=n•Mr=0.015•143,5=2,1525 г
Этот осадок уйдет из раствора, поэтому при вычислении массовой доли это число надо вычесть из массы раствора:
m(раствора) = m(раствора NaCl) + m(раствора AgNO3) — m(AgCl) = 117+127.5-2,1525=242,3475 г
Находим массовую долю вещества в растворе:
w=m(NaNO3) \ m(раствора)=1.275\242,3475 = 0,00526 или 0.526%

Еще на эту тему:
Обсуждение: «Задачи на массовую долю вещества в растворе»
(Правила комментирования)distant-lessons.ru
Решение задач с использованием понятия «Массовая доля растворенного вещества». Растворение и концентрирование растворов
Разделы: Математика, Химия
На уроках химии достаточно часто приходится решать задачи, в которых используются математические методы и приемы, вызывающие затруднения у учащихся, и учителю химии приходится брать на себя функции учителя математики и, в тоже время, задачи с химическим содержанием, с использованием специальных терминов сложно объяснить без специальной подготовки учителю математики. Так родилась идея подготовить и провести серию факультативных занятий совместно учителем химии и математики по решению задач на смеси с учащимися 9 классов.
ТЕМА: РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ ПОНЯТИЯ “МАССОВАЯ ДОЛЯ РАСТВОРЁННОГО ВЕЩЕСТВА. РАЗБАВЛЕНИЕ И КОНЦЕНТРИРОВАНИЕ РАСТВОРОВ” (ИНТЕГРАЦИЯ ХИМИИ И АЛГЕБРЫ)
ЦЕЛИ:
ОБОРУДОВАНИЕ: КОМПЬЮТЕР, МУЛЬТИМЕДИЙНАЯ ПРИСТАВКА, ЭКРАН, ПРЕЗЕНТАЦИЯ.
ХОД УРОКА.
Учитель химии: Количественный состав раствора выражается его концентрацией, которая имеет разные формы выражения. Чаще всего используют массовую концентрацию или массовую долю растворённого вещества. Вспомним математическую формулу для выражения массовой доли растворённого вещества.
Ученик:
- Массовая доля растворённого вещества обозначается – W р.в.
- Массовая доля растворённого вещества – это отношение массы растворённого вещества к массе раствора: W (р.в.) = m (р.в.)/m (р-ра) x 100%.
- Масса раствора складывается из массы растворённого вещества и массы растворителя: m (р-ра) = m (р.в.) + m (р-ля)
- Формула для массовой доли растворённого вещества будет выглядеть следующим образом: W (р.в.) = m (р.в.)/ m (р.в.) + m (р-ля) x 100%
- Преобразуем данную формулу и выразим массу растворённого вещества и массу раствора: m (р.в.) = w (р.в.) x m (р-ра)/100%, m (р-ра) =m (р.в.)/w (р.в.) x 100%
Учитель химии: Предлагаю решить задачу, используя предложенные формулы.
Задача. Сколько грамм йода и спирта нужно взять для приготовления 500 грамм 5%-ной йодной настойки?
| ДАНО: | РЕШЕНИЕ: |
| M (р-ра)=500 г. | W (р.в.)=m(р.в.)/m(р-ра) |
| W (р.в.)=5%=0,05 | W (р.в.)=m(I2)/m(наст.) |
| НАЙТИ: | m (I2)=W(р.в.)x m(наст.) |
| m(I2)=? | m(I2)=0,05 x 500 г.=25 г. |
| m(спирта)=? | m(р-ра)=m(I2)+m(спирта) |
| m(спирта)=m(р-ра)-m(I2) | |
| m(спирта)=500 г.-25г.=475 г. |
ОТВЕТ: m (I2)=25 г., m (спирта)=475 г.
Учитель химии: Очень часто в работе химических лабораторий приходится готовить растворы с определённой массовой долей растворённого вещества смешиванием двух растворов или разбавлением крепкого раствора водой. Перед приготовлением раствора нужно провести определённые арифметические расчёты.
Задача. Смешаны 100 грамм раствора с массовой долей некоторого вещества 20% и 50 грамм раствора с массовой долей этого вещества 32%. Вычислите массовую долю растворённого вещества во вновь полученном растворе.
Учитель химии: Решим эту задачу, используя правило смешения.
Запишем условие задачи в таблицу:
1 раствор |
2 раствор |
3 раствор |
|
| Масса раствора | m1=100 г. |
m2=50 г. |
m3=m1+m2 |
| Массовая доля растворённого вещества % | W1=0,2 |
W2=0,32 |
W3 |
| Масса растворённого в-ва в растворе | m1w1 |
m2w2 |
m3w3 |
Решим задачу, используя правило смешения:
- m1w1+m2w2=m3w3
- m1w1+m2w2=(m1+m2) w3
- m1w1+m2w2=m1w3+m2w3
- m1w1-m1w3=m2w2-m2w2
- m1(w1-w3)=m2(w3-w2)
- m1/m2=(w3-w2)/(w1-w3)
ВЫВОД.
Отношение массы первого раствора к массе второго равно отношению разности массовых долей смеси и второго раствора к разности массовых долей первого раствора и смеси:
m
1/m2=(w3-w2)/(w1-w3)ОТВЕТ: массовая доля растворённого вещества во вновь полученном растворе составляет 24%.
Учитель математики: Эту задачу можно решить, используя алгебраические преобразования:
РЕШЕНИЕ.
1.Найдём массу растворённого вещества в каждом из растворов:
20% от 100 г 32% от 50 г
0,2х100=20(г) 0,32х50=16(г)
2.Найдём массу растворённого вещества в смеси:
20+16=36(г)
3.Найдём массу раствора:
100+50=150(г)
4.Пусть концентрация полученного раствора составляет х%, тогда масса растворённого вещества в смеси:
Х% от 150 г
0,01Хх150=1,5Х
5.Составим уравнение и решим его:
1,5Х=36
Х=36:1,5
Х=24
ОТВЕТ: концентрация полученного раствора составляет 24%.
Учитель химии: В курсе химии встречаются задачи, решение которых можно осуществить только методом систем уравнений
Задача: Смешали 30%-ный раствор соляной кислоты с 10%-ным раствором этой же кислоты и получили 600 грамм 15%-ного раствора. Сколько грамм каждого раствора было взято?
ДАНО:
- W1=30%=0,3
- W2=10%=0,1
- W3=15%=0,15
- m3(р-ра)=600 г.
НАЙТИ:
- m1(р-ра)=?
- m2(р-ра)=?
РЕШЕНИЕ:
Учитель математики: Введём обозначения:
Рассчитаем массы растворённых в-в:
- m1=0,3X,
- m2=0,1Y,
- m3=600 г. x 0,15=90 г.
Составим систему уравнений:
Решим подчёркнутое уравнение:
180-0,3Y+0,1Y=90
180-0,2Y=90
180-90=0,2Y
90=0,2Y
Y=450
- если Y=450 г., то X=600 г.-450 г.=150 г.
ОТВЕТ:
- масса 1 р-ра=150 г.
- масса 2 р-ра=450г.
Учитель химии. Решим эту же задачу методом смешения. Какой ответ у вас получился? (Ответы сходятся).
ДОМАШНЕЕ ЗАДАНИЕ.
ЗАДАЧА.
- В каких массовых надо смешать 20%-ный и 5%-ный растворы одного вещества, чтобы получить 10%-ный раствор?
АЛГОРИТМ РЕШЕНИЯ:
- 1.Ввести буквенные обозначения для масс растворов.
- 2.Вычислить массы растворённых веществ в первом, втором растворе и смеси.
- 3.Составить систему уравнений и решить её.
- 4.Записать ответ.
Презентация
2.02.2006
Поделиться страницей:xn--i1abbnckbmcl9fb.xn--p1ai
Урок по химии «Массовая доля растворённого вещества. Решение расчётных задач.»
Тема урока: Массовая доля растворённого вещества. Решение расчётных задач.
Цель урока: систематизировать приобретённые теоретические знания, необходимые для решения расчётных задач; закрепить умения решать задачи разных типов; формировать умения применять полученные знания в повседневной жизни; развивать логическое мышление, память, внимание; формировать самостоятельность в выполнении поставленных заданий; учиться рационально использовать время; формировать умения работать в парах.
Тип урока: формирование умений и навыков.
Формы проведения урока: фронтальный опрос, решение задач, работа с учебником, работа в парах.
Ожидаемые результаты учебных достижений: умение дать понятие массовой доли вещества в растворе; применять знания для вычисления массовой доли и массы растворённого вещества в растворе; уметь делать расчёты для приготовления растворов, которые применяются в быту.
Структура урока:
1.Актуализация опорных знаний и практического опыта учеников ( фронтальный опрос):
— что такое раствор? Какие бывают растворы?
— какое вещество может быть растворителем? какое вещество растворённым?
— почему вода является универсальным растворителем?
2. Мотивация учебной деятельности: количественной характеристикой состава растворов является массовая доля растворённого вещества.
3. Сообщение темы, целей и задач урока.
4. Изучение нового материала: прочитать материал и дать ответы на вопросы
— как обозначается массовая доля растворённого вещества?
— какой формулой выражается массовая доля растворённого вещества?
Измеряется в долях и процентах
Обозначается буквой W дубль-вэ
Показывает отношение его массы к массе раствора
Массовая доля
растворённого вещества –
это величина, которая
W = m (ве-ва) : m (ра-ра) × 100% ;
m (ве-ва) = W × m(ра-ра) : 100%; m(ра-ра)= m(ве-ва):W × 100%
5. Первичные применение приобретённых знаний (пробные упражнения). Работа в парах по заготовленным алгоритмам ученики решают предложенные задачи. Обговариваются результаты работы и делаются записи решений задач на доске.
Алгоритм 1
Вычисление массовой доли вещества в растворе
1.Вычислить массу предложенного раствора по формуле:
m(р-ра)=m(ве-ва) + m(H2O)
2.Вычислить массовую долю вещества в растворе по формуле: W=m(в-ва) : m(р-ра) ×100%
Алгоритм 2.
Вычисление массы вещества и массы воды, необходимых для приготовления раствора
1.Вычислить массу вещества по формуле: m(в-ва)=W× m(р-ра) : 100%
2.Вычислить массу воды по формуле: m(H2O)= m(р-ра) – m(в-ва)
Алгоритм 3.
Определение массовой доли газообразного вещества в растворе
1.Вычислить количество растворённого вещества по формуле: n=V:Vm
2.Вычислить массу растворённого вещества: =n×M
3.Вычислить массу раствора: m(р-ра)= m(в-ва)+ m(H2O)
4.Вычислитьмассовую долю вещества в растворе по формуле: W=m(в-ва) : m(р-ра) ×100%
Алгоритм 4.
Определение массовой доли вещества, если к раствору прилили воду
1.Вычислить массу исходного раствора по формуле:
m1(р-ра)=ϸ×V1(р-ра)
2.Вычислите массу вещества в исходном растворе по формуле: m(в-ва)=W× m(р-ра) : 100%
3. Вычислить массу полученного раствора: mпол.(р-ра)= m1(в-ва)+ m(H2O)
4.Вычислить массовую долю вещества в полученном растворе по формуле: W=m1(в-ва) : mпол.(р-ра) ×100%
Алгоритм 5
Вычисление массовой доли вещества, если в раствор добавили растворённое вещество
1.Вычислите массу вещества в исходном растворе по формуле: m1(в-ва)=W× m(р-ра) : 100%
2.Вычислить общую массу растворённого вещества в растворе по формуле: m(в-ва)=m1(в-ва) +m2(в-ва)
3. Вычислить общую массу раствора по формуле: m(р-ра)=m1(р-ра) +m(в-ва)
4. Вычислить массовую долю вещества в конечном растворе по формуле: W=m(в-ва) : m(р-ра) ×100%
Хлорид натрия массой 6 г. растворили в воде массой 194г. Какая массовая доля хлорида натрия в растворе.
Сколько граммов гидроксида натрия необходимо взять для приготовления раствора массой 500г с массовой долей 10%.
В воде массой 2кг растворили хлороводород объёмом 224л.Какая массовая доля хлороводорода в растворе?
Раствор объёмом 1 литр и плотностью 1,31г/мл, в котором массовая доля азотной кислоты составляет 50%, разбавили водой массой 690г. Какая массовая доля кислоты в полученном растворе?
К раствору массой 300г с массовой долей 15% добавили соль массой 5г. Какая массовая доля соли в новом растворе?
6. Применение знаний и умений в стандартных условиях. Индивидуальная работа. Решение задач по сборнику.
7. Домашнее задание.§ 18 читать, задачи 104, 106 письм.
infourok.ru
Решение задач на расчёт массы и массовой доли вещества
Важно знать! Как научиться решать задачи по химии.
Задача 1-10. Сколько граммов кислорода можно получить при нагревании 25 г перманганата калия, если реакция разложения протекает с выходом 86% ?
Решение. Выход реакции η определяется как отношение практически полученной массы продукта к теоретической массе, рассчитанной по уравнению реакции:
η = (mпракт / mтеор) • 100%
Выход дан в условии задачи, а теоретическую массу кислорода рассчитаем по уравнению реакции:
2KMnO4 = К2MnO4 + MnO2 + O2↑.
v(KMnO4) = m(KMnO4) /M (KMnO4) = 25 / 158 = 0,16 моль.
В уравнении реакции разложения коэффициент перед O2 в 2 раза меньше, чем коэффициент перед KMnO4, поэтому количество вещества кислорода также в 2 раза меньше:
v(O2) = v(KMnO4) / 2 = 0,08 моль.
Теоретически возможная масса кислорода
mтеор(O2) = v(O2) • М(O2) = 0,08 • 32 = 2,56 (г).
Согласно уравнению реакции
из 2 моль (2 • 158 = 316 г) KMnO4 образуется 1 моль (32 г) O2;
из 25 г KMnO4 ->>- x г O2.
x = 25 • (32 / 316) = 2,56 (г)
Практическую массу кислорода находим, умножая теоретическую на выход:
mпракт(O2) = mтеор(O2) • η = 2,56 • 0,86 = 2,2 (г)
Ответ: 2,2 г O2.
Задача 1-11. Рассчитайте массовые доли веществ в смеси этилового спирта и воды, в которой число атомов кислорода в 2,5 раза больше числа атомов углерода.
Решение. Стандартный способ решения расчетных задач на установление состава смеси состоит в том, чтобы обозначить количества
веществ через неизвестные переменные и составить для них систему уравнений.
Пусть моль, моль. По условию общее число атомов кислорода (из этилового спирта и воды) в 2,5 раза больше числа атомов углерода (из этилового спирта):
Теперь надо выразить количества атомов через количества молекул, т. е. через x и y. В молекуле содержится один атом , поэтому в х моль содержится столько же, т. е. x моль ; в y моль содержится y моль : Углерод содержится только в этиловом спирте: в молекуле содержится два атома , поэтому в x моль содержится в два раза больше, т. е. 2x моль : . Подставим эти количества атомов в условие задачи:
,
откуда .
Число молекул воды в смеси в 4 раза больше числа молекул спирта.
Массы веществ можно выразить черед количества вещества и учесть соотношение между x и y:
;
;
.
При расчете массовых долей переменная x сокращается, и мы еще раз убеждаемся, что массовая доля вещества не зависит от общего количества смеси:
;
.
Ответ:
[Сборник задач и упражнений по химии: Школьный курс / В.В. Еремин, Н.Е. Кузьменко]
Массовая доля. Расчеты по химическим формулам. Задачи по химии. Решение задач на растворы (массовая доля).
Видео ютуб канала «День знаний»
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru

