Тест 8 щелочноземельные металлы вариант 2 – Тест «Щелочные и щелочноземельные металлы»
Тест «Щелочные и щелочноземельные металлы»
Тест « Щелочные и щелочноземельные металлы»
(контрольный срез знаний)
Цель: проверить знания и умения учащихся то теме «Щелочные и щелочноземельные металлы»
Умения:
определять положение металлов в периодической системе Д.И. Менделеева;
определять строение атома;
определять степень окисления;
составлять полные и сокращенные ионные уравнения
определять продукты реакции;
решать цепочки уравнений;
определять окислитель и восстановитель, писать электронный баланс;
расставлять коэффициенты;
определять молярную массу и молярный объем;
составлять пропорцию.
Знания:
тривиальные названия соединений;
химические свойства металлов, оксидов и гидроксидов;
качественные реакции;
историю открытия металлов.
Предлагаемые тестовые задания содержат теоретические и практические вопросы, соответствующие требованиям государственного стандарта химического образования: основные понятия, законы химии, строение, свойства, получение важнейших классов веществ, изучаемых в 8 классе и 9 классе (I и II четверть)
Количество вариантов: 2
На решение варианта, состоящего из 15 заданий, отводится 40 минут. Тесты состоят из части А (13 заданий )– с выбором правильного ответа из предложенных, и части В (2 задания – цепочка превращений и задача) — ответы учащиеся должны предложить сами.
Оценивание заданий:
Часть А – 1 балл
Часть Б:
Цепочка превращений:
— получение оксида – 1 балл;
— получение гидроксида – 1 балл;
— получение соли – 1 балл;
— метод электронного баланса – 2 балла;
— ионные уравнения – 1 балл.
Задача:
— составление уравнения – 1 балл;
— определение молярной массы – 1 балл;
— определение молярного объема – 1 балл;
— составление пропорции – 1 балл;
— ответ – 1 балл;
— оформление задачи – 1 балл.
Критерии для оценивания тематического теста:
«2» — менее 12 баллов
«3» — 12 — 17 баллов
«4» — 18 — 23 баллов
«5» — 24 — 25 баллов
Тест «Щелочные и щелочноземельные металлы»
Вариант I
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочноземельные металлы находятся в: 1) I A группе; 2) II А группе; 3) IV А группе 4) VIII А группе | 2 |
2 | Какой из указанных металлов является щелочным: 1) Mg; 2) Zn; 3) Ba; 4) K | 4 |
3 | Степень окисления щелочных металлов: 1) +1; 2) +2; 3) -2; 4) +3 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме магния: 1) 2,8,2; 2) 2,8,1; 3) 2,8,8,1; 4) 1,8,8,1 | 1 |
5 | Щелочноземельные металлы: А. Серебристо – белые. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения не верны; 2) Верны А и Б; 3) Верны А и С | 2 |
6 | При взаимодействии с кислородом натрий образует: 1) оксид; 2) пероксид; 3) натрий не реагирует с кислородом. | 2 |
7 | Каустическая сода: 1) NaOH; 2) KOH; 3) Mg (OH)2; 4) NaCl | 1 |
8 | С каким из следующих веществ реагирует кальций? 1) Na2O; 2) NaCl; 3) Cu; 4) h3O | 4 |
9 | С каким из следующих веществ реагирует гидроксид калия? 1) СO2; 2) NaCl; 3) KNO3; 4) Ba(OH)2 | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Na3PO4 и Ca(NO3)2 1) NaNO3; 2) Ca (OH)2; 3) Ca3(PO4)2; 4) NaOH | 3 |
11 | Какая из следующих реакций относится к реакциям ионного обмена? 1) CaO + h3O → Ca (OH)2 2) Ba (NO3)2 + Na2SO4 → BaSO4 + 2 NaNO3 3) 2 Mg + TiO2 → 2 MgO + Ti 4) 3 Ba + N2 → Ba3N2 | 2 |
12 | Соли калия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 4 |
13 | Английский химик впервые получивший магний в 1808г.: 1) Г.Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон | 1 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Ba → BaO → Ba(OH)2 → BaSO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде
1) 2 Ba0 + O02 → 2 Ba+2O-2
Ba0 – 2e → Ba+2 2 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) BaO + h3O → Ba(OH)2
3) Ba(OH)2 + h3SO4 → BaSO4 + 2 h3O
Ba2+ + 2OH- + 2H+ + SO42- → BaSO4 + 2 h3O
2. Решите задачу (6 баллов). При взаимодействии натрия массой 10 г с водой выделился водород. Определите объём водорода (н.у.).
Дано | Решение |
m(Na) = 10г | 0.43 моль х моль 2Na + 2 h3O → 2NaOH + h3 2 моль 1 моль 1) 2) 3) Ответ: V(h3) = 4.816 (л) |
Найти: V(h3) — ? |
Тест «Щелочные и щелочноземельные металлы»
Вариант II
Ученик (ца)_____________________________________________________________
Класс ___________________
Дата ____________________
ФИО учителя ___________________________________________________________
№ п/п | Задание | Ответ |
Блок А (1 балл) Выберите правильный вариант ответа | ||
1 | Щелочные металлы находятся в: 1) I A группе; 2) III А группе; 3) VII Б группе 4) VI А группе | 1 |
2 | Какой из указанных металлов является щелочноземельным: 1) Sr; 2) Cs; 3) Na; 4) Al | 1 |
3 | Степень окисления щелочноземельных металлов: 1) +2; 2) +4; 3) +3; 4) -1 | 1 |
4 | Распределение электронов по энергетическим уровням в атоме калия: 1) 2,8,7,2; 2) 2,8,8,1; 3) 2,8,1; 4) 1,8,8,2 | 2 |
5 | Щелочные металлы: А. Серебристо – белые. Б. Легко режутся ножом. В. Неактивные металлы. 1) Все утверждения верны; 2) Верны А и Б; 3) Верны А и В | 2 |
6 | Реакция сжигания магния сопровождается: 1) взрывом; 2) вспышкой; 3) нет ярко выраженных признаков химической реакции. | 2 |
7 | Английская соль: 1) CaSO4; 2) Ca (OH)2; 3) MgSO4; 4) CaCO3 | 3 |
8 | С каким из перечисленных веществ реагирует калий? 1) Na2O; 2) h3O; 3) Ca (OH)2; 4) Mg | 2 |
9 | С каким веществом реагирует гидроксид кальция? 1) NaOH; 2) Na2O; 3) HCl; 4) h3O | 1 |
10 | Какой осадок образуется при взаимодействии растворов солей Ba (NO3)2 и Na2SO4 1) NaNO3; 2)BaSO4; 3)NaHSO4; 4) Ba (OH)2 | 2 |
11 | Какая из следующих реакций выражается сокращенным ионным уравнением H + + OH — → h3O 1) 2 HCl + Cu (OH)2 → CuCl2 + 2 h3O 2) HBr + KOH → KBr + h3O 3) h3SO3 + 2 RbOH → Rb2SO3 + 2 h3O | 2 |
12 | Соли натрия окрашивают пламя в: 1) зеленый цвет; 2) красный цвет; 3) желтый цвет; 4) фиолетовый цвет | 3 |
13 | Шведский химик, открывший литий в 1817г: 1) Г.Дэви; 2) У. Гилберт; 3) Й. Берцелиус; 4) А.Арфведсон | 4 |
Блок Б
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (6 баллов):
Li → Li2O→ LiOH → Li3PO4
В первом уравнении определите окислитель и восстановитель (метод электронного баланса), третье уравнение напишите в ионном виде.
1) 4 Li0 + O02 → 2 Li+2O-2
Li0 – 1e → Li+ 4 (восстановитель/окисление)
4
O2 + 4e → 2O-2 1 (окислитель/восстановление)
2) Li2O + h3O → 2 LiOH
3) 3LiOH + h4PO4 → Li3PO4 + 3 h3O
3 Li+ + 3OH- + 3H+ + PO43- → Li3PO4 + 3 h3O
2. Решите задачу (6 баллов). При взаимодействии магния с хлором объемом 11,2 л (н.у.), образуется хлорид магния. Определите массу хлорида магния.
Дано | Решение |
V(Cl2) = 11.2 л | 0.5 моль х моль 2Mg + Cl2 → MgCl2 1 моль 1 моль 1) 2) 3) Ответ: m(MgCl2) = 45.5 (г) |
Найти: m(MgCl2) — ? |
xn--j1ahfl.xn--p1ai
Тест по теме «Щелочноземельные металлы и их соединения»
«Щелочноземельные металлы и соединения»
Вариант 1
Выберите 1 верный ответ
1. Атомы щелочноземельныхых металлов имеют на внешнем уровне:
А)1 электрон Б)2 электрона В)3 электрона Г)4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Щелочноземельные металлы в сравнении со щелочными:
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
4. Щелочноземельные металлы соединяются с водой, образуя:
А) гидроксиды Б) гидраты В) гидриды Г) карбонаты
5. Металлические свойства в главной подгруппе II группы:
А) увеличиваются Б) уменьшаются В) не изменяются
Г) сначала увеличиваются, потом уменьшаются
6. Соли кальция окрашивают пламя в:
А) синий цвет Б) желтый цвет В) оранжево-красный цвет
Г) фиолетовый цвет
7. Какое название не относится к CaCO3:
А) мрамор Б) гипс В) мел Г) известняк
8. Гидроксид кальция не реагирует с:
А) H2O Б) P2O5 В) H2SO4 Г) MgO
Напишите уравнение реакций следующих превращений
+Н2О +НNO3 +K2CO3 +HCl
Ва → А → В → С → Д
«Щелочноземельные металлы и соединения»
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют возможность:
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
2.С каким из следующих веществ не реагирует барий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
3. Соли бария окрашивают пламя в:
А) синий цвет Б) желто-зеленый цвет
В) красный цвет Г) фиолетовый цвет
4. Качественной реакцией на СО2 является его реакция с раствором:
А) NaOH Б) KOH В) Ca(OH)2 Г) Mg(OH)2
5. Щелочноземельные металлы хранят:
А) на воздухе Б) в воде В) в керосине Г) на полке
6. Щелочноземельные металлы в химических реакциях являются:
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
7. Щелочноземельные металлы находятся в природе в виде:
А)солей Б)в самородном виде В)гидроксидов Г)оксидов
8. Оксид кальция реагирует с:
А) Na Б) H2O В) Cu(OH)
Напишите уравнение реакций следующих превращений
+O2 +H2SO4 +NaOH +HCl
Mg → A → B → C → Д
«Щелочноземельные металлы и соединения»
Вариант 1
Выберите 1 верный ответ
1. Атомы щелочноземельныхых металлов имеют на внешнем уровне:
А)1 электрон Б)2 электрона В)3 электрона Г)4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Щелочноземельные металлы в сравнении со щелочными:
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
4. Щелочноземельные металлы соединяются с водой, образуя:
А) гидроксиды Б) гидраты В) гидриды Г) карбонаты
5. Металлические свойства в главной подгруппе II группы:
А) увеличиваются Б) уменьшаются В) не изменяются
Г) сначала увеличиваются, потом уменьшаются
6. Соли кальция окрашивают пламя в:
А) синий цвет Б) желтый цвет В) оранжево-красный цвет
Г) фиолетовый цвет
7. Какое название не относится к CaCO3:
А) мрамор Б) гипс В) мел Г) известняк
8. Гидроксид кальция не реагирует с:
А) H2O Б) P2O5 В) H2SO4 Г) MgO
Напишите уравнение реакций следующих превращений
+Н2О +НNO3 +K2CO3 +HCl
Ва → А → В → С → Д
«Щелочноземельные металлы и соединения»
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют возможность:
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
2.С каким из следующих веществ не реагирует барий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
3. Соли бария окрашивают пламя в:
А) синий цвет Б) желто-зеленый цвет
В) красный цвет Г) фиолетовый цвет
4. Качественной реакцией на СО2 является его реакция с раствором:
А) NaOH Б) KOH В) Ca(OH)2 Г) Mg(OH)2
5. Щелочноземельные металлы хранят:
А) на воздухе Б) в воде В) в керосине Г) на полке
6. Щелочноземельные металлы в химических реакциях являются:
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
7. Щелочноземельные металлы находятся в природе в виде:
А)солей Б)в самородном виде В)гидроксидов Г)оксидов
8. Оксид кальция реагирует с:
А) Na Б) H2O В) Cu(OH)2 Г) MgO
Напишите уравнение реакций следующих превращений
+O2 +H2SO4 +NaOH +HCl
Mg → A → B → C → Д
infourok.ru
Тест по химии на тему «Щелочные и щелочно-земельные металлы» (9 класс)
Тест по теме: «Щелочные и щелочноземельные металлы»
Вариант 1
1. Выберите характеристики для щелочных металлов
1) Степень окисления в соединениях +1
2) Степень окисления в соединениях +2
3) Являются сильнейшими восстановителями
5) Из-за активности хранятся под слоем керосина
6) Это серебристо-белые металлы , с характерным блеском, режутся ножом
7) Являются наиболее типичными представителями среди металлов
8) С кислородом образуют только оксиды
9) Оксиды этих металлов получают прокаливанием пероксидов с соответствующим металлом
10) При взаимодействии с кислородом образуют пероксиды
11) Оксиды получают обжигом карбонатов
12) Гидроксиды этих металлов называют щелочи
13) Растворимость гидроксидов растет с увеличением активности соответствующего металла
14) Имеют только растворимые гидроксиды
15) Гидроксиды образуются взаимодействием металлов с водой
16) Гидроксиды получают взаимодействием соответствующих оксидов с водой
17) Металлы реагируют с кислотами
18) Оксиды по характеру кислотные
19) Оксиды по характеру основные
20) Общая формула гидроксида R(ОН)2
21) Общая формула гидроксида RОН
22) Общая формула оксида R2О
23) Общая формула оксидаRO
24) Способны восстанавливать редкие металлы из их оксидов
25) Все соли металлов растворимы
26) Карбонаты этих металлов малорастворимы или нерастворимы в водe
2. В ряду от бериллия к радию атомный радиус:
1) увеличивается 2) уменьшается 3) не изменяется
3. Наиболее ярко выраженные металлические свойства у:
1) лития 2) калия 3) натрия 4) рубидия
4. Какими физическими свойствами обладают щелочные металлы?
1) серебристо — белые, твердые, легкоплавкие вещества
2) серебристо – розовые, мягкие, тугоплавкие вещества
3) серебристо – белые, мягкие, тугоплавкие вещества
4) серебристо – белые, мягкие, легкоплавкие вещества
5. Где содержат щелочные металлы?
1) под слоем воде 2) под слоем керосина 3) под слоем спирта
4) под слоем смеси воды и спирта
6. Оксид бария обладает свойствами:
1) основными 2) кислотными 3) амфотерными
7. В реакциях с неметаллами щелочноземельные металлы являются:
1) окислителями 2) восстановителями 3) окислителями и восстановителями
8. При взаимодействии калия с кислородом образуется:
1) оксид калия 2) гидроксид калия 3) пероксид калия
9.
Кальций взаимодействует с каждым из двух веществ:1) Na2SO4, N2 2) H2O, V2O5 3) HNO3, BaCl2
10. Оксид натрия реагирует с каждым из двух веществ:
1) CO2 , KNO3 2) Al(OH)3, CuCl2 3) Cu(NO3)2 , K2SO4 4) N2O5, H2SO4
11. Гидроксид бария реагирует с каждым из двух веществ:
1) N2O5, KCl б) HNO3, ZnCl2 3) KOH , SO2 4) K2O, H2O
12. Какой химический элемент входит в состав хлорофилла и участвует в процессах
фотосинтеза
1)кальций 2) натрий 3) калий 4) магний
13. Какой ион является основным внутриклеточным ионом в организме и поддерживает работу
сердечной мышцы
1)кальций 2) натрий 3) калий 4) магний
14. Установите соответствие между формулой вещества и его техническим названием:
А) Ca(OH)2 1) едкое кали
Б) NaHCO3 2) известковое молоко
В) KOH 3) жженая магнезия
Г) CaSO4 ∙ 2H2O 4) гипс
Д) K2CO3 5) пищевая сода
Е) MgO 6) поташ
Тест по теме: «Щелочные и щелочноземельные металлы»
Вариант 2
1. Выберите характеристики для щелочноземельных металлов
1) Степень окисления в соединениях +1
2) Степень окисления в соединениях +2
3) Являются сильнейшими восстановителями
4) Восстановительные свойства элементов усиливаются с ростом атомного радиуса
5) Из-за активности хранятся под слоем керосина
6) Это серебристо-белые металлы , с характерным блеском, режутся ножом
7) Являются наиболее типичными представителями среди металлов
8) С кислородом образуют только оксиды
9) Оксиды этих металлов получают прокаливанием пероксидов с соответствующим металлом
10) При взаимодействии с кислородом образуют пероксиды
11) Оксиды получают обжигом карбонатов
12) Гидроксиды этих металлов называют щелочи
13) Растворимость гидроксидов растет с увеличением активности соответствующего металла
14) Имеют только растворимые гидроксиды
15) Гидроксиды образуются взаимодействием металлов с водой
16) Гидроксиды получают взаимодействием соответствующих оксидов с водой
17) Металлы реагируют с кислотами
18) Оксиды по характеру кислотные
19) Оксиды по характеру основные
20) Общая формула гидроксида R(ОН)2
21) Общая формула гидроксида RОН
22) Общая формула оксида R2О
23) Общая формула оксидаRO
24) Способны восстанавливать редкие металлы из их оксидов
25) Все соли металлов растворимы
26) Карбонаты этих металлов малорастворимы или нерастворимы в водe
2. В ряду от лития к францию атомный радиус:
1) увеличивается 2) уменьшается 3) не изменяется
3. Наиболее ярко выраженные металлические свойства у:
1) магния 2) бериллия 3) кальция 4) бария
4. Как изменяется плотность и температура плавления у щелочных металлов?
1) плотность возрастает, температура плавления уменьшается
2) плотность уменьшается, температура плавления возрастает
3) плотность не изменяется, температура плавления уменьшается
4) плотность возрастает, температура плавления не изменяется
5.На воздухе щелочные металлы быстро окисляются, поэтому их хранят:
1) под слоем керосина 2) под слоем растительного масла 3) в атмосфере азота
6. Оксид натрия обладает свойствами:
1) основными 2) кислотными 3) амфотерными
7. В реакциях с неметаллами щелочные металлы являются:
1) окислителями 2) восстановителями 3) окислителями и восстановителями
8. При взаимодействии бария с кислородом образуется:
1) оксид бария 2) гидроксид бария 3) пероксид бария
9. Калий взаимодействует с каждым из двух веществ:
1) H2O, HCl 2) S, Zn(NO3)2 3) Cl2, H2O
10. Оксид кальция реагирует с каждым из двух веществ:
1) H2O , NaNO3 2) Zn(OH)2, CuSO4 3)HNO3, H2O 4) Na2O, H2SO4
11. Гидроксид натрия реагирует с каждым из двух веществ:
1) CO2 , KNO3 б) H2O, CuCl2 3) Cu(NO3)2 , SO3 4) CaO, H2SO4
12. Какой ион в организме является главным внеклеточным ионом, содержится в крови и лимфе
1)кальций 2) натрий 3) калий 4) магний
13. Какие ионы необходимы для работы сердца, участвуют в процессах свертывания крови
1)кальций 2) натрий 3) калий 4) магний
14. Установите соответствие между формулой вещества и его техническим названием:
А) Na2CO3∙ 10H2O 1) каустическая сода
Б) BaSO4 2) кристаллическая сода
В) NaOH 3) глауберова соль
Г) MgSO4 4) горькая соль
Д) CaCO3 5) баритова каша
Е) Na2SO4∙ 10H2O 6) известняк
Ответы
к тесту «Щелочные и щелочно-земельные металлы»
Вариант 1
1, 3, 4, 5, 6, 7, 9, 10, 12, 14, 15, 16, 19, 21, 22, 25 — (8 баллов)
1 (1балл)
4 (1балл)
4 (1балл)
2 (1балл)
1 (1балл)
2 (1балл)
3 К +О2 → (3балл)
2 Са + Н2О → (5баллов)
Са + V2O5 →
4 Na2O + N2O5 → (4 балла)
Na2O + H2SO4 →
2 Ba(OH)2 + HNO3→ (5 баллов)
Ba(OH)2 + ZnCl2 →
4 (1 балл)
3 (1 балл)
А2 Б5 В1 Г4 Д6 Е3 (3 балла)
Всего: 34 балла 50% — 17б («3»), 70% — 24б («4»), 90% — 31б («5»)
Вариант 2
2, 3, 4, 5, 6, 8, 11, 12, 13, 15, 16, 17, 19, 20, 23, 24,26 — (8,5 баллов)
1 (1балл)
4 (1балл)
1 (1балл)
1 (1балл)
1 (1балл)
2 (1балл)
1 Ва +О2 → (3балл)
3 K + Н2О → (5баллов)
K + Cl2→
3 CaO + HNO3 → (4 балла)
CaO + H2O →
3 NaOH + Cu(NO3)2→ (5 баллов)
NaOH + SO3→
2 (1 балл)
1 (1 балл)
А2 Б5 В1 Г4 Д6 Е3 (3 балла)
Всего: 34,5 балла 50% — 17б («3»), 70% — 24б («4»), 90% — 31б («5»)
infourok.ru
Тест «Щелочные и щелочноземельные металлы»
ТЕСТ «Щелочные и щелочноземельные металлы»
Вариант №1
А1. Распределение электронов по уровням атома
щелочного металла
1) 2;8;2 2) 2;8;1 3) 2;3 4) 2;8;8;5
А2. В ряду Ве – Мg – Ca – Ba имеет наибольшую
восстановительную способность
1) Ве 2) Мg 3) Ca 4) Ba
А3. Ряд химических элементов, гидроксиды которых
имеют состав, выражающийся общей формулой
Ме(ОН)2
1) Li, Be, Na, Mg 3) Na, Mg, Al, K
2) Mg, Ca, Sr, Ba 4) Li, Na, K, Rb
A4. Название металла, который с соляной кислотой
взаимодействует быстрее других
1) железо 3) магний
2) алюминий 4) натрий
А5. Ряд веществ, вступающих в реакции и с оксидом
натрия, и с оксидом кальция
1) Н2О, СО2, НСl 3)HNO3, Zn(OH)2, CuO
2) CuO, H2SO4, SО2 4) CuCl2, NaCl, H2S
В1. Установите соответствие:
ФОРМУЛА НАЗВАНИЕ
1. Са(ОН)2 А. поташ
2. NaHCO3 Б. гашеная известь
3. К2СО3 В.негашеная известь
Г. питьевая сода
В2. Массовая доля NaCl в растворе, состоящем из 30г NaCl
и 170г воды, равна:
1) 0,03 2) 0,15 3) 0,30 4) 0,45
ТЕСТ «Щелочные и щелочноземельные металлы»
Вариант №2
А1. Распределение электронов по уровням атома металла
второй группы главной подгруппы
1) 2;8;2 2) 2;8;1 3) 2;3 4) 2;8;8;5
А2. В ряду Li – Na – K – Rb наибольший радиус атома
имеет элемент
1) Li 2) Na 3) К 4) Rb
А3. Ряд химических элементов, гидроксиды которых
имеют состав, выражающийся общей формулой
МеОН
1) Li, Na, K, Cs 3) Mg, Ca, Sr, Be
2) Na, Mg, Al, Sn 4) Li, Be, K, Mg
A4. Название металла, который с водой взаимодействует
быстрее других
1) цинк 3) калий
2) натрий 4) бериллий
А5. Ряд веществ, вступающих в реакции и с гидроксидом
натрия, и с гидроксидом бария
1) CuCl2, NaCl, H2S 3) Н2О, СО2, НВr
2) HNO3, Zn(OH)2, SО3 4) CuO, H2SO4, SО2
В1. Установите соответствие:
ФОРМУЛА НАЗВАНИЕ
1. CaCO3 A. пищевая соль
2. КОН Б. мрамор
3. СаSO4 ∙ 2 Н2О В. гипс
Г. едкое кали
В2. На долю кальция приходится 1,5% от массы тела
человека. Определить массу кальция в теле человека
массой 60 кг.
1) 25г 2) 900г 3) 400г 4) 90г
ТЕСТ «Щелочные и щелочноземельные металлы»
Вариант №3
А1. Распределение электронов по уровням атома
щелочноземельного металла
1) 2; 1 2) 2; 7 3) 2; 8; 8; 2 4) 2
А2. В ряду Fr – Cs – Rb – K наибольшую
восстановительную способность имеет
1) Rb 2) Fr 3) K 4) Cs
А3. Ряд химических элементов, хлориды которых
имеют состав, выражающийся общей формулой
МеCl
1) Ba, Al, Ca, Cu 3) K, Na, Li, Rb
2) Ba, Sr, Ca, Be 4) Cu, Ag, Au, Na
A4. Название металла, который с соляной кислотой
взаимодействует медленнее других
1) калий 3) франций
2) кальций 4) магний
А5. Ряд веществ, вступающих в реакции и с оксидом
калия, и с оксидом бария
1) H2SO4, SО2, Н2О 3) Н2О, СО2, NaOH
2) Al2O3, HCl, KOH 4) CuO, H2SO4, SО2
В1. Установите соответствие:
ФОРМУЛА НАЗВАНИЕ
1. Na2CO3 ∙ 10 Н2О A. негашеная известь
2. MgO Б. кристаллическая сода
3. NaCl В. пищевая соль
Г. жженая магнезия
В2. Масса воды, выделившаяся после выпаривания до суха
300г 25% раствора хлорида кальция
1) 22,5г 2) 75г 3) 288г 4) 225г
ТЕСТ «Щелочные и щелочноземельные металлы»
Вариант №4
А1. Распределение электронов по уровням атома
переходного металла IIА группы
1) 2; 4 2) 2; 2 3) 2; 1 4) 2; 8; 8; 4
А2. В ряду Ва – Sr – Ca – Mg наибольший радиус атома
имеет элемент
1) Sr 2) Ca 3) Mg 4) Ва
А3. Ряд химических элементов, оксиды которых
имеют состав, выражающийся общей формулой
МеО
1) K, Na, Li, Rb 3) B, Al, Ca, Cu
2) Ba, Sr, Ca, Be 4) Hg, Cd, K, Zn
A4. Название металла, который с водой взаимодействует
медленнее других
1) магний 3) кальций
2) калий 4) барий
А5. Ряд веществ, вступающих в реакции и с гидроксидом
калия, и с гидроксидом кальция
1) CuO, H2SO4, SО2 3) СО2, НСl, H2SO4
2) ВаСl2, NaOH, Al2O3 4) CuCl2, NaCl, H2S
В1. Установите соответствие:
ФОРМУЛА НАЗВАНИЕ
1. NaOH A. известковая вода
2. Са(ОН)2 Б. негашеная известь
3. СаСО3 В. каустик
Г. известняк
В2. Масса поваренной соли, оставшейся после
выпаривания воды из 400г 30% раствора соли
1) 12г 2) 120г 3) 280г 4) 13г
infourok.ru
Тест «Щелочноземельные металлы и соединения»
«Щелочноземельные металлы и соединения» 9 класс
Вариант 1
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют на внешнем уровне
А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона
2. С каким из следующих веществ не реагирует кальций?
А) Cl2 Б) S В) Н2О Г) NaCl
3. Атомы щелочноземельных элементов имеют возможность
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
4 Радий, завершающий II группу, является
А) очень твёрдым Б) самым распространённым в земной коре
В) радиоактивным Г) неактивным
5 Щелочноземельные металлы в сравнении со щелочными
А) менее активны Б) более активны
В) одинаковые по активности Г) вообще неактивны
6. Щелочноземельные металлы в химических реакциях являются
А) изоляторами Б) восстановителями
В) окислителями Г) не изменяют степень окисления
7. Щелочноземельные металлы соединяются с водой, образуя
А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты
8. Металлические свойства в главной подгруппе II группы
А) увеличиваются Б) уменьшаются
В) не изменяются Г) сначала увеличиваются, потом уменьшаются
9. Соотнесите формулы и названия веществ:
А) Ca(OH)2 1) английская соль
Б) MgO 2) апатит
В) MgSO4 3) негашенная известь
Г) Ca3(PO4)2 4) жженая магнезия
5) гашенная известь
«Щелочноземельные металлы и соединения» 9 класс
Вариант 2
Выберите 1 верный ответ
1. Атомы щелочноземельных металлов имеют на внешнем уровне
А) 1 электрон Б) 2 электрона В) 3 электрона Г) 4 электрона
2. Атомы щелочноземельных элементов имеют возможность
А) отдавать 2 электрона Б) отдавать 1 электрон
В) принимать 1 электрон Г) принимать 2 электрона
3.С каким из следующих веществ не реагирует натрий?
А) O2 Б) S В) Н2О Г) Са(ОН)2
4. Металлические свойства в главной подгруппе II группы
А) уменьшаются Б) увеличиваются
В) не изменяются Г) сначала увеличиваются, потом уменьшаются
5. Радий, завершающий II группу, является
А) радиоактивным Б) самым распространённым в земной коре
В) очень твёрдым Г) неактивным
6. Щелочноземельные металлы хранят
А) на воздухе Б) в воде В) в керосине Г) на полке
7. Щелочноземельные металлы в химических реакциях являются
А) изоляторами Б) окислителями
В) восстановителями Г) не изменяют степень окисления
8. Щелочноземельные металлы соединяются с водородом образуя
А) гидроксиды Б) гидраты В) гидриды Г) гидрокарбонаты
9. Соотнесите формулы и названия веществ:
А) CaO 1) гипс
Б) BaSO4 2) баритовая каша
В) CaSO4 × H2O 3) негашенная известь
Г) Ca(OH)2 в воде 4)известковое молоко
5) гашенная известь
infourok.ru
Тест по теме «Щелочные и щелочноземельные металлы»
Тест №1 по химии (9 кл)
по теме « Щелочные и щелочноземельные металлы»
1. К радиоактивным элементам относятся:
а) Ra, Na, Ag
б) Ra, Fr
в) Cu, Rb,Fr
2. Закончи ХР:
А) Li+O2= Г) Na+Cl2= Ё) Na+S=
Б) K+O2= Д) K2O2+K=
В) Li+Н2O= Е) K+h3=
3. СО ЩЗМ во всех своих соединениях:
а) +2
б) +1
в) +3
4. ЩМ – это элементы:
а) 1 группы побочной подгруппы
б) 2 группы главной подгруппы
в) 1 группы главной подгруппы
5. Закончи ХР:
а) Mg+TiO2= б) Ca+h3O=
в) CaO+h3O= г) CaCO3=
6. Верно ли утверждение:
а) ЩМ и ЩЗМ хранят свободно при обычных условиях
б) ЩЗМ взаимодействуют с неМе при нагревании
в) ЩЗМ не взаимодействуют с водой
г) ЩЗМ хранят под слоем керосина или в запаянных сосудах
д) оксиды ЩЗМ при взаимодействии с водой образуют щелочь
7. Запиши названия соединения NaOH.
8. ЩЗМ – это элементы:
а) 2 группы побочной подгруппы
б) все элементы 2 группы главной подгруппы
в) 3 группы главной подгруппы
г) Ca, Sr, Ba, Ra
д) Be, Mg
9. К ЩМ относятся:
a) все элементы 1группы главной подгруппы
б) Li, Na, K, Rb, Cs, Fr
в) Li, Na, Mg, Sr, Ba, Fr
10. Закончи ХР:
а) Mg+Cl2= б) Ba+S=
в) Ca+N2= г) Mg+O2=
д) Ba+h3=
11. Запиши названия соединения Сa(OH)2.
12. Все ЩМ на внешнем уровне атома имеют:
а) 1 электрон
б) 2 электрона
в) 3 электрона
13. Верно ли утверждение:
а) Mg медленно взаимодействует с водой
б) Be не взаимодействует с водой
в) Mg не взаимодействует с водой
г) Al, Mg, Ca восстанавливают редкие металлы из их оксидов
14. Закончи ХР:
а) Na2CO3+Ca(OH)2=
б) Na2O+h3O=
15. Взаимодействие с неМе Н, СL, S ЩМ происходит:
а) при высоких температурах
б) в присутствии катализатора
в) при обычных условиях
г) при высоких температурах в присутствии катализатора
16. ЩЗМ во всех своих соединениях проявляют:
а) восстановительные свойства
б) восстановительные свойства
17. СО ЩМ во всех своих соединениях:
а) -1
б) +1
в) +2
18. Закончи ХР:
а) CaO+CO2= б) CaO+HCl= в) Ca(OH)2+HCl=
19. Верно ли утверждение:
а) все ЩМ при взаимодействии с О2 образуют оксиды
б) Na, K при взаимодействии с О2 образуют пероксиды
в) Li при взаимодействии с О2 образует оксид
г) Li, Na, K при взаимодействии с О2 образуют пероксиды
д) все ЩМ при взаимодействии с водой образуют щёлочь
20. Все ЩЗМ на внешнем уровне атома имеют:
а) 5 электронов
б) 1 электрон
в) 2 электрона
21. ЩМ во всех своих соединениях проявляют:
а) окислительные свойства
б) металлические свойства
в) восстановительные свойства
Система оценивания теста №1:
На «5»- 19-21 задание;
На «4»- На «5»- 15-18 задание;
На «3»- 8-14 задание;
На «2»- менее 7 заданий.
infourok.ru
Тест на тему «Щелочные и щелочноземельные металлы»
Автор: Иванова О. А., учитель химии
МБОУ «Гимназия 18»
Тест по теме «Щелочные и щелочноземельные металлы»
Вариант– I
1. Элементы главной подгруппы I группы периодической системы
имеют название:
А)халькогены В) щелочные металлы
Б) переходные металлы Г) щелочноземельные металлы
2. Заряд ядра атома калия равен
А) +4 В) +11
Б) +20 Г) +15
3. Самый активный щелочной металл ____________________
4. Число протонов, нейтронов и электронов в атоме 19К соответственно
равно
А) 11, 12, 11 В) 19, 20, 19
Б) 9, 10, 19 Г) 13, 14, 13
5. Электронная конфигурация 1S2 2S22P6 3S2 соответствует атому
А) натрия В) алюминия
Б) магния Г) кальция
6. Наиболее лёгкий металл ____________________________
7. Металл, образующий оксид при взаимодействии с кислородом
А) Li В) K
Б) Na Г) Rb
8. Вещество Х в схеме получения хлорида натрия Na + X → NaCl
A) O2 B) NaOH
Б) Cl2 Г) Na2O2
9. Пероксиды образуют
А) Li В) K
Б) Na Г) Mg
10. С водой с образованием растворимых оснований взаимодействуют
А) Zn В) Ba
Б) Na Г) Cr
11. Реагируют с барием
А) Cl2 В) HCl
Б) H2O Г) NaOH
12. Раствор гидроксида натрия окрашивает фенолфталеин
в следующий цвет:
А) жёлтый В) малиновый
Б) синий Г) оранжевый
13. Химическая связь в оксиде магния
А) ковалентная полярная В) металлическая
Б) ковалентная неполярная Г) ионная
14. Гидроксид лития реагирует с каждым из двух веществ:
А) H2SO4 и CO2 В) SiO2 и H2
Б) NaCl и BaO Г) Cu и Na2SO4
15. Укажите окислитель в реакции: 2Na + 2H2O = 2NaOH + H2
А) Na0 В) H0
Б) H+1 Г) Na+1
16. Сокращённое ионное уравнение: Zn2+ + 2OH− = Zn(OH)2
соответствует взаимодействию следующих веществ:
А) ZnSO4 + H2O В) ZnCl2 + 2KOH
Б) ZnCO3 + NaOH Г) Zn(NO3)2 + Fe(OH)2
17. В 100 г воды растворили 40 г гидроксида натрия. Массовая доля
вещества в полученном растворе равна _____________________
18. Определите массу 8% — ного раствора соляной кислоты, которая,
необходима для нейтрализации 150 г 10% раствора гидроксида бария.
19. Расположите щелочные металлы в порядке усиления
восстановительной способности: 1) Rb, 2) Cs, 3) Li, 4) K, 5) Na
Ответ дайте в виде последовательности цифр ______________________
20. Установите соответствие между формулой соединения
и его названием.
Ответ дайте в виде последовательности цифр,
соответствующих буквам по алфавиту.
ФОРМУЛА НАЗВАНИЕ
СОЕДИНЕНИЯ СОЕДИНЕНИЯ
А) ВаO 1) гидроксид калия
Б) Ba(OH)2 2) гидрокарбонат натрия
В) KOH 3) оксид бария
Г) NaНCO3 4) гидроксид бария
Вариант – II
1. Щелочноземельными металлами являются
А) Sr В) Ba
Б) Na Г) K
2. Заряд ядра атома бария равен
А) +12 В) +13
Б) +19 Г) +56
3. Радиоктивный щелочноземельный металл ___________________
4. Число протонов, нейтронов и электронов в атоме 56Вa
соответственно равно
А) 11, 12, 11 В) 19, 9, 19
Б) 13, 14, 13 Г) 56, 81, 56
5. Электронная конфигурация 1S2 2S22P6 3S23P6 4S2 соответствует атому
А) калия В) алюминия
Б) магния Г) кальция
6. Наиболее легкоплавкий металл ___________________________
7. Укажите, какое суждение является правильным:
1) прозрачный раствор гидроксида кальция в воде называют
известковой водой; 2) гипс – это CaSO4
А) верно только 1) В) верны оба суждения
Б) верно только 2) Г) оба суждения неверны
8. Вещество Х в схеме получения оксида лития Li + X → Li2O
A) O2 B) K2O2
Б) KH Г) KOH
9. Пероксиды образуют
А) Mg В) Ca
Б) Na Г) K
10. С водой с образованием растворимых оснований взаимодействуют
А) K В) Fe
Б) Cu Г) Ca
11. Реагируют с кальцием
А) S В) HCl
Б) H2O Г) NaOH
12. Раствор гидроксида натрия окрашивает фенолфталеин
в следующий цвет:
А) жёлтый В) малиновый
Б) синий Г) оранжевый
13. Химическая связь в оксиде лития
А) ковалентная полярная В) металлическая
Б) ковалентная неполярная Г) ионная
14. Оксид кальция реагирует с каждым из двух веществ:
А) CO2 и HCl В) SiO2 и NaOH
Б) NaCl и BaO Г) H2SO4 и СaCO3
15. Укажите восстановитель в реакции: 2Ca + O2 = 2CaO
А) Са0 В) О0
Б) Са+2 Г) О−2
16. Сокращённое ионное уравнение: Ba2+ + SO42− = BaSO4
соответствует взаимодействию следующих веществ:
А) BaCO3 + H2SO4 В) Ba3(PO4)2 + K2SO4
Б) BaCl2 + Na2SO4 Г) Ba(OH)2 + H2SO4
17. Определите массу 6% — ного раствора NaOH, который необходим
для полной нейтрализации 120 г 10% раствора серной кислоты.
18. В 100 г воды растворили 40 г оксида кальция. Массовая доля
вещества в полученном растворе равна ____________________
19. Расположите элементы в порядке уменьшения их
восстановительной способности: 1) Ba, 2) Mg, 3) Be, 4) Sr, 5) Ca
Ответ дайте в виде последовательности цифр ______________________
20. Установите соответствие между формулой соединения
и его названием.
Ответ дайте в виде последовательности цифр,
соответствующих букв по алфавиту.
ФОРМУЛА НАЗВАНИЕ
СОЕДИНЕНИЯ СОЕДИНЕНИЯ
А) BаO 1) гидроксид калия
Б) KOH 2) гидрокарбонат кальция
В) K2CO3 3) карбонат калия
Г) Ca(НCO3)2 4) оксид бария
infourok.ru


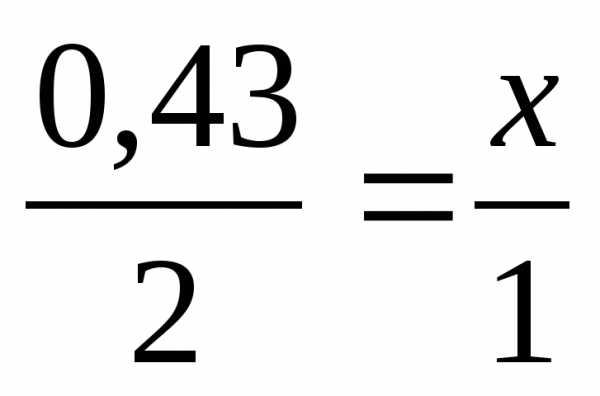 х = 0,215 (моль)
х = 0,215 (моль)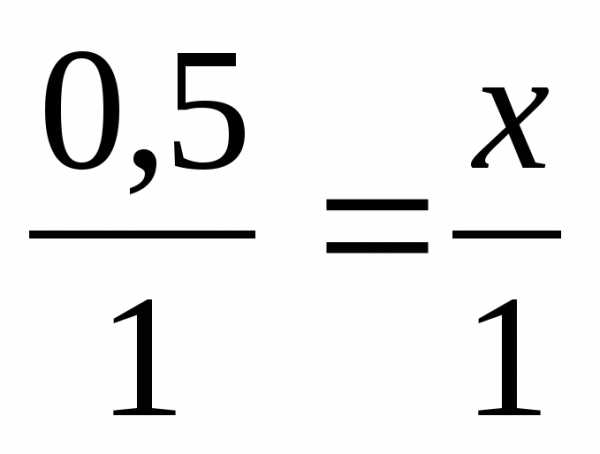 х = 0,5 (моль)
х = 0,5 (моль)