Автомеханик химия в моей профессии – Химия в профессии автомеханика — реферат
Химия для автомеханика — Химия
Просмотр содержимого документа
«Химия для автомеханика»

ГБПОУ «Починковский сельскохозяйственный техникум»
Химия
и АВТОМОБИЛЬ

показать, что достижения в области химии связаны с автомобилем
- Задачи:
- быть специалистом в своей профессии , значит необходимо знать химию;
- помнить, что твоя безопасность и безопасность других – это твои знания и умения;
- показать, что химические процессы не безопасны для человека.

Автомобиль-это…
Транспортное средств о ,
основное назначение
заключается в совершении
транспортной работы.
Автомобильный транспорт ,занимает ведущее место по сравнению с другими видами транспорта по объёму перевозок пассажиров и грузов.
Современный автомобиль состоит из 15—20 тысяч деталей , из которых 150—300 являются наиболее важными и требующих наибольших затрат в эксплуатации.

Автомобиль очень тесно связан
с химией
т.к. для поддержания его в рабочем состоянии используются различные жидкости химического происхождения например:
антифриз , моторное масло, трансмиссионное масло, тормозная жидкость, жидкость гидроусилителя, вода и т.д.
Но сегодня мы поговорим об АКБ
(аккумуляторной батареи и электролите).
Аккумуляторная батарея (АКБ)
Аккумуляторная батарея — источник постоянного тока, предназначенный для пуска двигателя стартером, для питания прочих потребителей при неработающем (или работающем на малых оборотах) двигателе.
Аккумуляторная батарея преобразует химическую энергию в электричество, являясь источником электроэнергии автомобиля.

Устройство АКБ
С точки зрения автомеханика…….

Состав аккумулятора
- Если разбить по процентной составляющей АКБ выходит примерно такой состав:
- 1) Свинец и его компоненты (оксиды и диоксиды) – порядка 60 – 70% от веса
- 2) Пластиковый корпус, перегородки и другие элементы ПВХ – 8 – 10%
- 3) Электролит (зачастую раствор серной кислоты) – 20%
- Так что получается нормально – если брать вес обычного 55 Амперного варианта, а он составляет порядка 15 кг. То металла должно быть – 15Х0,7= 10,5 кг, ПВХ – 15Х0,1= 1,5 кг и соответственно, электролит – 15Х0,2 = 3 кг

Работа АКБ
- Основными частями АКБ являются положительные и отрицательные пластины вылитые в виде решетки из сплава свинца , сурьмы и добавлением 1-го % мышьяка .
- Пластины находятся в химическом растворе 65% воды и 35 % серной кислоты (электролите ) .
- Главное в аккумуляторной батареи это мощные химические реакции , которые идут внутри пластин и повторяются, когда АКБ разряжается.
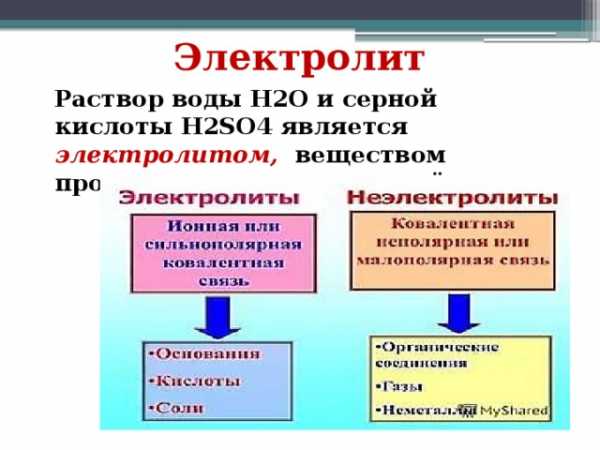
Электролит
Раствор воды h3O и серной кислоты h3SO4 является электролитом, веществом проводящим электрический ток.

Электролит
является опасной жидкостью!
При изготовлении которой необходимо соблюдать технику безопасности!

Для предохранения от ожогов кожи, глаз и отравлений необходимо надевать кислотостойкий костюм, защитные очки, резиновые перчатки и сапоги, фартук из кислотостойкого материала.

При приготовлении электролита обязательно вливать кислоту в воду тонкой струей при непрерывном помешивании раствора эбонитовой палочкой;

АКБ и окружающая среда
- Одной из основных проблем на сегодняшний день является утилизация автомобильных аккумуляторов.
- Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы.
- Страшно представить, что может случиться с почвой при длительном контакте с электролитом или свинцом из выброшенного на свалку аккумулятора.
Вред АКБ на организм человека
- Свинец является токсичным металлом , который может попасть в организм при вдыхании свинцовой пыли или при прикосновении ко рту с руками, которыми до этого трогали свинец.
- Попадая в землю, частицы свинца загрязняют поч ву, и когда она просыхает, то попадают в воздух. Чрезмерное содержание свинца может повлиять на рост ребенка, вызвать повреждение головного мозга, повредить почки, ухудшают слух и приводить к поведенческим проблемам.
- Свинец также опасен для детей, которые еще только находятся в утробе матери.
- Взрослых, свинец может привести к потере памяти и к снижению способности концентрации вниман ия, а также нанести вред репродуктивной системе.
- Известно, что свинец вызывает повышенное кровяного давления , неврологические нарушения, и мышечные и суставные боли. Исследователи считают, что Людвиг ван Бетховен заболел и умер из-за отравления свинцом.
- Серная кислота в свинцово-кислотных батареях чрезвычайно агрессивна и потенциально более вредна, чем кислоты, используемые в других аккумуляторных системах.
- При попадании в глаза она может привести к постоянной слепоте; при проглатывании она повреждает внутренние органы, что может привести к смерти..

Утилизация АКБ
- Утилизация аккумуляторных батарей происходит на перерабатываемых предприятиях, имеющих всё необходимое оборудование.
- Процесс утилизации автомобильных аккумуляторов позволяет извлечь большое количество вторичного сырья: пластик, сталь, свинец и медь.
- Если на предприятие есть специальное оборудование, то и нейтрализованный электролит также можно использоваться повторно.

Вывод:
- Автомобиль тесно связан с химией;
- АКБ являясь источником электроэнергии автомобиля, преобразует химическую энергию в электричество;
- Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы;
- Каждому автомеханику необходимы знания в области химии.

Спасибо за внимание!
multiurok.ru
презентация студента «Химия и автомобиль»
Слайд 1
Химия Группа 121 Бескоровайный Никита и АВТОМОБИЛЬСлайд 2
Цель: показать, что достижения в области химии связаны с автомобилем Задачи: б ыть специалистом в своей профессии , значит необходимо знать химию; п омнить, что твоя безопасность и безопасность других – это твои знания и умения; показать, что химические процессы не безопасны для человека.
Слайд 3
Автомобиль-это… Транспортное средств о , основное назначение заключается в совершении транспортной работы. Автомобильный транспорт ,занимает ведущее место по сравнению с другими видами транспорта по объёму перевозок пассажиров и грузов. Современный автомобиль состоит из 15—20 тысяч деталей , из которых 150—300 являются наиболее важными и требующих наибольших затрат в эксплуатации.
Слайд 4
Автомобиль очень тесно связан с химией т.к. для поддержания его в рабочем состоянии используются различные жидкости химического происхождения например: антифриз , моторное масло, трансмиссионное масло, тормозная жидкость, жидкость гидроусилителя, вода и т.д. Но сегодня мы поговорим об АКБ (аккумуляторной батареи и электролите).
Слайд 5
Аккумуляторная батарея (АКБ) Аккумуляторная батарея — источник постоянного тока, предназначенный для пуска двигателя стартером, для питания прочих потребителей при неработающем (или работающем на малых оборотах) двигателе. Аккумуляторная батарея преобразует химическую энергию в электричество, являясь источником электроэнергии автомобиля.
Слайд 6
Устройство АКБ С точки зрения автомеханика…….
Слайд 7
Состав аккумулятора Если разбить по процентной составляющей АКБ выходит примерно такой состав: 1) Свинец и его компоненты (оксиды и диоксиды) – порядка 60 – 70% от веса 2) Пластиковый корпус, перегородки и другие элементы ПВХ – 8 – 10% 3) Электролит (зачастую раствор серной кислоты) – 20% Так что получается нормально – если брать вес обычного 55 Амперного варианта, а он составляет порядка 15 кг. То металла должно быть – 15Х0,7= 10,5 кг, ПВХ – 15Х0,1= 1,5 кг и соответственно, электролит – 15Х0,2 = 3 кг
Слайд 8
Работа АКБ Основными частями АКБ являются положительные и отрицательные пластины вылитые в виде решетки из сплава свинца , сурьмы и добавлением 1-го % мышьяка . Пластины находятся в химическом растворе 65% воды и 35 % серной кислоты (электролите ) . Г лавное в аккумуляторной батареи это мощные химические реакции , которые идут внутри пластин и повторяются, когда АКБ разряжается.
Слайд 9
Электролит Раствор воды h3O и серной кислоты h3SO4 является электролитом, веществом проводящим электрический ток.
Слайд 10
Электролит является опасной жидкостью! П ри изготовлении которой необходимо соблюдать технику безопасности!
Слайд 11
Для предохранения от ожогов кожи, глаз и отравлений необходимо надевать кислотостойкий костюм, защитные очки, резиновые перчатки и сапоги, фартук из кислотостойкого материала.
Слайд 12
П ри приготовлении электролита обязательно вливать кислоту в воду тонкой струей при непрерывном помешивании раствора эбонитовой палочкой; – кислота имеет плотность в два раза большую, чем вода , при смешивании кислоты с водой выделяется газ водород H , помещение должно хорошо вентилироваться!
Слайд 13
АКБ и окружающая среда Одной из основных проблем на сегодняшний день является утилизация автомобильных аккумуляторов. Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы. Страшно представить, что может случиться с почвой при длительном контакте с электролитом или свинцом из выброшенного на свалку аккумулятора.
Слайд 14
Вред АКБ на организм человека Свинец является токсичным металлом , который может попасть в организм при вдыхании свинцовой пыли или при прикосновении ко рту с руками, которыми до этого трогали свинец. Попадая в землю, частицы свинца загрязняют поч ву, и когда она просыхает, то попадают в воздух. Чрезмерное содержание свинца может повлиять на рост ребенка, вызвать повреждение головного мозга, повредить почки, ухудшают слух и приводить к поведенческим проблемам. Свинец также опасен для детей, которые еще только находятся в утробе матери . Взрослых, свинец может привести к потере памяти и к снижению способности концентрации вниман ия, а также нанести вред репродуктивной системе . Известно, что свинец вызывает повышенное кровяного давления , неврологические нарушения, и мышечные и суставные боли. Исследователи считают, что Людвиг ван Бетховен заболел и умер из-за отравления свинцом. Серная кислота в свинцово-кислотных батареях чрезвычайно агрессивна и потенциально более вредна, чем кислоты, используемые в других аккумуляторных системах. При попадании в глаза она может привести к постоянной слепоте; при проглатывании она повреждает внутренние органы, что может привести к смерти ..
Слайд 15
Утилизация АКБ Утилизация аккумуляторных батарей происходит на перерабатываемых предприятиях, имеющих всё необходимое оборудование. Процесс утилизации автомобильных аккумуляторов позволяет извлечь большое количество вторичного сырья: пластик, сталь, свинец и медь. Если на предприятие есть специальное оборудование, то и нейтрализованный электролит также можно использоваться повторно.
Слайд 16
Вывод: Автомобиль тесно связан с химией; АКБ являясь источником электроэнергии автомобиля, преобразует химическую энергию в электричество; Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы; Каждому автомеханику необходимы знания в области химии.
Слайд 17
Спасибо за внимание!
nsportal.ru
Тема урока: «Химия в устройстве автомобиля»
Разделы: Химия, Технология
Профессия: 190631 Автомеханик
Профессиональный модуль: Техническое обслуживание и ремонт автотранспорта
Междисциплинарный курс: Устройство, техническое обслуживание и ремонт автомобилей
Формируемые компетенции:
ПК 1.2. Выполнять работы по различным видам технического обслуживания.
ПК 1.3. Разбирать, собирать узлы и агрегаты автомобиля и устранять неисправности.
ОК 2. Организовать собственную деятельность, исходя из цели и способов её достижения,
определённых руководителем.
ОК 3. Анализировать рабочую ситуацию, осуществлять текущий и итоговый контроль, оценку и коррекцию собственной деятельности, нести ответственность за результаты своей работы.
ОК 6. Работать в команде, эффективно общаться с коллегами, руководством, клиентами.
Задачи урока:
- Обучающие: сформировать у обучающихся представление о применении химических соединений в изготовлении деталей автомобиля. Закрепить знания об устройстве автомобиля.Показать обучающимся, что химия и устройство, техническое обслуживание и ремонт автомобиля являются взаимосвязанными между собой дисциплинами.
- Развивающие: способствовать развитию логика -смыслового мышления обучающихся, памяти химического и технического языка, а также умения осуществлять самостоятельную деятельность на уроке.
- Воспитательные: воспитывать культуру умственного труда, развивать коммуникативные качества личности.
Тип урока: Интегрированный урок химии и устройство, ТО автомобиля. Обобщение знаний.
Вид урока: Урок-игра
Методы:
— обучения: исследовательский,
— преподавания: проблемный,
— учения: частично-поисковый.
Материально техническое оснащение: доска, плакаты, мультимедийное оборудование.
Этапы урока
I. Организационный момент
Приветствие обучающихся, определение готовности группы к уроку, отметка отсутствующий.
Сегодняшний урок мы хотели начать с высказывания М.В.Ломоносова: “Широко распростирает химия руки свои в дела человеческие. Куда не посмотрим, куда не оглянемся – везде перед очами нашими успехи её применения…”
II. Актуализация знаний
— Учитель. Ребята для того чтобы определить какая сегодня тема урока, мы предлагаем вам решить кроссворд (кроссворд на доске и на столах обучающихся).
1.Сложная электонейтральная частица, состоящая из протонов, нейтронов и электронов. (химия)
2. Деталь автомобиля необходимая для воспламенения топливной смеси. (устройство автомобиля)
3. Вещества, растворы которых проводят электрический ток. (химия)
4. Подвижная часть кривошипно-шатунного механизма. (устройство автомобиля)
5. Наука о веществах, их свойствах и превращениях. (химия)
6. Рабочий объём всех цилиндров двигателя. (устройство автомобиля)
7. Химические элементы, атомы которых отдают электроны внешнего электронного слоя, превращаясь в положительные ионы. (химия)
8. Элемент автомобиля, служащий для охлаждения. (устройство автомобиля)
9. Самопроизвольное разрушение металлов и их сплавов под влиянием окружающей среды. (химия)
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
— Учитель. Как назовём тему сегодняшнего урока? (ответ: Автохимия)
Действительно, тема урока – Автохимия или мы назвали её “Химия в устройстве автомобиля”.
Урок необычный – урок-игра. Он будет проходить виде игры двух команд (команды №1 и №2). За каждый правильный ответ команда получает карточку с буквой, в конце урока, соединив эти буквы вы определите, какое домашнее задание мы вам предложим. (Буквы для команды №1 А.ШИНА и для команды № 2 ШАССИ).
III. Изучение нового материала
— Преподаватель по устройству и ТО автомобиля объявляет 1 конкурс.
Конкурс “Кто лучше знает устройство автомобиля?”
На выполнение этого задания предлагается 3 минуты. За это время обучающиеся должны вспомнить как можно больше деталей автомобиля входящие в состав: кузова, двигателя и трансмиссии и заполнить таблицу 1.
Таблица 1. Задание к конкурсу 1.
| кузов | двигатель | трансмиссия |
| 1 2 3 … 15 |
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
Конкурс “Зашифрованная таблица”
Проводит преподаватель химии.
— Учитель. Мы вам предлагаем вам пронумерованные детали автомобиля, нужно определить: что за деталь, каков его химический состав, в какой системе автомобиля можно встретить? И заполнить таблицу 2.
Таблица 2. Задание к конкурсу 2.
| № детали | Название детали | химический состав | В какой системе автомобиля встречается |
| 1. | |||
| 2. | |||
| … | |||
| 7. |
Каждой группе предлагается по 7 разных пронумерованных деталей.
Детали автомобиля: крышка распределителя зажигания, кронштейн энергоаккумулятора, подшипник ступицы, подкабинная рессора, пружина ГРМ, свеча зажигания, компрессионное кольцо, провод высокого напряжения, палец шатунный, плафон для освещения салона, шатун, поршень, втулка шатуна, насос масляной.
Химический состав: сталь низкоуглеродистая, пластмасса, легированная сталь, дюралюминий, латунь, органическое стекло, медь, антифрикционная сталь, серый чугун.
Правильные ответы представлены в таблице 3.
Таблица 3. Правильные ответы к заданию конкурса 2.
| № детали | Название детали | химический состав | В какой системе автомобиля встречается |
| 1 | Пружина ГРМ | Легированная сталь | двигатель |
| 2 | Втулка шатуна | Сталь низкоуглеродная | двигатель |
| 3 | Крышка распределителя | Пластмасса | электрооборудование |
| 4 | Плафон для освещения салона | Органическое стекло | кузов |
| 5 | Подкабинная рессора | Легированная сталь | кузов |
| 6 | Провод высокого напряжения | Медь, латунь | электрооборудование |
| 7 | Свеча зажигания | Легированная сталь | электрооборудование |
| 8 | Насос масляный | Дюралюминий | двигатель |
| 9 | Поршень | Дюралюминий | двигатель |
| 10 | Компрессионное кольцо | Сталь низкоуглеродная | двигатель |
| 11 | Палец шатунный | Антифрикционная сталь | двигатель |
| 12 | Шатун | Серый чугун | двигатель |
| 13 | Подшипник ступицы | Антифрикционная сталь | шасси |
| 14 | Кронштейн энергоаккамулятора | Серый чугун | тормозная система |
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один балл за правильно выполненное задание в рейтинговом листе.
Конкурс “Знаток аккумулятора”
Обучающиеся смотрят видеосюжет о строении аккумалятора, затем должны будут ответить на вопросы:
- Что такое аккумулятор?
- В какой части автомобиля находится?
- Какую функцию выполняет?
- Как устроен аккумулятор?
- Какой электролит применяют в аккумуляторах?
- Пластины какого металла используют в аккумуляторах?
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
4. Конкурс “ Определите какая жидкость? ”
Проводят преподаватель химии и преподаватель по устройству, ТО автомобиля.
Обучающимся предлагаются 4 мерных стаканчика, в которые налиты 4 разных жидкости. Обучающиеся должны, определить какие вещества находятся в мерных стаканчиках, используя информацию о физико-химических свойствах этих жидкостей.
| №1 Эта жидкость смесь этиленгликоля, воды и различных присадок. Токсическое действие антифриза в основном связано с этиленгликолем. Этиленгликоль – основа ____?_____ — обладает уникальной возможностью не замерзать при пониженных температурах, представляет собой бесцветную прозрачную жидкость, имеющая приятный сладковатый вкус, который может привлечь детей или домашних животных. |
| №2 __?____ — это смесь лёгких углеводородов с температурой кипения от 30°С до 200°C. Плотность составляет около 0,7 г/см?. Теплотворная способность горючего вещества примерно соответствует 10500 ккал/кг.Получается путём перегонки нефти, гидрокрекингом и, при необходимости дальнейшей ароматизации — каталитическим крекингом и риформингом. Для специальных ___?___ характерна дополнительная очистка от нежелательных компонентов и смешение с полезными добавками. |
| №3 __?____ жидкость ( состоит из основы (ее доля 93-98%) и различных присадок (остальные 7-2%). Устаревшие жидкости, например “БСК”, изготовлены на смеси касторового масла и бутилового спирта в пропорции 1:1. Основа современных, наиболее распространенных, в том числе (“Нева”, “Томь” и РосДОТ, она же “Роса”), - полигликоли и их эфиры. В комплексе присадок одни из них препятствуют окислению кислородом воздуха и при сильном нагреве, а другие — защищают металлические детали гидросистем от коррозии. Основные свойства любой __?__ жидкости зависят от сочетания ее компонентов. |
| №4 _____?____ бывают синтетические, полусинтетические и минеральные. Синтетические получают путём каталитического синтеза из газов. Полусинтетические — комбинация минеральных и синтетических основ, при условии не менее 25 % синтетического базового Минеральные получают путём очистки соответствующей фракции нефти. |
Правильные ответы:
№ 1 — тосол, антифриз или охлаждающая жидкость;
№ 2 – бензин;
№ 3 – тормозная жидкость;
№ 4 – моторное масло
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один балл за правильно выполненное задание в рейтинговом листе.
Конкурс “Первая доврачебная помощь ”
Обучающиеся должны рассказать, как они будут оказывать первую медицинскую помощь при:
а) ожог серной кислотой;
б) отравление бензином;
в) отравление при попадании на слизистую тормозной жидкости;
г) отравление тосолом или антифризом или охлаждающей жидкостью;
—Учитель. Как вы думаете, как правильно оказать первую помощь при ожоге серной кислотой?
а) Если вы обожглись серной кислотой, то использовать воду в качестве первой помощи нельзя, т.к. серная кислота при взаимодействии с водой выделяет тепло, которое лишь усугубит ожог. Поэтому место, обожженное серной кислотой, нужно промыть щелочным раствором (вода с мылом или раствор пищевой соды, чайная ложка на стакан воды). Можно посыпать магнезией или мелом. Вызвать скорую.
— Учитель. Как вы думаете, как правильно оказать первую помощь при отравлением бензином и его парами?
б) Первая помощь при отравлении бензином
и его парами: пострадавшего необходимо быстро удалить из помещения, насыщенного парами бензина. При попадании бензина внутрь делают промывание желудка, лучше 2%-ным раствором питьевой соды. При вдыхании паров — обеспечить приток свежего воздуха, желательно дать пострадавшему кислородную подушку. Вызвать скорую помощь.—Учитель. Как вы думаете, как правильно оказать первую помощь при попадании на слизистую тормозной жидкости?
в) При отравлении тормозной жидкостью развивается тяжелая форма интоксикации, в большинстве случаев отравление заканчивается смертью.
При проникновении тормозной жидкости в организм возникают боли в кишечнике и тошнота, затем открывается рвота. Спазмолитики не устраняют боли. Вскоре после отравления возникает слабость и сильное головокружение, рвота становится интенсивнее. Через несколько дней, при условии отсутствия лечения, сокращается и затем полностью останавливается отхождение мочи. Сознание периодически отключается. Лицо пострадавшего отекает и покрывается красными пятнами. Еще через несколько дней возникает желтушность, дыхание сильно затрудненно из-за
отека легочной ткани. После появления таких признаков пострадавшего спасти не удается, поэтому сразу же должна быть госпитализация.
—Учитель. Как вы думаете, как правильно оказать первую помощь при приёме внутрь тосола?
г) Приём внутрь чрезвычайно опасен, (смертельная доза составляет около 100 мл, т.е. стакан антифриза), повреждает центральную нервную систему и почек, органов дыхания, печень. В случае приёма внутрь необходимо вызвать скорую помощь и до её приезда вызвать рвоту, сделать промывание желудка водой или раствором соды. При длительном воздействии паров вызывает раздражение глаз, верхних дыхательных путей, слабость.
Итог: преподаватель отдаёт букву для домашнего задания. Обучающиеся ставят один бал за правильно выполненное задание в рейтинговом листе.
Конкурс “Угадай слово”
Преподаватель обучающимся предлагает из букв собрать слово. Зашифрованное слово “КОРРОЗИЯ”. Ответьте на следующие вопросы:
1. Что такое коррозия?
2. Что является причиной коррозии?
3. В каких частях автомобиля наиболее часто во
xn--i1abbnckbmcl9fb.xn--p1ai
Химия – основа рабочих профессий технической направленности
Химия – основа рабочих профессий технической направленности
В нашем современном мире — в мире технологий самыми востребованными являются специальности технической направленности. А чтобы стать высококлассным специалистом, необходимо еще в школьные годы приложить свои усилия в изучении таких предметов, как физика, математика и химия.
Я являюсь преподавателем предмета «Материаловедение» у мальчишек, получающих рабочие профессии «Сварщик», «Автомеханик», «Электромонтер», «Слесарь по контрольно-измерительным приборам и автоматике», «Слесарь по ремонту и обслуживанию газового оборудования», который очень тесно связан с предметом «Химия».
Практически все технические профессии связаны с изучением металлов, их свойств, с изучением их возможностей, а значит со знанием таблицы Менделеева, с которой мы знакомимся еще в школьные годы на уроках «Химии».
Много веков металлы верно служат человеку, помогая ему покорять стихию, овладевать тайнами природы, создавать замечательные машины и механизмы.
Богат и интересен мир металлов. Среди них есть старые друзья человека: медь, железо, золото, ртуть, серебро, олово. Эта дружба насчитывает уже тысячи лет. Но есть и такие металлы, знакомство с которыми состоялось лишь несколько десятилетий назад.
Свойства металлов чудесны и разнообразны. Ртуть, например не замерзает даже на морозе, а вольфрам не боится самых жарких объятий пламени. Литий мог бы быть отличным пловцом: ведь он вдвое легче воды и при всем желании не сможет утонуть, а осмий – чемпион среди металлов – тяжеловесов – камнем пойдет ко дну. Серебро с «удовольствием» проводит электрический ток, а у «титана» явно не лежит душа к этому занятию: его электропроводность в 300 раз ниже, чем у серебра. Железо мы встречаем на каждом ходу, а гольмий содержится в земной коре в мизерных количествах, что даже крупицы этого металла стоят баснословно дорого: чистый гольмий в несколько сот раз дороже золота.
Но как не различны свойства этих элементов, их роднит то, что они принадлежат к одной большой семье металлов. О судьбах некоторых важнейших металлов я сегодня поведаю вам, мои дорогие слушатели.
История металлов насыщена множеством интересных фактов и замечательных эпизодов, подчас романтических, порой юмористических, а иногда и трагических.
Расскажу, какую громадную роль играет в нашей жизни «великий труженик» — железо. Не будь его, на Земле не могло бы существовать ничто живое: ведь железо входит в кровь всех представителей животного мира нашей планеты. Трехвалентное железо содержится в гемоглобине – веществе, обеспечивающим кислородом ткани живых организмов. Именно железу кровь обязана своим красным цветом. Впрочем, кровь некоторых червей, в состав которой входит двух валентное железо, имеет зеленую окраску. Известен печальный факт, когда влюбленный студент-химик решил подарить избраннице своего сердца кольцо, сделанное из железа собственной крови. Периодически выпуская кровь, юноша получал соединения, из которого он выделял железо. Бедняга погиб от малокровия, так и не собрав железа, нужного для изготовления кольца: ведь общее количество этого элемента в крови человека всего 3-4 грамма.
В таблице Менделеева трудно найти другой металл, с которым так неразрывно связана история цивилизации. Через века и столетия человек пронес уважение к железу и людям, добывающим и обрабатывающим его. В древности у некоторых народов железо ценилось дороже золота. Лишь представители знати могли украшать себя изделиями из железа, причем нередко в золотой оправе. В Древнем Риме из железа изготовляли обручальные кольца. Постепенно по мере развития металлургии, этот металл становился доступнее и дешевле. И думаю, что никого из Вас не удивлю, если скажу, что именно железо входит в состав самого необходимого в нашей жизни сплава – стали.
Название многих элементов в таблице Менделеева говорят сами за себя: водород – «рождающий воду», углерод – «рождающий уголь», менделевий, эйнштейний, фермий, курчатовий, кюрий названы в честь великих ученых, европий, америций, франций, германий — производные географических понятий. Но есть элементы, название которых, нуждается в комментариях – это вольфрам. Даже перевод слова «вольфрам» — волчья пена – вряд ли объяснит происхождение этого названия. В самом деле, что может быть общего у элемента IV группы Периодической системы Менделеева с лесным хищником?
Еще в древние времена металлурги не раз сталкивались со странным явлением: время от времени по совершенно непонятным причинам выплавка олова из руды существенно падала. Поскольку технико-экономические показатели плавки волновали и наших предков, они стали внимательно присматриваться к оловянной руде, идущей на плавку. Вскоре им удалось подметить такую закономерность: неприятности возникали тогда, когда в руде встречались тяжелые камни бурого и желто-серого цвета. Вывод напрашивался сам: камень «пожирает олово, как волк овцу». А коли так, то пусть и называется этот злой камень «вольфрамом».
В 1864 году англичанин Роберт Мюшер впервые ввел вольфрам, всего 5%, как легирующую добавку в сталь. Резцы, изготовленные из этой стали, позволили в полтора раза повысить скорость резания металла. А спустя примерно 40 лет появилась быстрорежущая сталь, содержащая до 8% вольфрама. Чтобы расплавить вольфрам, нужно нагреть его до такой температуры, при которой большинство металлов уже испаряется – 3400оС. Тугоплавкость этого элемента и обеспечили ему применение в одной из важнейших отраслей нашей промышленности – энергетики.
Несметные сокровища волшебных камней-самоцветов таят в себе недра седого Урала. Но, пожалуй, ни с одним из них не связано столько легенд, как с малахитом. Воспетый Бажовым, этот чудесный зеленый камень с неповторимым узором золотые руки мастеров-камнерезов превращали в изумительной красоты изделия. Быть может, не все знают, что малахит является одним из минералов меди, с которым неразрывно связана вся история цивилизации.
Важнейшие свойства меди – ее отличная электропроводность и теплопроводность. Только один металл обладает еще более высокими показателями этих свойств – серебро. Но этот металл дорог и не может широко применяться в технике. По способности проводить электрический ток медь в 5 раз превосходит железо, в 1,5 раз – алюминий, в 3 раза – цинк, в 35 раз – титан. Вот почему медь по праву называют главным металлом электротехники.
Полностью урок можно скачать в начале страницы
Воспроизведение материалов на других сайтах возможно только с использованием гиперссылки на данную страницу или на главную страницу сайта www.moeobrazovanie.ru
moeobrazovanie.ru
Химия в профессии автомеханика — реферат
Высокое содержание СО.
Высокое содержание СО может
быть вызвано такими факторами, как:
• Чрезмерно богатая воздушно-топливная
смесь
• Загрязнение воздушного фильтра
• Выход из строя клапана PCV
• Загрязнение топлива маслом
• Заедание или протечки в топливной форсунке
На исправном автомобиле с каталитическим
нейтрализатором выделение одноокиси
углерода обычно приближается к нулю.
Содержание одноокиси углерода измеряется
в процентах от полного объема в воздухе.
Бензин.
Бензи́н — горючая смесь лёгких углеводородов с температурой кипения от 30 до 200 °C. Плотность около 0,75 г/см³. Теплотворная способность примерно 10500 ккал/кг (46 МДж/кг, 34,5 МДж/литр). Температура замерзания ниже -60 °C.
Получение.
Бензин получают путем разгонки и отбора фракций нефти, выкипающих в определенных температурных пределах; до 100 °C — бензин I сорта, до 110 °C — бензин специальный, до 130 °C — бензин II сорта, до 265 °C — керосин («метеор»), до 270 °C — керосин обыкновенный, примерно до 300 °C — производится отбор масляных фракций. Остаток считается мазутом.
Повышение качества автомобильного бензина.
Повысить качество автомобильных бензинов можно за счет следующих мероприятий:
отказа от применения в составе бензинов соединений свинца;
снижения содержания в бензине серы до 0,05%, а в перспективе до 0,003%;
снижения содержания в бензине ароматических углеводородов до 45%, а в перспективе до 35%;
нормирования концентрации фактических смол в бензинах на месте применения на уровне не более 5 мг на 100 см³;
деления бензинов по фракционному составу и давлению насыщенных паров на 8 классов с учетом сезона эксплуатации автомобилей и температуры окружающей среды, характерной для конкретной климатической зоны. Наличие классов позволяет выпускать бензин со свойствами, оптимальными для реальных температур окружающего воздуха, что обеспечивает работу двигателей без образования паровых пробок при температурах воздуха до +60 °С, а также гарантирует высокую испаряемость бензинов и легкий пуск двигателя при температурах ниже -35 °С;
введения моющих присадок, не допускающих загрязнения и осмоления деталей топливной аппаратуры. В табл. 1.3 приведены действующие и перспективные отечественные и зарубежные требования по ряду экологических показателей бензинов. Наиболее массовые отечественные бензины А-76, АИ-93 (ГОСТ 2084-77) и АИ-92 (ТУ 38.001165-97) не отвечают указанным требованиям по содержанию свинца (для этилированных бензинов), массовой доли серы, отсутствию регламентации содержания бензола и моющих присадок.
Применение.
В конце XIX века бензин не находил лучшего применения, чем антисептическое средство (бензин продавался в аптеках) и топлива для примусов. Зачастую из нефти отгоняли только керосин, а все остальное, включая бензин, либо сжигали, либо просто выбрасывали. Однако с появлением двигателя внутреннего сгорания, работающего по циклу Отто, бензин стал одним из главных продуктов нефтепереработки. Хотя по мере более широкого распространения дизельных двигателей на первый план выходит дизельное топливо благодаря более высокому КПД этих двигателей. Бензин применяется как топливо для карбюраторных и инжекторных двигателей, высокоимпульсное ракетное топливо (Синтин), при производстве парафина, как растворитель, как горючий материал, сырье для нефтехимии прямогонный бензин или бензин газовый стабильный (БГС).
Свойства бензинов.
Бензины — легковоспламеняющиеся бесцветные или слегка желтые (при отсутствии специальных добавок) жидкости, имеющие плотность 700-780 кг/м?. Бензины имеют высокую летучесть, и температуру вспышки в пределах 20-40 градусов по Цельсию. Температура кипения бензинов находится в интервале от 30 до 200 C. Температура застывания — ниже минус 60 градусов. При сгорании бензинов образуется вода и углекислый газ. При концентрациях паров в воздухе 70—120 г/м? образуются взрывчатые смеси.
Автомобильные бензины в силу своих физико-химических характеристик должны обладать следующими свойствами:
• Однородность смеси
• Плотность топлива — при +20 «С должна составлять 690…750 кг/м;
• Небольшую вязкость — с ее увеличением затрудняется протекание топлива через жиклеры, что ведет к обеднению смеси. Вязкость в значительной степени зависит от температуры. При изменении температуры от +40 до —40 °С расход бензина через жиклер меняется на 20…30%;
• Испаряемость — способность переходить из жидкого состояния в газообразное. Автомобильные бензины должны обладать такой испаряемостью, чтобы обеспечивались легкий пуск двигателя (особенно чвзимой), его быстрый прогрев, полное сгорание топлива, а также исключалось образование паровых пробок в топливной системе
• Давление насыщенных паров — чем выше давление паров при испарении топлива в замкнутом пространстве, тем интенсивнее процесс их конденсации. Стандартом ограничивается верхний предел давления паров летом — до 670 ГПа и зимой — от 670 до 930 ГПа. Бензины с более высоким давлением склонны к образованию паровых пробок, при их использовании снижается наполнение цилиндров и теряется мощность двигателя, увеличиваются потери от испарения при хранении в баках автомобилей и на складах;
• Низкотемпературные свойства — способность бензина выдерживать низкие температуры;
• Сгорание бензина. Под «сгоранием» применительно к автомобильным двигателям понимают быструю реакцию взаимодействия углеводородов топлива с кислородом воздуха с выделением значительного количества тепла. Температура паров при горении достигает 1500…2400 °С.
Присадки.
Присадки — вещества, добавляемые (обычно в количествах 0,05-0,1%) к топливам, минеральным и синтетическим маслам для улучшения их эксплуатационных свойств. К присадкам относятся, антидетонаторы, антиокислители, ингибиторы коррозии и др. Подробнее виды и назначение присадок рассмотрены в приложении №1 «Перечень допущенных присадок».
ПРЕДЕЛЬНЫЕ УГЛЕРОДЫ(алканы)
Алканы.
3D модель метана — простейшего алкана
Алканы (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой Cnh3n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28′. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Простейшим представителем класса является метан (Ch5).
Номенклатура
Химическая структура метана, простейшего алкана
Физические свойства.
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
При нормальных условиях неразветвлённые алканы с Ch5 до C4h20 — газы; с C5h22 до C13h38 — жидкости; после C14h40 — твёрдые тела.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства.
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С — Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму то есть с образованием радикалов.
Реакции радикального замещения.
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфохлорирование (реакция Рида).
При облучении УФ-светом алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления.
Термические превращения алканов.
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Реакции электрофильного замещения.
Изомеризация Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4h20), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
С марганцовокислым калием (KMnO4) и бромной водой (Br2) алканы не взаимодействуют.
Нахождение в природе
Нахождение в космосе
В небольших количествах алканы содержатся в атмосфере внешних газовых планет Солнечной системы, как-то: на Юпитере — 0,1 % метана, 0,0002 % этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5·10−10, соответственно.[1] На спутнике Сатурна Титане метан (1,6 %) содержится в жидком виде, причем, подобно воде, находящейся на Земле в круговороте, на Титане существуют (полярные) озёра метана (в смеси с этаном) и метановые дожди. К тому же, как предполагается, метан поступает в атмосферу Титана в результате деятельности вулкана.[2] Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах (углистых хондритах). Предполагается также, что метановые и этановые кометные льды образовались в межзвёздном пространстве.[3]
referat911.ru
Программа элективного курса «Химия и профессия Автомеханик»
Программу элективного курса «Химия и профессия Автомеханик»
Фролова Татьяна Михайловна, преподаватель химии
СОГБПОУ «Верхнеднепровский технологический техникум»
Программа элективного курса «Химия и профессия Автомеханик» актуальна, она носит прикладной характер и направлена на формирование у современных выпускников школ (9 кл.) конкретных знаний, связанных с профессией «Автомеханик». Курс программы рассчитан на 12 часов, занятия проводятся на базе СОГБПОУ «Верхнеднепровский технологический техникум» и способствуют познакомить обучающихся школ с профессиями, связанными с работой автомобиля, помочь подросткам выявить склонности и способности к этому виду профессиональной деятельности; познакомить учащихся с видами автомобильного топлива, материалами, используемыми в устройстве автомобиля, экологическими проблемами; предоставить возможность обучающимся реализовать свой интерес к выбранной профессии.
В качестве ожидаемого эффекта нововведения после изучения курса программы прогнозируется: развитие познавательных интересов, склонностей и способностей учащихся;помочь в освоении экспериментальных методов познавания;выработать умение самостоятельной работы со справочной и научно-технической литературой;развивать интеллектуальные и творческие способности обучающихся в процессе поиска решения поставленных проблем.
Изучения данного курса обеспечивает не только подготовку учащихся по предмету, но и способствует формированию у будущих рабочих профессионального мастерства.Темы элективного курса логически увязывают конкретный учебный материал с предметами профессионального цикла.
Важное место в программе отводится на проведение практических, экспериментальных исследовательских работ: «Очистка бензина от нежелательных примесей», «Исследование свойств полимеров», «Исследования загрязнения воздуха городским транспортом» и др.
Программа предполагает использование активных методов обучения (игровых, проблемных, исследовательских, наглядных, практических), где отражена творческая деятельность учащихся способствующая расширению, углублению и применению знаний.
Данная программа вносит вклад в реализацию трудового и эстетического воспитания, позволяет воспитать положительные качества характера, развивать новаторские способности, практическим умениям, расширяет знания по предмету химии.
Программа элективного курса не повторяет материал, содержащийся в базовых программах, она состоит из профессионально значимых тем, где обобщаются, конкретизируютсяи актуализируется те знания данного предмета, которые наиболее значимы в профессиональной деятельности автомехаников.
Уроки дают прекрасную возможность учащимся освоить предмет на повышенном уровне, применять знания в повседневной жизни и на практике, в разработку уроков включены различного характера химические эксперименты, повышающие интерес учащихся к обучению.
Программа элективного курса может быть предложена для проведения уроков факультативного курса для учащихся училищ, лицеев и других образовательных учреждений системы НПО, СПО.
Тематический план программы элективного курса «Химия и профессия Автомеханик»
2
1
1
2
2
Автомобильное топливо
2
1
1
2
3
Полимерные материалы, их свойства, применение в устройстве автомобиля
2
1
1
2
4
Сплавы и металлы, используемые в автомобилестроении.
Разрушение металлов
2
2
—
2
5
Экология и автомобиль
2
1
1
2
6
Зачет (защита проекта, реферата, презентации работ и. т. д.)
2
—
2
3
12
6
6
Краткое содержание программы элективного курса «Химия и профессия Автомеханик»
Тема 1. Презентация курса «Химия и профессия Автомеханик» (2). Знакомство с профессией, историей техникума. Встреча с представителями профессии (автомеханик, слесарь по ремонту автомобилей, слесарь по ремонту топливной аппаратуры и т.д.). Экскурсия в мастерские техникума.
Тема 2. Автомобильное топливо. Виды топлива, топливо для бензиновых двигателей. Дизельное топливо. Топливо для двигателей газобаллонных автомобилей (2).Лабораторная работа: «Очистка бензина от нежеланных примесей».Экскурсия на АЗС.
Тема 3. Полимерные материалы, их свойства, применение в устройстве автомобиля (2). Физико-механические свойства полимеров. Химические свойства. Использование пластмасс в автомобилестроении. Экологически грамотное обращение с полимерами.Практическая работа: «Исследование свойств полимеров».
Тема 4. Сплавы и металлы, используемые в автомобилестроении. Разрушение металлов (2). Характеристика металлических конструкционных материалов. Черные металлы, цветные металлы и сплавы, их применение в автомобилестроении. Мероприятия по увеличению долговечности металлов, применяемых в устройстве автомобиля. Влияние продуктов коррозии металлов на окружающую среду.
Тема 5. Экология и автомобиль (2). Загрязнение окружающей среды транспортными средствами, стационарными источниками на транспорте, шумовое воздействие транспорта. Альтернативные виды топлива.Практическая работа: «Исследование загрязнения воздуха городским транспортом».
Тема 6.Защита проекта (3). Завершающий этап работы над проектом. Повторение работы. Составление речи для выступления. Освоение навыков представления результатов своего интеллектуального труда, развитие творческих способностей. Обобщение представлений о профессии автомеханик.
Приложение программа элективного курса прилагается
Список используемой литературы
1. Габриелян О. С. Химия: учебник для студ. сред.проф. учеб. заведений /О.С. Габриелян, И. Г. Остроумов. – 4-е изд., стер. – М.: Издательский центр «Академия», 2008. – 336 с.
2. Габриелян О. С. Практикум по общей, неорганической и органической химии: учеб.пособие для студ. сред. проф. учеб. заведений/О.С. Габриелян, И. Г. Остроумов, Н. М. Дорофеева. – М.: Издательский центр «Академия», 2007. – 256 с.
3. Ерохин Ю. М. Химия: Учебник для средн. проф. учебных заведений. – 6-е изд., испр. и доп. – М.: Издательский центр «Академия», 2005. – 384 с.
4.Настольная книга учителя химии/О.С. Габриелян, Н.П.Воскобойникова, А.В.Яшукова – 2-е изд., стереотип — М.: Дрофа,2003 – 416 с.
5.Химия. Тесты для повторения и подготовки – Саратов: лицей, 2006 – 256с.
6.Занимательные задания и эффективные опыты по химии/ Б.Д.Степин, Л.Ю.Аликберова — М.: Дрофа,2002 – 432 с
7.Живая Инновация. Мышление 21 века: пособие для старшеклассников/С.Л.лесков – 2е изд. – М.: Просвещение, 2010 – 240с.
8.Из чего все сделано? Рассказы о веществе/Любовь Стрельникова под ред. Генриха эрлиха – М.: Яуза-пресс, 2011 – 208с.
9. Ерохин Ю. М. Сборник задач и упражнений по химии (с дидактическим материалом): учеб.пособие для студ. средн. проф. учебных заведений/ Ю. М. Ерохин, В. И. Фролов. – 5-е изд., стер. – М.: Издательский центр «Академия», 2008. – 304 с.
infourok.ru
Химия в профессии автомеханика — реферат
Консервационные масла предназначены
для консервации внутренних поверхностей
машин и механизмов, т.е. для защиты металлических
поверхностей от атмосферной коррозии.
Используются на заводах изготовителях.
В эти масла вводят ингибиторы коррозии.
В маркировке указан класс вязкости : К-17.
Эти масла должны обеспечивать защиту
не менее 5 лет.
Электроизоляционные масла – к ним относятся:
трансформаторные, конденсаторные, кабельные,
для выключателей.
Основные требования: устойчивость к окислению,
низкая электропроводность, высокая электрическая
прочность, устойчивость в электрическом
поле, хорошие вязкостно-температурные
свойства.
Эти масла перед использованием подвергаются
глубокой термовакуумной обработке. Концентрация
воздуха в масле, должна быть не более
0,1%(Св ?
0,1%), концентрация воды не более 0,001%.
Эти масла изготовляются из нефтепарафинового
основания с низким содержанием серы.
Гидравлические масла служат несжимаемой
жидкостной средой(или рабочей жидкостью)
для передачи энергии в гидравлической
системе. От одного узла к другому и превращении
этой энергии в полезную работу. Вязкость
является одной из основной характеристикой.
Обязательные условия: высокая антиокислительная
способность, антикоррозионные свойства,
устойчивость к пенообразованию.
Технологические масла – представляют
собой специфическую группу масел, т.к.
используются при производстве различных
материалов и продукции в качестве сырьевых
компонентов и добавок. Кроме того, могут
использоваться в качестве абсорбента.
Технологические масла применяют для
резинотехнических изделий, для текстильной
промышленности(для замасливания хлопка),
для производства синтетических волокон,
а также используются в качестве классификаторов,
в качестве теплоносителей, для производства
присадок.
Технологические масла изготавливают
из мало- и средневязких дистиллятов.
Эти масла подвергаются гидроочистке
и после этого используются в качестве
стандартных у/в сред, при определении
свойств резинотехнических изделий.
Вакуумные масла.
Большая доля приходится на минеральные
и синтетические масла. Подвергаются глубокой
очистке и проходят I-II ступени тонкой
вакуумной дистилляции, удаляют воздух
и влагу.
Выпускают различных классов вязкости,
предназначенных для различных типов
вакуумных насосов. К ним предъявляются
жесткие требования по антиокислительным
и антикоррозионным свойствам, и они должны
иметь хорошую вязкостно-температурные
характеристики. Индекс вязкости не менее
95.
Пластичные смазки отличаются от нефтяных
масел наличием твердого загустителя,
образующего структурный каркас, т.е. пластичные
масла сочетают свойства твердого тела
и жидкости. При отсутствии нагрузок пластичные
смазки ведут себя как твердые тела, но
при воздействии даже малых нагрузок,
структурный каркас разрушается и смазки
приобретают вязко-текучее состояние.
После прекращения воздействия нагрузок
структурный каркас восстанавливается,
и смазки приобретают первоначальные
свойства. Это явления называют тиксотропия
(не характерной для масел).
По составу пластичные смазки включают
три основные составляющие:
— дисперсионная среда;
— дисперсная фаза(т.е. твердый загуститель)-
10-13%;
— всевозможные добавки от 1 до 15%, они представляют
собой присадки, наполнители, модификаторы
структуры. Выбор и количество этих добавок
выбираются по назначению смазок.
Дисперсионная среда представляет собой
нефтяные или синтетические масла.
Чаще всего из нефтяных масел используют
индустриальные масла с V50= 40-60 мм2/с(легкие
и средние дистилляты).
При использовании синтетических масел
получают смазки, имеющие высокие индексы
вязкости — более 140.
Дисперсная фаза, которую образует твердый
загуститель, преимущественно образуется
при введении в состав масел солей жирных
высокомолекулярных кислот (или их называют
металлические мыла). Могут также использоваться
неорганические добавки (на основе силигагеля).
Также могут использоваться органические
загустители (кристаллические полимеры).
Добавки – антиокислительные присадки,
антифрикционные.
Основные свойства пластичных смазок.
Наиболее важное значение, придают их
реологическим свойствам (объемно- механические).
1. Предел прочности на сдвиг, определяет способность смазок удерживаться на поверхностях трения. Этот показатель должен быть не менее 100-200
2. Вязкость влияет на пусковые
характеристики механизмов и
на потери энергии при работе
различных узлов трения. Принято
определять динамическую
3. Механическая стабильность
4. Термоупрочнение — это характеристика только пластичных смазок, связанная с тем, что при изменении температуры все показатели меняются. Для некоторых смазок после термообработки, повышается предел прочности на сдвиг. ( на сажевых, на основе солей синтетических жирных кислот).
5. Испаряемость дисперсной среды
смазки. Этот показатель характеризует
срок службы смазки. При производстве
вакуумных смазок – отдают
предпочтение синтетическим
6. Химическая стабильность – используется при температуре 1000С. Только для смазок на основе нефтяных масел.
Пластические смазки подразделяются по типу загустителя на:
1. Мыльные;
2. Немыльные;
3. Углеводородные;
4. Полужидкие.
Мыльные смазки называют в зависимости от металла( литиевые, натриевые, кальциевые, алюминиевые, комплексные смазки).
Литиевые смазки позволяют расширить
температурные пределы использования
смазок.
В России доля литиевых смазок 23%, в США
60%.
Литол-24 – эта смазка позволяет использовать
её в широком температурном интервале
от –40 до +1300С.
Солидол – предел использования 60-700С.
Термостойкие смазки ВНИИНП-207, ВНИИНП-210, униол-1. Температурный предел до 2500С, удовлетворит антифрикционные свойства.
Немыльные смазки на неорганических загустителях
(силикагель, сажа, бентонит). Доля производства
0,02% или около 10 тонн в год. Обладает повышенной
химической устойчивостью к воздействию
агрессивных сред.
На органических загустителях – полиуретановые
– готовят на основе полимеров.
Углеводородные смазки( в России производят 3 тыс. тонн в год) готовят на основе у/в смесей.
Полужидкие смазки – используют для
герметизации малых зазоров в механизмах.
(150 наименований, использование до 1500С).
Пластики в автомобилестроении.
Применение пластмасс(пластиков) в конструкции автомобилей приобретает всй более широкие масштабы.Это объясняется в первую очередь тем, что по ряду показателей – плотности, коррозионной стойкости, антифрикционным и электротехническим, а также технологическим свойствам – пластики значительно превосходят традиционные материалы, используемве при изготовлении автомобиля.За последние 10 лет произошли принципиальные сдвиги в области применения пластмасс в автомобилестроении.Ранее из пластиков изготавливали детали только электротехнического, декоративного назначения.
Основные факторами, обусловливающими значительное внедрение пластмасс в конструкцию автомобилей, являются ;
1. Во-первых, машина становится легче, а это означает, что снижается расход топлива.
2. Во-вторых, открывается возможность для новых конструкционных решений, поскольку термопластичные полимеры легко поддаются переработке и, следовательно, позволяют воплотить любые дизайнерские идеи. Благодаря этому можно получать детали самых хитроумных форм и цветов без дополнительных операций по механической обработке и окраске.
3. В-третьих, применение пластиков помогает не только отказаться от дорогостоящих цветных металлов и нержавеющих сталей, но и сократить энерго- и трудозатраты в процессе производства, а значит, снизить стоимость автомобиля.
4. В-четвёртых, повышение долговечности и эксплуатационных характеристик автомобиля
Пластическими массами (пластмассами, пластиками) принято называть материалы, представляющие собой композицию полимера или олигомера с различными ингредиентами, находящуюся при формовании изделий в вязкотекучем или высокоэластическом состоянии, а при эксплуатации — в стеклообразном (аморфном) или кристаллическом состоянии. В качестве ингредиентов могут входить наполнители- тальк, каолин, слюда, древесная мука, стеклянные, органические, углеродные и др. волокна; пластификаторы, отвердители, стабилизаторы и т.д. По характеру связующего вещества пластики подразделяются на а)термопластичные пластмассы (термопласты), получаемые на основе термопластичных полимеров, и б)термореактивные пластмассы (реактопласты), т.е. неразмягчающиеся.
а)Термопластичные пластмассы (термопласты)
В настоящее время в конструкции автомобилей применяются разнообразные полимеры: полиолефины, ПВХ, полистирол, фторопласты, полиметилакрилат, полиамиды, полиформальдегид, поликарбонат, стеклопластики, фенольные пластики, полиуретаны, этролы, аминопласты, волокниты, текстолиты и др. Самое главное преимущество пластиков в том, что они обладают комплексом свойств, необходимых для конкретного конструкционного элемента А от того, насколько соответствует материал условиям эксплуатации, зависит надежность детали и, в конечном итоге, безопасность автомобиля, а также комфорт водителя и пассажиров
Полиолефины.
Полиолефины — высокомолекулярные углеводородные алифатического ряда, получаемые полимеризацией соответствующих олефинов( этилена,пропилена, и т.д.). В этих полимерах удачно сочетаются механическая прочность, химическая стойкость, высокая морозостойкость, низкая газо- и влагопроницаемость, и хорошие диэлектрические показатели.
В автомобильной промышленности из полиолефинов широко применяются полиэтилены, полипропилены, а так же различные их модификации.
Полиэтилен низког дваления(ПЭНД)- более прочный и жёсткий материал по сравнению с ПЭВД, механическая прочность его в 1,5-2 раза выше,чем у ПЭВД может эксплуатироваться в широком интервале температур. Хороший диэлектрик.Обладает высокой химической стойкостью.Нестоек к воздействию УФ-лучей.В автомобилестроении используют марки ПЭНД (по ГОСТ 16338-85):20908-040, 20708-016, 21008-075, 20608-012).Из ПЭНД изготавливают педали привода акселератора, бачки главного цилиндра тормоза и сцепления, оболочки внутреннего заднего троса привода ручного тормоза, втулки крепления уплотнения, крыльчатки, корпус лампы распределителя заднего отопитнля,коробы вентиляции передка.
Полипропилен
Продукт полимеризации пропилена при низком давлении.По сравнению с полиэтиленом полипропилен имеет более высокую механическую прочность и жёсткость, большую теплостойкость и меньшую стойкость к старению.Имеет хорошие химические и диэлетрические свойства.Разрушающее напряжение при растяжении достгает 25-4- МПа. Недостатком полипропилена является его невысокая морозостойкость (-20 С).В автомобилестроении полипропилен применяется для изготовления колец и прокладок изолирующих пружин подушки опоры двигателя, расширительного бачка,чехла защитного рычага привода ручного тормоза, крышки и корпуса блока предохранителей, для антикоррозионной фетеровки резервуаров, элетроизоляционных деталей, а так же изготоаления деталей применяемых при работе в агрессивных средах, корпусные детали автомобилей и корпуса аккумуляторов, прокладки,
Фланцы, корпуса воздушных фильтров, конденсаторы, вставки демпфирующих глушителей, зубчатые и червячные колёса, ролики, подшипники скольжения, фильтры масляных и воздушных систем, рабочие детали вентиляторов, насосов, уплотнения, кулачковые механизмы, изоляция проводов и пружин.
Полиамиды(ПА)
Полиамиды – представляют собой высокомолекулярные полимеры, содержащие в основной цепи макромолекулы амидную группу.Соотношение метиленовых и амидных групп в составе ПА определяет такие основные свойства полимера, как температура плавления, водопоглощение, эластичность, морозостойкость.
Поликарбонат
Поликарбонат — термопластичный полимер на основе дифенилолпропана и фостена, выпускаемый под названием дифлон.Поликарбонат характеризуется низкой водопоглощаемостьюи газонипроницаемостью, хоршими диэлектрическими свойствами, высокой жёсткостью, теплостойкостью и химической стойкостью,прозрачен, хорошо окрашивается.Стоек к световому старению и действию окислителей даже принагреве до 120 С, допускается при работе изделий в интервале от -100 до 135 С.Это один из наиболее удпропрочных термопластов, что позволяет использоватьего в качестве конструкционного материала, заменяющего металлы.В автомобилестроении из поликарбоната изготавливают шестерни, подшипники, корпуса,крышки,клапаны.
Полиформальдегиды(полиацетали)
Полиформальдегиды(ПФ) – это продукт полимеризации формальдегида и триоксана с диоксоланом(СТД).Они сочетают высокий модуль упругости при растяжении и изгибе с достаточно большой ударной вязкостью.По показателям долговременной прочности при растяжении и изгибе и по усталостной прочности эти материалы превочходят все другие термопласты , включая полиамиды, поликарбонаты.Теплостойкость при изгибе при высоких нагрузках у образцов из ПФ выше, чем у других термопластов, включая ПА-610, а коэффициент трения по стали близок к этому показателю для ПА.Антифрикционные марки ПФ имеют коэффициент трения 0,15-0,20.Полиформальдегиды значительно превосходят ПА по водостойкости:при эксплуатации в водной среде механические свойства материалов изменяются незначительно.Эти материалы удачно сочетают хорошие электротехнические свойства с механической прочностью и водостойкостью.
При нормальных и пониженных температурах они устойчивы ко всем без исключения органическим растворителям, слабым кислотами основаниям.Полиформальдегиды имеют хорошую сырьевую базу и в перспективе являются интересным конструкционным материалом.В настоящее время стоимость ПФ высока, что ограничивает их применение.К недостаткам этих материалов следует отнести невысокую стойкость к воздействию УФ-лучей и светостойкость.Основной метод переработки- литьё под давлением.
Фенопласты
Фенопласты(фенольные пластики) — пластмассы основе фенолоформальдегидных смол.В зависимости от наполнителя фенопласты подразделяются на порошкообразные, волокнистые, слоистые материалы.Фенопласты, содержащие порошкообразные наполнители(древесную муку, минеральные наполнители.), наз. – пресс-порошками.Фенопласты, содержащие наполнитель в виде хлопчатобумажных волокон, наз. – волокнитами, а в виде стеклянных волокон – стекловолокнитами.Если фенопласты имеют в качестве наполнителя ткани,то – текстолиты, если бумагу — гетинаксами. Отличительной особенностью фенопластов является хорошие диэлектрические показатели, высокие механические свойства, низкое водопоглощение, хорошие химические свойства.В автомобилестроении для производства деталей применяются следующие фенопласты:
Перспективы применеия пластмасс в конструкции автомобиля
Применение пластиков в конструкции автомобиля позволяет снизить массу, улучшить эксплуатационные характеристики автомобиля, повысить его травмобезопасность и комфортабельность.В среднем в одном легковом автомобиле применяется 45кг пластмасс, в перспективе предусматривается увеличение этого количества до 80-110кг.В основном внедрение пластмасс в автомобиль происходит при разработке новых конструкций базовых моделей.Основным направлением расширения применения пластмасс в конструкции автомобиля является внедрение крупногабаритных наружних деталей кузова из композиционных полимерных материалов, обеспечивающих снижение массы и повышение долговечности за счёт коррозионной стойкости.Разработка высокопрочных композиционных материалов с полимерной матрицей и стеклянными, углеродными и другими волокнами позволила перейти к использованию их в нагруженных силовых деталях, таких как карданные валы, рессоры, обода колёс.
referat911.ru

