Задачи по химии 9 класс олимпиада: Всероссийская олимпиада по химии, задания
Олимпиадные задания по химии. 9 класс. | Олимпиадные задания по химии (9 класс) на тему:
Школьная олимпиада по химии (9 класс)
Открытые вопросы
Вопрос 1 (3 балла)
Напишите уравнения реакций, при помощи которых, используя простые вещества кальций, фосфор и кислород, можно получить фосфат кальция.
Вопрос 2 (8 баллов)
Студенистое голубое вещество А нейтрализуется бесцветным веществом Б с образованием голубого раствора вещества В. При выпаривании раствора и прокаливании осадка образуются: газ бурого цвета Г, газ Д (бесцветный, в котором вспыхивает тлеющая лучинка) и твердое вещество Е черного цвета, которое может вступать в реакцию с веществом Б с образованием вещества В. Определите вещества А, Б, В, Г, Д и Е и приведите уравнения соответствующих реакций.
Вопрос 3. (6 баллов)
Твёрдое, белое, дымящееся на воздухе вещество, принесли из цеха, где делают мороженое, поместили в стакан с дистиллированной водой. Кусок «исчез». В получившемся растворе лакмус изменяет окраску на красную. Известно, что относительная плотность этого вещества в газообразном состоянии по воздуху приблизительно равна 1,52. Назовите вещество. Приведите уравнения реакций, характеризующих его свойства. Рассчитайте его относительную молекулярную массу.
Известно, что относительная плотность этого вещества в газообразном состоянии по воздуху приблизительно равна 1,52. Назовите вещество. Приведите уравнения реакций, характеризующих его свойства. Рассчитайте его относительную молекулярную массу.
Вопрос 4 .(6 баллов)
Используя только 11 букв, которые входят в название элемента номер 91 в периодической системе Д.И. Менделеева, составьте как можно больше названий других химических элементов.
Р.S. Предложив 6 названий, вы получите максимальный балл. Не ищите более шести названий.
Вопрос 5. (7 баллов)
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
1 2 3 4 5 6
Li → Li3N → LiOH → Li2CO3 → LiCl → LiNO3 → Li NO2
К 4 превращению записать сокращённое ионное уравнение.
Вопрос 6. (3 балла)
Методом электронного баланса подберите коэффициенты в схеме окислительно-восстановительной реакции, укажите окислитель и восстановитель:
h3S + K2Cr2O7 + h3SO4 → S + Cr2(SO4)3 + K2SO4 + h3O
Вопрос 7.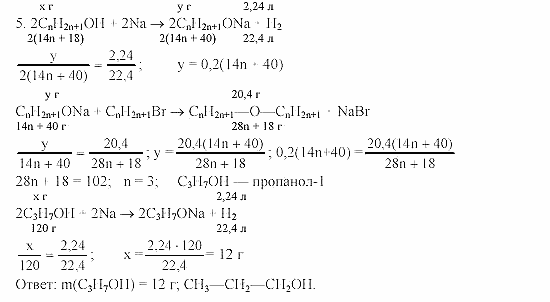 (2 балла)
(2 балла)
Один из элементов периодической системы химических элементов Д.И.Менделеева образует оксид, массовая доля кислорода в котором составляет 30,5 %. Элемент проявляет в этом оксиде степень окисления, равную +4. Определите относительную атомную массу этого элемента и назовите его.
Вопрос 8. (5 баллов)
Через раствор массой 50 г с массовой долей иодида натрия 15 % пропустили избыток хлора. Выделился иод массой 5,6 г. Определите выход продукта реакции.
Итого: 43 балла
Ответ на вопрос 1:
4 Р + 5О2 = 2 Р2О5 (1 балл)
2 Сa + O 2 = 2 CaO (1 балл)
3 СaO + P2 O5 = Ca3 (PO4)2 (1 балл)
Ответ на вопрос 2:
Студенистое голубое вещество А – Cu(OH)2 (1 балл)
бесцветное вещество Б – HNO3 (1 балл)
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2h3O (1 балл)
Cu(NO3)2 раствор этого вещества имеет голубую окраску. При прокаливании кристаллов этой соли образуются 3 вещества:
2Cu(NO3)2 = 2CuO + 4NO2 + O2 (1 балл)
CuO (вещество Е черного цвета) (1 балл)
NO2 (газ Г бурого цвета) (1 балл)
O2 (бесцветный газ Д, в котором вспыхивает тлеющая лучинка) (1 балл)
Вещество Е реагирует с веществом Б с образованием вещества В
CuO + CuO + 2HNO3 = Cu(NO3)2 + h3O (1 балл)
Ответ на вопрос 3:
А) Речь идет о твёрдом оксиде углерода (IV) – «сухом льде». Применяют его для охлаждения, например, мороженого, металла. (1 балл)
Применяют его для охлаждения, например, мороженого, металла. (1 балл)
Возможные уравнения реакций:
Б) CO2 + h3O=h3CO3 (1балл)
В) CO2 + Ca(OH) 2=CaCO3↓ + h3O (1балл)
Г) CaCO3 + h3O + CO2 = Ca(НCO3) 2 (1балл)
Д) CO2 + СаО= CaCO3↓ (1балл)
Е) Mr (газа)= Д(газа, воздуха) ∙ Mr(воздуха)
Mr (газа)=1,5∙ 29 = 44,08≈44 (1 балл)
Mr (CO2)=12 + 16∙ 2 ≈44 (1 балл)
Ответ на вопрос 4:
Протактиний
Актиний № 89 (1балл)
Торий №90 (1балл)
Натрий №11 (1балл)
Титан № 22 (1балл)
Криптон № 36 (1балл)
Иттрий №39 (1балл)
Ответ на вопрос 5:
1) 6 Li + N2 = 2 Li3N 1 балл
2) Li3N + 3 h3O = 3 LiOH + Nh4↑ 1 балл
3) 2 LiOH + СO2 = Li2CO3 + h3O 1 балл
4) Li2CO3 + 2 HCl = 2 LiCl + h3O + СO2↑ 1 балл
5) LiCl + AgNO3 = AgCl ↓+ LiNO3 1 балл
6) 2LiNO3 = 2 LiNO2 + O2↑ 1 балл
7) 2 H+ + СO32- = h3O + СO2↑ 1 балл
Ответ на вопрос 6:
3 h3S + K2Cr2O7 + 4 h3SO4 = 3 S + Cr2(SO4)3 + K2SO4 + 7 h3O 1 балл
3 S2- — 2e- = S0 2 балла
2 Cr+6 + 3 e- = Cr+3
h3S — восстановитель 1 балл
K2Cr2O7 — окислитель
Ответ на вопрос 7:
ЭО2 1 балл
ω (О) = Ar(О)•2 / Ar(Э) + Ar(О)•2
0,305 = 32 / х + 32
Х = 73 — германий 1 балл
Ответ на вопрос 8:
2 NaI + Cl2 = 2 NaCl + I2 1 балл
m(Nal) = m(Nal)раствора •ω = 50 •0. 15 7.5 (г) 1 балл
15 7.5 (г) 1 балл
n(Nal) = m/M = 7,5 / 150 = 0,05 (моль) 1 балл
n(l2) = 0,5 n(Nal) = 0,025 моль 1 балл
m(l2)теор. = M•n = 254 • 0,025 = 6,35 (г) 1 балл
ή = m практ. / m теор. = 0,882 (88,2%) 1 балл
Используемые источники:
- Примеры заданий к олимпиадам, подборки от учителя Валерии Токаревой
- http://ruolimpiada.ru/olimpiada-po-khimii-9-klass-zadaniya-s-ot/
- https://infourok.ru/shkolnaya-olimpiada-po-himii-klass-388389.html
- https://nsportal.ru/shkola/khimiya/library/2011/10/25/olimpiada-po-khimii-9-klass
- Примеры заданий по химии. Руднев Алексей Николаевич
Задания школьного этапа олимпиады по химии для 9 класса – УчМет
г. Нягань ХМАО-Югра Тюменская область
Решения заданий школьного тура олимпиады по химии 9 класс.
Тест.
№ задания | 1 | 2 | 3 | 4 | 5 |
Ответ | 4 | 3 | 1 | 1 | 3 |
Всего за задание: 5 баллов
Самый легкий металл –Li.

Он легко растворим в воде с выделением водорода 2Li + 2H2O = 2LiOH + H2↑ (1 балл)
При этом образуется гидроксид лития и раствор приобретает щелочную реакцию.Полученный газ водород легко горит
2H2+ O2 = 2H2O (ţ ) (1 балл)
и восстанавливает металлическую ртуть (жидкость) из ее оранжево-красного оксида
HgO + H2 = Hg + H2O (ţ ) (1 балл)
Эта
же жидкость (Hg) может быть
получена и в результате непосредственного
нагревания оксида ртути 2HgO
= 2Hg + O2↑
(ţ ) (1 балл) Таким образом: А-
литий(Li), В- водород (H2),
С- металлическая ртуть (Hg).
Всего за задание: 5 баллов
M(CaCO3) = 100 г/моль. (1 балл)
Массовая доля кальция в карбонате кальция равна
w(Ca) = 40/100 = 0,4. (1 балл)
Масса кальция в каждом курином яйце равна
m(Ca) = w(Ca)*m(CaCO3) = 0,4 * 5 = 2г. (1 балл)
Таким образом, с каждым яйцом курица теряет 2 г. кальция. В год она теряет
2*220 = 440 г. кальция. (1 балл)
Эта
масса кальция (440 г. ) должна восполняться
в рационе несушки в течение года
) должна восполняться
в рационе несушки в течение года
Всего за задание: 4 балла
Реакция замещения Zn + CuSO 4 = Cu↓ + ZnSO4 (1 балл)
Реакция обмена CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4 (1 балл)
ZnSO4 + 2NaOH = Zn(OH)2 ↓+ Na2SO4
Реакция разложения Cu(OH)2 = CuO↓ + H2O(ţ ) (1 балл)
Реакция присоединения Zn(OH)2 + 2NaOH = Na2[Zn(OH)]4 (2 балла)
Всего за задание: 5 баллов
По изменению цвета индикаторной бумаги определим, в каких двух пробирках находятся кислоты, в двух других – соли (среда этих растворов нейтральная).

Затем добавим к двум пробиркам, где находятся кислоты, реактив – раствор хлорида бария. Там, где находится HCl, ничего не произойдет. При взаимодействии с серной кислотой появится осадок белого цвета.
H2SO4 + BaCl2 BaSO4 + 2HCl (2 балла)
Добавим к двум другим пробиркам, где находятся соли, тот же реактив – раствор хлорида бария. Там, где находится NaCl, ничего не произойдет, в пробирке с Na2SO4 появится осадок белого цвета.
Na 2
SO4 + BaCl2 BaSO4 + 2NaCl (2 балла)Всего за задание: 6 баллов
Так как металл в оксиде трехвалентный, оксид имеет формулу Ме2О3.
 (1 балл)
(1 балл)
Зная, что оксид содержит 70 % металла, определим атомную массу металла –Ar(Me) из соотношения
2* Ar(Me) = 70/100 (3 балла)
2* Ar(Me) + 48
Откуда Аг(Ме)= 56 г/моль. Искомым металлом является железо. (1 балл)
Уравнения реакций протекающих процессов будут иметь вид:
Fe(NO3)3 + 3NaOH = 3NaNO3 + Fe(OH)3↓ (1 балл)
2Fe(OH)3 = Fe2O3 + 3H2O (2 балла)
Всего за задание: 8 баллов
6. N(О3)
= n (О3) × Nа = 150 × 6,02×1023 = 9,03× 1025 молекул
(2 балла)
N(О3)
= n (О3) × Nа = 150 × 6,02×1023 = 9,03× 1025 молекул
(2 балла)
М(О3)
= 48 г/моль
m(О3)
= n ×М = 150×48 = 7200 г = 7,2 кг (3 балла)
Всего за задание: 5 баллов
Прошлые работы олимпиады по химии | Ресурс
Потренируйтесь отвечать на вопросы в стиле олимпиады с помощью этих прошлых работ и отметьте схемы ответами
Для учащихся, планирующих принять участие в олимпиаде по химии, тестирование прошлых работ дает им возможность отточить ключевые навыки и повысить уверенность перед экзаменом. конкуренция. В этом сборнике собраны прошлые статьи, начиная с 2003 г., каждая из которых сопровождается кратким изложением затронутых тем, а также схемой оценок с ответами.
Некоторые документы также включают оригинальную брошюру с ответами учащихся и отчеты экзаменаторов.
Как использовать прошлые работы по химии
Прошлые работы могут гибко использоваться учителями и учащимися с разной степенью независимости. Просмотрите сводку докладов и тем ниже, чтобы найти конкретный вопрос, или выберите документ, который нужно проработать от начала до конца.
Химические олимпиады сосредоточены на решении задач и вознаграждают за стойкость, поэтому учащиеся должны пробовать как можно больше частей каждого вопроса и стараться не откладывать, если есть части, на которые они не могут ответить. Даже кажущаяся «низкой» оценка может принести медаль на соревнованиях.
Вопросы часто усложняются по мере продвижения работы, но учащиеся, изучающие A-level или эквивалентные квалификации, должны быть в состоянии выполнить большинство частей.
Дополнительная поддержка и ресурсы
- Ознакомьтесь с нашим буклетом поддержки олимпиады по химии, чтобы получить дополнительные указания по типам вопросов, используемых в конкурсе, а также примеры вопросов с комментариями и анализом.

- Подготовьтесь к решению всего предыдущего задания, используя нашу серию отработанных ответов, разработанных, чтобы помочь учащимся, менее знакомым с вопросами в олимпиадном стиле, развить необходимые навыки и уверенность, шаг за шагом.
Поиск и загрузка ресурсов по годам
2022
Темы включают бензин E10; химия закиси азота; синтез платонового твердого кубана; расчеты равновесий при испытаниях на боковой поток; синтез и структура самого маленького в мире китайского узла; и расчеты, основанные на силицировании компонентов вакцины для повышения их стабильности.
Прошлая статья | Буклет с ответами | Отметить схему | Отчет экспертов
2021
Темы включают реакции, в результате которых образуется фосфин; захват углерода кальциевой петлей; синтез и реакции левулиновой кислоты; проекции Ньюмена; синтез гидроксихлорохина; кинетика образования дифторида ксенона.
Бумага прошлого | Буклет ответов | Маркировочная схема
2020
Темы включают реакции и строение карбида кальция; термодинамика водорода как топлива; структура химических веществ, поглощающих УФ-излучение; структуры оксидов кремния; кинетика красочных соединений; и синтез [5]-ладдерановой кислоты.
Прошлая бумага | Буклет ответов | Схема маркировки
2019
Темы включают двуокись углерода в газированных напитках; электролиз драгоценных металлов и спектры ЯМР комплексов платины; кинетика лечения отравляющими веществами нервно-паралитического действия; синтез пестицидов; расчеты по биоразлагаемым полимерам.
Бумага прошлого | Буклет ответов | Схема маркировки
2018
Темы включают реакции в литий-ионных батареях; устойчивые методы производства аммиака; изотопы и реакции урана; синтез декстрометорфана; соединения гелия и натрия.
Прошлая бумага | Марк схема | Отчет экспертов
2017
Темы включают свойства гипохлорита натрия; реакции и кинетика атмосферных газов; сплавы титана; строение и синтез твистана; и реакции супероснований.
Бумага прошлого | Марк схема | Отчет экспертов
2016
Темы включают термодинамику цикла сера-йод; реакции вольфрама; ЯМР ненасыщенных молекул; синтез флибансерина; и анализируя древние кости.
Прошлая бумага | Марк схема | Отчет экспертов
2015
Темы включают расчеты на основе оксида индия-олова; свойства 2-метилпропаннитрила; синтез риталина; скорости метаболизма этанола; реакции и термодинамика «зеленого» реактивного топлива.
Бумага прошлого | Марк схема | Отчет экспертов
2014
Темы включают реакции карбоната лантана; энергии ионизации натрия; синтез тазаротена; анализ химических веществ, которые жуки-бомбардиры используют для защиты; строение и реакции гидратов метана.
Прошлая бумага | Марк схема | Отчет экспертов
2013
Темы включают реакции и термодинамику гидразина; медь в олимпийских медалях; цвета соединений; синтез бензодиазепинов; и структура креатина.
Бумага прошлого | Марк схема | Отчет экспертов
2012
Темы включают циклические аллотропы серы; реакции аминокислот в кератине; общие знания по химии; синтез липтора; и структура самого маленького автомобиля в мире.
Прошлая бумага | Схема маркировки
2011
Темы включают анализ ингредиентов закусок; карбид кальция; использование взрывчатых веществ в гражданском строительстве; ЯМР органических соединений; и синтез фенобарбитала.
Бумага прошлого | Схема маркировки
2010
Темы включают синтез амброкса; анализ комплекса меди с помощью титрования; термодинамика фторидов галогенов; расчеты на солевых растворах; использование соединений осмия в органических реакциях; и строение золота.
Прошлая бумага | Схема маркировки
2009
Темы включают азотсодержащие топлива; сжигание метана; реакции и строение сульфидов фосфора; синтез лоперамида; и обнаружение мышьяка.
Бумага прошлого | Маркировка схема
2008
Темы включают методы получения чистого кремния; кинетика образования витамина D в грибах; термодинамика и строение гремучей ртути; реакции и анализ соединений алюминия; масс-спектрометрия полипептидов; и синтез фексофенадина.
Прошлая бумага | Маркировочная схема
2007
Темы включают реакции и термодинамику ракетных топлив; структуры аллотропов фосфора; анализ уровня фосфатов в крови; спектроскопический анализ антипиренов; синтез Тамифлю; и реакции диоксида хлора.
Бумага прошлого | Схема маркировки
2006
Темы включают реакции ингредиентов лимонного щербета; реакции в выхлопах автомобилей; структуры ацилхлоридных соединений; термическое разложение сульфата меди(II); производство кислорода в чрезвычайных ситуациях; синтез силденафила; и масс-спектрометрия и ЯМР галогеналканов.
Прошлая бумага | Схема маркировки
2005
Темы включают свойства оксидов углерода; реакции пятиокиси дийода; расчеты с метановой кислотой; спектры ЯМР нанопутиан; оценка уровня алкоголя в крови; и синтез римонабанта.
Бумага прошлого | Схема маркировки
2004
Темы включают окислительно-восстановительные реакции; реакции поллютантов, разрушающих памятники; расчет растворенного кислорода в воде; структура оранжевого агента; термодинамика белого и серого олова; электронные переходы в водороде; и структуры серосодержащих соединений.
Прошлая бумага | Схема марки
2003
Темы включают подогрев банки кофе; структура соли Рейнеке; расчет атомной экономики; написание окислительно-восстановительных уравнений; расчеты на основе исторических экспериментов; гидроксиламин и его взаимодействие с ионами железа(III); синтез флунитразепама; и свойства полония.
Бумага прошлого | Схема Марка
Олимпиада по химии Advanced Class Syllabus — JPH Chemistry Olympiad
Олимпиада по усовершенствованным классам. волновая механика
— Волновая природа электронов
— Принцип неопределенности
— Волновое уравнение Шредингера
1.2 Атомные орбитали
— Квантовые числа n, l, и ml Ф)
— Радиальные и угловые узлы
— Орбитальные энергии в водородоподобных частицах
— Спиновое квантовое число и магнитное спиновое квантовое число
— Модель Бора
1. 3 Многоэлектронные атомы 9016 9016 Электронная конфигурация основного состояния: экспериментальные данные
3 Многоэлектронные атомы 9016 9016 Электронная конфигурация основного состояния: экспериментальные данные
-Пенетрирование и экранирование
1.4 Периодическая таблица
1,5 Принцип Aufbau
-Valene и Core Electrons
-Диаграмматические представления
1.6. —Сродство к электрону
—Электроотрицательность
—Поляризуемости
—Эффект инертной пары
— Диагональная взаимосвязь
-Правила
1.7 Атомные свойства и химическая реакционная способность
-Тренды в металлическом поведении
-Тенденция по течению или получению электронов
-поведение основной группы
-ACID-биологические поведение. Оксиды
— Свойства одноатомных ионов
— Электронные конфигурации ионов переходных металлов
— Магнитные свойства ионов переходных металлов
1.8 Проблемы и интегративные проблемы
1,9 Олимпиада экзамена
Тема 2: Молекулярная структура и связь
2,1 Связывание
-Структура
— -resonance структура
-Легкие конструкции
— -resonance. теория валентной связи (VB)
теория валентной связи (VB)
—VB модель связи в h3
—VB модель связи в F2, O2 и N2
2.3 Гомоядерные двухатомные молекулы: теория молекулярных орбиталей (MO)
-Орден связывания
-Магнитные свойства
2.4 Правило октета и изоэлектронные виды
-Октетное правило: первое ряд P-блокировки
-Изоэлектронные виды
-Октетное правило: Правило октета: тяжелый P-Block. элементы
2.5 Дипольные моменты
— Полярные двухатомные молекулы
— Молекулярные дипольные моменты
2.6 Молекулярная форма и модель VSEPR
— Модель VSEPR
— 0163-Увеличения модели VSEPR
2,7 Молекулярная форма: стереоизомеризм
-Планровые виды квадрата
-Видесные виды
-Тригональные бипирамидные виды
-High Координационные номера
—doublemals
. : Гибридизация атомных орбиталей
: Гибридизация атомных орбиталей
—sp Гибридизация: линейные виды
—sp2 Гибридизация: тригональные плоские и родственные виды
—sp3 Гибридизация: тетраэдрические и родственные виды
-Другая гибридизация
-Увеличение концепции гибридизации
2.9 Электроотрицательность и углы связи
2,10 Задача и интегративные проблемы
2.11.
3.1 Кинетическая молекулярная теория газов
3.2 Истечение и диффузия газов
3.3 Химия в атмосфере
3.4 Кинетический молекулярный вид трех состояний
3,5 Межмолекулярные силы
-Гидрогеновая связь
-Ион-дипольные силы
-диполя-диполя
—Поларизуемость и индуцированные силы 9063-Dipole-Dipole
— (Лондон) силы
— Биологические макромолекулы
3.6 Структуры и типы твердых тел
— Упаковка сфер
— Эффективность упаковки
— Определение атомного радиуса или плотности твердых тел
-Уравнение Брэгга
3,7 Структура и связь в металлах
-Молекулярная теория орбитальной полосы
-Контрольные и полупроводники
-Легированные полупроводники
3. 8 Vapor Damess and Foads of Wation
8 Vapor Damess and Foads of Wation
— 3.8.
— Ионные жидкости
3.9 Фазовые диаграммы
— Зависимость между плотностью и наклоном
3.10 Энергии образования растворов
3.11 Vapor Pressures of Solutions
—Binary liquid mixtures
—Distillation
—Azeotropes
3.12 Colloids
3.13 Challenge problems
3.14 Olympiad Exam
Topic 4: Chemical Kinetics
4.1 Концентрации и скорости реакций
—Средние скорости
—Мгновенные скорости
— Начальные скорости реакций
4.2 Уникальная средняя скорость реакции
4.3 Определение закона о скорости
4.4. Интегрированный закон о скорости
-Радиоактивные скорости распада
4. 5 Механизм реакции
5 Механизм реакции
-Реакции.
4.6 Кинетика стационарного состояния
4.7 Модель химической кинетики
—Уравнение Аррениуса
4.8 Кинетика и функция биологических катализаторов
4.9 Проблемы с заданиями
4.10 Олимпиад экзамен
Тема 5: Химическое равновесие
5.1. Состояние равновесия и равновесное состояние3
5.1. Состояние равновесия и равновесное состояние3
5.1. Состояние равновесия и равновесное состояние
5.1. Состояние равновесия и равновесное состояние3
5.1. Состояние равновесия и равновесное состояние
5.1. Состояние равновесия
5.1. Равное.
5.3 Сравнение Q и K для определения направления
5.4 Как решать задачи равновесия
5.5 Принцип Ле Шателье
5. 6 Катализаторы, химическая кинетика и равновесие
6 Катализаторы, химическая кинетика и равновесие
5.7 Равновесие с участием продукта растворимости
-Эффект иона -коммон
-Эффект PH на растворимость
-представленное предприятие
-Секретирование PH
-предстоящий ура
5.9 Равновесия с участием произведения растворимости и комплексных ионов
5.10 Задачи
5.11 Олимпиадный экзамен
Topic 6: Acids and Bases
6.1 Acids and Bases
—Arrhenius acid-base and neutralization
—BrФnsted-Lowry acid-base pair
—Lewis acid-base pair
6.2 Расчет pH кислых растворов
— Сильные кислоты
— Сильно разбавленные сильные кислоты
— Слабые кислоты
— Смесь сильной кислоты и слабой кислоты
— Смесь двух слабых кислот
-Процесс-диссоциация
6. 3 Основы
3 Основы
6.4 Свойства кислотной базы солей
-Конъюгированные завие
-Соли, которые продуцируют нейтральные растворы
-Салты, которые продуцируют основные растворы
-содержащие прочности. Соли, образующие кислые растворы
6.5 Расчет pH соли для слабой кислоты и слабого основания
6.6 Обобщение концепции Бренстеда-Лоури: эффект выравнивания
6.7 Рассчитайте рН солей полипротичной кислоты
6.8 Состав и рН
6.9. Свойства кислотной базы оксидов
6.10 Проблемы с вызовом и олимпиадиад.
7.1 Буферные растворы
— Состав буферного раствора
— Буферизация: как это работает
— Буферная емкость
7.2 Стехиометрия титрования полипротонной кислоты
7.3 Quantifying Redox Reactions by Titration
7.4 Back Titration
7. 5 Challenge problems
5 Challenge problems
7.6 Olympiad Exam
Topic 8: Thermodynamics: The First Law
8.1 Expansion Work
8.2 Энергия и энтальпия
8.3 Термодинамическое стандартное состояние
8.4 Энтальпии физических и химических изменений
8.5 Калориметрия и теплоемкость
8.6 Расчет изменений энтальпии — Закон Хесса
8.7 Стандартные энтальпии формирования
8.8 Цикл Born-Haber
8.9 Entalpies
8.9 ЭНДАЛП.
8.11 Контрольные задачи
8.12 Олимпиадный экзамен
Тема 9: Термодинамика: второй и третий законы
9.1 Самопроизвольные процессы и энтропии0152
-ПРИМЕДИНГОВОЕ ИЗМЕНЕНИЕ В ЭНТРОПИИ
-КВАРТИТАТИЧЕСКОЕ Определение энтропии
.
—Третий закон термодинамики
9.5 Окружение
9.6 Общее изменение энтропии
9.7 Равновесие
9,8 Свободная энергия
-Минимальная температура для реакций
-Термодинамическая тенденция
-Термокинетическая тенденция 9,9 Свободная энергия и химическая реакция на давление
9.10. Зависимость от свободной энергии на давление
9.10. Зависимость от свободной энергии
9.10. Свободная энергия и равновесие
—Уравнение Вант-Гоффа
9.12 Задачи
9.13 Олимпиадный экзамен
Тема 10: Электрохимия
10.1 Introduction
—Galvanic Cells
—Standard Reduction Potentials 10.2 Standard Reduction potentials, ξ°, and relationships between ξ°, ΔG° and K
—Half-cells and galvanic cells
— Определение и использование стандартных восстановительных потенциалов, ξ°
—Зависимость восстановительных потенциалов от клеточных условий
10. 3 Влияние образования комплексов или осаждения на восстановительный потенциал Mz+/M
3 Влияние образования комплексов или осаждения на восстановительный потенциал Mz+/M
— Полуэлементы с участием галогенидов серебра
— Изменение относительной стабильности различных степеней окисления металла
10.4 Диаграммы Латимера
10.5 Реакции диспропорционирования
9016 3 —Факторы, влияющие на величины стандартных восстановительных потенциалов
—Значения ΔGf° для водных ионов
10,7 Топливные элементы
10,8 Электролиз
10.9 Коррозия
10.10 Проблемы с проблемами
10.11 Олимпиада Экзал
ПРОДАНОВЛЕНИЯ ХИМИЯ — (Продолжение с главы 180152
Advanced Chemistry — (Продолжение с главы 180152 . 1A–4A Глава 20 -Репрезентативные элементы: группы с 5А по 8 Глава 21. Переходные металлы и координационная химия Глава 1 Структура и связь Глава 2 Полярная ковалентная связь; Кислоты и основания ГЛАВА 3 Органические соединения: алканы и их стереохимия Глава 4 Органические соединения: циклоалканы и их стереохимия Chapter 5 An Overview of Organic Reactions Глава 6 Алкены: структура и реакционная способность Глава 7 Алкены: реакции и синтез Глава 9 Стереохимия ГЛАВА 10 Органохалиды 9013 10,1150 ALKYLIDES ALKYLIDES ALKYLIDES
19.1 Обзор репрезентативных элементов
— Атомные свойства
— Тенденции связывания
— Аномалия первого ряда
— Изобилие элементов
— Препараты элементов
19. 2 Элементы группы 1А
2 Элементы группы 1А
— Самые отрицательные °ξ Li
19,3 Водород
-ПРЕЗВАЦИЯ
-Интрагидрогеновая связь
-три класса гидридов
19,4 Элементы группы 2A
-Диагональная связь
-Коордовая Бонда
-Диагональная Отношения
-Coordinting
-Диагональная связь
-Координинга
-Координинг0163 —BeCl2 Covalent Bonding
—AlCl3 Bridge Bonding
—Cation-Exchange Resin
19.5 The Group 3A Elements
—Multiple Oxidation States and Inert-Pair Effect
—Amphoteric Oxide
—Hall Process
— -Бораны и трехцентровые связи
19.6 Элементы группы 4А
— Алтропизм: графит, алмазы и бакминстерфуллеренция
— Химия углерода
— Химия кремния
-Связывание карбонильных комплексов
19,7 Проблемы задачи
20. 1. , пять или шесть ковалентных связей
1. , пять или шесть ковалентных связей
20.2 Химия азота
— Гидриды азота
— Оксиды азота
— Структуры Льюиса и молекулярные орбитали
-Оксикикиды азота
20,3 Химия фосфора
-оксиды и оксикиды и оксикиды
-Фосфор в удобрениях
-Фосфор Halides
20,4 Группа elements 9016 -Shoshlize 9016 -Shoshlize 9016 -Shoshlize 9016 -Shosphors 9016 -Shosphors 9016 -Shosphorus 9016. -SPRIDSISIRISIS 9016 -SPORIDSISIRISIS 9016 -SPORIDSISIRISIS 9016 -SPOSHALS 9016 -SPOSHALISALISIRISIS 9016. 20.5 Химия кислорода.0163 -Оксикикиды серы
-Другие соединения серы
20,7 Элементы группы 7A
-Одинокие пары и энергия связи
-Гидрогена. 20.8 Элементы группы 8А
—Структура соединений Xe
20.9 Задачи и интеграционные проблемы
21. 1. Металлы перехода: обзор
1. Металлы перехода: обзор
-Генеральные свойства
-Электронные конфигурации
-Состояния окисления
-Стандартная электронегативность
-Ионные. d и 5 d Переходная серия — Лантанидное сжатие
— Плотности переходных металлов
— Цвета ионов (комплексов)
— Магнитные свойства ионов (комплексов)
21,2 Переходные металлы
21,3 Координационные соединения
-Координирование №
-Лиганды
-НОМЕНДАПРА
21,4 Изомеризм
-Утроение 21,4 Изомеризм
-Утроение 21,4 Изомеризм
—strimer
-strimer
-strimer
-strimer
21.4. : Локализованная модель электрона
— Октаэдрические комплексы
— Линейные комплексы
— Квадратные комплексы
— Тетраэдрические комплексы
21.6 The Crystal Field Model
—Octahedral Complexes
—Other Coordination Geometries
21. 7 Complex Ion Reactions
7 Complex Ion Reactions
21.8 Complex Ion Equilibria
21.9 Biologic Importance of Coordination Complexes
21.10 The 18-Electron Rule
21.11 Магнитная восприимчивость
21.12 Задачи
Органическая химия
1.1 Атомная структура: ядро
1.2 Атомная структура: орбитали
1.3 Атомная структура: электронные конфигурации — расположение электронов с наименьшей энергией или конфигурация электронов в основном состоянии
1.5 Природа химических связей: теория валентных связей
1.6 Гибрид Орбитали
1.7 Природа химических связей: теория молекулярных орбиталей
1.8 Рисование химических структур — конденсированные структуры и скелетные структуры.
2. 1 Polar Covalent Bonds: Electronegativity
1 Polar Covalent Bonds: Electronegativity
2.2 Polar Covalent Bonds: Dipole Moments, m
2.3 Formal Charges:
2.4 Resonances
2.5 Rules for Resonance Forms
2.6 Drawing Resonance Forms
2.7 Acids and Bases: The Bronsted-Lowry Definition
2.8 Сила кислот и оснований 90–163 2.9 Прогнозирование кислотно-основных реакций по значениям pka 90–163 2.10 Органические кислоты и органические основания 90–163 2.11 Кислоты и основания: определение Льюиса 90–163 2.12 Нековалентные взаимодействия: межмолекулярные силы
3,1 Функциональные группы
3,2 Алканы и алкановые изомеры
3,3 Алкильные группы
3,4, снимающие алкоры 9013 3,5, алкильные группы
3.4, снимающиеся алкоры 9013 3,5.
4.1 Названия циклоалканов
4.2 Цис-транс-изомерия в циклоалканах
4. 3 Стабильность циклоалканов: Угловая (кольцевая) деформация — вследствие расширения или сжатия валентных углов.
3 Стабильность циклоалканов: Угловая (кольцевая) деформация — вследствие расширения или сжатия валентных углов.
4.4 Conformations of cycloalkanes — cyclohexanes
4.5 Axial and equatorial bonds in Cyclohexane
4.6 Conformation of monosubstituted cyclohexanes
4.7 Conformations of disubstituted cyclohexanes
5.1 Kinds of Organic Reactions
5.2 Как происходят органические реакции: механизмы
5.3 Радикальные реакции
5.4 Полярные реакции
5.6 Использование изогнутых стрелок в механизмах полярных реакций
5.7 Описание реакции: Равновесия, скорости и изменения энергии
5.8 Описание реакции: Энергии диссоциации связи (стр. 156, Таблица 5.3).
6.1 Расчет степени ненасыщенности: количество колец и/или множественных связей, присутствующих в молекуле.
6. 2 Названия алкенов
2 Названия алкенов
6.3 Правила последовательности: обозначение E, Z
6.4 Стабильность алкенов
6.5 Реакции электрофильного присоединения алкенов
7.1 Получение алкенов: отщепление
Br) — образование галогенгидрина
7.4 Присоединение воды: оксимеркурирование
7.5 Присоединение воды: гидроборирование
7.6 Восстановление: гидрирование
7.7 Окисление: расщепление до карбонильных соединений
7.8 Радикальное присоединение к алкенам: полимер 9Глава 8 Алкины: введение в органический синтез
8.5 Алкилирование ацетиленовых анионов
8.6 Введение в органический синтез
9.1 Энантиомеры и тетраэдрический углерод
9.2 Хиральность
9.3 Оптическая активность
9.4 Правила последовательности для определения конфигурации
9.5 Диастереомеры — стереоизомеры, не являющиеся зеркальными отображениями.
9,6 мезо соединений — Имеющие хиральности, но не ахиральные
9,7 Смесь для рецепта и разрешение энантиомеров
9,8 А. Обзор изомеризма
10.4 Приготовление алкилгалогенидов: аллиловая бромирование
10,5: стабильность аллилового радикала: Резонанс пересматривался
10,6: приготовление алкилгалогенидов: от спирта
10.7 Реакции алкилгалдеров
Глава 11 Реакции Алкил -халидов: nucleophili -weeptinations Глава 11 Реакции алкил -халидов.
11.1 Открытие реакций нуклеофильного замещения — Инверсия Уолдена
11.2 Реакция SN2 — Реакция нуклеофильного замещения
11.3 Характеристики реакции SN2
11,4 Реакция SN1
11,5 Характеристики реакции SN1
11. 6 Реакции элиминации: Правило Zaitsev’s
6 Реакции элиминации: Правило Zaitsev’s
Глава 12 Определение структуры: массовая спектрометрия и инфракрасная спектроскопия
12.1 Mass Spectrometry
12.1 Mass Spectrometry
12.1. Спектрометрия некоторых общих функциональных групп
12.4 Спектроскопия и электромагнитный спектр
12.5 Инфракрасная спектроскопия
12.6 Интерпретация инфракрасных спектров
12.7 Определите строение следующих соединений.
Глава 13 Определение структуры: спектроскопия ядерного магнитного резонанса
13.1 Спектроскопия ядерного магнитного резонанса
13.2 Природа поглощения ЯМР
13.3 Магнитное экранирование электронами
13.4 Ядерный магнитный резонанс спектроскопия
13.6 Интегрирование поглощения ЯМР 1Н: подсчет протонов
13.7 Спин-спиновое расщепление в спектрах ЯМР 1Н
13,8 Введение в 13C ЯМР-спектроскопия
13,9 Вопросы практики спектра
Глава 14 Сопряженные соединения и ультрафиолетовые спектроскопии
14,1 Стабильность DIENES
14,2 Электрические вложения. 14.4 Определение структуры в сопряженных системах: ультрафиолетовая спектроскопия
14.4 Определение структуры в сопряженных системах: ультрафиолетовая спектроскопия
Глава 15 Бензол и ароматичность
. Глава 16 Химия бензола: электрофильное ароматическое замещение
16.1 Реакции электрофильного ароматического замещения
16.2 Другие ароматические замещения
16.3 Реакция Фриделя-Крафтса
16.4 Заместительные эффекты в замещенных ароматических кольцах
16,5 Объяснение заместителей эффектов
16,6 Тризубстационные бензолы: Адитацию эффектов
16,7 Окисление ароматических соединений-алкилбензол боковых чинов 9000
1501501501501501501501501501505015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015015 и фенолы
17.2 свойства спиртов и фенолов
17.3 Получение спиртов
17.4 Спирты восстановлением карбонильных соединений
17.5 Спирты реакцией карбонильных соединений с реактивами Гриньяра
17. 6 Реакции спиртов
6 Реакции спиртов
17.7 Окисление спиртов
Глава 18 Эфиры и эпоксиды; Thiols and Sulfides
18.1 Names and properties
18.2 Physical properties
18.3 Synthesis of ethers
Chapter 19 Aldehydes and ketones: Nucleophilic addition Reactions
19.1 Naming aldehyde and ketone
19.2 Preparation of aldehyde and ketone
19.3 Oxidation альдегидов и кетонов
19.4 Реакции нуклеофильного присоединения альдегидов и кетонов
19.5 Nucleophilic addition of h3O
19.6 Nucleophilic addition of HCN
19.7 Nucleophilic addition of Grignard and hydride reagents
19.8 Nucleophilic addition of amines
19.9 Nucleophilic addition of hydrazine
19.10 Nucleophilic addition of alcohols
19.11 Nucleophilic addition phosphorus ylides
Chapter 20 Карбоновые кислоты и нитрилы
20.1 Наименование карбоновых кислот
20.2 Строение и свойства карбоновых кислот
 3 Substituent effects on acidity
3 Substituent effects on acidity 20.4 Preparation of carboxylic acids
20.5 Reactions of carboxylic acids
Chapter 21 Carboxylic Acid Derivatives Nucleophilic Acyl Substitution Reactions
21.1 Naming carboxylic acid derivatives
21.2 Nucleophilic acyl substitution reactions
21.3 Nucleophilic acyl substitution реакции карбоновых кислот
21.4 Химия галогенангидридов
21.5 Химия ангидридов кислот
21.6 Химия сложных эфиров
21,7 Химия амидов
21,8 Полиамиды и полиэфиры: полимеры поэтапного роста
Глава 22 Реакции карбонильной альфа-сосуды. реакция Хелла-Фольгарда-Зелинского
22,4 Кислотность альфа-атомов водорода: образование енолят-ионов
22,5 Реакционная способность енолят-ионов
22,6 Алкилирование енолят-ионов
Глава 23 Реакции карбонильной конденсации
23,1 Конденсации карбонила: реакция Aldol
23.
 3 Dehdration Aldol Products: Synthess orones
3 Dehdration Aldol Products: Synthess orones 23.3 Dehdration Aldol Products: Syntheses orones
23.3 Dehdration Aldol Products: Syntheses orones
23.3.3 Dehdration Aldol Products: Syntheses orones
23.3.3. альдольные реакции: образование циклического продукта.
23.7 Реакция конденсации Клайзена
23.8 Смешанное осуждение Клайзена
23.9 Внутримолекулярная конденсация Клайзена: циклизация Дикмана
23.10 Спряжение карбонила: Реакция Майкла
23.11 Карбонильные конденсации с эрами: реакция аиста
23.12 Аннуляция Робинсона. Реакция
Глава 24 амины и гетероциклы
24.11.
24.4 Основность замещенных ариламинов
24.5 Уравнение Гендерсона-Гассельбаха
24.6 Синтез аминов
24.7 Реакции аминов
24.8 Реакции ариламинов
24.9 Heterocycles
Chapter 25 Biomolecules: Carbohydrates
25.1 Classification of carbohydrates
25.2 Depicting carbohydrate stereochemistry: Fischer projections
25. 3 D, L Sugars
3 D, L Sugars
25.4 Configuration of the aldoses
25.5 Cyclic structures of monosaccarides: anomers
25.6 Reactions моносахаридов
25,7 Восемь незаменимых моносахаридов
25,8 Дисахариды
25,9 Полисахариды и их синтез
Глава 26 Биомолекулы: аминокислоты, пептиды и белки
26.1 Структуры аминокислот
26.2 Аминокислоты, уравнение Гендерсона-Гассельбаха и изометрические точки
26.3 Синтез аминокислот
структура
26.6 Ферменты и коферменты
Глава 27 Биомолекулы: нуклеиновые кислоты
27.1 Нуклеотиды и нуклеиновые кислоты
27.2 Спаривание оснований в ДНК: модель Уотсона-Крика
ГЛАВА 28 Синтетические полимеры
28,1 Полимеры роста цепей
28,2 Стереохимия полимеризации: Ziegler-Natta Catalyst
28,3
28,4 STEP-GROW-GROWNER
28,3 Сополимер
28.4 STEP-GROW-GROWTY
28,3
28.4 STEP-GROW-GROWTY POLYMERS
90.



 (1 балл)
(1 балл)