Амфотерные оксиды и гидроксиды 9 класс – Амфотерные оксиды и гидроксиды. Видеоурок. Химия 9 Класс
Амфотерные оксиды и гидроксиды. Видеоурок. Химия 9 Класс
Это занятие мы посвятим изучению амфотерных оксидов и гидроксидов. На нем мы поговорим о веществах, имеющих амфотерные (двойственные) свойства, и особенностях химических реакций, которые протекают с ними. Но сначала повторим, с чем реагируют кислотные и основные оксиды. После рассмотрим примеры амфотерных оксидов и гидроксидов.
Тема: Введение
Урок: Амфотерные оксиды и гидроксиды
Рис. 1. Вещества, проявляющие амфотерные свойства
Основные оксиды реагируют с кислотными оксидами, а кислотные оксиды – с основаниями. Но существуют вещества, оксиды и гидроксиды которых в зависимости от условий, будут реагировать и с кислотами и с основаниями. Такие свойства называются амфотерными.
Вещества, обладающие амфотерными свойствами приведены Рис.1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры их амфотерных оксидов приведены в таблице 1.
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
— Взаимодействие с основными оксидами и основаниями:
ZnO + Na2O → Na2ZnO2 (цинкат натрия). Оксид цинка ведет себя как кислотный.
ZnO + 2NaOH → Na2ZnO2+ H2O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
3ZnO + P2O5 → Zn3(PO4)2 (фосфат цинка)
ZnO + 2HCl → ZnCl2 + H2O
Аналогично оксиду цинка ведет себя и оксид алюминия:
— Взаимодействие с основными оксидами и основаниями:
Al2O3 + Na2O → 2NaAlO2 (метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
Al2O 3 + 2NaOH → 2NaAlO2+ H2O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
Al2O3 + P2O5 → 2AlPO4(фосфат алюминия)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Рассмотренные реакции происходят при нагревании, при сплавлении. Если взять растворы веществ, то реакции пойдут несколько иначе.
ZnO + 2NaOH + H2O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.
Рис. 2. Минералы на основе оксида алюминия
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюмини
interneturok.ru
Разработка урока по химии в 9 классе на тему «Амфотерные оксиды и гидроксиды»
Открытый урок по химии для учащихся 9 класса:
« Амфотерные оксиды и гидроксиды»

Сведения об авторе:
Учитель химии
Лапина О.В.
Стаж работы 18 лет
с
Общеобразовательная цель:
формирование у учащихся представления о переходных элементах, амфотерных соединениях;
создание условий для выявления амфотерности соединений посредством решения экспериментальных задач;
отработка умений в написании уравнений реакций с участием амфотерных соединений.
Воспитательная цель: поддержание интереса к изучению темы через самостоятельную работу; воспитывать сотрудничество, способствовать развитию грамотной химической речи.
Развивающая цель: формирование исследовательских навыков учащихся при выполнении экспериментальной работы.
Тип урока: изучение нового материала
Методы обучения: частично-поисковый, исследовательский, репродуктивный.
Формы организации познавательной деятельности: групповая, общеклассная, индивидуальная
Оборудование: цинк Zn , хлорид цинка ZnCl2, гидроксид натрия NaOH, соляная кислота HCl, пробирки.
Структура урока:
Организационный этап.
Подготовительный этап (мотивация, актуализация знаний).
Основной этап (усвоение новых знаний и способов действий)
Закрепление и применение знаний.
Подведение итогов.
Домашнее задание.
1.Организационный этап.
Эпиграф « Ни одна наука не нуждается в эксперименте в такой степени, как химия.
А чтобы вы могли сравнить свои знания в начале и в конце урока, предлагаю определить свое место на «скале» (учитель раздает ученикам заранее приготовленные трафареты «скалы»).
2. Подготовительный этап (мотивация, актуализация знаний).
Вопросы для актуализации знаний:
1. Заполните кластер «Классификация веществ» (Приложение 1)
«Почему остались пустые фрагменты в кластере?»Заполните схемы «Генетические ряды металлов и неметаллов». Вспомните, какой характер имеют оксиды и гидроксиды типичных металлов и неметаллов? (Приложение 2)
Как опытным путем доказать, что выданный вам оксид или гидроксид является:
а) основным; б) кислотным.
1 вариант задание
Экспериментально докажите кислотный характер серной кислоты.
2 вариант задание Экспериментально докажите основный характер гидроксида натрия.
Но прежде чем приступать к работе следует вспомнить правила обращения с химическими реактивами. Как следует вести себя в кабинете химии.
Вывод: что кислотные оксиды и гидроксиды (кислоты) взаимодействуют с основаниями с образованием соли и воды, но кислотные оксиды и гидроксиды не взаимодействуют с кислотами. Основные оксиды и гидроксиды (основания) взаимодействуют с кислотами, но не взаимодействуют с основаниями.
3. Основной этап (усвоение новых знаний и способов действий)
Внимательно посмотрите на предложенные объекты: амфитеатр, амфора, амфибии, склянки с твердыми веществами Zn(OH)2 и ZnO. Что объединят все эти объекты, и какое отношение они имеют к предложенным веществам?

амфитеатр – места для зрителей, расположенные полукругом на склонах холмов с двух сторон от артистов

амфора – древний глиняный сосуд для жидких и сыпучих продуктов, c двумя вертикальными ручками и узким горлом

амфибии – по-русски земноводные, живущие двоякой жизнью: и на суше, и в воде, и как животные, и как рыбы.
— В чем их сходство?Можно выделить
греческую частицу «амфо» или «амфи» — (что означает: с двух сторон; и то, и другое), все они обладают двойственностью.
-Правильно, они все обладают двойственностью. В химии она называется амфотерностью.
Амфотерность — (от греч. amphoteros и тот и другой). Получается, в химии это понятие применяется к веществам.
— Каким свойством обладает оксид и гидроксид цинка?
Выход на тему урока «Амфотерность оксидов и гидроксидов»
Постановка цели и задач урока . Мотивация учебной деятельности учащихся
Постановка учащимися цели урока как собственной учебной задачи.
Учащиеся ставят следующие цели: проверить данное предположение о существовании таких веществ с двойственными свойствами на примере Zn(OH)2 . Обращаем внимание учащихся на эпиграф урока.
Предлагаю учащимся выполнить практическую работу. Цель работы: получить амфотерный гидроксид и изучить его свойства.
Учащимся раздаются технологические карты которые они заполняют по ходу работы. На экране слайд «Технологическая карта»
Слайд Слайд
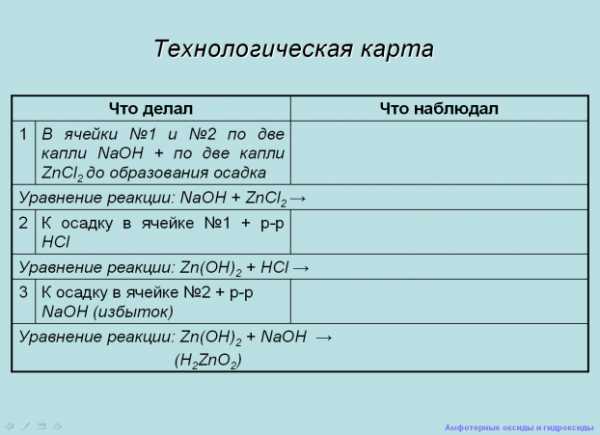

Учащиеся выполняют опыт «Получение гидроксида цинка».
Учащиеся на доске записывают уравнение реакции в молекулярной и ионной форме.
Учитель: Как проверить основный характер гидроксида цинка?
Учащиеся проводят опыт «Взаимодействие гидроксида алюминия с кислотами».
Учащиеся сообщают о результатах исследования, самостоятельно делают вывод и записывают на доске уравнение реакции в молекулярной и ионной форме.
Учитель:Как проверить кислотные свойства гидроксида алюминия?
Учащиеся проводят опыт « Взаимодействие гидроксида алюминия с щелочами». Учащиесясообщают о результатах исследования и самостоятельно делают вывод.
Учитель:
Чтобы записать уравнение реакции гидроксида алюминия с щелочью, представим его в форме кислоты: Zn(OH)2 = H2AlO2. Учащиеся на доске записывают уравнение реакции в молекулярной и ионной форме.Подтверждение гипотезы:
Учитель: Будет цинк типичным металлом? (Ответы учащихся). Учитель. Предлагаю учащимся сформулировать определение амфотерных (оксидов) гидроксидов. Привести примеры.
ответы учащихся: амфотерные (оксиды) гидроксиды – вещества, которые в зависимости от условий проявляют кислотные или основные свойства.
амфотерные оксиды: Al2O3, ZnO, BeO
амфотерные гидроксиды: Al(OH)3, Zn(OH)2, Be(OH)2,
Учащиеся записывают определения: а) Амфотерные вещества, б) Переходные элементы.
Учитель знакомит учащихся с другими переходными элементами, которые образуют амфотерные соединения.
Помимо цинка и алюминия амфотерные оксиды и гидроксиды имеют многие металлы побочных под-
групп, которые называются переходными.
В школьном мы курсе мы будем встречаться с
соединениями Be, Al, Zn, Cr+3.
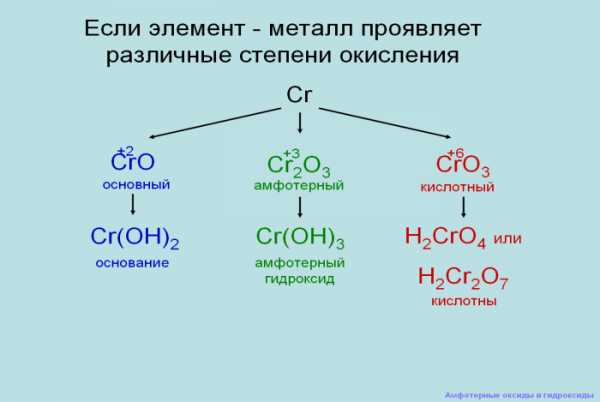
Почему хром, именно вс.о. +3 амфотерен?
Это вы поймете из схемы:
Дополнения учителя: если элемент металл проявляет различные степени окисления (демонстрация слайда)
Слайд
4. Закрепление новых знаний. Какие соединения называются амфотерными?
Как пользуясь ПСХЭ Д.И. Менделеева определить переходный элемент?
Какую степень окисления имеет металл в амфотерных соединениях?
Как опытным путем доказать амфотерный характер оксида и гидроксида?
5. Подведение итогов урока.
6. Домашнее задание. Параграф -2
Подсказка!
Кислоты, вещества, основные, металлы, сложные, основания, соли,
кислотные, щёлочи, неметаллы, бескислородные, нерастворимые,
кислородосодержащие, простые, оксиды.
Металлы | Неметаллы | Оксиды | Основания | Кислоты | Соли |
Кислотные
Щёлочи
Нераство-
римые
Кислородо-
содержащие
- Бескислород-
ные
Слайд № 3 « Генетические ряды металлов и неметаллов»
МЕТАЛЛ ОКСИД ГИДРОКСИД ХАРАКТЕР
__________ ______________
Na __________ ______________ ______________
НЕМЕТАЛЛ ОКСИД ГИДРОКСИД ХАРАКТЕР
__________ _______________
S __________ ______________ _____________
infourok.ru
9 класс. Химия. Амфотерные оксиды и гидроксиды — Амфотерные оксиды и гидроксиды
Комментарии преподавателя
1. Характеристика амфотерных соединений
Рис. 1. Вещества, проявляющие амфотерные свойства
Основные оксиды реагируют с кислотными оксидами, а кислотные оксиды – с основаниями. Но существуют вещества, оксиды и гидроксиды которых в зависимости от условий, будут реагировать и с кислотами и с основаниями. Такие свойства называются амфотерными.
Вещества, обладающие амфотерными свойствами приведены Рис.1.. Это соединения, образованные бериллием, цинком, хромом, мышьяком, алюминием, германием, свинцом, марганцем, железом, оловом.
Примеры их амфотерных оксидов приведены в таблице 1.
|
Амфотерные оксиды |
|
|
Формула |
Названия |
|
BeO |
Оксид берилия (II) |
|
ZnO |
Оксид цинка |
|
Al2O3 |
Оксид алюминия |
|
Cr2O3 |
Оксид хрома III) |
|
As2O3 |
Оксид мышьяка (III) |
|
GeO |
Оксид германия (II) |
|
PbO2 |
Оксид свинца (IV) |
|
MnO2 |
Оксид марганца (IV) |
|
Fe2O3 |
Оксид железа (III) |
|
SnO |
Оксид олова (II) |
2. Химические свойства амфотерных оксидов цинка и алюминия
Рассмотрим амфотерные свойства оксидов цинка и алюминия. На примере их взаимодействия с основными и кислотными оксидами, с кислотой и щелочью.
— Взаимодействие с основными оксидами и основаниями:
ZnO + Na2O → Na2ZnO2 (цинкат натрия). Оксид цинка ведет себя как кислотный.
ZnO + 2NaOH → Na2ZnO2+ h3O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
3ZnO + P2O5 → Zn3(PO4)2 (фосфат цинка)
ZnO + 2HCl → ZnCl2 + h3O
Аналогично оксиду цинка ведет себя и оксид алюминия:
— Взаимодействие с основными оксидами и основаниями:
Al2O3 + Na2O → 2NaAlO2 (метаалюминат натрия). Оксид алюминия ведет себя как кислотный.
Al2O3 + 2NaOH → 2NaAlO2+ h3O
— Взаимодействие с кислотными оксидами и кислотами. Проявляет свойства основного оксида.
Al2O3 + P2O5 → 2AlPO4(фосфат алюминия)
Al2O3 + 6HCl → 2AlCl3 + 3h3O
Рассмотренные реакции происходят при нагревании, при сплавлении. Если взять растворы веществ, то реакции пойдут несколько иначе.
3. Химические свойства амфотерных оксидов цинка и алюминия в растворах
ZnO + 2NaOH + h3O → Na2[Zn(OH)4] (тетрагидроксоцинкат натрия) Al2O3 + 2NaOH + 3h3O → 2Na[Al(OH)4] (тетрагидроксоалюминат натрия)
В результате этих реакций получаются соли, которые относятся к комплексным.
Рис. 2. Минералы на основе оксида алюминия
Оксид алюминия.
Оксид алюминия чрезвычайно распространенное на Земле вещество. Он составляет основу глины, бокситов, корунда и других минералов. Рис.2.
В результате взаимодействия этих веществ с серной кислотой, получается сульфат цинка или сульфат алюминия.
ZnO + h3SO4 → ZnSO4 + h3O
Al2O3 + 3h3SO4→ Al2 (SO4)3 + 3h3O
4. Химические свойства амфотерных гидроксидов цинка и алюминия
Реакции гидроксидов цинка и алюминия с оксидом натрия происходят при сплавлении, потому что эти гидроксиды твердые и не входят в состав растворов.
Zn(OН)2 +2 Na2O → Na2ZnO2 + Н2О соль называется цинкат натрия.
2Al(OН)3 + Na2O → 2NaAlO2 + 3Н2О соль называется метаалюминат натрия.
Рис. 3. Гидроксид алюминия
Реакции амфотерных оснований со щелочами характеризует их кислотные свойства. Данные реакции можно проводить как при сплавлении твердых веществ, так и в растворах. Но при этом получатся разные вещества, т.е. продукты реакции зависят от условий проведения реакции: в расплаве или в растворе.
Zn(OH)2 + 2NaOH тв. Na2ZnO2 + 2Н2О
Al(OH)3 + NaOH тв. NaAlO2+ 2h3O
Zn(OH)2 + NaOH раствор → Na2[Z
www.kursoteka.ru
Самостоятельная работа по химии Амфотерные оксиды и гидроксиды 9 класс
Самостоятельная работа по химии Амфотерные оксиды и гидроксиды для учащихся 9 класса. Самостоятельная работа состоит из 3 вариантов в каждом по 2 задания и предназначена для проверки знаний по теме Общая характеристика химических элементов и реакций.
1 вариант
1. Напишите уравнения возможных реакций гидроксида цинка со следующими веществами:
КОН, Li2O, NaCl, HCl, К2SO4
2. Осуществите превращения:
Zn → ZnO → ZnSO4 → Zn(OH)2 → Na2ZnO2
Приведите уравнения реакций в молекулярном и ионном виде.
2 вариант
1. Напишите уравнения возможных реакций оксида цинка со следующими веществами:
NaOH, Н2O, Na2O, BaCl2 , Н2SO4
2. Осуществите превращения:
Al → А12O3 → AlCl3 → Al(OH)3 → NaAlO2
Приведите уравнения реакций в молекулярном и ионном виде.
3 вариант
1. Напишите уравнения возможных реакций гидроксида цинка со следующими веществами:
Ва(ОН)2, HNO3, Аl2O3, Р2O5, Rb2O, Na2CO3.
Укажите условия протекания реакций.
2. Осуществите превращения:
Zn → ZnC12 → Zn(OH)2 → ZnO → Na2ZnO2
Приведите уравнения реакций в молекулярном и ионном виде.
Ответы на самостоятельную работу по химии Амфотерные оксиды и гидроксиды
Вариант 1.
1.
Zn(OH)2 + 2КОН = K2ZnO2 + 2Н2О;
Zn(OH)2 + Li2O = Li2ZnO2 + Н2О;
Zn(OH)2 + 2НСl = ZnCl2 + 2Н2О.
2.
2Zn + O2 = 2ZnO;
H2SO4 + ZnO = ZnSO4 + Н2О;
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2;
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2Н2О.
Вариант 2.
1.
NaOH + ZnO = Na2ZnO2 + Н2O;
Na2O + ZnO = Na2ZnO2;
H2SO4 + ZnO = ZnSO4 + Н2О.
2.
4Al + 3O2 = 2Аl2O3;
Аl2O3 + 6НСl = 2АlСl3 + 3Н2О;
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl;
Al(OH)3 + NaOH = NaAlO2 + 2Н2O.
Вариант 3.
1.
При сплавлении: Zn(OH)2 + Ва(ОН)2 = ВaZnO2 + Н2O, в растворе: Zn(OH)2 + Ва(ОН)2 = Ba[Zn(OH)4];
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2Н2О,
при сплавлении: 3Zn(OH)2 + Р2O5 = Zn3(PO4)2 + 3Н2О;
при сплавлении: Zn(OH)2 + Rb2O = Rb2ZnO2 + Н2О,
при сплавлении: Zn(OH)2 + Na2CO3 = Na2ZnO2 + СО2 + Н2О.
2.
Zn + 2НСl = ZnCl2 + Н2;
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl;
Zn(OH)2 = ZnO + Н2O;
ZnO + 2NaOH = Na2ZnO2 + Н2О.
testschool.ru
Что наблюдал | ||
1 | В 2 пробирки по две капли NaOH + по две капли ZnCl2 до образования осадка | |
Уравнение реаекции: NaOH + ZnCl2 = | ||
2 | К получившемуся осадку в 1 пробирке добавить раствор HCl | |
Уравнения реакции: Zn(OH)2 +HCl = | ||
3 | К получившемуся осадку во второй пробирке добавить избыток NaOH (в избытке) | |
Уравнение реакции: Zn(OH)2 + NaOH = (H2ZnO2) | ||
doc4web.ru
Тема 3. Амфотерные оксиды и гидроксиды.
Часть I
1. Амфотерные соединения – это вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства.
2. Амфотерные гидроксиды – это гидроксиды, например, элементов с порядковыми номерами 4, 13, 30 – Be, Al, Zn. Каждый гидроксид проявляет , в зависимости от условий реакций, свойства то основания, то кислоты.
а) Как основание, амфотерный гидроксид взаимодействует с кислотой, образуя соль и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций).
б) Как кислота, амфотерный гидроксид взаимодействует со щёлочью, образуя соль (входит в состав кислотного остатка) и воду (запишите молекулярное, полное и сокращённое ионное уравнения реакций):
3. Амфотерным гидроксидам соответствуют амфотерные оксиды.
4. Генетический ряд переходного металла:
5. Запишите формулы оксида и гидроксида, а также уравнения реакций переходов в молекулярной и ионной формах.
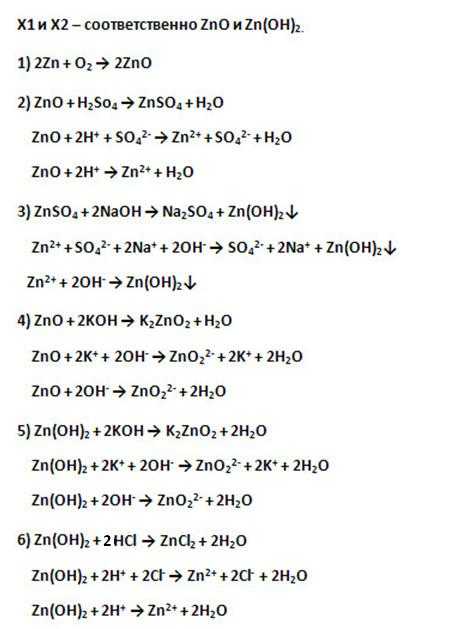
Часть II
1. Дайте характеристику элемента алюминия по плану, с которым вы познакомились на первых уроках:
1) Al – это элемент III А группы малого периода.
2) +13 Al, 2е, 8е, 3е.
3) Это восстановитель, который получают с. о. +3.
4-5) Al – металл, поэтому имеет металлическую кристаллическую решётку, образованную за счёт металлической химической связи, схема которой:
6) аллотропия для алюминия нехарактерна.
7) Как металл, алюминий менее активный, чем магний, но более активный, чем кремний.
8) Как металл, алюминий более активный, чем бор, но менее активный, чем галлий.
9) Оксид алюминия имеет амфотерный характер, поэтому взаимодействует и с кислотой, и с щёлочью, образуя соль и воду.
10) Амфотерный гидроксид является и основанием, и кислотой, которая имеет формулу
взаимодействует (напишите уравнения в молекулярной, полной и сокращённой ионной формах):

2. Оксид хрома (II) CrO проявляет основные свойства, поэтому взаимодействует с кислотными оксидами, кислотами.
Приведите уравнения соответствующих реакций.
3. Оксид хрома (VI) проявляет кислотные свойства, поэтому взаимодействует с основными оксидами, основаниями (щёлочами).
Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
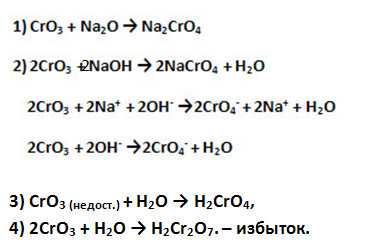
4. Оксид хрома (III) проявляет амфотерные свойства, поэтому взаимодействует и с кислотами, и со щелочами. Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
5. Верны ли следующие суждения?
А) Все гидроксиды металлов (I) имеют только основный характер.
Б) Гидроксиды металлов (II) могут быть как основаниями, так и амфотерными гидроксидами.
1) оба суждения верны.
6. Верны ли следующие суждения?
А) Характер гидроксидов переходных металлов VI B и VII B групп зависит от с. о. металлов:
— с низшей с. о. – носит основный характер;
— с промежуточной с. о. – амфотерный характер;
— с высшей с. о. – кислотный характер.
Б. Оксиды и гидроксиды неметаллов всегда имеют кислотный характер.
2) верно только А.
7. Формула высшего оксида марганца а формула его гидроксида – Оба соединения имеют кислотный характер (для подтверждения приведите по два уравнения возможных реакций в молекулярной и ионной формах):
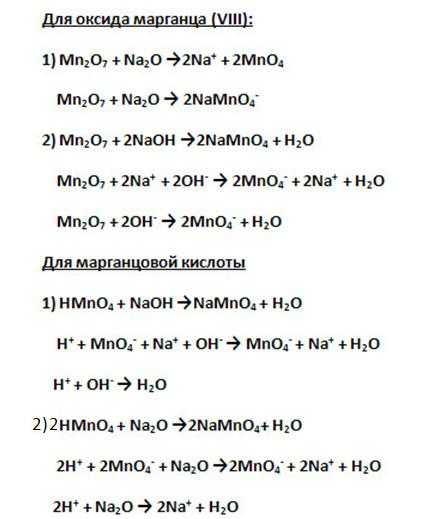
superhimik.ru
План-конспект урока по химии (9 класс) на тему: Амфотерные гидроксиды
МОУ «Гимназия «Дмитров»», 9 б класс,
Учитель: Человечкова Марина Ивановна
Открытый урок по химии
Тема: » Амфотерные гидроксиды»
Цели: Обучающие – научить определять опытным путем амфотерные гидроксиды и прописывать химические реакции в молекулярном, ионном виде;
Развивающие – развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку, опираясь на знания химии; совершенствовать умения работать с лабораторным оборудованием и реактивами; формировать способности к адекватному само- и взаимоконтролю;
Воспитательные – продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах ученик- ученик, ученик- учитель;
воспитывать наблюдательность, пытливость, инициатива, стремление к самостоятельному поиску.
Методы и методические приемы – фронтальный опрос. Взаимопроверка результатов самостоятельной работы в парах, выставление отметок, выполнение лабораторной работы в парах после просмотра видеофильма, работа со средствами наглядности ( ПСМ, таблица растворимости, карточки.)
Тип урока: комбинированный, с использованием групповой технологии, технологии проблемного обучения.
Оборудование: рисунок на доске, цепочка превращений, химические реактивы и оборудование, видеокассета, карточки с заданиями: а) самостоятельная работа, б) задача.
Ход урока
- Повторение.
Вспомним классификацию сложных веществ, для этого сейчас напишем диктант по матрице, которая лежит перед вами на парте. Рядом с таблицей – листки, где вы должны написать свою фамилию и класс. В листок ставится только номер правильного ответа, не перенося на лист формулу.
Выберите формулу вещества:
- простое вещество.
- кислотный оксид.
- бескислородная кислота.
- нерастворимое основание.
- средняя соль.
- основная соль.
- кислородсодержащая 2хосновная кислота.
- основный оксид.
- кислая соль.
- щелочь.
2. Новая тема.
Особое место в классификации неорганических соединений занимают амфотерные соединения. Это и есть тема нашего урока: «Амфотерные гидроксиды».
Вспомните, где вы слышали слова с приставкой «амфи». (Амфибии – земноводные животные, с двумя средами обитания; амфора – сосуд с двумя ручками). А в чем же особенность амфотерных соединений. (Ответ).
Чтобы приступить к доказательству двойственности амфотерных соединений поработаем с учебником. Откройте параграф 2 стр. 9-10.
Читаем, разбираем их свойства.
Смотрим видеофильм.
После фильма проводим опыт с гидроксидом цинка по уравнениям, которые записаны в параграфе. Обращаю внимание на ионное уравнение, называем полученные соли. Подчеркиваю, что к амфотерным соединениям относятся гидроксиды 111 и 1У группы и
Тут же задаю домашнее задание: Написать в молекулярном и ионном виде получение и химические свойства гидроксида алюминия по аналогии.
3. Решение задачи.
На столах лежат листочки с текстом задачи. Читаем:
«К 200 г 13,35 % раствора хлорида алюминия постепенно добавили 200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?»
.
На осмысление и оформление задачи отводиться 5 мин. (Я в это время должна успеть проверить химический диктант).
№ вопроса | ||||||||||
1 вариант | 4 | 6 | 7 | 9 | 2 | 5 | 3 | 10 | 1 | 8 |
2 вариант | 6 | 5 | 1 | 8 | 4 | 9 | 10 | 7 | 2 | 3 |
3 вариант | 5 | 6 | 7 | 9 | 10 | 8 | 1 | 3 | 4 | 2 |
4 вариант | 1 | 10 | 2 | 4 | 3 | 6 | 7 | 9 | 8 | 5 |
5 вариант | 3 | 4 | 7 | 8 | 1 | 9 | 10 | 5 | 6 | 2 |
6 вариант | 9 | 8 | 2 | 6 | 7 | 5 | 4 | 1 | 3 | 10 |
Помогите мне записать краткое условие задачи:
Дано: Решение:
m(р-ра AlCl3)= 200 г
w(AlCl3)= 13,35 %
m(р-ра NaOH)= 200 г
w(NaOH)= 14 %
m(осадка) — ?
Вариант вашего решения запишите на доску. Ответ__________.
А кто обратил внимание на дополнительный вопрос в задачи. (Ответ).
Значит, вы считаете, что от перемены слагаемых сумма не изменяется. А я считаю, что в данном случае может измениться.
Для разрешения нашего спора нам поможет следующий опыт: на доску вывешиваю на листке алгоритм проведения первого опыта.
Приливаем по схеме :
1) NaOH 2) AlCl3
AlCl3 NaOH
выпадение осадка осадок не выпадает
Наблюдаем образование осадка, который при добавлении избытка щелочи растворяется.
Вопрос: почему же так получается? Значит, мы не до решали задачу. Что мы не учли?
Давайте вернемся к решению задачи.
Что в избытке? Считаем по гидроксиду натрия. Если 0,1 моль осталось щелочи, то эта щелочь начинает реагировать с гидроксидом алюминия, которого было 0,2 моль, но тогда и гидроксида алюминия должно прореагировать тоже 0,1 моль. Следовательно, осталось ½ массы осадка. Делим массу осадка на два и получаем 7,8 г.
Проводим другой опыт (схема 2). Доказательство того, что осадка не образуется.
Мы убедились, что от перемены слагаемых «сумма» меняется.
Закрепление.
В — Что такое амфотерные соединения?
В – Какие гидроксиды являются амфотерными?.
В – чем выражается их амфотерность?
В — Какой класс н/с можно использовать для доказательства амфотерности?
Д/з параграф 2. Упр.3.
Анализ усвоенности материала.
С целью проверки знаний учащихся по данной теме была проведена диагностическая работа. Результаты следующие:
Класс – 25 чел.
На «5» — 6 чел.
На «4» — 14 чел.
На «3» — 4 чел.
Отсутствовал – 1 чел.
Были допущены следующие ошибки: математический расчет в задаче; составление ионных уравнений;
Устойчивый познавательный интерес у учащихся наблюдался в процессе проведения практической части, математических расчетах, составлении уравнений.
. Работу проводили спокойно, осмысленно.
Фамилия__________________________________________ Класс_________Вариант 1
№ вопроса | ||||||||||
№ ответа |
Фамилия__________________________________________ Класс_________Вариант 2
№ вопроса | ||||||||||
№ ответа |
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Условие задачи:
К 200 г 13,35 % раствора хлорида алюминия постепенно добавили
200 г 14% раствора гидроксида натрия. Определите массу осадка.
Изменится ли течение реакции, если реагенты поменять местами?
Выберите формулу вещества:
- простое вещество.
- кислотный оксид.
- бескислородная кислота.
- нерастворимое основание.
- средняя соль.
- основная соль.
- кислородсодержащая 2хосновная кислота.
- основный оксид.
- кислая соль.
- щелочь.
nsportal.ru

