Химия задачи 8 класс – Типовые задачи по химии за курс 8 класса
Типовые задачи по химии за курс 8 класса
Решение типовых задач
Моль. Молярная масса
Задача 1.
Определите кол-во в-ва атомного кислорода в оксиде меди (II) массой 159 г.
Ответ: 2моль
Задача 2.
Вычислите, какое кол-во в-ва карбоната кальция заключается в 80 г карбоната кальция.
Ответ: 0,8 моль
Задача 3.
Определите массу 3 моль нитрата кальция
Ответ: 492 г.
Задача 4.
Относительная атомная масса ртути равна 201. Определите массу одного атома ртути в граммах
Ответ: г.
Задача 5.
Вычислите, сколько молекул содержится в 34 г аммиака? Какова масса одной молекулы.
Ответ:
Химические формулы и расчеты по ним
Задача 1.
Напишите формулы соединений с водородом следующих элементов: азота, кремния, серы, брома
Задача 2.
Напишите формулы соединений с кислородом следующих элементов: Серебра(1), магния(2), фосфора(5), кремния(4), алюминия(3), марганца(7), серы(6), осмия(8)
Задача 3.
Рассчитайте массовую долю и в процентах по массе каждого элемента в сульфате аммония.
Задача 4.
Какая масса кальция потребуется для получения 148 г гидроксида кальция?
Задача 5.
Определите массовую долю кристаллизационной воды в медном купоросе?
Нахождение формулы вещества по результатам анализа
Задача 1.
Массовая доля серы в оксиде равна 40%. Определите формулу оксида.
Задача 2.
Состав оксида элемента выражается простейшей формулой ЭО2. Известно, что для получения оксида массой 22,2 г потребовался элемент массой 15,8 г. Какой элемент образует оксид?
Задача 3.
Вещество содержит 7,7% водорода и 92,3% углерода. Определите формулу этого в-ва, если его молярная масса составляет 26г/моль
Газовые законы. Молярный объем газаЗадача 1.
Какую массу будет иметь N2 объемом 60 л при н.у.?
Задача 2.
Определим массу и объем, занимаемый при н.у. молекулами кислорода
Задача 3.
Какой объем занимает при н.у. углекислый газ массой 22 г?
Задача 4.
Какой объем займет при температуре 20 и давлении 25 кПа аммиак массой 51 г.
Задача 5.
Относительная плотность галогеноводорода по воздуху равна 1,26. Определите плотность этого газа по водороду и назовите его
Задача 6.
Плотность газа по водороду 16. Определите плотность газа по воздуху
Задача 7.
Давление водяного пара при 25 составляет 3173 Па. Сколько молекул содержится в 1 мл этого пара?
Расчеты по химическим уравнениям
Задача 1.
Сколько граммов воды образуется при а) 10 г окиси мели б) 10 г CuO
Задача 2.
Определите массу брома, которая потребуется для получения бромида алюминия массой 53,4 г.
Задача 3.
Рассчитайте объем водорода, который выделится при растворении цинка массой 6,5 г в избытке соляной кислоты (н.у.)
Задача 4.
Вычислите объем оксида серы (6), который надо взять для реакции с кислородом, чтобы получить оксид серы (6) массой 20 г. Массовая доля выхода продукта равна 80%. Объем рассчитайте при н.у.
Задача 5.
Смесь медных и магниевых опилок массой 4,5 г обработали раствором соляной кислоты. В результате реакции выделился водород объемом 1,68 л (н.у.) Вычислите массовую долю меди в смеси.
Задача 6.
К раствору, содержащему 43,6 г нитрата серебра пропустили хлороводород объемом 5л. Выпавший осадок отделили, высушили и взвесили, его масса составила 29 г. Определите выход соли, выпавшей в осадок.
Задача 7.
К раствору, содержащему хлорид бария массой 41,6 г, прилили раствор, содержащий 35 г сульфата натрия. Рассчитайте массу полученного осадка.
infourok.ru
Материал по химии (8 класс) по теме: Решение задач по химии 8 класс
Письменная работа по вариантам / с ответами/
Вариант I
- Сколько молей содержится в 100 г следующих веществ при нормальных условиях: а) кислорода; б) аммиака?
Решение:
n = m/M
M(O2) = 16×2 = 32 г/моль
M(Nh4) = 14+3 = 17 г/моль
n (O2) = 100/32 = 3,1 моль
n(Nh4) = 100/17 = 5,9 моль
Ответ: n (O2) = 3,1 моль
n (Nh4) = 5,9 моль
- Какая масса гидроксида натрия образуется при взаимодействии 2,3 г натрия с водой?
Решение:
2,3г Xг
2Na + 2HOH = 2NaOH + h3
2×23г 2×40г
M(NaOH) = 23 + 16 +1 = 40 г/моль
X = 2,3 x 80/46 = 4 г (NaOH)
Ответ: масса NaOH = 4 г.
Вариант II
1. Чему равна массовая доля (%) кальция в гидроксиде кальция Са(ОН)2?
Решение:
Мr (Са(ОН)2) = 40 +16*2 + 2 = 74
W(Ca) = 40/74 *100% = 54%
2. Чему равна масса 2 моль цинка?
Решение:
m(Zn) = n*Ar =2*65 =130г
Вариант III
- Чему равна массовая доля (%) кислорода в оксиде алюминия А12О3?
Решение:
Mr(Al2O3) = 27*2 + 16*3 = 102
W(Al) = 27*2/102*100% = 53%
2. Чему равна масса 10 моль натрия?
Решение:
m(Na) = n*Ar = 10*23 = 230г
Вариант IV
1. Чему равна массовая доля (%) натрия в соде Na2CO3?
Решение:
Mr(Na2CO3) = 2*23 +12 + 16*3 = 106
W(Na) = 2*23/106*100% = 43%
2. Какое количество вещества содержится в 1 г воды?
Решение:
M(h3O) = 2+ 16 = 18 г/моль
n(h3O) = m/M = 1/18 = 0,06моль
Вариант V
- Чему равна массовая доля (%) азота в азотной кислоте HNO3?
Решение:
Mr(HNO3) = 1+14+16*3 = 63
W(N) = 14/63*100% = 23%
2. Сколько атомов содержится в 1 г железа?
Решение:
n(Fe) = 1/56 = 0,02моль
NатомовFe = 0,02*6*1023 = 0,12*1023
nsportal.ru
Расчётные задачи по химии. Химия, 8–9 класс: уроки, тесты, задания.
Вход на портал Вход на портал Регистрация Начало Поиск по сайту ТОПы Учебные заведения Предметы Проверочные работы Обновления Подписка Я+ Новости Переменка Отправить отзыв- Предметы
- 8–9 класс
-
Физические величины
-
Относительная атомная и молекулярная массы. Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
Вычисление количества вещества
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определенную долю примесей
-
Вычисление массовой доли вещества в растворе
-
Вычисления, связанные с приготовлением растворов с заданной массовой долей растворённого вещества
-
www.yaklass.ru
Как решать задачи по химии 8 класс 🚩 Задачи по химии 8 класс с решением 🚩 Образование 🚩 Другое
Решение задач по химии имеет свою специфику, и нужно найти отправную точку, которая поможет научиться разбираться в этом нелегком деле.Что необходимо знать для решения задач по химии
Чтобы правильно решать задачи по химии, в первую очередь необходимо знать, что такое валентность элементов. От этого зависит составление формулы вещества, уравнение химической реакции также без учета валентности не составить и не уравнять. Таблица Менделеева используется практически в каждом задании, нужно научиться ею правильно пользоваться, чтобы получать необходимые сведения о химических элементах, их массе, электронным уровням. Чаще всего в задачах требуется вычислить массу либо объем получаемого в итоге продукта, это – основа.
Если валентность определить неправильно, все расчеты окажутся неверными.
И далее другие, более сложные задачи, будут решаться легче. Но прежде всего – формулы веществ и правильно составленные уравнения протекающих реакций, с указанием того, что в итоге получится, и в каком виде. Это может быть жидкость, свободно выделяющийся газ, твердое вещество, выпадающее в осадок либо растворенное в воде или иной жидкости.
С чего начинать при решении задач по химии
Для решения задачи кратко записывается ее условие. После этого составляется уравнение реакции. Для примера можно рассмотреть конкретные данные: нужно определить массу полученного вещества, сульфида алюминия, при реакции металлического алюминия с серной кислотой, если алюминия взято 2,7 грамма. Обращать внимание следует лишь на вещества, что известны, после – на те, что требуется найти.
Начинать решать нужно с перевода массы в граммах в молярную. Составить формулу реакции, подставить в нее значения массы и рассчитать пропорцию. После того, как решена простая задача, можно попробовать освоить самостоятельно аналогичную, но с другими элементами, что называется, набить руку. Формулы будут такими же, только элементы изменятся. Все решение задач по химии сводится к написанию правильной формулы вещества, далее – к правильному составлению уравнения реакции.
Все задачи решаются по одному принципу, главное, правильно расставить коэффициенты в уравнении.
Для упражнений можно использовать интернет, в нем огромное количество самых разных заданий, и тут же можно посмотреть алгоритм решения, который далее применять самостоятельно. Преимущество в том, что всегда можно увидеть правильный ответ, и если собственный итог не совпал, разбираться, чтобы найти ошибку. Еще для обучения можно использовать справочники и сборники задач.
www.kakprosto.ru
Конспект «Решение 25 типовых задач по химии (8-11кл)»
Решение 25 типовых задач по химии (8-11 классы)
Ключевые слова: решение 25 типовых задач по химии, определение массы, доли, числа,
1 Определение относительной молекулярной массы Мг
Задача Какова относительная молекулярная масса Мг нитробензола С6Н5NO2? Какова молекулярная масса этого вещества в а.е.м.?

2 Определение массовой доли элемента в соединении
Задача Какова масса в граммах 1 атома 131I ?

3 Определение числа молекул в порции вещества
Задача Сколько молекул воды содержится в 1 капле воды массой 0,03 г?

4 Определение массы атома в граммах
Задача Какова массовая доля фосфора в фосфате кальция Са3(РO4)2 ?

Ответ: ω = 0.2 или 20%
5 Определение молярной массы
Задача Какова молярная масса вещества, если масса 2.5 моль этого вещества равна 250 г?
6 Определение массового отношения элементов в соединении
Задача Каково массовое отношение углерода, водорода и кислорода в глюкозе С6Н1206 ?
7 Определение объема, который занимает порция газа при н.у.
Задача Какой объем (н.у.) занимают 66 г С02?

8 Определение теплового эффекта реакции
Задача Молярная теплота сгорания угля на воздухе 393.5 кДж/моль. Сколько теплоты выделится при полном сгорании 1 кг угля?

9 Определение максимального выхода продукта реакции
Задача Сколько максимально литров (н.у.) водорода можно получить, используя 45.5 г цинка и избыток соляной кислоты?

10 Определение реального выхода продукта реакции
Задача При прокаливании 15,8 г перманганата калия КМnО4 получено 0,896 л (н.у.) кислорода. Каков выход кислорода в данном случае?

11 Определение выхода продукта по стехиометрическим соотношениям
Задача Сколько граммов азотной кислоты HNO3 максимально можно получить из 44.8 л (н.у.) азота?

12 Определение содержания основного компонента (или содержания примеси) в исходном веществе
Задача Каково содержание (в процентах) СаСО3 в образце известняка, при длительном прокаливании 400 г которого получено 78,4 л С02 (н.у.)?

13 Определение выхода реакции, когда одно из исходных веществ взято в избытке
Задача Сколько граммов поваренной соли NaCI можно получить, если смешать два раствора, один из которых содержит 29,2 г HCI, а другой 44 г NaOH?

14 Определение состава газовой смеси (в объемных процентах)
Задача 20 л (н.у.) аммиака пропустили через нагретую до 350°С трубку с железным катализатором. Объем полученной газовой смеси (н.у.) равен 25 л. Каков состав полученной газовой смеси (в объемных процентах) ?

15 Определение объема газа, расходуемого на проведение реакции с другими газами
Задача Какой минимальный объем кислорода, содержащего 10 объемн. % озона, необходим для полного сжигания 4 л пропана С3Н8 ?

16 Определение молекулярной формулы вещества по относительной плотности его паров
Задача Относительная плотность паров углеводорода по воздуху 2,69. Массовая доля водорода в соединении 7,69%. Какова молекулярная формула углеводорода?

17 Определение состава газовой смеси
Задача Относительная плотность 30 л смеси метана СН4 и азота N2 по гелию равна 5. Сколько литров метана и азота взято для приготовления смеси?

18 Определение состава солей в растворе
Задача В растворе смешали 9,8 г H2S04 и 6,5 г NaOH. Какие соли и в каких количествах образовались?

19 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько граммов сахарозы надо растворить в 250 г воды, чтобы получить раствор с массовой долей сахарозы 0,3 (30%)?
20 Приготовление раствора с заданной массовой долей растворенного вещества
Задача : Сколько граммов медного купороса CuS04 • 5Н20 надо добавить к 300 г 2%-го раствора сульфата меди, чтобы получить 5%-ный раствор ?

21 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько миллилитров воды нужно добавить к 100 мл 30%-го раствора соляной кислоты с плотностью 1,15 г/мл, чтобы получить раствор с массовой долей НCl 5%?

22 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько граммов ВаО надо добавить к 100 г воды, чтобы получить 5%-ный раствор?

23 Приготовление раствора с заданной молярной концентрацией
Задача Сколько граммов сульфата натрия Na2S04* 10Н20 необходимо для приготовления 0,5 л раствора с молярной концентрацией 0,02 моль/л?
24 Определение формулы органического вещества по данным о массе продуктов реакции
Задача При полном сгорании 6,0 г органического вещества получено 8,8 г С02 и 3.6 г воды. Плотность паров органического вещества по водороду равна 30. Какова молекулярная формула вещества?

25 Определение молекулярной формулы органического вещества по данным о продукте реакции
Задача При обработке 14,8 г одноосновной карбоновой кислоты избытком цинка получено 2,24 л водорода. Какова молекулярная формула кислоты?

Автор задач: С.С.Бердоносов
Решение 25 типовых задач по химии. Выберите дальнейшие действия:
Решение 25 типовых задач по химии (8-11кл)
5 (100%) 2 vote[s]uchitel.pro
Задачи по химии (8 класс)
Задачи по теме
«Химическая термодинамика и кинетика»
1. Имеется торт с кремом, срок хранения которого 4 дня при температуре +50C. Вопрос: как долго этот торт можно хранить при температуре +250C? Температурный коэффициент равен 2
2. Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите среднюю скорость реакции за этот промежуток времени.
3. Определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10 до 500С; б) при понижении температуры от 100 – 00 С. Температурный коэффициент реакции равен 3
4. Составьте кинетические уравнения для следующих реакций:
А) H2+I2=2HI;
Б) 2 Fe + 3CI2= 2 FeCI3.
5. Как изменится скорость реакции, имеющей кинетическое уравнение
v= kCA2CB, если а) концентрацию вещества А увеличить в 3 раза;
б) концентрацию обоих веществ увеличить в 2 раза.
6. Количество вещества метана в сосуде для проведения химических реакций равно 7 моль. В сосуд ввели избыток кислорода и смесь взорвали. Опытным путем было установлено, что через 5 с количество вещества метана уменьшилось в 2 раза. Найдите скорость данной химической реакции, если известно, что объем сосуда равен 20 л.
7. Начальная концентрация сероводорода в сосуде для сжигания газов была равна 3,5 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 15 с концентрация сероводорода составила 1,5 моль/л. Найдите скорость данной химической реакции.
8. Начальная концентрация этана в сосуде для сжигания газов была равна 5 моль/л. В сосуд ввели избыток кислорода и смесь взорвали. Через 12 с концентрация этана составила 1,4 моль/л. Найдите скорость данной химической реакции.
9. Кусочек серы с площадью реагирующей поверхности 7 см2 сожгли в кислороде с образованием оксида серы(IV). За 10 с количество вещества серы уменьшилось с 3 моль до 1 моль. Найдите скорость данной химической реакции.
10. Кусочек углерода с площадью реагирующей поверхности 10 см2 сожгли в кислороде с образованием оксида углерода(IV). За 15 с количество вещества углерода уменьшилось с 5 моль до 1,5 моль. Найдите скорость данной химической реакции.
11. Брусок из кальция с общей площадью реагирующей поверхности 12 см2 и количеством вещества 7 моль сожгли в избытке кислорода. При этом через 10 с после начала реакции количество вещества кальция оказалось в 2 раза меньше. Найдите скорость данной химической реакции.
12.Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
13.Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
14. Вычислите среднюю скорость химической реакции А + В = 2С, если начальная концентрация А = 0,25 моль/л, а через 20 секунд – 0,10 моль/л.
15. При 60 0С скорость реакции равна 2 моль/( ). Вычислите скорость этой реакции при 20 0С, если температурный коэффициент равен 2.
). Вычислите скорость этой реакции при 20 0С, если температурный коэффициент равен 2.
16. Температурный коэффициент реакции равен 3. Начальная скорость реакции равна 4 моль/( ). Какова будет скорость этой реакции при повышении температуры на 40 0С?
). Какова будет скорость этой реакции при повышении температуры на 40 0С?
17. Как изменится скорость химической реакции
2SO2(г.) + O2(г.)2SO3(г.) при повышении давления в 2 раза
18. При повышении температуры на 20 0С скорость реакции увеличилась в 16 раз. Найдите температурный коэффициент реакции
19. Во сколько раз увеличится скорость реакции при повышении температуры с 30 0С до 70 0С, если температурный коэффициент равен 2?
infourok.ru
Учимся решать задачи 8 класс Решение задач по теме: «Моль. Количество вещества».
Учимся решать задачи 8 класс
Решение задач по теме: «Моль. Количество вещества».
Обозначения:
n- количество вещества, (моль, кмоль, ммоль)
m – масса, ( г, кг, мг)
M – молярная масса, ( г/ моль, кг/ кмоль, мг/ ммоль)
V – объем, (л, м3, см3, мл)
Vм – молярный объем (л/ моль, м3/ кмоль, мл/ ммоль) для любого газа при нормальных условиях (н.у.) равен 22,4 л/моль
N- число частиц (атомы, молекулы, ионы)
NА- постоянная Авогадро равна 6,02.1023 частиц.моль-1
n= m/M n= V/VM n= N/NA
Задача 1. Сколько молекул озона О3 содержится в 72 г его?
Дано:m(О3)= 72г
Решение
1) n (О3)=m/ M= 72г:48г/моль=1,5моль
M(О3)=16.3= 48 г/моль
2) N (О3)=n NA= =1,5моль.6,02.1023молекул.моль-1=9.1023молекул
Ответ: N (О3)= 9.1023молекул
Найти:
N (О3)-?
Задача 2. Какой объем занимают (при н.у.) 280 кг азота?
Дано:m(N2) = 280кг
Решение
n (N2)=m/ M= 280кг:28кг/ кмоль =10кмоль
M (N2) = 14.2= 28 г/моль= 28кг/ кмоль
V (N2)= n .Vм =10кмоль.22,4м3/ кмоль=224 м3
Ответ: V (N2)= 224 м3
Найти:
V (N2) -?
Задача 3. Какую массу имеют 112л (при н.у.) углекислого газа?
- Дано:
V (СО2) = 112л
Решение
n (СО2)=V/ Vм = 112л/ 22,4л/моль= 5 моль
m (СО2) = n.M= 5моль?(12+16.2) г/ моль= 5.44=220г
Ответ: m (СО2) =220г
Найти:
m (СО2)-?
Решите самостоятельно задачи:
1. Хлориду натрия массой 5,85 г соответствует количество вещества:
1) 1 моль; 2) 0,5 моль; 3) 0,1 моль; 4 ) 0,01 моль.
2. Оксиду кальция массой 28 г соответствует количество вещества:
1) 1 моль; 2) 0,1 моль; 3 )2 моль; 4) 0,5 моль.
3. Масса 0,25 моль хлорида меди (II) равна:
1) 64 г; 2) 24,75 г; 3) 24,875 г; 4) 33,75 г.
Ответы:
1. 3
2. 4
3. 4
4. Какой объем при н.у. занимают 64г оксида серы (IV)?
5. Какую массу имеют 3 • 1024 молекул углекислого газа (оксида углерода (IV))?
6. Какую массу имеют 44,8 л при н.у. угарного газа (оксид углерода (II))?
7. Какой объем занимают 6 • 1023молекул сероводорода H2S?
9. Какой объем при н.у. занимают 96г озона О3?
10. Сколько молекул хлора CI2 cодержится в 284г его?
Решебник по «Химия 8 класс» Рабочая тетрадь Габриелян О.С. Сладков С.А
Тема 15. Молярный объём газов
Часть I
1. 1 моль любого газа при н. у. занимает одинаковый объём, равный 22,4 л. Этот объём называется молярный и обозначается Vm.
2. Количество вещества (n) — отношение объёма газа при н. у. к молярному объёму:
n = V/Vm=> Vm измеряется в л/моль.
3. Следовательно, количество вещества
4. Дополните таблицу «Количественные характеристики веществ», делая необходимые вычисления.
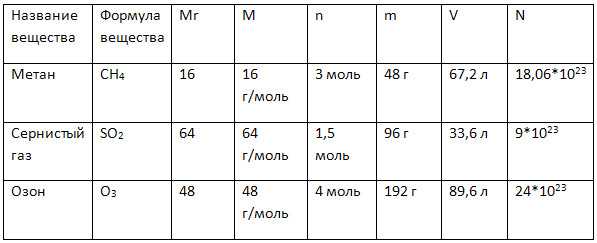
Часть II
1. Установите соотношение между названием и размерностью величины.

2. Укажите формулы, которые являются производными от основной формулы n = V/Vm.
2) V=n•Vm
3) Vm=V/n
3. Сколько молекул содержат 44,8 л (н. у.) углекислого газа? Решите задачу двумя способами.
4. Придумайте условие задачи, в которой нужно найти число молекул N, если известен объём V.
Найти число частиц оксида азота(II), если его объём равен 67,2 л.
Решите задачу любым способом.
5. Вычислите массу 78,4 л (н. у.) хлора.
6. Найдите объём 297 г фосгена (COCl2).
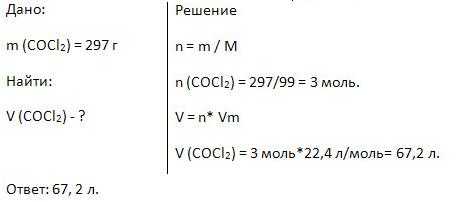

7. Вычислите массу 56 л аммиака, 10% -й водный раствор которого в медицине известен под названием «нашатырный спирт».
8. Придумайте задачу с использованием изученных понятий. С помощью компьютера создайте рисунок, иллюстрирующий данную задачу. Предложите способ её решения. Верно ли, что 22,4 л азота или 22,4 л водорода одинаковы по массе? Ответ подтвердите вычислениями.

infourok.ru

