Презентация ковалентная связь химия 8 класс – Презентация к уроку по химии (8 класс) на тему: Презентация к уроку химии в 8 классе «Ковалентная связь».
Презентация к уроку по химии (8 класс) на тему: Презентация к уроку химии в 8 классе «Ковалентная связь».
Слайд 1
ПРАВИТЕЛЬСТВО САНКТ-ПЕТЕРБУРГА КОМИТЕТ ПО ОБРАЗОВАНИЮ Государственное бюджетное общеобразовательное учреждение средняя общеобразовательная школа № 518 Выборгского района Санкт-Петербурга Ковалентная химическая связь Якубенок Мария Львовна учитель химии [email protected] 2014 годСлайд 2
№2а: 2 K 0 + O 0 → K + 2 O 2- №2б: Li 0 + Cl 0 → Li + Cl — №2в: Mg 0 + 2F 0 → Mg 2+ F — 2 Проверка д / з: 2e 1e 2e
Слайд 3
№3: Самый типичный металл – Fr , c амый типичный неметалл — F. Вещества с ионной связью: CaH 2 , BaCl 2 , Na 2 O, K 2 S, RbF .
Слайд 4
Среди перечисленных элементов максимальный радиус атома имеет Хлор Магний Натрий Алюминий
Слайд 5
Радиус атома увеличивается в ряду: Be, Mg, Ca I, Br, Cl B, C, N N, P, S
Слайд 6
Выберите ионные соединения: SO 2 , H 2 O, BaO , MgF 2 , O 2 , NH 3 , CH 4 , FeCl 3 , O 3 , K 2 O, C 2 H 2 , NaH , CO 2 . BaO MgF 2 FeCl 3 K 2 O NaH
Слайд 7
Составьте схемы образования ионной связи между: Натрием и азотом Алюминием и фтором Кальцием и кислородом
Слайд 8
В каком из соединений – LiCl или KCl – связь более ионная? KCl
Слайд 9
Ковалентная связь
Слайд 10
F 2 — ? F +9 2e 7e 1s 2 2s 2 p 5 1 2 s p F F + . . . . . . . . . . . . . . . . . . F . . . . F . . . . . . общая электронная пара (поделенная, связывающая) неподеленные электронные пары F – F структурная формула Сколько химических связей образовал каждый атом фтора? Валентность фтора I
Слайд 11
Химическая связь, возникающая при образовании общих электронных пар, называется ковалентной (атомной) связью. Валентность – это число химических связей данного атома в соединении.
Слайд 12
O 2 — ? . . . . O . . . . O . . . . . . O O . . . . . . + . . . . O = O Сколько химических связей образовал каждый атом кислорода? Валентность кислорода II
Слайд 13
HF — ? H F + . . . . . . . . . . H F . . . . . . H → F Электроотрицательность(ЭО) – это способность атомов притягивать к себе общие электронные пары в соединении. См. ряд ЭО: ЭО( H)
Слайд 14
Ковалентная связь неполярная полярная O 2 F 2 HF Какая химическая связь образуется между атомами: H и H P и Cl K и Cl C и H S и O N и N
Слайд 15
Домашнее задание: § 11, 12(до стр. 75) Стр.70 №2, 3-обязательно, №4-дополнительно
Слайд 16
Источники: 1) О.С.Габриелян Химия 8 класс учебник, Москва, «Дрофа», 2013 2) Е.В.Савинкина , Н.Д.Свердлова Сборник задач и упражнений по химии.
nsportal.ru
Презентация к уроку (химия, 8 класс) по теме: Химическая связь
Слайд 1
Химическая связьСлайд 2
Ионная связь металл + неметалл Na + 11 ) 2 ) 8 ) 1 Cl + 17 ) 2 ) 8 ) 7 8 + – Электростатическое притяжение Na + Cl — ионы
Слайд 3
Свойства ионной связи + ненаправленная, так как электромагнитное поле распространяется во все стороны + – – – – ненасыщаемая, притянется столько ионов, сколько уместится
Слайд 4
Поэтому все вещества с ионной связью имеют немолекулярное строение Кристаллическая решетка
Слайд 5
неметалл + неметалл Cl + 17 ) 2 ) 8 ) 7 С l С l Ковалентная связь С l Н Химическая связь, образованная посредством общих электронных пар, называется ковалентной. δ + δ — Ковалентная полярная связь Ковалентная неполярная связь
Слайд 6
N N Ковалентная связь может быть образована несколькими парами электронов N N Количество связей у атома равно количеству электронов, которых не достает у атома до октета.
Слайд 7
Свойства ковалентной связи направленная, атомы должны расположиться определенным образом. Н О Н 104˚ насыщаемая, связывает два атома, «третий – лишний» Н:Н
Слайд 8
Способы изображения ковалентной связи электронные схемы Н : Н структурные формулы перекрывание орбиталей электронно-графические схемы Н 2 Н F F 2 Н : F F : F Н -F Н -H F-F s-s s-p p-p H F F F
Слайд 9
+ + + + + + + + + + + + + + + + ион-атомы свободные электроны Металлическая связь
Слайд 10
Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл и неметалл если связь металлическая связь ковалентная связь ионная связь ковалентная полярная связь ковалентная неполярная ЭО элементов одинакова ЭО элементов различна
Слайд 11
Определите вид связи в следующих веществах: Н 2 , Na, NaF, H 2 S, NH 3 , O 2 , Zn, CaS, Mg 3 N 2 , CH 4 , Al, F 2 .
Слайд 12
Водородная связь – электростатическое притяжение между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом О, N или F другой молекулы (или другого фрагмента молекулы). — — — — — + + + + + + + + + + + + —
nsportal.ru
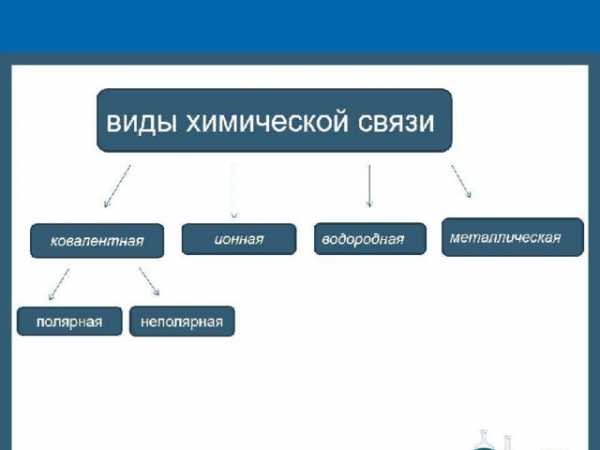
Презентация к уроку химии в 8 классе на тему: «Виды химической связи»
презентация к уроку химии -виды химической связи, состоит из 18 слайдов. содержит определения химических связей, схемы образования, материал на закрепление учебного материала/ виды ковалентной связи- полярная и неполярная, ионная связь, металлическая. дана таблица сравнения химических связей.
Просмотр содержимого документа
«Презентация к уроку химии в 8 классе на тему: «Виды химической связи» »

Презентация к уроку химии в 8 классе по теме: «Виды химической связи»
Выполнила учитель химии и биологии Клещева Любовь Владимировна

Мотиватор к уроку


- Определение :
- Связь,осуществляемая общими электронными парами

Ковалентная неполярная связь
- Электронное облако связи распределено в пространстве симметрично относительно обоих атомов
- Например: O2 N2 Cl2 F2 Br2
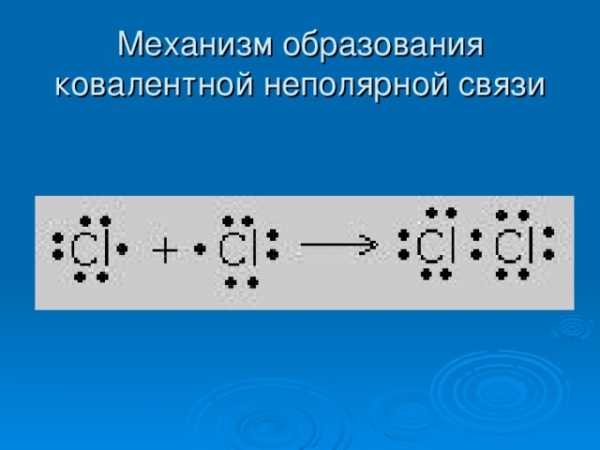
Механизм образования ковалентной неполярной связи

- Электронное облако связи смещено в сторону более электроотрицательного атома
- Например HCl h3O CO2

Механизм образования ковалентной полярной связи
- Образование молекулы НС l можно представить схемой
- Н.+ .С l : = Н : Cl :

- Связь между ионами, осуществляемая
посредством электростатического притяжения
Например NaCl BeF2 CuO


Определить вид химической связи по формулам
- h3 O2 K2O Fe h3O h3S N2 Cu
- F2 Ag HgO NaF P4 Nh4 SiO2 Br2
- KI PbO Zn Na O3 SO2 h3Se LiCl

Таблица «Виды химической связи и их отличия»
Химическая связь
Связываемые атомы
Ионная
Атом металла и неметалла
Характер элементов
Ковалентная
Процесс в электронной оболочке
Металличес кая
Атом ы неметаллов
Электроположительный и электроотрицательный
Атомы металлов
Переход валентных электронов
электроотрицательный
Образующиеся частицы
электроположительный
Характер вещества
Образование общих электронных пар
Положительные и отрицательные ионы
солеобразный
Отдача валентных электронов
Примеры
молекулы
Положительные ионы и электронный газ
NACL.KF.
CAO
Летучий или нелетучий,алмазоподобный
металлический
h3O. HCL
Металлы и сплавы

Образование молекулы OF2

Образование ионной связи

Залание по проверке изученного на уроке
- Какой тип связи в молекулах веществ?
- h3
- h3O
- Nh4
- Cl2
- h3S
- Напишите электронные формулы этих веществ.

Порядок построения молекул

Домашнее задание
kopilkaurokov.ru
Урок по химии для 8-го класса с использованием презентации по теме «Понятие о валентности и химической связи. Ковалентная химическая связь»
Разделы: Химия
Тип урока: урок-лекция, беседа.
Цель урока: научить учащихся составлять электронные и структурные формулы молекул с ковалентной связью.
Задачи урока: сформировать у учащихся представление о валентности и валентных электронах, о химической связи. Рассмотреть разновидность химической связи — ковалентную связь, механизм ее образования.
Оборудование: компьютер, интерактивная доска, мультимедийный проектор, периодическая система химических элементов Д. И. Менделеева.
План урока
- Организационный момент.
- Изучение нового материала (с использованием презентации).
- Изучение состава и строения веществ – одна из задач химии.
- Примеры молекул различных веществ.
- Что такое химическая связь и почему атомы соединяются в молекулы?
- Что такое валентность и какова роль валентных электронов в образовании химической связи?
- Ковалентная связь, механизм ее образования.
- Электронные (формулы Льюиса) и структурные формулы молекул хлора, азота, хлороводорода.
- Основные выводы урока.
Конспект урока
Слайд 1
Вспомним, что одной из задач химии как науки является изучение состава и строения веществ. Мы уже с вами знаем, что вещества состоят из молекул, которые могут состоять из 2, 3, 4 и большего числа атомов.
Слайд 2
Слайд 3
Лишь благородные газы существуют в одноатомном состоянии, их атомы не соединяются друг с другом. Но почему? Они имеют завершенный, восьмиэлектронный внешний энергетический уровень. Такое состояние называется устойчивым.
Слайд 4
Атомы других элементов стремятся перейти в устойчивое состояние, взаимодействуя между собой. При взаимодействии атомов между ними возникает химическая связь.
Слайд 5
В образовании химической связи принимают участие только валентные электроны. Они расположены на внешнем энергетическом уровне у элементов главной подгруппы. Рассмотрим валентности некоторых элементов.
Слайд 6
Химическая связь образуется за счет электронов внешнего энергетического уровня, но осуществляется она по-разному. Различают три основных типа химической связи:
- Ковалентную;
- Ионную;
- металлическую.
Сегодня познакомимся с ковалентной связью. В слове “ковалентная” приставка “ко” означает “совместное участие”, “валента” в переводе на русский – сила, способность. В данном случае имеется в виду способность атомов связываться с другими атомами.
Слайд 7
Ковалентная связь – это химическая связь между атомами, осуществляемая с помощью общих электронных пар. Ковалентная связь существует в молекулах, образованных атомами неметаллов.
В 1916г. американский ученый Джильбер Льюис разработал теорию ковалентной связи, согласно которой атомы приобретают устойчивое состояние путем образования одной или нескольких общих электронных пар между взаимодействующими атомами.
Слайд 8
Рассмотрим образование ковалентной связи в молекуле Cl2.
Сначала составим электронную схему, затем электронную и электронно-графическую формулы для атома хлора (используя возможности интерактивной доски).
Слайд 9
Обратим внимание на число валентных электронов. Льюис предложил обозначать валентные электроны точками рядом с символом элемента. Одна точка обозначает один электрон. У каждого атома хлора, составляющего молекулу хлора, по семь валентных электронов, из которых один является неспаренным. Именно за счет этих неспаренных электронов образуется общая электронная пара. И как предложил Льюис, именно пара электронов позволяет образовать ковалентную связь.
Рассмотрим образование ковалентной связи в молекуле N2 (используя возможности интерактивной доски).
Слайд 10
Рассмотрим образование ковалентной связи в молекуле HCl (используя возможности интерактивной доски).
Слайд 11
Рассмотрев образование ковалентной связи в различных молекулах, можем сделать следующие выводы.
Слайд 12
Презентация
23.03.2009
Поделиться страницей:urok.1sept.ru
Урок химии для 8 класса на тему: «Ковалентная связь».
Технологическая карта урока
Предмет Химия: 8 класс
Автор УМК : Новошинская Н.С., Новошинский И.И.
Тема урока: Ковалентная связь
Тип урока: Освоение новых знаний.
Цели: -образовательная: раскрыть сущность образования химической связи между атомами, сформировать понятие о ковалентной связи.
—развивающая :. формировать умение записывать схемы образования ковалентной связи, продолжить развитие умений анализировать, выделять главное в изучаемом учебном материале, делать выводы;
-воспитательная: воспитывать интерес к предмету, самостоятельность, умение работать в коллективе.
Планируемый результат:
1. Предметные УУД: конкретизировать понятие «химическая связь», ознакомить учащихся понятием «ковалентная связь», научиться записывать схемы образования ковалентной химической связи;
2. МетапредметныеУУД:
— познавательные УУД: давать определение понятиям, обобщать понятия, осуществлять сравнение и классификацию; строить логические рассуждения, устанавливать причинно-следственные связи, создавать обобщения, делать выводы, понимать , обобщать информацию, представленную в рисунках , схемах и таблицах.
-регулятивные УУД: планировать учебную деятельность в соответствии с учебным заданием, осуществлять само- и взаимоконтроль и коррекцию своей деятельности в процессе достижения результата .
-коммуникативные УУД: организовывать учебное сотрудничество и совместную деятельность с учителем и с одноклассниками, устанавливать рабочие отношения в группе, планировать общие способы работы, строить понятные для собеседника речевые высказывания, уметь слушать собеседника, адекватно и осознанно использовать устную и письменную речь, формировать опыт взаимодействия в условиях групповой работы.
3. Личностные УУД: понимать единство естественнонаучной картины мира и значимость естественнонаучных знаний для решения практических задач в повседневной жизни, уметь управлять своей познавательной деятельностью, самоконтроль и самооценка.
Формы работы: словесные, групповые.
Оборудование :периодическая система химических элементов Д.И.Менделеева;учебник; таблицы «Механизмы образования ковалентной химической связи», мультимедийная установка, презентация».
ХОД УРОКА
I. Этап «Актуализация знаний и постановка цели урока»
Приветствие учителя.
Слайд 1. Ребята, я хочу начать сегодняшний урок с персидской притчи : «Как часто вы обретали какое-то знание?
Как часто вам удавалось его передать кому-то другому? На самом деле, истинное знание невозможно передать — его можно только постичь самостоятельно». Вывод: знания добываем сами.
Слайд 2.
Я хочу вас спросить: « Зачем вы пришли ко мне на урок?» Дети отвечают; чтобы делать открытия, чтобы узнавать, что — то новое.Мы дышим кислородом, пьём воду. Вам хочется узнать, как устроены молекулы этих веществ?
Продолжаем познавать новое.
Деятельность учителя
Деятельность учащихся
УУД
1. Организует деятельность по актуализации понятий «химическая связь» , «валентность», «ковалентная связь.
Слайды 3,4
Учитель спрашивает:
— Ребята, а кто помнит, что такое атом?
— Из чего состоит атом?
— Какие вещества относятся к простым, а какие к сложным?
— Некоторые вещества существуют в виде молекул, которые состоят из атомов. Между ними возникает химическая связь.
-Что такое химическая связь?
-Что такое валентность?
— Определите валентность: HCl, H2O, CH4.
2. Создает проблемную ситуацию:
Слайд 5.
На доске: О2, Н2,Н2О, НCl, H3N
«Как вы думаете, ребята, каким образом атомы удерживаются друг возле друга в молекулах простых и сложных веществ?
Прежде чем перейти к рассмотрению новой темы, давайте вспомним еще раз, а что же такое химическая связь?
— Какие типы химической связи вам известны?
Правильно. Кто озвучит тему сегодняшнего урока?
Слайд 6.
Вспоминают изученный ранее материал. Слушают вопросы учителя, во фронтальном режиме отвечают на вопросы, контролируют правильность ответов учащихся.
Ответы:
— Атом — электронейтральная и химически неделимая частица, состоящая из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов;
— Атом состоит из протонов, нейтронов и электронов.
Простые вещества образованы атомами одного химического элемента, а сложные атомами разных химических элементов.
Химическая связь — это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
валентность-способность атома элемента образовывать разное число химических связей друг с другом.
Определяют валентность атомов в малекулах.
Дети вступают в диалог с учителем, высказывают свои предположения о связи между атомами.
Отвечают: химическая связь — это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
Ответ:ковалентная и ионная.
Пользуясь учебником, называют тему «Ковалентная химическая связь», записывают ее в рабочие тетради
1.Давать определение понятиям, обобщать понятия; осуществлять сравнение и классификацию; строить логические рассуждения, устанавливать причинно-следственные связи.
2.Слушать в соответствии с целевой установкой; дополнять, уточнять ответы одноклассников по существу поставленного задания.
3.Воспринимать на слух вопросы учителя и ответы учащихся, строить понятные для собеседника речевые высказывания.
4.Понимать единство естественнонаучной картины мира и значимость естественнонаучных знаний в практической жизни.
Осуществлять самоконтроль процесса и результата выполнения задания
3.Учитель совместно с учащимися формулируют цели урока.
Слайд 7.
Устанавливают причинно-следственные связи. Коллективное обсуждение проблемы.
В процессе диалога обсуждают цели:
сформировать понятие о ковалентной связи, механизме её образования.
1.Формирование рефлексивных умении: умение определять границы между знанием и незнанием.
2.Формирование способности постановки цели, ведущей к решению возникающих проблем.
II. Этап «Изучение нового материала»
1. Побуждает учащихся к теоретическому объяснению фактов. Стимулирует активное участие всех детей в поисковой деятельности:
Слайды 8,9
Сегодня на уроке нам нужно подумать над вопросом – почему атомы вступают в химическую связь?
Все ли валентные электроны будут участвуют в образовании химической связи?
-Как определяется число валентных электронов и неспаренных электронов?
1.Обнаруживают закономерности, обобщают результаты наблюдения, составляют план действий – алгоритм.
2. Фиксируют результаты, устанавливают причинно-следственные связи.
3.Отвечают на вопросы учителя.
1.Формирование навыка расширенного поиска информации.
2.Формирование умения выделять главное и второстепенное.
2. Организует работу в группах, предлагает по ходу работы составить краткий план – конспект, консультирует работу учащихся.
Слайд 10.
Дети делятся на группы по 4 человека, обсуждают в группах варианты решения учебной задачи, обосновывают выбор общего решения или несогласие с мнением других
Осуществляют поиск информации с использованием ПСХЭ и текста параграфа 16.Делают выводы и умозаключения. Дополняют, уточняют ответы одноклассников по существу поставленного задания.
.Корректно ведут диалог, участвуют в дискуссии.
Работая с текстом учебника стр 48-49 §16 учащиеся узнают как определить число неспаренных электронов и заполняют таблицу
Группа
Валентные
Неспаренные
5
5
3
7
7
1
6
6
2
составляют план – конспект и делают пометки, если что-то не понятно.
1.Формирование коммуникативных умений, культуры общения, сотрудничества.
2.Отработка способности к адекватному использованию речевых средств для решения различных коммуникативных задач.
3.Формирование умения вести диалог на основе равноправных отношений и взаимного уважения и принятия.
4.Формирование умения самостоятельно контролировать свое время и управлять им.
5.Привитие способности объективно оценивать себя и других участников учебного процесса.
6.Формирование позитивной моральной самооценки.
3. На первичном этапе осмысления учитель контролирует усвоение новых понятий:
— предлагает определить, сколько неспаренных электронов у атомов IV, V, VI , VII группы (несколько примеров)? Слайд 11.
— Составить электронные формулы: J2, H2, N2, HF( Слайд 12)
Взаимопроверка.
Оцените себя. Есть ребята, которые не справились с этим заданием?
Дает определение ковалентной связи:
связь, образованная между двумя неметаллами, называется ковалентной. Она осуществляется за счет образования общих электронных пар между двумя атомами неметаллов. (Например: H2, HCl, H2O). Слайд 13.
группа
IV
V
VI
VII
Число неспаренных электронрв
4
5
6
7
Дети анализируют, сравнивают информацию.
Выполняют пробное учебное действие.Фиксируют индивидуальные затруднения в пробном действии.
Проводят взаимопроверку, оценивают друг друга.
Слушают учителя.
4. Учитель предлагает вниманию учащихся алгоритм составления схемы
образования ковалентной связи (на примере молекулы Cl2).Слайд14.
1.Определить валентные электроны.
2.Определить количество неспаренных электронов
2. Валентные электроны каждого атома обозначить точками вокруг символа элемента. В атоме хлора один электрон находится в неспаренном состоянии:
··
׃Cl •
·· Сколько электронов не хватает атому хлора до завершения внешнего электронного слоя?
Учитель объясняет, поэтому при сближении двух атомов хлора каждый из них предоставляет по одному неспаренному электрону на образование общей электронной пары, т.е. образуется ковалентная связь.
3.Показать взаимодействие атомов:
·· ··
׃Cl ׃Cl ׃
·· ··
Электронная формула молекулы.
Объясняет, что если в формуле вещества электронную пару изобразить черточкой , то получится структурная формула вещества.
Слайд15. Пользуясь этим алгоритмом, работая в группах, попробуем составить cхемы образования ковалентных связей в молекулах кислорода и азота.
Вводит понятие одинарная, двойная, тройная связь. Слайд 16.
Вопрос детям: чем определяется количество связей между атомами в молекуле?
4.Учитель ставит задачу. Мы сейчас рассмотрели случай, когда образуется молекула простого вещества. Но вокруг нас множество веществ сложного строения. Как в этом случае происходит образование связи?
Попробуйте самостоятельно изобразить схему образования связи в молекуле хлорводорода HCl и объясните, что произошло с электронными слоями у водорода и хлора в результате образования ковалентной связи.Слайд 17.
Дети определяют, что их 7.
Дети определяют, что -1
Дети записывают алгоритм в тетрадь и составляют подобные задания. После обсуждают и дискутируют.
Дети определяют, что
до завершения внешнего электронного слоя атому хлора не хватает одного электрона.
Моделируют ситуацию на основе имеющихся знаний. Работая в группах, составляют схемы, сталкиваются с проблемой: у кислорода два неспаренных электрона, а у азота три.
Ответ: определяются числом электронов недостающих до завершения электронного слоя атома
Составляют схему строения.
Объясняют, что у атома водорода появился завершенный двухэлектронный слой, а у атома хлора завершенный восьмиэлектронный слой.
1.Формирование способности владения основами прогнозирования как предвидения будущих событий и развития процесса.
2.Формирование способности к моделированию ситуации на основе имеющихся данных.
3.Формирование способности к самостоятельному построению умозаключений и формулировке выводов на основе аргументации.
4.Развитие креативного мышления и способности к сопоставлению данных.
III. РЕФЛЕКСИЯ.
Слайд18.
1.Организует обсуждение результатов:
Какую задачу ставили?
Чем занимались на уроке?
Какие сложности возникли?
Как оцениваете свою работу?
Работу класса в целом?
Трудно делать какие либо открытия. Но это интересно, приятно, так как ваши открытия – это ваши победы, а из этих маленьких побед складываются большие открытия. Вы уже знаете, как устроена молекула кислорода, молекула воды, на следующем уроке расширим понятие ковалентной связи и узнаем какие типы ковалентной связи существуют.
Слайд 19.
Предлагаются задания для закрепления.
Составьте электронную схему строения атома серы. Подчеркните валентные электроны и обозначьте их точками вокруг символа элемента. Укажите , сколько электронов атома серы могут участвовать в образовании связей с атомами водорода. Какой тип связи при этом образуется?
-Обобщают результаты своей деятельности по достижению цели.
Выстраивание причинно- следственных связей.
-Осуществление сравнения обобщения и классификации.
-Контроль и оценка процесса и результатов деятельности.
— Слушают, задают вопросы на понимание и уточнение.
-Участвуют в обсуждении
-Выражают собственное мнение о работе и полученном результате.
.
Парная работа с последующим комментированием
1.Формирование умения участвовать в обсуждении проблемы.
2.Формирование умения выражать свои мысли.
3.Развитие способности объективно оценивать себя и анализировать условия достижения цели.
4.Формирование позитивной моральной самооценки.
IV. ДОМАШНЕЕ ЗАДАНИЕ
Подводит итог урока, отмечает наиболее активных учащихся, выставляет отметки по результатам работы на уроке.
Слайд 20.
Организует объяснение выполнения домашнего задания:
1. § 16 учебника.
2. Ответить на вопросы после текста параграфа.
3. Выполнить задания на стр.54 № 1,2,3 (по выбору учащегося)
Адекватно воспринимать оценку учителя
Слушают учителя.
Записывают домашнее задание
1.Развитие навыков активного слушания и правильной постановки вопросов.
2.Формирование способности формулировать и задавать вопросы. необходимые для организации собственной деятельности.
infourok.ru
Ковалентная связь 8 кл.

Химическая связь
Ковалентная связь
Кривошапкина В. В.
Учитель химии, биологии
МОУ «СОШ № 1»
Г.Котлас

Свойства веществ зависят
от строения
Атома
Молекулы
Кристалла

- Молекулы веществ состоят из двух, трех, четырех и большего количества атомов
- И только молекулы инертных газов одноатомны
- Составьте схема атомов кальция, азота, неона, аргона, гелия

- Стабильность!
- Стремление к стабильности

Химическая связь – это
силы взаимодействия,
которые соединяют
отдельные атомы в
молекулы, ионы,
кристаллы .

Валентность –
это способность атома
образовывать определенное число химических связей
с другими атомами .
Величина валентности элемента
определяется числом химических связей,
которые атом элемента образует с
другими атомами.

- Валентные электроны –
это электроны, которые могут принимать участие в образовании химической связи
Электроны располагаются парами
Спаренные Неспаренные
электроны

группа
Число
4
валентных
IV
Валентные
5
электронов
Число
V
неспаренных
VI
6
электроны
показаны
электронов
7
VII
4
3
точками
2
1

- Число неспаренных электронов =
= 8 — № группы
S 2
N 3
Cl
Si
P
Se
Br

Как завершить внешний энергетический уровень?
- Надо добавить электроны на внешний уровень.
- Где взять такие электроны?
- У другого атома.

. .
А + В
А : В
Общая
электронная
пара
Неспаренные
электроны

Ковалентная связь –
это химическая связь, возникающая в результате образования
общих электронных пар
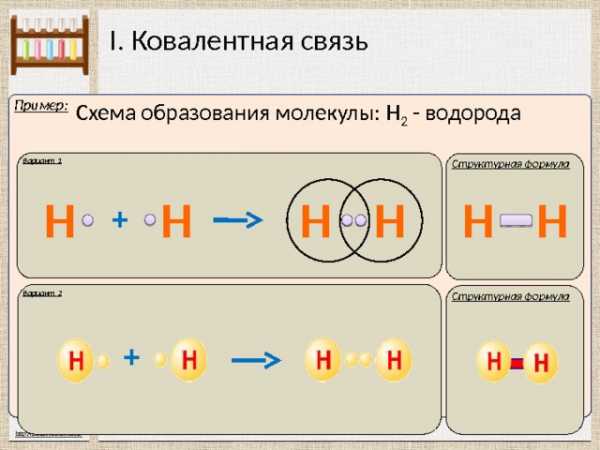
I. Ковалентная связь
Пример:
Схема образования молекулы: Н 2 — водорода
Вариант 1
Структурная формула
Н
Н
Н
Н
Н
Н
Н
Н
+
Вариант 2
Структурная формула
+
13

I. Ковалентная связь
Пример:
Схема образования молекулы: F 2 — фтора
Вариант 1
Структурная формула
0
0
F
F
F
F
F
F
F
F
+
Вариант 2
Структурная формула
+
14

Д.З. Параграф 14 ,

Интернет-ресурсы:
Микроскоп http://img-fotki.yandex.ru/get/9299/134091466.f5/0_d4d6e_ccd0a668_S
Колбы http://img-fotki.yandex.ru/get/6613/134091466.a/0_8eae3_6ea58e84_S
Пробирки http://img-fotki.yandex.ru/get/9300/134091466.c5/0_c98b9_19d24419_S
Горелка http://img-fotki.yandex.ru/get/4904/134091466.f5/0_d4d6d_4740c1eb_S
Колбы http://img-fotki.yandex.ru/get/9558/134091466.9a/0_c0378_bebb161_S
Блокнот с ручкой http://img-fotki.yandex.ru/get/19/108950446.6d/0_b4102_1793a431_S
videouroki.net
Презентация к уроку по химии (8 класс) на тему: Химическая связь.
Слайд 1
Химическая связьСлайд 2
Ионная связь металл + неметалл Na + 11 ) 2 ) 8 ) 1 Cl + 17 ) 2 ) 8 ) 7 8 + – Электростатическое притяжение Na + Cl — ионы
Слайд 3
Свойства ионной связи + ненаправленная, так как электромагнитное поле распространяется во все стороны + – – – – ненасыщаемая, притянется столько ионов, сколько уместится
Слайд 4
Поэтому все вещества с ионной связью имеют немолекулярное строение Кристаллическая решетка
Слайд 5
неметалл + неметалл Cl + 17 ) 2 ) 8 ) 7 С l С l Ковалентная связь С l Н Химическая связь, образованная посредством общих электронных пар, называется ковалентной. δ + δ — Ковалентная полярная связь Ковалентная неполярная связь
Слайд 6
N N Ковалентная связь может быть образована несколькими парами электронов N N Количество связей у атома равно количеству электронов, которых не достает у атома до октета.
Слайд 7
Свойства ковалентной связи направленная, атомы должны расположиться определенным образом. Н О Н 104˚ насыщаемая, связывает два атома, «третий – лишний» Н:Н
Слайд 8
Способы изображения ковалентной связи электронные схемы Н : Н структурные формулы перекрывание орбиталей электронно-графические схемы Н 2 Н F F 2 Н : F F : F Н -F Н -H F-F s-s s-p p-p H F F F
Слайд 9
+ + + + + + + + + + + + + + + + ион-атомы свободные электроны Металлическая связь
Слайд 10
Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл и неметалл если связь металлическая связь ковалентная связь ионная связь ковалентная полярная связь ковалентная неполярная ЭО элементов одинакова ЭО элементов различна
Слайд 11
Определите вид связи в следующих веществах: Н 2 , Na, NaF, H 2 S, NH 3 , O 2 , Zn, CaS, Mg 3 N 2 , CH 4 , Al, F 2 .
Слайд 12
Водородная связь – электростатическое притяжение между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом О, N или F другой молекулы (или другого фрагмента молекулы). — — — — — + + + + + + + + + + + + —
nsportal.ru

