Химия 10 класс презентация алкены: Презентация на тему: » Алкены»
Алкены | Презентация к уроку по химии (10 класс):
Слайд 1
Непредельные углеводороды
Слайд 2
Алкены (этиленовые углеводороды) это углеводороды, содержащие в молекуле одну двойную связь. C n H 2 n общая формула (n = 2,3,4….) С 2 Н 4 – этилен – эт ен СН 2 = СН 2 С 3 Н 6 – проп ен СН 2 = СН – СН 3 С 4 Н 8 — бут ен С 5 Н 10 — пент ен С 6 Н 12 — гекс ен
Слайд 3
Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C 2 – C 4 – газы, C 5 – C 17 – жидкости, высшие представители – твердые вещества. Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы. Все алкены легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
Слайд 4
Этилен – газ, почти без запаха, плохо растворим в воде. Строение этилена С 2 Н 4 – молекулярная формула Н Н структурная С = С формула Н Н этилена
Слайд 5
1. Образование σ -связей Каждый атом С образует по 3 σ -связи (одну – с соседним атомом С и две связи с атомами Н). На их образование углерод затрачивает 3 электрона (один s- электрон и два р-электрона), поэтому происходит sp 2 -гибридизация. Схематическое изображение строения молекулы этилена В результате каждый атом углерода обладает тремя гибридными sp 2 -орбиталями, которые лежат в одной плоскости под углом 120º друг к другу.
Образование σ -связей Каждый атом С образует по 3 σ -связи (одну – с соседним атомом С и две связи с атомами Н). На их образование углерод затрачивает 3 электрона (один s- электрон и два р-электрона), поэтому происходит sp 2 -гибридизация. Схематическое изображение строения молекулы этилена В результате каждый атом углерода обладает тремя гибридными sp 2 -орбиталями, которые лежат в одной плоскости под углом 120º друг к другу.
Слайд 6
Схема образования sp 2 -гибридных орбиталей В гибридизации участвуют орбитали одного s — и двух p -электронов: s 2p sp 2
Слайд 7
2. Образование π -связи У каждого атома С есть ещё по одному облаку, которые в гибридизации не участвуют и сохраняют форму правильных восьмерок. Перекрываясь над и под плоскостью, они образуют π — связь , которая располагается перпендикулярно к плоскости σ — связей. Двойная связь алкенов представляет собой сочетание σ — и π — связей. Длина двойной связи = 0,134 нм.
Слайд 8
Запомните. Простая (ординарная) связь – это всегда σ -связь. В кратных (двойных или тройных) связях – одна σ -связь, а остальные π -связи. σ -связи всегда образованы гибридными орбиталями (неправильными восьмерками). π -связи образованы негибридными p – орбиталями (правильными восьмерками).
В кратных (двойных или тройных) связях – одна σ -связь, а остальные π -связи. σ -связи всегда образованы гибридными орбиталями (неправильными восьмерками). π -связи образованы негибридными p – орбиталями (правильными восьмерками).
Слайд 9
π — связь менее прочна, чем σ — связь. В связи с этим, π — связь легко разрывается и переходит в две новые σ — связи в результате присоединения по месту двойной связи двух атомов или групп атомов реагирующих веществ. Для алкенов наиболее типичными являются реакции присоединения.
Слайд 10
Изомерия алкенов 1) углеродного скелета CH 2 = CH – CH 2 – CH 3 CH 2 = C – CH 3 бутен-1 ׀ CH 3 2-метилпропен-1 2) положения двойной связи CH 2 = CH – CH 2 – CH 3 CH 3 – CH = CH – CH 3 бутен-1 бутен-2 3) классов соединений (циклоалканы) CH 2 = CH – CH 2 – CH 3 CH 2 – CH 2 бутен-1 | | CH 2 – CH 2 циклобутан
Слайд 11
4) пространственная (цис-транс-изомерия) CH 3 H H H \ / \ / C = C C = C / \ / \ H CH 3 CH 3 CH 3 транс — цис — Запомните! Если одинаковые заместители находятся по одну сторону двойной связи, это цис–изомер, если по разные – это транс–изомер.
Слайд 12
Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс –ан на –ен , цифрой указывается номер того атома углерода, от которого начинается двойная связь. Главная цепь атомов углерода должна обязательно включать двойную связь, и ее нумерацию проводят с того конца главной цепи, к которому она ближе. В начале названия перечисляют радикалы с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов, то цифрой указывается место каждого из них в главной цепи и перед их названием ставят соответственно приставки: ди- , три- , тетра- и т.д.
Слайд 13
Химические свойства алкенов 1) Горение При сжигании на воздухе алкены образуют углекислый газ и воду. C 2 H 4 + 3 O 2 → 2 CO 2 + 2 H 2 O + Q 2 ) Окисление – качественная реакция на двойную связь (растворы окислителей обесцвечиваются)
Слайд 14
При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли ( реакция Е. Е.Вагнера ). Реакция протекает на холоде. 3H 2 C=CH 2 + 2KMnO 4 + 4H 2 O → 2MnO 2 + 2KOH + 3CH 2 −CH 2 | | OH OH В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь. H 2 C=CH 2 + [О] + НОН → CH 2 −CH 2 этилен- | | гликоль OH OH
Е.Вагнера ). Реакция протекает на холоде. 3H 2 C=CH 2 + 2KMnO 4 + 4H 2 O → 2MnO 2 + 2KOH + 3CH 2 −CH 2 | | OH OH В результате реакции наблюдается обесцвечивание раствора перманганата калия. Реакция Вагнера служит качественной пробой на двойную связь. H 2 C=CH 2 + [О] + НОН → CH 2 −CH 2 этилен- | | гликоль OH OH
Слайд 15
3 ) Реакции присоединения. а) Присоединение галогенов — Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводным алканов, содержащим атомы галогена у соседних углеродных атомов. H 2 C = CH 2 + Br 2 → BrCH 2 – CH 2 Br С 2 Н 4 + Br 2 → С 2 Н 4 Br 2 дибромэтан С 2 Н 4 + Cl 2 → С 2 Н 4 CI 2 дихлорэтан Приведенная реакция — обесцвечивание этиленом бромной воды является качественной реакцией на двойную связь.
Слайд 16
б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов ( Pt , Pd , Ni ) образуя предельные углеводороды. CH 2 = CH 2 + H 2 → CH 3 – CH 3 С 2 Н 4 + H 2 → C 2 H 6 этан t,kat в) Присоединение галогеноводородов — Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов. H 2 C = CH 2 + H С I → CH 3 – CH 2 CI С 2 Н 4 + HCI → C 2 H 5 CI хлорэтан
Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов. H 2 C = CH 2 + H С I → CH 3 – CH 2 CI С 2 Н 4 + HCI → C 2 H 5 CI хлорэтан
Слайд 17
Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова ( водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому углерода с наибольшим числом водородных атомов ). CH 3 − CH = CH 2 + HCl → CH 3 – CH ( Cl )− CH 3
Слайд 18
Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. H+ CH 3 − C = CH 2 + H 2 O → CH 3 − CH(CH 3 ) − CH 3 | | CH 3 OH Как видно, направление реакций гидратации определяется правилом Марковникова. г) Гидратация – присоединение воды С 2 Н 4 + НОН → С 2 Н 5 ОН этиловый спирт (этанол)
Слайд 19
4. Полимеризация — это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу. При полимеризации двойные связи в молекулах исходного непредельного соединения «разрываются», и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. Полимеризация алкенов вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом: n CH 2 = CH 2 → (- CH 2 – CH 2 -) n ЭТИЛЕН ПОЛИЭТИЛЕН
Полимеризация алкенов вызывается нагреванием, давлением, облучением, действием свободных радикалов или катализаторов. В упрощенном виде такую реакцию на примере этилена можно представить следующим образом: n CH 2 = CH 2 → (- CH 2 – CH 2 -) n ЭТИЛЕН ПОЛИЭТИЛЕН
Слайд 20
Вывод: Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π -связи ).
Слайд 21
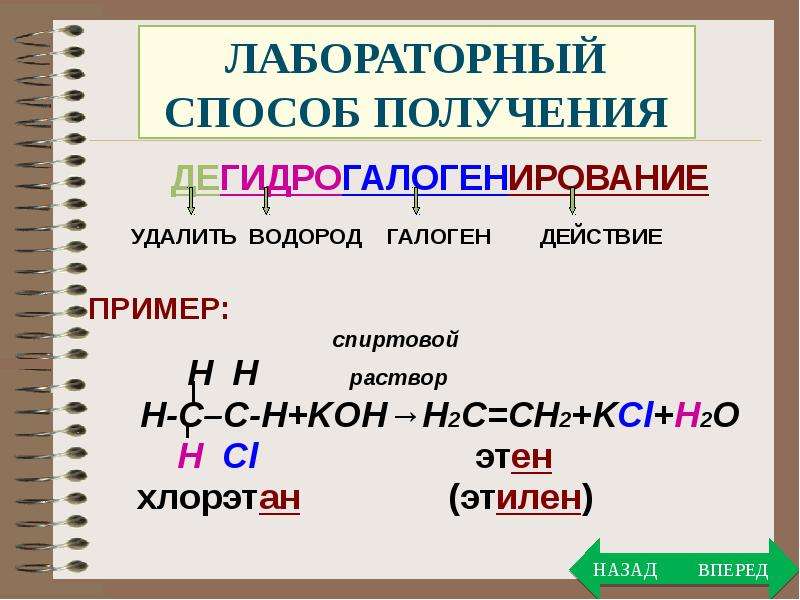
Получение алкенов 1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором. СН 3 – СН 3 → СН 2 = СН 2 + Н 2 С 2 Н 6 → С 2 Н 4 + Н 2 t, kat 2) Дегидратация (отщепление воды) спиртов при нагревании с водоотнимающими средствами (концентрированная серная или фосфорная кислоты) или при пропускании паров спирта над катализатором (окись алюминия). CH 3 – CH 2 – OH → CH 2 = CH 2 + H 2 O С 2 Н 5 ОН → С 2 Н 4 + Н 2 О
Слайд 22
Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения многих важнейших продуктов. Наибольшее значение имеет этилен и его производные. Применение этилена и его производных:
Наибольшее значение имеет этилен и его производные. Применение этилена и его производных:
Слайд 23
Этилен ускоряет созревание плодов
Слайд 24
В качестве топлива
Слайд 25
Для получения алканов
Слайд 26
Этиленгликоль – для получения антифризов, тормозных жидкостей
Слайд 27
Дихлорэтан – растворитель
Слайд 28
Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ)
Слайд 29
Дибромэтан – антидетонационная добавка в топливо
Слайд 30
Дибромэтан – для обработки бревен от термитов и жуков
Слайд 31
Хлорэтан, бромэтан – для наркоза при легких операциях
Слайд 32
Этиловый спирт — растворитель, анти-септик в медицине , в производстве синтетического каучука…
Слайд 33
Производство полиэтилена:
Слайд 34
Содержание Алкены Номенклатура Изомерия Физические свойства Строение алкенов Химические свойства ( реакции присоединения: галогенирование, гидрирование, гидрогалогенирование, гидратация; окисление, реакция полимеризации ) Получение (дегидрогенизация алканов, дегидратация спиртов, дегидрогалогенирование галогенпроизводных, дегалогенирование) Применение Литература
Слайд 35
А) Пленка
Слайд 36
Б) Тара
Слайд 37
В) Трубы
Слайд 38
Г) Сантехника
Слайд 39
Д) Изоляция проводов и кабелей
Слайд 40
Ж) Каркасы катушек
Слайд 41
З) Бронепанели в бронежилетах
Слайд 42
И) Предметы быта
Слайд 44
Применение этилена Свойство Применение 1 . Горение 2. Присоединение галогенов 3. Присоединение водорода (гидрирование) 4. Присоединение галогеноводородов (гидрогалогенирование)
Горение 2. Присоединение галогенов 3. Присоединение водорода (гидрирование) 4. Присоединение галогеноводородов (гидрогалогенирование)
Слайд 45
Свойство Применение 5.Присоединение воды (гидратация) 6. Окисление раствором KMnO 4 7. Полимеризация 8. Особое свойство этилена
Слайд 46
Применение этилена (эталон) Свойство Применение 1 . Горение В качестве топлива 2. Присоединение галогенов Растворители (дихлорэтан) 3. Присоединение водорода (гидрирование) 4. Присоединение галогеноводородов Для получения алканов Растворители (хлорэтан)
Слайд 47
Свойство Применение 5.Присоединение воды (гидратация) Для получения этилового спирта, используемого как растворитель, анти-септик в медицине , в производстве синтетического каучука 6. Окисление раствором KMnO 4 Получение антифризов, тормозных жидкостей 7. Полимеризация 8. Особое свойство этилена Производство полиэтилена Этилен ускоряет созревание плодов
Презентация по теме «Алкены» (10 класс)
11/10/18
Алкены
ХИМИЯ — 10
Автор: Кунова Г. В. — учитель химии ГОАОУ «ЦОРиО»
В. — учитель химии ГОАОУ «ЦОРиО»
г. Липецк
11/10/18
- Строение молекулы
- К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода .
- Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения , прежде всего водорода, с образованием предельных, или насыщенных, углеводородов – алканов.
- Какую пользу получит аудитория от презентации: взрослых учащихся больше интересует предмет, если они знают, почему и насколько он важен для них.
- Уровень знаний докладчика по теме: кратко укажите свои профессиональные успехи в этой области или объясните, почему участникам интересно будет вас послушать.
- По названию первого представителя гомологического ряда – этилена – алкены называют этиленовыми углеводородами.
11/10/18
- Строение молекулы
- Орбитали атомов углерода, между которыми имеется двойная связь, находятся в состоянии sp 2 -гибридизации.

- Это означает, что в гибридизации участвуют одна s- и две p-орбитали , а одна p-орбиталь остаётся негибридизованной.
- Перекрывание гибридных орбиталей приводит к образованию σ-связи , а за счёт негибридизованных p-орбиталей соседних атомов углерода образуется вторая, π-связь.
Вывод: двойная связь состоит из одной σ- и одной π-связи.
11/10/18
- Строение молекулы
- Оси гибридных орбиталей атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь , располагаются перпендикулярно плоскости молекулы.
- Двойная связь (0,132 нм) короче одинарной, а её энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
- Гомологический ряд этена
11/10/18
11/10/18
- Изомерия и номенклатура
- Структурная изомерия
1) изомерия углеродного скелета:
2) изомерия положения двойной связи:
11/10/18
- Изомерия и номенклатура
- Межклассовая изомерия
Алкены изомерны циклоалканам , например:
- Пространственная (геометрическая) изомерия
Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов геометрической, или

С 6 Н 12
С 6 Н 12
11/10/18
- Изомерия и номенклатура
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Определения главной цепи – самой длинной цепочки атомов углерода в молекуле. Главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов,
-ен.5-метилгексен-2
11/10/18
Получение алкенов
Рассмотрим основные способы получения алкенов
- в промышленности
- в лаборатории
11/10/18
- Получение – в промышленности
- Крекинг нефтепродуктов.

В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов, например:
- Дегидрирование предельных углеводородов.
При пропускании алканов над катализатором (Pt, Ni, Cr2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена.
11/10/18
- Получение – в лаборатории
- Дегидратация спиртов (отщепление воды).
Воздействие водоотнимающих средств (H 2 SO 4 , Al 2 O 3 ) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
11/10/18
- Получение – в лаборатории
- Дегидрогалогенирование (отщепление галогеноводорода).
При взаимодействии галогеналкана с щёлочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода:
Реакция идёт по правилу Зайцева:
11/10/18
- Получение – в лаборатории
- Дегалогенирование.

При действии цинка или магния на дибромпроизводное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:
11/10/18
Химические свойства алкенов
- Реакции присоединения
- Реакции полимеризации
- Реакции окисления
11/10/18
- Химические свойства
Отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения.
- Гидрирование алкенов.
Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
11/10/18
- Химические свойства
- Галогенирование (присоединение галогенов).
Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (CCl 4 ) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов:
- Признак реакции – обесцвечивание бромной воды.

Качественна реакция на кратную
углерод-углеродную связь С=С
11/10/18
- Химические свойства
- Гидрогалогенирование (присоединение галогеноводорода):
Эта реакция подчиняется правилу Марковникова:
?
11/10/18
- Химические свойства
- Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов.
При присоединении воды к этену образуется первичный спирт –
этиловый спирт:
При гидратации пропена или других алкенов образуются вторичные или третичные спирты:
11/10/18
- Химические свойства
- Реакция полимеризации – особый случай реакции присоединения:
Реакции полимеризации веществ, содержащих двойную связь, используют для получения различных высокомолекулярных соединений:
11/10/18
- Химические свойства
- Реакции окисления
- Алкены горят в кислороде с образованием CO 2 и H 2 O:
- Алкены легко окисляются под действием водного раствора перманганата калия до двухатомных спиртов:
Качественна реакция на кратную углерод-углеродную связь С=С
11/10/18
- Применение алкенов
- Алкены широко используются в химической промышленности как сырьё для получения разнообразных органических веществ и материалов.

- Этен — исходное вещество для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.
Большое количество этена перерабатывается в полиэтилен
- Из пропена получают глицерин, ацетон, изопропиловый спирт, растворители.
Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена — одно из самых прочных синтетических волокон.
Материалы, изготовленные из этих волокон, являются перспективными и находят всё большее применение в разных областях человеческой деятельности.
11/10/18
- Источники
Алкен
АлкенРеклама
1 из 14
Верхний вырезанный слайд
Образование
Dr James Chemistry Форма 5 РП Глава 2 Соединения углерода
Реклама
Реклама
Алкен
- двойная связь Общая формула: Функциональная группа: Название алкенов: Cnh3n Количество Углерод 2 3 4 5 6 7 Формула C2h5 C3H6 C4H8 C5h20 C6h22 C7h24 Название Этен Пропен Бутен Пентен Гексен Гептен Двойная связь , n=2,3,4… Алкены
- Структурная формула алкенов Этен: C2h5 Пропен: C3H6
- Физические свойства алкенов похож на алканы Физический Характеристики алкенов Растворимость — растворяется в органических растворители — нерастворим в воде Плавление и точка кипения — легкоплавкие и точка кипения Плотность — менее плотный, чем вода Электрическая проводимость — не может проводить электричество — потому что нет свободных движущиеся ионы
- Объясните эффект увеличения число атомов углерода в алкене молекулы Размер молекулы увеличивается Точка плавления и температура кипения увеличивать • Чем выше количество углерода атомов, тем выше плавление & точка кипения
- а.

- б. Реакция добавления 1. Гидрирование Алкены реагируют с водородом при 180 °С в присутствии из никеля / платины (катализатор) для производства алканов
- 2. Гидратация Алкены реагируют с водяным паром, водой при 300 °С и 60 атм. в присутствии концентрированного h4PO4 (в качестве катализатора) производить спирт
- 3. Добавление галогеноводородов – HX
Галогениды водорода: хлористый водород, HCl
бромистый водород, HBr или йодистый водород, HI
Алкены реагируют с галогеноводородом HX при комнатной
температуры для получения галогеналкана.
C2h5 + HCl → C2H5Cl
Реакция взаимодействия этилена и хлороводорода
производит хлорэтан.
Реакция взаимодействия этилена и бромоводорода
производит бромэтан.
Реакция взаимодействия этилена и водорода
йодид дает йодоэтан.

- 4. Добавление гидроксильной группы Алкены реагируют с подкисленным манганатом калия(VII), KMnO4 для получения соединения диола C2h5 + [O] + h3O → C2h5 (ОН)2 или Используется для проверки наличия двойной связи С-С
- 5. Галогенирование Не требуется катализатор или ультрафиолет Алкены реагируют с галогеном при комнатной температуре. в присутствии тетрахлорметана CCl4 C2h5 + Cl2 → C2h5Cl2 C4H8 + Br2 → C4H8Br2 Используется для проверки наличия двойной связи С-С
- в. Реакция полимеризации Молекулы малых алкенов подвергаются реакции присоединения друг к другу при высокое давление 1000 атм и температура 200 °С
- Алканы Различия Алкены Cnh3n+2 Общая формула Cnh3n Насыщенные Типы углеводородов Ненасыщенные Одинарная связь Тип связи Двойная связь Низкий Сажа (несгоревший углерод) Высокий Замещение Тип реакции 1. Дополнение 2. Полимеризация Нет реакции Бромная вода Коричневый цвет обесцвеченный Нет реакции Подкисленный калий раствор манганита (VII) Фиолетовый цвет обесцвеченный Сравнение алканов с алкенами
- Изомеры – соединения с одинаковым молекулярным
формула, но другая структурная формула.
 Изомерия – это наличие двух и более соединений
имеют одинаковую молекулярную формулу, но разные
структурные формулы.
Изомеры имеют различные физические свойства, потому что они
имеют различное молекулярное строение.
Однако изомеры имеют одинаковые химические свойства
потому что они принадлежат к одному и тому же гомологическому ряду.
изомерия
Изомерия – это наличие двух и более соединений
имеют одинаковую молекулярную формулу, но разные
структурные формулы.
Изомеры имеют различные физические свойства, потому что они
имеют различное молекулярное строение.
Однако изомеры имеют одинаковые химические свойства
потому что они принадлежат к одному и тому же гомологическому ряду.
изомерия - Примеры двух изомеров бутана 2 молекулы имеют одинаковую молекулярную формулу но разные структурные формулы
Реклама
7.1: Введение в алкены — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31449
Objective
После завершения этого раздела вы сможете привести пример встречающегося в природе соединения, содержащего хотя бы одну двойную связь.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
- олефин
Учебные заметки
Алкены представляют собой класс углеводородов (т. е. содержащих только углерод и водород). Это ненасыщенные соединения, содержащие по крайней мере одну углерод-углеродную двойную связь. Двойная связь делает алкены более реакционноспособными, чем алканы. Олефин — это еще один термин, используемый для описания алкенов.
На рисунке показаны три алкена. Более сложный алкен широко известен как 1-ментен, но его полное правильное название IUPAC — 1-метил-2-(1-метилэтил)-циклогексен.
Алкены
Алкены представляют собой класс углеводородов (т. е. содержащих только углерод и водород). Это ненасыщенные соединения, содержащие по крайней мере одну углерод-углеродную двойную связь. Двойная связь делает алкены более реакционноспособными, чем алканы. Олефин — это еще один термин, используемый для описания алкенов. Алкеновую группу также можно назвать винильной группой, а атомы углерода, имеющие общую двойную связь, можно назвать виниловыми атомами углерода.
Алкеновую группу также можно назвать винильной группой, а атомы углерода, имеющие общую двойную связь, можно назвать виниловыми атомами углерода.
Структура этена — простейшего алкена
Этен часто записывается как CH 2 =CH 2 , что означает:
Двойная связь является общей для двух атомов углерода и не включает атомы водорода, хотя сокращенная формула не делает этот момент очевидным. . Обратите внимание, что молекулярная формула этилена C 2 H 4 , а этана C 2 H 6 .
Этен — не очень сложная молекула. Он состоит из четырех 1s 1 атомов водорода и двух 2s 2 2p x 1 2p y 1 атомов углерода. У этих атомов углерода уже есть четыре электрона, но каждый из них хочет получить еще четыре, чтобы иметь полную восьмерку (октет) в валентной оболочке. Наличие восьми валентных электронов вокруг углерода дает атому ту же электронную конфигурацию, что и неон, благородный газ. Углерод хочет иметь ту же конфигурацию, что и неон, потому что, когда он имеет восемь валентных электронов, углерод находится в своем наиболее стабильном, самом низком энергетическом состоянии. 92\) гибридизация. Два других угла (H-C=C) равны 121,5°.
Углерод хочет иметь ту же конфигурацию, что и неон, потому что, когда он имеет восемь валентных электронов, углерод находится в своем наиболее стабильном, самом низком энергетическом состоянии. 92\) гибридизация. Два других угла (H-C=C) равны 121,5°.
Жесткость этилена
Жесткость молекулы этилена обусловлена двойной связью углерода. Двойная связь состоит из одной сигма-связи, образованной перекрыванием гибридных орбиталей sp 2 , и одной пи-связи, образованной перекрытием параллельных 2 p-орбиталей. В этене нет свободного вращения вокруг сигма-связи углерод-углерод, потому что эти два атома углерода также имеют общую связь \(\pi\). Связь \(\pi\) образуется только при адекватном перекрытии между верхней и нижней p-орбиталями. Вращение p-орбиталей делает их равными 90° друг от друга, разрывая связь \(\pi\), потому что не будет перекрытия. Для вращения существует гораздо больший энергетический барьер, чем для сигма-связи углерод-углерод.
(a) Каркас с σ-связями образован перекрытием двух наборов однократно занятых углеродных sp 2 гибридных орбиталей и четырех однократно занятых водородных 1 s орбиталей с образованием электронно-парных связей. При этом используются 10 из 12 валентных электронов для образования в общей сложности пяти σ-связей (четыре связи C–H и одна связь C–C).
При этом используются 10 из 12 валентных электронов для образования в общей сложности пяти σ-связей (четыре связи C–H и одна связь C–C).
(b) На каждом атоме углерода остается одна однократно занятая негибридная 2 p z орбиталь, образующая π-связь углерод-углерод. (Примечание: условно в плоских молекулах осью, перпендикулярной плоскости молекулы, является ось z .)
Упражнение
1. Хотя существует только один алкен с формулой C (этен) и только один с формулой C 3 H 6 (пропен), есть несколько алкенов с формулой C 4 H 8 . Изобразите все возможные структуры линий связи для алкенов с формулой C 4 H 8 , включая все возможные структурные и стереоизомеры.
- Ответить
7.1: Introduction to Alkenes распространяется под лицензией CC BY-SA 4.








 Изомерия – это наличие двух и более соединений
имеют одинаковую молекулярную формулу, но разные
структурные формулы.
Изомеры имеют различные физические свойства, потому что они
имеют различное молекулярное строение.
Однако изомеры имеют одинаковые химические свойства
потому что они принадлежат к одному и тому же гомологическому ряду.
изомерия
Изомерия – это наличие двух и более соединений
имеют одинаковую молекулярную формулу, но разные
структурные формулы.
Изомеры имеют различные физические свойства, потому что они
имеют различное молекулярное строение.
Однако изомеры имеют одинаковые химические свойства
потому что они принадлежат к одному и тому же гомологическому ряду.
изомерия