Строение и функции белков 10 класс урок: Открытый урок «Строение функции белков» 10 класс
Открытый урок «Строение функции белков» 10 класс
Разработка урока по биологии
Макоевой Марьяны Мацуевны,
учителя биологии МКОУ «Лицей №1» г.п.Нарткала
Тема урока: «Строение и функции белков»
Слайд2
Цель: продолжить расширение и углубление знаний об органических веществах клетки на основе изучения строения и функций белков;
Задачи:
- Познакомиться с ведущей ролью белков в строении и жизнедеятельности клетки.
- Изучить строение макромолекул белка, имеющих характер информационных биополимеров.
- Изучить свойства и функции белков.
- Углубить знания о связи строения молекул веществ и их функции на примере белков
Ход урока
I. Организационный момент.
II. Изучение нового материала.
Слайд3
Жизнь
– есть способ существования белковых, существенным моментом которого является
постоянный обмен веществ с окружающей их внешней природой, причем с
прекращением этого обмена веществ прекращается и жизнь, что приводит к
разложению белка….
Ф.Энгельс
Изучая химический состав клетки, вы знаете, что все вещества входящие в ее состав делятся на две групп. Назовите эти группы. Сегодня на уроке мы продолжим изучать органические вещества – белки. Знания о белках имеют особенно важное значение для понимания всех процессов, происходящих в клетке. Белки лежат в основе всего живого. Поэтому эпиграфом нашего урока будет высказывание Энгельса: «Жизнь – есть способ существования белковых, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка…»
Вопрос. Какова роль белков в строении и жизнедеятельности клетки?
(В беседе учащиеся вспоминают известный из курса 8 – 9 классов материал о белках).
Среди
органических компонентов клетки самыми важными являются белки. Они очень
разнообразны и по строению, и по функциям. После удаления воды из клетки в
сухом остатке на первом месте по содержанию стоят белки. Они составляют 10 – 20
% от сырой массы и от 50 до 80% от сухой массы клетки. Белки называют также протеинами (греч. hrоtos – первый, главный). Этим названием хотели подчеркнуть
первостепенное значение белков для жизненного процесса.
Они составляют 10 – 20
% от сырой массы и от 50 до 80% от сухой массы клетки. Белки называют также протеинами (греч. hrоtos – первый, главный). Этим названием хотели подчеркнуть
первостепенное значение белков для жизненного процесса.
Белки представляют собой высокомолекулярные (молекулярная масса до 1,5 млн углеродных единиц) органические соединения. Кроме С, О, Н, N. в состав белков могут входить S, Р, Fе. Белки построены из мономеров, которыми являются аминокислоты. Поскольку в состав молекул белков может входить большое число аминокислот, то их молекулярная масса бывает очень большой. Так, молекулярная масса инсулина – 5700, белка – фермента рибонуклеазы – 12 700, яичного альбумина – 36 00, гемоглобина – 65 000. Для сравнения: молекулярная масса спирта – 46, уксусной кислоты 60, бензола 78.
Белки являются нерегулярными полимерами.
Вопрос. Что является мономером белков?
В
клетках разных живых организмов встречается свыше 170 различных аминокислот,
но бесконечное разнообразие белков создается за счет различного сочетания всего
20 аминокислот. Из них может быть образовано ими 2∙ 1018 комбинаций,
т. е. различных белков, которые будут обладать совершенно одинаковым составом,
но различным строением. Но и это огромное число не предел — белок может
состоять и из большего числа аминокислотных остатков, и, кроме того, каждая
аминокислота может встречаться в белке несколько раз.
Из них может быть образовано ими 2∙ 1018 комбинаций,
т. е. различных белков, которые будут обладать совершенно одинаковым составом,
но различным строением. Но и это огромное число не предел — белок может
состоять и из большего числа аминокислотных остатков, и, кроме того, каждая
аминокислота может встречаться в белке несколько раз.
Слайд 4
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (— NН2 с основными свойствами, другая — карбоксильной группой (—СООН) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. В зависимости от количества аминокислот и карбоксильных групп, входящих в состав аминокислот, различают:
Нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу.
Кислые
аминокислоты, имеющие
более одной карбоксильной группы.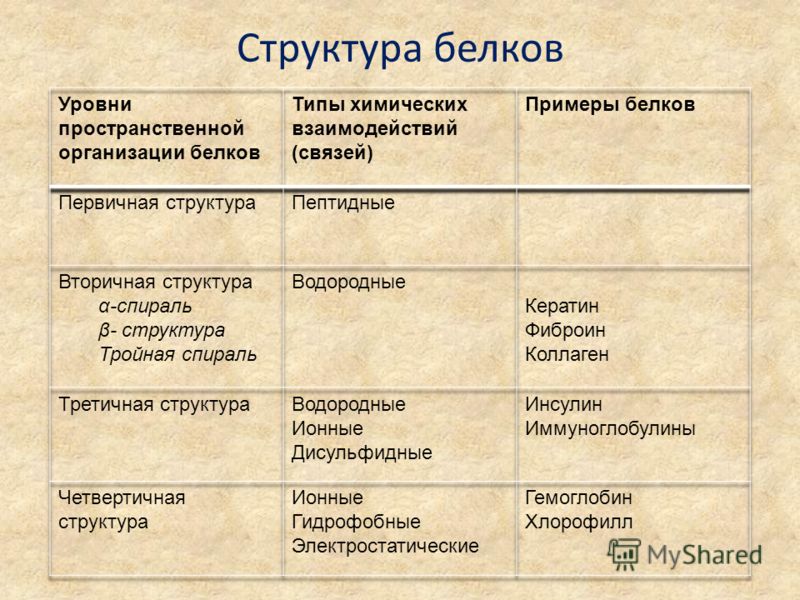
Основные аминокислоты, имеющие более одной карбоксильной группы.
Слайд 5
Наличие в одной молекуле аминокислоты и основной, и кислотной групп обусловливает их амфотерность и высокую реактивность. Через эти группы происходят соединения аминокислот при образовании белка. Связь образуется при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется
Полипептидные
цепи белков бывают очень длинными и включают самые различные комбинации
аминокислот. В состав белка может входить не одна, а две полипептидные цепи и
более. Так, в молекуле инсулина — две цепи, а иммуноглобулины состоят из
четырех цепей.
В состав белка может входить не одна, а две полипептидные цепи и
более. Так, в молекуле инсулина — две цепи, а иммуноглобулины состоят из
четырех цепей.
Вопрос. На какие группы можно разделить аминокислоты в зависимости от того, могут ли они синтезироваться в организме?
Бактерии и растения могут синтезировать все необходимые им аминокислоты из более простых веществ. Многие животные, в том числе и человек, способны синтезировать не все аминокислоты, поэтому так называемые незаменимые аминокислоты (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин) они должны получать с пищей в готовом виде. Заменимые аминокислоты – аминокислоты, которые в организме синтезируются.
В зависимости от аминокислотного состава белки бывают:
Слайд 6
Классификация
белков. Сложность
строения белковых молекул и чрезвычайное разнообразие их функций крайне
затрудняют создание единой четкой классификации белков, на какой – либо одной
основе.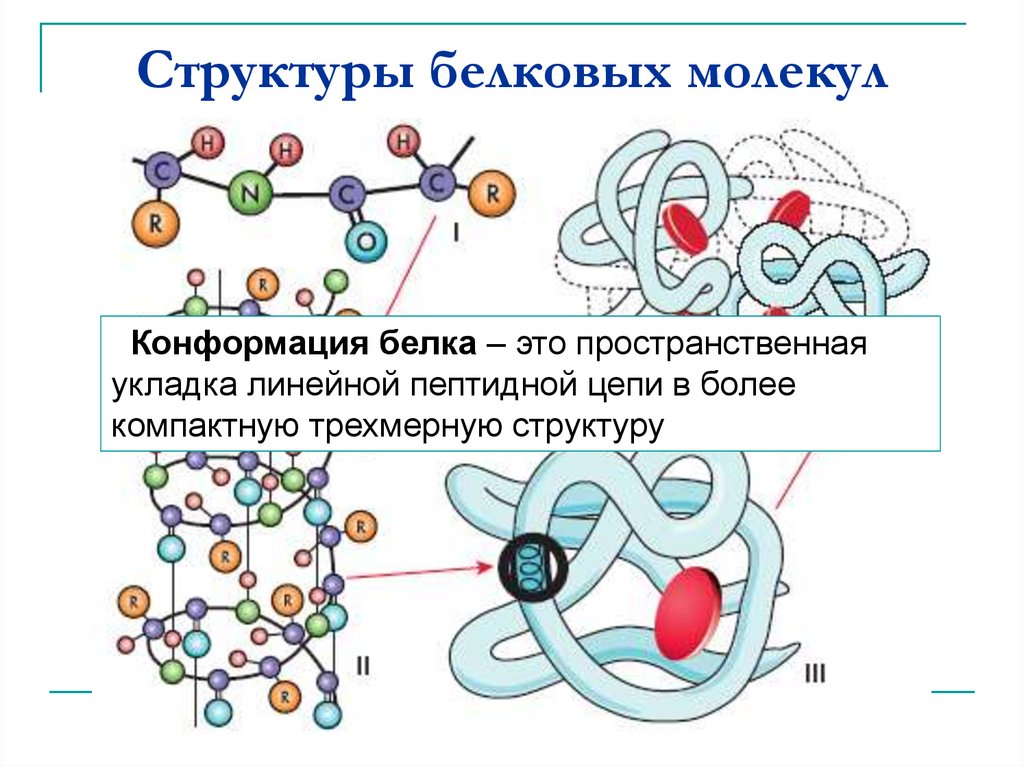
Самостоятельная работа(1 минута)
Прочитайте статью «Классификация белков» на 42 стр. и ответе на вопросы:
- Какие группы белков выделяют?
- Какие характеристики лежат в основе данной классификация?
Среди белков различают протеины, состоящие только из белков, и протеиды — содержащие небелковую часть (например, гемоглобин).
Кроме простых белков, состоящих только из аминокислот, есть еще и сложные, в состав которых могут входить углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды) и др.
I. Классификация белков по их составу.
II. Классификация белков по их структуре.
- Фибриллярные: наиболее важна
вторичная структура (третичная почти или совсем не выражена).
 Нерастворимы
в воде. Выполняют в клетке и в органах структурные функции, например в
составе соединительной ткани (коллаген, миозин, кератин)
Нерастворимы
в воде. Выполняют в клетке и в органах структурные функции, например в
составе соединительной ткани (коллаген, миозин, кератин) - Глобулярные: наиболее важна третичная структура. Растворимы – легко образуют коллоидные суспензии. Выполняют функции ферментов, антител и др.
- Промежуточные: фибриллярной природы, но растворимые. Примером может служить фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.
Слайд7
III. Классификация белков по их функциям.
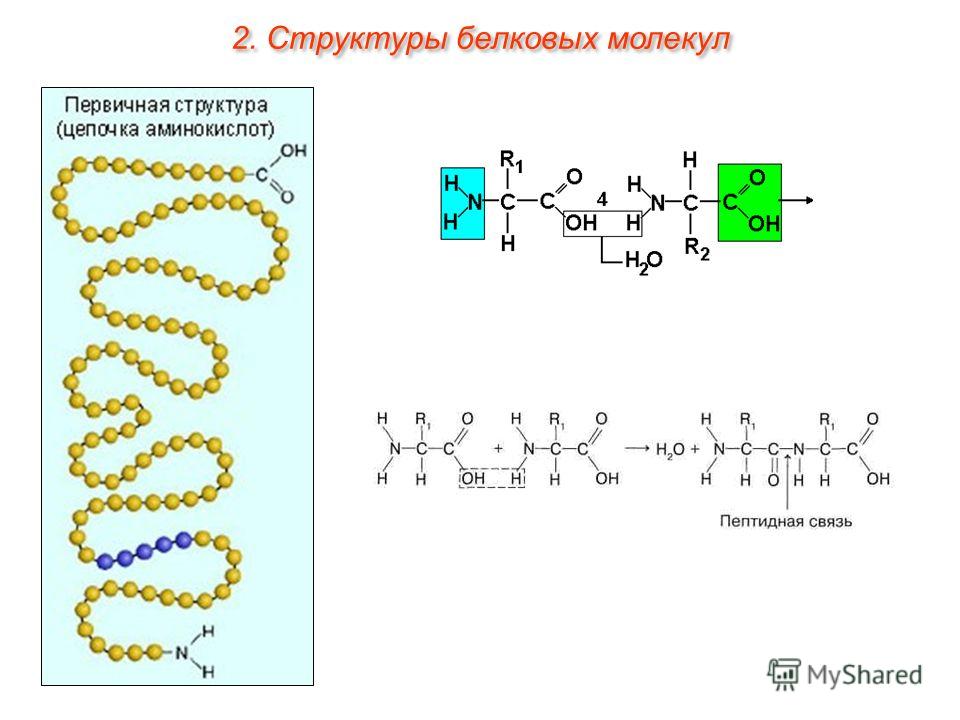
Уровни организации белковой молекулы. Молекулы белков могут принимать различные пространственные формы —
Слайд 8
Под
первичной структурой белка понимают число и
последовательность аминокислот, соединенных друг с другом пептидными связями в
полипептидной цепи.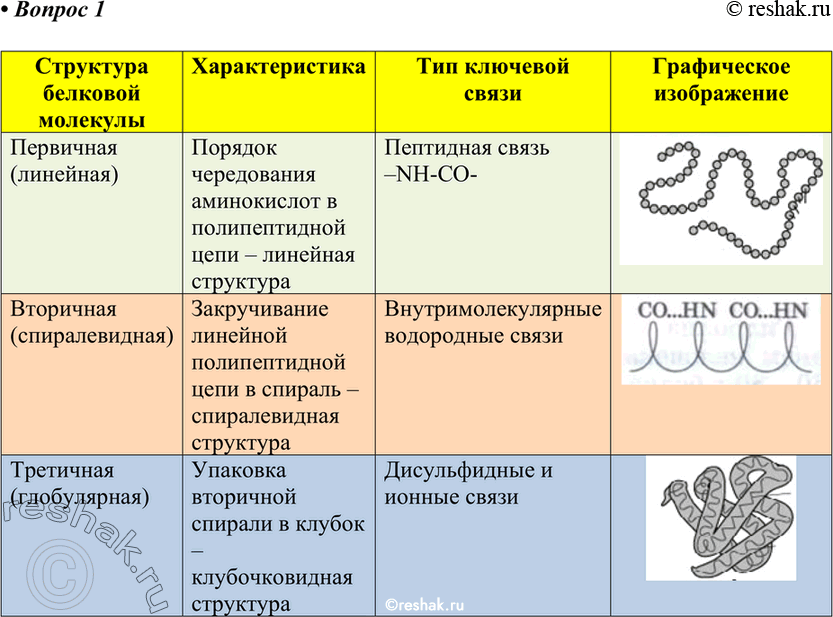 Первые исследования по выяснению аминокислотной
последовательности белков были выполнены в Кембриджском университете Ф.
Сэнгером, дважды удостоенным за свои работы Нобелевской премии. Сэнгер работал
с гормоном инсулином. Это был первый белок, для которого удалось выяснить
аминокислотную последовательность. Работа заняла ровно 10 лет (1944 – 1954гг.)
В молекуле инсулина входит 51 аминокислота, а молекулярная масса этого белка
равна 5733. Молекула состоит из двух полипептидных цепей. Удерживаемых вместе
дисульфидными мостиками
Первые исследования по выяснению аминокислотной
последовательности белков были выполнены в Кембриджском университете Ф.
Сэнгером, дважды удостоенным за свои работы Нобелевской премии. Сэнгер работал
с гормоном инсулином. Это был первый белок, для которого удалось выяснить
аминокислотную последовательность. Работа заняла ровно 10 лет (1944 – 1954гг.)
В молекуле инсулина входит 51 аминокислота, а молекулярная масса этого белка
равна 5733. Молекула состоит из двух полипептидных цепей. Удерживаемых вместе
дисульфидными мостиками
Первичная структура уникальна для любого белка и определяет его форму, свойства и функции.
В организме человека свыше 10 000 различных белков, и все они построены из одних и тех же 20 станрдантных аминокислот. Аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность однозначно определяется нуклеотидной последовательностью.
Слайд 9
Вторичная
структура белков возникает в результате образования
водородных связей между группами — СООН и — NН2 — разных
аминокислотных остатков полипептидной цепи.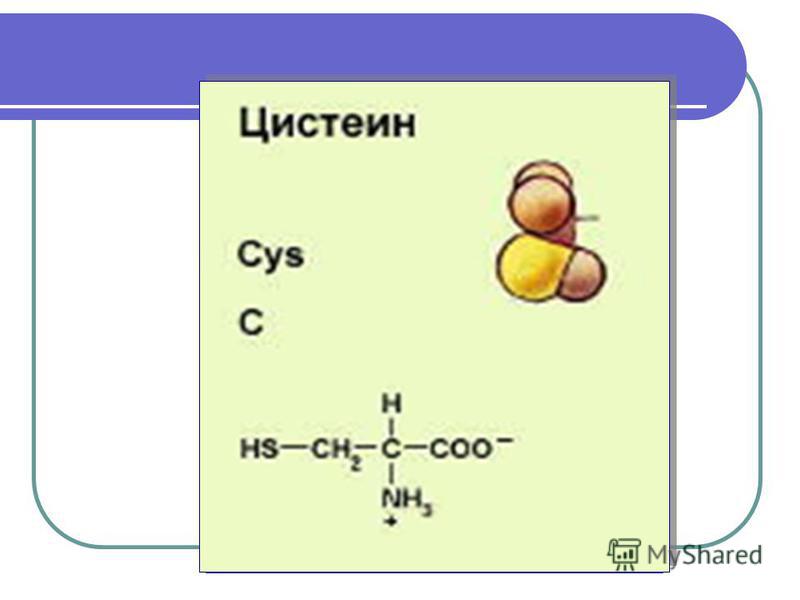 Хотя водородные связи малопрочные,
но благодаря их значительному количеству в комплексе они обеспечивают довольно
прочную структуру. Белковая молекула напоминает растянутую пружину. Ренгено –
структурный анализ показывает, что на один виток спирали приходится 3,6
аминокислотного остатка.
Хотя водородные связи малопрочные,
но благодаря их значительному количеству в комплексе они обеспечивают довольно
прочную структуру. Белковая молекула напоминает растянутую пружину. Ренгено –
структурный анализ показывает, что на один виток спирали приходится 3,6
аминокислотного остатка.
Слайд 10
Третичная структура
Слайд 11
Четвертичная
структура характерна не для всех белков. Она
возникает в результате соединения нескольких глобул в сложный комплекс.
Полипептидные цепи удерживаются в молекуле вместе за счет гидрофобных
взаимодействий, а также при помощи водородных и ионных связей Например,
гемоглобин крови человека представляет комплекс из четырех таких субъединиц:
из двух α — цепей и двух β-цепей. Две α — цепи содержат по 141 аминокислотному
остатку, а две β-цепи – по 146 остатков. Полную структуру гемоглобина
определили Кендрью и Перуц.
Две α — цепи содержат по 141 аминокислотному
остатку, а две β-цепи – по 146 остатков. Полную структуру гемоглобина
определили Кендрью и Перуц.
Некоторые вирусы, например вирус мозаики табака, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядочным образом.
Слайд12
Свойства белков.
Белки обладают рядом физико – химических свойств, вытекающих из их структурной организации. Это во многом обуславливает функциональную активность каждой молекулы.
Во — первых, белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
Во – вторых, белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
В –
третьих, белки термолабильны, т. е. проявляют свою активности в узких
температурных рамках.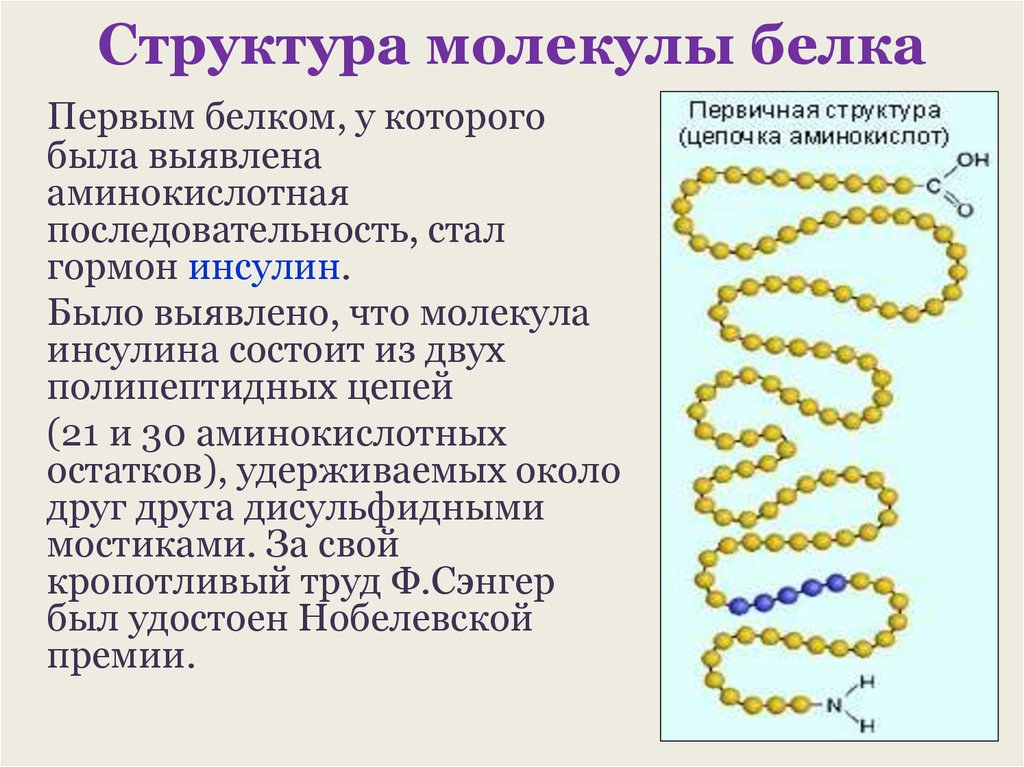
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникать под воздействием температуры, химических веществ, обезвоживания, облучения и других факторов. Если при денатурации не нарушена первичная структура, то при восстановлении нормальных условий белок способен воссоздавать свою структуру. Этот процесс называется ренатурацией. Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Слайд13
Функции белков. Белки выполняют целый ряд функций как в каждой клетке, так и в целом организме. Функции белков многообразны.
Белки
являются основой всех биологических мембран, всех органоидов клетки, таким
образом они выполняют структурную (строительную) функцию.
Так, коллаген является важным составным компонентом соединительной ткани,
кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный
компонент связок, стенок кровеносных сосудов.
Слайд14
Очень важна ферментативная функция белков. Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетке в сотни миллионов раз. К настоящему времени выделено и изучено более тысячи ферментов, каждый из которых способен влиять на скорость течения той или иной биохимической реакции.
Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент. В качестве коферментов выступают различные вещества, как правило, витамины и неорганические — ионы различных металлов.
Ферменты
участвуют как в процессах синтеза, так и распада. При этом ферменты действуют в
строго определенной последовательности, они специфичны для каждого вещества и
ускоряют только определенные реакции. Встречаются ферменты, которые катализируют
несколько реакций. Избирательность действия ферментов на разные химические
вещества связана с их строением. Каталитическая активность фермента
определяется не всей его молекулой, а определенным участком молекулы фермента,
который называется его активным центром.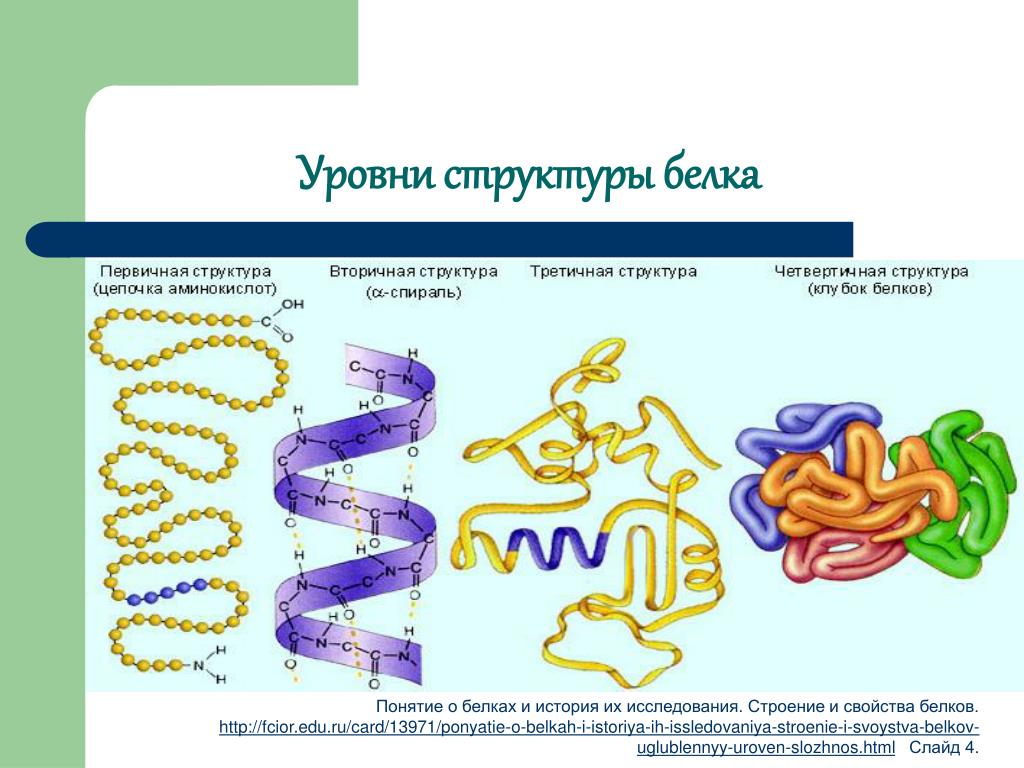 Субстрат взаимодействует с
ферментом, причем связывание субстрата осуществляется именно в активном центре.
Форма и химическое строение активного центра таковы, что с ним могут связываться
только определенные молекулы в силу их пространственного соответствия, они
подходят друг к другу, «как ключ к замку».
Субстрат взаимодействует с
ферментом, причем связывание субстрата осуществляется именно в активном центре.
Форма и химическое строение активного центра таковы, что с ним могут связываться
только определенные молекулы в силу их пространственного соответствия, они
подходят друг к другу, «как ключ к замку».
Рассмотрите рис. 16 «Схема образования комплекса «фермент—субстрат»
На заключительном этапе химической реакции комплекс «фермент—субстрат» распадается с образованием конечных продуктов и свободного фермента. Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества-субстрата.
Важное
значение имеет транспортная функция белков. Так, гемоглобин
переносит кислород из легких к клеткам других тканей. В мышцах эту функцию
выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу
липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Слайд15
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения. Так, антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки; интерфероны — универсальные противовирусные белки; фибриноген, тромбин и другие предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки
могут выполнять энергетическую функцию, являясь одним из
источников энергии в клетке.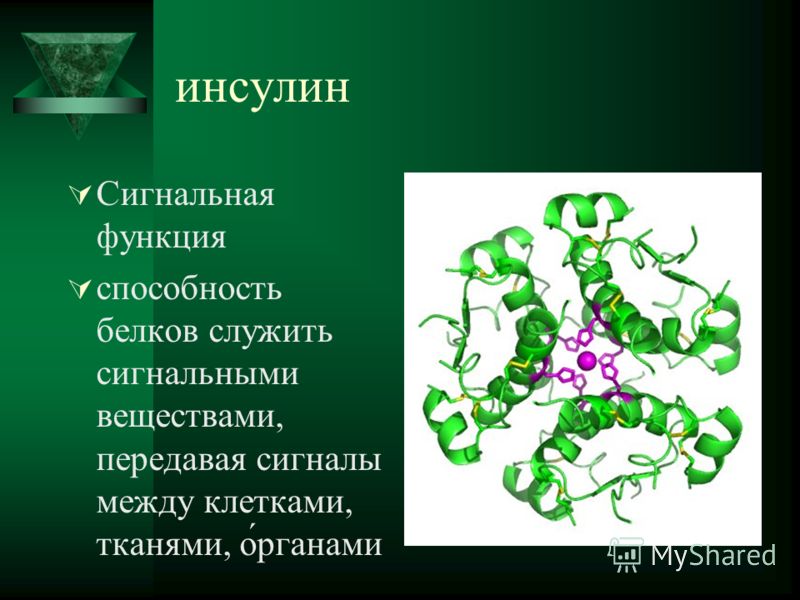 При полном расщеплении 1 г белка до конечных
продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки
используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении
белковых молекул, используются для построения новых белков.
При полном расщеплении 1 г белка до конечных
продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки
используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении
белковых молекул, используются для построения новых белков.
Роль белка в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяются, в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Слайд16
Выводы:
- Белки как макромолекулы – основа жизни.
- Мономерами белков являются аминокислоты.
- Первичная структура белка определяется генотипом.
- Вторичная, третичная и четвертичная структурная организация зависят от первичной структуры.
- Все биологические катализаторы – ферменты – имеют белковую природу.
- Белковые молекулы обеспечивают иммунологическую защиту
организма от чужеродных веществ.

Слайд17
Проверьте себя
- Каким образом происходит соединение двух аминокислот, приводящих к образованию дипептида?
- Каков характер связей в первичной, самой простой структуре молекулы белка?
- Как называется структура молекулы белка, возникающая путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот одной молекулы белка?
- Каким образом третичная структура превращается в четвертичную?
- Что такое антитела?
Слайд18
Каждому термину, указанному в левой колонке. Подберите соответствующее ему определение, приведенное в правой колонке.
- Первичная структура белка
- Процесс утраты белковой молекулой своей структурной организации.
2. Денатурация
Б. Часть молекулы фермента,
ответственная за присоединение и преобразование веществ.
3. Ренатурация
В. Последовательность аминокислотных остатков в полипептидной цепи, определенная генотипом.
4. Активный центр фермента
Г. Низкомолекулярные органические соединения различной природы, многие из которых являются предшественниками активных центров ферментов.
5. Витамины
Д. Процесс восстановления структурной организации белковой молекулы.
Слайд19
Домашнее задание: Изучить §11, ответить на вопросы на с. 46, заполнить таблицу, повторить § 9 -10. Подготовить сообщения или рефераты на темы: «Белки – биополимеры жизни», «Функции белков – основа жизнедеятельности каждого организма на Земле», «Многообразие ферментов, их роль в жизнедеятельности клеток и организмов».
Конспект урока биологии для 10 класса «Строение и функции белков»
Метапредметный урок на тему: «Строение и функции белков».
«Белки: докажите тождество, что жизнь-белок»
Тип урока (рассчитано на 2 академических часа): урок обобщения и усвоения новых знаний.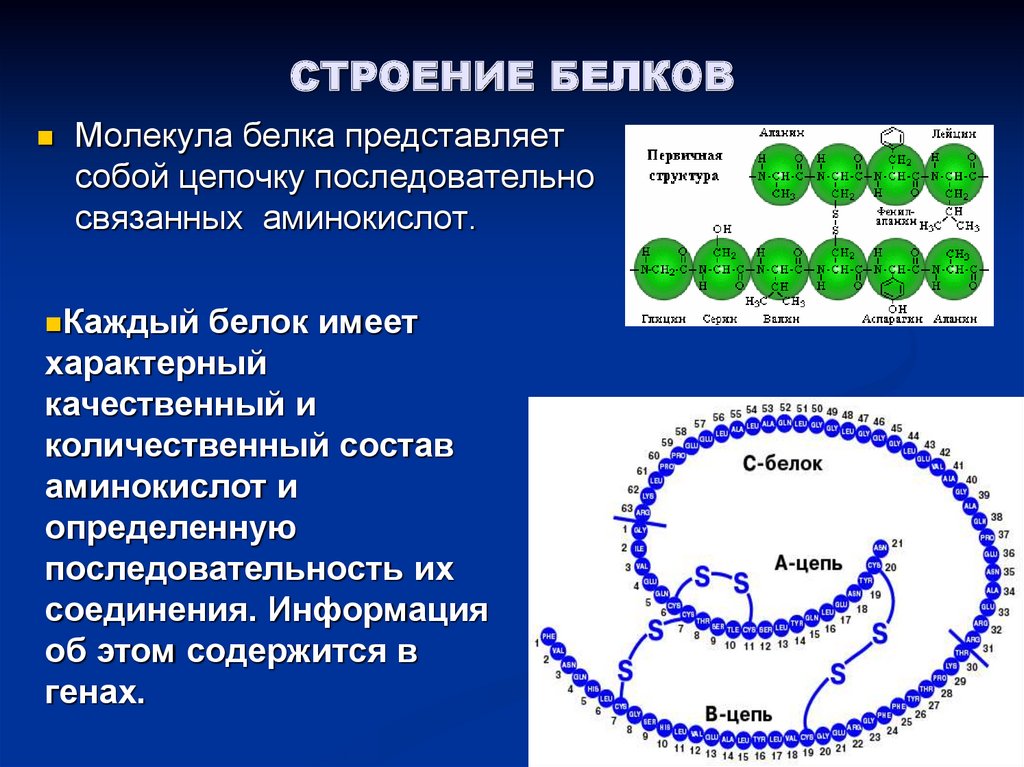
Триединая дидактическая цель урока
Обучающая: полученные на уроках биологии, химии, физики знания о свойствах, нахождении в природе, значении белков интегрировать; развить знания о химических свойствах белков, о типах химической связи на примере водородной и ковалентной, раскрыть роль белковых молекул в зарождении, развитии, существовании живых организмов на Земле.
Развивающая: развитие речи, практических навыков работы с лабораторным оборудованием, схемами, опорными и обобщающими конспектами, умения работать с учебником; развитие мышления, памяти; развитие умения проводить анализ, синтез и на их основе обобщение и выводы.
Воспитывающая: формирование нравственных отношений, умения работать самостоятельно и вдвоем, выслушать мнение одноклассников, доказывать свое мнение; воспитание бережного отношения к природным объектам, воспитание здорового образа жизни.
Задачи урока
1. Учащиеся должны обобщить химические свойства белков, этапы синтеза белка клетке и роль белков в живом организме.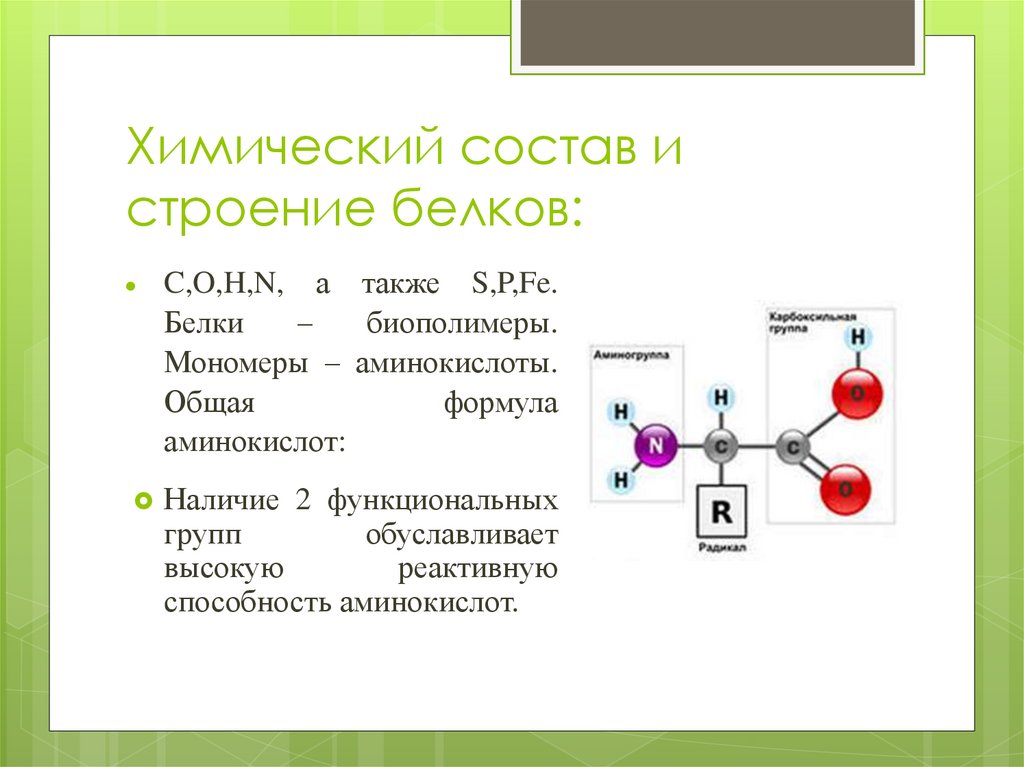
2. Уметь применять полученные знания при проведении качественных реакций на белок в лабораторных исследованиях, и выполнении упражнений по данной теме.
Оборудование урока: компьютер, медиапроектор, интерактивная доска; на доске – схема-конспект (блоки разных цветов), таблица “Важнейшие аминокислоты”; на партах – информационные учебные тексты в файлах, пробирки, химические стаканы, предметные стёкла, спиртовки, держатели пробирок, воронки, пипетки, спички.
Реактивы: растворы яичного белка, сульфата меди (II), гидроксида натрия, поваренной соли; концентрированный раствор азотной кислоты, кусочки шерстяной и синтетической ткани и мяса.
ХОД УРОКА
1. Организационный момент, приветствие
2. Актуализация знаний и целеполагание
Вступительное слово учителей химии и биологии (слова постепенно высвечиваются на презентации):
Меняя каждый миг свой образ прихотливой,
Капризна, как дитя и прозрачна, как дым,
Кипит повсюду жизнь в тревоге суетливой,
Великое смешав с ничтожным и смешным.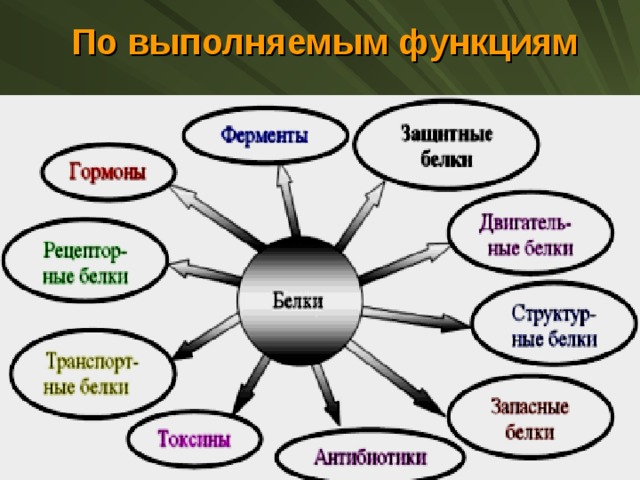 ..
..
(Семен Надсон)
Жизнь существует на Земле миллиарды лет. Она заполняет все уголки нашей планеты. Озёра, реки, моря, океаны, горы, равнины, пустыни, даже воздух – населены живыми существами. Что же такое жизнь? Откуда она взялась на Земле? Эти вопросы волнуют людей всегда. В течении веков копились наблюдения, проводились исследования, создавались теории. Одни служили основой новых исследований, другие гибли в виду несостоятельности… Пожалуй, ни одно естественнонаучное явление не вызвало такой острой борьбы мировоззрений, какая всегда сопровождала проблемы живого. А причина этой борьбы – в самом объекте познания, его уникальности, неповторимости и сложности.
Не стоит забывать и слова русских поэтов:
“Не то, что мните вы, природа,
Не слепок, не бездушный лик.
В ней есть душа, в ней есть свобода,
В ней есть любовь, в ней есть язык”.
Ф. И. Тютчев
В одной из книг Библии сказано: “Вначале было слово”. Современная наука по аналогии начинается фразой: “Вначале был белок”.
Знаменитый путешественник и естествоиспытатель Александр Гумбольдт ещё на пороге XIX века вознамерился “распутать этот гордиев узел жизненных процессов”. Но наука XIX века ещё не могла видеть всей глубины изучаемого процесса. Постепенно было накоплено достаточное количество экспериментального материала, чтобы дать следующее определение жизни:
“Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, при чём с прекращением этого обмена веществ прекращается и сама жизнь, что приводит к разложению белка.” (Ф.Энгельс)
Вступительное слово учителя химии: Современная наука представляет жизнь как переплетение сложнейших химических процессов взаимодействия белков между собой и другими веществами. Следует подчеркнуть, что отдельные очищенные белки не имеют характерных признаков живого. Эту точку зрения можно подтвердить высказыванием члена Королевского общества Британской Академии наук ДжонаД. Бернала:
Бернала:
“Нельзя приписывать свойство жизни какому-либо одному соединению, оно лишь проявляется в результате многообразных реакций, в которых участвуют различные соединения”.
Какова цель нашего урока?
Учащиеся: Доказать или опровергнуть тождество: жизнь=белок. Изучив при этом состав, строение и функции белков.
Учитель биологии и химии: Давайте вернемся к домашнему заданию. Проверим, как Вы его выполнили (первоначальные сведения о белках были получены в 9 классе и на уроках биологии).
ТЕКСТ с ошибками (прием “Лови ошибку”)
Белки – сложные органические полимеры, мономерами которых являются аминокислоты. В состав природных белков входят 20 аминокислот, 8 из них незаменимые, т.е. синтезируются в организме и их поступление в организм не обязательно вместе с пищей.
Белки, взаимодействуя с азотной кислотой, дают фиолетовое окрашивание. Данная реакция называется ксантопротеиновой реакцией. Вторичная структура белков – это чередование аминокислотных остатков в линейной структуре.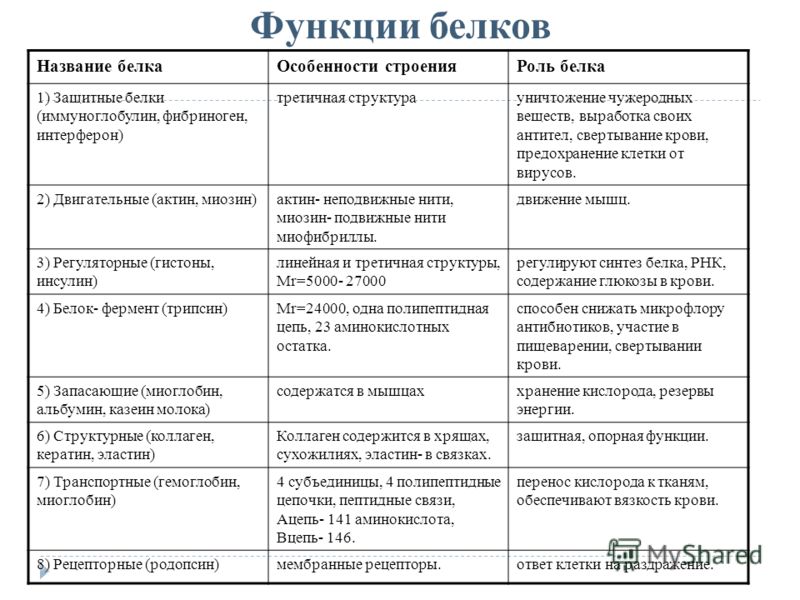 Денатурация – процесс изменения цвета белковой молекулы. Содержание белка в яйце меньше, чем в молоке и молочных продуктах. При варке яиц белок не меняет свой цвет.
Денатурация – процесс изменения цвета белковой молекулы. Содержание белка в яйце меньше, чем в молоке и молочных продуктах. При варке яиц белок не меняет свой цвет.
После работы с текстом найденные ребятами ошибки записываются на доску, безкомментарий и без объяснения правильных ответов. Данная запись сохраняется в течение всего урока для проведения рефлексии.
3. Изучение нового материала
Учащиеся самостоятельно работают в составе трёх групп. На интерактивную доску высвечивается три блока схемы-конспекта, выделенных определённым цветом (1 блок – жёлтый, 2 блок – зелёный, 3 блок – синий), которые затем нужно заполнить.
Сразу нужно отметить, что желтый цвет концентрирует внимание, зеленый снимает усталость, синий вдохновляет на поиск новых идей (сдоровьесберегающие технологии).
Для самостоятельной работы группам выданы учебные тексты по блокам соответствующего цвета. После каждого учебного текста приведены разноуровневые вопросы и задания к нему.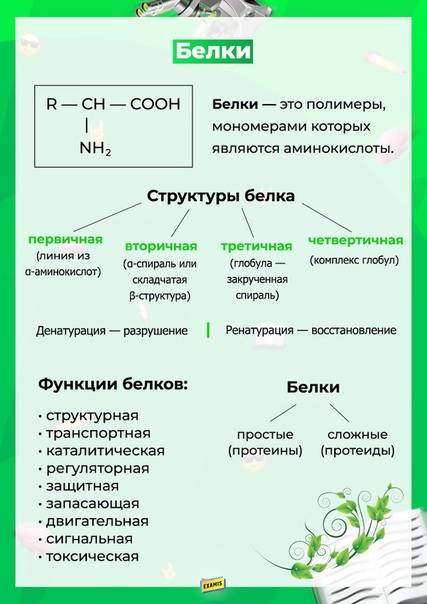 Вопросы первого уровня составлены по тексту, готовят учащихся к осмыслению и воспроизведению его. Вопросы второго уровня ставят перед учащимися познавательные задачи и требуют применения знаний. Рефлексия проводится в конце урока.
Вопросы первого уровня составлены по тексту, готовят учащихся к осмыслению и воспроизведению его. Вопросы второго уровня ставят перед учащимися познавательные задачи и требуют применения знаний. Рефлексия проводится в конце урока.
Алгоритм работы учащихся с учебными текстами:
прочитайте текст;
определите место полученной информации в этом блоке;
ответьте на вопросы, обсудите ответы в группе;
приготовьтесь к комментарию изученного материала по схеме-конспекту (выберете комментатора).
Блок №1 (желтого цвета). Состав и строение белков.
Консультант – учитель химии.
Вещества белковой природы известны давно. Начало их изучения положено в середине XVIII века итальянцем Я.Беккари, но только через 100 лет учёным удалось систематизировать свойства изученных белков, определить их состав и сделать вывод, что белки – это главный компонент живых организмов. Затем из белковых гидролизатов были получены продукты расщепления и возникли гипотезы о строении белков из аминокислот. Немецкий химик Эмиль Фишер первым выяснил как построены молекулы белков, и заложил основы их химического синтеза. В начале XX века Фишер доказал пептидную теорию строения белков, синтезировав полипептиды, состоящие из 3 – 18 аминокислотных остатков.
Немецкий химик Эмиль Фишер первым выяснил как построены молекулы белков, и заложил основы их химического синтеза. В начале XX века Фишер доказал пептидную теорию строения белков, синтезировав полипептиды, состоящие из 3 – 18 аминокислотных остатков.
Химический состав
Белки – очень сложные органические соединения. Их молекулы содержат огромное число атомов – от нескольких тысяч до нескольких миллионов, в зависимости от вида белка. Поэтому белки называют высокомолекулярными органическими соединениями – биополимерами или макромолекулами. Каков же элементный состав белков?
Предположения учащихся: C, H, O, N, S, P и ионы металлов.
(демонстрируем молекулы гемоглобина, миоглобина и коллагена).
Учащиеся проводят опыты по определению качественного состава белков
Опыт №1
В трех пробирках – кусок мяса, сыра и яичный белок. Нагреем их на пламени спиртовки. Наблюдаем на стенках пробирок продукты горения.
Записывае вывод: в составе белков присутствуют C, H, O.
Опыт №2
Нагреваем яичный белок с раствором NaOH, поместим влажную универсальную индикаторную бумагу в горлышко пробирки.
Голубая окраска индикатора указывает на щелочную реакцию раствора, ощущается запах аммиака.
Записываем вывод: в состав белка входит азот.
Опыт №3
К раствору яичного белка добавить NaOH и несколько капель Pb(NO3)2. Нагреть содержимое пробирки.
Записываем вывод: в состав яичного белка входит сера.
Вопросы для вывода:
В чём причина многообразия белков?
К какому классу органических веществ можно отнести белки? Каков их состав?
Какой уровень организации белка определяет его биологическую активность?
Затем группы начинают работать с учебными текстами и учебником §27. Белки. Химия 10 класс. О.С. Габриелян и др.
После самостоятельного изучения текста §27 (О.С. Габриелян) стр. 226 – 230 учебника, учащиеся приступают к изучению дополнительных материалов, выданных учителем.
Можно выделить четыре уровня в строении полипептидной цепи.
Дополнительный материал для работы 1 группы (даны в приложении 1)
Разноуровневые вопросы и задания.
Первый уровень.
Как из аминокислот образуются молекулы белка?
Что такое первичная структура белка?
Что представляет собой вторичная структура белка?
За счёт чего молекула белка удерживается в данной структуре?
Что такое третичная структура белка?
За счёт чего молекулы некоторых белков могут закручиваться в клубок и удерживаться в этом виде?
Что такое четвертичная структура белка?
Второй уровень.
Напишите уравнение реакции получения трипептида из дипептида (изпользуйте формулу цистеина или серина), назовите полученныйтрипептид.
Сколько дипептидов может быть получено из двух аминокислот: аланина и лизина? Приведите структуры этих пептидов.

Могут ли измениться свойства белка при нарушении последовательности аминокислотных звеньев в линейной полимерной цепи?
Чем отличается вторичная структура белка от первичной?
Чем отличается третичная структура от вторичной и первичной?
Блок №2 (зеленого цвета). Свойства белков.
Консультант – учитель химии.
Алгоритм работы учащихся по блоку №2 несколько отличается от приведённого выше. Так, учащиеся первой и второй групп должны разделиться на две подгруппы для проведения опытов 1 и 2, 3 и 4. (Результаты каждого опыта обязательно обсуждаются в группе).
После самостоятельного изучения текста §27 стр. 231 – 234 учебника, учащиеся приступают к изучению дополнительных материалов, выданных учителем и проводят лабораторные опыты.
Белки – амфотерные электролиты. Глобулярные белки растворяются в воде и солевых растворах с образованием коллоидных систем, доказательством чего служит их способность рассеивать свет. Фибриллярные белки имеют волокнистое строение и нерастворимы в воде. Молекулы белков содержат свыше 50 аминокислотных остатков, поэтому их молекулярная масса велика.
Фибриллярные белки имеют волокнистое строение и нерастворимы в воде. Молекулы белков содержат свыше 50 аминокислотных остатков, поэтому их молекулярная масса велика.
Дополнительный материал для работы 1 группы (даны в приложении 2)
Разноуровненвые вопросы и задания.
Первый уровень
Задача.
В одном из белков содержится 0,32% серы. Определите относительную молекулярную массу данного белка, если предположить (упрощённо), что в молекуле содержится один атом серы.
Задача.
Известно, что для взрослого человека необходимо 1,5г белка на 1кг массы тела в день. Зная свою массу, определите суточную норму потребления белка для своего организма.
Задача.
Известно, что при продолжительности жизни 70 лет обновление белков в организме происходит в среднем 200 раз. Предположите, сколько раз произошло обновление белков в вашем организме.
Задача.

Закончите уравнение гидролиза трипептида:
Какая структура белка разрушается при гидролизе?
Обратима ли реакция гидролиза?
Каково значение качественных реакций на белки? Почему их называют цветными?
Второй уровень.
Определите по тексту значения понятий “высаливание”, “денатурация”, “коагуляция”; сравните результаты опытов, сделайте вывод о токсичности солей различных металлов.
Можно ли использовать белки как противоядие при отравлениях?
В каких случаях и с какой целью можно было бы применить качественные реакции в жизни?
В чём заключается сущность гидролиза?
Предположите, можно ли пищевые белки заменить другими компонентами рациона (например, углеводами и жирами), чтобы обеспечить важнейшие процессы в организме. Почему?
Блок №3 (жёлтого цвета). Функции белков.
Консультант – учитель биологии.
Биологическое значение белков очень велико.
В ходе эволюции появилось 1010 различных белков. Вы видите сколь огромно их количество. Сложность живого организма характеризуется количеством белков. Если в кишечной палочке их 3000, то в организме человека больше 5 млн.
1.Что происходит с белками в организме?
2. Какая из функций является ведущей?
3. На какую функцию будут потрачены белки только в крайнем случае, если нет жиров и углеводов?Дополнительный материал для работы 3 группы (даны в приложении 3)
Разноуровневые вопросы и задания.
Первый уровень.
Какова роль ферментов в организме?
Как образованы названия групп ферментов?
Что лежит в основе деятельности гормонов?
Где образуются гормоны в организме?
Какие ещё функции выполняют белки?
Какие белки определяют иммунные свойства организма?
Второй уровень
Предположите, каковы функции каждой группы ферментов.

Приведите примеры известных вам ферментов, назовите их функции.
Какую болезнь вызывает недостаток инсулина у человека?
Могут ли гормоны оказать негативное влияние на организм?
Расскажите о СПИДе и профилактике этого страшного заболевания.
Заключительное слово учителя.
Белки представляют собой природные вещества, построенные главным образом из аминокислот. Все ферменты, некоторые гормоны и антибиотики, некоторые токсины относятся к белкам. Белки являются важнейшей составной частью живых организмов и выполняют различные биологические функции. Важное свойство белков – денатурация, которая имеет физиологическое значение. Денатурация приводит к антигенной чувствительности белка, а иногда и полному блокированию ряда иммунологических реакций, к инактивации ферментов и нарушению обмена веществ. Учёные предполагают, что процессы старения связаны с медленно протекающей денатурацией. Может быть, именно в преодолении этого процесса – ключ продления жизни. Понятия “жизнь” и “белок” неразрывно связаны. Насколько многообразны белки, настолько сложна, загадочна и многолика сама жизнь. Подтверждением этого может стать высказывание Гёте: “Я всегда говорил и не устаю повторять, что мир бы не мог существовать, если бы был так просто устроен”.
Понятия “жизнь” и “белок” неразрывно связаны. Насколько многообразны белки, настолько сложна, загадочна и многолика сама жизнь. Подтверждением этого может стать высказывание Гёте: “Я всегда говорил и не устаю повторять, что мир бы не мог существовать, если бы был так просто устроен”.
Рефлексия (ошибки в тексте выделены)
Белки – сложные органические полимеры, мономерами которых являются аминокислоты. В состав природных белков входят 20 аминокислот, 8 из них незаменимые, т.е. синтезируются в организме и их поступление в организм не обязательно вместе с пищей.
Белки, взаимодействуя с азотной кислотой, дают фиолетовое окрашивание. Данная реакция называется ксантопротеиновой реакцией. Вторичная структура белков – это чередование аминокислот в линейной структуре. Денатурация – процесс изменения цвета белковой молекулы. Содержание белка в яйце меньше, чем в молоке и молочных продуктах. При варке белок не меняет свой цвет.
5. Информация о домашнем задании
Творческое задание:
1. Почему жители крупных мегаполисов имеют проблему с кожей-дерматиты, полиносы?
2. Почему нельзя сушить кожаную обувь, прислонив ее непосредственно к батарее?
3. Собрав информацию об экологическом благополучии Благодарненского района, сделайте вывод о наиболее “комфортном” районе для счастливой жизни.
Разработка урока на тему: «Строение и функции белков»
Строение белков.
Длинные белковые цепи построены всего из 20 различных типов аминокислот. Биологи называют их «волшебными» аминокислотами. Аминокислоты имеют общий план строения, но отличаются друг от друга по строению радикала. Соединяясь, молекулы аминокислот образуют так называемые пептидные связи. Реакция, на рисунке 13, называется реакцией полимеризации. В результате взаимодействия аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты выделяется молекула воды, а освобождающиеся электроны образуют ковалентную связь, которая получила название пептидной.
Две аминокислоты, соединившись, образуют дипептид, три – трипептид. Продолжите ряд, (4 — тетрапепсид, 5 — пентапептид, 6 — гекса… , а много — полипептид). Если вам в тексте учебника попадутся термины «полипептид», «полипептидная молекула», то вы уже будете знать, что речь идет о молекуле белка.информация учителя.
Белковые молекулы могут быть короткими и длинными, например:
Инсулин — гормон поджелудочной железы, состоит из двух цепей: в одной 21, а в другой 30 аминокислотных остатков.
Миоглобин — белок, мышечной ткани, состоит из 153 аминокислот.
Коллаген- состоит из трех полипептидных цепей, каждая из которых содержит около 1000 аминокислотных остатков.
Помогите мне сформулировать определение понятия «белок».
Белок – это
— низкомолекулярное соединение или высокомолекулярное? (высокомолекулярное)
— можем мы назвать ее биополимером? (да)
— аргументируйте свою мысль (биополимеры – это крупные органические молекулы, состоящие из мономеров)
— что является мономером белковой молекулы? (аминокислоты)
— сколько видов аминокислот может входить в состав белковой молекулы? (20)
— белок относится к гомополимерам или гетерополимерам? Аргуменитруйте свою мысль. (к гетерополимерам, потому что в состав белков входят отличающиеся друг от друга мономеры – 20 аминокислот).
(к гетерополимерам, потому что в состав белков входят отличающиеся друг от друга мономеры – 20 аминокислот).
Белок это нерегулярный биополимер, мономерами которого являются аминокислоты.
По составу белки можно классифицировать:
протеины – состоят только из белков
протеиды – белок + небелковая часть:
а. гликопротеиды – аминокислоты + углеводы
б. липопротеиды – аминокислоты + жиры
в. нуклеопротеиды – аминокислоты + нуклеиновая кислота
г. металлопротеиды – аминокислоты + металлы (гемоглобин)
Уровни организации белковой молекулы (см. презентацию).
Молекулы белков имеют сложную пространственную структуру.
Линейная последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Вторичная структура белков представляет собой спираль или гармошку. Витки спирали или ребра гармошки удерживаются водородными связями между группами — СООН и —NН2— . Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.
Витки спирали или ребра гармошки удерживаются водородными связями между группами — СООН и —NН2— . Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру.
Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию, имеющую вид клубка (глобулу). Прочность третичной структуры обеспечивается ионными, водородными и дисульфидными (—S—S—) связями между остатками цистеина, а также гидрофобным взаимодействием.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех таких субъединиц, инсулин – из двух.
Денатурация и ренатурация белков.
Проблемные вопросы:
1. Почему врачи рекомендуют «сбивать» температуру больного, если она превышает 38 °С? (Из-за возможной тепловой денатурации белков).
2. Почему из сваренного яйца никогда не появится цыпленок? (Белки яйца необратимо теряют структуру из-за тепловой денатурации).
Денатурация — это утрата белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жестких условиях — и первичной структуры (рис. 19). В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей.
Денатурация может быть обратимой и необратимой, частичной и полной. Иногда, если воздействие денатурирующих факторов оказалось не слишком сильным и разрушение первичной структуры молекулы не произошло, при наступлении благоприятных условий денатурированный белок может вновь восстановить свою трехмерную форму. Этот процесс называется ренатурацией, и он убедительно доказывает зависимость третичной структуры белка от последовательности аминокислотных остатков, т. е. от его первичной структуры.
е. от его первичной структуры.
Вопросы к тексту:
Что называется денатурацией? (утрата белковой молекулой своей структурной организации)
Что может явиться причиной денатурации? (высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей)
В каком случае возможно восстановление структуры белковой молекулы? (если не произошло разрушение первичной структуры белка)
Как называется этот процесс? (ренатурация)
Какая структура белковой молекулы обеспечивает свойства белка и ее пространственную конфигурацию? (первичная)
Выполните опыты и объясните их результаты:
Белок яйца является типичным протеином. Выясните, что с ним произойдет, если на него подействовать водой, спиртом, ацетоном, кислотой, щелочью, растительным маслом, высокой температурой и т. д.
Нарисуйте таблицу. Какие функции белков вы знаете?
Функция | Сущность | Пример |
Структурная | Образование мембраны клеток и органоидов и др. | Коллаген кератин |
Регуляторная | Регулирование обмена веществ в организме | гормоны: инсулин глюкагон |
Защитная | -При попадании в организм чужеродных белков и микроорганизмов в лейкоцитах образуются защитные белки -защита от потери крови при ранении в результате свертывания | -антитела -фибриноген |
Транспортная | Присоединение и перенос химических элементов по организму | гемоглобин |
Сократительная | Осуществление всех типов движения | Актин, миозин |
Запасающая | Резерв для организма, плода | Яичный альбумин |
Токсическая | Змеиный яд | |
Энергетическая | Не основной, но источник энергии в клетке | Расщепление 1г |
Сигнальная | Узнавание молекул мембраной клетки | гликопротеины |
Ферментативная, каталитическая | Каталитическое ускорение биохимических реакций в клетке | Белки-ферменты Пепсин, трипсин |
Изучим подробнее каталитическую функцию белков.
Каталитическая функция — одна из важнейших функций белков. Все биохимические реакции протекают с огромной скоростью благодаря участию в них биокатализаторов — ферментов. Определение: ферменты — это белки, ускоряющие протекание реакций. Скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: 2Н2О2 — 2Н2О + О2. В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет до 5 млн. молекул Н2О2.
Известно более 2000 ферментов. Несмотря на большое количество и разнообразие ферментов, все их по особенностям строения можно разделить на две группы: простые белки и сложные белки. У сложных ферментов помимо белковой части имеется добавочная группа- кофактор (например, у многих витаминов).
Активный центр фермента взаимодействует с молекулой субстрата с образованием фермент-субстратного комплекса. Затем фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Согласно гипотезе, выдвинутой в 1890 г. Э. Фишером, субстрат подходит к ферменту, как ключ к замку, то есть пространственные конфигурации активного центра фермента и субстрата точно соответствуют друг другу. Субстрат сравнивается с «ключом», который подходит к «замку» — ферменту.
В 1959 году Д. Кошланд выдвинул гипотезу, по которой пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу называют гипотезой «руки и перчатки» (гипотезой индуцированного соответствия).
Поскольку все ферменты являются белками, их активность наиболее высока при физиологически нормальных условиях: большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 50 °С) каталитическая активность растет (на каждые 10 °С скорость реакции повышается примерно в 2 раза). При температуре выше 50 °С белок подвергается денатурации и активность фермента падает.
При повышении температуры до некоторого значения (в среднем до 50 °С) каталитическая активность растет (на каждые 10 °С скорость реакции повышается примерно в 2 раза). При температуре выше 50 °С белок подвергается денатурации и активность фермента падает.
Кроме того, для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность.
На скорость реакции влияет также концентрация субстрата и концентрация фермента. При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем; увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Урок биологии «Функции белков», 10 класс
Категория: Биология.
Урок биологии «Функции белков», 10 класс
Цель урока: используя знания о строении и свойствах белков расширить представления о функциях белков через творческую и исследовательскую деятельность (Слайд №2).
Задачи (Слайд №3)
Образовательная:
Расширить знания о белках как природных полимерах, о многообразии их функций во взаимосвязи со строением и свойствами.
Развивающие:
1.Развивать мышление учащихся и умение устанавливать причинно-следственные связи на примере изучения свойств и функций белка.
2. Развивать практические умения постановки цитологических опытов при установлении роли белков ферментов.
3. Развивать умение делать выводы на основе практических работ, развивать умение самостоятельно получать информацию из дополнительных информационных источников (информационная компетентность).
4.Развивать умение структурировать материал.
5. Формировать способность рефлексировать свою деятельность.
Воспитательная:
1.Воспитывать умение работать в группе
2. Воспитывать аккуратность учащихся при выполнении и оформлении практических работ и записей в тетради.
Тип урока: комбинированный с использованием исследовательской деятельности.
Технологии: тестовая, ИКТ, проблемного обучения.
Методы: частично-поисковый, словесный, наглядный, исследовательский.
Оборудование: презентация «Функции белков», компьютер с мультимедийным проектором, лабораторное оборудование к исследованию по теме «Ферментативная функция белка»: чашки петри, пероксид водорода, пипетка, кусочки вареного и сырого мяса, вареного и сырого картофеля, речной песок.
Методическое обеспечение:
- Раздаточный материал – текст «Белки» (Приложение №2), инструктивная карточка к лабораторной работе «Ферментативная функция белков» (Приложение №3), задание на установление соответствия между белками и их функциями (Приложение №4).

- Презентация Microsoft PowerPoint «Функции белков» (Приложение №1) – (POWER POINT).
- Актуальность использования средств ИКТ
- Возможность представления в мультимедийной форме уникальных информационных материалов.
Ход урока:
1.Организационное начало урока (приветствие, проверка готовности к работе, психологический настрой на урок) (Слайд № 4).
Притча.
“Жил мудрец, который знал все. Один человек захотел доказать, что мудрец знает не все. Зажав в ладонях бабочку, он спросил: “Скажи, мудрец, какая бабочка у меня в руках: мертвая или живая?” А сам думает: “Скажет живая – я ее умерщвлю, скажет мертвая – выпущу”. Мудрец, подумав, ответил: “Все в твоих руках”.
В наших руках сегодня создать такую атмосферу на уроке, при которой все будут чувствовать себя комфортно.
Эпиграфом нашего урока будут слова А. Эйнштейна «Радость видеть и понимать есть величайший дар природы» (Слайд №5).
2. Мотивация
Мотивация
Задание: сделайте анализ круговой диаграммы (Слайд №6) и ответьте на вопросы:
1). Каков химический состав клетки?
2). Каких веществ органической природы в клетке больше?
3). О чем свидетельствует сходство химического состава клеток?
«Жизнь — это способ существования белковых тел» (Ф. Энгельс) (Слайд №7).
Ни одно вещество химики не изучали так долго, как белок прежде, чем удалось разгадать их строение. От первых шагов на пути познания состава белка до расшифровки структуры прошло более двухсот лет.
Любой биологический объект, начиная от вирусов и заканчивая человеком, состоит в основном из белков (в пересчете на сухое вещество),
поэтому очень важно знать строение, свойства и функции этих соединений.
3.Личностная значимость изучаемого материала.
В сутки человек должен обязательно употреблять 100 г белка, иначе разовьется белковое голодание.
(Слайд №8) Недостаток белков в питании вызывает у детей замедление роста и развития, а у взрослых — глубокие изменения в печени, нарушение деятельности желез внутренней секреции, изменение гормонального фона, ухудшение усвоения питательных веществ, проблемы с сердечной мышцей, ухудшение памяти и работоспособности.
В 70 годах отмечались смертельные случаи у людей, длительное время соблюдающих низкокалорийные диеты с выраженным недостатком белка. Происходило это из-за серьезных нарушений в деятельности сердечной мышцы. Дефицит белка уменьшает устойчивость организма к инфекциям. Кроме того, белковая недостаточность часто сопровождается авитаминозом В12, А, Д, К и так далее, что также влияет на состояние здоровья.
Вопрос к учащимся: «Какой личностный смысл для каждого из Вас имеют эти факты?»
4. Целеполагание
Задание:
Установите соответствие между белками и их функциями
(Слайд №9).
Белки: Функции
А. Кератин 1. Строительная
Б. Гемоглобин 2. Запасающая
В. Актин 3. Защитная
Г. Антитела 4. Двигательная
Д. Миозин 5. Транспортная
Е. Фибриноген 6. Ферментативная
Ж. Коллаген 7. Регуляторная
З. Альбумин
И.Каталаза
К. Пепсин
Л.Инсулин
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Почему Вы не можете выполнить данное задание? (ответ: не хватает знаний)
Постановка проблемного вопроса. В состав клетки входят белки, жиры, углеводы, нуклеиновые кислоты, вода, минеральные вещества, но ни одно из веществ не выполняет столь специфичных функций, как белки. Справедливо ли это?
В состав клетки входят белки, жиры, углеводы, нуклеиновые кислоты, вода, минеральные вещества, но ни одно из веществ не выполняет столь специфичных функций, как белки. Справедливо ли это?
Учащиеся ставят цели и задачи работы на данном уроке.
5.Актуализация знаний.
Задания:
1.Работа со слайдами № 10, 11,12,13,14,15 и беседа по вопросам:
1). Что такое полимеры?
2) Используя схему, ответьте доказательно, к каким полимерам относятся белки?
3) Строение мономера белка.
4). Характеристика структурной организации белка.
2. Работа с текстом «Белки» (Слайд №16).
Вставьте в текст пропущенные термины и слова.
1). В состав белка входят следующие элементы___,___,____,___,____. 2).Белки – _______________,___________________ полимеры,
мономерами которых являются ____________________. 3).В состав природных белков входят ______ аминокислот, ___ из них незаменимые, т. е. синтезируются в организме и их поступление в организм не обязательно вместе с пищей. 4).Мономеры белка состоят из ___________,_________________.________________. 5).В состав всех мономеров белка входят___________,________________, а отличаются_______________.
е. синтезируются в организме и их поступление в организм не обязательно вместе с пищей. 4).Мономеры белка состоят из ___________,_________________.________________. 5).В состав всех мономеров белка входят___________,________________, а отличаются_______________.
6). Денатурация – процесс изменения нативной структуры белка.
6. Изучение нового материала
Свойства и функции белка определяются его структурой, строением и многообразием, поэтому даже малые его дефекты структуры имеют серьезные последствия.
Наследственное заболевание серповидно-клеточная анемия связано с тем, что при синтезе гемоглобина, состоящего приблизительно из 600 аминокислотных остатков, два из них заменяются на другие. Это приводит к нарушению функции гемоглобина: эритроциты больных приобретают серповидную форму и утрачивают способность к нормальному переносу кислорода (Слайд №17).
Это пример связи структуры и функции макромолекул.
Вам заранее было дано задание «Проанализировать информационные ресурсы сети-Интернет и составить несколько слайдов», а также сегодня мы проведем исследование. Данная деятельность позволит нам выяснить функции белков (Слайд 19-27)
Данная деятельность позволит нам выяснить функции белков (Слайд 19-27)
Результатом данной работы будет таблица, которую по ходу работы будем заполнять.
Функции белков (Слайд №18).
| Функция | Сущность | Пример |
| Структурная | Образование мембраны клеток и органоидов и др. структур | Коллаген, кератин |
| Регуляторная | Регулирование обмена веществ в организме | Некоторые гормоны – инсулин, глюкагон |
| Защитная | 1. При попадании в организм чужеродных белков и микроорганизмов в лейкоцитах образуются защитные белки. 2. Защита от потери крови при ранении в результате свертывания | Антитела Фибриноген |
| Транспортная | Присоединение и перенос химических элементов по организму | Гемоглобин |
| Сократитель-ная | Осуществление всех типов движения | Актин, миозин |
| Запасающая | Резерв для организма, плода | Яичный альбумин, казеин молока. |
| Токсическая | Змеиный яд, дифтерийный токсин | |
| Энергетичес-кая | Не основной, но источник энергии в клетке | Расщепление 1 г белка – 17 кДж |
| Сигнальная | Узнавание молекул мембраной клетки | Гликопротеины |
| Ферментативная или ката-литическая | Каталитическое ускорение биохимических реакций в клетке | Белки-ферменты (каталаза, пепсин, трипсин) |
Учащиеся представляют выполненную презентацию.
Давайте вспомним: «О чем в ядре клетки хранится наследственная информация» (представить логическую цепь: признак-вещество-реакция-белок-фермент). Павлов назвал ферменты «возбудителями жизни и первым актом жизненной деятельности».
Среди многочисленных функций белков особое место занимает ферментативная.
Наука о ферментах называется энзимологией, а ферменты – энзимами
Выражение И.П. Павлова «Не все белки – ферменты, но все ферменты белки» подчеркивают их химическую организацию.
Далее учитель объясняет строение и механизм действия фермента.
Чем же объясняется ускоряющее действие ферментов? (Слайд №28,29)
Каждый фермент имеет активный центр — определенная группа аминокислотных остатков. В активном центре происходит соединение фермента с субстратом (вещество, которое подлежит превращению) Форма активного центра и субстрата подходят друг другу как ключ к замку.
Процесс действия ферментов можно разделить на три стадии:
1. Фермент распознает субстрат и связывается с ним.
2. Образуется активный комплекс, состоящий из фермента и субстрата.
3. Отделение продукта в результате ферментативной реакции.
Свойства ферментов (анализ графиков) (Слайд 30-33)
Далее учащимся предлагается выполнить исследование.
Исследовательское задание
Лабораторная работа
«Ферментативное расщепление пероксида водорода в тканях организма»
Цель: сформировать знания о роли ферментов в клетках, закрепить умения проводить опыты и объяснять результаты работы.
Оборудование: свежий 3%-ный раствор пероксида водорода, штатив с пробирками, ткани растений (кусочки сырого и варёного картофеля) и животных (кусочки сырого и варёного мяса), пипетки, песок.
Ход работы:
1.Приготовьте четыре пробирки и поместите в первую пробирку — кусочек сырого картофеля, во вторую— кусочек варёного картофеля, в третью— кусочек сырого мяса, в четвёртую — кусочек варёного мяса. Капните в каждую из пробирок немного пероксида водорода. Пронаблюдайте, что будет происходить в каждой из пробирок.
2.Составьте таблицу, показывающую активность каждой ткани.
«Результаты исследования»
| № пробирки | Содержимое | Что делаю? | Что наблюдаю? |
| № 1 | |||
| № 2 | |||
| № 3 | |||
| № 4 | |||
| №5 |
Ответьте на вопросы (устно):
Ø В каких пробирках проявилась активность фермента? Объясните почему?
Ø Как проявляется активность фермента в живых и мёртвых тканях? Объясните наблюдаемое явление.
Ø Различается ли активность фермента в живых тканях растений и животных?
Ø Как вы считаете, все ли живые организмы содержат фермент каталазу, обеспечивающую разложение пероксида водорода?
Ответ обоснуйте.
Сделайте вывод.
Группы учащихся отчитываются о выполнении задания.
7. Рефлексия. Учащиеся выполняют задание, делают вывод (Слайд № 34).
8.Домашнее задание (Слайд № 35): параграф, найти классификацию ферментов в Интернете.
Интернет-ресурсы:
www.biology.asvu.ru — все о биологии.
www.biodev.ru — все о биологии.
Г. В. Ефимова, МКОУ СОШ № 16, Бирюсинск, Иркутская область
Метки: Биология
Урок по теме Белки | План-конспект урока по биологии (10 класс):
Тема: Белки
Тип урока: комбинированный
Цель: углубить знания о важнейших классах биологически значимых органических соединений — белках
Задачи:
Образовательные:
— сформировать представление о белках как непериодических линейных биополимерах, состоящих из различных аминокислотных остатков;
— охарактеризовать состав и химическое строение полипептидных молекул, а также первичную, вторичную, третичную и четвертичную структуру белка;
— ознакомить учащихся с важнейшими функциями белков;
— сформировать знания о качественных реакциях на молекулы белка.
Развивающие:
— способствовать развитию умения анализировать и обобщать ранее изученные факты
— совершенствовать навыки работы с лабораторным оборудованием
Универсальные учебные действия (познавательные, регулятивные, коммуникативные)
- Формировать умение извлекать информацию из таблиц, схем (П)
- Формировать умение выявлять сущность, особенности изучаемых веществ (П)
- Формировать умение на основе анализа ранее изученных фактов делать выводы (П)
- Формировать умения отвечать на поставленный вопрос, аргументировать (К)
- Формирование вербальных и невербальных способов коммуникации (К)
- Адекватно передавать информацию (К)
- Уметь корректировать свои действия и других (Р)
- Давать оценку результатам работы и т.д. (Р)
Воспитательные:
-воспитывать интерес к изучаемому предмету;
Универсальные учебные действия (личностные)
- Воспитывать культуру диалога (Л)
- Формировать позитивное отношение к себе и окружающему миру (Л)
- Формировать личностную мотивацию учебной деятельности (Л)
Основной дидактический метод: словесный метод обучения
Частные методы: побуждающий и подводящий диалоги, работа с текстом, метод иллюстрации, метапредметный подход,
Дидактические средства: таблицы «Функции белков», «Строение белковой молекулы»; реактивы: раствор куриного белка, растворы NaOH, CuS04, HN03; химическая посуда, спиртовка, держатели; тестовые задания; карточки с текстовым материалом; презентация к уроку; компьютер; проектор; экран; учебник.
Список использованных источников:
— Габриелян О.С., Маскаев Ф.Н., Пономарев С.Ю. Химия: Учебник для 10 кл. общеобразовательных учреждений. — М.: Дрофа, 2010.
— Габриелян О.С., Остроумов И.Г. Химия 10 класс: Настольная книга. — М.: Дрофа, 2004.
— Химия в схемах и таблицах для 8-11 классов общеобразовательных школ/ авт-сост — Э.М.Левина. В.В. Кириллов.– СПб.: Тригон, 2008.
— Щербатых Ю.В. Биология в схемах и таблицах: учебное пособие.- 2-е изд.,испр. – М.:Эксмо, 2007
Оформление доски: число, тема урока, таблицы, эпиграф «Жизнь – это способ существования белковых тел» Ф. Энгельс.
Белки – это непериодические полимеры, мономерами которых являются аминокислоты.
В организме человека встречается 5 млн типов белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Такое разнообразие обеспечивается сочетанием всего лишь 20 разных аминокислот, составляющих несколько сотен, а иногда и тысяч комбинаций. Порядок их чередования может быть самым разнообразным; благодаря этому возможно существование огромного числа молекул белка, отличающихся друг от друга. Например, из 20 остатков аминокислот теоретически можно составить около 2 • 1018 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит, и формой, и свойствами.
Например, из 20 остатков аминокислот теоретически можно составить около 2 • 1018 вариантов белковых молекул, различающихся порядком чередования аминокислот, а значит, и формой, и свойствами.
Белки делятся на протеины, содержащие только остатки аминокислот, и протеоды, содержащие еще и небелковую часть ( липо-, хромо-, глико-, фосфопротеиды)
Белки (по составу)
Протеины Протеиды
(простые) (сложные)
макромолекулы состоят только кроме остатков ά- аминокислот макромолекулы
из остатков ά- аминокислот. содержат другие группы атомов.
СТРОЕНИЕ БЕЛКОВЫХ МОЛЕКУЛ
- Что вы можете сказать о структуре белка, исходя из знаний биологии?
Молекула белка напоминает нитку, унизанную разноцветными бусинами и скрученную в виде спирали. «Бусины» — это аминокислотами. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка — около 300 аминокислот.
«Бусины» — это аминокислотами. Белки разного размера включают в себя от нескольких десятков до нескольких сотен и даже тысяч аминокислот. В среднем длина белка — около 300 аминокислот.
Последовательность соединения аминокислотных остатков в полипептидной цепи получила названиепервичной структурой белка. Углерод карбонильной группы, азот и связанные с ними четыре атома лежат в одной плоскости. Валентные углы при sp2-гибридном атоме углерода близки к 1200, при sp3-гибридном атоме углерода — 1100.
Группа атомов –СО – NH — , с помощью которой связаны две ά- аминокислоты, называется пептидной связью.
- На листочке написаны формулы трех аминокислот. Используя их получите трипептид.
h3N-Ch3-COOH C6H5-Ch3-CH –COOH HO-Ch3-CH-COOH
Nh3 Nh3
Первичная структура белковой молекулы играет чрезвычайно важную роль. Изменение только одной аминокислоты на другую может привести либо к гибели всего организма, либо к появлению совершенно нового вида. Замена одного остатка аминокислоты глутамина на валин в молекуле гемоглобина (содержащего 574 аминокислотные группы!) вызывает тяжелейшее заболевание — анемию, приводящую к смертельному исходу.
Изменение только одной аминокислоты на другую может привести либо к гибели всего организма, либо к появлению совершенно нового вида. Замена одного остатка аминокислоты глутамина на валин в молекуле гемоглобина (содержащего 574 аминокислотные группы!) вызывает тяжелейшее заболевание — анемию, приводящую к смертельному исходу.
- Какую еще структуру, кроме первичной вы знаете? (Вторичная структура белка)
- Что она представляет? (спираль)
- Как крепятся витки в молекуле? (за счет водородных связей между группами СО и NH)
В пространстве полипептидная цепь белка может располагаться двумя способами. Она может быть закручена в спираль, на каждом витке которой располагается 3,6 звена аминокислот с обращенными наружу радикалами. Отдельные витки скреплены между собой водородными связями между группами NH и СО различных участков цепи. Такая структура белка называется ά-спираль и наблюдается, к примеру, у ά-кератина (шерсть, волосы, рога, ногти).
Если боковые группы аминокислотных остатков не очень велики (глицин, аланин, серии), две полипептидных цепи могут быть расположены параллельно и скрепляться между собой водородными связями. При этом полоса получается не плоской, а складчатой. Это
При этом полоса получается не плоской, а складчатой. Это
β-структура белка, характерная, например, для фиброина шелка.
Таким образом, вторичная структура — это спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами СО и NH.
Полипептидные цепочки с определенной вторичной структурой могут быть по-разному расположены в пространстве. Это пространственное расположение ά-спирали или β-структуры в пространстве. получило название третичной структуры.
Третичная структура — пространственная конфигурация спирали в пространстве. Эта структура поддерживается за счет гидрофобных взаимодействий, водородных, дисульфидных, ионных связей.
По характеру «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.
Белки (по форме молекул)
Глобулярные Фибриллярные
(шаровидные) (нитевидные)
Для глобулярных белков более характерна ά-спиральная структура, спирали изогнуты, «свернуты». Макромолекула имеет сферическую форму. Они растворяются в воде и солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным белкам.
Макромолекула имеет сферическую форму. Они растворяются в воде и солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным белкам.
Для фибриллярных белков более характерна нитевидная структура. Они, как правило, не растворяются в воде. Фибриллярные белки обычно выполняют структурообразующие функции. Их свойства (прочность, способность растягиваться) зависят от способа упаковки полипептидных цепочек. Примером фибриллярных белков служат белки мускульной ткани (миозин), кератин (роговая ткань).
В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического и других взаимодействий образуют более сложные структуры.
Четвертичная структура — способ совместной укладки нескольких глобул. Есть не у всех белков.
Биологическая активность белков определяется третичной и четвертичной структурами.
ФУНКЦИИ БЕЛКОВ
- Какие функции белков вы проходили на уроках биологии?
Функции белков в клетке чрезвычайно многообразны.
Одна из важнейших — строительная (структурная) функция: белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внеклеточных структур. Белки, выполняющие структурные функции, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играетколлаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов — мукоидов, муцина и т. д. В комплексе с липидами (в частности фосфолипидами) белки участвуют в образовании биомембран клеток.
Исключительно важное значение имеет каталитическая (ферментативная) роль белков. Все ферменты — вещества белковой природы, они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз. Многочисленные биохимические реакции в живых организмах протекают в мягких условиях, при температурах, близких к 40°С, и значениях рН, близких к нейтральным. В этих условиях скорость протекания большинства реакций ничтожно мала, поэтому для их приемлемого осуществления необходимы специальные биологические катализаторы — ферменты. Как правило, ферменты — это либо белки, либо комплексы белков с каким-либо кофактором — ионом металла или специальной органической молекулой. Многие белки ускоряют химические реакции в сотни раз.
Как правило, ферменты — это либо белки, либо комплексы белков с каким-либо кофактором — ионом металла или специальной органической молекулой. Многие белки ускоряют химические реакции в сотни раз.
Двигательная функция живых организмов обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы: образование псевдоподий, мерцание ресничек и биение жгутиков у простейших, сокращение мышц у многоклеточных животных, движение листьев у растений и др.
В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин — специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Транспортная функция белков заключается в присоединении химических элементов (например, кислорода) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела.
Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина — белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. При поступлении в организм чужеродных белков или микроорганизмов в белых кровяных тельцах — лейкоцитах — образуются особые белки — антитела. Они связывают и обезвреживают несвойственные организму вещества (антигены).
Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу «белок — белок» способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков крови к свертыванию. Свертывание белка плазмы кровифибриногена приводит к образованию сгустка крови, что предохраняет от потери крови при ранениях.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции. Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Инсулин –регулирует содержание сахара в крови.
Белки служат и одним из источников энергии в клетке, т. е. выполняют энергетическую функцию. При полном расщеплении 1 г белка выделяется 17,6 кДж энергии.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ (цветные)
Биуретовая реакция.
При действии на белки раствора солей меди (II) в щелочной среде возникает сиреневое или фиолетовое окрашивание. К равным объемам раствора белка (можно использовать мясной бульон) и гидроксида натрия учитель добавляет несколько капель раствора сульфата меди (II). Голубая окраска раствора соли меди изменяется на фиолетовую (или несколько иную в зависимости от природы белка) за счет образования комплексных соединений.
Ксантопротеиновая реакция.
При действии на белки концентрированной азотной кислоты образуется желтая окраска, связанная с нитрованием ароматических колец в соответствующих аминокислотах. Если биуретовая реакция универсальна на все белки, то ксантопротеиновую дают только те полипептиды, которые содержат остатки фенилаланина, триптофана, тирозина. Таких аминокислот много в белках мышечных тканей (миозин), но почти нет в соединительных (желатин). Если на скорлупу вареного вкрутую яйца нанести несколько капель концентрированной азотной кислоты, происходит бурное вспенивание. Скорлупа состоит главным образом из карбоната кальция. Разрушая скорлупу, кислота проходит до белка. После промывания яйца под струей воды освободите его от остатков скорлупы. В месте попадания азотной кислоты осталось желтое пятно. Его окраска усилится и перейдет в оранжевую, если вырезанный фрагмент белка с пятном опустить в раствор щелочи или аммиака (нитроарен переходит в ацинитроформу).
Качественное определение серы в белках.
При горении белки издают характерный запах «жженого рога» (учащиеся говорят — горелых мух). В этом легко убедиться, если поджечь шерстяную нитку или пучок волос. В значительной степени этот запах определяется содержанием в белках атома серы (цистеин, метионин, цистин).
Наличие в белках этого элемента доказывают следующим образом. К раствору белка добавляют равный объем щелочи, нагревают до кипения и добавляют несколько капель раствора ацетата свинца. Выпадение черного осадка свидетельствует о присутствии в полученном растворе сульфид-аниона:
(Ch4COO)2Pb + S2- > PbS↓ + 2СН3СОО-
Урок 3. органические вещества: белки и нуклеиновые кислоты, и их значение. атф — Биология — 10 класс
Значение белков и нуклеиновых кислот
Роль белков и нуклеиновых кислот в живой природе
Почему именно белки и нуклеиновые кислоты отождествляются с понятием жизнь?
Белки занимают первое место среди всех содержащихся в живой материи макромолекул; на их долю приходится около половины сухой массы клетки. Велико также и их разнообразие; в одной клетке можно обнаружить тысячи различных видов белков. Из одного и того же набора – 20 аминокислот – организмы способны вырабатывать такие разнообразные продукты, как ферменты, гормоны, белок хрусталика глаза, перья, паутина, панцирь черепахи, белки молока, антибиотики, ядовитые вещества грибов и многие другие соединения. Информация о строении белков зашифрована в молекулах нуклеиновых кислот. Именно нуклеиновые кислоты отвечают за синтез белков и за передачу этой информации по наследству.
Велико также и их разнообразие; в одной клетке можно обнаружить тысячи различных видов белков. Из одного и того же набора – 20 аминокислот – организмы способны вырабатывать такие разнообразные продукты, как ферменты, гормоны, белок хрусталика глаза, перья, паутина, панцирь черепахи, белки молока, антибиотики, ядовитые вещества грибов и многие другие соединения. Информация о строении белков зашифрована в молекулах нуклеиновых кислот. Именно нуклеиновые кислоты отвечают за синтез белков и за передачу этой информации по наследству.
Белок кератин синтезируется у всех позвоночных. Он служит главным структурным компонентом волос, чешуи, рогов, шерсти, ногтей и перьев. Кератин как главный компонент входит также в состав плотного панциря черепахи. Информация о строении кератина зашифрована в молекуле ДНК. Последовательность мономеров кератина и кодирующей его ДНК у разных организмов различна, что отражает их генетическую индивидуальность.
Почему именно белки и нуклеиновые кислоты отождествляются с понятием жизнь? Какие особенности строения определяют многообразие белковых молекул, а также обеспечивают возможность хранения и реализации генетической информации нуклеиновыми кислотами?
Цели и задачи
Цель:
— выявление особенностей строения, определяющих многообразие белковых молекул, а также обеспечивающих возможность хранения и реализации генетической информации нуклеиновыми кислотами.
Задачи:
— раскрыть особенности химического состава, строения, структурной организации белков и нуклеиновых кислот;
— выяснить причины многообразия белков;
— установить связь между составом, строением молекул химических соединений и выполняемыми ими функциями на примере белков и нуклеиновых кислот;
— показать ведущую роль белков и нуклеиновых кислот в процессах жизнедеятельности; значение АТФ и витаминов в организме.
Узнаем, научимся, сможем
На уроке
мы узнаем:
— о составе, строении аминокислот, нуклеотидов, принципе их объединения в полипептидные и полинуклеотидные цепочки;
— о свойствах белков и причинах их денатурации;
— о разных видах нуклеиновых кислот;
мы научимся:
— устанавливать связь между составом, строением молекул химических соединений и выполняемыми ими функциями на примере белков и нуклеиновых кислот;
— характеризовать приведенные понятия и объяснять соотношения между ними:
— полимер, мономер;
— аминокислота, полипептид, белок;
— катализатор, фермент, активный центр;
— нуклеотид, нуклеиновая кислота, АТФ;
— анализировать результаты лабораторных опытов;
— различать ДНК, РНК, АТФ;
— решать задачи на определение последовательности нуклеотидов молекул ДНК; определение нуклеотидного состава ДНК;
мы сможем:
— объяснить причины многообразия белков;
— объяснить влияние факторов среды на белковые молекулы;
— выявить в ходе виртуальной лабораторной работы влияние изменения температуры на активность фермента каталазы.
Функции белков и нуклеиновых кислот
Выберите два верных ответа.
На основании последних научных достижений современной биологической науки дано следующее определение жизни: «Жизнь – это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов, построенные из сложных биологических полимеров – белков и нуклеиновых кислот».
Почему именно белки и нуклеиновые кислоты отождествляются с понятием жизнь?
Вспомните функции белков и нуклеиновых кислот.
При расщеплении и окислении молекул белков выделяется энергия, которая обеспечивает жизнедеятельность организма
Белки составляют материальную основу химической деятельности клетки, являются её основным строительным материалом, выполняют разнообразные функции в живой материи
Нуклеиновые кислоты имеют сложное строение, участвуют в регуляции процессов жизнедеятельности, являются структурной основой органоидов клетки
Нуклеиновые кислоты являются материальными носителями генетического кода, именно эта генетическая информация программирует структуру и метаболическую активность живых организмов
Сбросить Проверить Показать ответ
Глава 2: Структура белка — Химия
2. 1 Структура и свойства аминокислот 2,2 Образование пептидных связей и первичная структура белка 2,3 Структура вторичного белка 2,4 Супер -структура и протеина Motifs 799999000 2,4 Supersecondary Structure и протеина Motifs 7999999000 2,4 Supersecondary и протеина Motifs 7799999000 2,4. 2.5 Третичная и четвертичная структура белка 2.6 Сворачивание, денатурация и гидролиз белка 2.7 Ссылки
1 Структура и свойства аминокислот 2,2 Образование пептидных связей и первичная структура белка 2,3 Структура вторичного белка 2,4 Супер -структура и протеина Motifs 799999000 2,4 Supersecondary Structure и протеина Motifs 7999999000 2,4 Supersecondary и протеина Motifs 7799999000 2,4. 2.5 Третичная и четвертичная структура белка 2.6 Сворачивание, денатурация и гидролиз белка 2.7 Ссылки 2.1 Структура и свойства аминокислот
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры альфа-аминокислот, расположенных в линейной последовательности и соединенных между собой ковалентными связями.
Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры альфа-аминокислот, расположенных в линейной последовательности и соединенных между собой ковалентными связями.
Основные строительные блоки белков называются альфа (α) аминокислотами . Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется для обозначения того, что эти две функциональные группы отделены друг от друга одной углеродной группой. В дополнение к амину и карбоновой кислоте альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белков используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Базовая структура аминокислоты показана ниже:
Они отличаются друг от друга только положением R-группы. Базовая структура аминокислоты показана ниже:
Рисунок 2.1 Общая структура альфа-аминокислоты
Всего существует 20 альфа-аминокислот, которые обычно включаются в белковые структуры (рис. 2.x). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Существуют R-группы, которые преимущественно содержат углерод и водород и являются очень неполярными или гидрофобными. Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержат функциональные группы амина) или кислотными (содержат функциональные группы карбоновой кислоты). Эти аминокислоты способны образовывать полные заряды и могут иметь ионные взаимодействия. Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-группы обозначены обведенной/закрашенной частью каждой молекулы. Цвета обозначают определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевые, гидрофильные кислотные — синие, гидрофильные основные — розовые.
2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-группы обозначены обведенной/закрашенной частью каждой молекулы. Цвета обозначают определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевые, гидрофильные кислотные — синие, гидрофильные основные — розовые.
Щелкните здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты можно разделить на два более конкретных класса: алифатические аминокислоты и ароматические аминокислоты. Алифатические аминокислоты (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, самые простые из которых представляют собой глицин, а более сложные структуры — лейцин и валин. Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь зациклена с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь, и обычно обнаруживается в областях белка, где возникают складки или повороты.
Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь, и обычно обнаруживается в областях белка, где возникают складки или повороты.
Ароматические аминокислоты (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода/водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь различные физические и химические свойства в зависимости от их структуры. Например, гидроксильная группа, присутствующая в тирозине, увеличивает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот , обычно классифицируется как неполярная гидрофобная аминокислота, поскольку концевая метильная группа создает функциональную группу тиоэфира, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость. .
.
Полярные гидрофильные аминокислоты можно разделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы. В пределах полярный незаряженный класс , боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксилсодержащие аминокислоты, серин, треонин и цистеин и амидосодержащие аминокислоты, глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат), составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновой кислоты, способные к полной ионизации в растворе. Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные группы амина, которые могут быть протонированы для получения полного заряда.
Многие аминокислоты с гидрофильными R-группами могут участвовать в активном центре ферментов. Активный центр представляет собой часть фермента, которая непосредственно связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитические группы , состоящие из R-групп аминокислот, которые способствуют образованию и разрушению связей. Аминокислоты, играющие значительную роль в специфичности связывания активного сайта, обычно не соседствуют друг с другом в первичной структуре, а образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите далее в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют как трехбуквенные, так и однобуквенные кодовые аббревиатуры (таблица 2.1). Эти сокращения обычно используются для описания белковых последовательностей в биоинформатических и исследовательских целях.
Мысль Вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит индольное кольцо, включающее функциональную группу амина. Однако из-за близости структуры ароматического кольца и электроноакцепторной природы неподеленная пара электронов на атоме азота не может принять протон. Вместо этого они участвуют в формировании pi- связывается в пределах нескольких различных резонансных структур, возможных для индольного кольца. На рис. 2.3А показаны четыре возможные резонансные структуры индола. И наоборот, в иммидазольной кольцевой структуре гистидина есть два атома азота, один из которых участвует в формировании резонансных структур (азот №1 на рис. 2.3Б) и не может принимать протон, а другой (азот №3 ), у которого есть неподеленная пара электронов, которая может принять протон.
Рисунок 2.3 Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в структурах индольного и иммидизольного колец . (A) Показаны четыре резонансные структуры индольной кольцевой структуры, демонстрирующие, что неподеленная пара электронов на атоме азота участвует в образовании пи -связей. (B) Иммидазольная кольцевая структура имеет один атом азота (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй атом азота (3) имеет неподеленную пару электронов, доступную для приема протона. как показано.
Разработайте самостоятельно:Используя приведенный выше пример, опишите с помощью химической диаграммы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты являются хиральными молекулами. (рис. 2.4) Хиральная молекула не может быть совмещена со своим зеркальным отражением.
 Как левая и правая руки, в которых большой палец расположен в одном порядке, но являются зеркальными отражениями, а не одинаковыми, к хиральным молекулам присоединены одни и те же элементы в том же порядке, но они являются зеркальными отражениями, а не одним и тем же. Версии зеркального отображения хиральных молекул обладают физическими свойствами, которые почти идентичны друг другу, что делает очень трудным отличить их друг от друга или разделить. Из-за этой природы им дается специальное название стереоизомера, называемое 9.0003 энантиомеры и, собственно, сами соединения имеют одинаковые названия! Эти молекулы отличаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правом направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.
Как левая и правая руки, в которых большой палец расположен в одном порядке, но являются зеркальными отражениями, а не одинаковыми, к хиральным молекулам присоединены одни и те же элементы в том же порядке, но они являются зеркальными отражениями, а не одним и тем же. Версии зеркального отображения хиральных молекул обладают физическими свойствами, которые почти идентичны друг другу, что делает очень трудным отличить их друг от друга или разделить. Из-за этой природы им дается специальное название стереоизомера, называемое 9.0003 энантиомеры и, собственно, сами соединения имеют одинаковые названия! Эти молекулы отличаются тем, как они вращают простой поляризованный свет, и тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правом направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого. D- и L-формы аланина показаны на рис. 2.4B.
D- и L-формы аланина показаны на рис. 2.4B.Хотя большинство аминокислот могут существовать как в левовращающих, так и в правовращающихся формах, жизнь на Земле почти исключительно состоит из левовращающих аминокислот. Протеогенные аминокислоты, включаемые в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но использование D-аминокислот в природе встречается редко. Интересно, что когда мы будем обсуждать структуру сахаров в главе XX, мы обнаружим, что сахара, входящие в состав углеводов, почти всегда находятся в D-конформации. Никто не знает, почему это так. Тем не менее, доктора. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, падающих на Землю из космоса на метеоритах, больше L-конформации, чем D-конформации. Таким образом, тот факт, что мы состоим преимущественно из L-аминокислот, может быть результатом аминокислот из космоса.
Почему аминокислоты в космосе предпочитают L-конформацию? Никто точно не знает, но известно, что излучение также может существовать в лево- и правосторонней формах. Итак, существует теория, называемая гипотезой Боннера , которая предполагает, что преобладающие формы излучения в космосе (например, от вращающейся нейтронной звезды) могут приводить к селективному образованию гомохиральных молекул, таких как L- аминокислоты и D-сахара. Это все еще спекулятивно, но недавние находки метеоритов делают эту гипотезу гораздо более правдоподобной.
Итак, существует теория, называемая гипотезой Боннера , которая предполагает, что преобладающие формы излучения в космосе (например, от вращающейся нейтронной звезды) могут приводить к селективному образованию гомохиральных молекул, таких как L- аминокислоты и D-сахара. Это все еще спекулятивно, но недавние находки метеоритов делают эту гипотезу гораздо более правдоподобной.
Рис. 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все другие аминокислоты, входящие в состав белковых структур, являются хиральными по своей природе. (A) Демонстрирует хиральность основной альфа-аминокислотной структуры при использовании неспецифической R-группы. (B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и палочки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из НАСА
Обратите внимание, что D- и L-обозначения являются специальными терминами, используемыми для обозначения того, как молекула вращает простой поляризованный свет. Он не обозначает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию, например. R или S , ссылаясь на Rectus или Sinister соответственно.
Он не обозначает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию, например. R или S , ссылаясь на Rectus или Sinister соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. Когда получена абсолютная конфигурация, назначение R или S основано на правилах приоритета Кана-Ингольда-Прелога, , которые можно просмотреть, перейдя по ссылке и на рис. 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии. Однако цистеин вращает простой поляризованный свет в левовращающем или левостороннем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Однако цистеин вращает простой поляризованный свет в левовращающем или левостороннем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рис. 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Cahn Ingold Prelog для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, при этом наивысший атомный номер получает наивысший приоритет (A на диаграмме выше), а самый низкий атомный номер получает самый низкий приоритет. приоритет (D на схеме выше). Затем самый низкий приоритет отводится от зрителя, чтобы правильно сориентировать молекулу для дальнейшей оценки. Затем отслеживается путь приоритетов № 1, № 2 и № 3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедии
Аминокислоты — это цвиттерионы
отрицательный электрический заряд, а суммарный заряд всей молекулы равен нулю при определенном рН. Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренние соли . Заряды различных функциональных групп уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном рН. pH, при котором это происходит, известен как изоэлектрическая точка .
В отличие от простых амфотерных соединений, которые могут образовывать только катионные или катионные или анионные частицы, цвиттер-ион одновременно имеет оба ионных состояния. Аминокислоты являются примерами цвиттер-ионов (рис. 2.6). Эти соединения содержат аммониевую и карбоксилатную группу, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рисунок 2.6 Аминокислоты представляют собой цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа представляет собой цвиттерионную форму.
Поскольку аминокислоты являются цвиттерионами, а некоторые из них также обладают потенциалом ионизации в своих R-группах, их зарядовое состояние in vivo и, таким образом, их реакционная способность могут варьироваться в зависимости от pH, температуры и состояния сольватации аминокислоты. локальная микросреда, в которой они находятся. График стандарта 9Значения 0038 pK a для аминокислот показаны в Таблице 2.1 и могут быть использованы для прогнозирования состояния ионизации/заряда аминокислот и полученных из них пептидов/белков. Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменить относительные значения этих функциональных групп и обеспечить уникальные реактивные свойства в пределах активных центров ферментов (таблица 2. 1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Версия для печати значений pKa
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как pH, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа смещается выше или ниже своего pK значение , будет сдвиг в концентрациях ионизированных и неионизированных форм в пользу одного состояния по сравнению с другим. На рис. 2.7 показаны различные R-группы в их ионизированных и ионизированных состояниях, а также их предпочтительные состояния выше или ниже значения pK a .
Рис. 2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (С-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах. Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих pK и значений.
2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (С-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах. Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих pK и значений.
Как правило, ионизируемая группа будет поддерживать протонированное состояние в условиях pH ниже соответствующих значений pK и и будет способствовать депротонированному состоянию в условиях pH выше соответствующих значений pK a . Таким образом, значения pK и можно использовать для прогнозирования общего состояния заряда аминокислот и образующихся на их основе пептидов/белков в определенной среде. Например, если мы посмотрим на кривую титрования основной аминокислоты гистидина (рис. 2.8). Поскольку каждый pK и , зарядовое состояние аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком рН (полностью протонированный) до общего заряда -1 при очень высоком рН (полностью депротонированный).
2.8). Поскольку каждый pK и , зарядовое состояние аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком рН (полностью протонированный) до общего заряда -1 при очень высоком рН (полностью депротонированный).
Рис. 2.8 Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH. Каждая точка эквивалентности (pK a ) указана. (B) Показывает предпочтительное состояние ионизации гистидина после прохождения каждого pK значение .
Изображение адаптировано из L. Van Warren
Дополнительная практика:
Нарисуйте глутаминовую кислоту и предскажите общий заряд аминокислоты при pH = 1, pH = 1, pH = 1 7 и pH = 12.
Цистеин и образование дисульфидных связей
Цистеин также является уникальной аминокислотой, так как эта боковая цепь способна подвергаться обратимому окислению-восстановлению ( окислительно-восстановительная ) реакция с другими остатками цистеина с образованием ковалентной дисульфидной связи в окисленном состоянии (рис. 2.9). Вспомним, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они их приобретают. В ходе биологических окислительно-восстановительных реакций ионы водорода ( протонов ) часто удаляются вместе с электронами из молекулы при окислении, а при восстановлении возвращаются. Таким образом, если реакция теряет или приобретает протоны, это хороший признак того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция. Таким образом, присоединение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
2.9). Вспомним, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они их приобретают. В ходе биологических окислительно-восстановительных реакций ионы водорода ( протонов ) часто удаляются вместе с электронами из молекулы при окислении, а при восстановлении возвращаются. Таким образом, если реакция теряет или приобретает протоны, это хороший признак того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция. Таким образом, присоединение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью формирования трехмерной структуры белков и поэтому могут сильно влиять на функцию полученного белка. В клеточных системах образование/разрыв дисульфидных связей является реакцией, опосредованной ферментами, и может использоваться как механизм контроля активности белка. Дисульфидные связи будут более подробно обсуждаться в разделе 2. xx этой главы и в главе XX.
xx этой главы и в главе XX.
Рис. 2.9 Цистеин может окисляться с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
вернуться к началу страницы2.2 Образование пептидных связей и первичная структура белков
В клеточных системах белки связаны между собой большим комплексом ферментов, который содержит смесь РНК и белков. Этот комплекс называется рибосомой . Таким образом, поскольку аминокислоты связаны друг с другом, образуя определенный белок, они располагаются в совершенно определенном порядке, который диктуется генетической информацией, содержащейся в молекуле матричной РНК (мРНК). Этот специфический порядок аминокислот известен как 9 белков.0003 первичная последовательность
. Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно рассмотрен в главе XX. В этой главе основное внимание будет уделено только химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов/белков.
В этой главе основное внимание будет уделено только химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов/белков. Первичная последовательность белка связана вместе с использованием синтеза дегидратации (потеря воды), который объединяет карбоновую кислоту вышестоящей аминокислоты с функциональной группой амина нижестоящей аминокислоты с образованием амидной связи ( Рисунок 2.10). Точно так же обратная реакция гидролиз и требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи. Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для построения белковых молекул, тогда как класс ферментов, называемых протеазами , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут присоединены к концевой карбоксильной кислоте растущего белка. Таким образом, белки всегда синтезируются направленно, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как N-C-синтез .
Последующие аминокислоты будут присоединены к концевой карбоксильной кислоте растущего белка. Таким образом, белки всегда синтезируются направленно, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как N-C-синтез .
Рис. 2.10 Формирование пептидной связи. Добавление двух аминокислот для образования пептида требует дегидратационного синтеза.
Как отмечалось выше в разделе, посвященном цвиттерионам, амидные связи имеют резонансную структуру, которая не позволяет неподеленной паре электронов азота действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленная пара электронов азота участвует в pi — образование связи с карбонильным углеродом, образующим двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N внутри амидной структуры фиксирована в пространстве и не может вращаться из-за характера связи pi-.
Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N внутри амидной структуры фиксирована в пространстве и не может вращаться из-за характера связи pi-.
Изображение из В.К. Chang
Вместо этого они участвуют в образовании связи пи- с карбонильным углеродом. Кроме того, связь C-N внутри амидной структуры фиксирована в пространстве и не может вращаться из-за pi- символ связи. Это создает фиксированное физическое расположение R-групп внутри растущего пептида либо в конформациях цис , либо транс . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс . Конформация цис предпочтительна только с одной конкретной аминокислотой, пролином . Это связано с циклической структурой R-группы пролина и стерическими затруднениями, возникающими, когда пролин принимает конформацию -транс- (рис. 2.12). Таким образом, остатки пролина могут оказывать большое влияние на трехмерную структуру получаемого пептида.
2.12). Таким образом, остатки пролина могут оказывать большое влияние на трехмерную структуру получаемого пептида.
Рисунок 2.12 Цис и Транс Конформация R-групп аминокислот. На верхней диаграмме показаны конформации цис и транс двух соседних аминокислот, отмеченных как X и Y, которые обозначают любую из 20 аминокислот, кроме пролина. В 9В конформации 0038 транс R-группа аминокислоты X повернута на другую сторону молекулы по сравнению с R-группой аминокислоты Y. Эта конформация дает наименьшее количество стерических затруднений по сравнению с цис-. конформация, в которой R-группы расположены на одной стороне и в непосредственной близости друг от друга. На нижней диаграмме любая аминокислота X расположена выше остатка пролина. Из-за циклизации R-группы пролина с амидным азотом в основной цепи это смещает положение R-группы пролина, чтобы она была ближе к R-группе от аминокислоты X, когда она принимает транс конформация. Таким образом, пролин предпочитает конформацию цис , которая имеет меньше стерических препятствий.
Таким образом, пролин предпочитает конформацию цис , которая имеет меньше стерических препятствий.
Белки представляют собой очень большие молекулы, содержащие множество аминокислотных остатков, связанных друг с другом в очень определенном порядке. Размер белков варьируется от 50 аминокислот в длину до самого большого из известных белков, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептидов (рис. 2.13).
Рис. 2.13. Пептиды и белки представляют собой макромолекулы, построенные из длинных цепей аминокислот, соединенных амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют характер укладки белка в зависимости от окружающей среды белка (т. е. если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде). , тогда как, если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждую позицию в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее количество возможных трипептидов будет 20 X 20 X 20 или 20 3 , что равно 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот. Было бы 20 40 вариантов, или умопомрачительные 1,09 X 10 52 возможные варианты последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот в белке помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма необходима для функциональной активности белка (т.е. форма белка = функция белка ). Для белков, находящихся внутри водной среды клетки, гидрофобные аминокислоты часто будут находиться внутри белковой структуры, тогда как водолюбивые гидрофильные аминокислоты будут находиться на поверхности, где они могут образовывать водородные связи и взаимодействовать с молекулами воды. Пролин уникален тем, что он имеет единственную R-группу, которая образует циклическую структуру с функциональной группой амина в основной цепи. Именно эта циклизация заставляет пролин принимать цис-конформация , а не транс-конформация внутри основной цепи. Этот сдвиг структуры часто будет означать, что пролины представляют собой положения, в которых внутри белка происходят изгибы или изменения направления. Метионин уникален тем, что служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и поэтому могут окисляться другими цистеиновыми остатками с образованием ковалентных дисульфидных связей в структуре белка (рис.
Именно эта трехмерная форма необходима для функциональной активности белка (т.е. форма белка = функция белка ). Для белков, находящихся внутри водной среды клетки, гидрофобные аминокислоты часто будут находиться внутри белковой структуры, тогда как водолюбивые гидрофильные аминокислоты будут находиться на поверхности, где они могут образовывать водородные связи и взаимодействовать с молекулами воды. Пролин уникален тем, что он имеет единственную R-группу, которая образует циклическую структуру с функциональной группой амина в основной цепи. Именно эта циклизация заставляет пролин принимать цис-конформация , а не транс-конформация внутри основной цепи. Этот сдвиг структуры часто будет означать, что пролины представляют собой положения, в которых внутри белка происходят изгибы или изменения направления. Метионин уникален тем, что служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и поэтому могут окисляться другими цистеиновыми остатками с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто необходимы для правильного фолдинга и функционирования белка (рис. 2.14).
2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто необходимы для правильного фолдинга и функционирования белка (рис. 2.14).
Рисунок 2.14 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, образующие гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона и регулирования уровня глюкозы в крови.
Изображение: CNX OpenStax через Wikimedia Commons
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну укладки, характерному для этого конкретного белка. Таким образом, первичная последовательность представляет собой линейный порядок аминокислот, поскольку они связаны друг с другом в белковой цепи (рис. 2.15). В следующем разделе мы обсудим укладку белков, которая приводит к образованию вторичных, третичных и иногда четвертичных структур белка.
2.15). В следующем разделе мы обсудим укладку белков, которая приводит к образованию вторичных, третичных и иногда четвертичных структур белка.
Рис. 2.15 Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального института исследования генома человека)
вернуться к началу2.3 Вторичная структура белка
связи в амидной связи, когда аминокислоты соединяются друг с другом, и узнал, что это приводит к тому, что R-группы аминокислот благоприятствуют конформации транс (за исключением пролина, который способствует цис конформация). Эта жесткость с белковым остовом ограничивает потенциал складывания и структуру полученного белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и способствовать гибкости и уникальным схемам складывания, наблюдаемым в белках. Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряют торсионные углы Phi (Φ) и Psi (ψ). Торсионный угол Phi (Φ) измеряет вращение вокруг связи α-углерод-азот путем оценки угла между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод — карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо на связь α-углерод — карбонильный углерод (рис. 2.16).
Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряют торсионные углы Phi (Φ) и Psi (ψ). Торсионный угол Phi (Φ) измеряет вращение вокруг связи α-углерод-азот путем оценки угла между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз по связи α-углерод-азот в плоскость бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод — карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо на связь α-углерод — карбонильный углерод (рис. 2.16).
Рис. 2.16 Углы кручения Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, соседними со связью, как показано на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, как показано на нижней панели.
Он измеряется как угол между двумя атомами азота, примыкающими к связи, как показано на нижней панели.
В то время как связи вокруг α-углерода могут свободно вращаться, предпочтительные торсионные углы ограничены меньшим подмножеством возможностей, поскольку соседние атомы избегают конформаций, которые имеют высокие стерические затруднения, связанные с ними. Г.Н. Рамачандран создал компьютерные модели малых пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). С его результатами он создал то, что известно как график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных углов кручения Phi (Φ) и Psi (ψ) (рис. 2.17)
Рисунок 2.17 Заговор Рамачандрана. Благоприятные и крайне благоприятные торсионные углы Phi (Φ) и Psi (ψ) обозначены желтым и красным цветом соответственно. Указаны валентные углы для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
Cooper
В каждом белке небольшие участки белка могут принимать специфические повторяющиеся паттерны укладки. Эти специфические мотивы или узоры называются вторичной структурой . Две наиболее распространенные вторичные структурные особенности включают альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородные связи между основной аминовой и карбонильной функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18 Вторичные структурные признаки в структуре белка. Правосторонняя альфа-спираль и бета-складчатая пластина являются общими структурными мотивами, встречающимися в большинстве белков. Они удерживаются вместе водородными связями между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из Википедии Школы биомедицинских наук
Альфа-спираль
Для альфа-спиральных структур правосторонняя спираль очень распространена, тогда как левосторонняя спираль очень редка. Это связано с углами закручивания Phi (Φ) и Psi (ψ), необходимыми для получения левосторонней альфа-спиральной структуры. Белку пришлось бы свернуться и закрутиться под многими неблагоприятными углами, прежде чем он получил бы правильную ориентацию для левой спирали. Таким образом, они не очень распространены в природе.
Это связано с углами закручивания Phi (Φ) и Psi (ψ), необходимыми для получения левосторонней альфа-спиральной структуры. Белку пришлось бы свернуться и закрутиться под многими неблагоприятными углами, прежде чем он получил бы правильную ориентацию для левой спирали. Таким образом, они не очень распространены в природе.
Для правосторонней альфа-спирали каждый спиральный виток содержит 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из цепи α -спирали. Полипептидный остов образует повторяющуюся спиральную структуру, которая стабилизирована водородными связями между карбонильным кислородом и аминным водородом. Эти водородные связи возникают через равные промежутки времени, одна водородная связь на каждую четвертую аминокислоту, и заставляют полипептидный остов образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; поэтому шаг спирали равен 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Разные аминокислоты имеют разную склонность к образованию α -спираль. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин. Пролин и глицин почти не имеют склонности к образованию спиралей.
На спираль приходится в среднем десять аминокислотных остатков. Разные аминокислоты имеют разную склонность к образованию α -спираль. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин. Пролин и глицин почти не имеют склонности к образованию спиралей.
Рис. 2.19 Структура правосторонней альфа-спирали. (A) Модель с мячом и клюшкой, вид сбоку. Всего для образования одного витка спирали α требуется 3,6 аминокислоты. Водородные связи между карбонильным кислородом и азотом 4-й аминокислоты стабилизируют спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серые — карбонильные атомы углерода, красные — кислород, синие — азот, зеленые — R-группы, а светло-фиолетовые — атомы водорода. (B) Расширенная линейная структура вида сбоку и модель заполнения пространства (C) Расширенная линейная структура вида сверху и модель заполнения пространства
Изображение A изменено из: Максим Изображение B и C из: Генри Якубовски
Ключевые моменты об альфа-спирали:
- Альфа-спираль с более компактной полипептидной цепью, чем полипептид phi /psi углы 180 o
- В белках среднее количество аминокислот в спирали равно 11, что дает 3 витка.

- Левосторонняя альфа-спираль, хотя и допускается при осмотре графика Рамачандрана, наблюдается редко, поскольку аминокислоты, используемые для построения структуры белка, представляют собой L-аминокислоты и склонны к образованию правосторонней спирали. Когда образуются левые спирали, они часто имеют решающее значение для правильного фолдинга белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рисунок 2.20 Структура левосторонней альфа-спирали. На этой диаграмме левосторонняя альфа-спираль, показанная желтым цветом, является частью поворота шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Figure from: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Сердцевина спирали плотно упакована. В спирали нет отверстий или пор.

- Все R-группы простираются наружу и в сторону от оси спирали. R-группы могут быть гидрофильными или гидрофобными и могут быть локализованы в определенных положениях спирали, образуя амфипатические области белка, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рис. 2.21 .
Рисунок 2.21 Расположение R-групп внутри альфа-спиральных структур. R-группы могут быть расположены внутри альфа-спирали для создания амфипатических областей в белке, где гидрофильные остатки расположены на одной стороне спирали, а гидрофобные — на другой, как показано на виде сбоку (А) или видах сверху вниз ( ДО Н.Э). R-группы также могут быть полностью гидрофобными внутри альфа-спиралей, которые охватывают плазматическую мембрану, как показано на (D).
Рисунок изменен из: Khara, J.S., et al. (2017) Acta Biomat 57:103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие.
 Вот аминокислоты, которые обычно НЕ встречаются в альфа-спиральных структурах: Gly слишком малы и конформационно гибки, чтобы их можно было обнаружить с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткие и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут образовывать Н-связь ( Ser, Asp, и Asn ) и не слишком длинные, по-видимому, действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа-спирали. R-группы с ранним разветвлением, такие как , , Val, , и , , , Ile, , , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
Вот аминокислоты, которые обычно НЕ встречаются в альфа-спиральных структурах: Gly слишком малы и конформационно гибки, чтобы их можно было обнаружить с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткие и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут образовывать Н-связь ( Ser, Asp, и Asn ) и не слишком длинные, по-видимому, действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа-спирали. R-группы с ранним разветвлением, такие как , , Val, , и , , , Ile, , , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали. - Краткое изложение склонности аминокислот к альфа-спирали (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клюва и ногтей, почти полностью представляют собой альфа-спирали.

Jmol: Обновлено Изолированная спираль антифризного белка Jmol14 (Java) | JSMol (HTML5)
Бета-складчатый лист: В бета-складчатом листе «складки» образуются за счет водородных связей между атомами в основной цепи полипептида. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки в транс конформация. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова (рис. 2.21).
Рис. 2.21 Структура бета-гофрированного листа. β-складчатый лист может быть ориентирован параллельно или антипараллельно, как показано на (A) выше, где β-складчатый лист представлен красными ленточными стрелками. Направление стрелки указывало на ориентацию белка, при этом стрелка проходила в направлении от N к C. Водородная связь между основной карбонильной и основной аминной функциональными группами стабилизировала как антипараллельную (B слева), так и параллельную (B справа) β-складчатую листовую структуру.
Водородная связь между основной карбонильной и основной аминной функциональными группами стабилизировала как антипараллельную (B слева), так и параллельную (B справа) β-складчатую листовую структуру.
Image (A) from: Xenoblast Image (B) from: Fvasconcellos
Other Secondary Structure Motifs:
Other important secondary structures include turns, loops, hairpins и гибких линкеров . Существует множество различных классификаций поворотов в структуре белка, включая α-повороты, β-повороты, γ-повороты, δ-повороты и π-витки . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, поскольку цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковать аминокислоты, что способствует поворотной структуре.
Рис. 2.22 Схема β-витков I и II типов.
Изображение получено: Muskid
Шпилька является частным случаем поворота, при котором направление белкового остова меняется на противоположное и взаимодействуют фланкирующие элементы вторичной структуры. Например, бета-шпилька соединяет две антипараллельные β-нити, связанные водородными связями. Повороты иногда обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющимся доменам свободно скручиваться и вращаться, чтобы рекрутировать своих партнеров по связыванию за счет динамики белковых доменов.
вернуться к началу страницы2.4 Супервторичная структура и белковые мотивы
Между вторичной и третичной структурой белков находятся более крупные трехмерные элементы, которые были идентифицированы во множестве различных белковых структур. Они известны как сверхвторичная структура и как белок мотивы . Сверхвторичная структура обычно состоит из двух вторичных структур, соединенных вместе витком, и включает спираль-виток-спираль, спираль-петлю-спираль, углы α-α, углы β-β и β-шпильку-β (рис. 2.23).
Они известны как сверхвторичная структура и как белок мотивы . Сверхвторичная структура обычно состоит из двух вторичных структур, соединенных вместе витком, и включает спираль-виток-спираль, спираль-петлю-спираль, углы α-α, углы β-β и β-шпильку-β (рис. 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) Структуры β-шпильки-β характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур. (B) Предлагаемая структура спираль-поворот-спираль белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A: Isabella Daidone. Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11(3):e0151431
Image C изменено из: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и сверхвторичных структурных компонентов, которые являются повторяющимися модальностями, визуализируемыми во многих белковых структурах.
Бета-цепи имеют тенденцию скручиваться в правом направлении, чтобы минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или седла, а также бета-баррели (рис. 2.24) 9.0042
Рис. 2.24 Общие структурные мотивы бета-нитей. (A) Правый скрученный лист, вид сверху и сбоку, (B) Бета-ствол, вид сбоку и (С) Бета-бочонок, вид сверху
Изображение: Генри Якубовски такие как обеспечение возможности связывания субстратов или кофакторов. Например, укладка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-тяжей, образующих расширенный бета-лист. Первые три цепи соединены α-спиралями, что приводит к структуре бета-альфа-бета-альфа-бета. Этот паттерн дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом нити расположены в порядке 321456 (1 = N-конец, 6 = C-конец). Пять скрученных складок, подобных Россману, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный бутерброд, в котором начинка состоит из расширенного бета-листа, а два ломтика хлеба образованы соединительными параллельными альфа-слоями. спирали.
В целом нити расположены в порядке 321456 (1 = N-конец, 6 = C-конец). Пять скрученных складок, подобных Россману, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный бутерброд, в котором начинка состоит из расширенного бета-листа, а два ломтика хлеба образованы соединительными параллельными альфа-слоями. спирали.
Рисунок 2.25 Складка Россмана. (A) Структура никотинамидадениндинуклеотида (NAD + ) (B) Мультипликационная диаграмма складки Россмана (спирали AF красные и нити 1-6 желтые) из фермента малатдегидрогеназы E. coli . Кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестинитевой складки Россмана.
Изображение изменено с: Богхог
Одной из особенностей складки Россмана является специфичность связывания кофактора. Наиболее консервативным сегментом складок Россмана является первый сегмент бета-альфа-бета. Поскольку этот сегмент находится в контакте с АДФ-частью динуклеотидов, таких как ФАД, НАД и НАДФ, его также называют «АДФ-связывающей бета-бета-складкой».
Поскольку этот сегмент находится в контакте с АДФ-частью динуклеотидов, таких как ФАД, НАД и НАДФ, его также называют «АДФ-связывающей бета-бета-складкой».
Интересно, что сходные структурные мотивы не всегда имеют общего эволюционного предка и могут возникать в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, чередующихся вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из наиболее распространенных белковых складок. Одной из самых интригующих особенностей представителей этого класса белков является то, что, хотя все они демонстрируют одинаковую третичную укладку, между ними очень мало сходства последовательностей. По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного центра, всегда на С-конце восьми параллельных бета-цепей ствола.
Рисунок 2.26 Ствол TIM. бочонка TIM считаются складками белка α / β, поскольку они включают чередующийся образец α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 штук) образуют соленоид, который изгибается, чтобы замкнуться на себя в форме пончика, топологически известного как тороид. Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-бочку), тогда как α-спирали формируют внешнюю стенку бублика. Каждая β-цепь соединяется со следующей соседней нитью в стволе через длинную правую петлю, включающую одну из спиралей, так что раскраска ленты от N к C на виде сверху (A) происходит в радужном порядке вокруг бочка. Таким образом, ствол TIM также можно рассматривать как состоящий из 8 перекрывающихся правосторонних β-α-β сверхвторичных структур, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя на ленточной диаграмме цилиндра TIM показано отверстие в центральном ядре белка, боковые цепи аминокислот не показаны на этом изображении (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра, чтобы сильно ограниченный центр из 8 приблизительных повторов совпадал. Во взаимодействиях упаковки между цепями и спиралями также доминирует гидрофобность, а разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра, чтобы сильно ограниченный центр из 8 приблизительных повторов совпадал. Во взаимодействиях упаковки между цепями и спиралями также доминирует гидрофобность, а разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в природной сокровищнице белковых структур, продолжают расти, мы продолжаем получать представление о том, как структура белка связана с функцией, и у нас появляется больше возможностей для характеристики вновь приобретенных белковых последовательностей с использованием in silico. технологий. 2.5 Третичная и четвертичная структура белка0003 третичная структура
белка и является уникальным и определяющим признаком этого белка (рис. 2.27). Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина может привести к образованию дисульфидных связей.
2.27). Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина может привести к образованию дисульфидных связей.Рис. 2.27 Третичная структура белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Изображение: School of Biomedical Sciences Wiki
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он обычно перестает быть функциональным.
Когда белок теряет свою трехмерную форму, он обычно перестает быть функциональным.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рис. 2.14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина позволяет организму хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), а активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит способом защиты высокореактивного инсулина, но в то же время легкодоступного.
Рисунок Автор: Исаак Йонемото
Предсказание паттерна укладки белка на основе его первичной последовательности является чрезвычайно сложной задачей из-за присущей аминокислотным остаткам гибкости, которые можно использовать для формирования различных вторичных признаков. Как описано Fujiwara и др., классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, обеспечивающими подробное и исчерпывающее описание всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, 9Семейство 0003 и надсемейство
описывают близкие и дальние эволюционные отношения, тогда как третье, fold , описывает геометрические отношения и структурные мотивы внутри белка. В рамках схемы складчатой классификации большинство белков относятся к одному из четырех структурных классов: (1) все α-спирали, (2) все β-слои, (3) α/β для белков с дисперсным рисунком и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
В рамках схемы складчатой классификации большинство белков относятся к одному из четырех структурных классов: (1) все α-спирали, (2) все β-слои, (3) α/β для белков с дисперсным рисунком и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна. На основании их формы, функции и расположения белки можно охарактеризовать в широком смысле как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки характеризуются удлиненной белковой структурой. Эти типы белков часто объединяются в нити или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин α-кератин является ключевым структурным элементом, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Из-за своей плотно намотанной структуры он может функционировать как один из самых прочных биологических материалов и имеет различное применение у млекопитающих, от хищных когтей до волос для тепла. α-кератин синтезируется в результате биосинтеза белка с использованием транскрипции и трансляции, но по мере созревания клетки и ее заполнения α-кератином она погибает, образуя сильную несосудистую единицу ороговевшей ткани.
α-кератин синтезируется в результате биосинтеза белка с использованием транскрипции и трансляции, но по мере созревания клетки и ее заполнения α-кератином она погибает, образуя сильную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Hanukoglu и Fuchs. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератинами типа I и кератинами типа II. У человека имеется 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, то есть содержат больше кислых аминокислот, таких как аспарагиновая кислота, а белки типа II являются основными, то есть содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе димера его субъединицы спиральная спираль , одна белковая спираль должна быть типа I, а другая должна быть типа II (рис. 2.29). Даже в типах I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме. Например, в коже человека К5, α-кератин II типа, в основном соединяется с K14, α-кератином I типа, с образованием α-кератинового комплекса эпидермального слоя клеток кожи.
Даже в типах I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме. Например, в коже человека К5, α-кератин II типа, в основном соединяется с K14, α-кератином I типа, с образованием α-кератинового комплекса эпидермального слоя клеток кожи.
Спиралевидные димеры затем собираются в протофиламенты, очень стабильный левосторонний суперспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29).). Главной силой, которая удерживает спирально-спиральные структуры связанными друг с другом, являются гидрофобные взаимодействия между неполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из суперспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют спиральную спиральную димерную структуру (B). Два спиральных спиральных димера соединяются, образуя тетрамер, расположенный в шахматном порядке (C), тетрамеры начинают соединяться вместе (D), в конечном итоге образуя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивается в левозакрученную спираль, образуя конечную промежуточную нить (Е). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Затем лист из восьми тетрамеров скручивается в левозакрученную спираль, образуя конечную промежуточную нить (Е). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Изображение BY: US GOV
Collagen
. Фиброзной белок, Коллаген -самый абюндский белок, %, что является наиболее абюндным белком, %, что является наиболее абрентным белком, %, что является наиболее абрентным белком, %, что является наиболее абрентным белком, %-это больше всего белка. содержание. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых нитей, свернутых вместе в тройную спираль. Он в основном встречается в волокнистых тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент жесткости к податливости (хрящи). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6 % веса сильных сухожильных мышц. Фибробласт является наиболее распространенной клеткой, которая создает коллаген. Желатин, используемый в пищевой промышленности и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, частично и полностью гидролизованные порошки коллагена используются в качестве пищевых добавок. Коллаген имеет множество медицинских применений при лечении осложнений костей и кожи.
Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6 % веса сильных сухожильных мышц. Фибробласт является наиболее распространенной клеткой, которая создает коллаген. Желатин, используемый в пищевой промышленности и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, частично и полностью гидролизованные порошки коллагена используются в качестве пищевых добавок. Коллаген имеет множество медицинских применений при лечении осложнений костей и кожи.
Название коллаген происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , обозначающего «производство». Это относится к раннему использованию соединения в процессе варки кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 г. было идентифицировано, описано 28 типов коллагена, которые разделены на несколько групп в зависимости от структуры, которую они образуют. Пять наиболее распространенных типов:
Однако по состоянию на 2011 г. было идентифицировано, описано 28 типов коллагена, которые разделены на несколько групп в зависимости от структуры, которую они образуют. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилия, сосуды, органы, кости (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: ретикулярный (основной компонент ретикулярных волокон), обычно встречается наряду с типом I
- Тип IV: образует базальную пластинку, секретируемый эпителием слой базальной мембраны
- Тип V: поверхности клеток, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена типа I. Коллаген типа I имеет необычный аминокислотный состав и последовательность:
- Глицин присутствует почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции.
 Эти аминокислоты находятся в определенных местах по сравнению с глицином и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
Эти аминокислоты находятся в определенных местах по сравнению с глицином и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).- Гидроксипролин, полученный из пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена гликозилировано различное количество гидроксилизинов (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (А) и лизина (В) соответственно. (Примечание: хотя положение 3 показано выше, остатки пролила могут альтернативно быть гидроксилированы в положении 4). Ферменты гидроксилазы изменяют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбат) в качестве кофактора. (C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в оксикислород.
(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в оксикислород.
Большинство коллагенов образуются сходным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность фолдинга и процессинга белка (рис. 2.31).
- Внутри клетки
- При трансляции на рибосомах вдоль шероховатого эндоплазматического ретикулума (РЭР) образуются два типа альфа-цепей: альфа-1 и альфа-2 цепи. Эти пептидные цепи (известные как препроколлаген) имеют регистрационные пептиды на каждом конце и сигнальный пептид.
- полипептидных цепей высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и их цепи теперь известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от аскорбиновой кислоты (витамин С) в качестве кофактора.
- Происходит гликозилирование определенных остатков гидроксилизина.

- Тройная альфа-спиральная структура формируется внутри эндоплазматического ретикулума из двух альфа-1-цепей и одной альфа-2-цепи.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
- Вне клетки
- Пептиды регистрации расщепляются, и тропоколлаген образуется пептидазой проколлагена.
- Множественные молекулы тропоколлагена образуют коллагеновые фибриллы посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина. Несколько коллагеновых фибрилл образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена формируется и транспортируется через аппарат Гольджи, где происходит дальнейшая обработка. Проколлаген секретируется во внеклеточный матрикс, где расщепляется до тропоколлагена. Тропоколлаген собирается в коллагеновую фибриллу, где происходит перекрестное связывание и образование водородных связей с образованием окончательного коллагенового волокна.
Тройная спираль проколлагена формируется и транспортируется через аппарат Гольджи, где происходит дальнейшая обработка. Проколлаген секретируется во внеклеточный матрикс, где расщепляется до тропоколлагена. Тропоколлаген собирается в коллагеновую фибриллу, где происходит перекрестное связывание и образование водородных связей с образованием окончательного коллагенового волокна.
Изображение изменено: E.V. Wong and Encyclopedia Britannica
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефект коллагена препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа обесцвечивается, а раны не заживают. До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые волокна коллагена. Кортизол стимулирует расщепление коллагена до аминокислот, что позволяет предположить, что стресс может усугубить эти болезненные состояния.
Кортизол стимулирует расщепление коллагена до аминокислот, что позволяет предположить, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его выработке.
вернуться к началу страницыГлобулярные белки
Глобулярные белки или Сферопротеины представляют собой сферические («шаровидные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуя коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует множество классов глобулярных белков с укладки, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может относиться более конкретно к белкам, включая глобиновую складку. Глобиновая складка является обычной трехмерной складкой в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные спиральные удлинения на концах. Глобиновая складка встречается в одноименных семействах глобиновых белков: гемоглобинах и миоглобинах, а также в фикоцианинах. Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Глобиновая складка является обычной трехмерной складкой в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные спиральные удлинения на концах. Глобиновая складка встречается в одноименных семействах глобиновых белков: гемоглобинах и миоглобинах, а также в фикоцианинах. Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была, таким образом, первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рисунок 2.32 Складка Глобина. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновые складки.
Изображение A: Википедия. Изображение B: Zephyris. описательная структурно-мотивная лексика. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, обеспечивая диполь-дипольные взаимодействия с растворителем, что объясняет растворимость молекулы.
Изображение B: Zephyris. описательная структурно-мотивная лексика. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, обеспечивая диполь-дипольные взаимодействия с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые играют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализируя органические реакции, протекающие в организме в мягких условиях и с большой специфичностью. Эту роль выполняют различные эстеразы.
- Посланники, передавая сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, т.е. инсулин и т.д.
- Транспортеры других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняют глобулярные белки, а не волокнистые белки.
- Структурные белки, например актин и тубулин, глобулярные и растворимые в виде мономеров, но полимеризующиеся с образованием длинных жестких волокон
Многие белки, которые будут подробно описаны в последующих главах, попадают в этот класс белков.
Мембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними. Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно присоединены к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые пересекают мембрану, или интегральные монотопные белки, которые должны быть прикреплены только к одной стороне мембраны.
Мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки, широко распространены. Мембранные белки, символизирующие их важность в медицине, являются мишенями для более чем 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков определение структуры мембранных белков остается сложной задачей в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его нативной среды (рис. 2.33).
2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Мембранные рецепторные белки передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно классифицировать в соответствии с базой данных Transporter Classification.
- Мембранные ферменты могут иметь множество активностей, таких как оксидоредуктазы, трансферазы или гидролазы.
- Молекулы клеточной адгезии позволяют клеткам идентифицировать друг друга и взаимодействовать. Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопный мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный белок β-слоя. Мембрана представлена светло-коричневым цветом.
Изображение: Foobar
Интегральные мембранные белки прочно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с помощью детергентов, неполярных растворителей или иногда денатурирующих агентов. Их можно классифицировать в соответствии с их отношением к бислою:
Такие белки можно отделить от биологических мембран только с помощью детергентов, неполярных растворителей или иногда денатурирующих агентов. Их можно классифицировать в соответствии с их отношением к бислою:
- Интегральные политопные белки представляют собой трансмембранные белки, которые пересекают мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белки спирального пучка, присутствующие во всех типах биологических мембран;
- бета-бочкообразных белка, которые обнаружены только во внешних мембранах грамотрицательных бактерий, а также во внешних мембранах митохондрий и хлоропластов.
- Битопические белки представляют собой трансмембранные белки, которые пересекают мембрану только один раз. Трансмембранные спирали этих белков имеют значительно отличающееся распределение аминокислот по сравнению с трансмембранными спиралями политопных белков.

- Интегральные монотопные белки представляют собой интегральные мембранные белки, которые прикрепляются только к одной стороне мембраны и не охватывают всю ее поверхность.
Рис. 2.34. Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие по амфипатической α-спирали, параллельной плоскости мембраны (в плоскости мембранной спирали) 2. взаимодействие по гидрофобной петле 3. взаимодействие по ковалентно связанному мембранному липиду ( липидизация ) 4. электростатические или ионные взаимодействия с мембранными липидами.
Image by : Foobar
Белки периферической мембраны временно присоединены либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий. Периферические белки диссоциируют после обработки полярным реагентом, таким как раствор с повышенным pH или высокой концентрацией солей.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицериновых или пренильных цепей или GPI (гликозилфосфатидилинозитол), которые могут быть закреплены в липидном бислое.
Неупорядоченные белкиВнутренне неупорядоченный белок ( IDP ) представляет собой белок, у которого отсутствует фиксированная или упорядоченная трехмерная структура (рис. 2.35). IDP охватывают спектр состояний от полностью неструктурированных до частично структурированных и включают случайные клубки, (пре-)расплавленные глобулы и большие многодоменные белки, связанные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, фиброзными и мембранными белками).
Рис. 2.35 Конформационная гибкость белка SUMO-1 (PDB:1a5r). Центральная часть имеет относительно упорядоченную структуру. Наоборот, N- и C-концевые области (левый и правый, соответственно) демонстрируют «внутренний беспорядок», хотя короткая спиральная область сохраняется в N-концевом хвосте. Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Изображение: Лукаш Козловски
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была оспорена за последние двадцать лет увеличением количества данных из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем. Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом, IDP во многих отношениях отличаются от структурированных белков и, как правило, обладают отличными свойствами с точки зрения функции, структуры, последовательности, взаимодействия, эволюции и регуляции.
В 1930-х — 1950-х годах первые структуры белков были решены с помощью кристаллографии белков. Эти ранние структуры предполагали, что для обеспечения биологических функций белков обычно может потребоваться фиксированная трехмерная структура. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не понимали, что работа Фишера подкрепила бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации укрепили центральную догму молекулярной биологии о том, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков. В 1950, Каруш писал о «конфигурационной адаптивности», противоречащей всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном и том же энергетическом уровне и могут выбирать одну из них при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли даст единственную свернутую белковую структуру в биологически релевантных временных масштабах (т. е. от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro . Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально закодирована в своей первичной структуре (аминокислотной последовательности), кинетически доступна и стабильна в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
е. от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro . Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально закодирована в своей первичной структуре (аминокислотной последовательности), кинетически доступна и стабильна в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
В последующие десятилетия, однако, многие крупные белковые области не могли быть отнесены к наборам рентгеновских данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности. Отсутствие фиксированных, уникальных положений относительно кристаллической решетки предполагало, что эти области «неупорядочены». Спектроскопия ядерного магнитного резонанса белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. В настоящее время общепризнано, что белки существуют как ансамбль подобных структур, причем некоторые области более ограничены, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний край этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкие многодоменные сборки. Эти очень динамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментативный катализ.
В настоящее время общепризнано, что белки существуют как ансамбль подобных структур, причем некоторые области более ограничены, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний край этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкие многодоменные сборки. Эти очень динамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментативный катализ.
Многие неупорядоченные белки имеют аффинность связывания с их рецепторами, регулируемую посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков способствует различным конформационным требованиям для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее расстройство особенно обогащено белками, участвующими в клеточной передаче сигналов, транскрипции и функциях ремоделирования хроматина.
Неупорядоченные участки часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать своих партнеров по связыванию посредством динамики белковых доменов. Они также позволяют своим партнерам по связыванию вызывать крупномасштабные конформационные изменения с помощью дальнодействующей аллостерии.
Линейные мотивы Линейные мотивы представляют собой короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахара и т. д.). Многие роли линейных мотивов связаны с клеточной регуляцией, например, в контроле формы клеток, субклеточной локализации отдельных белков и регулировании оборота белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (нередко на несколько порядков) отдельных линейных мотивов к конкретным взаимодействиям. В отличие от глобулярных белков, IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых подробной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые представляют собой временные вторичные структурные элементы, предназначенные для распознавания мишеней. В нескольких случаях было продемонстрировано, что эти переходные структуры становятся полноценными и стабильными вторичными структурами, например, спиралями, при связывании с мишенью. Следовательно, PreSMos являются предполагаемыми активными сайтами у ВПЛ.
В отличие от глобулярных белков, IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых подробной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые представляют собой временные вторичные структурные элементы, предназначенные для распознавания мишеней. В нескольких случаях было продемонстрировано, что эти переходные структуры становятся полноценными и стабильными вторичными структурами, например, спиралями, при связывании с мишенью. Следовательно, PreSMos являются предполагаемыми активными сайтами у ВПЛ.
Многие неструктурированные белки претерпевают переходы в более упорядоченные состояния при связывании со своими мишенями. Парное сворачивание и связывание могут быть локальными, затрагивающими лишь несколько взаимодействующих остатков, или могут затрагивать весь белковый домен. Недавно было показано, что совмещенное сворачивание и связывание позволяют закопать большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регуляции определенной биологической функции путем переключения на упорядоченную конформацию при молекулярном распознавании, например, связывание малых молекул, связывание ДНК/РНК, взаимодействие ионов.
Недавно было показано, что совмещенное сворачивание и связывание позволяют закопать большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регуляции определенной биологической функции путем переключения на упорядоченную конформацию при молекулярном распознавании, например, связывание малых молекул, связывание ДНК/РНК, взаимодействие ионов.
Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже когда они специфически связываются с другими белками. Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексах для функционирования требуется структурная множественность, и манипуляции со связанными неупорядоченными участками изменяют активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких участков, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируются ко многим различным структурам in vivo в зависимости от условий клетки, создавая структурный или конформационный ансамбль.
Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких участков, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируются ко многим различным структурам in vivo в зависимости от условий клетки, создавая структурный или конформационный ансамбль.
Таким образом, их структуры тесно связаны с функциями. Однако лишь немногие белки полностью разупорядочены в нативном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) в хорошо структурированном белке. Таким образом, термин внутренне неупорядоченный белок (IDP) включает белки, содержащие IDR, а также полностью неупорядоченные белки.
Существование и тип белкового нарушения закодированы в его аминокислотной последовательности. В целом ИДП характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, что обычно называют низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие суммарные заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы свернуться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключ к идентификации областей, которые подвергаются сопряженному сворачиванию и связыванию (обратитесь к биологическим ролям).
Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие суммарные заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы свернуться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключ к идентификации областей, которые подвергаются сопряженному сворачиванию и связыванию (обратитесь к биологическим ролям).
Многие неупорядоченные белки обнаруживают участки без регулярной вторичной структуры. Эти участки можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в отличие от IDP. Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, т. е. последовательности с чрезмерным представлением нескольких остатков. Хотя последовательности низкой сложности являются явным признаком беспорядка, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
Гибкость структурированных белков связана с равновесным состоянием, в отличие от IDP. Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, т. е. последовательности с чрезмерным представлением нескольких остатков. Хотя последовательности низкой сложности являются явным признаком беспорядка, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
2.6 Сворачивание, денатурация и гидролиз белков
Конформация белков, приобретающая свою 3-мерную структуру обычно является биологически функциональным, быстрым и воспроизводимым образом (рис. 2.36). Это физический процесс, при котором полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайного клубка при трансляции последовательности мРНК в линейную цепь аминокислот. У этого полипептида отсутствует какая-либо стабильная (длительная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру. Сворачивание начинает происходить уже во время трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Результирующая трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
У этого полипептида отсутствует какая-либо стабильная (длительная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру. Сворачивание начинает происходить уже во время трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Результирующая трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рисунок 2.36 Белок до и после складывания
Изображение по: DRKJAergaard
70037
70037. остаются развернутыми или, как в случае с IDP, остаются гибкими, поэтому важна динамика белка. Неспособность свернуться в нативную структуру обычно приводит к неактивным белкам, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсическую функциональность. Считается, что некоторые нейродегенеративные и другие заболевания возникают в результате накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Неспособность свернуться в нативную структуру обычно приводит к неактивным белкам, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсическую функциональность. Считается, что некоторые нейродегенеративные и другие заболевания возникают в результате накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Складывание — самопроизвольный процесс, который в основном направляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия. Процесс укладки часто начинается котрансляционно, так что N-конец белка начинает складываться, в то время как С-концевая часть белка все еще синтезируется рибосомой; однако молекула белка может спонтанно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «сворачивающиеся», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, рН, температуры, возможного присутствия кофакторов и молекулярных шаперонов. Белки будут иметь ограничения на их способность складываться из-за ограниченных углов изгиба или возможных конформаций, как описано на графике Рамачандрана.
Белки будут иметь ограничения на их способность складываться из-за ограниченных углов изгиба или возможных конформаций, как описано на графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются по направлению к центру, защищаясь от водной среды.
Фото: Tomixdf Поскольку известно, что сворачивание белка является спонтанной реакцией, то она должна принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для отрицательного 9Чтобы возникло 0038 ΔG и чтобы фолдинг белка стал термодинамически благоприятным, благоприятными должны быть либо энтальпия, либо энтропия, либо оба члена.
Минимизация количества гидрофобных боковых цепей, подвергающихся воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка схлопываются в сердцевину белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию агрегировать вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки упорядоченных молекул воды. Упорядочивание молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (меньше энтропии в системе). Молекулы воды зафиксированы в этих водяных клетках, что приводит к гидрофобному коллапсу или сворачиванию гидрофобных групп внутрь (рис. 2.38).
2.37) — это явление, при котором гидрофобные цепи белка схлопываются в сердцевину белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию агрегировать вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки упорядоченных молекул воды. Упорядочивание молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (меньше энтропии в системе). Молекулы воды зафиксированы в этих водяных клетках, что приводит к гидрофобному коллапсу или сворачиванию гидрофобных групп внутрь (рис. 2.38).
Рисунок 2.38 Формирование водного клатрата. Хлороформ является гидрофобным соединением, поэтому при его растворении в воде с образованием гидрата гидрофобная гидратация сопровождается отрицательным изменением энтропии из-за повышенного порядка в окружающей воде и положительным изменением теплоемкости, что часто вызывает положительное ΔГ. Подобные водные клетки могут связываться вокруг гидрофобных белковых остатков до правильного фолдинга.
Подобные водные клетки могут связываться вокруг гидрофобных белковых остатков до правильного фолдинга.
Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водяных клеток, что освобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярно свернутого белка, в значительной степени способствует стабильности белка после сворачивания из-за значительного накопления ван-дер-ваальсовых сил (в частности, лондонских дисперсионных сил). Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большой гидрофобный участок. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, в стабильность нативного состояния.
Шапероны Молекулярные шапероны представляют собой класс белков, которые помогают правильно сворачивать другие белки in vivo (рис. 2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы обеспечить формирование нативной трехмерной конформации белка; однако сами шапероны не включаются в конечную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда рибосома синтезирует формирующийся полипептид. Молекулярные шапероны действуют путем связывания, чтобы стабилизировать в противном случае нестабильную структуру белка на пути его сворачивания, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные конформации складывания.
2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы обеспечить формирование нативной трехмерной конформации белка; однако сами шапероны не включаются в конечную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда рибосома синтезирует формирующийся полипептид. Молекулярные шапероны действуют путем связывания, чтобы стабилизировать в противном случае нестабильную структуру белка на пути его сворачивания, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные конформации складывания.
Рисунок 2.39 Модель комплекса бактериальных шаперонов GroES/GroEL, вид сверху путь к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные скопления полипептидной цепи, которые в противном случае могли бы замедлить поиск правильного промежуточного соединения, и они обеспечивают более эффективный путь для принятия полипептидной цепью правильных конформаций. Шапероны не следует путать с катализаторами фолдинга, которые на самом деле катализируют медленные этапы пути фолдинга. Примерами катализаторов укладки являются протеиндисульфидизомеразы и пептидилпролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимопревращении между цис и транс стереоизомеры соответственно.
Шапероны не следует путать с катализаторами фолдинга, которые на самом деле катализируют медленные этапы пути фолдинга. Примерами катализаторов укладки являются протеиндисульфидизомеразы и пептидилпролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимопревращении между цис и транс стереоизомеры соответственно.
Показано, что шапероны играют решающую роль в процессе фолдинга белка in vivo , потому что они обеспечивают белку помощь, необходимую для принятия его правильного выравнивания и конформации достаточно эффективно, чтобы стать «биологически релевантным». Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как показали эксперименты по сворачиванию белков, проведенные в in vitro ; однако этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка 90–245 in vivo. Показано, что наряду со своей ролью в содействии формированию нативной структуры шапероны участвуют в различных ролях, таких как транспорт белков, деградация и даже позволяют денатурированным белкам, подвергшимся воздействию определенных внешних денатурирующих факторов, рефолдироваться в их правильные нативные структуры.
Показано, что наряду со своей ролью в содействии формированию нативной структуры шапероны участвуют в различных ролях, таких как транспорт белков, деградация и даже позволяют денатурированным белкам, подвергшимся воздействию определенных внешних денатурирующих факторов, рефолдироваться в их правильные нативные структуры.
В полностью денатурированном белке отсутствует как третичная, так и вторичная структура, однако первичная последовательность белка остается нетронутой, и белок существует в виде случайного клубка (рис. 2.39). При определенных условиях некоторые белки могут рефолдироваться; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего влияния тепла с помощью ферментов, известных как белки теплового шока (разновидность шаперонов), , которые помогают другим белкам как сворачиваться, так и оставаться свернутыми (рис. 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их фолдинг не прерывался взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им сворачиваться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения нерастворимых аморфных агрегатов.
Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их фолдинг не прерывался взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им сворачиваться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения нерастворимых аморфных агрегатов.
Рисунок 2.40 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе применяется тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. Шаг (3) показывает развернутый или денатурированный белок. Окрашенные области в денатурированном белке соответствуют окрашенным областям нативно свернутого белка, показанного на (1).
Диаграмма предоставлена: Scurran15
Внешние факторы, участвующие в денатурации белков или нарушении нативного состояния, включают температуру, внешние поля (электрические, магнитные), молекулярную скученность и даже ограничение пространства, которые могут иметь большое влияние на сворачивание белков. Высокие концентрации растворенных веществ, экстремальные значения pH, механические воздействия и присутствие химических денатурантов также могут способствовать денатурации белка. Эти отдельные факторы классифицируются вместе как стрессы. Показано, что шапероны существуют в увеличивающихся концентрациях во время клеточного стресса и помогают правильной укладке новых белков, а также денатурированных или неправильно свернутых.
Высокие концентрации растворенных веществ, экстремальные значения pH, механические воздействия и присутствие химических денатурантов также могут способствовать денатурации белка. Эти отдельные факторы классифицируются вместе как стрессы. Показано, что шапероны существуют в увеличивающихся концентрациях во время клеточного стресса и помогают правильной укладке новых белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не сворачиваются в свои биохимически функциональные формы. Температуры выше или ниже диапазона, в котором обычно живут клетки, заставят термически нестабильные белки разворачиваться или денатурировать (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далека от постоянной; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 °C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых комплексов был стабилен при этой температуре или выше.
Гидролиз представляет собой расщепление первичной белковой последовательности путем добавления воды для преобразования мономерных звеньев отдельных аминокислот (рис. 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом, и преобразует карбоновую кислоту. Водород из воды преобразует амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически 99% ферментативных реакций внутри клетки опосредованы белками. Таким образом, они являются неотъемлемой частью процессов построения или разрушения клеточных компонентов. Белки также могут действовать как структурные леса внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в транспорте молекул из одного места в другое. В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
2.7 Ссылки
OpenStax, Proteins. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл:Хиральность с руками.jpg. (2017, 16 сентября). Wikimedia Commons, бесплатный репозиторий мультимедиа . Получено 17:34, 10 июля 2019 г., с https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
участников Википедии. (2019, 6 июля). Цвиттерион. В Википедии , Свободной энциклопедии . Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=
9721 участников Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедии , Свободной энциклопедии . Получено 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index. php?title=Absolute_configuration&oldid=
php?title=Absolute_configuration&oldid=
Структурная биохимия/фермент/активный сайт. (2019, 1 июля). Викиучебники, Проект бесплатных учебников . Получено 16:55, 16 июля 2019 г., с https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия/белки. (2019, 24 марта). Викиучебники, Проект бесплатных учебников . Получено 19:16, 18 июля 2019 г., с https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость склонности аминокислот к α-спирали и β-слою от общего типа укладки белка. BMC Структурная биология 12:18. Доступно по ссылке: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
Авторы Википедии. (2019, 16 июля). Кератин. В Википедии , Свободной энциклопедии . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=
8340 участников Википедии. (2019, 13 июля). Альфа-кератин. В Википедии , Свободной энциклопедии . Получено 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Alpha-keratin&oldid=
(2019, 13 июля). Альфа-кератин. В Википедии , Свободной энциклопедии . Получено 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Alpha-keratin&oldid=
7410
Open Learning Initiative. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=43489.01580020ca6010f804da8baf7ba.
Авторы Википедии. (2019, 16 июля). Коллаген. В Википедии , Свободной энциклопедии . Получено 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=9954
участников Википедии. (2019, 2 июля). Складка Россмана. В Википедии , Свободной энциклопедии . Получено 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=
8788
9.0037 участников Википедии. (2019, 30 мая). ствол ТИМ. В Википедии , Свободной энциклопедии . Получено 16:46, 20 июля 2019 г., с https://en. wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569участников Википедии. (2019, 16 июля). Сворачивание белков. В Википедии , Свободной энциклопедии . Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=4145
участников Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=
0467участников Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедии , Свободной энциклопедии . Получено 19:52, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=
2287
белок | Определение, структура и классификация
синтез белка
Посмотреть все СМИ
- Ключевые люди:
- Джон Б. Фенн
Джордж П. Смит
Ричард Хендерсон
Тасуку Хондзё
Уильям Г.
 Кэлин-младший
Кэлин-младший
- Похожие темы:
- фермент интерферон фактор транскрипции прион фосфорилирование белка
- Выдающиеся лауреаты:
- Родни Роберт Портер
Просмотреть весь связанный контент →
Популярные вопросы
Что такое белок?
Белок представляет собой встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для последующего использования у животных. Когда животное потребляет избыточное количество белков, они превращаются в жиры (глюкозу или триглицериды) и используются для получения энергии или создания запасов энергии. Если животное не потребляет достаточного количества белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной активности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Резюме
Прочтите краткий обзор этой темы
белок , очень сложное вещество, присутствующее во всех живых организмах. Белки имеют большую питательную ценность и принимают непосредственное участие в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йонсом Якобом Берцелиусом, который в 1838 году ввел термин белок , слово, происходящее от греческого proteios 9. 0041, что означает «занять первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
0041, что означает «занять первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Молекула белка очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных друг с другом в длинные цепи, подобно тому, как бусы расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка исходя из его аминокислотной последовательности, установленные корреляции между структурой и функцией можно объяснить свойствами аминокислот, входящих в состав белков.
Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, которые обеспечивают азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0038 см. питание человека).
Они используют углекислый газ в воздухе в процессе фотосинтеза для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений невелико, животным, таким как жвачные (например, коровы), требуется очень большое количество растительного материала, который питается только растительным материалом для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, включая человека, получают белки в основном из животных и их продуктов, например, мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой пищи, богатой белком (9).0038 см. питание человека).
Содержание белка в органах животных обычно намного выше, чем в плазме крови. Мышцы, например, содержат около 30 процентов белка, печень — от 20 до 30 процентов, а эритроциты — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Количество свободных аминокислот и пептидов у животных значительно меньше количества белка; белковые молекулы образуются в клетках путем ступенчатого выравнивания аминокислот и высвобождаются в жидкости организма только после завершения синтеза.
Викторина «Британника»
Викторина «Медицинские термины и пионеры»
Кто открыл основные группы крови? Что вызывает болезнь крови талассемию? Проверьте, что вы знаете о медицине, пройдя этот тест.
Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые наиболее важные белки, такие как ферменты и гормоны, встречаются в очень малых количествах. Важность белков связана главным образом с их функцией. Все ферменты, идентифицированные до сих пор, являются белками. Ферменты, являющиеся катализаторами всех метаболических реакций, позволяют организму накапливать необходимые для жизни химические вещества — белки, нуклеиновые кислоты, углеводы и липиды, превращать их в другие вещества и разлагать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регулирующими функциями. У всех позвоночных дыхательный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Тема 2.4: Белки — УДИВИТЕЛЬНЫЙ МИР НАУКИ С MR. ЗЕЛЕНЫЙ
В разделе «Основы биохимии» учащиеся знакомятся с основными классами биологически важных молекул и типами реакций, используемых для создания и разрушения этих молекул. Структура и функция воды как среды жизни также находятся в центре внимания.
Модуль рассчитан на 3 учебных дня.
Основная идея:
- Белки выполняют очень широкий спектр функций в живых организмах.
Природа науки:
- Поиск закономерностей, тенденций и расхождений — большинство, но не все организмы собирают белки из одних и тех же аминокислот.
 (3.1)
(3.1)- Объясните тенденцию образования организмами полипептидов из одних и тех же аминокислот.
- Опишите несоответствие тенденции использования всеми организмами одних и тех же аминокислот для сборки полипептидов.
- Объясните тенденцию образования организмами полипептидов из одних и тех же аминокислот.
Понимание:
2.4.U.1 Аминокислоты соединяются друг с другом путем конденсации с образованием полипептидов.
- Опишите образование полипептидной цепи с точки зрения образования пептидных связей и реакций конденсации.
- Определите количество пептидных связей, зная количество аминокислот в полипептиде.
- Дайте определение дипептиду, олигопептиду и полипептиду.
Полипептиды представляют собой цепи аминокислот, которые образуются путем соединения аминокислот в результате реакций конденсации, происходящих на рибосомах в результате процесса, называемого трансляцией. Аминокислоты являются основным компонентом белков, а во многих белках они являются единственным компонентом
Полипептиды могут содержать один белок, некоторые содержат больше
Реакция конденсации включает аминогруппу (-Nh3) одной аминокислоты и карбоксильную группу (-COOH) другой. Вода удаляется, как и во всех реакциях конденсации, и между двумя аминокислотами образуется новая связь, называемая пептидной связью
Вода удаляется, как и во всех реакциях конденсации, и между двумя аминокислотами образуется новая связь, называемая пептидной связью
2.4.U.2 В полипептидах, синтезируемых на рибосомах, содержится 20 различных аминокислот.
- Укажите количество аминокислот, используемых живыми организмами для образования полипептидов.
- Имея изображение аминокислоты, классифицируйте химические свойства аминокислоты на основе свойств группы R.
- Опишите роль витамина С в превращении пролина в гидроксипролин.
2.4.U.3 Аминокислоты могут быть связаны друг с другом в любой последовательности, что дает широкий спектр возможных полипептидов.
- Подсчитайте возможное количество аминокислотных последовательностей при заданном количестве аминокислот.
Полипептиды представляют собой молекулы, состоящие из множества аминокислот, связанных пептидными связями. Полипептиды могут содержать любое количество аминокислот в цепях из менее чем 20 аминокислот и обычно называются олигопептидами, а не полипептидами.
Полипептиды могут содержать любое количество аминокислот в цепях из менее чем 20 аминокислот и обычно называются олигопептидами, а не полипептидами.
- инсулин – небольшой белок, содержащий два полипептида, один из которых состоит из 21 аминокислоты, а другой из 30
Рибосомы связывают аминокислоты вместе до тех пор, пока полипептид полностью не сформируется. Рибосома может образовывать пептидные связи между любой парой аминокислот. аминокислоты, поэтому возможна любая последовательность аминокислот. Количество аминокислотных последовательностей можно рассчитать, начиная с дипептидов. Любые аминокислоты в дипептиде могут быть любыми из 20, поэтому существует 20 умножить на 20 возможных последовательностей – всего 20 x 20 x 20 возможных последовательностей. трипептидные последовательности для полипептида из n аминокислот существует 20 n возможных последовательностей # аминокислот в полипептиде может быть от 200 до 1000 например, 400 аминокислот существует 20^400 возможных аминокислотных последовательностей
2. 4.U.4 Аминокислотная последовательность полипептидов кодируется генами.
4.U.4 Аминокислотная последовательность полипептидов кодируется генами.
- Опишите связь между генами и полипептидами.
Количество аминокислотных последовательностей, которые могут быть получены, огромно, но живые организмы на самом деле производят лишь небольшую их часть. Типичная клетка производит полипептиды с тысячами различных последовательностей и должна хранить информацию, необходимую для этого — аминокислотная последовательность каждого полипептида хранится в закодированной форме в базовой последовательности гена.
Некоторые гены выполняют другие функции, но большинство генов в клетке хранят аминокислотные последовательности полипептида, используя для этого генетический код. Для кодирования каждой аминокислоты в полипептиде необходимы три основания генного кода. Последовательность оснований, которая на самом деле кодирует полипептид, известна молекулярным биологам как загадка с открытой рамкой считывания. Первая состоит в том, что открытые рамки считывания занимают лишь небольшую часть всей ДНК вида.
Первая состоит в том, что открытые рамки считывания занимают лишь небольшую часть всей ДНК вида.
из HyperPhysics Concepts
2.4.U.5 Белок может состоять из одного полипептида или более чем из одного полипептида, связанных вместе.
- Опишите структуру и функцию трех примеров белков, состоящих из двух или более полипептидов, связанных вместе.
Некоторые белки представляют собой одиночные полипептиды, но другие состоят из двух или более полипептидов, связанных вместе
- дипептид представляет собой молекулу, состоящую из двух аминокислот, связанных пептидной связью все полипептиды имеют некоторые одинаковые структурные особенности – атом углерода в центре молекулы связан с аминогруппой, карбоксильной группой и атомом водорода
- атом углерода также связан с группой R = в каждой аминокислоте различно Группы R позволяют живым организмам производить и использовать удивительно широкий спектр белков
- некоторые белки обладают четвертым уровнем структурной организации, называемым четвертичной структурой
- четвертичные структуры обнаруживаются в белках, которые состоят из более чем одной полипептидной цепи, связанных вместе
- в качестве альтернативы белки могут иметь четвертичную структуру, если они включают неорганические простетические группы как часть своей структуры
- не все белки будут иметь четвертичную структуру – многие белки состоят из одной полипептидной цепи
изображение из Thermo Fisher Scientific
2. 4.U.6 Аминокислотная последовательность определяет трехмерную конформацию белка.
4.U.6 Аминокислотная последовательность определяет трехмерную конформацию белка.
- Сравните структуру глобулярных белков со структурой волокнистых белков.
- Опишите структуру мембраносвязанных глобулярных белков.
Порядок аминокислотной последовательности называется первичной структурой и определяет способ сворачивания цепи. Различные аминокислотные последовательности складываются в разные конфигурации из-за химических свойств вариабельных боковых цепей. Аминокислотные последовательности обычно складываются в две стабильные конфигурации, называемые вторичными структурами.
Альфа-спирали возникают, когда аминокислотная последовательность сворачивается в клубок/спираль. Бета-складчатые листы возникают, когда аминокислотная последовательность принимает конформацию направленно ориентированной ступенчатой цепи. Как α-спирали, так и β-складки образуются в результате образования водородных связей между несмежными аминогруппами и карбоксильными группами
Там, где вторичной структуры не существует, полипептидная цепь будет образовывать случайную спиральную конформацию белка в его трехмерной структуре.
Общая трехмерная конфигурация белка называется третичной структурой белка. Третичная структура полипептидной цепи будет определяться взаимодействиями между вариабельными боковыми цепями
Эти взаимодействия могут включать водородные связи, дисульфидные мостики , ионные взаимодействия, полярные ассоциации и др.
- определяется аминокислотной последовательностью белка и составляющих его полипептидов
- волокнистые белки, такие как коллаген, имеют удлиненную форму, обычно с повторяющейся структурой подобный листу
- аминокислоты добавляются одна за другой для образования полипептида
- они всегда добавляются в одной и той же последовательности для образования определенного полипептида это стабилизируется связями между группами R аминокислот, которые были сведены вместе в результате складывания
- глобулярные белки, растворимые в воде – снаружи молекулы находятся гидрофильные группы R, а внутри обычно находятся гидрофобные группы
- в белках глобулярных мембран есть участки с гидрофобными группами R снаружи молекул притягиваются к гидрофобному центру мембраны
- в волокнистых белках аминокислотная последовательность предотвращает складывание и обеспечивает сохранение аминокислотной цепи в удлиненной форме.

изображение из Difference Wiki
2.4.U.7 Живые организмы синтезируют множество различных белков с широким спектром функций.
- Сравните генерализованную функцию глобулярных белков с генерализованной функцией волокнистых белков.
- Перечислите десять функций белков в клетке или организме.
- Опишите функцию белков-ферментов.
- Опишите функцию гормональных белков.
- Опишите функцию белков иммуноглобулинов.
- Опишите функцию пигментных белков.
- Опишите функцию структурных белков
- Катализ – существуют тысячи различных ферментов для катализа специфических химических реакций внутри клетки или вне ее тело
- Цитоскелеты — тубулин представляет собой субъединицу микротрубочек, которые придают животным клеткам форму и натягивают хромосомы во время митоза
- Усиление растяжения – волокнистые белки придают прочность на растяжение, необходимую коже, сухожилиям, связкам и стенкам кровеносных сосудов
- Свертывание крови – белки плазмы действуют как факторы свертывания, которые заставляют кровь превращаться из жидкости в гель в ранах
- Транспорт питательных веществ и газы – белки в крови помогают транспортировать кислород, углекислый газ, железо и липиды
- Клеточная адгезия – мембранные белки заставляют соседние клетки животных прилипать друг к другу внутри ткани
- Мембранный транспорт — мембранные белки используются для облегченной диффузии и активного транспорта, а также для транспорта электронов во время клеточного дыхания и фотосинтеза
- Гормоны — некоторые, такие как инсулин, ФСГ и ЛГ, являются белками, но гормоны химически разнообразны.

- Рецепторы — участки связывания в мембранах и цитоплазме гормонов, медиаторов вкуса и запаха, а также рецепторы света в глазу и растениях.
- Упаковка ДНК – гистоны связаны с ДНК у эукариот и помогают хромосомам конденсироваться во время митоза
- Иммунитет — это самая разнообразная группа белков, так как клетки вырабатывают огромное количество различных антител.
2.4.U.8 Каждый человек имеет уникальный протеом.
- Дайте определение протеома.
- Сравните протеом с геномом.
Протеом – это совокупность белков, экспрессируемых в клетке, ткани или организме в определенное время. Протеом любого конкретного человека будет уникальным, поскольку паттерны экспрессии белков определяются генами человека
- все белки, продуцируемые клеткой, тканью или организмом.
- сравнение с геномом — это все гены клетки, ткани или организма
- чтобы выяснить, сколько различных белков вырабатывается смеси белков извлекаются из образца и затем разделяются с помощью гель-электрофореза
- это Чтобы определить, присутствует ли определенный белок, можно использовать антитела к белку, которые были связаны с флуоресцентным маркером – если клетка флуоресцирует, белок присутствует
- НО геном организма фиксирован, протеом изменчив, потому что разные клетки в организме производят разные белки
- даже в одной клетке белки, которые вырабатываются, со временем меняются в зависимости от активности клеток – поэтому протеом показывает, что на самом деле происходит в организме, а не то, что потенциально могло бы произойти
- внутри вида протеом всех особей сильно похож, но также и различается
- протеом каждой особи уникален отчасти из-за различий в активности, но также и из-за различий в аминокислотной последовательности белков — за исключением, возможно, однояйцевых близнецов, ни у кого из нас нет одинаковых белков, поэтому у каждого из нас уникальный протеом, даже у однояйцевых близнецов протеом с возрастом может стать другим.

изображение из Thermo Fisher Scientific
Applications
2.4.A.1 Rubisco, инсулин, иммуноглобулины, родопсин, коллаген и шелк паука как примеры ряда функций белка.
- Укажите функцию каждого из следующих белков: рубиско, инсулин, иммуноглобулин, родопсин. коллаген, шелк паука, актин, миозин, казеин, гемоглобин, рецептор ацетилхолина, окситоцин, пролактин, ферритин, биллирубин, фибриноген, трансферрин и альбумин.
2.4.A.2 Денатурация белков при нагревании или отклонении pH от оптимального.
- Дайте определение денатурации.
- Опишите влияние тепла и pH на структуру белка.
Денатурация белков включает разрушение и возможную деструкцию как вторичной, так и третичной структуры. Поскольку реакции денатурации недостаточно сильны, чтобы разорвать пептидные связи, первичная структура (последовательность аминокислот) остается неизменной после процесса денатурации. Денатурация разрушает нормальную альфа-спираль и бета-листы в белке и раскручивает их в случайную форму
Денатурация разрушает нормальную альфа-спираль и бета-листы в белке и раскручивает их в случайную форму
Денатурация белков обычно может быть вызвана двумя ключевыми условиями – температурой и pH
Температура
- Высокий уровень тепловой энергии может разрушить водородные связи, удерживающие белок вместе
- Когда эти связи будут разрушены, белок начнет разворачиваться и терять способность функционировать должным образом
- Температуры, при которых происходит денатурация белков, могут различаться, но большинство человеческих белков оптимально функционируют при температуре тела (~37ºC)
pH
- Аминокислоты представляют собой цвиттерионы, нейтральные молекулы, обладающие как отрицательно (COO–), так и положительно (Nh4+) заряженными областями
- Изменение pH изменит заряд белка, что, в свою очередь, изменит растворимость белка и общую форму
- Все белки имеют оптимальный pH, который зависит от среды, в которой они функционируют (например, белкам желудка для работы требуется кислая среда, тогда как белки крови лучше всего функционируют при нейтральном pH)
Навыки:
2. 4.S.1 Рисование молекулярных диаграмм, показывающих образование пептидной связи.
4.S.1 Рисование молекулярных диаграмм, показывающих образование пептидной связи.
- Образование пептидной связи в реакциях конденсации.
Пептидные связи образуются между аминогруппой и карбоксильной группой соседних аминокислот
Аминогруппа теряет атом водорода (H), а карбоновая кислота теряет гидроксил (OH) – при этом образуется вода (h3O)
Ключевые термины:
аминокислоты | полипептид | пептидных связей | конденсация | дипептид |
Class Assignment:
Protein Rules
Modeling Protein Lab
Protein Denaturation Lab
Amino Acids
Topic 2. 4 Review
4 Review
T opic 2.4 Kahoot Review Quiz
Powerpoint и примечания по теме 2.4 Криса Пейна
Правильное использование терминологии является ключевым навыком в биологии. Очень важно правильно использовать ключевые термины при выражении своего понимания, особенно в оценках. Используйте карточки-викторины или другие инструменты, такие как изучение, разброс, космическая гонка, правописание и тест, чтобы помочь вам освоить словарный запас.
,
Helpful Links:
The Macromolecules of Life
BBC Bitesize
Protein Denature McGraw Hill
Biomolecules: Proteins
Amino Acid and Peptide Bond Animation
Life Cycle of a Белок
Изменение структуры белка при нагревании
Секреция белка
Игра ацидероидов
Аминокислоты и белки from John Kyrk
Life Cycle of a Protein from Sumanas
Making polypeptides from John Kyrk
Protein Structures and Protein Folding by John Gianni
In the News:
U of A professors Исследовательская связь между белками и болезнью Альцгеймера0693 Разработка некоторых методов приносит пользу определенным человеческим группам больше, чем другим. Например, разработка безлактозного молока, доступного в Европе и Северной Америке, принесет больше пользы в Африке/Азии, где более распространена непереносимость лактозы. Разработка методик требует финансовых вложений. Следует ли делиться знаниями, когда методы, разработанные в одной части мира, более применимы в другой?
Например, разработка безлактозного молока, доступного в Европе и Северной Америке, принесет больше пользы в Африке/Азии, где более распространена непереносимость лактозы. Разработка методик требует финансовых вложений. Следует ли делиться знаниями, когда методы, разработанные в одной части мира, более применимы в другой?
Видеоклипы:
Пол Андерсен объясняет структуру и важность белков. Он описывает, как белки создаются из аминокислот, связанных путем дегидратационного синтеза. Он показывает важность химических свойств в R-группах отдельных аминокислот в полипептиде. Он объясняет четыре уровня сворачивания белков и дает вам возможность самостоятельно складывать белки с помощью игры Foldi 9.0042
Профессор Дэйв объясняет, что все слышали о белках. Что они собой представляют на молекулярном уровне? Конечно, это полимеры аминокислот. Они составляют большую часть вашего тела, поэтому мы должны очень хорошо понимать их строение! Ознакомьтесь с этим, чтобы узнать об иерархии структуры белка, чтобы позже мы могли узнать все о том, что могут делать разные типы белков.
Большой скачок в нашем понимании фолдинга белков может открыть двери для новых лекарств и материалов на основе белков, разработанных с нуля.
В течение 50 лет «проблема сворачивания белков» оставалась большой загадкой. Как миниатюрное химическое вещество, похожее на струну, — белковая молекула — кодирует функции живых организмов: как действуют наши мышцы, как наша иммунная система отвергает болезнетворные микроорганизмы, как наши глаза видят окружающее, как растения преобразуют солнечную энергию и т. отдыхать. Достигнут огромный прогресс. Более того, эти удивительные наномашины могут сыграть важную роль в области здравоохранения, болезней и торговли в будущем.
Protein Structure and Protein Denaturation HD Animation
youtube.com/embed/O5uqdxQyJj8?wmode=opaque» frameborder=»0″ allowfullscreen=»»>Reference sites
i-Biology
Click4Biology
Online IB Biology Subject Guide
BioNinja
Biology For Life
IB Biology Help
2.3 Биологические молекулы – концепции биологии – 1-е канадское издание
Перейти к содержанию
Глава 2: Введение в химию жизни
К концу этого раздела вы сможете:
- Описывать, каким образом углерод имеет решающее значение для жизни
- Объясните влияние незначительных изменений аминокислот на организмы
- Опишите четыре основных типа биологических молекул
- Понять функции четырех основных типов молекул
Посмотрите видео о белках и белковых ферментах.
Большие молекулы, необходимые для жизни, построенные из более мелких органических молекул, называются биологическими макромолекул . Существует четыре основных класса биологических макромолекул (углеводы, липиды, белки и нуклеиновые кислоты), каждый из которых является важным компонентом клетки и выполняет широкий спектр функций. В совокупности эти молекулы составляют большую часть массы клетки. Биологические макромолекулы являются органическими, а это означает, что они содержат углерод. Кроме того, они могут содержать водород, кислород, азот, фосфор, серу и дополнительные микроэлементы.
Существует четыре основных класса биологических макромолекул (углеводы, липиды, белки и нуклеиновые кислоты), каждый из которых является важным компонентом клетки и выполняет широкий спектр функций. В совокупности эти молекулы составляют большую часть массы клетки. Биологические макромолекулы являются органическими, а это означает, что они содержат углерод. Кроме того, они могут содержать водород, кислород, азот, фосфор, серу и дополнительные микроэлементы.
Часто говорят, что жизнь основана на углероде. Это означает, что атомы углерода, связанные с другими атомами углерода или другими элементами, образуют фундаментальные компоненты многих, если не большинства, молекул, встречающихся только в живых существах. Другие элементы играют важную роль в биологических молекулах, но углерод определенно считается «основным» элементом для молекул живых существ. Именно связывающие свойства атомов углерода ответственны за его важную роль.
Углерод содержит четыре электрона на внешней оболочке. Следовательно, он может образовывать четыре ковалентные связи с другими атомами или молекулами. Простейшей органической молекулой углерода является метан (CH 4 ), в котором четыре атома водорода связаны с атомом углерода.
Следовательно, он может образовывать четыре ковалентные связи с другими атомами или молекулами. Простейшей органической молекулой углерода является метан (CH 4 ), в котором четыре атома водорода связаны с атомом углерода.
Однако более сложные конструкции изготавливаются из углерода. Любой из атомов водорода может быть заменен другим атомом углерода, ковалентно связанным с первым атомом углерода. Таким образом можно получить длинные и разветвленные цепи углеродных соединений (рис. 2.13.9).0003 и ). Атомы углерода могут связываться с атомами других элементов, таких как азот, кислород и фосфор (рис. 2.13 b ). Молекулы также могут образовывать кольца, которые сами могут соединяться с другими кольцами (рис. 2.13 c ). Это разнообразие молекулярных форм объясняет разнообразие функций биологических макромолекул и в значительной степени основано на способности углерода образовывать множественные связи с самим собой и другими атомами.
Углеводы представляют собой макромолекулы, с которыми большинство потребителей знакомы. Чтобы похудеть, некоторые люди придерживаются «низкоуглеводной» диеты. Спортсмены, напротив, часто «загружаются углеводами» перед важными соревнованиями, чтобы убедиться, что у них достаточно энергии для соревнований на высоком уровне. Углеводы, по сути, являются неотъемлемой частью нашего рациона; злаки, фрукты и овощи являются естественными источниками углеводов. Углеводы обеспечивают организм энергией, в частности, через глюкозу, простой сахар. Углеводы также выполняют другие важные функции в организме человека, животных и растений.
Углеводы также выполняют другие важные функции в организме человека, животных и растений.
Углеводы можно представить формулой (CH 2 O) n , где n — число атомов углерода в молекуле. Другими словами, отношение углерода к водороду и кислороду составляет 1:2:1 в молекулах углеводов. Углеводы делятся на три подтипа: моносахариды, дисахариды и полисахариды.
Моносахариды (моно- = «один»; сахар- = «сладкий») представляют собой простые сахара, наиболее распространенным из которых является глюкоза. В моносахаридах число атомов углерода обычно колеблется от трех до шести. Большинство названий моносахаридов заканчиваются суффиксом -ose. В зависимости от количества атомов углерода в сахаре они могут быть известны как триозы (три атома углерода), пентозы (пять атомов углерода) и гексозы (шесть атомов углерода).
Моносахариды могут существовать в виде линейных цепочек или кольцеобразных молекул; в водных растворах они обычно находятся в кольцевой форме.
Химическая формула глюкозы C 6 H 12 O 6 . У большинства живых организмов глюкоза является важным источником энергии. Во время клеточного дыхания энергия высвобождается из глюкозы, и эта энергия используется для производства аденозинтрифосфата (АТФ). Растения синтезируют глюкозу, используя углекислый газ и воду в процессе фотосинтеза, а глюкоза, в свою очередь, используется для энергетических потребностей растения. Избыток синтезированной глюкозы часто откладывается в виде крахмала, который расщепляется другими организмами, питающимися растениями.
Галактоза (часть лактозы или молочного сахара) и фруктоза (содержится во фруктах) являются другими распространенными моносахаридами. Хотя глюкоза, галактоза и фруктоза имеют одинаковую химическую формулу (C 6 H 12 O 6 ), они отличаются структурно и химически (и известны как изомеры) из-за различного расположения атомов в углеродной цепи. .
Рисунок 2. 14. Глюкоза, галактоза и фруктоза являются изомерными моносахаридами, что означает, что они имеют одинаковую химическую формулу, но немного различаются по структуре.
14. Глюкоза, галактоза и фруктоза являются изомерными моносахаридами, что означает, что они имеют одинаковую химическую формулу, но немного различаются по структуре.Дисахариды (ди- = «два») образуются, когда два моносахарида подвергаются реакции дегидратации (реакция, при которой происходит удаление молекулы воды). В ходе этого процесса гидроксильная группа (–OH) одного моносахарида соединяется с атомом водорода другого моносахарида, высвобождая молекулу воды (H 2 O) и образуя ковалентную связь между атомами в двух молекулах сахара.
Общие дисахариды включают лактозу, мальтозу и сахарозу. Лактоза – это дисахарид, состоящий из мономеров глюкозы и галактозы. В природе содержится в молоке. Мальтоза, или солодовый сахар, представляет собой дисахарид, образующийся в результате реакции дегидратации между двумя молекулами глюкозы. Наиболее распространенным дисахаридом является сахароза или столовый сахар, который состоит из мономеров глюкозы и фруктозы.
Длинная цепь моносахаридов, связанных ковалентными связями, известна как полисахарид (поли- = «много»). Цепь может быть разветвленной или неразветвленной, и она может содержать различные типы моносахаридов. Полисахариды могут быть очень большими молекулами. Крахмал, гликоген, целлюлоза и хитин являются примерами полисахаридов.
Крахмал представляет собой запасенную форму сахаров в растениях и состоит из амилозы и амилопектина (оба полимеры глюкозы). Растения способны синтезировать глюкозу, а избыток глюкозы откладывается в виде крахмала в различных частях растения, включая корни и семена. Крахмал, потребляемый животными, расщепляется на более мелкие молекулы, такие как глюкоза. Затем клетки могут поглощать глюкозу.
Гликоген представляет собой запасную форму глюкозы у людей и других позвоночных и состоит из мономеров глюкозы. Гликоген является животным эквивалентом крахмала и представляет собой сильно разветвленную молекулу, обычно хранящуюся в клетках печени и мышц. Всякий раз, когда уровень глюкозы снижается, гликоген расщепляется с выделением глюкозы.
Всякий раз, когда уровень глюкозы снижается, гликоген расщепляется с выделением глюкозы.
Целлюлоза — один из самых распространенных природных биополимеров. Клеточные стенки растений в основном состоят из целлюлозы, которая обеспечивает структурную поддержку клетки. Древесина и бумага в основном целлюлозные по своей природе. Целлюлоза состоит из мономеров глюкозы, которые связаны связями между определенными атомами углерода в молекуле глюкозы.
Все остальные мономеры глюкозы в целлюлозе перевернуты и плотно упакованы в виде вытянутых длинных цепей. Это придает целлюлозе жесткость и высокую прочность на растяжение, что так важно для растительных клеток. Целлюлоза, проходящая через нашу пищеварительную систему, называется пищевыми волокнами. В то время как глюкозо-глюкозные связи в целлюлозе не могут быть разрушены пищеварительными ферментами человека, травоядные животные, такие как коровы, буйволы и лошади, способны переваривать траву, богатую целлюлозой, и использовать ее в качестве источника пищи. У этих животных некоторые виды бактерий обитают в рубце (часть пищеварительной системы травоядных) и выделяют фермент целлюлазу. Аппендикс также содержит бактерии, расщепляющие целлюлозу, что придает ей важную роль в пищеварительной системе жвачных животных. Целлюлазы могут расщеплять целлюлозу на мономеры глюкозы, которые могут использоваться животным в качестве источника энергии.
У этих животных некоторые виды бактерий обитают в рубце (часть пищеварительной системы травоядных) и выделяют фермент целлюлазу. Аппендикс также содержит бактерии, расщепляющие целлюлозу, что придает ей важную роль в пищеварительной системе жвачных животных. Целлюлазы могут расщеплять целлюлозу на мономеры глюкозы, которые могут использоваться животным в качестве источника энергии.
Углеводы выполняют другие функции у разных животных. Членистоногие, такие как насекомые, пауки и крабы, имеют внешний скелет, называемый экзоскелетом, который защищает их внутренние части тела. Этот экзоскелет состоит из биологической макромолекулы хитина , азотсодержащего углевода. Он состоит из повторяющихся звеньев модифицированного сахара, содержащего азот.
Таким образом, благодаря различиям в молекулярной структуре углеводы способны выполнять очень разные функции накопления энергии (крахмал и гликоген) и структурной поддержки и защиты (целлюлоза и хитин).
Рис. 2. 15. Хотя их структура и функции различны, все полисахаридные углеводы состоят из моносахаридов и имеют химическую формулу (Ch3O)n.
15. Хотя их структура и функции различны, все полисахаридные углеводы состоят из моносахаридов и имеют химическую формулу (Ch3O)n.Зарегистрированный диетолог: Ожирение является проблемой здравоохранения во всем мире, и многие заболевания, такие как диабет и болезни сердца, становятся все более распространенными из-за ожирения. Это одна из причин, почему все чаще обращаются за советом к зарегистрированным диетологам. Зарегистрированные диетологи помогают планировать продукты питания и программы питания для людей в различных условиях. Они часто работают с пациентами в медицинских учреждениях, разрабатывая планы питания для профилактики и лечения заболеваний. Например, диетологи могут научить пациента с диабетом, как управлять уровнем сахара в крови, употребляя углеводы правильного типа и количества. Диетологи также могут работать в домах престарелых, школах и частных практиках.
Чтобы стать зарегистрированным диетологом, необходимо получить как минимум степень бакалавра в области диетологии, питания, пищевых технологий или смежных областях. Кроме того, зарегистрированные диетологи должны пройти стажировку под наблюдением и сдать национальный экзамен. Те, кто занимается диетологией, проходят курсы по питанию, химии, биохимии, биологии, микробиологии и физиологии человека. Диетологи должны стать экспертами в области химии и функций пищи (белков, углеводов и жиров).
Кроме того, зарегистрированные диетологи должны пройти стажировку под наблюдением и сдать национальный экзамен. Те, кто занимается диетологией, проходят курсы по питанию, химии, биохимии, биологии, микробиологии и физиологии человека. Диетологи должны стать экспертами в области химии и функций пищи (белков, углеводов и жиров).
Через призму коренных народов (Сюзанна Вилкерсон и Чарльз Молнар)
Я работаю в колледже Камосун, расположенном в красивой Виктории, Британская Колумбия, с кампусами на традиционных территориях народов леквунген и васанеч. Показанная ниже подземная луковица цветка камас была важным источником пищи для многих коренных народов острова Ванкувер и всей западной части Северной Америки. Луковицы камас до сих пор едят как традиционный источник пищи, и приготовление луковиц камас относится к этому текстовому разделу об углеводах.
Рис. 2.16. Изображение цветка голубой камас и насекомого-опылителя. Подземная луковица камаса запекается в яме для костра.
 Тепло действует подобно ферменту амилазе поджелудочной железы и расщепляет длинные цепи неперевариваемого инулина на усваиваемые моно- и дисахариды.
Тепло действует подобно ферменту амилазе поджелудочной железы и расщепляет длинные цепи неперевариваемого инулина на усваиваемые моно- и дисахариды.Чаще всего растения создают крахмал в виде хранимой формы углеводов. Некоторые растения, такие как камас, производят инулин. Инулин используется в качестве пищевых волокон, однако он плохо усваивается человеком. Если бы вы откусили сырую луковицу камаса, она была бы горькой на вкус и имела бы липкую текстуру. Метод, используемый коренными народами, чтобы сделать камас одновременно удобоваримым и вкусным, заключается в том, чтобы медленно запекать луковицы в течение длительного периода в подземной яме для костра, покрытой определенными листьями и землей. Тепло действует подобно ферменту амилазе поджелудочной железы и расщепляет длинные цепи инулина на легкоусвояемые моно- и дисахариды.
Правильно запеченные луковицы камас по вкусу напоминают сочетание запеченной груши и вареного инжира. Важно отметить, что, хотя голубые камы являются источником пищи, их не следует путать с камами белой смерти, которые особенно токсичны и смертоносны. Цветы выглядят по-разному, но луковицы очень похожи.
Цветы выглядят по-разному, но луковицы очень похожи.
Липиды включают разнообразную группу соединений, объединенных общим признаком. Липиды гидрофобны («водобоязненные») или нерастворимы в воде, поскольку являются неполярными молекулами. Это потому, что они представляют собой углеводороды, которые включают только неполярные связи углерод-углерод или углерод-водород. Липиды выполняют множество различных функций в клетке. Клетки хранят энергию для длительного использования в виде липидов, называемых 9.0003 жиры . Липиды также обеспечивают изоляцию растений и животных от окружающей среды. Например, они помогают держать водоплавающих птиц и млекопитающих сухими из-за их водоотталкивающей природы. Липиды также являются строительными блоками многих гормонов и важным компонентом плазматической мембраны. Липиды включают жиры, масла, воски, фосфолипиды и стероиды.
Рисунок 2.17. Гидрофобные липиды в мехе водных млекопитающих, таких как речная выдра, защищают их от непогоды.
Молекула жира, такая как триглицерид, состоит из двух основных компонентов — глицерина и жирных кислот. Глицерин представляет собой органическое соединение с тремя атомами углерода, пятью атомами водорода и тремя гидроксильными (-ОН) группами. Жирные кислоты имеют длинную цепь углеводородов, к которой присоединена кислая карбоксильная группа, отсюда и название «жирная кислота». Число атомов углерода в жирной кислоте может составлять от 4 до 36; наиболее распространены те, которые содержат 12–18 атомов углерода. В молекуле жира жирная кислота присоединена ковалентной связью к каждому из трех атомов кислорода в группах –ОН молекулы глицерина.
Рис. 2.18. Липиды включают жиры, такие как триглицериды, которые состоят из жирных кислот и глицерина, фосфолипидов и стероидов. Во время образования этой ковалентной связи высвобождаются три молекулы воды. Три жирные кислоты в жире могут быть похожими или разными. Эти жиры также называют триглицеридами , потому что они содержат три жирные кислоты. Некоторые жирные кислоты имеют общие названия, указывающие на их происхождение. Например, пальмитиновую кислоту, насыщенную жирную кислоту, получают из пальмы. Арахиновая кислота получается из Arachis hypogaea , научное название арахиса.
Некоторые жирные кислоты имеют общие названия, указывающие на их происхождение. Например, пальмитиновую кислоту, насыщенную жирную кислоту, получают из пальмы. Арахиновая кислота получается из Arachis hypogaea , научное название арахиса.
Жирные кислоты могут быть насыщенными или ненасыщенными. В цепи жирных кислот, если между соседними атомами углерода в углеводородной цепи имеются только одинарные связи, жирная кислота является насыщенной. Насыщенные жирные кислоты насыщены водородом; другими словами, число атомов водорода, присоединенных к углеродному скелету, максимально.
Когда углеводородная цепь содержит двойную связь, жирная кислота представляет собой ненасыщенная жирная кислота .
Большинство ненасыщенных жиров являются жидкими при комнатной температуре и называются маслами . Если в молекуле есть одна двойная связь, то он известен как мононенасыщенный жир (например, оливковое масло), а если имеется более одной двойной связи, то он известен как полиненасыщенный жир (например, масло канолы).
Насыщенные жиры имеют тенденцию к плотной упаковке и остаются твердыми при комнатной температуре. Животные жиры со стеариновой и пальмитиновой кислотами, содержащиеся в мясе, и жиры с масляной кислотой, содержащиеся в сливочном масле, являются примерами насыщенных жиров. Млекопитающие хранят жиры в специализированных клетках, называемых адипоцитами, где шарики жира занимают большую часть клетки. У растений жир или масло хранится в семенах и используется в качестве источника энергии во время эмбрионального развития.
Ненасыщенные жиры или масла обычно имеют растительное происхождение и содержат ненасыщенные жирные кислоты. Двойная связь вызывает изгиб или «перегиб», который препятствует плотной упаковке жирных кислот, сохраняя их жидкими при комнатной температуре. Оливковое масло, кукурузное масло, масло канолы и масло печени трески являются примерами ненасыщенных жиров. Ненасыщенные жиры помогают улучшить уровень холестерина в крови, тогда как насыщенные жиры способствуют образованию бляшек в артериях, что увеличивает риск сердечного приступа.
В пищевой промышленности масла искусственно гидрогенизируют, чтобы сделать их полутвердыми, что снижает их порчу и увеличивает срок хранения. Проще говоря, газообразный водород пропускают через масла, чтобы они затвердели. Во время этого процесса гидрирования двойные связи цис -конформации в углеводородной цепи могут быть преобразованы в двойные связи транс -конформации. Это образует транс -жир из цис -жир. Ориентация двойных связей влияет на химические свойства жира.
Рис. 2.19. В процессе гидрогенизации ориентация вокруг двойных связей меняется, в результате чего из цис-жира образуется транс-жир. Это изменяет химические свойства молекулы. Маргарин, некоторые виды арахисового масла и шортенинг являются примерами искусственно гидрогенизированных транс -жиров. Недавние исследования показали, что увеличение содержания транс- -жиров в рационе человека может привести к повышению уровня липопротеинов низкой плотности (ЛПНП) или «плохого» холестерина, что, в свою очередь, может привести к отложению бляшек в артерии, что приводит к сердечно-сосудистым заболеваниям. Многие рестораны быстрого питания недавно отказались от использования транс -жиры, и теперь на этикетках продуктов питания в США требуется указывать содержание транс -жиров.
Многие рестораны быстрого питания недавно отказались от использования транс -жиры, и теперь на этикетках продуктов питания в США требуется указывать содержание транс -жиров.
Незаменимые жирные кислоты — это жирные кислоты, которые необходимы, но не синтезируются человеческим организмом. Следовательно, они должны быть дополнены через диету. Жирные кислоты Омега-3 попадают в эту категорию и являются одной из двух известных незаменимых жирных кислот для человека (другой является жирная кислота омега-6). Они представляют собой тип полиненасыщенных жиров и называются омега-3 жирными кислотами, потому что третий углерод с конца жирной кислоты участвует в двойной связи.
Лосось, форель и тунец являются хорошими источниками омега-3 жирных кислот. Жирные кислоты омега-3 важны для работы мозга, нормального роста и развития. Они также могут предотвратить сердечные заболевания и снизить риск развития рака.
Как и углеводы, жиры получили много дурной славы. Это правда, что чрезмерное употребление жареной и другой «жирной» пищи приводит к увеличению веса. Однако жиры выполняют важные функции. Жиры служат долгосрочным хранилищем энергии. Они также обеспечивают теплоизоляцию тела. Поэтому «здоровые» ненасыщенные жиры в умеренных количествах следует употреблять на регулярной основе.
Это правда, что чрезмерное употребление жареной и другой «жирной» пищи приводит к увеличению веса. Однако жиры выполняют важные функции. Жиры служат долгосрочным хранилищем энергии. Они также обеспечивают теплоизоляцию тела. Поэтому «здоровые» ненасыщенные жиры в умеренных количествах следует употреблять на регулярной основе.
Фосфолипиды являются основным компонентом плазматической мембраны. Как и жиры, они состоят из цепочек жирных кислот, прикрепленных к глицерину или аналогичному остову. Однако вместо трех присоединенных жирных кислот имеются две жирные кислоты, а третий углерод основной цепи глицерина связан с фосфатной группой. Фосфатную группу модифицируют добавлением спирта.
Фосфолипид имеет как гидрофобные, так и гидрофильные участки. Цепи жирных кислот гидрофобны и исключают себя из воды, тогда как фосфаты гидрофильны и взаимодействуют с водой.
Клетки окружены мембраной, которая имеет двойной слой фосфолипидов. Жирные кислоты фосфолипидов обращены внутрь, от воды, тогда как фосфатная группа может быть обращена либо к внешней среде, либо внутрь клетки, которые оба являются водными.
Через призму коренных народов
Для первых народов Тихоокеанского Северо-Запада богатая жирами рыба олиган с 20% жира по массе тела была важной частью рациона нескольких коренных народов. Почему? Потому что жир является самой калорийной пищей, и для выживания важно иметь компактный высококалорийный источник энергии. Характер его жира также сделал его важным товаром. Подобно лососю, олиган возвращается в родной ручей после многих лет плавания в море. Его прибытие ранней весной сделало его первым свежим продуктом года. В цимшианских языках о прибытии улигана… традиционно возвещали восклицанием: «Хлаа аат’иксши халимутхв!»… что означает «Наш Спаситель только что прибыл!»
Рис. 2.20. Изображение приготовленного олигана. Эта богатая жирами рыба, содержащая 20% жира от массы тела, является важной частью рациона коренных народов.
Как вы уже узнали, все жиры гидрофобны (ненавидят воду). Чтобы изолировать жир, рыбу варят и снимают плавающий жир. Жировой состав олигана состоит из 30% насыщенных жиров (например, сливочного масла) и 55% мононенасыщенных жиров (например, растительных масел). Важно отметить, что это твердая смазка при комнатной температуре. Поскольку в нем мало полиненасыщенных жиров (которые быстро окисляются и портятся), его можно хранить для последующего использования и использовать в качестве предмета торговли. Говорят, что его состав делает его таким же полезным для здоровья, как оливковое масло, или еще лучше, так как содержит омега-3 жирные кислоты, которые снижают риск диабета и инсульта. Он также богат тремя жирорастворимыми витаминами А, Е и К.
Важно отметить, что это твердая смазка при комнатной температуре. Поскольку в нем мало полиненасыщенных жиров (которые быстро окисляются и портятся), его можно хранить для последующего использования и использовать в качестве предмета торговли. Говорят, что его состав делает его таким же полезным для здоровья, как оливковое масло, или еще лучше, так как содержит омега-3 жирные кислоты, которые снижают риск диабета и инсульта. Он также богат тремя жирорастворимыми витаминами А, Е и К.
Стероиды и воски
В отличие от фосфолипидов и жиров, обсуждавшихся ранее, стероиды имеют кольцевую структуру. Хотя они не похожи на другие липиды, их объединяют с ними, поскольку они также являются гидрофобными. Все стероиды имеют четыре связанных углеродных кольца, и некоторые из них, как и холестерин, имеют короткий хвост.
Холестерин — это стероид. Холестерин в основном синтезируется в печени и является предшественником многих стероидных гормонов, таких как тестостерон и эстрадиол. Он также является предшественником витаминов Е и К. Холестерин является предшественником солей желчных кислот, которые способствуют расщеплению жиров и их последующему усвоению клетками. Хотя о холестерине часто говорят в негативном ключе, он необходим для правильного функционирования организма. Это ключевой компонент плазматических мембран клеток животных.
Он также является предшественником витаминов Е и К. Холестерин является предшественником солей желчных кислот, которые способствуют расщеплению жиров и их последующему усвоению клетками. Хотя о холестерине часто говорят в негативном ключе, он необходим для правильного функционирования организма. Это ключевой компонент плазматических мембран клеток животных.
Воски состоят из углеводородной цепи со спиртовой (-ОН) группой и жирной кислоты. Примеры восков животного происхождения включают пчелиный воск и ланолин. У растений также есть воск, например, покрытие на листьях, которое помогает предотвратить их высыхание.
Концепция в действии
Чтобы получить дополнительную информацию о липидах, изучите «Биомолекулы: липиды» с помощью этой интерактивной анимации.
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Функции белков очень разнообразны, потому что существует 20 различных химически различных аминокислот, которые образуют длинные цепи, и аминокислоты могут располагаться в любом порядке. Например, белки могут функционировать как ферменты или гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (таких как пищеварение) и обычно представляют собой белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Ферменты могут разрушать молекулярные связи, перестраивать связи или образовывать новые связи. Примером фермента является слюнная амилаза, расщепляющая амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно белки или стероиды, секретируемые эндокринной железой или группой эндокринных клеток, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, поддерживающий уровень глюкозы в крови.
Например, инсулин — это белковый гормон, поддерживающий уровень глюкозы в крови.
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации (более подробно это будет обсуждаться позже). Все белки состоят из различных комбинаций одних и тех же 20 видов аминокислот.
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, связанного с аминогруппой (-NH 2 ), карбоксильной группы (-COOH) и атома водорода. Каждая аминокислота также имеет другой вариабельный атом или группу атомов, связанных с центральным атомом углерода, известную как группа R. Группа R — единственное различие в структуре между 20 аминокислотами; в остальном аминокислоты идентичны.
Каждая аминокислота также имеет другой вариабельный атом или группу атомов, связанных с центральным атомом углерода, известную как группа R. Группа R — единственное различие в структуре между 20 аминокислотами; в остальном аминокислоты идентичны.
Химическая природа группы R определяет химическую природу аминокислоты в ее белке (то есть, является ли она кислотной, основной, полярной или неполярной).
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа второй аминокислоты соединяются, высвобождая молекулу воды. Образующаяся связь является пептидной связью.
Образующаяся связь является пептидной связью.
Продукты, образованные такой связью, называются полипептидами . Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, имеют четкую форму и выполняют уникальную функцию.
Эволюция в действии
Эволюционное значение цитохрома с Цитохром с является важным компонентом молекулярного механизма, который собирает энергию из глюкозы. Поскольку роль этого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белков показало, что между молекулами цитохрома с разных видов существует значительное сходство последовательностей; эволюционные отношения можно оценить, измерив сходства или различия между белковыми последовательностями различных видов.
Например, ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с, которая была секвенирована на сегодняшний день из разных организмов, 37 из этих аминокислот появляются в одном и том же положении в каждом цитохроме с. Это указывает на то, что все эти организмы произошли от общего предка. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. При сравнении последовательностей человека и макаки-резус было обнаружено единственное различие в одной аминокислоте. Напротив, сравнение человека и дрожжей показывает разницу в 44 аминокислотах, что позволяет предположить, что люди и шимпанзе имеют более позднего общего предка, чем люди и макаки-резусы или люди и дрожжи.
Для каждой молекулы цитохрома с, которая была секвенирована на сегодняшний день из разных организмов, 37 из этих аминокислот появляются в одном и том же положении в каждом цитохроме с. Это указывает на то, что все эти организмы произошли от общего предка. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. При сравнении последовательностей человека и макаки-резус было обнаружено единственное различие в одной аминокислоте. Напротив, сравнение человека и дрожжей показывает разницу в 44 аминокислотах, что позволяет предположить, что люди и шимпанзе имеют более позднего общего предка, чем люди и макаки-резусы или люди и дрожжи.
Белковая структура
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный , вторичный, третичный и четвертичный .
Уникальная последовательность и количество аминокислот в полипептидной цепи является ее первичной структурой. Уникальная последовательность для каждого белка в конечном итоге определяется геном, который кодирует белок. Любое изменение в последовательности гена может привести к добавлению другой аминокислоты к полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии β-цепь гемоглобина имеет единственную аминокислотную замену, вызывающую изменение как структуры, так и функции белка. Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурное различие между молекулой нормального гемоглобина и молекулой серповидно-клеточной анемии, которое резко снижает продолжительность жизни у пораженных людей, заключается в одной аминокислоте из 600.
Из-за этого изменения одной аминокислоты в цепи, обычно двояковогнутые или дискообразные эритроциты принимают серповидную или «серповидную» форму, которая закупоривает артерии. Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, у кого есть это заболевание.
Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, у кого есть это заболевание.
Паттерны укладки, возникающие в результате взаимодействий между частями аминокислот, не относящимися к группе R, приводят к возникновению вторичной структуры белка. Наиболее распространены альфа-(α)-спиральные и бета-(β)-складчатые листовые структуры. Обе структуры удерживаются в форме водородными связями. В альфа-спирали связи образуются между каждой четвертой аминокислотой и вызывают поворот в аминокислотной цепи.
В β-складчатом листе «складки» образуются за счет водородных связей между атомами на основной цепи полипептидной цепи. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты выстраиваются параллельно друг другу, а водородные связи образуются между одними и теми же парами атомов на каждой из выровненных аминокислот. Структуры α-спирали и β-складок обнаружены во многих глобулярных и волокнистых белках.
Уникальная трехмерная структура полипептида известна как его третичная структура. Эта структура обусловлена химическими взаимодействиями между различными аминокислотами и областями полипептида. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Могут быть ионные связи, образованные между группами R на разных аминокислотах, или водородные связи помимо тех, которые участвуют во вторичной структуре. Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, гемоглобин представляет собой комбинацию четырех полипептидных субъединиц.
Каждый белок имеет свою уникальную последовательность и форму, скрепленные химическими взаимодействиями. Если белок подвергается изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму, что известно как денатурация , как обсуждалось ранее. Денатурация часто бывает обратимой, поскольку первичная структура сохраняется при удалении денатурирующего агента, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Один из примеров денатурации белка можно увидеть, когда жарят или варят яйцо. Белок альбумин в жидком яичном белке денатурирует при помещении на горячую сковороду, превращаясь из прозрачного вещества в непрозрачное белое вещество. Не все белки денатурируют при высоких температурах; например, бактерии, выживающие в горячих источниках, имеют белки, адаптированные для работы при таких температурах.
Концепция в действии
Чтобы получить дополнительную информацию о белках, изучите «Биомолекулы: белки» с помощью этой интерактивной анимации.
Нуклеиновые кислоты являются ключевыми макромолекулами в непрерывности жизни. Они несут генетический план клетки и инструкции по ее функционированию.
Двумя основными типами нуклеиновых кислот являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК) . ДНК — это генетический материал, присутствующий во всех живых организмах, от одноклеточных бактерий до многоклеточных млекопитающих.
Другой тип нуклеиновой кислоты, РНК, в основном участвует в синтезе белка. Молекулы ДНК никогда не покидают ядро, а вместо этого используют РНК-посредника для связи с остальной частью клетки. Другие типы РНК также участвуют в синтезе белка и его регуляции.
ДНК и РНК состоят из мономеров, известных как нуклеотидов . Нуклеотиды объединяются друг с другом, образуя полинуклеотид, ДНК или РНК. Каждый нуклеотид состоит из трех компонентов: азотистого основания, пентозного (пятиуглеродного) сахара и фосфатной группы. Каждое азотистое основание в нуклеотиде связано с молекулой сахара, которая присоединена к фосфатной группе.
Нуклеотиды объединяются друг с другом, образуя полинуклеотид, ДНК или РНК. Каждый нуклеотид состоит из трех компонентов: азотистого основания, пентозного (пятиуглеродного) сахара и фосфатной группы. Каждое азотистое основание в нуклеотиде связано с молекулой сахара, которая присоединена к фосфатной группе.
имеет двойную спиральную структуру. Он состоит из двух нитей или полимеров нуклеотидов. Нити образованы связями между фосфатными и сахарными группами соседних нуклеотидов. Нити соединены друг с другом у основания водородными связями, а нити закручиваются друг вокруг друга по всей длине, отсюда и название «двойная спираль», что означает двойную спираль.
Рис. 2.24. Химическая структура ДНК с цветной меткой, обозначающей четыре основания, а также фосфатный и дезоксирибозный компоненты остова. Чередующиеся сахарные и фосфатные группы располагаются снаружи каждой нити, образуя основу ДНК. Азотистые основания сложены внутри, как ступени лестницы, и эти основания спарены; пары связаны друг с другом водородными связями. Основания спариваются таким образом, что расстояние между остовами двух цепей одинаково на всем протяжении молекулы. Правило состоит в том, что нуклеотид А соединяется с нуклеотидом Т, а G с С, см. раздел 9..1 для более подробной информации.
Азотистые основания сложены внутри, как ступени лестницы, и эти основания спарены; пары связаны друг с другом водородными связями. Основания спариваются таким образом, что расстояние между остовами двух цепей одинаково на всем протяжении молекулы. Правило состоит в том, что нуклеотид А соединяется с нуклеотидом Т, а G с С, см. раздел 9..1 для более подробной информации.
Живые существа основаны на углероде, потому что углерод играет такую заметную роль в химии живых существ. Четыре положения ковалентной связи атома углерода могут привести к большому разнообразию соединений со многими функциями, что объясняет важность углерода в живых существах. Углеводы представляют собой группу макромолекул, которые являются жизненно важным источником энергии для клетки, обеспечивают структурную поддержку многих организмов и могут быть обнаружены на поверхности клетки в качестве рецепторов или для распознавания клетками. Углеводы классифицируются как моносахариды, дисахариды и полисахариды в зависимости от количества мономеров в молекуле.
Липиды представляют собой класс макромолекул, неполярных и гидрофобных по своей природе. Основные типы включают жиры и масла, воски, фосфолипиды и стероиды. Жиры и масла представляют собой накопленную форму энергии и могут включать триглицериды. Жиры и масла обычно состоят из жирных кислот и глицерина.
Белки представляют собой класс макромолекул, которые могут выполнять разнообразные функции в клетке. Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, носители или гормоны. Строительными блоками белков являются аминокислоты. Белки организованы на четырех уровнях: первичном, вторичном, третичном и четвертичном. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры, pH или химическим воздействием, может привести к денатурации белка и потере функции.
Нуклеиновые кислоты представляют собой молекулы, состоящие из повторяющихся единиц нуклеотидов, которые управляют клеточной активностью, такой как деление клеток и синтез белка. Каждый нуклеотид состоит из пентозного сахара, азотистого основания и фосфатной группы. Существует два типа нуклеиновых кислот: ДНК и РНК.
Каждый нуклеотид состоит из пентозного сахара, азотистого основания и фосфатной группы. Существует два типа нуклеиновых кислот: ДНК и РНК.
аминокислота: мономер белка
углевод: биологическая макромолекула, в которой отношение углерода к водороду к кислороду составляет 1:2:1; углеводы служат источником энергии и структурной опорой в клетках
целлюлоза: полисахарид, входящий в состав клеточных стенок растений и обеспечивающий структурную поддержку клетки стенки грибов
денатурация: потеря формы в белке в результате изменений температуры, pH или воздействия химических веществ
дезоксирибонуклеиновая кислота (ДНК): двухцепочечный полимер нуклеотидов, несущий наследственная информация клетки
дисахарид: два мономера сахара, соединенные пептидной связью
фермент : катализатор биохимической реакции, обычно сложный или сопряженный белок кислоты и глицерин (триглицерид), который обычно существует в твердой форме при комнатной температуре
гликоген: запасной углевод у животных
гормон: химическая сигнальная молекула, обычно белок или стероид, секретируемая эндокринной железой или группу эндокринных клеток; действует, чтобы контролировать или регулировать определенные физиологические процессы
липиды: класс макромолекул, неполярных и нерастворимых в воде
макромолекула: большая молекула, часто образованная полимеризацией более мелких мономеров нуклеиновая кислота: биологическая макромолекула, несущая генетическую информацию клетки и несущая инструкции по функционированию клетки
нуклеотид: мономер нуклеиновой кислоты; содержит пентозный сахар, фосфатную группу и азотистое основание
масло: ненасыщенный жир, который является жидкостью при комнатной температуре
фосфолипид: основной компонент мембран клеток; состоит из двух жирных кислот и фосфатной группы, присоединенной к глицериновому остову
полипептид: длинная цепь аминокислот, связанных пептидными связями
полисахарид: длинная цепь моносахаридов; может быть разветвленным или неразветвленным
белок: биологическая макромолекула, состоящая из одной или нескольких цепей аминокислот
рибонуклеиновая кислота (РНК): одноцепочечный полимер нуклеотидов, участвующий в синтезе белка
насыщенная жирная кислота: а длинноцепочечный углеводород с одинарными ковалентными связями в углеродной цепи; максимальное количество атомов водорода, присоединенных к углеродному скелету
крахмал: запасной углевод в растениях
стероид: тип липидов, состоящий из четырех конденсированных углеводородных колец связь
триглицерид: молекула жира; состоит из трех жирных кислот, связанных с молекулой глицерина
ненасыщенная жирная кислота: углеводород с длинной цепью, имеющий одну или более двойных связей в углеводородной цепи
Атрибуция СМИ
- Рисунок 2.
 16 Кена Босмы распространяется под лицензией CC BY 4.0.
16 Кена Босмы распространяется под лицензией CC BY 4.0. - Рис. 2.22 компании OpenStax распространяется под лицензией CC BY 4.0. Это модификация работы Национального института исследования генома человека, которая находится в открытом доступе.
- Рис. 2.24 Мадлен Прайс Болл лицензирован в соответствии с лицензией CC BY-SA 2.5.
License
Concepts of Biology — 1st Canadian Edition Чарльза Молнара и Джейн Гейр распространяется по лицензии Creative Commons Attribution 4.0 International License, если не указано иное.
Поделиться этой книгой
Поделиться в Твиттере
Белки (интерактивный учебник) – Learn-Biology
Структура страницы
- Функции белков
- Белки представляют собой полимеры аминокислот, связанные пептидными связями
- Викторина по аминокислотам, пептидным связям и полипептидам
- Белковая структура
- Введение: Белки имеют специфическую и динамичную форму
- Основная конструкция
- Вторичная конструкция
- Третичная структура
- Четвертичная структура
- Динамическая природа белков
- Денатурация
- Викторина о белках
1.
 Функции белков
Функции белковНачнем изучение белков с рассмотрения наших рук.
В основном белокНаши ногти состоят из белка под названием кератин . Другая форма кератина составляет внешний слой вашей кожи. Эластичность более глубоких слоев вашей кожи — способность вашей кожи возвращаться к своей форме после сжатия или растяжения — обеспечивается белком под названием эластин .
Копните немного глубже. Ваши пальцы двигаются, потому что они прикреплены к мышцам сухожилиями и связками, которые состоят из белка под названием коллагена . Мышцы, которые двигают кости в вашей руке, состоят из белков, таких как актин и миозин .
Подумай о своих венах. Красные кровяные тельца, которые текут внутри них, заполнены кислородсодержащим белком, называемым гемоглобином . Если бы вы порезали руку и заразились инфекцией, ваша иммунная система произвела бы белки, называемые иммуноглобулинами , для формирования антител, которые отражали бы проникновение бактерий.
Когда вы смотрите на любое животное, вы видите белок. Этого нельзя сказать о растениях, которые в основном состоят из углеводов. Но как этот углевод туда попал? Фермент, который вытягивает углекислый газ из воздуха для создания углеводов во время фотосинтеза, называется Rubisco. Как почти все ферменты, это белок.
Я мог бы продолжить. Но давайте систематизируем наши размышления о различных функциях белков, заполнив интерактивную таблицу ниже. Используйте предварительные знания, метод проб и ошибок (и не беспокойтесь о том, чтобы получить правильный ответ с первого раза).
[qwiz qrecord_id=»sciencemusicvideosMeister1961-Biochem: Functions of Proteins Table»]
[h]Некоторые функции белков
[q labels = «top»]
Белки
- Контроль химических реакций0038 ______________ .
- Создать _____________, например кость, волосы, перья (кератин)
- Бой __________ (антитела)
- Перемещение продукции (___________)
- ____________ кислород (гемоглобин в эритроцитах)
- Магазин __________________ (альбумин в яичном белке)
- Передают _________ в виде гормонов и нейротрансмиттеров.

БЕЛКИ ЯВЛЯЮТСЯ ___________________ МАКРОМОЛЕКУЛАМИ
[л] химическая энергия
[fx] Нет, это не так. Пожалуйста, попробуйте еще раз.
[ф*] Отлично!
[l] инфекция
[fx] Нет. Повторите попытку.
[ф*] Верно!
[l] ферменты
[fx] Нет, это неправильно. Пожалуйста, попробуйте еще раз.
[ф*] Отлично!
[l] САМОЕ РАЗНООБРАЗНОЕ
[fx] Нет, не так. Пожалуйста, попробуйте еще раз.
[ф*] Отлично!
[l] мышцы
[fx] Нет. Пожалуйста, попробуйте еще раз.
[ф*] Верно!
[l] структуры
[fx] Нет. Пожалуйста, попробуйте еще раз.
[ф*] Отлично!
[l] транспорт
[fx] Нет. Пожалуйста, попробуйте еще раз.
Пожалуйста, попробуйте еще раз.
[ф*] Верно!
[л] сигналы
[fx] Нет. Пожалуйста, попробуйте еще раз.
[ф*] Хорошо!
[/qwiz]
2. Белки представляют собой полимеры аминокислот, связанных пептидными связями
2а. Аминокислоты
Ранее мы узнали, что полисахариды представляют собой полимеры моносахаридов, а нуклеиновые кислоты представляют собой полимеры нуклеотидов. Точно так же белки представляют собой полимеры аминокислот.
В живых существах содержится двадцать аминокислот. Каждый из них имеет трехбуквенную аббревиатуру: «lys» для лизина, «ser» для серина и т. д. Все они являются вариациями общей структуры.
Аминокислота (неионизированное представление) В центре каждой аминокислоты находится центральный атом углерода (1 на диаграмме слева). Центральный углерод также называют альфа (α) углеродом. Этот центральный углерод окружен аминогруппой («2») и карбоновой кислотой («3»). Отсюда и название «аминокислота».
Отсюда и название «аминокислота».
Обратите внимание, что аминогруппа и карбоксильная группа могут быть показаны как в их неионизированной (как показано слева), так и в их ионизированной формах (как показано справа). Вы должны быть в состоянии признать оба.
В позиции «4» находится «группа R» или «боковая цепь». Каждая из двадцати аминокислот имеет отдельную группу R. Группы R заштрихованы на диаграмме ниже.
Двадцать аминокислот: Penn State Department of BiologyДвадцать аминокислот можно разделить на четыре группы на основании химического состава их боковых цепей. Эти группы R могут быть
- неполярными/гидрофобными
- Полярный/гидрофильный
- Кислотные (оставляя отрицательный заряд после того, как они отдали протон раствору)
- Основные (оставляя положительный заряд после того, как они поглотили протон из раствора)
Следуя нескольким правилам, вы можете легко определить, к какой категории относится аминокислота.
- Неполярные: R-группы с метильными функциональными группами (-CH 3 ) или с конденсированными углеродными кольцами.
- Полярные: группы R с гидроксильными (-OH) или сульфгидрильными (-SH) функциональными группами.
- Кислотный: группы R с функциональными группами карбоновой кислоты.
- Основной: группы R с функциональными аминогруппами: NH 3 + или NH 2 + или NH.
Это важно, поскольку мутации в ДНК могут привести к замене одной аминокислоты на другую. Если замененная аминокислота имеет другой химический состав, чем исходная аминокислота, влияние на структуру и функцию белка может быть значительным. Например, наследственное заболевание крови серповидноклеточная анемия вызывается заменой глутаминовой кислоты на валин в белке, называемом гемоглобином, который переносит кислород в эритроцитах. Глутаминовая кислота (очевидно) является кислотой, тогда как валин неполярен. Замена изменяет химический состав гемоглобина таким образом, что он полимеризуется в условиях низкого содержания кислорода, в результате чего эритроциты становятся шиповидными («2») вместо гладких («1»), блокируя капилляры и вызывая повреждение тканей.
Глутаминовая кислота (очевидно) является кислотой, тогда как валин неполярен. Замена изменяет химический состав гемоглобина таким образом, что он полимеризуется в условиях низкого содержания кислорода, в результате чего эритроциты становятся шиповидными («2») вместо гладких («1»), блокируя капилляры и вызывая повреждение тканей.
2.б. Пептидные связи
В процессе синтеза белка рибосомы (крошечные частицы внутри клеток, обозначенные цифрой «2» ниже) связывают аминокислоты («1») вместе, следуя инструкциям, посылаемым им ДНК клетки. Инструкции представлены в виде одноцепочечной нуклеиновой кислоты, называемой матричной РНК , обозначенной цифрой «3» ниже.
Рибосомы — это белковые фабрики клетки.Вот что происходит, когда рибосомы связывают аминокислоты вместе.
Образование пептидной связи Рибосома соединяет две аминокислоты («1» и «3»), удаляя функциональную гидроксильную группу (-ОН) из одной аминокислоты и атом водорода из другой. В результате получается дипептид («5»): две аминокислоты, связанные пептидной связью («4»). Поскольку это синтез дегидратации, в результате этой реакции также образуется молекула воды (в позиции «6»).
Поскольку это синтез дегидратации, в результате этой реакции также образуется молекула воды (в позиции «6»).
2с. Полипептиды
Добавьте больше аминокислот, и у вас получится полипептид (цепочка связанных аминокислот).
Полипептид. Попробуйте определить каждую пептидную связь.Так же, как буквы в слове могут быть в любом порядке, аминокислоты в белке могут быть в любом порядке. Однако, как я уже отмечал ранее, аналогия «буквы в слова = аминокислоты в белок» ограничена. Белки могут состоять из тысяч аминокислот, что делает вселенную потенциальных белков намного больше, чем вселенную потенциальных слов.
Давайте закончим этот раздел небольшим количеством белковой терминологии (все они появились на экзаменах AP bio после редизайна в 2012 году).
- Каждый из концов белковой/полипептидной цепи имеет определенное название. Аминокислота в начале белка имеет открытую функциональную аминогруппу (-NH 2 ). Эта аминокислота называется N-концом аминокислоты, а этот конец называется N-концом .
 Аминокислота на другом конце белка имеет открытую карбоксильную группу (-COOH), что делает ее С-концом аминокислоты, а этот конец С-конца . Вы увидите, что эти термины появляются в связи с ферментами, расщепляющими белок, некоторые из которых могут отщеплять аминокислоты только на N-конце, а другие ограничены С-концом.
Аминокислота на другом конце белка имеет открытую карбоксильную группу (-COOH), что делает ее С-концом аминокислоты, а этот конец С-конца . Вы увидите, что эти термины появляются в связи с ферментами, расщепляющими белок, некоторые из которых могут отщеплять аминокислоты только на N-конце, а другие ограничены С-концом. - Аминокислоту в полипептидной цепи иногда называют остатком (потому что это то, что осталось после реакции синтеза дегидратации, которая поместила ее туда). Например, при обсуждении мутации гемоглобина, вызывающей серповидноклеточную анемию, вы можете прочитать, что «мутация находится в шестом аминокислотном остатке », , как показано ниже
Они просто говорят, что она находится в шестом аминокислота цепи (и теперь она вас не побеспокоит, когда вы ее увидите!).
3. Аминокислоты, пептидные связи и полипептиды: проверка понимания
[h]
Викторина по белкам 1
[i]
[x][restart][/qwiz]
4.
 Структура белков
Структура белков4a. Белки специфичны и динамичны
Белковая структура имеет несколько замечательных особенностей. Первый — специфика формы . Чтобы понять это, давайте подумаем о нашей иммунной системе.
Представьте, что вы заражены вирусом («1»). Ваша иммунная система контратакует, вырабатывая белки, называемые антителами («3»), которые могут связываться со специфическими молекулами на поверхности вируса. Эти молекулы называются антигенами («2»).
Антитело может связываться с антигеном, потому что кончик антитела имеет сайт связывания антигена («4»), форма которого точно соответствует или дополняет форму антигена. Это связывание либо непосредственно нейтрализует вирус (удерживая его, например, от заражения клетки), либо позволяет другим частям иммунной системы нейтрализовать и уничтожить вирус.
Антитело. Источник: Институт медицинских исследований Гарвана / Центр таргетной терапии. Permission Pending На диаграмме выше я нарисовал антиген в виде круга и придал сайту связывания антигена на антителе комплементарную форму. Но чтобы получить представление о необходимой специфичности антигенсвязывающего сайта, взгляните на изображение справа, полученное Гарванским институтом медицинских исследований/Центром таргетной терапии. Это модель, заполняющая пространство, в которой представлен каждый атом (примечание: я настроил изображение таким образом, что вы можете щелкнуть по нему, чтобы открыть новую вкладку с его увеличенной версией: пожалуйста, щелкните по нему, чтобы внимательно рассмотреть участки связывания антигена на кончиках плеч). Ключевым моментом является то, что эта форма, вплоть до нанометрового масштаба, специфична. Он может выполнять свою работу (связываться с антигеном), только если имеет именно такую форму. И это приводит к вопросу: как можно так точно определить форму белка?
Но чтобы получить представление о необходимой специфичности антигенсвязывающего сайта, взгляните на изображение справа, полученное Гарванским институтом медицинских исследований/Центром таргетной терапии. Это модель, заполняющая пространство, в которой представлен каждый атом (примечание: я настроил изображение таким образом, что вы можете щелкнуть по нему, чтобы открыть новую вкладку с его увеличенной версией: пожалуйста, щелкните по нему, чтобы внимательно рассмотреть участки связывания антигена на кончиках плеч). Ключевым моментом является то, что эта форма, вплоть до нанометрового масштаба, специфична. Он может выполнять свою работу (связываться с антигеном), только если имеет именно такую форму. И это приводит к вопросу: как можно так точно определить форму белка?
Вторая особенность формы белка, которую необходимо объяснить, заключается в том, что форма многих белков является динамической. Он может измениться.
Давайте рассмотрим, что происходит, когда вы сокращаете мышцу. Участвуют два взаимодействующих белка: актин (в «1») и миозин (в «2а» и «2b»). Они взаимодействуют, образуя поперечный мостик (в позиции «3»), что стало возможным благодаря комплементарности по форме между головкой миозина и участком связывания на актине.
Участвуют два взаимодействующих белка: актин (в «1») и миозин (в «2а» и «2b»). Они взаимодействуют, образуя поперечный мостик (в позиции «3»), что стало возможным благодаря комплементарности по форме между головкой миозина и участком связывания на актине.
Когда миозин связывается с АТФ (энергетической молекулой клетки: нажмите здесь , чтобы узнать больше о том, как это работает), АТФ расщепляется на более низкую энергетическую форму (АДФ и P i ), что позволяет миозину достигать и схватиться за актин. Когда миозин высвобождает АДФ и Р и , он снова меняет форму, изгибаясь под прямым углом (как показано на «2b»), что тянет за собой актин, укорачивая мышечное волокно.
Другими словами, белок миозин подобен рычагу: снабдите его АТФ (и выполните несколько других условий), и он согнется. Другие белковые структуры вращаются как пропеллеры.
Найдите три минуты и посмотрите видео ниже, созданное XVIVO для Гарвардского университета.
Почти все представленные умопомрачительные вещи связаны с динамической природой белков. Итак, вопрос в том, какая молекулярная структура позволяет белку (например, миозину) изменять свою форму?
4б. Первичная структура
Поток информации, ведущий к первичной структуре: от ДНК к РНК к белкуСпецифичность формы белка, а также способность многих белков изменять форму возникает из трех или четырех уровней молекулярных взаимодействий, обычно называемых « уровни структуры». Первый уровень, также называемый первичная структура определяется генетически.
ДНК («3») в ядре («2») наших клеток («1») содержит инструкции по созданию РНК («5»).
Эта РНК синтезируется посредством процесса, называемого транскрипцией, который обозначен стрелкой у цифры «4». После транскрипции различные процессы в ядре модифицируют РНК, превращая ее в информационную РНК (мРНК).
После транскрипции различные процессы в ядре модифицируют РНК, превращая ее в информационную РНК (мРНК).
мРНК покидает ядро и попадает в цитоплазму («6»), где рибосомы («7») переводят РНК в полипептид («8»).
Первичная структураОбратите внимание, что каждый из маленьких кружков в цифре «8» выше представляет собой аминокислотный остаток. Теперь соедините этот образ с тем, что вы узнали об аминокислотах, пептидных связях и полипептидах. «8» выше с точки зрения биохимии соответствует тому, что вы видите справа: линейная последовательность аминокислотных остатков в полипептидной цепи.
Итак, теперь нам нужно объяснить, как мы переходим от генетически детерминированной линейной последовательности аминокислот в полипептидной цепи к трехмерной форме белка.
4с. Вторичная структура
Следующий уровень взаимодействия включает водородные связи, которые образуются между карбонильными функциональными группами и аминогруппами в основной цепи полипептида. Чтобы убедиться в этом, взгляните на диаграмму полипептида ниже:
Чтобы убедиться в этом, взгляните на диаграмму полипептида ниже:
Цифра «1» — полипептидный остов. Точно так же, как ваши ребра прикреплены к остову, боковые цепи/R-группы каждого аминокислотного остатка присоединены к остову полипептида.
Полипептид был образован путем соединения аминогруппы одной аминокислоты с карбоксильной группой другой в реакции синтеза дегидратации, в результате которой из аминогруппы удалялась буква «—Н», а из карбоксильной группы — «—ОН». Это оставляет после себя две узнаваемые функциональные группы. На «2» стоит -NH (до сих пор называемая «аминогруппой», несмотря на потерю атома водорода). В позиции «3» находится карбонильная группа . Обратите внимание, что это была карбоксильная группа (-СООН), но потерявшая концевой -ОН, теперь она карбонильная (-С=О).
И аминогруппа, и карбонильная группа являются полярными. Амино имеет частично положительный заряд (δ + ), а карбонил имеет частично отрицательный заряд (δ – ). Это означает, что эти две функциональные группы, если они достаточно сблизятся друг с другом, могут образовать водородную связь. И хотя водородные связи относительно слабы (намного слабее, чем ковалентные связи, удерживающие полипептидный остов вместе), они могут скручивать полипептидный остов в определенные формы и стабилизировать эти формы. Две фигуры называются альфа-спираль и бета-складчатый лист .
Это означает, что эти две функциональные группы, если они достаточно сблизятся друг с другом, могут образовать водородную связь. И хотя водородные связи относительно слабы (намного слабее, чем ковалентные связи, удерживающие полипептидный остов вместе), они могут скручивать полипептидный остов в определенные формы и стабилизировать эти формы. Две фигуры называются альфа-спираль и бета-складчатый лист .
4с.1. Альфа-спираль
Альфа-спираль. Оригинальная диаграмма, созданная на кафедре биологии государственного университета Пенсильвании. Альфа-спираль представляет собой штопор, стабилизированный водородными связями.
Справа вы видите одну такую спираль. Полипептидный остов обозначен цифрой «1». Вы должны заметить повторяющуюся структуру углерод-углерод-азот внутри позвоночника.
R-группы (обозначены цифрой 2) свисают с каждого центрального атома углерода. Атомы азота связаны с атомами водорода, образуя аминогруппы («3»), а второй атом углерода (тот, что , а не центральный углерод) связан с кислородом, образуя карбонильную группу («4»).
В альфа-спирали водородные связи (обозначенные цифрой 5) образуются между карбонильной группой и аминогруппами в аминокислотных остатках, отстоящих друг от друга на четыре аминокислоты.
4c.2. Бета-гофрированный лист Структура, которую нужно знать, представляет собой бета-складчатый лист
.«Складка» — это складка. Если вы возьмете лист бумаги и сложите его несколько раз вперед и назад, у вас получатся складки.
Бета-складчатые листы образуются, когда разные части одной и той же полипептидной цепи выстраиваются рядом друг с другом. Цепи могут быть параллельными (с N-концом и С-концом в одинаковой ориентации) или антипараллельными, что показано слева. На этой диаграмме связи, составляющие полипептидный остов, показаны как «5». «. В «1» вы можете видеть водородные связи, которые образуются между карбонильной («3») и аминогруппой («4»). Эти связи создают складчатую форму и стабилизируют ее.
4д. Третичная структура
Третичные белки из OPENSTAX Третичная структура возникает в результате взаимодействий между R-группами, которые заставляют полипептидную цепь («1») скручиваться и изгибаться. Эти взаимодействия включают
Эти взаимодействия включают
- Водородные связи : если боковая цепь с карбонильной группой (которая имеет частично отрицательный заряд) сближается с гидроксильной группой или аминогруппой, может образоваться водородная связь. Одна такая связь между карбонилом и гидроксилом показана цифрой «2».
- Дисульфидные мостики: аминокислота цистеин имеет сульфгидрильную функциональную группу (-SH) на конце боковой цепи. Если две из этих сульфгидрильных групп цистеинов в одной и той же полипептидной цепи сблизятся друг с другом, они могут образовать дисульфидный мостик. Дисульфидный мостик представляет собой ковалентную связь.
- Гидрофобные взаимодействия : Если гидрофобные боковые цепи соприкасаются, они могут образовывать гидрофобные кластеры. Эти кластеры поддерживаются двумя силами. Во-первых, это исключение этих гидрофобных боковых цепей из водородных связей между молекулами воды в окружающем растворе. Во-вторых, слабые связи Ван-дер-Ваальса, которые образуются между этими гидрофобными боковыми цепями.
 Один такой гидрофобный кластер показан под номером «4».
Один такой гидрофобный кластер показан под номером «4». - Ионные связи : Они образуются, когда боковые цепи с полным положительным зарядом приближаются к боковым цепям с полным отрицательным зарядом, как показано на «5».
4е. Четвертичная структура
Миоглобин: ленточная диаграммаДля некоторых белков первичные, вторичные и третичные взаимодействия объясняют форму и функцию белка. Миоглобин, например, представляет собой белок, который хранит и выделяет кислород в мышечной ткани. Он состоит из 154 аминокислот, которые скручиваются, поворачиваются и скручиваются в форму, показанную справа. Пока вы смотрите, я надеюсь, что вы замечаете альфа-спирали (и соединяете их со вторичной структурой) и шпильки (и думаете, что какая-то третичная связь должна вызывать поворот полипептидной цепи под таким острым углом).
В других белках существует четвертый уровень структуры, называемый четвертичным . Четвертичная структура включает две или более свернутых полипептидных цепей, взаимодействующих с образованием более сложной структуры.
Примером одного из таких белков четвертичного уровня является гемоглобин. Гемоглобин — это молекула, которая переносит кислород в наши эритроциты. Он состоит из четырех полипептидных цепей, двух альфа-цепей (показаны красным) и двух бета-цепей (показаны синим цветом).
Связи между полипептидными субъединицами в четвертичном белке могут включать любые связи, возникающие на третичном уровне: водородные связи, гидрофобные взаимодействия, дисульфидные мостики и ионные связи.
4ф. Динамическая природа белков
Моя цель в предыдущих разделах состояла в том, чтобы объяснить, как белки имеют такие специфические формы. Но второй вопрос, на который мы хотели ответить о белках, заключался в том, как они могут изменять свою форму, чтобы действовать как молекулярные версии ворот, рычагов, шкивов, тисков, пропеллеров и так далее.
Основная идея заключается в том, что когда белки связываются с другими молекулами, когда их окружение изменяется (в результате изменения температуры или рН), или когда они сжимаются или растягиваются, конфигурация связей в этом белке может измениться. Изменение конфигурации связей, в свою очередь, может изменить форму белка.
Изменение конфигурации связей, в свою очередь, может изменить форму белка.
Например, альфа-спираль похожа на молекулярную пружину. Изменение в другой части белка может сжать эту пружину или растянуть ее, после чего она может вернуться к своей первоначальной форме. Или, если третичная связь, вызвавшая поворот шпильки в полипептидной цепи, изменена, тогда эта цепь может выпрямиться, но позже вернуться обратно.
Давайте рассмотрим в качестве примера мембранный белок, который действует как кальциевые ворота. На диаграмме слева показан белковый гормон («а»), диффундирующий к клеточной мембране («б»). Внутри мембраны встроен белок канала («с»). В таких мембранных каналах альфа-спирали часто являются преобладающей структурой, и вы должны увидеть несколько таких спиралей, охватывающих мембрану.
Связывание гормона с канальным белком (показано справа) изменяет конфигурацию этих альфа-спиралей, так что они расходятся друг от друга. Это создает отверстие в мембране, которого раньше не было. Вещества теперь могут диффундировать через это отверстие. Когда гормон, который слабо связан с белком канала через водородные связи, отделяется от канала, канал закрывается, и диффузия прекращается.
Вещества теперь могут диффундировать через это отверстие. Когда гормон, который слабо связан с белком канала через водородные связи, отделяется от канала, канал закрывается, и диффузия прекращается.
5. Денатурация
Функция белка основана на его структуре. Как мы видели выше, взаимодействия, которые приводят к структуре белка на вторичном, третичном и четвертичном уровнях, связаны с некоторыми относительно слабыми силами, такими как водородные связи и другие связи Ван-дер-Ваальса. Другие взаимодействия, такие как ионные связи, происходят только в том случае, если раствор имеет определенный pH. Одним словом, белки могут быть хрупкими, и на их функцию могут влиять изменения в окружающей их среде. Говорят, что белок, который теряет свою функцию из-за изменения окружающей среды — обычно тепла или рН, — 9.0003 денатурирует , и процесс, посредством которого это происходит, называется денатурацией . Беглый взгляд на ферменты покажет вам, как это работает (вы можете узнать больше о ферментах здесь ).
Ферменты — это катализаторы, ускоряющие химические реакции в живых организмах. За очень немногими исключениями ферменты являются белками. Вот пример того, как фермент может расщеплять дисахарид лактозу на два моносахарида, глюкозу и галактозу
- Фермент («1») связывается с лактозой («3»). Связывание возможно только потому, что определенная часть фермента, его активный центр («2»), имеет форму, дополняющую форму лактозы.
- В то время как фермент связан с лактозой, фермент меняет форму, чтобы усилить связи, которые удерживают вместе мономеры глюкозы и галактозы.
- Связь разрывается, и фермент высвобождает глюкозу и галактозу.
Хотя детали различных реакций, катализируемых ферментами, различаются, ключевой момент заключается в том, что фермент может катализировать реакцию только в том случае, если он может соединиться со своим субстратом (с какой бы молекулой он ни взаимодействовал). Это соответствие так же специфично, как способность ключа открывать замок. Измените форму ключа, и замок не откроется.
Измените форму ключа, и замок не откроется.
Взяв на вооружение эти идеи, давайте посмотрим на приведенный ниже график, который показывает взаимосвязь между скоростью реакции, катализируемой ферментом, процентным содержанием активных молекул фермента и температурой.
Сначала рассмотрим скорость. При повышении температуры от 10°С до примерно 37°С («А») скорость реакции также увеличивается. Примерно при 37°С реакция достигает пика («В»). Поскольку температура продолжает повышаться значительно выше 37°С, скорость реакции снижается («С») до тех пор, пока при 45°С скорость реакции не падает до нуля.
Теперь рассмотрим «процент активного фермента» (ось Y справа). Для любой температуры от 10°C до чуть выше 37°C процент активного фермента составляет 100%. Но после точки «В» процент падает («С»), пока не достигнет нуля («D»).
Как вы, наверное, догадались, происходит денатурация . До определенной температуры фермент может сохранять свою форму и взаимодействовать со своим субстратом, вызывая реакцию. По мере повышения температуры до 37 °C реакция протекает все быстрее и быстрее, потому что более высокая температура означает большее молекулярное движение и большую вероятность того, что фермент столкнется со своим субстратом в правильной ориентации, чтобы запустить реакцию. При температуре выше 37°C кинетическая энергия в системе начинает разрушать связи, удерживающие фермент в требуемой трехмерной форме. Когда эта форма начинает изменяться, фермент теряет способность связываться со своим субстратом, и скорость реакции (вместе с количеством активного фермента) падает до нуля.
По мере повышения температуры до 37 °C реакция протекает все быстрее и быстрее, потому что более высокая температура означает большее молекулярное движение и большую вероятность того, что фермент столкнется со своим субстратом в правильной ориентации, чтобы запустить реакцию. При температуре выше 37°C кинетическая энергия в системе начинает разрушать связи, удерживающие фермент в требуемой трехмерной форме. Когда эта форма начинает изменяться, фермент теряет способность связываться со своим субстратом, и скорость реакции (вместе с количеством активного фермента) падает до нуля.
Вот визуальное представление денатурации. Цифра «1» показывает белок в его оптимальной конформации. Тепло («2») разрушает связи, которые стабилизируют форму этого белка на вторичном и третичном уровнях. В результате фермент разворачивается в полипептид.
Иногда, например, когда вы готовите яйцо и превращаете жидкий альбумин в твердый яичный белок, денатурация необратима. Другими словами, вы можете дать яичному белку остыть, но он не станет снова жидким. С другой стороны, некоторые белки могут временно денатурироваться (обычно за счет изменения рН). Когда pH сбрасывается до исходного уровня, аминокислоты в полипептиде могут взаимодействовать таким образом, что восстанавливает первоначальную форму белка. Этот процесс называется ренатурация .
С другой стороны, некоторые белки могут временно денатурироваться (обычно за счет изменения рН). Когда pH сбрасывается до исходного уровня, аминокислоты в полипептиде могут взаимодействовать таким образом, что восстанавливает первоначальную форму белка. Этот процесс называется ренатурация .
6. Викторина белков
[qwiz use_dataset = ”smv_biochem_8_proteins_cumulative” dateset_intro = ”false” qRecord_id = ”ScienceMusicvideoSmeismeister1961-SMV-Proteins”] [h]
7777. 2
900 37777.
77. ][/qwiz]
Ссылки
- Обзор нуклеиновых кислот (следующее руководство в этой серии)
- Итоговые карточки и викторина по биохимии
- Главное меню биохимии
Биологические строительные блоки | CancerQuest
Клетка является основной единицей жизни. Все организмы состоят из одной или нескольких клеток. Как будет показано ниже, люди состоят из многих миллионов клеток. Чтобы понять, что не так при раке, важно понять, как работают нормальные клетки. Первым шагом является обсуждение структуры и основных функций клеток.
Чтобы понять, что не так при раке, важно понять, как работают нормальные клетки. Первым шагом является обсуждение структуры и основных функций клеток.
Сначала мы представим общие строительные блоки клеток. Все клетки, независимо от их функции или расположения в организме, имеют общие черты и процессы. Удивительно, но клетки почти полностью состоят всего из четырех основных типов молекул. Выше показана клетка, окруженная примерами молекул этих строительных блоков.
Поскольку они присутствуют в живых существах, эти строительные блоки называются биомолекулами. В следующих разделах описываются структуры и функции каждого из этих основных строительных блоков. Дополнительную информацию по темам на этой странице также можно найти в большинстве вводных учебников по биологии, мы рекомендуем Campbell Biology, 11-е издание.1
- Углеводы
- Белки
- Липиды
- Нуклеиновые кислоты
- Комбинации
Углеводы
Первый класс биомолекул, который мы обсудим, — это углеводы. Эти молекулы состоят из элементов углерода (C), водорода (H) и кислорода (O). Обычно эти молекулы известны как сахаров . Углеводы могут варьироваться в размерах от очень маленьких до очень больших. Как и все другие биомолекулы, углеводы часто выстраиваются в длинные цепи, связывая вместе более мелкие единицы. Это похоже на добавление бусинок к браслету, чтобы сделать его длиннее. Общий термин для отдельной единицы или шарика – мономер . Термином для длинной цепочки мономеров является полимер .
Эти молекулы состоят из элементов углерода (C), водорода (H) и кислорода (O). Обычно эти молекулы известны как сахаров . Углеводы могут варьироваться в размерах от очень маленьких до очень больших. Как и все другие биомолекулы, углеводы часто выстраиваются в длинные цепи, связывая вместе более мелкие единицы. Это похоже на добавление бусинок к браслету, чтобы сделать его длиннее. Общий термин для отдельной единицы или шарика – мономер . Термином для длинной цепочки мономеров является полимер .
Примеры углеводов включают сахара, содержащиеся в молоке (лактоза) и столовом сахаре (сахароза). Ниже представлена структура мономера сахара-глюкозы, основного источника энергии для нашего организма.
Углеводы выполняют в клетках несколько функций. Они являются отличным источником энергии для различных видов деятельности, происходящих в наших клетках. Некоторые углеводы могут иметь структурную функцию. Например, материал, благодаря которому растения стоят высоко и придают древесине прочность, представляет собой полимерную форму глюкозы, известную как целлюлоза. Другие типы полимеров сахара составляют запасенные формы энергии, известные как крахмал и гликоген. Крахмал содержится в растительных продуктах, таких как картофель, а гликоген содержится в животных. Ниже показана короткая молекула гликогена. Вы можете сами манипулировать молекулой, чтобы хорошенько ее рассмотреть.
Другие типы полимеров сахара составляют запасенные формы энергии, известные как крахмал и гликоген. Крахмал содержится в растительных продуктах, таких как картофель, а гликоген содержится в животных. Ниже показана короткая молекула гликогена. Вы можете сами манипулировать молекулой, чтобы хорошенько ее рассмотреть.
Углеводы необходимы клеткам для связи друг с другом. Они также помогают клеткам прилипать друг к другу и к материалу, окружающему клетки в организме. Способность организма защищаться от вторжения микробов и удалять из организма чужеродные материалы (такие как захват пыли и пыльцы слизью в нашем носу и горле) также зависит от свойств углеводов.
Узнайте больше о том, как доктор Майкл Пирс использует углеводы для исследования рака.
Белки
Как и углеводы, белки состоят из более мелких единиц. Мономеры, из которых состоят белки, называются аминокислотами . Существует около двадцати различных аминокислот. Структура простейшей аминокислоты глицина показана ниже.
Белки выполняют многочисленные функции в живых существах, в том числе следующие:
- Они помогают формировать многие структурные элементы тела, включая волосы, ногти и мышцы. Белки являются основным структурным компонентом клеток и клеточных мембран.
- Они помогают транспортировать материалы через клеточные мембраны. Примером может служить поглощение глюкозы клетками из кровотока. Мы вернемся к этой важной способности, когда будем обсуждать устойчивость раковых клеток к химиотерапевтическим агентам.
- Они действуют как биологические катализаторы. Большая группа белков, известных как ферменты, способна ускорять химические реакции, необходимые для правильной работы клеток. Например, существует множество ферментов, которые участвуют в расщеплении пищи, которую мы едим, и обеспечении доступности питательных веществ.
- Взаимодействия между клетками очень важны для поддержания организации и функционирования клеток и органов. Белки часто отвечают за поддержание контакта между соседними клетками и между клетками и их местным окружением.
 Хорошим примером может служить межклеточное взаимодействие, благодаря которому клетки нашей кожи удерживаются вместе. Эти взаимодействия зависят от того, что белки соседних клеток прочно связываются друг с другом. Как мы увидим, изменения в этих взаимодействиях необходимы для развития метастатического рака.
Хорошим примером может служить межклеточное взаимодействие, благодаря которому клетки нашей кожи удерживаются вместе. Эти взаимодействия зависят от того, что белки соседних клеток прочно связываются друг с другом. Как мы увидим, изменения в этих взаимодействиях необходимы для развития метастатического рака. - Белки контролируют активность клеток, включая решения, касающиеся клеточного деления. Раковые клетки неизменно имеют дефекты этих типов белков. Мы вернемся к этим белкам более подробно, когда будем говорить о регуляции клеточного деления.
- Многие гормоны, сигналы, которые проходят через тело, чтобы изменить поведение клеток и органов, состоят из белка. Ниже показан инсулин, небольшой белковый гормон, который регулирует поглощение глюкозы из кровотока.
Липиды
Термин «липид» относится к широкому спектру биомолекул, включая жиры, масла, воски и стероидные гормоны. Независимо от их структуры, местоположения или функции в клетке/организме, все липиды имеют общие черты, которые позволяют их группировать.
- Не растворяются в воде; они гидрофобны.
- Как и углеводы, они состоят в основном из углерода, водорода и кислорода.
Гидрофобная природа липидов обуславливает их использование в биологических системах. Жиры являются хорошим источником накопленной энергии, а масла и воски используются для формирования защитного слоя на нашей коже, предотвращая инфекцию. Некоторые липиды, стероидные гормоны, являются важными регуляторами клеточной активности. Мы вернемся к этому во время обсуждения потока информации в клетках. Активность стероидных гормонов, таких как эстроген, связана с раком женской репродуктивной системы. Лечение, основанное на этих знаниях, будет подробно обсуждаться в разделе сайта о лечении.
Выше изображен пример триацилглицерола или жира. Три длинные цепи состоят только из углерода и водорода, что придает молекуле ее гидрофобные свойства. Когда вы читаете о содержании насыщенных и ненасыщенных жиров на этикетках пищевых продуктов, они имеют в виду различия в этих длинных углеводородных цепях.
Основной функцией липидов является образование биологических мембран. Клетки окружены тонким слоем липидов. Слой состоит из особого типа липидов, обладающих как гидрофобными, так и гидрофильными свойствами. Гидрофильные концы этих молекул обращены к заполненной водой среде внутри клеток и к водной среде вне клеток. Внутри двух слоев существует гидрофобная область. Мембрана, окружающая клетки, богата белками и другими липидами, такими как холестерин.
Большинство химических веществ не могут проникать через липидный бислой. Вода и некоторые другие небольшие молекулы могут свободно проходить через мембрану, в то время как другие молекулы должны активно транспортироваться через встроенные в мембрану белковые каналы. Мембраны также содержат комбинацию биомолекул, которые были описаны до сих пор. Как показано выше, белки могут быть связаны с углеводами с образованием гликопротеинов. Гликопротеины играют важную роль в межклеточных взаимодействиях, которые обсуждались ранее, и изменения в количестве или типах этих белков наблюдаются при раке. Точно так же сочетание липидов и углеводов приводит к образованию гликолипидов.
Точно так же сочетание липидов и углеводов приводит к образованию гликолипидов.
Нуклеиновые кислоты
В этих молекулах хранится вся информация, необходимая для управления и построения клеток.
Существует два основных типа нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Обе эти молекулы являются полимерами. Они состоят из мономерных субъединиц, подобных углеводам и белкам, описанным ранее. Мономеры, используемые для построения нуклеиновых кислот, называются нуклеотидами. Нуклеотиды часто обозначаются однобуквенными сокращениями A, C, G, T и U. Как и все мономеры, описанные до сих пор, мономеры, используемые для построения ДНК, похожи друг на друга, но не совсем одинаковы. Одно из различий между ДНК и РНК заключается в подмножестве нуклеотидов, используемых для построения полимеров. ДНК содержит A, C, G и T, а РНК содержит A, C, G и U.
Дезоксирибонуклеиновая кислота (ДНК)
ДНК состоит из двух длинных цепочек (полимеров) нуклеотидов, скрученных вокруг друг друга, образующих спиральную или спиралевидную структуру, показанную ниже. Скрученные молекулы расположены определенным образом, причем определенные нуклеотиды всегда находятся напротив друг друга. Нуклеотид, содержащий аденин (А), всегда сочетается с нуклеотидом, содержащим тимин (Т). Точно так же гуанин (G) всегда сочетается с цитозином (C). Если вы внимательно посмотрите на график ниже, вы увидите пары нуклеотидов, взаимодействующие в середине спирали. Полимеры, образующие ДНК, могут быть очень длинными, достигая миллионов нуклеотидов на каждую отдельную молекулу ДНК. На следующем рисунке изображена короткая цепь двухцепочечной ДНК. 2
Скрученные молекулы расположены определенным образом, причем определенные нуклеотиды всегда находятся напротив друг друга. Нуклеотид, содержащий аденин (А), всегда сочетается с нуклеотидом, содержащим тимин (Т). Точно так же гуанин (G) всегда сочетается с цитозином (C). Если вы внимательно посмотрите на график ниже, вы увидите пары нуклеотидов, взаимодействующие в середине спирали. Полимеры, образующие ДНК, могут быть очень длинными, достигая миллионов нуклеотидов на каждую отдельную молекулу ДНК. На следующем рисунке изображена короткая цепь двухцепочечной ДНК. 2
ДНК расположена в ядрах клеток, структура которых будет описана в следующем разделе сайта. Все ядерные клетки в организме человека имеют одинаковое содержание ДНК независимо от их функции. Разница в том, какие части ДНК используются в той или иной клетке. Например, клетки, из которых состоит печень, содержат ту же ДНК, что и клетки, из которых состоят мышцы. Резко отличающаяся активность этих двух типов клеток зависит от частей ДНК, которые активны в клетках. ДНК – это форма хранения генетической информации, которая действует как схема для клеток. Как мы увидим, изменения в последовательности ДНК могут привести к изменению поведения клеток. Нерегулируемый рост, как и многие другие изменения, наблюдаемые при раке, в конечном итоге являются результатом мутаций, изменений в структуре ДНК.
ДНК – это форма хранения генетической информации, которая действует как схема для клеток. Как мы увидим, изменения в последовательности ДНК могут привести к изменению поведения клеток. Нерегулируемый рост, как и многие другие изменения, наблюдаемые при раке, в конечном итоге являются результатом мутаций, изменений в структуре ДНК.
Рибонуклеиновая кислота (РНК) во многом похожа на ДНК. Это полимер нуклеотидов, несущий информацию, присутствующую в генах. В дополнение к некоторым химическим различиям между РНК и ДНК существуют важные функциональные различия.
- РНК копируется с ДНК в ядре и большая ее часть отправляется в цитозоль.
- РНК — это рабочая форма информации, хранящейся в ДНК.
- РНК одноцепочечная, а не двухцепочечная
Информация, содержащаяся в ДНК, действует на клетки так же, как архитектор использует план. Специфическое производство РНК позволяет клетке использовать только те страницы «чертежа», которые требуются в любой конкретный момент времени. Очень важно, чтобы правильные РНК производились в нужное время. При раке продукция или регуляция определенных РНК не происходит должным образом. Точно так же, как неправильное прочтение чертежа приводит к появлению дефектов в здании, неправильное производство РНК вызывает изменения в поведении клеток, которые могут привести к раку. Эта важная тема будет подробно рассмотрена в разделе, посвященном функциям генов. Сначала мы рассмотрим более сложные формы биомолекул, а затем познакомимся с некоторыми ключевыми функциональными компонентами эукариотических клеток.
Очень важно, чтобы правильные РНК производились в нужное время. При раке продукция или регуляция определенных РНК не происходит должным образом. Точно так же, как неправильное прочтение чертежа приводит к появлению дефектов в здании, неправильное производство РНК вызывает изменения в поведении клеток, которые могут привести к раку. Эта важная тема будет подробно рассмотрена в разделе, посвященном функциям генов. Сначала мы рассмотрим более сложные формы биомолекул, а затем познакомимся с некоторыми ключевыми функциональными компонентами эукариотических клеток.
Комбинации
Теперь мы познакомились с основными классами биомолекул.
- углеводы
- липиды
- белки
- нуклеиновые кислоты
Эти биомолекулы работают вместе, чтобы выполнять определенные функции и создавать важные структурные особенности клеток. Например, в разделе о липидах мы впервые увидели приведенную ниже диаграмму мембраны.
В дополнение к липидному бислою, состоящему из особого типа липидов, мембрана содержит множество белков и сахаров. Как показано, белки и сахара могут объединяться с образованием гликопротеинов. Сахара также могут быть добавлены к липидам с образованием гликолипидов.
Как показано, белки и сахара могут объединяться с образованием гликопротеинов. Сахара также могут быть добавлены к липидам с образованием гликолипидов.
Многие белки, играющие важную роль в развитии и/или выявлении рака, представляют собой гликопротеины. Например, диагностические тесты на рак предстательной железы включают тестирование образцов крови на наличие гликопротеина, называемого специфическим антигеном простаты или ПСА. Рак яичников можно контролировать по продукции другого гликопротеина, называемого СА-125. СА означает ассоциированный с раком.
Подробнее о тесте CA-125
Часто многие белки и другие биомолекулы соединяются вместе, образуя функциональные структуры в клетках. Далее мы исследуем некоторые из этих более сложных структур, называемых органеллами.
Резюме
Все живые существа, включая клетки, из которых состоит тело человека, состоят из небольшого подмножества различных биомолекул. Существует четыре основных класса, как описано ниже:
- Углеводы
- Углеводы состоят из элементов углерода (C), водорода (H) и кислорода (O).

- Сахара являются обычными углеводами.
- Углеводы выполняют несколько функций внутри клеток:
- Основной источник энергии
- Обеспечьте структуру
- Связь
- Клеточная адгезия
- Защита от посторонних материалов и их удаление
- Углеводы состоят из элементов углерода (C), водорода (H) и кислорода (O).
- Белки
- Белки состоят из аминокислот.
- Белки выполняют несколько функций внутри живых существ:
- Структура волос, мышц, ногтей, клеточных компонентов и клеточных мембран
- Сотовый транспорт
- Биологические катализаторы или ферменты
- Поддержание сотового контакта
- Контроль активности клеток
- Передача сигналов через гормоны
- Липиды
- Широкий спектр биомолекул, включая жиры, масла, воски и стероидные гормоны.
- Липиды не растворяются в воде (они гидрофобны) и в основном состоят из углерода (С), водорода (Н) и кислорода (О).
- Липиды выполняют несколько функций в живых существах:
- Форма биологических мембран
- Жиры могут храниться как источник энергии
- Масла и воски обеспечивают защиту, покрывая области, в которые могут проникнуть микробы (например, кожу или уши)
- Стероидные гормоны регулируют активность клеток, изменяя экспрессию генов
- Нуклеиновые кислоты
- Вся информация, необходимая для управления и построения клеток, хранится в этих молекулах.

- Нуклеиновые кислоты состоят из нуклеотидов, которые обозначаются аббревиатурой A, C, G, T и U.
- Существует два основных типа нуклеиновых кислот: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК):
- ДНК
- ДНК имеет структуру двойной спирали, состоящей из нуклеотидов A, C, G и T. ДНК
- расположена в ядре клетки.
- ДНК является формой хранения генетической информации.
- РНК
- РНК обычно одноцепочечная и состоит из нуклеотидов A, G, C и U.
- РНК копируется с ДНК и является рабочей формой информации. РНК
- образуется в ядре, а мРНК экспортируется в цитозоль.
- ДНК
- Вся информация, необходимая для управления и построения клеток, хранится в этих молекулах.
Дополнительные биомолекулы можно получить, комбинируя эти четыре типа. Например, многие белки модифицируются путем добавления углеводных цепей. Конечный продукт называется гликопротеином.
Если вы найдете материал полезным, рассмотрите возможность размещения ссылки на наш веб-сайт.


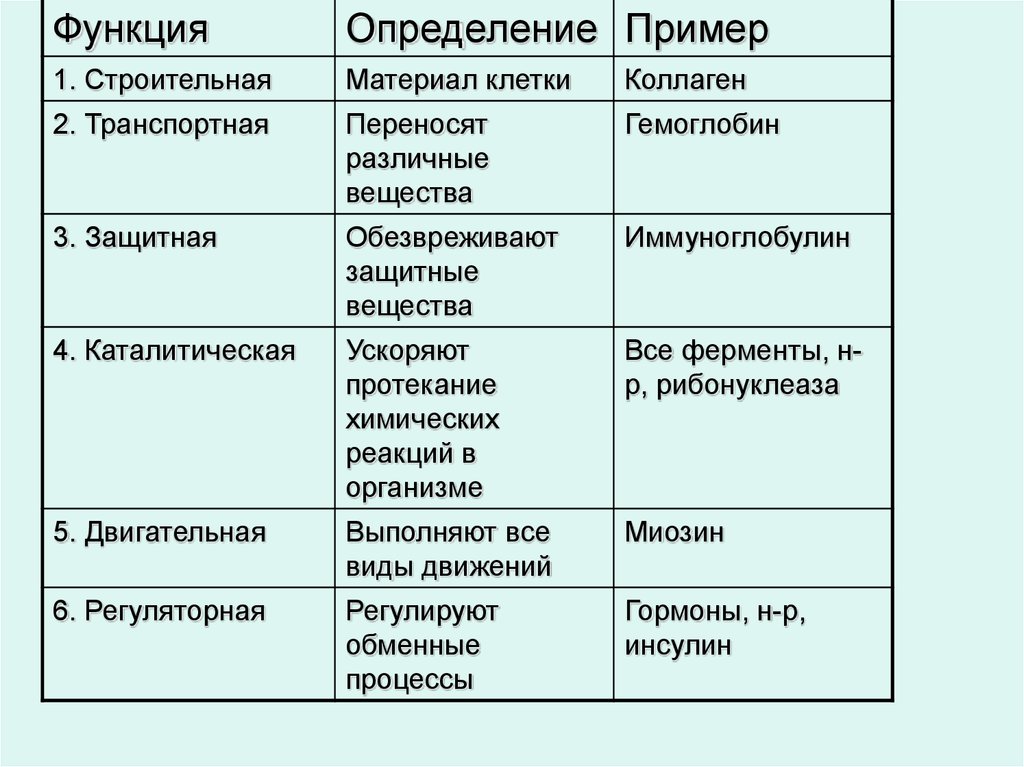 Нерастворимы
в воде. Выполняют в клетке и в органах структурные функции, например в
составе соединительной ткани (коллаген, миозин, кератин)
Нерастворимы
в воде. Выполняют в клетке и в органах структурные функции, например в
составе соединительной ткани (коллаген, миозин, кератин)