10 класс химия презентация предмет органической химии: Презентация «Предмет органической химии» 10 класс
Презентация к уроку химии в 10 классе «Предмет органической химии с применением модулей ФЦИОР»
Муниципальное бюджетное образовательное учреждение «Аргуновская средняя общеобразовательная школа»
Урок химии в
10 классе
Учитель химии –
Карачева Людмила Витальевна
Тема урока: Предмет органической химии. Особенности строения органических веществ.
Цель урока :
формирование представлений
о составе и строении органических соединений
План урока.
- Что?
- Кто?
- Валентность.
- Какие?
- Где?
- за наука органическая химия.
- основоположник органической химии.
- особенности строения органических соединений.
 Теория химического строения органических соединений.
Теория химического строения органических соединений. - значение органических соединений.
Термин “органическая химия” был введен шведским ученым Й. Берцелиусом в начале XIX века.
Раздел химии, который изучает органические вещества, стали называть «органической химией»
Так как в состав каждого органического вещества входит элемент углерод, то
Органическая химия — это химия соединений углерода ( кроме оксидов углерода, угольной кислоты и её солей).
Отличие органических веществ от неорганических
Признак
Органические
Состав
Неорганические
С и Н
Строение
Сложное
Разнообразны
Количество
Горение
Более 27 млн.
Более простое
Горят почти все
Около 1 млн.
Тип химической связи
Горят не все
Ковалентная
Тип кристаллической решетки
Молекулярная
Ионная, ковалентная, металлическая
Ионная, молекулярная, атомная
2. Александр Михайлович Бутлеров
Александр Михайлович Бутлеров
- БУТЛЕРОВ Александр Михайлович (1828—86), российский химик-органик, академик Петербургской АН (1874). Создал (1861) и обосновал теорию химического строения, согласно которой свойства веществ определяются порядком связей атомов в молекулах и их взаимным влиянием. Первым объяснил (1864) явление изомерии. Открыл полимеризацию изобутилена. Синтезировал ряд органических соединений (уротропин, полимер формальдегида и др.).
3. Валентность
Понятие валентности в органи-ческой химии более полезно, чем термин «степень окисления», харак-терный для неорганической химии. Это связано с тем, что большинство органических веществ имеет
Валентностью называют число химичес-ких связей, которые данный атом обра-зует с другими атомами в молекуле.
Валентность химического элемента можно выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого элемента. Например, азот в аммиаке трёхвалентен (а степень окисления =-3):
Например, азот в аммиаке трёхвалентен (а степень окисления =-3):
H
NH 3 или H N H
Другие примеры:
H 2 O 2 H O O H В(О) = 2, Ст. ок.(О) =-1
S
FeS 2 Fe В( S ) =2, Ст. ок ( S) = -1
S
H 2 S H S H В( S) =2, Ст. ок ( S) =-2
В отличии от степени окисления, валентность не имеет знака и не может быть равна нулю.
Часто валентность и степень окисления атомов численно совпадают. Например:
формула
Н 2 O
CS 2
CH 4
валентность
Степень окисления
H (I), O (II)
C (IV), S (II)
C (IV) , H (I)
H +1 , O -2
C +4 , S -2
C -4 , H +1
C
Теория химического строения
- основные положения Бутлерова.
 oms
oms
Основное положение ТХС:
Атомы химических элементов в молекулах соединены в строгой последовательности в соответствии с их валентностями.
Порядок соединения атомов химичес-ких элементов в молекуле согласно их валентности называется химическим строением.
Запомни! Углерод в органических соединениях всегда четырёхвалентен.
C (IV), H (I), O (II), N (III), S(II), Cl (I).
Например, химическое строение метана:
Н
СН 4 Н С Н
Н
Химическое строение молекул отображают при помощи структурных формул.
Молекулярная формула
Структурная формула
Строение молекулы пропана С 3 Н 8 отражают формулы:
Н Н Н
Н С С С Н
Н Н Н
СН 3 СН 2 СН 3
Как показывают формулы пропана, атомы
углерода в этом веществе соединены не только с атомами водорода, но и друг с другом.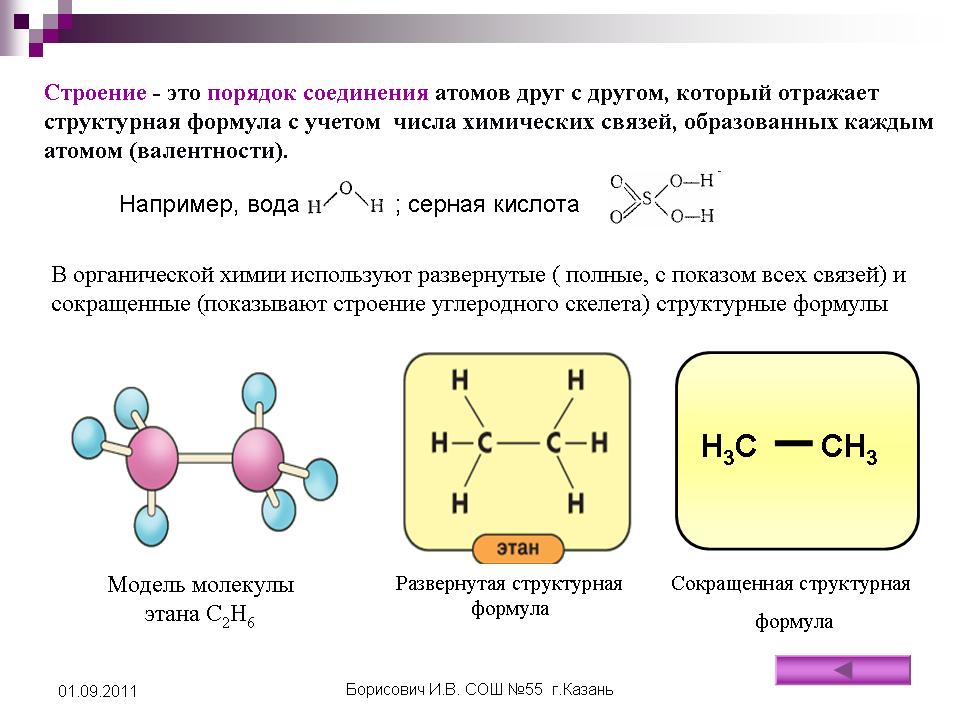
Полная структурная формула
Сокращённая структурная формула
В чем же причины многообразия органических веществ?
Нормальный бутан
- CH 3 – CH 2 – CH 2 – CH 3
t к =-0,5 С
CH 3 – CH – CH 3
CH 3
t к =-11,7 С
Изобутан
Вещества, имеющие одинаковый состав и одинаковую молекулярную массу но различное строение молекул, а поэтому обладающие разными свойствами называются изомерами.
Состав органического вещества – С2Н6О.
Топливо
Синтетика
Моющие средства
Белки
Аминокислоты
Углеводы
Полимеры
Вопросы и задания.
- Что изучает органическая химия?
Какие вещества называются органическими?
2. Выберите органические вещества среди следующих кислот: щавелевая кислота, муравьиная кислота, угольная кислота, уксусная кислота, серная кислота, соляная кислота.
3. Органическими или неорганическими веществами или теми и другими являются продукты питания человека? Приведите конкретные примеры.
4.Приведите примеры использования органических веществ в быту, в медицине, в сельском хозяйстве, в технике, в искусстве.
5. Что называется валентностью атома?
6 . Сформулируйте основные положения теории химического строения А.М.Бутлерова.
- РЕФЛЕКСИЯ
Составить в паре синквейн на тему «Органическая химия»
Домашнее задание
§32; упражнения 1,2 стр. 200
Предмет органической химии. 9 класс
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Предмет органической химии
9 классПредмет органической химии
2. ВЕЩЕСТВА
ОРГАНИЧЕСКИЕПолучены из продуктов
жизнедеятельности растительных и животных
Организмов (сахар, жиры, масла, красители и
др.), а также синтетические вещества (полиэтилен, капрон и др.).
Известно около 27млн.
НЕОРГАНИЧЕСКИЕ
Минеральные
(вещества неживой
природы: глина,
песок, металлы и
др.).
Таких веществ около
0,5 млн.
3. Особенности органических веществ
•их гораздо больше, чем неорганическихвеществ;
•органические вещества имеют более
сложное строение, чем неорганические;
•многие органические вещества обладают
огромной молекулярной массой например,
белки углеводы, нуклеиновые кислоты и
др.;
•При горении органических веществ обычно
образуются углекислый газ и вода=> в
состав входят углерод и водород
4.
 Раздел химии, который изучает органические вещества, стали называть «органической химией»Так как в состав
Раздел химии, который изучает органические вещества, стали называть «органической химией»Так как в составкаждого органического вещества
входит элемент углерод, то
Органическая химия — это химия
соединений углерода ( кроме оксидов
углерода, угольной кислоты и её
солей).
5. Теория химического строения
Для органической химииосновополагающей стала теория
химического строения (ТХС)
органических веществ
А.М.Бутлерова, подобно тому,
как для неорганической химии
основополагающим является
периодический закон и
периодическая система
химических элементов
Д.И.Менделеева.
Александр Михайлович Бутлеров
(1828-1886) –русский химик, академик
Петербургской АН, создатель теории
химического строения органических
веществ (1861)
6. Основные положения ТХС:
Атомы химическихэлементов в молекулах
соединены в строгой
последовательности в
соответствии с их
валентностями
Свойства веществ
зависят не только от
состава их молекул, но
и от их строения
7.
 ВалентностьIV
ВалентностьIVВалентностью называют число
химических связей, которые данный атом
образует с другими атомами в молекуле
C
• большинство органических веществ имеет ковалентный тип связи и
молекулярное строение;
• в отличии от степени окисления, валентность не имеет знака и не
может быть равна нулю;
• часто валентность и степень окисления атомов численно совпадают;
Формула
Валентность
Н 2O
CS2
Ch5
H (I), O (II)
C (IV), S (II)
C (IV) , H (I)
Степень окисления
H+1 , O-2
C+4 , S-2
C-4 , H+1
Фридрих Кекуле предположил,
что атомы углерода в органических
соединениях всегда образуют
четыре связи, т.е. четырёхвалентны.
IV
C
Ф. Кекуле
1829–1896гг.
9. Например, химическое строение метана:
Порядок соединения атомов химическихэлементов в молекуле согласно их валентности
называется химическим строением
Например, химическое строение метана:
Молекулярная формула
Структурная формула
Н
СН4
Химическое строение
молекул отображают при
помощи структурных
формул.

Н
С
Н
Н
10. Строение молекулы пропана С3 Н8
Полная структурная формула Сокращённая структурная формулаН
Н
Н
Н
С
С
С
Н
Н
Н
СН3 ― СН2 ― СН3
Н
• Как показывают формулы пропана, атомы углерода в этом веществе
Задание:
English Русский Правила
Органическая химия 10 класс
Органическая химия 10 классРеклама
1 из 24
Верхний вырезанный слайд Скачать для чтения офлайнОбразование
Технологии 9000 3
Бизнес
Один из моих старых выпусков PowerPoint еще со школы. Надеюсь, они помогут x
Реклама
Реклама
Реклама
Органическая химия 10 класс
- Органическая химия Редакция 10 класс
- Что такое сырая нефть? Это смесь углеводородов.
- Как образовалась сырая нефть?
• Из погребенных останков
животные и растения
• на протяжении миллионов лет
• Высокое давление и
температура.

- Что такое углеводороды? Соединения состоят из только водород и углерод.
- Как называется процесс используется для разделения сырой нефти? Фракционная перегонка
- Как называется аппарат используется для разделения сырой нефти? Фракционирующая колонна
- Назовите четыре фракции, производимые фракционная перегонка. Нефтеперерабатывающий газ Бензин Бензин керосин Дизель битум
- Что касается размера углеводорода, какая фракция будет собрана при вершина? В нижней части дробильная башня? Короткие фракции вверху Длинные фракции внизу
- Какие продукты входят в комплект горение углеводорода? Углекислый газ и водяной пар
- Какие продукты неполного горение углеводорода? Угарный газ и вода пар
- Как называется ядовитый газ, произведенный неполным горение? Монооксид углерода
- Как действует этот газ на
здоровье?
Угарный газ является ядовитым
газ.
Снижает переносчики кислорода в
кровь.
 Это может привести к смерти, если его уровень в
кровь высокая.
Это может привести к смерти, если его уровень в
кровь высокая. - Как разорвать длинную цепь углеводороды? Взломав
- Чем отличается взлом а фракционная перегонка? Крекинг – это химический процесс. тогда как фракционная перегонка физический процесс.
- Каковы условия для взлома? Высокая температура катализатор
- Что такое гомологический ряд? Члены серии имеют Та же общая формула. Похожие химические свойства Последовательные элементы отличаются Ch3 подобные физические свойства, такие как внешний вид, температура плавления/кипения,
- Какова общая формула алканов? Сп h3n+2
- Какова общая формула алкенов? Сп h3n
- Назовите молекулярную формулу: этан пропен бутен метан С 2 Н6 С 3 Н6 С 4 Н8 С h5
- Нарисуйте структурную формулу пропана
- Нарисуйте структурную формулу бутена
- Для чего используется химический тест?
различать алканы и
алкены? Что в итоге?
Тест бромной воды
Бром обесцвечивает в
алкенов и остается оранжево-коричневым в
алканы.

- Напишите реакцию полимеризации полиэтилен. п С С С С н
- Назовите два других полимера и нарисуйте их мономеры, затем назовите их. Ч Ч4 полипропилен С С Ч Ч Н Cl полихлорэтен C C Ч Ч
Реклама
PPT – Органическая химия Темы HL2 10 и 20 Презентация PowerPoint | скачать бесплатно
Об этой презентации Стенограмма и примечания докладчика Название: Органическая химия HL2 Темы 10 и 20 1
Органическая химия HL2 Темы 10 и 20
- IB Chemistry Gr 12
Обзор целей (тема 10)
- 10.1.1 Описать признаки гомологичного 9Серия 0091.
- 10.1.2 Предскажите и объясните тренды точек кипения
членов гомологического ряда. - 10.
 1.3 Различают эмпирические, молекулярные
1.3 Различают эмпирические, молекулярные
и структурные формулы. - 10.1.4 Опишите структурные изомеры как соединения
с одинаковой молекулярной формулой, но с
различным расположением атомов.
10.1.1 Опишите признаки гомологичного ряда
.
- Гомологические ряды имеют одинаковую общую формулу
с соседними членами отличающегося на
a -Ch3- блока. - Члены гомологического ряда имеют сходные
химические свойства и демонстрируют постепенное изменение
физических свойств по мере изменения массы, а также ван-
-дер-ваальсовых сил и иногда полярности
молекул.
10.1.2 Прогнозировать и объяснять тренды температуры кипения
членов гомологического ряда.
Алкан, температура кипения C
Метан, Ch5 -164
Этан, C2H6 -89
Пропан, C3H8 -42
Бутан, C4h20 -0,5
Пентан, C5h22 36
Гексан, C6h24 69
Гептан, C7h26 98
Октан, C8h28 12 5
- Обратите внимание на тенденцию в б.
 п. предсказуемо из-за
п. предсказуемо из-за
увеличения ван-дер-ваальсовых сил с массой, но
оно нелинейно увеличение длины цепи
пропорционально больше для малых цепочек. - Другими физическими свойствами, которые предсказуемо изменяются
, являются плотность и вязкость.
Свойства
- Большинство органических соединений, как правило, неполярны, а
имеют только силы Ван-дер-Ваальса и нерастворимы в воде. - Некоторые функциональные группы содержат кислород и
азот и вызывают диполь-дипольные
взаимодействия и/или водородные связи. - Некоторые функциональные группы также будут взаимодействовать с водой
, как кислоты или основания, поэтому они будут влиять на pH
. - Чем длиннее неполярная углеводородная цепь, тем
менее вероятно, что молекула будет смешиваться с полярными растворителями
, такими как вода.
10.1.3 Различают эмпирические,
молекулярные и структурные формулы.

- Эмпирическое простейшее соотношение атомов пр. C2h5O
- Фактическое молекулярное число атомов пр. C4H8O2
- Структурный (конденсированный) показывает общую структуру
пр. Ch4Ch3Ch3COOH - Полная структура (отображается) показывает каждую связь и
атом напр.
em-subs_digest-vrecs
7
Цели обзора
- 10.1.4 Описать структурные изомеры, одна и та же молекулярная формула
, но другая структура 9 0028 - http// www.youtube.com/watch?vWp7v6D8BgyQ
- 10.1.5 Выведите структурные формулы изомеров
нециклических алканов до С6. - http//www.youtube.com/watch?vJvLyQC_FNxg
- 10.1.6 Применение правил ИЮПАК для обозначения изомеров
нециклических алканов до C6. - http//www.youtube.com/watch?vnS9I_c9lYYA
Задачи обзора
- 10.1.7 Вывести структурные формулы изомеров
прямой цепи алкены до С6.
- http//www.youtube.com/watch?vWBzG5iOD6h5
- 10.1.8 Применять правила ИЮПАК для обозначения изомеров
алкенов с прямой цепью до С6. - http//www.youtube.com/watch?vLI5Zmh_naqU
Классификация углеводородов
Углеводороды состоят только из водорода и
углерода.
10
Алканы, алкены, алкины,
- Алканы НАСЫЩЕНЫ, так как они имеют только одинарные связи
. - Алкены и алкины НЕНАСЫЩЕНЫ, так как
содержат кратные связи. Эти связи прочнее
и означают, что молекулы могут больше реагировать. - Алкены содержат связь СС.
- Алкины содержат тройную связь CC.
- Алкены очень важны в нефтехимической
промышленности, поскольку они являются исходными веществами для
производства многих других соединений, таких как полимеры
(пластик).
Как называть органические соединения
- 1.
 Определите самую длинную углеродную цепь. Бывший. пент-
Определите самую длинную углеродную цепь. Бывший. пент-
для 5 Cs в самой длинной цепи. - 2. Определите тип соединения в цепи или кольце
. - 3. Определите функциональную группу, присоединенную к
цепочка или кольцо. Это может быть в начале или
в конце. - Пример. Этанол (спирт)
- 4. Цифры используются для обозначения положения
групп или связей в цепи. - пр. Бут-1-ен
Цели
- 10.1.9 Выведите структурные формулы соединений
, содержащих до шести атомов углерода с одной из следующих функциональных групп
спирт, альдегид,
кетон, карбоновая кислота кислота и галогениды . - 10.1.10 Применять правила ИЮПАК для обозначения соединений
, содержащих до шести атомов углерода, с одной из функциональных групп
, следующих за спиртом, альдегидом,
кетоном, карбоновой кислотой и галогенидом. - http//www.youtube.com/watch?vsd3YfPbPTgY
- 10.
 1.11 Определите следующие функциональные группы
1.11 Определите следующие функциональные группы
, если они присутствуют в структурных формулах амино (Nh3),
бензольное кольцо и сложные эфиры (RCOOR). - http//www.youtube.com/watch?v2sRNlhaYZDQ
Цели
- 10.1.12 Идентификация первичных, вторичных и третичных атомов углерода
в спиртах и галогеналканах. - 10.1.13 Обсудите летучесть и растворимость в
воде соединений, содержащих
функциональные группы, перечисленные в 10.1.9. - http//www.youtube.com/watch?vpH51q_YOluE
- 20.1.1 Выведите структурные формулы для
соединений, содержащих до шести атомов углерода с
одной из следующих функциональных групп амин,
амид, сложный эфир и нитрил. - 20.1.2 Применять правила ИЮПАК для наименования соединений
, содержащих до шести атомов углерода, с одной из функциональных групп
, следующих за амином, амидом, сложным эфиром,
и нитрилом. - http//www.
 youtube.com/watch?v0BHrXS9Zvt4
youtube.com/watch?v0BHrXS9Zvt4
Функциональные группы
Название Префикс/суффикс функциональной группы Пример
Алкан Нет -ан Ch5, метан
Алкен CC -ен Ch3Ch3, этен
Алкин CC -ин CHCH, этин
Спирт -OH -анол (или гидрокси) Ch4OH, метанол
Альдегид -CHO -аналь Ch4CHO, этаналь
Кетон -CO -анон Ch4COCh4, пропанон
Карбоновая кислота -COOH -ановая кислота Ch4COOH, этановая кислота
Галогеналкан -X (F, Cl, Br или I) Галогено-(фтор) Ch4Ch3Cl, хлорэтан
Амин-Nh3-иламин (или амино) Ch4Ch3Nh3, этиламин
Амид-CONh3-анамид Ch4CONh3, этанамид
Сложный эфир R-CO-O-R Алкил-алканоат Ch4COOCh4, метилэтаноат
Нитрил-CN-аннитрил (или циано-) Ch4-CN, этаннитрил (цианометан)
15
10.1.13 Обсудите летучесть и растворимость в
воде соединений, содержащих
функциональные группы, перечисленные в 10.1.9 (спирт, альдегид,
кетон, карбоновая кислота и галогенид).
- Волатильность является мерой насколько легко вещество
переходит в газообразное состояние. Высокая летучесть означает
Высокая летучесть означает
, что соединение имеет низкую температуру кипения. - Влияние на летучесть различных функциональных групп
обобщено как - галогеналканальдегидgt кетонegt спиртgt карбоновая
кислота - Растворимость в воде увеличивается за счет присутствия
функциональных групп, таких как спирты, карбоновые
кислоты и амины, поскольку все они могут образовывать водородные
связи. - Альдегиды, кетоны, амиды и сложные эфиры имеют полярные связи
, поэтому они растворимы в воде. - http//www.youtube.com/watch?vpH51q_YOluE
10.2 АЛКАНЫ
- 10.2.1 Объясните низкую реакционную способность алканов в
условия энтальпии связи и полярности связи. - Относительно прочные связи означают, что молекуле
требуется много энергии, чтобы начать любую реакцию
с низкой реакционной способностью. Молекула также
имеет много неполярных или малополярных связей, поэтому
электрофилы (ищущие отрицательные места для реакции)
и нейклеофилы (положительные места) не будут
притягиваться к ней.
10.2.2 Опишите, используя уравнения, полный
и неполное сгорание алканов
- Полное сгорание
- Ch5 (г) 2O2 (г) ? CO2 (г) 2h3O (л)
DH0 -890,4 кДж/мес
сгорания метана.
18
Реакции метана и этана
- 10.2.3 Опишите, используя уравнения, реакции
метана и этана с хлором и бромом. - http//www.youtube.com/watch?v7sEfRaXdh5A
- 10.2.4 Объясните реакции метана и этана
с хлором и бромом с точки зрения свободнорадикального механизма
. - http//www.youtube.com/watch?vukxOtG7d3OA
10.2.3 Опишите, используя уравнения, реакции
метана и этана с хлором и бромом.
HCl
Cl
20
10.2.4 Объясните реакции метана и этана
с хлором и бромом с точки зрения свободнорадикального механизма
.
- http//www.
 youtube.com/watch?vukxOtG7d3OA
youtube.com/watch?vukxOtG7d3OA - Реакционная смесь стабильна в темноте, но
УФ-излучение инициирует реакцию. Связь галогена
разрывается УФ-светом при гомолитическом делении
. Образовавшиеся радикалы хлора очень реакционноспособны. Реакция проходит через распространение
и завершение.
- 10.3.1 Опишите, используя уравнения, реакции
алкенов с водородом и галогенами. - Алкены можно превратить в алканы путем добавления
водорода (с использованием тепла и никелевого катализатора).
Галогены также могут быть добавлены к алкенам для получения
дигалогеналканов. НО галогены присоединяются к каждой стороне
связи CC — у
недостаточно места для галогенов, чтобы удобно разместиться только на одном углероде
. Это обе реакции ПРИСОЕДИНЕНИЯ. - http//www.youtube.com/watch?vVtQRO4MFfmM
- 10.3.2 Опишите, используя уравнения, реакции
симметричных алкенов с галогеноводородами и
вода.
- Гидратирование алкенов дает спирты, а
гидрогалонирование (на самом деле никто не использует это слово)
алкены производят галоалканы. Просто добавьте маленькую молекулу
поперек связи CC. - http//www.youtube.com/watch?v5z7seQ7IBsQ
и/или
Правило Марковникова при добавлении несимметричных
(то есть полярных) реагентов к алкенам,
положительная часть реагента ( обычно
водород) присоединяется к атому углерода, который уже
имеет наибольшее количество атомов водорода.
23
- 10.3.3 Различать алканы и алкены
с помощью бромной воды. - http//www.youtube.com/watch?v6FaBN70E2tM
- АЛКЕНЫ, CC обесцвечивает бромную воду (которая
имеет красный цвет). Двойная связь в алкене разрывается, и
атом брома связывается с С с каждой стороны.
АЛКАНЫ не реагируют, поэтому красный цвет брома
сохраняется. - 10.3.4 Опишите полимеризацию алкенов.

- http//www.youtube.com/watch?vLYZP9LQd-do
- Алкены ведут себя как мономеры (простые строительные блоки
), которые могут быть соединены вместе для образования длинных
цепей, называемых полимерами. Из этена можно получить полиэтилен
, из пропилена можно получить полипропилен и т. д.
Это полимеры присоединения — в реакции
полностью используется весь мономер, также не образуется сверхмалой молекулы
, как в полимерах конденсации
.
10.3.5 Опишите экономическое значение
реакции алкенов
- Алкены в растительном масле могут быть удалены путем
гидрирования для получения пастообразного маргарина — и
прибыли. Этен также может быть гидратирован с образованием топливного этанола
. Алкены полимеризуются для получения
пластиков, таких как полиэтилен или полипропилен, которые
многократно используются в качестве упаковки, одежды и т. д.
Алкены и пар 0091 алкена при 300С и 7 атм, обратимая реакция
, который производит ЭТАНОЛ.

этанол используется в больших количествах в качестве растворителя
и промежуточного продукта для получения других соединений.
алкены образуются при дегидратации спиртов.
h3SO4.
10.4 Спирты
- 10.4.1 Опишите, используя уравнения, полный
сжигание спиртов. - 10.4.2 Опишите, используя уравнения, реакции окисления
спиртов. - 10.4.3 Определите продукты, образующиеся при
окислении первичных и вторичных спиртов.
Спирты
- Их общая формула Cnh3n1OH.
- -OH является полярным, что увеличивает летучесть
и растворимость в воде по сравнению с алканами
аналогичной массы. - Наиболее известным спиртом является этанол C2H5OH, который
легко растворяется в воде и присутствует в
алкогольных напитках.
- Этанол для напитков производится путем
ферментации сахаров, таких как
глюкоза. Это медленный процесс, который требует
теплых анаэробных условий. - 3 класса спиртов
- 1. первичный имеет ОН, присоединенный к концу C.
- 2. вторичный имеет OH, присоединенный к среднему
C. - 3. третичный имеет OH, присоединенный к C
, связанный с 3 другими Cs .
Окисление спиртов
- Атомы H, присоединенные к C с группой OH
, легко окисляются, поэтому эти 3 класса спиртов
ведут себя по-разному. - Распространенным окислителем является подкисленный дихромат(VI) калия
. h3SO4 обычно используется в качестве кислоты
. - Третичные спирты не имеют реакционноспособных атомов H
и плохо окисляются. - Вторичные спирты имеют один реакционноспособный H и
окисляются с образованием кетонов.
Окисление спиртов
- Первичные спирты ? альдегиды? карбоновые кислоты.

- И альдегиды, и спирты полярны, но
спирты могут участвовать в водородных связях в
дополнении к диполь-дипольным силам, поэтому они имеют на
более высокую температуру кипения. Альдегиды имеют только
диполь-дипольных сил. - Для получения альдегида в лаборатории спирт
добавляют к кипящему окислителю таким образом, чтобы
, как только образуется более летучий альдегид,
отгоняется. - Для получения карбоновой кислоты вместо альдегида
добавляют более концентрированный раствор окислителя
и смесь
кипятят с обратным холодильником, чтобы альдегид не мог улетучиться. - Нагревание с обратным холодильником позволяет провести реакцию
при температуре кипения растворителя
без потери растворителя. - Пары кипящего растворителя превращаются обратно в
жидкий в вертикальном холодильнике и капает
обратно в колбу.
Свойства и реакции карбоновых кислот
- Обычно слабые кислоты
- Реагируют со спиртами с образованием сложных эфиров
- Нейтрализация
- Производство галогенангидридов (промежуточных продуктов синтеза
)
Амины
Амины представляют собой органические основания с общей формулой
R3N.

Нейтрализация
32
20.2 Нуклеофильное замещение
- 20.2.1 Объясните, почему гидроксид-ион является лучшим
нуклеофилом, чем вода. - http//www.youtube.com/watch?vDo8ugMm-vMs
- 20.2.3 Объясните, как соотношение Sn1/Sn2 в
галогеналканах по OH- зависит от того, является ли
галогеналкан первичным, вторичным или третичным. - Реакции Sn2 имеют более высокую энергию активации (и
являются нестабильным промежуточным продуктом реакции), поэтому
медленнее, чем реакции Sn1. (Sn1 представляет собой двухстадийный процесс
с третичными галогеналканами FAST) - http//www.youtube.com/watch?vUJJAyJrv1o0
- 20.2.4 Опишите реакции замещения
галогеналканов Nh4 и KCN - http//www. youtube.com/watch?vz0ryePkDfrg
Нуклеофильное замещение
- 20.2.5 Объясните реакции Sn2 первичных галогеналканов
с Nh4 и KCN - http//www.
 youtube.com/watch?vaV_EH65e5G0
youtube.com/watch?vaV_EH65e5G0 - 20.2.6 Опишите восстановление нитрилов с использованием
h3 и никелевого катализатора - http//www.youtube.com/watch?vkhgVZp-1OcM
Реакции элиминирования 9000 3
- 20.3.1 Опишите, используя уравнений, удаление
HBr из бромалканов - Теплый OH-(водн.) реагирует с бромалканами путем
замещения (Sn1 или Sn2) НО, если используется горячий OH-(этанол)
, то будет происходить реакция «элиминирования»
и этен будет продукт. Это показывает, что
те же реагенты, но другой растворитель могут
вызвать другую химическую реакцию. - http//www.youtube.com/watch?vvK03vp3m2cA
- 20.3.2 Опишите/объясните механизм
удаления HBr из бромалканов. - http//www.youtube.com/watch?vb9bHbtehQdQ
- Никто точно не знает, насколько подробно МБ хочет
здесь (учебники расходятся во мнениях) — так что это видео
содержит все, что вам нужно знать.
Реакции конденсации
- 20.4.1 Реакции спиртов с карбоновыми
кислотами с образованием сложных эфиров. Государственное использование сложных эфиров. - Реакция спирта с карбоновой кислотой в теплой серной кислоте
дает сложный эфир и воду.
Это реакция конденсации (образуется небольшая дополнительная молекула
— в данном случае вода). Серная кислота
действует как катализатор. Уравнение
в равновесии. Сложные эфиры имеют «фруктовый» запах
(в основном) и содержатся во фруктах. Они также являются хорошими растворителями
из-за их промежуточной полярности
(не полярная — не совсем неполярная!). Они
также легко воспламеняются.
Сложные эфиры
Сложные эфиры имеют общую формулу R’COOR, где R
представляет собой углеводородную группу.
Характерные запахи и вкусы
Гидролиз
Щелочной гидролиз (омыление)
38
Пути реакции
- 10.
 6.1 Сделайте вывод о путях реакции, учитывая
6.1 Сделайте вывод о путях реакции, учитывая
исходные материалы и продукт. - http//www.youtube.com/watch?v2SabU1POXoQ
- 20.5.1 Определите пути реакции, учитывая исходные материалы
и продукт. - http//www.youtube.com/watch?v0ujVlabZHT4
Реакции конденсации
- 20.4.2 Опишите, используя уравнения, реакции
аминов с карбоновые кислоты. - Амины реагируют с карбоновыми кислотами с образованием
амида и молекулы воды. это
реакция конденсации (продукты включают малую молекулу
и более крупный продукт) - http//www.youtube.com/watch?vPEROYlrufqI
- 20.4.3 Выведите структуры полимеров, образованных
спиртами и карбоновыми кислотами - http //www.youtube.com/watch?vgNAqy4eAbMU
- 20.4.4 Выведите структуру полимеров
, образованных аминами с карбоновыми кислотами. - http//www.youtube.com/watch?vPobsIm1KeFg
Стереоизомерия
- 20.



 Теория химического строения органических соединений.
Теория химического строения органических соединений. oms
oms
 Это может привести к смерти, если его уровень в
кровь высокая.
Это может привести к смерти, если его уровень в
кровь высокая.
 1.3 Различают эмпирические, молекулярные
1.3 Различают эмпирические, молекулярные 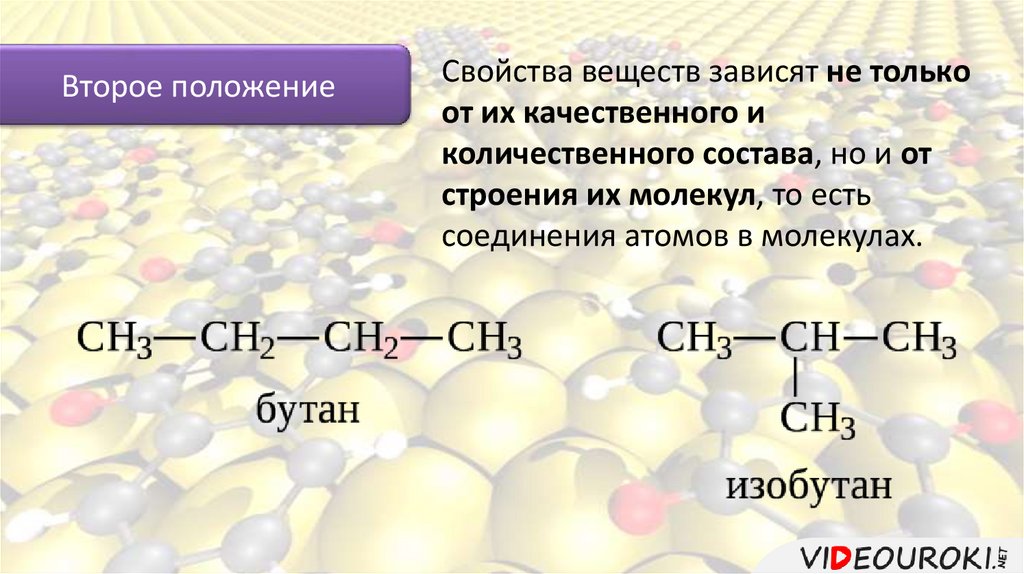 п. предсказуемо из-за
п. предсказуемо из-за 
 Определите самую длинную углеродную цепь. Бывший. пент-
Определите самую длинную углеродную цепь. Бывший. пент- 1.11 Определите следующие функциональные группы
1.11 Определите следующие функциональные группы  youtube.com/watch?v0BHrXS9Zvt4
youtube.com/watch?v0BHrXS9Zvt4 Высокая летучесть означает
Высокая летучесть означает 
 youtube.com/watch?vukxOtG7d3OA
youtube.com/watch?vukxOtG7d3OA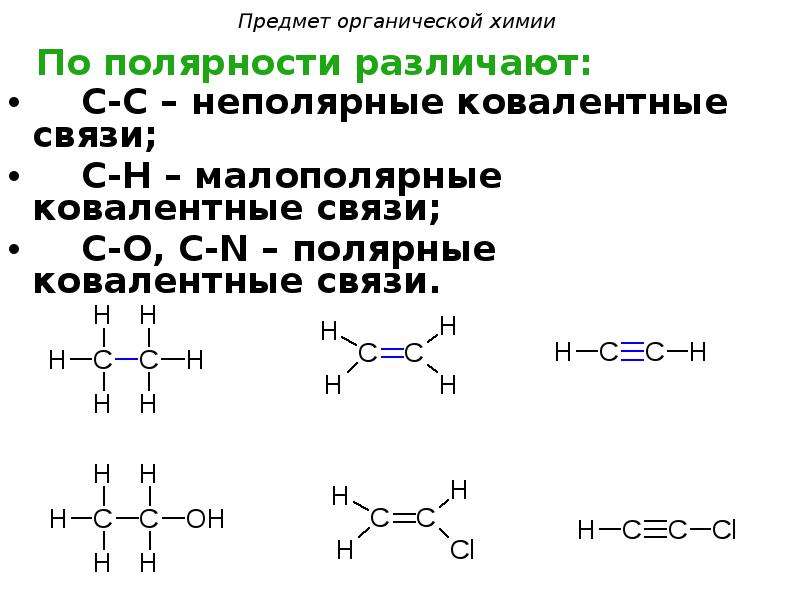



 youtube.com/watch?vaV_EH65e5G0
youtube.com/watch?vaV_EH65e5G0
 6.1 Сделайте вывод о путях реакции, учитывая
6.1 Сделайте вывод о путях реакции, учитывая 