Введение в химию – 404 Not Found
Н.Ф. Стась введение в химию
Томск 2007
УДК 546 (076.5)
ББК
Стась Н.Ф.
Введение в химию: Учебное пособие. – Томск: СТАНИФ, 2007. – 155 с.
В пособии рассматриваются понятия и закономерности атомно-молекулярного учения, классификация и номенклатура неорганических соединений, структура и закономерности Периодической системы Д.И. Менделеева, типы химических реакций. Предназначено для студентов с недостаточной базовой подготовкой по химии.
Рецензенты
Кандидат химических наук, доцент кафедры общей
и неорганической химии Томского политехнического университета
Л.Д. Свинцова
Кандидат химических наук, доцент кафедры общей
и неорганической химии Томского политехнического университета
А.В. Коршунов
Николай Фёдорович Стась, 2007
ПРЕДИСЛОВИЕ
Уровень базовых знаний по химии выпускников наших школ из года в год снижается. Причин этого явления много: уменьшение числа уроков, выделяемых на изучение химии, плохое материальное снабжение химических кабинетов, снижение профессиональной компетенции учителей и т.д. Но главная причина, как мы считаем, – это отмена обязательного выпускного экзамена в школах по химии. Поступив в технический университет, многие студенты испытывают поистине шоковое состояние, когда узнают о том, что в университете изучается химия, на которую в школе они не обращали внимания, считая её второстепенным предметом.
Преподаватели химии в технических университетах вынуждены решать проблему ликвидации пробелов в школьном химическом образовании студентов в условиях, когда аудиторное время не выделяется, так как в Государственных образовательных стандартах высшего профессионального образования изучение базового химического материала не предусмотрено. На входном контроле, который мы проводим ежегодно, и на первых же занятиях выявляются огромные пробелы в базовых знаниях по химии. Отметим самые типичные пробелы первокурсников в школьных знаниях по химии.
1. Они не знают атомно-молекулярное учение (это фундамент химии) и простейшие соотношения между количеством, массой и молярной массой вещества.
2. Из школьной химии «вытравлено» понятие стехиометрической валентности; не зная валентность элементов, они часто ошибаются при составлении формул химических соединений.
3. Пониманию состава соединений способствуют их структурные формулы, но о структурных формулах «что-то слышали» лишь отдельные студенты.
4. Они не знают разницы между схемой и уравнением реакции.
6. Практически все первокурсники не могут привести объем газа к нормальным условиям и проводить без ошибок вычисления по уравнению уравнению Клапейрона – Менделева.
7. Основные классы неорганических соединений абитуриенты знают, но показать уравнениями реакций химические свойства – это проблема для многих, а показать свойства амфотерного оксида или основания – проблема для всех.
8. Абитуриенты не демонстрируют глубины понимания периодического закона и закономерностей Периодической системы, например, как изменяются в периодах и группах свойства элементов и однотипных соединений. Поэтому они не могут прогнозировать свойства элемента и его соединений по его месту в Периодической системе.
9. Они имеют слабое представление о способах получения и практическом применении даже самых распространенных соединений: серной кислоты, гидроксида натрия и кальция, карбоната натрия. Практически никто не знает доменный процесс получения железа.
10. При объяснении закономерности химической кинетики абитуриенты любую реакцию рассматривают как простую, тогда как большинство реакций – сложные, кинетический порядок которых не равен молекулярности.
11. Они не знают, что кислые и основные соли диссоциируют ступенчато, не умеют правильно записывать схемы диссоциации.
12. Гидролиз солей: по этой теме из года в год повторяется проблема его ступенчатости; у абитуриентов гидролиз всех солей протекает необратимо по всем ступеням одновременно.
13. Они плохо решают задачи, связанные с массовой долей растворенного вещества, и совсем не знают молярной концентрации, которая является основным способом выражения состава растворов.
14. Трудно поверить, но многие абитуриенты не знают соотношения между граммом и килограммом, миллилитром и литром и т.д.
15. Они не умеют вычислять логарифмы и антилогарифмы чисел, хотя в химических расчётах такие математические действия приходится проводить, например в расчётах по уравнениям Аррениуса и Нернста.
Немало и таких студентов, которые до поступления в университет химию вообще не изучали. Например, на машиностроительный факультет Томского политехнического университета принимаются выпускники машиностроительного колледжа, которым в качестве вступительных экзаменов засчитываются итоговые оценки колледжа. В этом колледже изучение химии учебным планом не предусмотрено, и она не изучается.
В Томском политехническом университете преподаватели кафедры общей и неорганической химии в течение 5–6 недель в начале семестра вынуждены обучать студентов школьной химии, из-за чего часть вузовского материала, предусмотренного Государственным образовательным стандартом, не изучается. Но они должны это делать, так как без этой вынужденной меры химические знания студентов не будут иметь прочного фундамента.
studfiles.net
План-конспект урока (химия, 8 класс) по теме: Введение в химию. История химии.
1. Знакомство с кабинетом. Учитель рассказывает о своем кабинете, какие таблицы в ней представлены, какая информация содержится в витринных шкафах, для чего нужен вытяжной шкаф.
2. Техника безопасности. Учитель раздает каждому ребенку правила техники безопасности в химической лаборатории[1]в виде раздаточного материала и воспроизводит модуль[2] «Правила работы в химической лаборатории». Слайд 3.
3. Введение в химию. Рассказ учителя: Прежде, чем мы начнем изучать с вами химию, давайте рассмотрим, область применения химии. Еще великий русский ученый М. В. Ломоносов сказал:
«Широко распростирает химия руки свои в дела человеческие.
Куда не посмотрим, куда не оглянемся – везде
перед очами нашими успехи её применения…» Слайд 4.
Посмотреть, как широко раскинула свои руки химия, нам помогут фотографии, представленные на слайдах:
- каучук и резина;
- мыла и моющие средства;
- соль и сахар;
- средства личной гигиены;
- канцелярские товары и лекарства;
- удобрение;
- стекло. Слайд 5-13.
Теперь я задам вам вопрос: Где еще в жизни мы не можем обойтись без химии?
4. История химии. Рассказ учителя.
Слайд 14. В какой части земного шара и когда появились первые проблески химических знаний? Ответа на эти вопросы нет, из-за того, что от времен, когда зарождались первые химические знания, не осталось никаких памятников. Вероятно, первые сведения из химии передавались из поколения в поколение устно, да еще нередко и по секрету.
Слайд 15. Химия – наука древняя. Ее начало теряется в глубине веков. Если отождествлять химию с химической технологией, то можно с полным правом утверждать, что зародилась химия в доисторические времена, поскольку нашим предкам уже были знакомы кое-какие химико-технологические процессы, например добывание металлов из руд.
Слайд 16. Химия берет свое начало с Древнего Египта — это примерно 3-4 тысячи лет до н.э. Первое, что свидетельствует о том, как высоко была развита там химия, – это искусство египтян бальзамировать трупы, составляющее загадку, не раскрытую полностью учеными и поныне. Несмотря на то, что современные ученые владеют сотнями тысяч естественных и искусственных веществ, они не могут сделать мумию точно так, как это делали во времена фараонов.
Слайд 17. Вторая область, где египтяне достигли большого совершенства, – это красители. Да еще какие! Тысячи лет прошло с тех пор, как были окрашены в Египте предметы, а краски до сих пор сохранили свою яркость и прочность.
Слайд 18. На древних памятниках города Фивы, насчитывающих возраст до 4500 лет, имеются изображения горшечников и стеклодувов, а при раскопках найдены разноцветные стеклянные вазы.
Слайд 19. За 1600 лет до н. э. египтяне знали производство папирусов — больших листов для письма. Папирусы даже вывозились в другие страны.
Слайд 20. Народам Дальнего Востока также не чужда была химия. Наиболее крупный вклад в развитие материальной культуры был, бесспорно, вложен народами, населяющими территорию Китая. Самым значительным ранним открытием в Китае необходимо считать изобретение фарфора.
Слайд 21. Вначале II в. в Китае была изобретена бумага. Еще до нашей эры китайцы разработали способы получения сахара из растений.
Слайд 22. В Александрийской библиотеке в III веке до н.э. хранилось около 700 рукописных книг по химии.
Слайд 23. В V веке до н.э. древнегреческий философ Демокрит высказал предположения о существовании мельчайших частиц – атомов.
Слайд 24. Кончился древний период химии, период очень интересный по своим открытиям и накоплению знаний, и наступил новый, так называемый «период алхимии». Цель алхимиков – поиски путей превращения неблагородных металлов в благородные (золото или серебро) с помощью философского камня и создание эликсира вечной молодости. Все эти поиски привели к богатому багажу знаний по химии.
Слайд 25. До Михаила Васильевича Ломоносова каких-либо целенаправленных исследований по химии в России не проводилось. Ломоносов производил опыты с накаливанием металлов и создал первую в стране химическую лабораторию.
Слайд 26. Большой вклад в развитие химии внесли русские ученые: Александр Михайлович Бутлеров, создавший в 1861 г. теорию строения органических соединений и Дмитрий Иванович Менделеев, сформулировавший в 1869 г. периодический закон.
5. Значение слова химия.
Так что же означает слово «Химия»? Учитель воспроизводит учебный модуль [3] Значений слова «Химия» .
Учитель дает задание классу найти в учебнике в § 1 определение понятия химия и записать его.
nsportal.ru
Презентация по химии «Введение в химию»

Введение в химию

План:
- Введение.
- Что такое химия?
- Задачи химии.
- Происхождение слова » химия »
- Химия в жизни.
- Химия внутри нас.
- Философский подход к оценке химии в жизни человека.
- Заключение.

Введение.
Повсюду, куда бы ни обратил свой взор, нас окружают предметы и изделия, изготовленные из веществ и материалов, которые получены на химических заводах и фабриках. Кроме того, в повседневной жизни, сам того не подозревая, каждый человек осуществляет химические реакции. Например, умывание с мылом, стирка с использованием моющих средств и др.

Что такое химия?
Наука о веществах ,их строении ,свойствах ,превращениях и явлениях ,которыми сопровождаются эти превращения.

Химия — одна из отраслей естествознания, предметом изучения которой являются химические элементы (атомы), образуемые ими простые и сложные вещества (молекулы), их превращения и законы, которым подчиняются эти превращения.

Задачи химии.

Происхождение слова » химия »
Происхождение слова «химия» выяснено не окончательно. Многие исследователи полагают, что оно происходит от старинного наименования Египта — Хемия (греч. Chemía, встречается у Плутарха), которое производится от «хем» или «хаме» — чёрный и означает «наука чёрной земли» (Египта), «египетская наука».

Химия в жизни.
Химия – это наука. Строго говоря, наука не может окружать человека. Его могут окружать результаты практического приложения науки. Это уточнение весьма существенное. В настоящее время часто можно слышать слова: «химия испортила природу», «химия загрязнила водоем и сделала его непригодным для использования» и т. д. На самом же деле наука химия здесь вовсе непричем .Люди, используя результаты науки, плохо оформили их в технологический процесс, безответственно отнеслись к требованиям правил безопасности и к экологически допустимым нормам промышленных сбросов, неумело и не в меру использовали удобрения на сельскохозяйственных угодьях и средства защиты растений от сорняков и вредителей растений.

Многие важные для человека химические процессы были открыты задолго до того, как химия оформилась в науку. Значительное количество химических открытий было сделано наблюдательными и любознательными ремесленниками. Эти открытия переходили в семейные или клановые секреты и далеко не все дошли до нас. Часть из них была утеряна для человечества. Приходилось и приходится затрачивать огромный труд, создавать лаборатории, а иногда и институты для раскрытия секретов древних мастеров и их научного толкования.

Многие не знают, как устроен телевизор, но успешно пользуются им. Однако знание устройства телевизора никогда и никому не помешает в правильной его эксплуатации. Так и с химией. Понимание сущности химических процессов, с которыми мы встречаемся в повседневной жизни, может принести человеку только пользу.

Химия внутри нас.
Все живые организмы на Земле, в том числе и человек, находятся в тесном контакте с окружающей средой. Пищевые продукты и питьевая вода способствуют поступлению в организм практически всех химических элементов. Они повседневно вводятся в организм и выводятся из него. В народе бытует мнение о том, что в организме человека можно обнаружить практически все элементы периодической системы Д. И. Менделеева. Ученые же утверждают, что в живом организме не только присутствуют все химические элементы, но каждый из них выполняет какую-то биологическую функцию.

Философский подход к оценке химии в жизни человека.
Проявляя в своём поведении разумный компромисс между отстаиванием своих интересов (защита) и учётом мнения оппонента, изменяя слегка свои подходы к решению проблем, как атом углерода в процессе реакций изменяет расположение своих электронов и вакансий, мы продвинемся в деле получения результатов значительно дальше, чем, если бы сохраняли свою позицию неизменной.
С учётом того, что такой подход может быть применён большим количеством людей, то они, как одинаковые атомы углерода, смогут образовать прочные (двойные и тройные) связи. Тоже самое можно сказать и в отношении человеческих общностей
Пример водорода, в этом вопросе также очень показателен. Сократите сферу своего влияния (или уменьшите область своих запросов) и Вы, подобно атому водорода, сможете взаимодействовать и объединяться со значительно большим числом людей (элементов).

Заключение.
Роль химии в жизни общества очень велика. Она применяется во всех отраслях промышленности в природе, науке и технике.
Химия в нашей стране служит одним из мощных средств построения общества. Мощный химической промышленности, непрерывно растет и развивается требуется пополнение кадров высококвалифицированных химиков. Химию широко применяют в в сих отраслях промышленности.
videouroki.net
Элективный курс. Введение в химию
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА.
Программа «Введение в химию» включает новые для учащихся знания. Элективный курс должен развить познавательную активность учащихся.
Курс рассчитан на 17 часов учебного времени.
Цели курса:
Создание условий для формирования интереса к изучению химии у учащихся;
Создание условий для формирования умений самостоятельно применять полученные знания на практике.
Задачи курса:
Дать ученику возможность реализовать свой интерес к предмету,
Уточнить готовность ученика к осваиванию нового предмета.
Привить навыки работы с лабораторным оборудованием, химической
посудой и реактивами.
Планируемый результат:
Учащиеся должны знать: химическую символику – знаки химических элементов, формулы химических веществ; понимать важнейшие химические понятия — химический элемент, атом, молекула, относительные атомные и молекулярные массы, вещество, чистое вещество и смесь, химическая реакция, ее признаки.
Учащиеся должны уметь: называть химические элементы, вычислять относительные атомные и молекулярные массы, разделять смеси, определять признаки химических реакций, обращаться с химической посудой и лабораторным оборудованием; использовать приобретенные знания и умения в практической деятельности и повседневной жизни.
Основные формы обучения:
Теоретические занятия, лекции, беседы, групповые занятия, практические работы.
Форма итоговой отчётности:
Тестирование, презентация.
Содержание программы:
Теоретическая часть.
Химия – часть естествознания. Взаимоотношение человека и окружающего мира. Физические тела и вещества. Свойства веществ. Применение веществ. Растительная и животная клетка. Химический состав вещества клетки. Фотосинтез. Жиры. Углеводы. Белки. Витамины. Строение земли. Земная кора. Минералы и горные породы. Неорганические и органические осадочные породы. Три агрегатных состояния вещества на примере воды. Физические явления. Газообразные, жидкие и твердые вещества. Аморфные вещества. Наблюдения, эксперимент и моделирование – как методы познавания вещества. Лабораторное оборудование. Правила техники безопасности. Химический элемент. Химический знак и химические формулы. Простые и сложные вещества. Определение атомной и молекулярной массы. Чистые вещества и смеси. Газообразные, жидкие и твердые смеси. Способы разделения смесей. Разделение, очистка, просеивание, отстаивание, декантация, центрифунгирование, фильтрование. Адсорбция. Химические реакции и условия их протекания. Соприкоснове6ние веществ, нагревание, катализаторы. Ферменты. Управление реакцией горения. Признаки химических реакций: образование осадка, выделение газа, изменение цвета, появление запаха, выделение тепла и света. Великие ученые — химики М.В.Ломоносов, Д.И.Менделеев.
Практическая часть.
Демонстрационный опыт: Взаимодействие хлорида бария с серной кислотой. Изменение окраски фенолфталеина в растворе щелочи. Разложение дихромата аммония. Горение свечи. Смеси и их разделение. Взаимодействие карбоната кальция (мрамора, мела) с раствором соляной кислоты. Взаимодействие серы с железом. Взаимодействие индикаторов с растворами кислоты и щелочи, сульфита натрия. Получение углекислого газа и доказательство его наличия.
Лабораторный опыт: Обнаружение содержания жира в ядре грецкого ореха. Обнаружение крахмала. Изучение состава гранита. Распыление аэрозоля. Растворение перманганата калия. Взаимодействие хлорида бария с сульфатом натрия. Взаимодействие фенолфталеина со щелочью. Взаимодействие карбоната натрия с соляной кислотой.
Практическое занятие: Знакомство с лабораторным оборудованием, Наблюдение за горящей свечой. Разделение смесей.
Литература.
О. С. Габриелян, Н.П.Воскобойников, А.В.Яшукова Химия 8 класс. Настольная книга учителя. М. Дрофа, 2002 г.
О.С.Габриелян, И.Г.Остроумова, А.К.Ахлебенин Химия. Вводный курс. 7 класс. М. Дрофа. 2006г.
О.С.Габриелян. Химия 8 класс. Учебник для общеобразовательных учреждений. М. Дрофа. 2008 г.
А.В.Перышкин. Физика 7 класс. Учебник для общеобразовательных учреждений. М. Дрофа. 20076г.
И.Н.Пономарева, О.А.Корнилова, В.С. Кучеенко Биология. 6 класс. Учебник для учащихся 6 класса общеобразовательных учреждений.
п\п
Содержание
Кол-во
часов
Виды деятельности
Дата
Прим.
1
Химия как часть естествознания
1
Лекция.
Демонстрационный опыт
23.01.09
2
Химия и биология.
1
Беседа.
Лабораторный опыт.
30.01.09
3
Химия и география.
1
Беседа.
Лабораторный опыт.
06.02.09.
4
Химия и физика
1
Беседа.
Лабораторный опыт.
13.02.09.
5
Методы изучения химии.
1
Лекция.
Демонстрационный опыт
20.02.09.
6
Знакомство с лабораторным оборудованием
1
Практическая работа.
27.02.09
7
Наблюдение за горящей свечой
1
Практическая работа
06.03.09.
8
Химические знаки и химические формулы.
1
Лекция
13.03.09.
9
Химия и математика. Вычисление относительных атомной и молекулярной массы
1
Решение задач по алгоритму.
20.03.09.
10
Чистые вещества и смеси.
1
Лекция.
Демонстрационный опыт.
03.04.09
11
Разделение смесей.
1
Практическое занятие.
10.04.09.
12
Физические явления и химические реакции
1
Лекция.
Демонстрационный опыт.
17.04.09.
13
Химические реакции. Качественные реакции.
1
Лекция.
Демонстрационный опыт.
24.04.09.
14
Признаки химических реакций.
1
Лекция.
Лабораторный опыт.
08.05.09.
15
М.В. Ломоносов
1
Доклады, презентации
15.05.09
16
Д.И. Менделеев.
1
Доклады, презентации
22.05.09
17
Урок — обобщение
1
Тестирование
Презентация.
29.05.09
infourok.ru
Раздел 1. Введение в физическую химию.
Тема 1. Предмет физической химии, история развития, разделы и методы исследования.
Историческая обусловленность возникновения физической химии и других смежных наук. Место физической химии среди других наук. Предмет, задачи, разделы и методы исследования физической химии.
Исторические этапы развития физической химии. Вклад ученых России в развитие физической химии (Ломоносов М.В., Гесс Г.И., Бекетов Н.И., Менделеев Д.И., Бутлеров А.М., Коновалов Д.П., Курнаков Н.С., Кистяковский Н.И., Семенов Н.Н., Фрумкин А.Н., Ребендер П.А., Измайлов Н.А. и др.).
Роль физической химии в химической промышленности и биологии, в формировании научного (материалистического) мировоззрения. Значение физической химии в подготовке учителя биологии и химии.
Раздел 2. Химическая термодинамика
Тема 2. Предмет и метод термодинамики, основные понятия.
Историческая справка. Предмет и роль химической термодинамики в изучении физико-химических и химических процессов. Методы и ограничения термодинамики. Основные понятия: тело, система (классификация), состояние, процесс, термодинамические параметры экстенсивные и интенсивные.
Тема 3. Энергия. Закон сохранения и превращения энергии. Первый закон термодинамики. Энтальпия.
Формы существования материи. Закон сохранения материи. Формы энергии и формы обмена энергии системы с окружающей средой.
Первый закон термодинамики. Понятие о внутренней энергии. Энтальпия. Математическое выражение первого закона термодинамики. Идеальный газ. Работа расширения идеального газа. Изопроцессы. Адиабатный процесс. Работа процессов: изобарного, изохорного, изотермического, адиабатного. Стандартные условия в термодинамике.
Теплоемкость истинная, средняя, молярная, удельная. Теория теплоемкости газов. Число степеней свободы. Теплоемкость при постоянном давлении и объеме. Разность между изобарной и изохорной теплоемкостями идеального газа. Зависимость теплоемкости от температуры.
Тема 4. Термохимия.
Приложение первого закона термодинамики к химическим процессам. Понятие о тепловом эффекте реакции. Термохимические уравнения. Закон Гесса и вытекающие из него следствия. Тепловые эффекты химических реакций при постоянном давлении и объеме. Энтальпия образования, сгорания, растворения, фазовых переходов. Расчет теплового эффекта химических реакций, энергии связи, кристаллической решетки, гидратации ионизации. Зависимость теплового эффекта (энтальпии) реакции от температуры. Закон Кирхгоффа.
Тема 5. Второй закон термодинамики. Энтропия.
Второй закон термодинамики. Обратимые и необратимые процессы. Обратимое изотермическое расширение газов. Формулировки второго закона термодинамики. Самопроизвольные и несамопроизвольные процессы. Цикл Карно и максимальный коэффициент полезного действия. Математическое выражение второго закона термодинамики. Энтропия как функция состояния. Энтропия и термодинамическая вероятность. Уравнение Больцмана. Изменение энтропии в обратимых и необратимых процессах. Третий закон термодинамики. Абсолютная энтропия. Изменение энтропии при изменении объема системы, температуры, числа частиц, при фазовых превращениях.
Применение второго закона термодинамики к изолированной системе. Наиболее вероятное состояние системы и флуктуации. Критика идеалистической теории «тепловой смертности Вселенной». Изменение энтропии в открытых системах.
studfiles.net
Введение в токсикологическую химию
Предмет и задачи. Взаимосвязь с другими дисциплинами. Особенности.
Основные разделы токсикологической химии.
Основные направления химико-токсикологического анализа.
Этапы становления и развития токсикологической химии.
Название предмета «Токсикологическая химия» уже само показывает, что это наука, связанная, с одной стороны, с токсикологией, с другой — с химией. Токсикология — наука медицинская. Ее название происходит от двух греческих слов: toxikon — яд и logos — учение. Токсикология, таким образом, является наукой о ядах и их действии на организм (человека, животного, растения).
Токсикологическая химия возникла из потребностей токсикологии, что отражается и на названии, и на содержании предмета. В период своего становления и развития токсикологическая химия была связана, главным образом, с судебно-медицинской токсикологией и называлась судебной химией, а в 1965 году переименована в токсикологическую химию). В других странах при том же содержании этот предмет называют судебно-химическая токсикология, аналитическая токсикологическая химия, химическая токсикология, аналитическая токсикология.
Программа для фармацевтических вузов, утвержденная Минздравом РФ в 1996 г., дает следующее определение изучаемой дисциплины :
Токсикологическая химия – это наука о химических превращениях токсических веществ и их метаболитов в организме, методах их выделения из объектов биологического происхождения, обнаружения и количественного определения.
В действующем до настоящего времени учебнике М.Д.Швайковой «Токсикологическая химия», изданном в 1975 г.,
Токсикологическая химия определяется как наука о химических методах изолирования, обнаружения и определения ядовитых и сильнодействующих веществ, а также продуктов их превращения в тканях, органах и жидкостях организма (животного, растения) и в окружающей человека среде и предметах (вода, воздух, земля, остатки пищевых продуктов, лекарств и т.п.)
Характерной чертой современной токсикологической химии является значительное расширение арсенала потенциально опасных для человека и животных химических соединений. Потенциальные возможности отравлений заложены в широчайшем использовании химических средств в медицине, промышленности и быту, в доступности различных химических веществ широким слоям населения, не всегда достаточно знакомого с токсическими свойствами этих веществ, применяемых в качестве лекарств, пестицидов, препаратов бытовой химии, а также в попытках самолечения и т.п. Постоянное увеличение числа отравлений, особенно лекарственными средствами, отмечается в последние десятилетия практически во всех развитых странах мира. Немаловажное значение имеют и загрязнение окружающей человека среды (вода, пища, воздух современных городов и др.) отходами производства, накопление в этих объектах большого количества веществ, которые при определенных условиях могут стать причиной отравления.
Основными задачами современной токсикологической химии как науки поэтому продолжают оставаться:
разработка новых и усовершенствование применяемых методов выделения (изолирования), обнаружения и количественного определения токсических веществ в жидкостях, органах и тканях организма и во внешней среде, а также методов изолирования, обнаружения и определения продуктов их превращения (метаболитов) в живом организме и в трупе.
Решение этих задач направлено на диагностику отравлений, оказание быстрой помощи отравившемуся, на предупреждение всякого рода отравлений токсическими веществами.
Токсикологическая химия является специальной фармацевтической дисциплиной и взаимосвязана с другими дисциплинами:
медицинскими (фармакология, судебно-медицинская и клиническая токсикология),
биологическими (биохимия, биология, фармакогнозия),
химическими (фармацевтическая, аналитическая, органическая и др. химии).
Следует отметить, что токсикологическая химия как специальная фармацевтическая дисциплина преподается только в фармацевтических вузах страны.
Овладение основами токсикологической химии необходимо провизору для последующей специализации в области судебно-химической экспертизы, клинической токсикологии и фармации, криминалистики, экологии и санитарной химии.
Токсикологическую, ранее — судебную химию, следует считать сравнительно молодой наукой. Годом ее узаконения считается 1714г., когда Петром I был издан Воинский указ об обязательном установлении причины смерти лиц, погибших насильственной смертью (обязательно вводилось судебно-медицинское вскрытие таких трупов).
Создана судебная химия была трудами фармацевтов. Трудами этих же специалистов она развивалась и развивается в настоящее время
Своей деятельностью в области судебной химии выделились ученые:
А..А.Иовский (Московский университет) в 1834 г. впервые в России издал на русском языке руководство по судебной химии, названное им «Руководство к распознанию ядов, противоядий и важнейшему определению первых как в организме, так и вне оного посредством химических средств, названных реактивами».
А.П.Нелюбин заведовал кафедрой фармации медико-хирургической академии Санкт-Петербурга. В 1824 г. опубликовал первые «Правила для руководства судебного врача при исследовании отравления», где впервые в мире он теоретически обосновал необходимость разрушения объекта (органических веществ) при судебно-химических и других исследованиях на «металлические яды», предложил и свой способ разрушения, обосновал способ обнаружения соединений мышьяка после его восстановления до мышьяковистого водорода.
А.П.Дианин профессор Медико-хирургической академии работал в ней более 30 лет и произвел за это время около 5 тысяч судебно-химических анализов. В 1903 г. Дианин получил звание академика Военно-медицинской академии, а в 1904 г. — звание главного судебно-химического эксперта.
Г.Драгендорф, профессор Дерптского (Тарту) Университета, проработавший в России 32 года, впервые выделил судебную химию из фармации в самостоятельную науку и читал ее отдельным курсом. Книга Драгендорфа «Судебно-химическое открытие ядов» выдержала 4 издания. Издавал фармацевтический журнал на немецком языке. Занимался вопросами изолирования и доказательства алкалоидов при судебно-химических исследованиях. Общеалкалоидный реактив Драгендорфа применяется и в наше время.
Профессор Н.И.Кромер — воспитанник Дерптского университета, был основателем химико-фармацевтического отделения при Пермском университете, а затем – самостоятельного фармацевтического института и организатором судебно-медицинской экспертизы в г.Перми (в советское время).
В дореволюционной России не существовало специальных лабораторий для производства судебно-химического анализа.
После 1917 г. началось создание сети государственных судебно-медицинских лабораторий с судебно-химическими отделениями при них.
В 1918 г. при Народном комиссариате здравоохранения был организован отдел медицинской экспертизы, учреждены должности судебно-медицинских экспертов и выработано впервые «Положение о правах и обязанностях государственных судебно-медицинских экспертов».
В 1920 г. были созданы первые кафедры судебной химии на химико-фармацевтического факультета II Московского государственного университета и в Петроградском химико-фармацевтическом институте.
В 1934 г. был создан Государственный НИИ судебной медицины, который в настоящее время переименован в Центр судебно-медицинской экспертизы при МЗ РФ.
В 1934 г. Наркомздравом РСФСР были утверждены первые «Правила судебно-медицинского и судебно-химического исследования вещественных доказательств», которые затем периодически обновлялись.
В настоящее время действует Приказ Минздрава РФ № 407 от 10 декабря 1996 года «О введении в практику правил производства судебно-медицинской экспертизы», который регламентирует правовые и методологические основы, в том числе, и судебно-химической экспертизы.
В развитие токсикологической химии и совершенствование судебно-химической экспертизы в нашей стране огромный вклад внесли:
профессор А.В.Степанов — создатель и руководитель первой кафедры судебной химии во II Московском государственном университете, магистр фармации, доктор биологических наук, заслуженный деятель науки РСФСР. Он являлся одним из главных организаторов Московского фармацевтического института, где был заместителем директора по научной части и первым деканом. В области судебной химии проработал 45 лет. Написал около 100 научных работ и 3 учебника, в том числе учебник по судебной химии был трижды переиздан. Занимался подготовкой кадров для судебно-химической экспертизы, впервые при кафедре организовал курсы специализации и усовершенствования судебных химиков. Известны его работы по вопросам изолирования алкалоидов и металлических ядов,
профессор М.Д.Швайкова, ученица А.В.Степанова, которая после его смерти в 1946 г. возглавила кафедру судебной химии и руководила ею в течение 30 лет. М.Д.Швайкова продолжила и успешно развивала все научные направления, созданные А.В.Степановым. Ею подготовлено 30 кандидатов фармацевтических наук в области судебной химии; написан учебник по судебной, а затем по токсикологической химии, выдержавший три издания.
Центрами научной мысли в области токсикологической химии в РФ являются Центр судебно-медицинской экспертизы при МЗ РФ, кафедры и курсы токсикологической химии фармацевтических вузов страны, где и сейчас работают ученики М.Д.Швайковой.
Достижения в области токсикологической химии тесно связаны с общими успехами химических и токсикологических наук. Новейшие методы аналитической химии находят широкое применение и в токсикологической химии.
Основными разделами токсикологической химии являются биохимическая и аналитическая токсикология.
Современное развитие токсикологии показывает, что понимание механизмов токсического действия веществ на организм невозможно без системного подхода. Организм является сложной биосистемой, совокупностью взаимодействующих частей. Токсичность вещества неразрывно связана с кинетикой его всасывания, распределения, выделения, механизмом метаболических реакций и т.д., поэтому необходимо уделять особое внимание главным путям и механизмам транспорта, количественным закономерностям, определяющим зависимость между химическими свойствами и биологической активностью веществ. Все эти вопросы составляют основы биохимической токсикологии.
Вопросы кинетики чужеродных соединений, основные закономерности и параметры их распределения, процессы всасывания и экскреции, кинетика выведения из организма подробно рассмотрены в курсе фармакологии.
Вопросы биотрансформации чужеродных соединений в организме, этапы и пути реакций биотрансформации, факторы, влияющие на метаболизм, — рассмотрены в курсе биологической химии.
Информация о физико-химических характеристиках ядовитых веществ позволяет правильно ориентироваться в степени их токсичности, в многообразиях химических превращений, происходящих с токсическим веществом в организме, а также оценивать токсическую ситуацию, связанную с поступлением токсического вещества в организм человека или животного.
Аналитическая токсикология является главным и основным разделом токсикологической химии, в котором рассматриваются способы и методы химического анализа в приложении к биологическим объектам. Основным вопросом аналитической токсикологии остается, как и ранее в судебной химии, рассмотрение вопросов, связанных с подготовкой проб (объектов), включающих выделение (изолирование), очистку и концентрирование токсических соединений из разнообразных биологических объектов, а также правильное использование для качественного и количественного определения возможностей различных методов анализа, их рациональное сочетание.
Химико-токсикологический анализ (ХТА) является чрезвычайно ответственным и имеет свои специфические особенности (это и выделяет токсикологическую химию в самостоятельную фармацевтическую дисциплину).
studfiles.net
Введение в химию Химия это наука
 Введение в химию
Введение в химию
 Химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением их структуры и состава.
Химия – это наука, изучающая процессы превращения веществ, сопровождающиеся изменением их структуры и состава.
 Тело • материальный объект, имеющий массу, объём и отделенный от других тел границей раздела • (кусочек мела) • совокупность атомов или молекул, находящихся в определенном агрегатном состоянии Вещество • (мел Ca. CO 3) • мельчайшая частица вещества, которая сохраняет его химические свойства Молекула • (1 частица — молекула Ca. CO 3) Атом • наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств • (Ca, или C, или O)
Тело • материальный объект, имеющий массу, объём и отделенный от других тел границей раздела • (кусочек мела) • совокупность атомов или молекул, находящихся в определенном агрегатном состоянии Вещество • (мел Ca. CO 3) • мельчайшая частица вещества, которая сохраняет его химические свойства Молекула • (1 частица — молекула Ca. CO 3) Атом • наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств • (Ca, или C, или O)
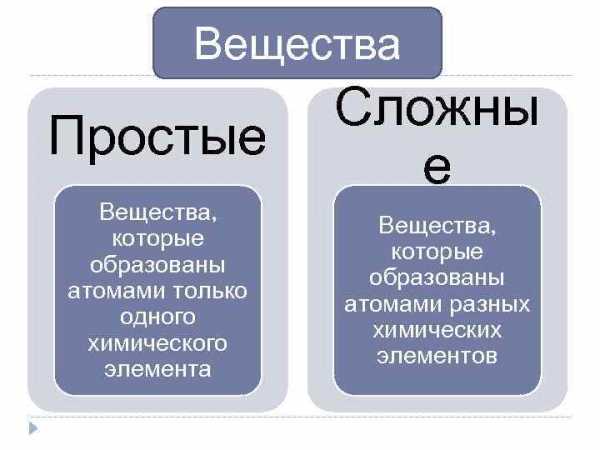 Вещества Простые Сложны е Вещества, которые образованы атомами только одного химического элемента Вещества, которые образованы атомами разных химических элементов
Вещества Простые Сложны е Вещества, которые образованы атомами только одного химического элемента Вещества, которые образованы атомами разных химических элементов
 Простые вещества Сера S Натрий Na Фосфор P Медь Cu Бром Br 2 Ртуть Hg
Простые вещества Сера S Натрий Na Фосфор P Медь Cu Бром Br 2 Ртуть Hg
 Сложные вещества Вода H 2 O Кварц Si. O 2 Бурый газ NO 2 Поваренная соль Na. Cl Цинковая обманка Zn. S
Сложные вещества Вода H 2 O Кварц Si. O 2 Бурый газ NO 2 Поваренная соль Na. Cl Цинковая обманка Zn. S
 Свойства веществ – это признаки, по которым одни вещества отличаются от других. Физические свойства: • агрегатное состояние • цвет • запах • вкус • растворимость в воде • теплопроводность • электропроводность • температуры плавления • температура кипения • удельный вес • плотность Химические свойства: • способность реагировать с другими веществами
Свойства веществ – это признаки, по которым одни вещества отличаются от других. Физические свойства: • агрегатное состояние • цвет • запах • вкус • растворимость в воде • теплопроводность • электропроводность • температуры плавления • температура кипения • удельный вес • плотность Химические свойства: • способность реагировать с другими веществами
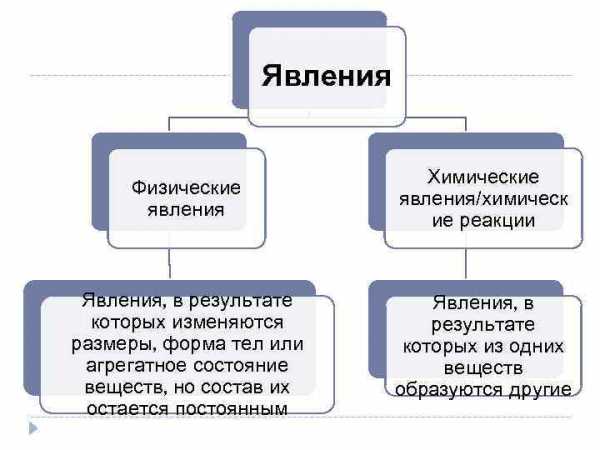 Явления Физические явления Химические явления/химическ ие реакции Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние веществ, но состав их остается постоянным Явления, в результате которых из одних веществ образуются другие
Явления Физические явления Химические явления/химическ ие реакции Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние веществ, но состав их остается постоянным Явления, в результате которых из одних веществ образуются другие
 Признаки химических реакций: изменение цвета выделение газа появление запаха образование осадка выделение тепла и света
Признаки химических реакций: изменение цвета выделение газа появление запаха образование осадка выделение тепла и света
 Горение древесины Плавление галлия на ладони Пожелтели листья Скисание молока Таяние льда
Горение древесины Плавление галлия на ладони Пожелтели листья Скисание молока Таяние льда
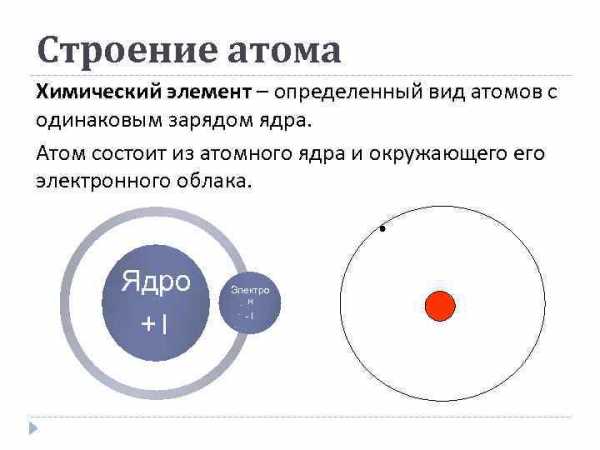 Строение атома Химический элемент – определенный вид атомов с одинаковым зарядом ядра. Атом состоит из атомного ядра и окружающего электронного облака. Ядро +1 Электро н -1
Строение атома Химический элемент – определенный вид атомов с одинаковым зарядом ядра. Атом состоит из атомного ядра и окружающего электронного облака. Ядро +1 Электро н -1
 Строение атома Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
Строение атома Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов.
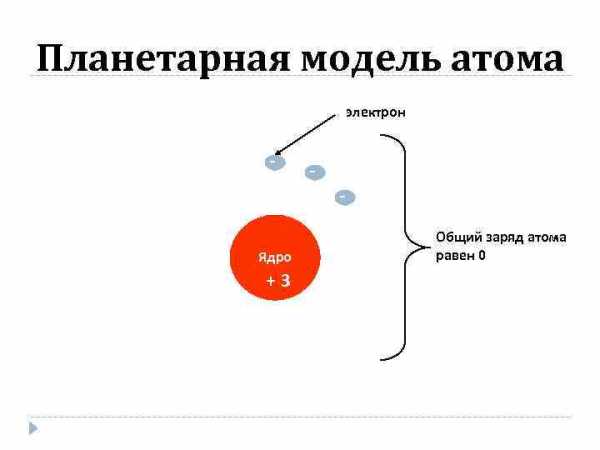 Планетарная модель атома электрон — — Ядро +3 Общий заряд атома равен 0
Планетарная модель атома электрон — — Ядро +3 Общий заряд атома равен 0
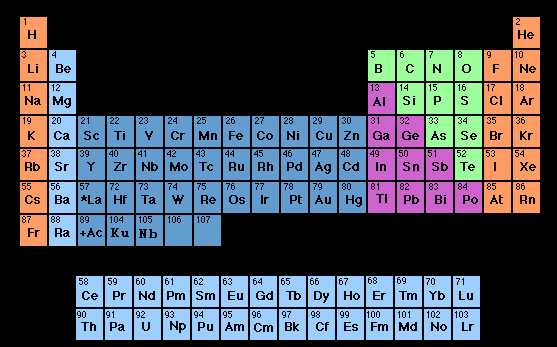
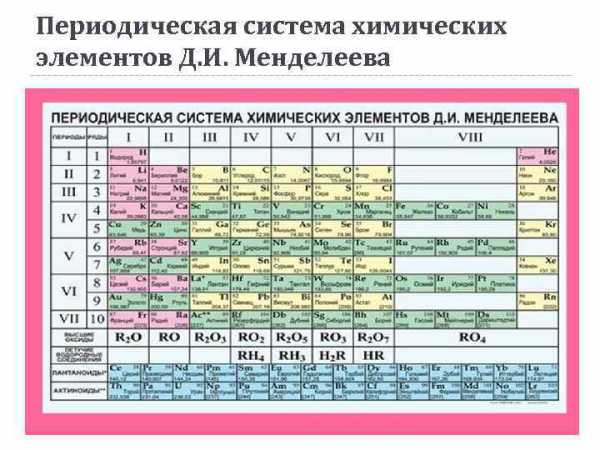 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева
 Периодическая система элементов по IUPAC
Периодическая система элементов по IUPAC
 Периодический закон Д. И. Менделеев (1869 г. ): «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» . Современная формулировка: свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Периодический закон Д. И. Менделеев (1869 г. ): «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса» . Современная формулировка: свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
 Периодическая система химических элементов Д. И. Менделеева Г р у п п ы Периоды Малые периоды (1 -3) Большие периоды (47) Главные подгруппы (со стороны Н) Побочные подгруппы (с противоположной стороны от Н)
Периодическая система химических элементов Д. И. Менделеева Г р у п п ы Периоды Малые периоды (1 -3) Большие периоды (47) Главные подгруппы (со стороны Н) Побочные подгруппы (с противоположной стороны от Н)
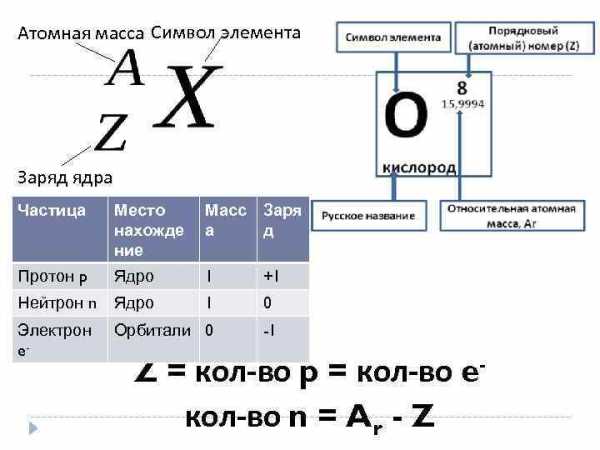 Атомная масса Символ элемента Заряд ядра Частица Место нахожде ние Масс Заря а д Протон p Ядро 1 +1 Нейтрон n Ядро 1 0 Электрон e- Орбитали 0 -1 Z = кол-во p = кол-во eкол-во n = Ar — Z
Атомная масса Символ элемента Заряд ядра Частица Место нахожде ние Масс Заря а д Протон p Ядро 1 +1 Нейтрон n Ядро 1 0 Электрон e- Орбитали 0 -1 Z = кол-во p = кол-во eкол-во n = Ar — Z
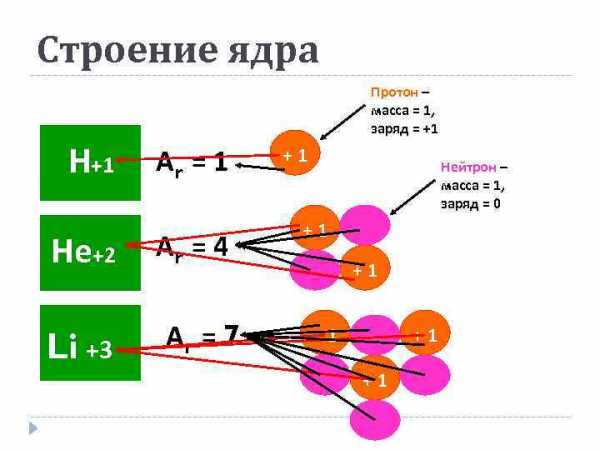 Строение ядра Протон – масса = 1, заряд = +1 Не+2 Li +3 Аr = 1 Аr = 4 Аr = 7 +1 Нейтрон – масса = 1, заряд = 0 +1 +1 +1
Строение ядра Протон – масса = 1, заряд = +1 Не+2 Li +3 Аr = 1 Аr = 4 Аr = 7 +1 Нейтрон – масса = 1, заряд = 0 +1 +1 +1
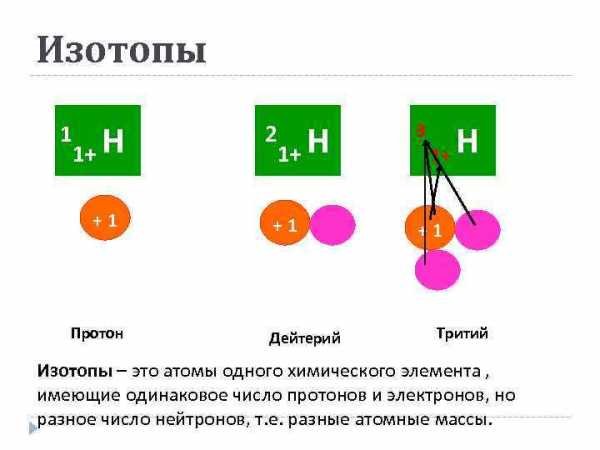 Изотопы 1 1+ Н +1 Протон 1+ Н 3 +1 +1 2 Дейтерий 1+ Н Тритий Изотопы – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное число нейтронов, т. е. разные атомные массы.
Изотопы 1 1+ Н +1 Протон 1+ Н 3 +1 +1 2 Дейтерий 1+ Н Тритий Изотопы – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но разное число нейтронов, т. е. разные атомные массы.
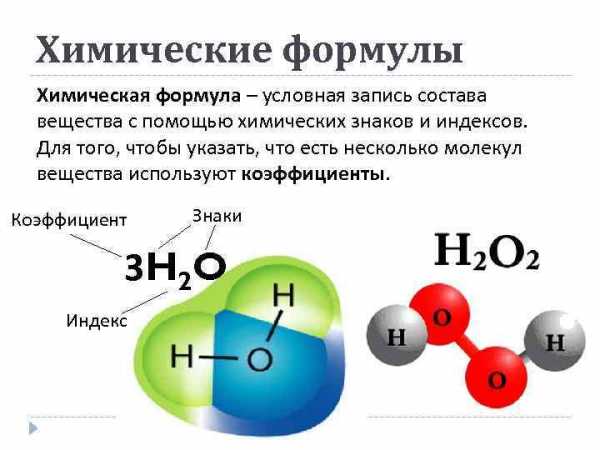 Химические формулы Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Для того, чтобы указать, что есть несколько молекул вещества используют коэффициенты. Коэффициент Знаки 3 H 2 O Индекс
Химические формулы Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Для того, чтобы указать, что есть несколько молекул вещества используют коэффициенты. Коэффициент Знаки 3 H 2 O Индекс
present5.com

