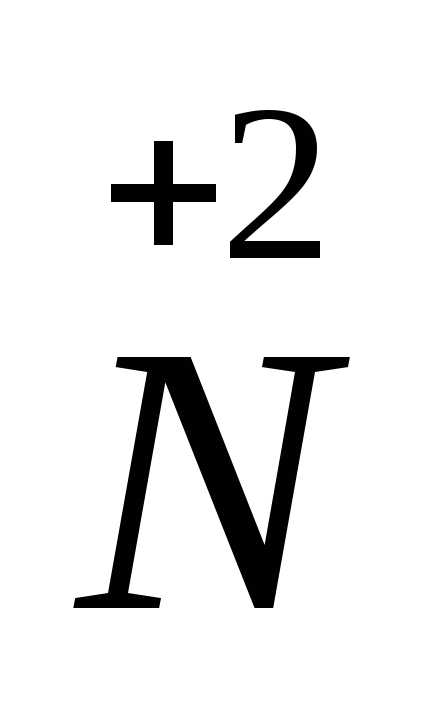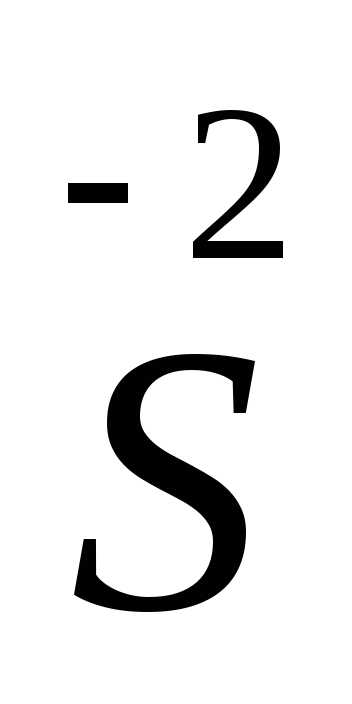Примеры овр реакций – Задачи к разделу Окислительно-восстановительные реакции
Задачи к разделу Окислительно-восстановительные реакции
В данном разделе собраны задачи по теме Окислительно-восстановительные реакции. Приведены примеры задач на составление уравнений реакций, нахождение окислительно-восстановительного потенциал, и константы равновесия ОВР и другие.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S = H2SO4 + NO + H2O.
Показать решение »
Решение.
Простые вещества, атомы которых не могут отдать электрон, а могут только присоединить его в реакциях являются только окислителями. Из простых веществ только окислителем может быть фтор F2, атомы которого имеют наивысшую электроотрицательность. В сложных соединениях – если атом, входящий в состав этого соединения (и меняющий степень окисления) находится в своей наивысшей степени окисления, то данное соединение будет обладать только окислительными свойствами.
Из предложенного списка соединений, нет веществ, которые обладали бы только окислительными свойствами, т.к. все они находятся в промежуточной степени окисления.
Наиболее сильный окислитель из них – Cl2, но в реакциях с более электроотрицательными атомами будет проявлять восстановительные свойства.
N-3H3, C+2O, S+4O2, K2Mn+6O4, Сl02, HN+3O2
HNO3 + H2S = H2SO4 + NO + H2O.
Составим электронные уравнения:
N+5 +3e— = N+2 | 8 окислитель
S-2 — 8e— = S+6 | 3 восстановитель
Сложим два уравнения
8N+5 +3S-2— = 8N+2 + 3S+6
Подставим коэффициенты в молекулярное уравнение:
8HNO3 +3H2S = 3H2SO4 + 8NO + 4H2O.
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
Показать решение »
Решение.
HN+3O2 — Степень окисления азота в азотистой кислоте равна +3 (промежуточная степень окисления). Азот в этой степени окисления может как принимать, так и отдавать электроны, т.е. может являться как окислителем, так восстановителем.
а) HNO2 + Br2 + H2O = 2HBr + HNO3
N+3 – 2 e = N+5 | 1 восстановитель
Br20 + 2 e = 2Br— | 1 окислитель
N+3 + Br2 = N+5 + 2Br—
б) HNO2 + 2HI = I2 + 2NO + 2H2O
N+3 + e = N+2 | 1 окислитель
2I— — 2 e = I2 | 1 восстановитель
N+3 + 2I— = N+2 + I2
в) 5HNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5HNO3 + K2SO4 + 3H2O
N+3 – 2 e = N+5 | 5 восстановитель
Mn+7 + 5 e = Mn+2 | 2 окислитель
5N+3 + 2Mn+7 = 5N+5 + 2Mn+2
Задача 3. Определите степени окисления всех компонентов, входящих в состав следующих соединений: HСl, Cl2, HClO2 , HClO3 , Cl2O7 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции:
КСlO3 → КС1 + КСlO4.
Укажите окислитель и восстановитель.
Показать решение »
Решение.
Хлор может проявлять степени окисления от -1 до +7.
Соединения, содержащие хлор в его высшей степени окисления, могут быть только окислителями, т.е. могут только принимать электроны.
Соединения, содержащие хлор в его низшей степени окисления, могут быть только восстановителями, т.е. могут только отдавать электроны.
Соединения, содержащие хлор в его промежуточной степени окисления, могут быть как восстановителями, так и окислителями, т.е. могут отдавать, так и принимать электроны.
H+1Сl-1, Cl02, H+1Cl+3O2-2 , H+1Cl+5O3-2 , Cl2+7O7-2
Таким образом, в данном ряду
Только окислитель — Cl2O7
Только восстановитель – HСl
Могут быть как окислителем, так и восстановителем — Cl2, HClO2 , HClO3
КСlO3 → КС1 + КСlO4.
Составим электронные уравнения
Cl+5 +6e— = Cl— | 2 | 1 окислитель
Cl+5 -2e— = Cl+7 | 6 | 3 восстановитель
Расставим коэффициенты
4Cl+5 = Cl— + 3Cl+7
4КСlO3 → КС1 + 3КСlO4.
Задача 4. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель.
а) KNO3 = KNO2 + O2;
б) Mq+ N2 = Mq3N2;
в) KClO3 = KCl + O2.
Показать решение »
Решение.
В реакциях внутримолекулярного окисления-восстановления перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы)
а) 2KNO3 = 2KNO2 + O2 — внутримолекулярная ОВР
N+5 +2e— = N+3 | 2 окислитель
2O-2 -4e— = O20 | 1 восстановитель
2N+5 + 2O-2 = 2N+3 + O20
б) 3Mq + N2 = Mq3N2 — межмолекулярная ОВР
N2 +6e— = 2N-3 | 2 | 1 окислитель
Mg0 -2e— = Mg+2 | 6 | 3 восстановитель
N2 + 3Mg0 = 2N-3 + 3Mg+2
в) 2KClO3 = 2KCl + 3O2 — внутримолекулярная ОВР
Cl+5 +6e— = Cl— | 4 | 2 окислитель
2O-2 -4e— = O20 | 6 | 3 восстановитель
2Cl+5+ 6O-2 = 2Cl— + 3O20
Задача 5. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях:
а) Cl2 + KOH = KCl + KClO3 + H2O;
б) KClO3 = KCl + KClO4 .
Показать решение »
Решение.
В реакциях диспропорционирования окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления.
а) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O;
Cl20 +2e— = 2Cl— | 10| 5 окислитель
Cl20 -10e— = 2Cl+5 | 2 | 1 восстановитель
5Cl20 + Cl20 = 10Cl— + 2Cl+5
3Cl20 = 5Cl— + Cl+5
б) 4KClO3 = KCl + 3KClO4
Cl+5 +6e— = Cl— | 2 | 1 окислитель
Cl+5 -2e— = Cl+7 | 6 | 3 восстановитель
4Cl+5 = Cl— + 3Cl+7
Задача 6. Составьте электронные уравнения и подберите коэффициенты ионно-электронным методом в реакции
KMnO4 + KNO2 + H2SO4 = K2SO4 + MnSO4 + KNO3 + H2O
Показать решение »
Решение.
Составим полуреакции:
MnO4— + 8H+ +5e— = Mn2+ + 4H2O | 2 окислитель
NO2— + H2O — 2e— = NO3— + 2H+ | 5 восстановитель
Сложим две полуреакции, умножив каждую на соответствующий коэффициент:
2MnO4— + 16H+ + 5NO2—+ 5H2O = 2Mn2+ + 8H2O + 5NO3— + 10H+
После сокращения идентичных членов, получаем ионное уравнение:
2MnO4— + 6H+ + 5NO2— = 2Mn2+ + 3H2O + 5NO3—
Подставим коэффициенты в молекулярное уравнение и уравняем его правую и левую части:
2KMnO4 + 5KNO2 + 3H2SO4 = K2SO4 + 2MnSO4 + 5KNO3 + 3H2O
Задача 7. Определите методом электронного баланса коэффициенты в уравнениях окислительно-восстановительных реакций:
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O
Zn + H2SO4(конц) = ZnSO4 + SO2 + H2O
Показать решение »
Решение.
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
Составим электронные уравнения
Zn0 – 2 e = Zn2+ | 8 | 4 | восстановитель
N+5 + 8 e = N3- | 2 | 1 | окислитель
4Zn0 + N+5 = 4Zn2+ + N3-
Zn + 2H2SO4(конц) = ZnSO4 + SO2 + 2H2O
Составим электронные уравнения
Zn0 – 2 e = Zn2+ | 2 | 1 восстановитель
S+6 + 2 e = S+4 | 2 | 1 окислитель
Zn0 + S+6 = Zn2+ + S+4
Задача 8. Можно ли в качестве окислителя в кислой среде использовать K2Cr2O7 в следующих процессах при стандартных условиях:
а) 2F— -2e— = F2, E0 = 2,85 В
б) 2Сl— -2e— = Cl2, E0 = 1,36 В
в) 2Br— -2e— = Br2, E0 = 1,06 В
г) 2I— -2e— = I2, E0 = 0,54 В
Стандартный окислительно-восстановительный потенциал системы
Cr2O72- + 14H+ + 6e— = 2Cr3+ + 7H2O равен E0 =1,33 В
Показать решение »
Решение.
Для определения возможности протекания ОВР в прямом направлении необходимо найти ЭДС гальванического элемента:
ЭДС = Е0ок — Е0восст
Если найденная величина ЭДС > 0, то данная реакция возможна.
Итак, определим, можно ли K2Cr2O7 использовать в качестве окислителя в следующих гальванических элементах:
F2|F— || Cr2O72-|Cr3+ E = 1,33 – 2,85 = -1,52 В
Cl2|Cl— || Cr2O72-|Cr3+ E = 1,33 – 1,36 = -0,03 В
Br2|Br— || Cr2O72-|Cr3+ E = 1,33 – 1,06 = +0,27 В
I2|I— || Cr2O72-|Cr3+ E = 1,33 – 0,54 = +0,79 В
Таким образом, в качестве окислителя дихромат калия можно использовать только для процессов:
2Br— -2e— = Br2 и 2I— -2e— = I
Задача 9. Вычислите окислительно-восстановительный потенциал для системы
MnO4— + 8H+ +5e— = Mn2+ + 4H2O
Если С(MnO4—)=10-5 М, С(Mn2+)=10-2 М, С(H+)=0,2 М.
Показать решение »
Решение.
Окислительно-восстановительный потенциал рассчитывают по уравнению Нернста:
E = E° + (0,059/n)lg(Cок/Cвос)
В приведенной системе в окисленной форме находятся MnO4— и H+, а в восстановленной форме — Mn2+, поэтому:
E = 1,51 + (0,059/5)lg(10-5*0,2/10-2) = 1,46 В
Задача 10. Рассчитайте для стандартных условий константу равновесия окислительно-восстановительной реакции:
2KMnO4 + 5HBr + 3H2SO4 = 2MnSO4 + 5HBrO + K2SO4 + 3H2O
Показать решение »
Решение.
Константа равновесия K окислительно-восстановительной реакции связана с окислительно-восстановительными потенциалами соотношением:
lgK = (E10 -E20 )n/0,059
Определим, какие ионы в данной реакции являются окислителем и восстановителем:
MnO4— + 8H+ +5e— = Mn2+ + 4H2O | 2 окислитель
Br— + H2O — 2e— = HBrO + H+ | 5 восстановитель
Общее число электронов, принимающих участие в ОВР n = 10
E10 (окислителя) = 1,51 В
E20 (восстановителя) = 1,33 В
Подставим данные в соотношение для К:
lgK = (1,51 — 1,33 )10/0,059
lgK = 30,51
K = 3,22*1030
zadachi-po-khimii.ru
Примеры окислительно-восстановительных реакций с решением. ОВР: схемы
Прежде чем приводить примеры окислительно-восстановительных реакций с решением, выделим основные определения, связанные с данными превращениями.
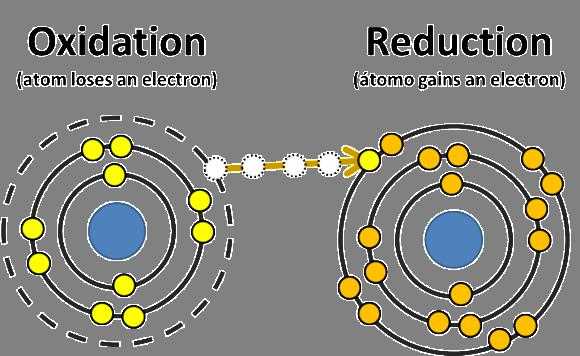
Те атомы или ионы, которые в ходе взаимодействия меняют степень окисления с понижением (принимают электроны), называют окислителями. Среди веществ, обладающих такими свойствами, можно отметить сильные неорганические кислоты: серную, соляную, азотную.
Окислитель
Также к сильным окислителям относятся перманганаты и хроматы щелочных металлов.
Окислитель принимает то количество электронов в ходе реакции, которое необходимо ему до завершения энергетического уровня (установления завершенной конфигурации).

Восстановитель
Любая схема окислительно-восстановительной реакции предполагает выявление восстановителя. К нему относят ионы или нейтральные атомы, способные повышать в ходе взаимодействия показатель степени окисления (отдают электроны иным атомам).
В качестве типичных восстановителей можно привести атомы металлов.
Процессы в ОВР
Чем еще характеризуются ОВР? Окислительно-восстановительные реакции характеризуются изменением степеней окисления у исходных веществ.
Окисление предполагает процесс отдачи отрицательных частиц. Восстановление предполагает принятие их от других атомов (ионов).
Алгоритм разбора
Примеры окислительно-восстановительных реакций с решением предлагаются в различных справочных материалах, предназначенных для подготовки старшеклассников к выпускным испытаниям по химии.
Для того чтобы успешно справиться с предлагаемые в ОГЭ и ЕГЭ заданиями, важно владеть алгоритмом составления и разбора окислительно-восстановительных процессов.
- В первую очередь проставляют зарядовые величины у всех элементов в веществах, предложенных в схеме.
- Выписываются атомы (ионы) из левой части реакции, которые в ходе взаимодействия, поменяли показатели.
- При повышении степени окисления используется знак «-», а при понижении «+».
- Между отданными и принятыми электронами определяется наименьшее общее кратное (число, на которое они делятся без остатка).
- При делении НОК на электроны, получаем стереохимические коэффициенты.
- Расставляем их перед формулами в уравнение.
Первый пример из ОГЭ
В девятом классе далеко не все школьники знают, как решать окислительно-восстановительные реакции. Именно поэтому они допускают множество ошибок, не получают высоких баллов за ОГЭ. Алгоритм действий приведен выше, теперь попробуем отработать его на конкретных примерах.
Особенность заданий, касающихся расстановки коэффициентов в предложенной реакции, выданных выпускникам основной ступени обучения, в том, что и левая, и правая части уравнения даны.
Это существенно упрощает задачу, так как не нужно самостоятельно придумывать продукты взаимодействия, подбирать недостающие исходные вещества.
Например, предлагается с помощью электронного баланса выявить коэффициенты в реакции:
CuO+Fe=FeO+Cu
На первый взгляд, в данной реакции не требуются стереохимические коэффициенты. Но, для того, чтобы подтвердить свою точку зрения, необходимо у всех элементов зарядовые числа.
В бинарных соединениях, к которым относится оксид меди (2) и оксид железа (2), сумма степеней окисления равна нулю, учитывая, что у кислорода она -2, у меди и железа данный показатель +2. Простые вещества не отдают (не принимают) электроны, поэтому для них характерна нулевая величина степени окисления.
Составим электронный баланс, показав знаком «+» и «-» количество принятых и отданных в ходе взаимодействия электронов.
Cu2++2e=Cu0;
Fe0-2e=Fe2+.
Так как количество принятых и отданных в ходе взаимодействия электронов одинаково, нет смысла находить наименьшее общее кратное, определять стереохимические коэффициенты, ставить их в предложенную схему взаимодействия.
Для того чтобы получить за задание максимальный балл, необходимо не только записать примеры окислительно-восстановительных реакций с решением, но и выписать отдельно формулу окислителя (CuO) и восстановителя (Fe).

Второй пример с ОГЭ
Приведем еще примеры окислительно-восстановительных реакций с решением, которые могут встретиться девятиклассникам, выбравшим химию в качестве выпускного экзамена.
Допустим, предлагается расставить коэффициенты в уравнении:
Na+HCl=NaCl+H2.
Для того чтобы справиться с поставленной задачей, сначала важно определить у каждого простого и сложного вещества показатели степеней окисления. У натрия и водорода они будут равны нулю, так как они являются простыми веществами.
В соляной кислоте водород имеют положительную, а хлор — отрицательную степень окисления. После расстановки коэффициентов получим реакцию с коэффициентами.
Как дополнить окислительно-восстановительные реакции? Примеры с решением, встречающиеся на ЕГЭ (11 класс), предполагают дополнение пропусков, а также расстановку коэффициентов.
Например, нужно электронным балансом дополнить реакцию:
H2S+ HMnO4= S+ MnO2 +…
Определите восстановитель и окислитель в предложенной схеме.
Как научиться составлять окислительно-восстановительные реакции? Образец предполагает использование определенного алгоритма.
Сначала во всех веществах, данных по условию задачи, необходимо поставить степени окисления.
Далее нужно проанализировать, какое вещество может стать неизвестным продуктом в данном процессе. Поскольку в здесь присутствует окислитель (в его роли выступает марганец), восстановитель (им является сера), в искомом продукте не меняются степени окисления, следовательно, это вода.
Рассуждая о том, как правильно решать окислительно-восстановительные реакции, отметим, что следующим этапом будет составление электронного соотношения:
Mn+7 принимает 3 e= Mn+4;
S-2 отдает 2e= S0.
Катион марганца является восстановителем, а анион серы – типичный окислитель. Поскольку наименьшим кратным между принятыми и отданными электронами будет 6, получаем коэффициенты: 2, 3.
Последним этапом будет постановка коэффициентов в исходное уравнение.
3H2S+ 2HMnO4= 3S+ 2MnO2+ 4H2O.

Второй образец ОВР в ЕГЭ
Как правильно составить окислительно-восстановительные реакции? Примеры с решением помогут отработать алгоритм действий.
Предлагается методом электронного баланса заполнить пропуски в реакции:
PH3+ HMnO4 = MnO2 +…+…
Расставляем у всех элементов степени окисления. В данном процессе окислительные свойства проявляются марганцем, входящим в состав марганцовой кислоты, а восстановителем должен быть фосфор, меняя свою степень окисления на положительную в фосфорной кислоте.
Согласно сделанному предположению, получаем схему реакции, затем составляем уравнение электронного баланса.
P-3 отдает 8 e и превращается в P+5;
Mn+7 принимает 3e, переходя в Mn+4.
НОК будет 24, поэтому у фосфора должен присутствовать стереометрический коэффициент 3, а у марганца -8.
Ставим коэффициенты в полученный процесс, получаем:
3 PH3+ 8 HMnO4= 8 MnO2+ 4H2O+ 3 H3PO4.

Третий пример из ЕГЭ
Путем электронно-ионного баланса нужно составить реакцию, указать восстановитель и окислитель.
KMnO4+ MnSO4+…= MnO2 +…+ h3SO4.
По алгоритму расставляем у каждого элемента степени окисления. Далее определяем те вещества, что пропущены в правой и левой частях процесса. Здесь дан восстановитель и окислитель, поэтому в пропущенных соединениях степени окисления не меняются. Упущенным продуктом станет вода, а исходным соединением – сульфат калия. Получаем схему реакции, для которой составим электронный баланс.
Mn+2-2 e= Mn+4 3 восстановитель;
Mn+7+3e= Mn+4 2 окислитель.
Записываем коэффициенты в уравнение, суммируя атомы марганца в правой части процесса, так как он относится к процессу диспропорционирования.
2KMnO4+ 3MnSO4+ 2H2O= 5MnO2+ K 2SO4+ 2H2SO4.
Заключение
Окислительно-восстановительные реакции имеют особое значение для функционирования живых организмов. Примерами ОВР являются процессы гниения, брожения, нервной деятельности, дыхания, обмена веществ.
Окисление и восстановление актуальны для металлургической и химической промышленности, благодаря таким процессам можно восстанавливать металлы из их соединений, защищать от химической коррозии, подвергать обработке.
Для составления окислительно-восстановительного процесса в органической или неорганической химии необходимо использовать определенный алгоритм действий. Сначала в предложенной схеме расставляют степени окисления, потом определяют те элементы, которые повысили (понизили) показатель, записывают электронный баланс.
Далее между принятыми и отданными электронами необходимо определить наименьшее кратное, вычислить математическим путем коэффициенты.
При соблюдении последовательности действий, предложенной выше, можно без проблем справиться с заданиями, предлагаемыми в тестах.
Помимо метода электронного баланса, расстановка коэффициентов возможна также путем составления полуреакций.
fb.ru
примеры и решение :: SYL.ru
Что такое ОВР? Химия состоит из множества разделов, один из них рассматривает взаимодействия веществ, в результате которых у элементов (веществ) меняются показатели их степеней окисления. Рассмотрим основные термины, связанные с данной проблемой, приведем примеры взаимодействий.
Основные определения
В школьной программе рассматривается метод ОВР. Химия базируется на составлении баланса между количеством отданных (принятых) электронов. Окислителем является ион или атом, принимающий в процессе взаимодействия отрицательные частицы. Процесс, который при этом происходит, называется восстановлением. Восстановителем считают атомы или ионы, которые лишаются своих электронов, окисляясь при этом.

Значимость ОВР
Какое значение имеют ОВР? Химия располагает множеством примеров, когда данные превращения приводили к негативным последствиям. Например, до сих пор ученые не установили истинную причину разрушения статуи Колосса Родосского. Химики убеждены в том, что именно коррозия, которая является ОВР, стала причиной разрушения уникального памятника. В организме живых существ данные превращения обеспечивают обменные процессы.
Алгоритм разбора
Как правильно разбирать реакции ОВР? Химия школьного курса основывается на составлении электронного баланса между окислителем и восстановителем. Остановимся подробнее на последовательности действий школьников. Сначала необходимо поставить степени окисления у всех элементов, имеющихся в реакции. Для того чтобы успешно справиться с поставленной задачей, важно знать правила. Далее необходимо выявить те вещества, в которых после взаимодействия значения степеней окисления изменились.
При составлении электронного баланса, с помощью знака «плюс» показывают число принятых частиц, а «минусом» показывают количество отданных электронов. Между ними определяется наименьшее общее кратное, затем вычисляются индексы. Завершающим этапом будет расстановка коэффициентов в ОВР. Химия неорганических и органических веществ тесно связана с данным типом взаимодействий, к тому же задания предлагаются школьникам на выпускных испытаниях в 9 и 11 классах.
Первый пример
Разве ОВР — химия? Как решать такие задания? Данный вопрос является актуальным для ребят, которые выбрали предмет в качестве выпускного экзамена. На примере взаимодействия оксида железа (3) и угарного газа (оксида углерода (2)) рассмотрим последовательность действий.

Итак, дана схема Fe2O3 + CO → Fe + CO2, ее нужно рассмотреть как ОВР. ЕГЭ (химия) в 11 классе предполагает самостоятельное дополнение школьниками схемы недостающими веществами, но мы начнем с более простого задания, в котором уже даны все участники процесса. Как проверить, что это ОВР? Химия отвечает на этот вопрос посредством степеней окисления. Так как железо превращается из +3 в простое вещество с нулевым показателем степени окисления, а углерод повышает ее с +2 до +4, процесс является ОВР.
Баланс данного задания имеет следующий вид:
Fe(+3)+3e=Fe(0) 2
C(+2)-2e=C(+4) 3
Наименьшее общее кратное составляет 6. Железо является окислителем, угарный газ проявляет восстановительную способность. В готовом виде процесс имеет вид:
Fe2O3 + 3CO → 2Fe + 3CO2
Второй пример
ОВР в органической химии рассматривается по такому же алгоритму, есть только некоторые отличия в расстановке степеней окисления. Одно из заданий ЕГЭ посвящено вопросам, связанным с расстановкой коэффициентов в ОВР. Для успешного выполнения данного задания сначала школьники должны подумать, какие недостающие вещества им нужно вписать, и только после этого переходить к алгоритму разбора ОВР.

Например, с помощью электронного баланса необходимо составить уравнение:
Ph4 + AgNO3 +… = Ag + HNO3
Для начала выявим, какое вещество пропущено в левой части данного взаимодействия. С учетом того, что серебро проявляет окислительные свойства, а фосфор будет восстановителем, недостающим веществом станет вода.
При составлении электронного баланса, получаем следующий вид:
P(-3) отдает 8 электронов = P(+5) 1
Ag(+) принимает электрон = Ag(0) 8
При расстановке коэффициентов, получаем запись процесса:
Ph4 + 8 AgNO3 + 4h3O = 8Ag + 8HNO3 + h4PO4
Ph4 — восстановитель, AgNO3 — окислитель
Третий пример
Воспользовавшись методом электронного баланса, решите уравнение:
Cr2 (SO4) 3 +…+ NaOH = Na2CrO4 + NaBr +…+ h3O
В данной схеме пропущено два вещества, поэтому сначала восстановим пробелы. Хром в данном процессе меняет степень окисления с +3 на +6, следовательно, им проявляются окислительные характеристики. Восстановитель в задании упущен, поэтому его функцию будет выполнять молекулярный бром. Среди продуктов реакции должна быть соль натрия, ею будет сульфат.
Электронный баланс для данного превращения имеет вид:
2Cr(+3) — 6e = 2Cr(+6) 1
Br2(0) + 2e = 2Br — 3
При расстановке в схеме коэффициентов учитываем, что атом натрия находится в составе нескольких веществ, поэтому его необходимо суммировать:
Cr2(SO4) 3+3 Br2 + 16NaOH = 2Na2CrO4 + 6 NaBr + 3Na2 SO4 + 8h3O
- Cr2(SO4) 3 является окислителем;
- Br2 выступает в роли восстановителя.
Четвертый пример
Воспользовавшись электронным балансом, решите уравнение:
KMnO4 + h3S + h3SO4 = S+ Mn SO4 +…+…
В задании есть два пропуска, причем оба вещества являются продуктами взаимодействия. Учитывая, что в данной схеме в качестве окислителя выступает марганец, а восстановительные свойства характерны для серы, степени окисления в пропущенных веществах остаются неизменными. Ими будет сульфат калия и вода.

Электронный баланс данного процесса:
Mn(+7) забирает 5 e = Mn(+2) 2
S(-2) отдает 2e = S(0) 5
Конечный вариант предлагаемой схемы ОВР имеет следующий вид:
2KMnO4 + 5h3S + 3h3SO4 = 5S + 2MnSO4 + 8h3O + K 2SO4
Перманганат калия проявляет окислительные свойства, сероводород является восстановителем.
Пятый пример
Заполните пропуски, расставьте коэффициенты в предложенной схеме превращений:
KMnO4 + h3SO4 + KBr = MnSO4 + Br2 +…+…
В данном взаимодействии окислительные параметры демонстрирует марганец, входящий в состав марганцовки. Бром, входящий в бромид калия, является восстановителем. Следовательно, среди продуктов реакции должны быть такие вещества, в которых не наблюдается изменений степеней окисления. Недостающими веществами будут выступать вода и сульфат калия. Процесс передачи электронов:
Mn(+7) принимает 5e = Mn(+2) 2
2Br(-) отдает 2e = Br2(0) 5
Расставим полученные коэффициенты в предложенную схему, получим следующее уравнение:
2KMnO4 + 8h3SO4 + 10KBr = 2MnSO4 + 5Br2 + 8h3O + 6K2SO4
- Перманганат калия — окислитель.
- Бромид калия — восстановитель.
Шестой пример
Воспользовавшись электронным балансом, поставьте коэффициенты в предложенной схеме превращений:
P + HNO3 = NO2 +…+…
Пропуски веществ даны в правой части. Чтобы выявить продукты, определяем окислитель и восстановитель. В левой части берется сильная кислота, поэтому в продуктах будет вода. Вторым пропущенным соединением будет являться фосфорная кислота.

Электронный баланс имеет вид:
P(0) отдает 5e = P(+5) 1
N(+5) принимает e = N(+4) 5
Приступаем к расстановке коэффициентов в уравнении:
P + 5HNO3 = 5NO2 + h3O + h4PO4
- Фосфор — восстановитель.
- Азотная кислота — окислитель.
Заключение
Разбор окислительных и восстановительных процессов методом электронного баланса является одним из тех заданий, которые вызывают серьезные проблемы у выпускников девятого и одиннадцатого классов. Именно поэтому важно отработать алгоритм действий, чтобы ребята успешно выполняли задания данного типа. Среди типичных ошибок, которые допускаются ребятами, выделим неправильную расстановку степеней окисления у элементов в сложных веществах.
Также довольно много проблем возникает при определении количества принятых и отданных атомами (ионами) электронов. Ребята неправильно определяют окислитель и восстановитель, допускают ошибки при расстановке коэффициентов в схеме уравнения. Задания, связанные с ОВР, считаются сложными, поэтому предполагают отработку порядка действий во внеурочной деятельности.
www.syl.ru
Вопрос 24) Классификация окислительно – восстановительных реакций. Преведите по 2 примера реакций каждого типа (не используйте уравнения из задания №5).
Классификация ОВР:
1) межмолекулярные ОВР – в этих реакциях окислителем и восстановителем являются разные молекулы.
2)
внутримолекулярные ОВР – в этих реакциях
окислителем и восстановителем являются
атомы различных или одиноковых элементов,
находящихся в разных частях одной
молекулы, например: (N-3H4)2Cr+62O7 N02 + Cr+32O3 +
4H20.
N02 + Cr+32O3 +
4H20.
3)
реакции диспропорционирования, в которых
окислителем и восстановителем являются
одни и те же атомы в молекуле: 3Cl02 + 6KOH  5KCl-1 + KCl
5KCl-1 + KCl
Вопрос 25) Типичные восстановители в овр. Каковы продукты их окисления? Приведите примеры. Классификация овр.
Восстановитель – вещество, молекулы или ионы которого отдают электроны. Типичные восстановители:
1) в-ва, молекулы которых содержат атомы элементов в высоких отрицательных степенях окисления или степени окисления которых легко повышаются, например: Na2S-2; KI-1; N-3H3; KN+3O2; K2S+4O3;
2) катионы металлов более низкой степени окисления, например: Fe+2; Sn+2;
3) металлы, из них в первую очередь – щелочные и щелочно-земельные металлы, а так же – водород при повышенных температурах.
Продукты их окисления: Если элемент является окислителем – его степень окисления понижается; если элемент является восстановителем – его степень окисления повышается.
Среди простых веществ к типичным восстановителям принадлежат активные металлы (щелочные и щелочноземельные, алюминий, цинк, железо и др.), а также некоторые неметаллы, такие как Н2, С (в виде угля или кокса), Р, Si. При этом в кислой среде металлы окисляются до положительно заряженных ионов. В щелочной среде металлы, которые образуют амфотерные гидроксиды (например, цинк, алюминий, олово), входят в состав анионов гидроксокомплексов. С чаще всего окисляется до монооксида или диоксида; Р, при действии сильных окислителей, окисляется до ортофосфорной кислоты.В бескислородных кислотах (HCl, HBr, HI, H2S) и их солях носителями восстановительной функции являются анионы, которые, окисляясь, обычно образуют простые вещества. В ряду галогенид-ионов восстановительные свойства усиливаются от Cl– к I–.
Окислительно-восстановительная двойственность – способность одного и того же вещества, в зависимости от реагентов и от условий проведения реакции, выступать как в роли окислителя, так и в роли восстановителя. В таких веществах содержится элемент в промежуточной степени окисления .
Окислительно-восстановительная двойственность характерна для простых веществ – неметаллов. Например, азотная кислота за счет азота в высшей степени окисления +5 может выступать только в роли окислителя. В аммиаке азот в низшей степени окисления –3, и, поэтому, за счет азота аммиак может выступать только в роли восстановителя. А в азотистой кислоте HNO2 азот находится в промежуточной степени окисления +3. Азотистая кислота окисляется кислородом, и в этом случае азот – восстановитель.
Вопрос 26) Типичные окислители в овр. Каковы продукты их восстановления? Классификация овр. Приведите примеры.
Окислитель – вещество, молекулы или ионы которого принимают электроны. Типичные окислители:
1) в-ва, молекулы которых содержат атомы элементов в высших положительных степенях окисления, например: KMn+7O4, KBi+5
O3, K2Cr2+6O7, Pb+4O2;2) катионы металлов более высокого заряда (более высокой степени окисления), например: Fe+3; Au+3; Sn+4;
3) галогены и кислород (при повышенных температурах).
Классификация ОВР:
1) межмолекулярные ОВР – в этих реакциях окислителем и восстановителем являются разные молекулы.
2)
внутримолекулярные ОВР – в этих реакциях
окислителем восстановителем являются
атомы различных или одиноковых элементов,
находящихся в разных частях одной
молекулы, например: (N-3H4)2Cr+62O7 N02 + Cr+32O3 +
4H20.
N02 + Cr+32O3 +
4H20.
3)
реакции диспропорционирования, в которых
окислителем и восстановителем являются
одни и те же атомы в молекуле: 3Cl 5KCl-1 + KCl+5O3 + 3H2O.
5KCl-1 + KCl+5O3 + 3H2O.
Продукты их восстановления: Если элемент является окислителем – его степень окисления понижается; если элемент является восстановителем – его степень окисления повышается. Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Br2, I2, O2, O3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причем от фтора к иоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (H2O или OH–).
Сложные вещества, используемые в качестве окислителей, очень часто, содержат элементы в высшей степени окисления. Например: KMn +7O4; K2Cr+62O7; HN+5O3; KCl+7O4. Концентрированная серная кислота проявляет окислительные свойства за счет серы в высшей степени окисления +6. Продуктами восстановления серы могут быть: SO2 (степень окисления серы +4), сера – простое вещество (степень окисления серы 0), сероводород (степень окисления серы –2).
Азотная кислота проявляет ок ислительные свойства за счет азота в высшей степени окисления +5, причем окислительная способность HNO3 усиливается с ростом ее концентрации. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы; чем активнее восстановитель и ниже концентрация кислоты, тем глубже происходит восстановление азота.
Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, расположенными в ряду напряжений до водорода).
studfiles.net
12. Окислительно – восстановительные реакции
Окислительно-восстановительные реакции (ОВР) имеют большое значение в теории и практике. С ними связаны процессы: дыхание, обмен веществ, фотосинтез, гниение, горение, электролиз, коррозия металлов и др.
ОВР называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления (зарядность, окислительное число) – это условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях.
Окислитель принимает электроны. Процесс приема электронов называется восстановлением, например:
Mn6+ + 2e— Mn4+,
Мn6+ — окислитель, в процессе реакции восстанавливается до Mn4+.
Восстановитель отдает электроны. Процесс отдачи электронов называется окислением, например:
Zn0 – 2e— Zn2+,
Zn0 – восстановитель, в процессе реакции окисляется до Zn2+.
Степень окисления может иметь нулевое, отрицательное, положительное значения.
При определении степени окисления следует знать несколько основных положений:
(-2) — степень окисления атома кислорода в соединениях:
H2+O-2, Cu+2O-2
(-1) — степень окисления фтора в соединениях: H+F— , Са+2F2—.
( 0) — нулевую степень окисления имеют атомы в молекулах простых веществ и свободные металлы: H20 , O20 , Cl20 , Zn0 , Cu0 и др.
(+1) — степень окисления щелочных металлов (I А погруппа): Na+Cl—, K+Br— и др.
(+2) — степень окисления щелочноземельных металлов (II А подгруппа): Сa+2Cl2— , Ba+2
O-2 и др.Используя эти данные, можно вычислять степени окисления других атомов в соединениях, зная, что алгебраическая сумма степеней окисления всех атомов, входящих в молекулу, равна нулю.
Примеры решения задач
Пример. Вычислите степень окисления азота в молекуле азотной кислоты. Определите, окислителем или восстановителем является HNO3.
Решение. Обозначим степень окисления азота через х. Расставим степени окисления водорода (+1) и кислорода (-2): H+NxO3-2.
Составим уравнение, умножая степени окисления на число атомов в молекуле азотной кислоты:
(+1) 1 + х + (-2) 3 = 0.
Находим х = + 5. Ответ: степень окисления азота равна +5.
НNO3 проявляет только окислительные свойства,
так как азот в данном соединении имеет
максимально положительную степень
окисления +5 (равна номеру группы, в
которой находится азот). Увеличить ее
N
Вывод: если элемент в соединении имеет высшую степень окисления, он является только окислителем, в низшей степени – только восстановителем, в промежуточной – и окислителем, и восстановителем.
Основные типы окислительно-восстановительных реакций (овр)
К межмолекулярным относятся реакции, в которых окислитель и восстановитель находятся в разных веществах. Например, в реакции алюминия с азотной кислотой:
8 Al0 + 30 HN+5O3разб. = 8 Al+3(NO3)3 + 3 N+12O + 15 H2O
Al – восстановитель, HNO3 – окислитель.
К внутримолекулярным относятся реакции, в которых окислитель и восстановитель находятся в одном и том же веществе:
2 KCl+5O3-2 = 2 KCl-1 + 3 O20
В этой реакции атом хлора (окислитель) и атом кислорода (восстановитель) входят в состав одного и того же вещества KClO3.
Среди внутримолекулярных реакций выделяют реакции диспропорционирования (самоокисления-самовосстановления). Атом одного и того же элемента является и окислителем и восстановителем:
Cl20 + H2O= HCl+1O + HCl-1
В этой реакции часть атомов хлора восстанавливается, изменяя степень окисления от 0 до -1, а другая часть окисляется от 0 до +1.
Все химические реакции протекают в соответствии с законом сохранения массы и энергии. В ходе окислительно-восстановительных реакций число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем (закон сохранения зарядности). Полные уравнения окислительно-восстановительных реакций можно составить с помощью методов: а) электронного и б) электронно-ионного балансов.
а). Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. Сущность этого метода можно уяснить на следующем примере.
Пример. Составить электронные уравнения для реакции, протекающей по схеме:
KMnO4 + H3PO3 + H2SO4 MnSO4 + H3PO4 + K2SO4 + H2O
1). Расставляем степени окисления атомов.
K+1Mn+7O4-2 + H3+1P +3O3-2 + H2 +1S+6O4-2 = Mn+2S+6O4-2 + H3 +1P+5O4-2 + K2 +1S+6O4-2 + H2 +1O-2
2). Выписываем элементы, атомы или ионы которых изменяют степени окисления, такими элементами являются Mn и P.
3). Составляем электронные уравнения, то есть схемы изменения зарядов атомов в левой и правой частях реакции:
P3+ — 2e— Р5+ 5, процесс окисления
Mn7+ +5e— Mn2+ 2, процесс восстановления
4). Общее число электронов, которые присоединяет окислитель, должно быть равно числу электронов, которые отдает восстановитель. Общее наименьшее кратное для отданных и принятых электронов — десять. Делим число 10 на число принятых электронов марганцем и на число отданных электронов фосфором, получим коэффициенты: для марганца — 2, а для фосфора – 5.
5). Найденные коэффициенты 2 и 5ставим перед формулами соединений восстановителя и окислителя.
Уравниваем количество ионов калия в правой и левой частях уравнения, подсчитываем число ионов SO42- в правой части, ставим коэффициент 3 перед формулой H2SO4. Уравниваем число атомов водорода в правой части уравнения, ставим коэффициент 3 перед формулой H2O.
Молекулярное уравнение реакции будет иметь вид:
2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
6). Проводим проверку по количеству атомов кислорода. Вступило в реакцию 35 атомов кислорода. В продуктах реакции атомов кислорода 35. Следовательно, реакция записана, коэффициенты расставлены правильно.
б). Метод электронно-ионного баланса применим к окислительно-восстановительным реакциям, протекающим в водных растворах. Он основан на составлении электронно-ионных балансов двух полуреакций: одной — для процесса окисления и другой – для процесса восстановления. Затем проводится суммирование этих полуреакций. В результате получается общее ионно-молекулярное уравнение окислительно-восстановительной реакции.
Пример. Используя метод электронно-ионного баланса, расставим коэффициенты в уравнении реакции:
Cu + HNO3 (конц.) Cu(NO3)2 + NO2 + H2O.
Решение. Уравнение первой полуреакции – окисление восстановителя:
Cu – 2e— Cu2+.
Уравнение второй полуреакции – восстановление окислителя – составили так: ион NO3— превращается в NO2 , то есть один атом кислорода в кислой среде связывается с ионами водорода с образованием воды:
NO3— + 2H+ NO2 + H2O.
Уравняв число зарядов, получим:
NO3— + 2H+ + e— NO2 + H2O.
Составляем суммарное ионно-молекулярное уравнение:
Cu – 2e— Cu2+ 1
NO3— + 2H+ + e— NO2 + H2O2
Сu + 2NO3— + 4H+ Cu2+ + 2NO2 +2H2O.
Правильность составленного уравнения проверяется по балансу числа атомов и зарядов в левой и правой частях уравнения.
Уравнение реакции в молекулярной форме имеет вид:
Сu + 4HNO3 (конц.) Cu(NO3)2 + 2NO2 +2H2O.
studfiles.net
1.4. Классификация окислительно-восстановительных реакций (типы овр)
Все ОВР подразделяются: на реакции межатомного или межмолекулярного окисления–восстановления; реакции внутримолекулярного окисления–восстановления; реакции самоокисления, самовосстановления (диспропорционирования).
1.4.1. Реакции межатомного или межмолекулярного окисления-восстановления
В реакциях этого типа обмен электронами происходит между различными атомами, молекулами или ионами.
Mg + O2 = 2MgO
H2SO3 + 2H2S = 3S + 3H2O
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4+K2SO4 + 5Fe2(SO4)3+8H2O
Такие реакции могут протекать в трех разных условиях-средах.
а) в кислой среде, в левой части уравнения присутствуют молекулы кислот, например:
K2Cr2O7 + 3H2S + 4H2SO4 → Cr2(SO4)3 + K2SO4 + 3S + 7H2O;
б) в щелочной среде, в левой части уравнения присутствуют молекулы основания, например:
3Zn + KNO2 + 5KOH = NH3 + 3K2ZnO2 + H2O;
в) в нейтральной среде, в левой части уравнения присутствуют молекулы воды, например:
5(NH4)2S2O8 + 8H2O + 2MnSO4→ 2HMnO4 + 7H2SO4 + 5(NH4)2SO4.
1.4.2. Реакции внутримолекулярного окисления – восстановления
Это такие реакции, когда в одной и той же молекуле сложного вещества атомы одного элемента проявляют свойства окислителя, а атомы другого элемента – свойства восстановителя. Простейшими примерами таких реакций могут служить реакции термического распада сложного вещества. Например:
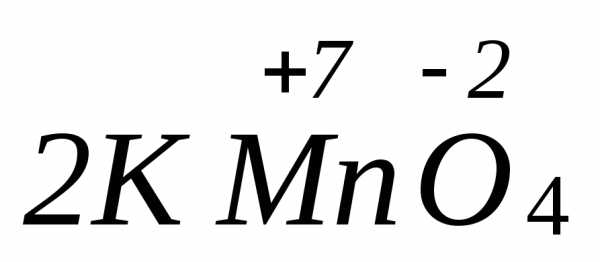 =
= 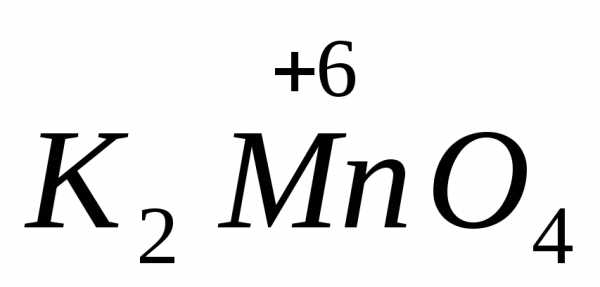 +
+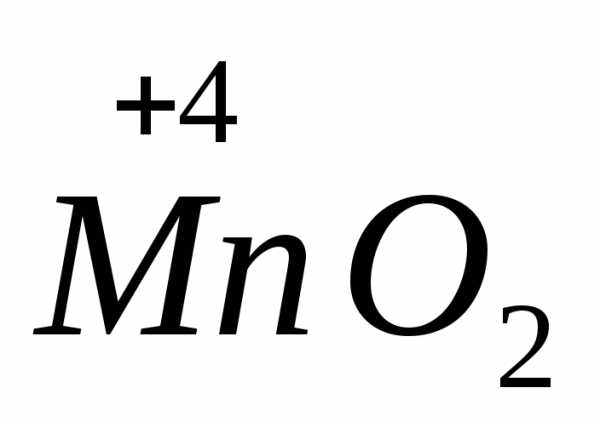 +
+
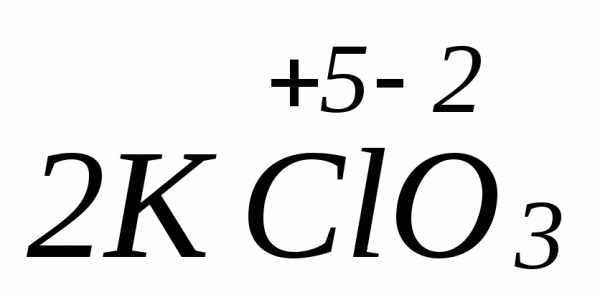 =
= 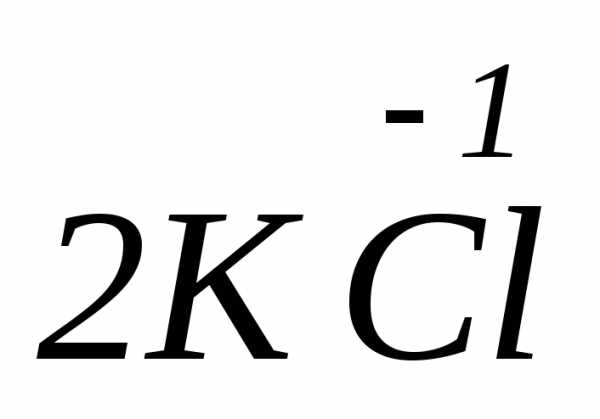 +3
+3
окислитель
 +
6ē =
+
6ē = 
2 процесс восстановления
восстановитель
 –4ē
=
–4ē
= 
3 процесс окисления
1.4.3. Реакции диспропорционирования (самоокисления – самовосстановления)
В таких реакциях атомы одного элемента в соединении исходного вещества одновременно проявляют как окислительные, так и восстановительные свойства. Эти реакции протекают в том случае, когда атомы в соединении имеют промежуточную степень окисления и поэтому могут отдавать и принимать электроны и соответственно – окисляться и восстанавливаться, переходя в состояние с низшей или высшей степенью окисления.
Скорость реакции диспропорционирования связана с близостью внешних энергетических уровней в обоих состояниях атома.

 =
= 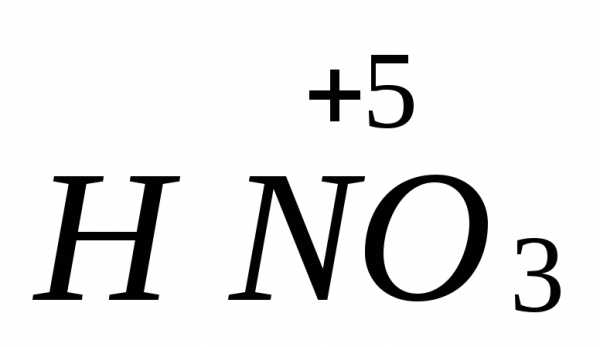 +
+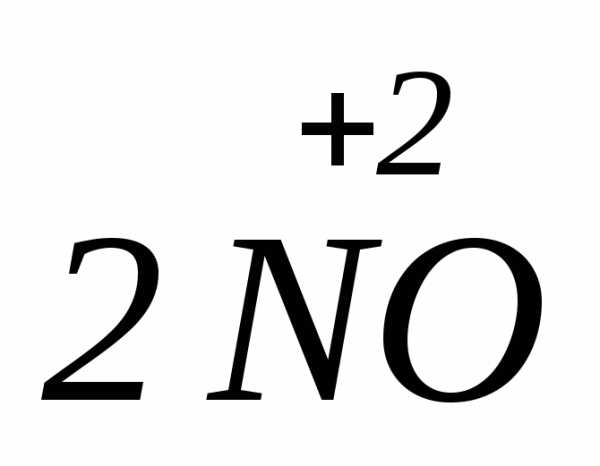 +
+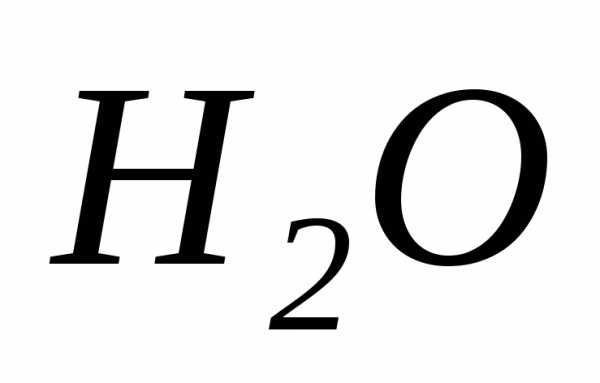 ,
где соединения азота в степени окисления
(+3) проявляют как окислительные, так и
восстановительные свойства:
,
где соединения азота в степени окисления
(+3) проявляют как окислительные, так и
восстановительные свойства:
восстановитель
 -2ē =
-2ē = 
процесс окисления
окслитель
 + ē =
+ ē = 
процесс восстановления
2Sº
+ 6KOH = 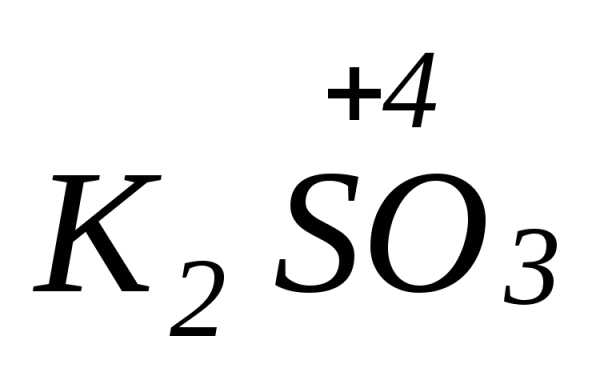 +
+ 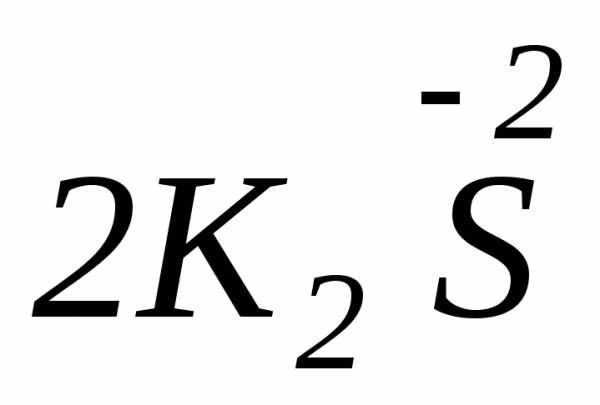 + 2H2O
+ 2H2O
Sº — выполняет роль и окислителя и восстановителя:
восстановитель
Sº – 4ē =

процесс окисления
окислитель
Sº + 2ē =

процесс восстановления
2. Составление уравнений реакций окисления – восстановления
Для составления уравнений ОВР надо знать свойства взаимодействующих веществ, учитывать значения окислительно-восстановительных потенциалов (ОВП) в разных средах (глава 5.4.2), на их основании определять направление протекания ОВР и уметь написать на этом основании продукты реакции правой части уравнения.
Правильно составленное уравнение реакции является выражением сохранения массы веществ. Поэтому необходимо следить за тем, чтобы количество атомов одного и того же элемента в исходных веществах и продуктах реакции было одинаковым. Применяют два основных метода составления реакций окисления-восстановления:
– метод электронного баланса;
– метод ионно-электронного баланса (метод полуреакций).
studfiles.net
Дополнительные примеры ОВР — 21 Сентября 2013
Добрый день, сегодня мы разберем еще ряд примеров решения ОВР. Ранее мы разобрали общую методику решения ОВР методом полуреакций и методом электронного баланса. Сейчас пополним этот список дополнительными примерами. Для экономии времени и Вашего внимания, будем более кратко рассматривать этот материал, так как, мы ранее подробно познакомились с общими методиками решения ОВР и оформления ответов.
1. AsCl3+Zn+H2SO4→AsH3+ZnSO4+HCl.
Для начала определим кто окислитель, а кто восстановитель. Цинк в кислой среде – сильный восстановитель, что подтверждается изменением заряда на нем с 0 до 2+. Значит, окислитель – второй элемент, изменивший в ходе реакции свой заряд, это мышьяк. Используя ряд электроотрицательности, приходим к выводу, что с хлором мышьяк имеет заряд 3+, а с водородом 3-. Следовательно, мышьяк принимает 6 электронов, а цинк отдает 2 электрона. Наименьшее общее кратное 6, значит множители: 3 для цинка и 1 для мышьяка. После перемножения имеем:
AsCl3+3Zn+3H2SO4→AsH3+3ZnSO4+3HCl.
2. Na2HAsO4+KI+HCl→I2+H3AsO3+NaCl+KCl+H2O.
Соединения йода 1- в кислой среде – достаточно сильные восстановители, что подтверждается изменением валентности йода с 1- до 0. Значит, окислитель – мышьяк, который меняет степень окисления с 5+ до 3+. Следовательно, мышьяк принимает 2 электрона, а йод отдает 1 электрон. Наименьшее общее кратное 2, множители: 2 для йода и 1 для мышьяка.
Na2HAsO4+2KI+4HCl→I2+H3AsO3+2NaCl+2KCl+H2O.
3. Na2HAsO4+SO2+H2SO4→SO3+H3AsO3+Na2SO4.
Ситуация аналогична, но, теперь восстановитель – диоксид серы, он окисляется до триоксида серы. То есть, отдает по 2 электрона. Значит, наименьшее общее кратное 2, множители по единице. Дополнительных множителей не требуется.
4. As2S3+(NH4)2S2→As2S5+(NH4)2S.
Полисульфид аммония является сравнительно слабым окислителем (по аналогии с пероксидом водорода), он окисляет мышьяк с 3+ до 5+. Таким образом, наименьшее общее кратное 2 (так как, два атома серы в полисульфидном анионе идут вместе и принимают два электрона на двоих). Дополнительных множителей здесь не требуется, но, мышьяк содержится по два атома в каждой молекуле сульфида. Что требует удвоить количество полисульфида аммония.
As2S3+2(NH4)2S2→As2S5+2(NH4)2S.
5. NaBiO3+MnSO4+H2SO4→Bi2(SO4)3+HMnO4+Na2SO4+H2O.
В данной реакции висмутат калия является сильным окислителем, что подтверждается изменением заряда на висмуте с 5+ до 3+. Восстановителем является марганец, переходящий из формы 2+ в высокоокисленную форму Mn7+. Таким образом, марганец отдает 5 электронов, а висмут принимает 2 электрона. Наименьшее общее кратное 10, значит множители 2 и 5 соответственно. Так как, висмут в правой части уравнения входит в молекулу сульфата по два атома в молекуле, а пять атомов не поделить на 2, то удваиваем коэффициенты. Количество серной кислоты должно хватить на образование всех солей, а количество воды пропорционально оставшимся бесхозными атомам водорода.
10NaBiO3+4MnSO4+16H2SO4→5Bi2(SO4)3+4HMnO4+5Na2SO4+14H2O.
6. SbH3+Ag2SO4→Sb+Ag+H2SO4.
Гидриды металлов все являются сильными восстановителями, в данном случае водород гидрида восстанавливает серебро до свободного металла. Водород отдает 1 электрон, серебро принимает 1 электрон. Так как, в каждой молекуле гидрида висмута по три атома водорода, то утраиваем количество серебра. Последнее входит в состав сульфата по два атома на молекулу. Что требует еще удвоить коэффициенты. В результате имеем:
2SbH3+3Ag2SO4→2Sb+6Ag+3H2SO4.
7. С+HNO3→CO2+NO+H2O.
Азотная кислота достаточно сильный окислитель, углерод выступает в роли восстановителя. Атом углерода отдает 4 электрона, азот нитратной группы принимает 3 электрона. Наименьшее общее кратное 12, значит множители 3 и 4 соответственно:
3С+4HNO3→3CO2+4NO+2H2O.
8. Na2O2+CO2→Na2CO3+O2.
В этой реакции меняет степень окисления только кислород перекисного мостика. Значит, один атом является окислителем, а второй восстановителем. Для упрощения, разделим окислитель и восстановитель по разным молекулам. Значит, перекисный анион O22- в одной полуреакции принимает 2 электрона, а в другой отдает два электрона. Значит, наименьшее общее кратное равно 2, множители по единице, а в общее уравнение сводим оба аниона:
2Na2O2+2CO2→2Na2CO3+O2.
9. HCOH+Cu(OH)2→HCOOH+CuOH+H2O.
Формалин является сильным восстановителем, а медь принимает один электрон, переходя из 2+ в 1+. Заряд на углероде меняется с нуля на 2+. Значит, наименьшее общее кратное 2. Множители: 2 для меди и 1 для углерода:
HCOH+2Cu(OH)2→HCOOH+2CuOH+H2O.
10. Ag+HNO3→AgNO3+NO+H2O.
Серебро отдает 1 электрон переходя из 0 степени окисления в 1+, значит он восстановитель. Азот окислитель, он переходит из N5+ в N2+. Наименьшее общее кратное 3. Множители: 3 для серебра и 1 для азота нитратного аниона. Для связывания трех катионов серебра необходимы три молекулы азотной кислоты. Остающиеся атомы водорода связывают лишний кислород из разрушенной нитратной группы.
3Ag+4HNO3→3AgNO3+NO+4H2O.
11. S+Cl2+H2O→H2SO4+HCl.
Хлор является достаточно сильным окислителем, серы выступает в роли восстановителя. Атом серы отдает 6 электронов, атом хлора принимает один электрон. Наименьшее общее кратное 6, множители: 6 для хлора и 1 для серы.
S+3Cl2+4H2O→H2SO4+6HCl.
12. Na2S+Na2CO3+SO2→Na2S2O3+CO2.
Окислителем является сера из диоксида, так как, она меняет степень окисления с 4+ на 2+. Восстановителем является сера сульфида, она меняет степень окисления с 2- на 2+. Значит, в одной полуреакции сера принимает 2 электрона, а в другой сера отдает 4 электрона. Наименьшее общее кратное 4. Множители 2 и 1. Но, так как в правой части уравнения сера присутствует по два атома в молекуле бисульфита, то удваиваем коэффициенты.
2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2.
Надеюсь, это дополнительное количество примеров поможет Вам лучше разобраться в данной теме. Помните, что одни и те же вещества могут встречаться в самых разных реакциях, как в качестве окислителя, так и восстановителя. Большее количество примеров приводить на вижу смысла, но, потренироваться Вам все же стоит. Если что-то не сможете решить, оставьте свой пример на форуме или в комментариях к этой статье. Мы всегда поможем.
www.chemfive.info


 +
6ē =
+
6ē = 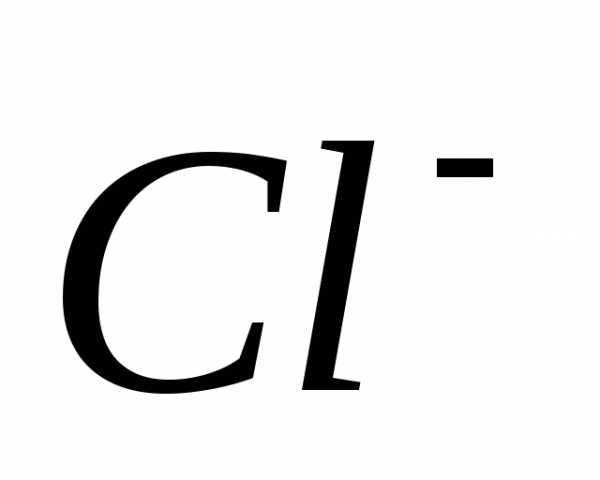
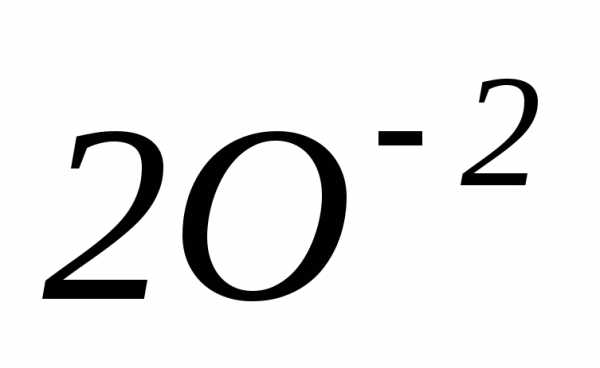 –4ē
=
–4ē
= 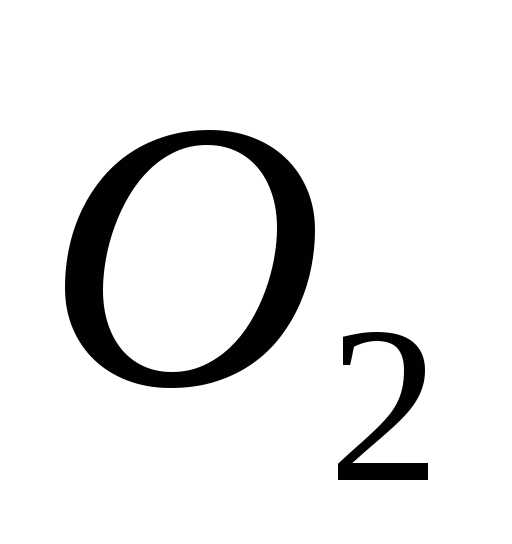
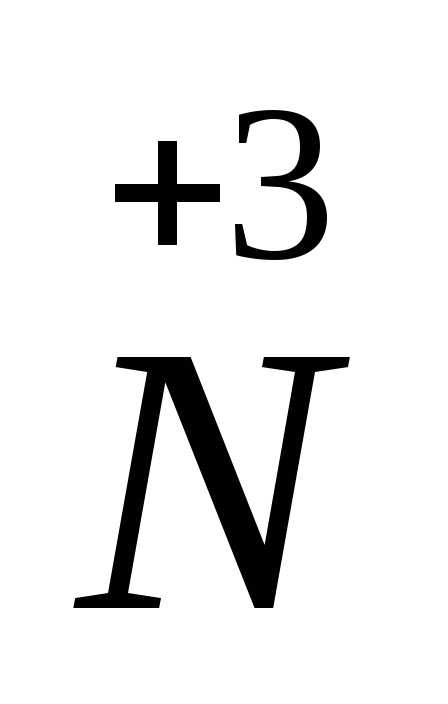 -2ē =
-2ē = 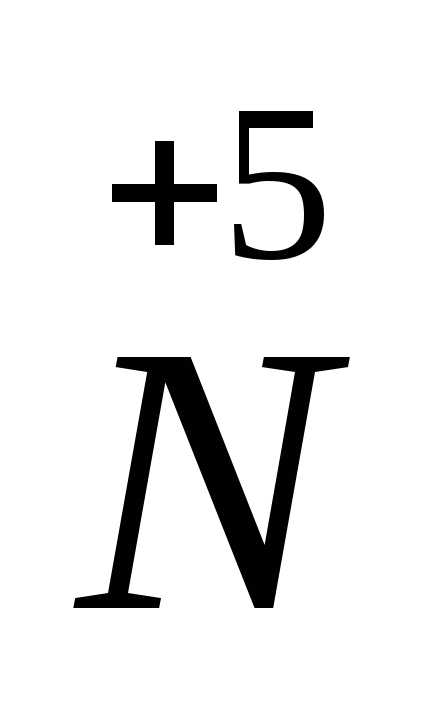
 + ē =
+ ē =