Какие суждения верны ферменты специфичны каждый фермент – 7. .
Задание 8. «Активный центр фермента»
Рассмотрите рисунок и ответьте на вопросы:
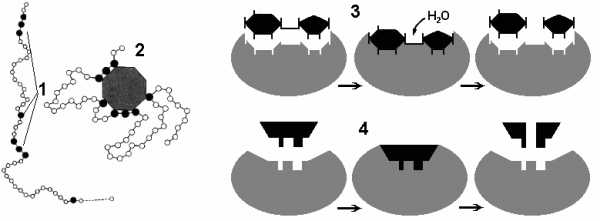
Что обозначено на рисунке под цифрами 1 — 4?
Как называется участок фермента, взаимодействующий с молекулой субстрата?
Какая структура у белков-ферментов?
Почему при изменении температуры и рН изменяется каталитическая активность ферментов?
Почему ферменты специфичны?
Чем гипотеза Фишера отличается от гипотезы Кошланда?
Задание 9. «Белки»
Запишите номера тестов, против каждого – правильные варианты ответа
Тест 1. На первом месте по массе из органических веществ в клетке находятся:
Углеводы.
Белки.
Липиды.
Нуклеиновые кислоты.
**Тест 2. В состав простых белков входят следующие элементы:
Углерод. 5. Фосфор.
Водород. 6. Азот.
Кислород. 7. Железо.
Сера. 8. Хлор.
Тест 3. Количество различных аминокислот, встречающихся в белках:
170.
26.
20.
10.
**Тест 4.Количество незаменимых для человека аминокислот:
Таких аминокислот нет.
20.
10.
7.
**Тест 5.
Неполноценные белки — белки:В которых отсутствуют некоторые аминокислоты.
В которых отсутствуют некоторые незаменимые аминокислоты.
В которых отсутствуют некоторые заменимые аминокислоты.
Все известные белки являются полноценными.
Тест 6.Придают аминокислотам свойства:
Кислые — радикал, щелочные — аминогруппа.
Кислые — аминогруппа, щелочные — радикал.
Кислые — карбоксильная группа, — щелочные — радикал.
Кислые — карбоксильная группа, щелочные — аминогруппа.
Тест 7.Пептидная связь образуется в результате:
Реакции гидролиза.
Реакции гидратации.
Все выше перечисленные реакции могут привести к образованию пептидной связи.
Тест 8.Пептидная связь образуется:
Между карбоксильными группами соседних аминокислот.
Между аминогруппами соседних аминокислот.
Между аминогруппой одной аминокислоты и радикалом другой.
Между аминогруппой одной аминокислоты и карбоксильной группой другой.
**Тест 9.Вторичную структуру белков стабилизируют:
Ковалентные.
Водородные.
Ионные.
Такие связи отсутствуют.
**Тест 10.Третичную структуру белков стабилизируют:
Ковалентные.
-
Водородные.
Ионные.
Гидрофильно-гидрофобное взаимодействие.
**Тест 11. При окислении 1 г белка образуются:
Вода. 5. Мочевина.
Углекислый газ. 6. 38,9 кДж энергии.
Аммиак.
17, 6 кДж энергии.
Тест 12. В пробирки с пероксидом водорода поместили кусочек вареной колбасы, хлеба, моркови, рубленого яйца. Кислород выделялся в пробирке:
С кусочком вареной колбасы.
С кусочком хлеба.
С кусочком моркови.
С кусочком рубленого яйца.
**Тест 13. Верные суждения:
Ферменты специфичны, каждый фермент обеспечивает реакции одного типа.
Ферменты универсальны и могут катализировать реакции разных типов.
Каталитическая активность ферментов не зависит от рН и температуры.
Каталитическая активность ферментов напрямую зависит от рН и температуры.
**Тест 14.Верные суждения:
Фермент — ключ, субстрат — замок согласно теории Фишера.
Фермент — замок, субстрат — ключ согласно теории Фишера.
После каталитической реакции фермент и субстрат распадаются, образуя продукты реакции.
После каталитической реакции фермент остается неизменным, субстрат распадается, образуя продукты реакции.
Тест 15.Верное суждение:
Витамины являются кофакторами многих ферментов.
Все белки являются биологическими катализаторами, ферментами.
При замерзании происходит необратимая денатурация ферментов.
Ренатурация — утрата трехмерной конфигурации белка без изменения первичной структуры.
studfiles.net
Тест по химии Ферменты 10 класс
Тест по химии Ферменты для учащихся 10 класса с ответами. Тест состоит из 2 частей. Часть А — 15 заданий с выбором ответа. Часть B — 5 заданий с кратким ответом.
Часть А
А1. Укажите верное суждение:
А) ферменты -это катализаторы белковой природы, ускоряющие химические реакции в организме;
Б) энзимы -это аминокислоты, которые ускоряют химические реакции в организме.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
1) около 10
2) около 100
3) около 1000
4) более 2000
А3. Относительная молекулярная масса ферментов находится в пределах
1) 102 — 103
2) 103 — 105
3) 105 — 107
4) 107 — 109
А4. Каждый фермент может ускорять
1) все реакции
2) несколько разнотипных реакций
3) только одну реакцию или группу однотипных реакций
4) однотипные и разнотипные реакции
А5. Укажите верное суждение:
А) ферменты ускоряют химические реакции в организме независимо от температуры и реакции среды;
Б) способность фермента ускорять одну реакцию или группу однотипных реакций называется селективностью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
А6. Глицерин и жирные кислоты образуются при ферментативном гидролизе
1) жиров
2) белков
3) углеводов
4) нуклеиновых кислот
А7. Аминокислоты образуются при ферментативном гидролизе
1) жиров
2) белков
3) углеводов
4) нуклеиновых кислот
А8. Моносахариды образуются при ферментативном гидролизе
1) жиров
2) белков
3) углеводов
4) нуклеиновых кислот
А9. Ферменты увеличивают скорость реакций
1) в 10 раз
2) в 1000 раз
3) в 104 — 105 раз
4) в 108 — 1015 раз
А10. Ферменты наиболее эффективны при температуре
1) 0 °С
2) 34 °С
3) 37 °С
4) 42 °С
А11. Фермент желудочного сока пепсин наиболее активен при рН
1) 1,5-2
2) 4-6
3) 6-8
4) 8-10
А12. Фермент крови каталаза наиболее активна при рН
1) 2
2) 7
3) 4
4) 9
А13. Если кровоточащую рану обработать раствором пероксида водорода, то появляется характерное вспенивание, свидетельствующее о выделении газа. Укажите фермент, участвующий в этом процессе.
1) амилаза
2) пепсин
3) каталаза
4) реннин
А14. При продолжительном разжевывании хлеба во рту появляется сладковатый вкус, свидетельствующий о гидролизе крахмала хлеба. Укажите фермент, участвующий в этом процессе.
1) амилаза
2) пепсин
3) каталаза
4) реннин
А15. Для ферментов характерны следующие особенности
1) белковая природа и большая молекулярная масса
2) селективность, избирательность действия
3) высокая эффективность
4) характерны все перечисленные особенности
Часть В
B1. Установите соответствие между продуктами ферментативного гидролиза веществ и самими веществами. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Продукты гидролиза
А) моносахариды
Б) глицерин
В) аминокислоты
Г) жирные кислоты
Вещества
1) жиры
2) белки
3) углеводы
В2. Установите соответствие между интервалом значений рН и характеристикой среды в этом интервале. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Интервал значений pH
А) 0-2
Б) 3-5
В) 6-8
Г) 8-10
Д) 12-14
Среда
1) нейтральная
2) слабощелочная
3) слабо кислотная
4) сильнощелочная
5) сильнокислотная
В3. Установите соответствие между физиологической жидкостью и средним значением рН в этой жидкости. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Жидкость
А) плазма крови
Б) желудочный сок
В) моча
Г) слюна
pH
1) 1,7
2) 5,8
3) 6,8
4) 7,4
В4.
Ферменты
А) амилазы
Б) протеазы
В) каталаза
Процессы
1) расщепление пероксида водорода
2) расщепление белков
3) расщепление крахмала
В5. Установите соответствие между отраслями промышленности и ферментами, используемыми в этих отраслях. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Промышленность
А) пивоваренная
Б) сыроделие
В) хлебопекарная
Ферменты
1) реннин
2) амилаза
3) папаин
Ответы на тест по химии Ферменты
часть А
А1-1
А2-4
А3-3
А4-3
А5-2
А6-1
А7-2
А8-3
А9-4
А10-3
А11-1
А12-2
А13-3
А14-1
А15-4
часть B
В1-3121
В2-53124
В3-4123
В4-321
В5-312
testschool.ru
Специфичность действия ферментов
Ферменты обладают более высокой специфичностью действия по сравнению с неорганическими катализаторами. Различают специфичность по отношению к типу химической реакции, катализируемой ферментом, и специфичность по отношению к субстрату. Эти два вида специфичности характерны для каждого фермента.
Специфичность по отношению к субстрату– это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами. Различают 4 вида субстратной специфичности ферментов:
Абсолютная специфичность– способность фермента катализировать превращение только одного субстрата. Например – глюкокиназа фосфорилирует только глюкозу, аргиназа расщепляет только аргинин, уреаза – мочевину.
Относительная специфичность– фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например – липаза расщепляет сложноэфирную связь в триацилглицеролах.
Относительная групповая специфичность– фермент катализирует превращение нескольких субстратов, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав субстратов. Например, все протеолитические ферменты расщепляют пептидную связь, но пепсин – образованную аминогруппами ароматических аминокислот, химотрипсин – образованную карбоксильными группами этих же аминокислот, трипсин – пептидную связь, образованную карбоксильной группой лизина, аргинина.
Стереохимическая специфичность– фермент катализирует превращение только одного стереоизомера. Например, бактериальная аспартатдекарбоксилаза катализирует декарбоксилирование толькоL-аспартата и не действует наD-аспарагиновую кислоту.
Специфичность по отношению к реакции
Каждый фермент катализирует одну реакцию или группу реакций одного типа. Часто одно и то же химическое соединение выступает как субстрат для разных ферментов, причем каждый из них катализирует специфическую для него реакцию, приводящую к образованию разных продуктов. Специфичность по типу реакции лежит в основе единой классификации ферментов.
ГЛАВА 4 регуляция активности ферментов. Медицинская энзимология
Способы регуляции активности ферментов:
Изменение количества ферментов.
Изменение каталитической эффективности фермента.
Изменение условий протекания реакции.
Регуляция количества ферментов
Количество молекул фермента в клетке определяется соотношением двух процессов – скоростями синтеза и распада белковой молекулы фермента.
В клетках существуют два типа ферментов:
Конститутивные ферменты – являются обязательными компонентами клетки, синтезируются с постоянной скоростью в постоянных количествах.
Адаптивные ферменты – их образование зависит от определенных условий. Среди них выделяют индуцируемые и репрессируемые ферменты.
Индуцируемыми, как правило, являются ферменты с катаболической функцией. Их образование может быть вызвано или ускорено субстратом данного фермента. Репрессируемыми обычно бывают ферменты анаболической направленности. Ингибитором (репрессором) синтеза этих ферментов может быть конечный продукт данной ферментативной реакции.
Изменение каталитической эффективности ферментов
Этот тип регуляции может осуществляться по нескольким механизмам.
Влияние активаторов и ингибиторов на активность ферментов
Активаторы разными путями могут повышать ферментативную активность:
формируют активный центр фермента;
облегчают образование фермент-субстратного комплекса;
стабилизируют нативную структуру фермента;
защищают функциональные группы активного центра.
Классификация ингибиторов ферментов:
Неспецифические.
Специфические:
а) необратимые
б) обратимые:
— конкурентные
— неконкурентные.
Неспецифические ингибиторы вызывают денатурацию молекулы фермента – это кислоты, щелочи, соли тяжелых металлов. Их действие не связано с механизмом ферментативного катализа.
studfiles.net
Тест кхимический состав клетки | Образовательный портал EduContest.Net — библиотека учебно-методических материалов
«Химический состав клетки» (Молекулярный уровень)Вариант 1. 10 класс ( базовый уровень).
1. Какой хим. элемент содержится одновременно в костной ткани и нуклеиновых кислотах?
А) кальций Б) фосфор В) калий Г) магний
2.Вода обладает способностью растворять ионные вещества, потому
что:
А) содержит ионы В) её молекулы полярны
Б) содержит кислород Г) содержит водород
З.К макроэлементам относятся :
А) сера Б) железо В) кислород Г) углерод Д) кальций Е) фосфор Ж) азот 3) йод
4.Какие суждения верные?
А) молекула воды -диполь
Б) молекула воды не имеет заряда
В) на атоме кислорода в молекуле воды имеется небольшой
отрицательный заряд , на атомах водорода — положительный
Г) на атоме кислорода в молекуле воды имеется небольшой
положительный заряд, на атомах водорода – отрицательный
5. К дисахаридам относятся:
А) крахмал В) глюкоза Д) лактоза
Б) сахароза Г) хитин
6.Углеводы в организме выполняют следующие функции:
А) строительную Б) энергетическую В) каталитическую
Г) регуляторную7. Основу клеточных мембран образуют: А) жиры Б) воска В) фосфолипиды Г) липиды
8.К пентозам относятся :
А) рибоза Б) фруктоза В) глюкоза Г) дезоксирибоза
9.Липопротеины — это комплекс:
А) глицерина и жирных кислот Б)липидов и белков В) нуклеотидов и белков Г) углеводов и липидов
10. Из органических веществ в клетке на первом месте по массе находятся :
А) углеводы Б) липиды В) белки Г) нуклеиновые кислоты
11.Связи , которые удерживают первичную структуру молекулы белка, называются:
А) водородными Б) пептидными В) гидрофобными Г) дисульфидными
12.Гуанин образует комплементарную связь с :
А)аденином Б)тимином В)урацилом Г)цитозином
13.Молекулы ДНК не находятся в:
А)ядре Б)митохондриях В)хлоропласта Г)комплексе
Гольджи
14. РНК выполняет следующую функцию:
А)перенос аминокислот на рибосомы
Б)формирование рибосом
В)снятие и перенос информации с ДНК
Г) все перечисленные функции
15. В процессе биохимических реакций ферменты:
А)ускоряют реакции и сами при этом не изменяются
Б)ускоряют реакции и изменяются в результате реакции
В)замедляют хим.реакции, не изменяясь
Г) замедляют хим.реакции, изменяясь
16. Макроэргические связи образуются в молекуле:
А) глюкозы Б)АТФ В) ДНК Г) РНК
17. В каком случае правильно указан состав нуклеотида ДНК
А) дезоксирибоза, аденин, остаток фосфорной кислоты
Б) рибоза, остаток фосфорной кислоты, тимин
В) фосфорная кислота , урацил, дезоксирибоза
Г) остаток фосфорной кислоты, рибоза, гуанин
Задание уровня В
В1. Выберите только признаки молекулы ДНК.
А) Состоит из одной цепи
Б) Состоит из двух цепей
В) Мономерами являются аминокислоты
Г) Молекула не способна к репликации
Д) Мономерами являются нуклеотиды
Е) Молекула способна к репликации
«Х и м и ч е с к и й с о с т а в к л е т к и» ( М о л е к у л я р н ы й у р о в е н ь)
В а р и а н т 2 ( базовый уровень) 10 класс
1. Из перечисленных элементов в молекуле хлорофилла содержится:
а) натрий б) фосфор в) калий г) магний.
2. Полярностью воды обусловлены её:а)теплопроводность б) теплоёмкость в) способность растворять полярные соединения г) способность растворять неполярные соединения.
3. К макроэлементам относятся:
а) водород д) сера б) кислород е) железо
в) углерод ж) азот г) фосфор з) кальций.
4. Какие суждения верны?
а) жиры относятся к гидрофильным веществам
б) вода обладает большой теплопроводностью и теплоёмкостьюв ) жиры относя
educontest.net
1. Ферменты
Ферменты – это:
а) катализаторы;
б) витамины;
в) регуляторы;
г) рецепторы.
Правильный ответ: а
По химической природе ферменты – это:
а) белки;
б) углеводы;
в) липиды;
г) металлы.
Правильный ответ: а
Ферменты отличаются от неорганических катализаторов тем, что:
а) не изменяются в процессе реакции;
б) не катализируют термодинамически невозможные реакции;
в) не сдвигают положение равновесия обратимых реакций;
г) обладают специфичностью.
Правильный ответ: г
4. Ферменты, катализирующие одну и ту же реакцию, но отличающиеся по составу и физико-химическим свойствам, называются:
а) изоферментами;
б) сопряженными ферментами;
в) конкурирующими ферментами;
г) лимитирующими ферментами.
Правильный ответ: а
Простой фермент состоит из:
а) аминокислот;
б) аминокислот и ионов металлов;
в) аминокислот и витаминов;
г) аминокислот и липидов.
Правильный ответ: а
Сложный фермент состоит из:
а) аминокислот;
б) аминокислот и кофактора;
в) глюкозы и ионов металлов;
г) нуклеотидов.
Правильный ответ: б
У простых ферментов в состав активного центра входят:
а) нуклеиновые кислоты;
б) ионы металлов;
в) аминокислоты;
г) углеводы.
Правильный ответ: в
У сложных ферментов химический состав активного центра представлен:
а) только аминокислотами;
б) аминокислотами и кофактором;
в) аминокислотами и углеводами;
г) фосфолипидами.
Правильный ответ: б
Константа Михаэлиса (КМ) характеризует:
а) сродство фермента к субстрату;
б) эффективность активатора;
в) эффективность ингибитора;
г) сродство фермента к продукту.
Правильный ответ: а
Активность фермента определяется:
а) по скорости убывания субстрата;
б) по изменению конформации субстрата;
в) по скорости образования фермент-субстратного комплекса;
г) по изменению температуры.
Правильный ответ: а
Константа Михаэлиса – это:
а) концентрация субстрата, при которой скорость реакции является максимальной;
б) концентрация субстрата, при которой скорость реакции равна половине максимальной;
в) насыщающая концентрация субстрата;
г) концентрация продукта.
Правильный ответ: б
Активный центр фермента – это:
а) участок фермента, отвечающий за связывание субстрата и образование продукта;
б) участок фермента, отвечающий за регуляцию активности;
в) участок фермента, отвечающий за связывание с клеточными структурами.
г) участок фермента, отвечающий за присоединение кофактора.
Правильный ответ: а
Кофактор – это:
а) небелковая часть фермента;
б) белковая часть фермента;
в) часть аллостерического центра;
г) часть конкурентного ингибитора.
Правильный ответ: а
Коферменты от простетических групп отличаются:
а) прочностью связи с апоферментом;
б) прочностью связи с аллостерическим центром;
в) местоположением в молекуле фермента;
г) ролью в процессе ферментного катализа.
Правильный ответ: а
Температура тела выше 40о С опасно для человека жизни:
а) из-за денатурации многих белков, включая ферменты;
б) из-за резкого увеличения скорости ферментативных реакций и истощения запасов субстратов;
в) из-за переполнения клеток продуктами ферментативных реакций;
г) из-за теплового разрушения небелковых лигандов ферментов.
Правильный ответ: а
Сдвиг рН в любую сторону от оптимального значения:
а) изменяет конформацию фермента;
б) не изменяет конформацию фермента;
в) изменяет первичную структуру фермента;
г) разрушает дисульфидные связи в ферменте.
Правильный ответ: а
Ферменты ускоряют химические реакции:
а) снижением энергии активации;
б) повышением энергии активации;
в) повышением температуры реакции;
г) снижением температуры реакции.
Правильный ответ: а
Изменение конформации фермента при алкалозе вызвано:
а) разрушением водородных и ионных связей;
б) разрушением дисульфидных связей;
в) разрушением пептидных связей;
г) разрушением гидрофобных связей.
Правильный ответ: а
19. Денатурация фермента приводит к его инактивации вследствие:
а) разрушения активного центра;
б) разрушения кофактора;
в) разрушения аллостерического центра;
г) разрушения субстрата.
Правильный ответ: а
20. При относительной специфичности ферменты действуют на:
а) один субстрат;
б) группу родственных субстратов;
в) на определенный тип связи;
г) на любые субстраты.
Правильный ответ: в
21. По теории Фишера:
а) субстрат должен абсолютно соответствовать конформации активного центра;
б) субстрат может не соответствовать конформации активного центра фермента;
в) кофактор должен абсолютно соответствовать конформации активного центра;
г) кофактор может не соответствовать конформации активного центра.
Правильный ответ: а
По теории Кошланда:
а) активный центр фермента формируется окончательно при связывании с субстратом;
б) активный центр имеет необходимую конформацию до взаимодействия с субстратом;
в) активный центр фермента формируется окончательно при связывании с коферментом;
г) форма активного центра не зависит строения кофактора и субстрата.
Правильный ответ: а
Для очистки гнойных ран используют обработку пептидазами, так как они:
а) расщепляют белки разрушенных клеток и этим очищают рану;
б) расщепляют гликолипиды разрушенных клеток и этим очищают рану;
в) расщепляют нуклеиновые кислоты и этим очищают рану;
г) расщепляют углеводы разрушенных клеток и этим очищают рану.
Правильный ответ: а
Добавление трипсина к ферментам:
а) не изменит их активность;
б) приведет к потере их активности;
в) приведет к повышению их активности;
г) приведет разрушению кофактора.
Правильный ответ: б
Прямым доказательством белковой природы фермента является:
а) снижение энергии активации;
б) ускорение прямой и обратной реакции;
в) ускорение достижения положения равновесия обратимой реакции;
г) прекращение каталитического действия при добавлении в раствор вещества, разрушающего пептидные связи.
Правильный ответ: г
Для сохранения сладкого вкуса свежесобранные початки кукурузы помещают на несколько минут в кипящую воду для того, чтобы:
а) они стали мягкими;
б) денатурировать ферменты, превращающие глюкозу в крахмал;
в) было легко освободить зерна;
г) разрушить пептидные связи.
Правильный ответ: б
Изменение конформации фермента при ацидозе вызвано:
а) разрушением водородных и ионных связей;
б) разрушением дисульфидных связей;
в) разрушением пептидных связей;
г) разрушением гидрофобных связей.
Правильный ответ: а
28. При абсолютной специфичности ферменты действуют на:
а) один субстрат;
б) на определенный тип связи в субстрате;
в) на определенный тип связи в продукте;
г) на любые субстраты.
Правильный ответ: а
Денатурацию ферментов вызывают:
а) субстраты;
б) соли тяжелых металлов;
в) продукты;
г) кофакторы.
Правильный ответ: б
Денатурацию ферментов вызывают:
а) субстраты;
б) продукты ;
в) трихлоруксусная кислота;
г) кофакторы.
Правильный ответ: в
Денатурацию ферментов вызывают:
а) субстраты;
б) высокие температуры;
в) продукты;
г) кофакторы.
Правильный ответ: б
Апофермент — это:
а) комплекс белка и кофактора;
б) белковая часть фермента;
в) ионы металлов;
г) витамины.
Правильный ответ: б
Общим свойством фермента и неорганического катализатора является:
а) регулируемость;
б) не расходуется в процессе реакции;
в) действует в мягких условиях;
г) высокая специфичность.
Правильный ответ: б
Общим свойством фермента и неорганического катализатора является:
а) регулируемость;
б) снижение энергии активации;
в) молекулярная масса;
г) высокая специфичность.
Правильный ответ: б
Конкурентный ингибитор:
а) по строению похож на субстрат;
б) по строению не похож на субстрат;
в) по строению похож на продукт;
г) по строению похож на кофактор.
Правильный ответ: а
Аллостерические ингибиторы:
а) действуют обратимо;
б) действуют необратимо;
в) присоединяются к активному центру;
г) конкурируют с субстратом.
Правильный ответ: а
Аллостерические ингибиторы:
а) действуют необратимо;
б) присоединяются к аллостерическому центру;
в) присоединяются к активному центру;
г) конкурируют с кофактором.
Правильный ответ: б
Ограниченный протеолиз — это:
а) присоединение олиго- или полипептида к ферменту;
б) отщепление олиго- или полипептида от фермента;
в) присоединение олиго- или полипептида к аллостерическому центру фермента;
г) отщепление олиго- или полипептида от аллостерического центра фермента.
Правильный ответ: б
studfiles.net
ферменты
Ферме́нты, или энзи́мы (от лат.Fermentum — закваска) — обычно белковые молекулыилимолекулы РНК(рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции вживыхсистемах.Реагентыв реакции, катализируемой ферментами, называютсясубстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазыфосфорилируеттолько фосфорилазу).
Ферментативная активность может регулироваться активаторамииингибиторами(активаторы — повышают, ингибиторы — понижают).
Белковые ферментысинтезируются нарибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы(первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтомпри обсуждении механизмовпищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, акрахмалпревращается всахарпод действием слюны. Однако механизм этих явлений был неизвестен[1].
В XIX в. Луи Пастер, изучая превращениеуглеводоввэтиловый спиртпод действиемдрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастерас одной стороны, иМ. БертлоиЮ. Либиха— с другой, о природе спиртового брожения. Собственноферментами (от лат.fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч.ἐν- — в- и ζύμη — дрожжи, закваска) предложен в1876 годуВ. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин,амилаза). Через два года после смерти Л. Пастера в1897 годуЭ. Бухнер опубликовалработу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В1907 годуза эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 годуДж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшимсплайсингРНК уинфузорииTetrahymena thermophila. Рибозимомоказался участок молекулы пре-рРНК Tetrahymena, кодируемыйинтрономвнехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
Функции ферментов
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах. К 2013 году было описано более 5000 разных ферментов[2][3]. Они играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществорганизма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активациипроцесса.Химическое равновесиепри этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокаяспецифичность—константа связываниянекоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например,пепсинимеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза,алкогольдегидрогеназа.
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстратана другую. Среди трансфераз особо выделяюткиназы, переносящие фосфатную группу, как правило, с молекулыАТФ.
КФ 3: Гидролазы, катализирующие гидролизхимических связей. Пример:эстеразы,пепсин,трипсин,амилаза,липопротеинлипаза.
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролизас образованиемдвойной связив одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза АТФ. Пример:ДНК-полимераза.
Оксиредуктазы – это ферменты, катализирующие реакции окисления и восстановления, т.е. перенос электронов от донора к акцептору. Окисление представляет собой отнятие атомов водорода от субстрата, а восстановление это присоединение атомов водорода к акцептору.
К оксидоредуктазам относятся: дегидразы,оксидазы,оксигеназы, гидроксилазы, пероксидазы, каталазы. Например, ферменталкогольдегидрогеназакатализирует реакцию превращение спирта в альдегид.
Оксиредуктазы, переносящие атом водорода или электроны непосредственно на атомы кислорода, называются аэробными дегидрогеназами (оксидазами), тогда как оксидоредуктазы, переносящие атом водорода или электроны от одного компонентадыхательной цепи ферментов к другому, называются анаэробными дегидрогеназами. Распространённым вариантом окислительно-восстановительного процесса в клетках является окисление атомов водорода субстрата при участии оксиредуктаз. Оксидоредуктазы являются двухкомпонентными ферментами, у которых один и тот же кофермент может связываться с различными апоферментами. Например, многие оксидоредуктазы в качестве кофермента содержат НАД и НАДФ. В конце многочисленного класса оксиредуктаз ( на 11 позиции) находятся ферменты типа каталаз и пероксидаз. Из всего количества белков пероксисом клеток до 40 процентов приходится на каталазу. Каталаза и пероксидаза расщепляют пероксид водорода в следующих реакциях: Н2О2 + Н2О2 = О2 + 2Н2О h3O2 + HO – R – OH = O=R=O + 2h3O Из данных уравнений сразу становятся видны как аналогия, так и существенное отличие между этими реакциями и ферментами. В этом смыслекаталазное расщепление пероксида водорода представляет собой особый случай пероксидазной реакции, когда пероксид водорода служит и в качестве субстрата, и акцептора в первой реакции.
Трансфера́зы — отдельный класс ферментов, катализирующих перенос функциональных групп и молекулярных остатков от одной молекулы к другой. Широко распространены в растительных и животных организмах, участвуют в превращениях углеводов, липидов, нуклеиновых и аминокислот.
Реакции, катализируемые трансферазами, в общем случае выглядят так:
A—X + B ↔ A + B—X.
Молекула Aздесь выступает в качестве донора группы атомов (X), а молекулаBявляется акцептором группы. Часто в качестве донора в подобных реакциях переноса выступает один изкоферментов. Многие из катализируемых трансферазами реакций являются обратимыми. Систематические названия ферментов класса образуются по схеме:
«донор:акцептор + группа + трансфераза».
Или же используются чуть более общие названия, когда в название фермента включается имя либо донора, либо акцептора группы:
«донор + группа + трансфераза» или «акцептор + группа + трансфераза».
Например, аспартатаминотрансферазакатализирует переносаминной группыс молекулыглутаминовой кислоты,катехол-О-метилтрансферазаосуществляет переносметильной группыS-аденозилметионина на бензольное кольцо различныхкатехоламинов, агистон-ацетилтрансферазапереносит ацетильную группу с ацетил-кофермента А нагистонв процессе активациитранскрипции.
Кроме того ферменты 7 подгруппытрансфераз, переносящие остаток фосфорной кислоты, используя в качестве донора фосфатной группыАТФ, часто называют также киназами; аминотрансферазы (6 подгруппа) часто называюттрансаминазами
Гидролазы (КФ3) — это классферментов, катализирующийгидролизковалентной связи. Общий вид реакции, катализируемой гидролазой выглядит следующим образом:
A–B + H2O → A–OH + B–H
Систематическое название гидролаз включает название расщепляемого субстрата с последующим добавлением -гидролаза. Однако, как правило в тривиальном названии слово гидролаза опускается и остаётся только суффикс «-аза».
Важнейшие представители
Эстеразы: нуклеаза, фосфодиэстераза, липаза, фосфотаза;
Гликозидазы: амилаза, лизоцим и др;
Протеазы: трипсин, химотрипсин, эластаза, тромбин, ренин и др ;
Кислотный ангидрид-гидролаза ( хеликаза, ГТФаза)Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Лиа́зы — отдельный класс ферментов, катализирующих реакции негидролитического и неокислительного разрыва различных химических связей (C—C, C—O, C—N, C—S и других) субстрата, обратимые реакции образования и разрыва двойных связей, сопровождающиеся отщеплением или присоединением групп атомов по её месту, а также образованием циклических структур.
В общем виде названия ферментов образуются по схеме «субстрат + лиаза». Однако чаще в названии учитывают подкласс фермента. Лиазы отличаются от других ферментов тем, что в катализируемых реакциях в одном направлении участвуют два субстрата, а в обратной реакции только один. В названии фермента присутствуют слова «декарбоксилаза» и «альдолаза» или «лиаза» (пируват-декарбоксилаза, оксалат-декарбоксилаза, оксалоацетат-декарбоксилаза, треонин-альдолаза, фенилсерин-альдолаза, изоцитрат-лиаза, аланин-лиаза, АТФ-цитрат-лиаза и др.), а для ферментов, катализирующих реакции отщепления воды от субстрата — «дегидратаза» (карбонат-дегидратаза, цитрат-дегидратаза, серин-дегидратаза и др.). В тех случаях, когда обнаружена только обратная реакция, или это направление в реакциях более существенно, в названии ферментов пристутствует слово «синтаза» (малат-синтаза, 2-изопропилмалат-синтаза, цитрат-синтаза, гидроксиметилглутарил-CoA-синтаза и др.).
Примеры: гистидиндекарбоксилаза,фумаратгидратаза.
Изомеразы — ферменты,катализирующиеструктурные превращенияизомеров(рацемизация или эпимеризация). Изомеразы катализируютреакции, подобные следующей: A → B, где B является изомером A.
В названии фермента присутствует слово «рацемаза» (аланин-рацемаза, метионин-рацемаза, гидроксипролин-рацемаза, лактат-рацемаза и др.), «эпимераза» (альдоза-1-эпимераза, рибулозофосфат-4-эпимераза, УДФ-глюкуронат-4-эпимераза и др.), «изомераза» (рибозофосфат-изомераза, ксилозоизомераза, глюкозаминфосфат-изомераза, эноил-СоА изомераза и др.), «мутаза» (фосфоглицерат-мутаза, метиласпартат-мутаза, фосфоглюкомутазаи др.).
Лигаза (лат.ligāre — сшивать, соединять) — фермент,катализирующийсоединение двух молекул с образованием новой химической связи (лигирование[1][2]). При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул.
Лигазы относятся к классу ферментов EC 6.
В молекулярной биологии лигазы подкласса 6.5 классифицируют на РНК-лигазы и ДНК-лигазы.
ДНК-лигазы
ДНК-лигаза, осуществляющая репарациюДНК
ДНК-лигазы — ферменты(EC 6.5.1.1),катализирующиековалентное сшиваниецепейДНКв дуплексе прирепликации,репарацииирекомбинации. Они образуют фосфодиэфирные мостики между 5′-фосфорильной и 3′-гидроксильной группами соседнихдезоксинуклеотидовв местах разрыва ДНК или между двумя молекулами ДНК. Для образования этих мостиков лигазы используют энергиюгидролизапирофосфорильной связиАТФ. Один из самых распространённых коммерчески доступных ферментов — ДНК-лигазабактериофагаТ4.
ДНК-лигазы млекопитающих
У млекопитающих классифицируют три основных типа ДНК-лигаз.
ДНК-лигаза I лигирует фрагменты Оказакив ходерепликацииотстающей цепи ДНК и участвует в эксцизионной репарации[3].
ДНК-лигаза III в комплексе с белком XRCC1участвует вэксцизионной репарациии в рекомбинации.
ДНК-лигаза IV в комплексе с XRCC4катализирует окончательный этап негомологичного соединения (non-homologous end joining — NHEJ) двунитевых разрывов ДНК. Также требуется для V(D)J рекомбинации геновиммуноглобулинов.
Ранее выделяли ещё один тип лигаз — ДНК-лигазу II, которая позднее была признана артефактом выделения белков, а именно продуктом протеолиза ДНК-лигазы III[4].
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата(например, лактаза— фермент, участвующий в превращениилактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальномуpH(щелочная фосфатаза) или локализации в клетке (мембраннаяАТФаза).
Структура и механизм действия ферментов
Активность ферментов определяется их трёхмерной структурой[8].
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс.Третичная структурабелков разрушается при нагревании или воздействии некоторых химических веществ.
Активный центр ферментов
Изучение механизма химической реакции, катализируемой ферментом наряду с определением промежуточных и конечных продуктов на разных стадиях реакции подразумевает точное знание геометрии третичной структуры фермента, природы функциональных групп егомолекулы, обеспечивающих специфичность действия и высокую каталитическую активность на данныйсубстрат, а также химической природы участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Обычно молекулы субстрата, участвующие в ферментативных реакциях, по сравнению с молекулами ферментов имеют относительно небольшие размеры. Таким образом, при образовании фермент-субстратных комплексов в непосредственное химическое взаимодействие вступают лишь ограниченные фрагменты аминокислотной последовательности полипептидной цепи — «активный центр» — уникальная комбинация остатков аминокислот в молекуле фермента, обеспечивающая непосредственное взаимодействие с молекулой субстрата и прямое участие в акте катализа[9].
В активном центре условно выделяют[9]:
каталитический центр — непосредственно химически взаимодействующий с субстратом;
связывающий центр (контактная или «якорная» площадка) — обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторовили ионов металлов.
Фермент, соединяясь с субстратом:
очищает субстрат от водяной «шубы»
располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
подготавливает к реакции (например, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствие фермента:
В присутствии фермента:
А+Ф = АФ
АФ+В = АВФ
АВФ = АВ+Ф
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. Например, реакции синтеза биополимеровчасто сопрягаются с реакциейгидролизаАТФ.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидазатрипсинразрывает пептидную связь только послеаргининаилилизина, если за ними не следует пролин, апепсингораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
В 1890 г. Эмиль Фишерпредположил, что специфичность ферментов определяется точным соответствием формы фермента и субстрата[10]. Такое предположение называется моделью «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. Однако, хотя эта модель объясняет высокую специфичность ферментов, она не объясняет явления стабилизации переходного состояния, которое наблюдается на практике.
Модель индуцированного соответствия
В 1958 г. Дениел Кошландпредложил модификацию модели «ключ-замок»[11]. Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Ещё один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин(протеаза, участвующая впищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется вподжелудочной железе. Неактивная форма транспортируется вжелудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавинилигем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Регуляция работы ферментов
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Ингибирование конечным продуктом
Метаболический путь — цепочка последовательных ферментативных реакций. Часто конечный продукт метаболического пути является ингибитором фермента, ускоряющего первую из реакций данного метаболического пути. Если конечного продукта слишком много, то он действует как ингибитор для самого первого фермента, а если после этого конечного продукта стало слишком мало, то первый фермент опять активируется. Таким образом, ингибирование конечным продуктом по принципу отрицательной обратной связи— важный способ поддержаниягомеостаза(относительного постоянства условий внутренней среды организма).
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме — давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.
Множественные формы ферментов
Множественные формы ферментов можно разделить на две категории:
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
Органные — ферменты гликолизав печени и мышцах.
Клеточные — малатдегидрогеназацитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа— 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются разными аллелями одного и того же гена.
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомахони подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
Изоферменты разные на генетическом уровне и отличаются от первичной последовательности, а истинные множественные формы становятся разными на посттрансляционном уровне.
Медицинское значение
Связь между ферментами и наследственными болезнями обмена веществ была впервые установлена А. Гэрродом[en]в 1910-е гг. Гэррод назвал заболевания, связанные с дефектами ферментов, «врожденными ошибками метаболизма».
Если происходит мутация в гене, кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина.Фенилкетонуриясвязана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
Практическое использование
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии и медицине. Большинство лекарств влияют на течение ферментативных процессов в организме, запуская или приостанавливая те или иные реакции.
Ещё шире область использования ферментов в научных исследованиях и в медицине.
studfiles.net
2. Специфичность ферментов
Различают два главных вида специфичности ферментов: СУБСТРАТНУЮ СПЕЦИФИЧНОСТЬ и СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
Специфичность действия — это способность фермента катализировать только определенный тип химической реакции.
Субстратная специфичность — это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента. Большинство ферментов высокоспецифично как к природе, так и к пути превращения субстрата. Специфичность к субстрату обусловлена комплементарностью структуры субстратсвязывающего центра фермента структуре субстрата.
Как показывает рис. 2, субстратсвязывающий участок по форме соответствует субстрату (геометрическое соответствие), более того, между аминокислотными остатками активного центра фермента и субстратом образуются специфические связи (гидрофобные, ионные и водородные), т.е. устанавливается электронное или химическое соответствие.
Связывание субстрата с активным центром фермента происходит многоточечно, с участием нескольких функциональных групп, которые далее могут участвовать в катализе.
Ферменты могут различаться по субстратной специфичности и обладать абсолютной специфичностью, т.е. действовать только на один субстрат и не взаимодействовать даже с очень близкими по строению молекулами (например, уреаза ускоряет гидролиз мочевины, но не действует на тиомочевину), или даже стереоспецифичностыо (когда фермент взаимодействует с определенным оптическим и геометрическим изомером).
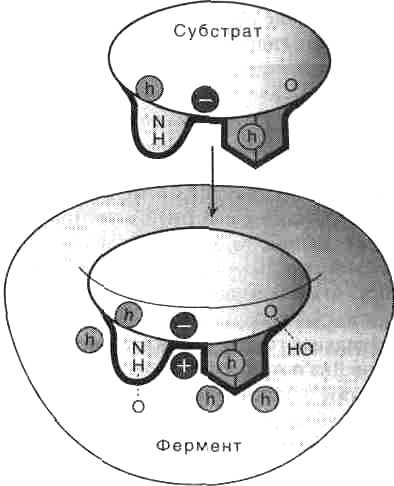
Рис. 2. Геометрическое и химическое соответствие (комплементарность) между ферментом и субстратом. h — гидрофобные группы, — водородные связи.
Некоторые ферменты проявляют более широкую специфичность (групповая или относительная специфичность) и взаимодействуют со многими веществами, имеющими похожую структуру (протеазы ускоряют гидролиз пептидных связей в белках, липазы ускоряют расщепление эфирных связей в липидах
Пример. Сериновые протеазы проявляют групповую специфичность к субстратам. Все они ускоряют гидролиз пептидных связей в белках, но, имея похожую структуру и каталитический механизм, различаются по субстратной специфичности.
В химотрипсине субстрат-связывающий участок представляет гидрофобный карман, который связывает радикалы ароматических аминокислот, таких, как фенилаланин. Этот фермент ускоряет гидролиз пептидных связей, образованных карбоксильной группой ароматических аминокислот. | В трипсине отрицательный заряд остатка аспарагиновой кислоты в активном центре участвует как в связывании аминогруппы лизина (или гуанидиновой группы аргинина), так и непосредственно в катализе, при котором разрывается пептидная связь, в образовании которой участвует карбоксильная группа положительно заряженных остатков Лиз и Apr. | В эластазе остатки валина и треонина, входящие в состав субстратсвязывающего центра, допускают связывание остатков аминокислот только с небольшими боковыми цепями, например, как у глицина. |
Рис. 3. Характеристика субстратсвязывающих центров сериновых протеаз. Стрелки — разрываемые связи в полипептидных цепях белков—субстратов. а — гидрофобный карман; б — ионная связь; в — небольшой гидрофобный карман.
Сравнительно недавно выявлена еще одна своеобразная черта в строении однокомпонентных ферментов: некоторые из них являются полифункциональными, т.е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Эта единая цепь при формировании третичной структуры образует несколько функционально и пространственно обособленных глобулярных участков — доменов, каждый из которых характеризуется своей каталитической активностью.
studfiles.net

