Атомно молекулярное учение урок – Разработка урока химии для 8 класса. Атомно
Разработка урока химии для 8 класса. Атомно
Тема2 .урок №5. Атомно – молекулярное учение.
Цели:
— Обобщить знания учащихся об атомах и молекулах; об атомно – молекулярном учении, опираясь на знания учащихся, полученных в курсе физики и химии;
— систематизировать знания учащихся о развитии и создании атомно-молекулярной теории, о работах учёных в области атомно-молекулярной теории;
— научить учащихся анализировать физические и химические явления и уметь объяснять их сущность с точки зрения атомно-молекулярного учения.
Оборудование: модели атомов, пк
Ход урока
I. Актуализация знаний
1.вводная часть
В течение нескольких уроков мы изучали тему «Первоначальные химические понятия». Оказалась ли она для вас интересной? Как вы считаете, смогут ли они вам пригодиться полученные знания в предыдущем? А сейчас мы с вами закрепим знания по данной теме.
2. повторение
Наука о веществах и их превращениях. (химия)
Служит для проведения опытов. (пробирка)
Определенный вид атомов. (химический элемент)
Условная символика химического элемента, где берется начальная буква с латинского названия элемента. (химический знак)
Вещества, состоящие из атомов одного вида (простые).
Вещества, состоящие из атомов разных видов (сложные).
Явления, при которых не происходит превращений одних веществ в другие (физические).
Явления, при которых происходит превращение одних веществ в другие (химические).
Всякое чистое вещество имеет постоянный состав, независимо от способа получения и местонахождения. (закон постоянства состава вещества)
- Кто сформулировал этот закон? (Пруст)
Что такое индекс? (цифра, обозначающая число атомов в молекуле)
Условная запись состава вещества с помощью химических знаков и индексов (химическая формула)
Материал, из которого изготовлена лабораторная посуда (стекло).
II. Изучение новой темы
Переходим к изучению новой темы. Тема связана с именем великого русского ученого М.В.Ломоносова. Заслушаем сообщение о жизни и деятельности замечательного ученого «Слово о Ломоносове».
Что мы можем сказать о М.В.Ломоносове? Кем он был?
Вывод: М.В.Ломоносов был естествоиспытателем, философом, поэтом, историком, географом, политическим деятелем, успешно работал с мозаикой.
Пушкин писал: «Он создал первый университет, он лучше сказать, сам был первым нашим университетом».
Фундамент научной химии был заложен в 17-18 вв. усилиями ученых разных стран: англичанина Р.Бойля, француза А.Лавуазье, русского М.В.Ломоносова. Первые представления о том, что вещество состоит из отдельных частиц, появились еще в глубокой древности. Некоторые философские школы древней Индии (1 тыс. до н.э.) признавали не только существование первичных неделимых частиц вещества, но и их способность соединяться друг с другом, образуя новые частицы.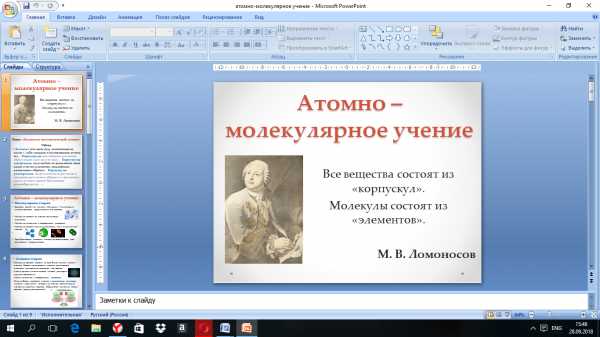
В 19 в . Развивали химическую атомистику труды Д.Дальтона (Англия), Ж.Пруста (Франция), А.Авогадро (Италия), Я.Берцелиуса (Швеция), А.М.Бутлерова, Д.И.Менделеева (Россия). Как и другие науки, химия интернациональна.
Основной теорией химии, сохранившей свое значение и до наших дней является атомно-молекулярное учение. Атомно-молекулярное учение – это учение, в основу которого положено представление о том, что наименьшими структурными единицами веществ являются атомы, молекулы и ионы.
Из атомов состоят:все металлы;
многие неметаллы (инертные газы, С, Si, B, Se, As, Te).
Из молекул состоят:
все органические вещества;
некоторые неорганические: простые газы (N2, H2, Cl2, F2), сложные (CO2, NO2, SO3, SO2).
Из ионов состоят:
В 1741 г. в одной из своих первых работ М.В.Ломоносов «Элементы математической химии» сформулировал важнейшие положения атомно-молекулярной теории.
Теперь прочитайте §8;
Изложите сущность основных положений атомно-молекулярного учения.
Давайте сделаем краткий вывод этих положений и запишем в тетради:
Все вещества состоят молекул.
Молекулы состоят из атомов.
Молекулы и атомы находятся в постоянном движении.
Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных – из разных.
Дополнили атомно-молекулярное учение открытия Гей-Люссака, А.Авогадро. Окончательно утвердилось лишь в 1860 г. в г.Карсруэ на Международном съезде химиков, где было дано определение атома и молекулы.
Атом – наименьшая частица химического элемента, сохраняющая все его свойства.
Молекула – наименьшая частица простого и сложного вещества, обладающая его химическими свойствами.
III. Домашнее задание: §8
IV.Закрепление
infourok.ru
Конспект урока «Атомно-молекулярное учение»
Тема урока: «Атомно – молекулярное учение»
Цель: систематизировать знания учащихся об атомах и молекулах, изучить основные положения атомно-молекулярного учения (АМУ). Продолжить формирование основных положений АМУ и на основе эксперимента подвести учащихся к выводу закона о сохранении массы веществ. Отметить важную роль М.В. Ломоносова в открытии закона. Показать научное и практическое значение этого закона.
Задачи урока:
Образовательные: сформировать знания учащихся об основных положениях атомно – молекулярного учения с учетом физических законов. На основе эксперимента рассмотреть закон сохранения массы веществ. Дать краткие сведения об истории открытия закона и научной деятельности ученых в этой области. Рассмотреть значимость этого закона в химии.
Развивающие: развить наблюдательность при просмотре компьютерной презентации и проведении демонстрационного эксперимента. Развить умение прогнозировать, обобщать и делать выводы. Используя эксперимент, рассмотреть важность закона сохранения массы веществ. Развить информационную культуру и логическое мышление учащихся.
Воспитательные:воспитать чувство патриотизма к Родине и русским ученым, таким как М. В. Ломоносов, который внес значимый вклад в развитие мировой науки.
Тип урока: комбинированный.
Оборудование к уроку:
— компьютер,
— мультимедийный проектор,
— программа для создания презентаций PowerPoint.
Реактивы и оборудование:
— настольные весы
— разновесы
— пробирка Ландольта
— раствор сульфата меди (II) — CuSO4
— раствор гидроксида натрия – NaOH
Ход урока:
«Однажды созданная материя не увеличивается и не уменьшается. Материя не возникает вновь и не исчезает, она может лишь подвергаться изменениям»
Аристотель.
Организационный момент
Учитель называет первую часть темы урока (слайд №1), перечисляет цели (слайд №2) и задачи (слайд №3) урока.
Актуализация знаний учащихся
— Фронтальный опрос
Что такое валентность?
Что называется химической связью?
Перечислите элементы, имеющие постоянную валентность.
Что такое индекс и что он обозначает?
Дайте определение химической формуле.
Перечислите порядок действий при составлении химических формул.
— Работа учащихся самостоятельно по вариантам
(ответы сверяют с ответами на слайде № 4)
Вариант №1
Определить неизвестную валентность элемента:
Сu2О; Н2S ; НgO ; Р2О5; Fe2O3
Составить формулу, зная валентности химических элементов:
II III I V I
СО; NH; NaO; РСl; ВО
3. Найти Мr (Р2О5)
Вариант №2
Определить неизвестную валентность элемента:
I
ZnS; Сu2S; ZnCl2; МgO; В2О3
2. Составить формулу, зная валентности хим. элементов:
I II V I
СuСl; LiO; AlO; РСl; КО
3. Найти Мr (Fe2О3)
Вариант №3
1. Определить неизвестную валентность элемента:
К2О; ZnO; N2О3; РbO2
2. Составить формулу, зная валентности хим. элементов:
I I IV
СаО; АlCl; RbO; NO
3. НайтиМr (Н2SO4)
Вариант №4
1. Определить неизвестную валентность элемента:
Аl2О3; НСl; СО; СО2; Fe2О3
2. Составить формулу, зная валентности хим. элементов:
I I V
AICl; ВаСl; NaO; CIO
3. Найти Мr (НNO2)
Вариант №5
1. Определить неизвестную валентность элемента:
Fe2О3 ; Мn2O5; СО; ZnCl2
2. Составить формулу, зная валентности хим. элементов:
V III I II III
РО; РН; AlCl; FeO; FeO;
3. Найти Мr (Н2СО
Вариант №6
1. Определить неизвестную валентность элемента:
КСl; MgCl2; Аl2O3; NO2; NO
2. Составить формулу, зная валентности хим. элементов:
I I V
КО; ВаCl; AlBr; NO; СаО
3. Найти Мr (НNO3)
Предъявление нового материала.
Атомно-молекулярное учение (слово учителя)
Представление о том, что вещество состоит из отдельных, очень малых частиц, — атомная гипотеза – возникло еще в Древней Греции. Однако создание научно обоснованного атомно-молекулярного учения стало возможным значительно позже – в ХVIII-XIX веках, когда физика стала базироваться на точном эксперименте. В химию количественные методы исследования были введены М. В. Ломоносовым во второй половине ХVIII века (слайд №5)
Михаил Васильевич Ломоносов родился 8 ноября 1711г. в деревне Мишанинской близ
с. Холмогоры Архангельской губернии в семье рыбака-помора. Обучившись чтению и письму, перечитывает все книги в деревни. Огромная любознательность и страстная тяга к знанию побудили его в возрасте 19 лет покинуть родную деревню. Зимой 1730 г. Ломоносов пешком и почти без денег отправляется в Москву, где добился зачисления Славяногреколатинскую академию – единственное в то время в Москве высшее учебное заведение.
Блестящие способности и упорный труд позволили Ломоносову за четыре года пройти программу семи классов академии. В числе двенадцати лучших учеников он был переведен в Петербург для обучения при Академии наук.
Меньше чем через год после переезда Петербург Ломоносов был направлен за границу для изучения металлургии и горного дела. В 1741г. после возвращения на родину Ломоносов был назначен адъюнктом Академии по физическому классу, а вскоре стал профессором химии и членом Российской Академии наук.
Ломоносов принадлежал к числу тех редких, исключительно одаренных натур, научные идеи которых на многие десятилетия опережают свою эпоху. Его кипучая научная деятельность отличалась поразительной широтой разносторонностью. По словам академика Вавилова: «Достигнутое им одним в областях физики, химии, астрономии, приборостроения, геологии, географии, языкознания, истории достойно было деятельности целой академии.
Ломоносов впервые определил химию как науку «об изменениях, происходящих в смешанном теле». И считал своей «главной профессией» химию, но в то же время был первым замечательным русским физиком. Ясно представляя необходимость тесной связи между химией и физикой, он считал, что химию следует изучать при помощи физики и что химические анализы могут получить правильное истолкование только на основе физических законов. Применяя физику для объяснения химических явлений, Ломоносов заложил основы новой науки – физической химии.
Ломоносов был не только гениальным естествоиспытателем, но и философом.
(слово учителя).
Основы атомно-молекулярного учения впервые были изложены Ломоносовым в так называемой корпускулярной теории строения вещества.
Согласно представлениям Ломоносова, все вещества состоят из мельчайших «нечувствительных» частичек, физически неделимых и обладающих способностью взаимного сцепления. Более мелкие «элементы» (атомы), а более крупные — «корпускулы» (молекулы). Каждая корпускула имеет тот же состав, что и все вещество. Химически разные вещества имеют и разные по составу корпускулы. Существуют корпускулы однородные и разнородные. Причиной различия веществ Ломоносов считал не только различие в составе корпускул, но и различное расположение элементов в корпускуле.
Ломоносов подчеркнул, что корпускулы движутся согласно законам механики и сталкиваясь друг с другом изменяются. Поэтому химические превращения должны изучаться не только методами химии, но и методами физики и математики.
С тех пор прошло более 200 лет, когда жил и работал Ломоносов, его идеи о строении вещества прошли всестороннюю проверку, и их справедливость была полностью подтверждена.
В настоящее время на атомно-молекулярном учении базируются все наши представления о строении материи, о свойствах веществ и о природе физических и химических явлений. Так, например, теперь известно, что не все вещества состоят из молекул.
1.Существуют вещества с молекулярным и немолекулярным строением. (Слайд № 6-7)
2.Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки еще меньше, поэтому они почти не сжимаются. (Слайд №8)
3.Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры, чем выше температура, тем выше скорость движения молекул. (Слайд №9)
4.Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей – в газах. (Слайд № 9)
5.Атомы одного вида отличаются от атомов другого вида массой и свойствами. (Слайд № 9)
6.При физических явлениях молекулы сохраняются, а при химических, как правило, разрушаются. (Слайд № 10)
7.У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток находятся молекулы. Связи между молекул слабые и при нагревании разрушаются. Поэтому вещества с молекулярным строением имеют низкие температуры плавления. (Слайд № 11)
8.У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых потребуется много энергии. Поэтому эти вещества имеют высокие температуры плавления.
(Слайд №12)
3. Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения (слово учителя).
Физические и химические явления получают объяснения с позиций атомно-молекулярного учения. Так, например, процесс диффузии, объясняется способностью молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
(Слайд №13)
2.Закон сохранения массы веществ. (Слайд № 14)
На основе атомно-молекулярного учения приходим к выводу, что сущность химических реакций заключается в разрушении химической связи между атомами одних веществ и в перегруппировке атомов с образованием других веществ. Атомы при химических реакциях сохраняются, значит должна сохраняться и масса каждого из них в отдельности, следовательно, должна сохраняться и масса всех атомов вместе взятых. А значит, что продукты любых химических реакций должны весить столько же, сколько весили исходные вещества. Но, лучше один раз увидеть, чем сто раз услышать. Необходимо провести опыт, доказывающий наш вывод.
(Учащиеся записывают название опыта и выводы в тетрадях).
Опыт № 1.
Сливание растворов в сосуде Ландольта и их взвешивание до и после опыта.
(Учитель демонстрирует опыт)
В одном колене пробирки Ландольта налит раствор сульфата меди, а в другом — раствор гидроксида натрия (растворы наливаются очень осторожно и пробирка плотно закрывается). Перед тем, как провести опыт необходимо взвесить пробирку на весах.
Вопрос: что необходимо сделать для того чтобы произошла реакция?
Вопрос: какие признаки реакции вы увидели?
Произошла химическая реакция (образовался красивый голубой осадок), значит произошла перегруппировка атомов.
Вопрос: а изменилась ли масса получившихся веществ?
Проводим взвешивание пробирки.
Вопрос: какой вывод можно сделать?
На основе увиденного опыта делаем вывод.
Вывод: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции. (Слайд № 15)
Вывод является формулировкой закона сохранения массы веществ.
Положение, которое звучит так: «Все изменяется, но ничто не исчезает» принималось за аксиому уже 500 лет до н.э. Оно в течение долгого времени сопутствовало человечеству, как умозаключение. Аристотель писал: «Однажды созданная материя не увеличивается и не уменьшается. Материя не возникает вновь и не исчезает, она может лишь подвергаться изменениям». Мысль о сохранении вещества высказывается в трудах многих ученых. Но все они его принимали за гипотезу, не подтверждая опытами.
Одним из первых ученых, поставивших опыты, был знаменитый английский химик Роберт Бойль (имя записывается на доске и в тетради), прокаливает металл. Он их взвешивал до и после нагревания, но масса металла становила больше. Основываясь на этих опытах, он не учёл роль воздуха. Бойль сделал вывод, что масса веществ в результате химической реакции изменяется, что было неправильно. Он говорил, что есть «какая-то огненная материя», которая при нагревании металла соединяет с ним, и за счёт этого увеличивается масса.
В отличие от Роберта Бойля М. В. Ломоносов, (имя записывается на доске и в тетради) прокаливал металл в запаянных ретортах, взвешивал их до и после прокаливания, масса оставалась неизменной. Ломоносов сделал вывод, что при прокаливании к металлам присоединяется какая-то часть воздуха. Результаты своих опытов он сформулировал так: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупляется к другому. Так, еже ли где убудет материи, то умножиться в другом месте; сколько часов положит кто на бдение, столько же сну отнимает…». Эту формулировку Ломоносов дал в 1748 году.
В настоящее время этот закон звучит так: «Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции».
Естественно, не только Ломоносов думал над этой проблемой. Независимо от него, но чуть позже, в 1789 году закон сохранения массы веществ был установлен французским химиком Антуаном Лораном Лавуазье (имя записывается на доске и в тетради).
Открытие закона нанесло серьезный удар флагистонной теории и религии.
Способствовало дальнейшему развитию химии, как науки.
На основе этого закона проводят практически важные расчеты.
На основе закона сохранения массы веществ составляют уравнения химических реакций.
Закрепление.
Перечислите основные положения атомно-молекулярного учения.
Кем и когда был открыт закон сохранения массы веществ?
Назовите имена ученых, которые причастны к открытию закона.
Дайте определение закону сохранения массы веществ.
Задача: При разложение 44,4 г малахита образуется 32 г СuO и 3,6 г воды Н2О. Какая масса углекислого газа СО2 образуется? (Слайд № 20)
Дано: Решение:
m (малахита)=44,4 г Т.к. по закону сохранения массы веществ, масса вступивших
веществ равна
m (H2O)=3,6 г массе образовавшихся.
m (СuO)=32 г m (малахита)= m (СO2)+ m (H2O)+ m (СuO)
Отсюда следует, что: m (СO2)= m (малахита)- m (СuO) — m(H2O)
m (СO2)= 44,4-32-3,6=8,8 г
m (СO2)= ? Ответ: m (СO2)= 8,8 г
Задача. При нагревании Ag2O образовалось 43,2 г Ag и 3,2 г O2. Какая была масса разложившегося оксида? (Слайд № 21)
Домашнее задание.(Слайд № 21)
§ 13-14, ст. 33 ( вопросы 8-12), ст. 42 ( вопросы 1-3)
Рефлексия.
infourok.ru
Методическая разработка по химии (8 класс) на тему: Разработка урока по теме «Атомно-молекулярное учение. Закон сохранения массы веществ»
Тема урока: «Атомно – молекулярное учение. Закон сохранения массы веществ».
Цель: систематизировать знания учащихся об атомах и молекулах, изучить основные положения атомно-молекулярного учения (АМУ). Продолжить формирование основных положений АМУ и на основе эксперимента подвести учащихся к выводу закона о сохранении массы веществ. Отметить важную роль М.В. Ломоносова в открытии закона. Показать научное и практическое значение этого закона.
Задачи урока:
Образовательные: сформировать знания учащихся об основных положениях атомно – молекулярного учения с учетом физических законов. На основе эксперимента рассмотреть закон сохранения массы веществ. Дать краткие сведения об истории открытия закона и научной деятельности ученых в этой области. Рассмотреть значимость этого закона в химии.
Ход урока:
«Однажды созданная материя не увеличивается и не уменьшается. Материя не возникает вновь и не исчезает, она может лишь подвергаться изменениям»
Аристотель.
- Организационный момент
- Актуализация знаний учащихся
— Фронтальный опрос
- Что такое валентность?
- Перечислите элементы, имеющие постоянную валентность.
- Что такое индекс и что он обозначает?
- Дайте определение химической формуле.
— Работа учащихся самостоятельно по вариантам
Вариант №1 (Березин 8а, Зайченко 8 б)
- Определить неизвестную валентность элемента:
Сu2О; Н2S ; НgO ; Р2О5; Fe2O3
- Составить формулу, зная валентности химических элементов:
II III I V I
СО; NH; NaO; РСl; ВО
3. Найти Мr (Р2О5)
Вариант №2 (Воробьев, 8а, Кузнецова 8б)
- Определить неизвестную валентность элемента:
I
ZnS; Сu2S; ZnCl2; МgO; В2О3
2. Составить формулу, зная валентности хим. элементов:
I II V I
СuСl; LiO; AlO; РСl; КО
3. Найти Мr (Fe2О3)
Вариант №3 (Днепровский 8а, Теремков 8 б)
1. Определить неизвестную валентность элемента:
К2О; ZnO; N2О3; РbO2
2. Составить формулу, зная валентности хим. элементов:
I I IV
СаО; АlCl; RbO; NO
3. НайтиМr (Н2SO4)
Вариант №4 (Зайцев 8а, Таржимина 8б)
1. Определить неизвестную валентность элемента:
Аl2О3; НСl; СО; СО2; Fe2О3
2. Составить формулу, зная валентности хим. элементов:
I I V
AICl; ВаСl; NaO; CIO
3. Найти Мr (НNO2)
Вариант №5 (Кузько 8а, Гордиенко 8б)
1. Определить неизвестную валентность элемента:
Fe2О3 ; Мn2O5; СО; ZnCl2
2. Составить формулу, зная валентности хим. элементов:
V III I II III
РО; РН; AlCl; FeO; FeO;
3. Найти Мr (Н2СО3)
Вариант №6 (Павлов 8а, Губина 8б)
1. Определить неизвестную валентность элемента:
КСl; MgCl2; Аl2O3; NO2; NO
2. Составить формулу, зная валентности хим. элементов:
I I V
КО; ВаCl; AlBr; NO; СаО
3. Найти Мr (НNO3
- Предъявление нового материала.
- Атомно-молекулярное учение
Представление о том, что вещество состоит из отдельных, очень малых частиц, — атомная гипотеза – возникло еще в Древней Греции. Однако создание научно обоснованного атомно-молекулярного учения стало возможным значительно позже – в ХVIII-XIX веках, когда физика стала базироваться на точном эксперименте. В химию количественные методы исследования были введены М. В. Ломоносовым во второй половине ХVIII века
- Основные положения атомно-молекулярного учения
Основы атомно-молекулярного учения впервые были изложены Ломоносовым в так называемой корпускулярной теории строения вещества.
Согласно представлениям Ломоносова, все вещества состоят из мельчайших «нечувствительных» частичек, физически неделимых и обладающих способностью взаимного сцепления. Более мелкие «элементы» (атомы), а более крупные — «корпускулы» (молекулы). Каждая корпускула имеет тот же состав, что и все вещество. Химически разные вещества имеют и разные по составу корпускулы. Существуют корпускулы однородные и разнородные. Причиной различия веществ Ломоносов считал не только различие в составе корпускул, но и различное расположение элементов в корпускуле.
Ломоносов подчеркнул, что корпускулы движутся согласно законам механики и сталкиваясь друг с другом изменяются. Поэтому химические превращения должны изучаться не только методами химии, но и методами физики и математики.
С тех пор прошло более 200 лет, когда жил и работал Ломоносов, его идеи о строении вещества прошли всестороннюю проверку, и их справедливость была полностью подтверждена.
В настоящее время на атомно-молекулярном учении базируются все наши представления о строении материи, о свойствах веществ и о природе физических и химических явлений. Так, например, теперь известно, что не все вещества состоят из молекул.
1.Существуют вещества с молекулярным и немолекулярным строением.
2.Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки еще меньше, поэтому они почти не сжимаются.
3.Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры, чем выше температура, тем выше скорость движения молекул.
4.Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей – в газах.
5.Атомы одного вида отличаются от атомов другого вида массой и свойствами.
6.При физических явлениях молекулы сохраняются, а при химических, как правило, разрушаются
7.У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток находятся молекулы. Связи между молекул слабые и при нагревании разрушаются. Поэтому вещества с молекулярным строением имеют низкие температуры плавления.
8.У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых потребуется много энергии. Поэтому эти вещества имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения
Физические и химические явления получают объяснения с позиций атомно-молекулярного учения. Так, например, процесс диффузии, объясняется способностью молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
2.Закон сохранения массы веществ.
- Выполнение эксперимента
На основе атомно-молекулярного учения приходим к выводу, что сущность химических реакций заключается в разрушении химической связи между атомами одних веществ и в перегруппировке атомов с образованием других веществ. Атомы при химических реакциях сохраняются, значит должна сохраняться и масса каждого из них в отдельности, следовательно, должна сохраняться и масса всех атомов вместе взятых. А значит, что продукты любых химических реакций должны весить столько же, сколько весили исходные вещества. Но, лучше один раз увидеть, чем сто раз услышать. Необходимо провести опыт, доказывающий наш вывод.
Вывод: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции.
Вывод является формулировкой закона сохранения массы веществ.
- История открытия закона.
Положение, которое звучит так: «Все изменяется, но ничто не исчезает» принималось за аксиому уже 500 лет до н.э. Оно в течение долгого времени сопутствовало человечеству, как умозаключение. Аристотель писал: «Однажды созданная материя не увеличивается и не уменьшается. Материя не возникает вновь и не исчезает, она может лишь подвергаться изменениям». Мысль о сохранении вещества высказывается в трудах многих ученых. Но все они его принимали за гипотезу, не подтверждая опытами.
Одним из первых ученых, поставивших опыты, был знаменитый английский химик Роберт Бойль (имя записывается на доске и в тетради), прокаливает металл. Он их взвешивал до и после нагревания, но масса металла становила больше. Основываясь на этих опытах, он не учёл роль воздуха. Бойль сделал вывод, что масса веществ в результате химической реакции изменяется, что было неправильно. Он говорил, что есть «какая-то огненная материя», которая при нагревании металла соединяет с ним, и за счёт этого увеличивается масса.
В отличие от Роберта Бойля М. В. Ломоносов, (имя записывается на доске и в тетради) прокаливал металл в запаянных ретортах, взвешивал их до и после прокаливания, масса оставалась неизменной. Ломоносов сделал вывод, что при прокаливании к металлам присоединяется какая-то часть воздуха. Результаты своих опытов он сформулировал так: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупляется к другому. Так, еже ли где убудет материи, то умножиться в другом месте; сколько часов положит кто на бдение, столько же сну отнимает…». Эту формулировку Ломоносов дал в 1748 году.
В настоящее время этот закон звучит так: «Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции».
Естественно, не только Ломоносов думал над этой проблемой. Независимо от него, но чуть позже, в 1789 году закон сохранения массы веществ был установлен французским химиком Антуаном Лораном Лавуазье (имя записывается на доске и в тетради).
- Значение закона
- Открытие закона нанесло серьезный удар флагистонной теории и религии.
- Способствовало дальнейшему развитию химии, как науки.
- На основе этого закона проводят практически важные расчеты.
- На основе закона сохранения массы веществ составляют уравнения химических реакций.
- Закрепление.
- Фронтальная беседа
- Перечислите основные положения атомно-молекулярного учения.
- Кем и когда был открыт закон сохранения массы веществ?
- Назовите имена ученых, которые причастны к открытию закона.
- Дайте определение закону сохранения массы веществ.
- Решение задач на закон сохранения массы веществ
Задача: При разложение 44,4 г малахита образуется 32 г СuO и 3,6 г воды Н2О. Какая масса углекислого газа СО2 образуется? (Слайд № 20)
Дано: Решение:
m (малахита)=44,4 г Т.к. по закону сохранения массы веществ, масса вступивших
веществ равна
m (h3O)=3,6 г массе образовавшихся.
m (СuO)=32 г m (малахита)= m (СO2)+ m (h3O)+ m (СuO)
Отсюда следует, что: m (СO2)= m (малахита)- m (СuO) — m(h3O)
m (СO2)= 44,4-32-3,6=8,8 г
m (СO2)= ? Ответ: m (СO2)= 8,8 г
Задача. При нагревании Ag2O образовалось 43,2 г Ag и 3,2 г O2. Какая была масса разложившегося оксида? (Слайд № 21)
- Домашнее задание.(Слайд № 21)
§ 13-14, стр 42 ( вопросы 1-3)
nsportal.ru
| 2 12 мин | Актуализация опорных ЗУН | Вопросы к учащимся:
работа со слайдом №2 Дается задание учащимся распределить карточки по понятиям “тело” и “вещество” Вопросы к учащимся
работа со слайдом №3 Дается задание учащимся распределить карточки по понятиям “простое вещество” и “сложное вещество” работа со слайдом №3 Дается задание учащимся распределить карточки по понятиям “атом” и “молекула” Вопросы к учащимся:
работа со слайдом №4 Дается задание учащимся распределить карточки по понятиям “физическое и химическое явление” | Учащиеся дают определения названным
понятиям Работа в парах по заполнению верхнего левого сектора карты учащегося Учащиеся дают определения названным понятиям Учащиеся дают определения смысла химической формулы Работа в парах по заполнению верхнего правого сектора карты учащегося Работа в парах по заполнению нижнего левого сектора карты учащегося Учащиеся дают определения понятиям “физическое и химическое явление” Работа в парах по заполнению нижнего правого сектора карты учащегося | 3 12 мин | Знакомство с историей развития АМУ | Учащихся просят перевернуть карточки,
разложенные на поле и ответить на вопрос “Что
получилось при перевороте?” Предлагается парам ознакомиться с полученным текстом самостоятельно. Учитель индивидуально консультирует пары, если есть необходимость. Выстраивание событий в хронологическом порядке. работа со слайдом №5 | Работа в парах по составлению текста на
оборотной стороне карты учащегося При правильном выполнении предыдущих заданий, перевернув карточки, учащиеся получают один из фрагментов истории развития АМУ Индивидуальная работа по прочтению и осмыслению получившегося текста Каждая группа озвучивает свой фрагмент, при этом она должна показать: Способность пересказать главное Выстраивание общей картины развития АМУ | 6 4 мин | Информация о домашнем задании Рефлексия | Параграф №13 упр 1 и 2 после параграфа Демонстрация “Подарка” ученика за активную работу на занятии, напутствие и заключительный слайд презентации | Позитивное настроение учащихся |
xn--i1abbnckbmcl9fb.xn--p1ai
Урок по химии: «Атомно-молекулярное учение»
Урок
Дата: Класс: 8
Тема урока: «Атомно – молекулярное учение».
Цель: систематизировать знания учащихся об атомах и молекулах, изучить основные положения атомно-молекулярного учения (АМУ). Продолжить формирование основных положений АМУ и на основе эксперимента подвести учащихся к выводу закона о сохранении массы веществ. Отметить важную роль М.В. Ломоносова в открытии закона. Показать научное и практическое значение этого закона.
Задачи урока:
Образовательные: сформировать знания учащихся об основных положениях атомно – молекулярного учения с учетом физических законов. На основе эксперимента рассмотреть закон сохранения массы веществ. Дать краткие сведения об истории открытия закона и научной деятельности ученых в этой области. Рассмотреть значимость этого закона в химии.
Развивающие: развить наблюдательность при просмотре компьютерной презентации и проведении демонстрационного эксперимента. Развить умение прогнозировать, обобщать и делать выводы. Используя эксперимент, рассмотреть важность закона сохранения массы веществ. Развить информационную культуру и логическое мышление учащихся.
Воспитательные:воспитать чувство патриотизма к Родине и русским ученым, таким как М. В. Ломоносов, который внес значимый вклад в развитие мировой науки.
Тип урока: комбинированный.
Ход урока:
Организационный момент
Учитель называет первую часть темы урока (слайд №1), перечисляет цели и задачи урока.
Актуализация знаний учащихся
— Фронтальный опрос
Что такое валентность?
Что называется химической связью?
Перечислите элементы, имеющие постоянную валентность.
Что такое индекс и что он обозначает?
Дайте определение химической формуле.
Перечислите порядок действий при составлении химических формул.
— Работа учащихся самостоятельно по вариантам
(ответы сверяют с ответами на слайде № 2
Изучение нового материала.
Атомно-молекулярное учение (слово учителя)
Представление о том, что вещество состоит из отдельных, очень малых частиц, — атомная гипотеза – возникло еще в Древней Греции. Однако создание научно обоснованного атомно-молекулярного учения стало возможным значительно позже – в ХVIII-XIX веках, когда физика стала базироваться на точном эксперименте. В химию количественные методы исследования были введены М. В. Ломоносовым во второй половине ХVIII века (слайд №5)
(слово учителя).
Основы атомно-молекулярного учения впервые были изложены Ломоносовым в так называемой корпускулярной теории строения вещества.
Согласно представлениям Ломоносова, все вещества состоят из мельчайших «нечувствительных» частичек, физически неделимых и обладающих способностью взаимного сцепления. Более мелкие «элементы» (атомы), а более крупные — «корпускулы» (молекулы). Каждая корпускула имеет тот же состав, что и все вещество. Химически разные вещества имеют и разные по составу корпускулы. Существуют корпускулы однородные и разнородные. Причиной различия веществ Ломоносов считал не только различие в составе корпускул, но и различное расположение элементов в корпускуле.
Ломоносов подчеркнул, что корпускулы движутся согласно законам механики и сталкиваясь друг с другом изменяются. Поэтому химические превращения должны изучаться не только методами химии, но и методами физики и математики.
С тех пор прошло более 200 лет, когда жил и работал Ломоносов, его идеи о строении вещества прошли всестороннюю проверку, и их справедливость была полностью подтверждена.
В настоящее время на атомно-молекулярном учении базируются все наши представления о строении материи, о свойствах веществ и о природе физических и химических явлений. Так, например, теперь известно, что не все вещества состоят из молекул.
1.Существуют вещества с молекулярным и немолекулярным строением. (Слайд № 6-7)
2.Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки еще меньше, поэтому они почти не сжимаются. (Слайд №8)
3.Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры, чем выше температура, тем выше скорость движения молекул. (Слайд №9)
4.Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей – в газах. (Слайд № 9)
5.Атомы одного вида отличаются от атомов другого вида массой и свойствами. (Слайд № 9)
6.При физических явлениях молекулы сохраняются, а при химических, как правило, разрушаются. (Слайд № 10)
7.У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решеток находятся молекулы. Связи между молекул слабые и при нагревании разрушаются. Поэтому вещества с молекулярным строением имеют низкие температуры плавления. (Слайд № 11)
8.У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых потребуется много энергии. Поэтому эти вещества имеют высокие температуры плавления.
(Слайд №12)
3. Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения (слово учителя).
Физические и химические явления получают объяснения с позиций атомно-молекулярного учения. Так, например, процесс диффузии, объясняется способностью молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
(Слайд №13)
Закрепление.
Домашнее задание.
§
Рефлексия.
infourok.ru
Урок химии по теме Атомно-молекулярное учение
Конспект урока по химии 8 класса
Атомно-молекулярное учение
Борисова Ольга Дмитриевна,
педагог дополнительного образования
Цели и задачи урока
Сегодня вы познакомитесь с основными положениями атомно-молекулярного учения и выясните его значение для науки химии.
Атомы и молекулы
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. Во многих случаях атомы не существуют по одиночке, а объединяются в группы – молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике. Осознать значение числа радиуса атомного ядра очень сложно. Например, радиус атома углерода равен 1,5–10 м. Возьмите карандаш (графит – это углерод), проведите отрезок прямой линии длиной 3 см.
Как вы думаете, сколько атомов углерода содержится в проведенной вами линии? Полученная линия содержит 100 мл атомов углерода в длину и около 1 мл в ширину.
Рассмотрим пример с сахаром: Какими свойствами обладает сахар? Представим, что крупинки сахара это молекулы. Раздробим молекулы до атомов. А сейчас смотрим, мы размельчили наши «молекулы», свойства сахара изменились? Какой вывод мы можем сделать? Какое определение вы дадите молекуле и атому с химической точки зрения.
Атом (от греч. atomos – неделимый) – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Атом сохраняется во всех химических превращениях и является носителем свойств химического элемента.
Вид атомов с одинаковым зарядом ядра и идентичными химическими свойствами называется химическим элементом. В настоящее время известно более 110 химических элементов, 89 из которых встречаются в природе, остальные получены искусственным путем.
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей. Молекула сохраняет все свойства данного вещества.
И молекул и атомов не видно даже под микроскопом, но они реально существуют.
Однако подобные представления о строении вещества сформировались много веков назад, когда человечество пыталось ответить на вопрос: можно ли из одного вещества в процессе химических превращений получить какое угодно другое вещество или в этом имеются определенные ограничения?
Поскольку увидеть устройство вещества невозможно, то ученые стали создавать модели (помните, мы тоже пытались представить себе невидимый объект?).
Итак, модель 1 — Аристотеля (384-322 гг. до н.э.): огонь, вода, воздух и земля — неделимые элементы, которые могут превращаться друг в друга, а также соединяться, образуя новые более сложные тела. Соединение элементов с противоположными свойствами невозможно (земля и воздух, огонь и вода). Иными словами, из одного вещества можно получить любое другое, главное — подобрать соответствующие условия!
Модель 2 — Демокрита (460 — 370 гг. до н.э.): вещество нельзя делить до бесконечности пополам. Предел такого деления — атом (греч. atomos — неделимый). Благодаря особенностям своей формы и размера, они могут объединяться, образуя вещества. Иными словами, из одного вещества невозможно получить какое угодно другое вещество.
М.В.Ломоносов
Модель Аристотеля просуществовала много веков, модель Демокрита забыли довольно быстро, поскольку не могли найти доказательств существования атомов. Несколько поколений ученых посвятили свои исследования экспериментальному доказательству атомно-молекулярного строения вещества, в том числе и наш соотечественник М.В.Ломоносов (1711-1765).
В результате была сформулирована атомно-молекулярная теория, основными положениями которой пользуются до сих пор и физики, и химики:
1. Вещества состоят из молекул.
2. Между молекулами есть промежутки.
3. Молекулы находятся в постоянном движении.
4. Молекулы состоят из атомов.
5. В ходе химических реакций атомы не изменяются (не делятся).
Атомно-молекулярное учение имеет исключительное значение для развития науки. Считают, что химия действительно стала наукой в то время, когда химические реакции стали истолковывать с точки зрения атомно-молекулярного учения.
Более двухсот лет назад М.В. Ломоносов объявил изучение строения вещества главной задачей химии. За это время его идеи о строении вещества прошли всестороннюю проверку, и их справедливость была полностью подтверждена.
Значение атомно-молекулярного учения состоит в том, что на нем базируются современные научные представления о строении материи, о свойствах веществ, о природе физических и химических явлений.
Атомно-молекулярное учение, превратившись из догадок и предположений в научную теорию, является мощным инструментом для правильной трактовки самых разнообразных явлений природы.
Выводы:
Атомно-молекулярное учение – это теоретическая основа химии.
Атомно-молекулярное учение сложилось из атомного и молекулярного учений.
Основные положения атомно-молекулярного учения сформулированы М.В. Ломоносовым.
Закрепление
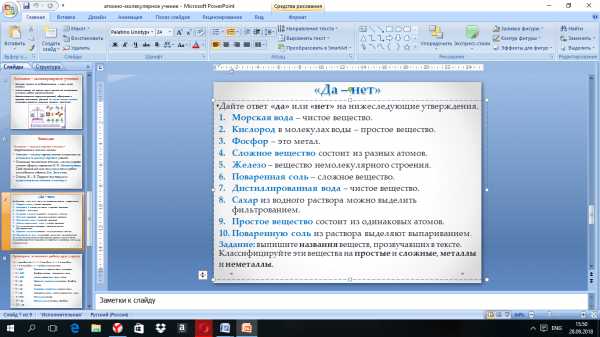
1. Укажите формулу вещества, отличающуюся от других(лишнее):
N2
Cl2
Р
О2
2. Укажите формулу вещества, отличающуюся от других:
HCl
H2О
H2
HNO3
3. Какие эксперименты иллюстрируют основные положения атомно-молекулярной теории?
infourok.ru
Разработка урока для 8 класса по теме Атомно-молекулярное учение
Тема 2 .урок №5. Атомно – молекулярное учение.
Цели:
— обобщить знания учащихся об атомах и молекулах;
— дать представление об атомно – молекулярном учении, опираясь на знания учащихся, полученных в курсе физики и химии;
— систематизировать знания учащихся о развитии и создании атомно-молекулярного учения;
— научить учащихся анализировать физические и химические явления и уметь объяснять их сущность с точки зрения атомно-молекулярного учения.
— раскрытие роли работ М.В.Ломоносова, представителя российской науки, других ученых в становлении атомно-молекулярного учения
Оборудование: модели атомов, портреты ученых, стенд о М.В.Ломоносове в кабинете химии.
Ход урока
I. Актуализация знаний
1.вводная часть
Любуясь узором на стекле или глядя на снежинки, мы пытаемся понять как они устроены. Объяснить это можно только, зная внутреннее строение вещества. Мы сегодня этим и займемся, но сначала выясним, что вы помните из прошлых уроков.
2. повторение
А) проверка знания знаков химических элементов
— Учитель показывает карточки со знаками химических элементов, а учащиеся называют элементы.
AlBa
Na
Zn
Ca
Алюминий, барий, натрий, цинк, кальций и т.д.
— на доске написаны названия химических элементов, учащиеся выходят к доске и пишут знаки.
Б)фронтальный опрос
1. что такое химический знак?
2. что такое химическая формула?
3. что можно сказать о веществе по его химической формуле?
4. что такое атом? Молекула?
5. чем отличаются они друг от друга?
6. что такое химический элемент?
7. как взаимосвязаны понятия «химический элемент», «атом», «вещество»?
8. чем простое вещество отличается от сложного?
II. Изучение нового материала
История станоления атомно-молекулярного учения
Химия развивалась, появились представления об атомах, как мельчайших частицах вещества
Атом в переводе с греческого – «неделимый»
Далее химики определили понятие химического элемента – не могут быть разложены на другие простые вещества или превращаться в другие простые вещества. Для элементов были введены химические знаки. С развитием химии и открытием трех заков:
(- закон постоянства Ж.Л.Пруста;
— закон кратных отношений Д. Дальтона
— закон объемных отношений (для газов) Гей – Люссака) кроме понятия атом как носитель свойств элемента, вводится понятие молекулы – сложной частицы, состоящей из нескольких атомов, являющейся наименьшей частицей вещества, обладающей его химическими свойствами.
2.вклад М.В.Ломоносова ( сообщение ученика)

Михаил Васильевич Ломоносов в XVIII в. разработал учение
о молекулах и атомах:
• утверждал что тела в природе состоят из корпускул (молекул), в состав которых входят неделимые элементы (атомы).
• Многообразие веществ объяснял соединением разных атомов в молекулах и различным расположением атомов в них.
• Предполагал, что некоторые молекулы могут состоять из одинаковых атомов.
В 1741 г. Ломоносов в своем труде Элементы математической химии изложил мысли, которые, по существу, являются основой современного атомно-молекулярного учения. Он писал, что все изменения тел происходят посредством движения. В основе этого движения лежат элементы (под этим термином следует понимать атомы), которые, соединяясь между собой, образуют корпускулы (молекулы). Элемент (атом) есть часть тела, не состоящая из каких-либо меньших и отличных между собой тел. В основе учения Ломоносова также лежали умозрительные заключения.
«Атомно-молекулярное учение помогает составить правильное представление о веществах и их превращениях. Во тьме должны находиться физики и особливо химики, не зная внутреннего частиц строения» ,— писал М. В. Ломоносов.

3.труды Д.Дальтона — учитель
Дальнейшее развитие эта теория получила в трудах Д.Дальтона. В 1808 году английский химик Дальтон сформулировал атомистическую теорию.
• Утверждал, что все вещества состоят из атомов, мельчайших неделимых частиц, которые не могут быть ни созданы, ни уничтожены. Ввёл понятие атомного веса.
• Дальтон считал, что все атомы одного итого же элемента совершенно идентичны, например, имеют одинаковые массы.
• На основе химических законов (закон кратных отношений, закон эквивалентов и закон постоянства состава) создал атомистическую теорию, основанную на количественных соотношениях, возникающих при взаимодействии между химическими элементами. Основы используются до сих пор.
Открытие в XX веке изотопов и ядерных реакций внесло изменения в атомистическую теорию Дальтона.
4.основные положения атомно – молекулярного учения
А)учитель предлагает учащимся атомно – молекулярного учения побывать в роли ученых и самостоятельно сформулировать положения и записать их в тетрадь.
1. Каждое вещество состоит из мельчайших частиц ( Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
2. Молекулы находятся в постоянном движении.
3. Молекулы состоят из атомов ( Ломоносов назвал их элементами)..
4. Молекулы могут состоять как из одинаковых, так и различных атомов.
Б)Работа учащихся с учебником «Химия» Н.Е.Кузнецовой стр.40(прочитать материал на странице 40 и сравнить свои записи с текстом учебника и дополнить недостающее.
5. Выводы о значении атомно – молекулярного учения 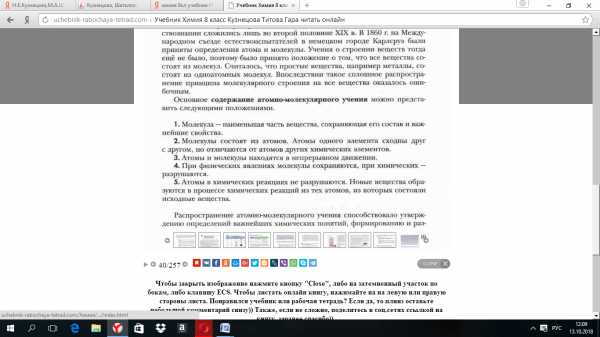
( учащиеся делают записи в тетрадях)
Атомно-молекулярное учение- теоретическая основа химии.
Основные положения атомно-молекулярного учения сформулированы М.В. Ломоносовым
. Свое признание оно получило после работ Дж. Дальтона.
Согласно атомно-молекулярному учению при химических реакциях молекулы разрушаются, а атомы сохраняются; в процессе реакции происходи перегруппировка атомов.
Атомно-молекулярное учение является фундаментальной научной теорией, подтверждающей древнейшую научную идею — дискретность материи. Положения данного учения можно использовать для объяснения физических, химических, биологических и других природных явлений.
III.Подведение итогов урока
Что нового вы узнали сегодня ?
– Можно ли считать, что ваши цели на урок достигнуты?
– Оцените свою деятельность на уроке, дайте оценку полученным знаниям, их значимости в дальнейшей деятельности.
Я понял, что …
Я научился …
Мне необходимо..
Можно использовать смайлики.

IV. Домашнее задание § 8, вопрос №3 стр.41
infourok.ru

