Химические свойства классов неорганических соединений таблица: Таблица «Химические свойства неорганических веществ»
Таблица-памятка в цвете «Основные классы неорганических соединений (классификация и химические свойства)» | Учебно-методический материал по химии (8, 9, 10, 11 класс) на тему:
Опубликовано 11.10.2016 — 12:29 — Зоткова Юлия Анатольевна
данный материал служит помощью, «шпаргалкой» при подготовке к ЕГЭ по химии,а также на уроках химии в любом классе. Таблички выполнены в цвете,что позволяет зрительно запомнить материал. Все, что связано с неметаллами выделено красным цветом, с металлами — синим, с солями- зеленым.
Скачать:
Предварительный просмотр:
Оксиды
Основные (Ме) CuO | Кислотные (Неме) CO2 | Амфотерные ZnO/BeO AL2O3/Fe2O3/Cr2O3 | Несолеобразующие CO/NO/N2O |
Химические свойства
Основные | Кислотные |
С водой | |
Первые пять в ряду напряжений металлов | Все, кроме SiO2 (песок) |
Получаем щелочь Na2O+h3O=NaOH | Получаем кислоту CO2+h3O=h3CO3 |
С кислотными оксидами | С основными оксидами |
Получаем соль Na2O+CO2=Na2CO3 | |
С кислотами | С щелочами |
Получаем соль | |
Na2O+2HCL=2NaCL+h3O | NaOH+CO2=Na2CO3+ h3O |
Оксиды не вступают в реакции обмена, на ионы не диссоциируют!
Основания
Растворимые | Нерастворимые |
Щелочи |
Химические свойства
| NaOH+CL2= NaCL+NaCLO3+h3O | Три продукта |
| NaOH+CO2=Na2CO3+ h3O | Соль +вода |
| NaOH+HCL=NaCL+h3O | Соль +вода |
| 2NaOH+CuCL2=2NaCL+Cu(OH)2 | Соль+ гидроксид |
| Cu(OH)2=CuO+h3O | Оксид +вода |
Одноосновные | Двухосновные | Трехосновные |
HCL | h3SO4 | h4PO4 |
HNO3 | h3SO3 | |
HNO2 | h3S | |
HI | h3CO3 | |
HBr | h3SiO3 | |
HF |
Кислоты
Бескислородные | Кислородсодержащие |
HF | h3SiO3 |
HBr | h3CO3 |
HCL | h3SO3 |
HI | h3SO4 |
h3S | h4PO4 |
HNO3 | |
HNO2 |
Сильные | Слабые |
h3SO4 | HF |
HNO3 | h3SiO3 |
HBr | h3CO3=СО2+h3O |
HCL | h3SO3=SO2+h3O |
HI | h3S |
h4PO4 | |
HNO2 |
Химические свойства
С металлами | Стоящими до Н в ряду напряжений металлов | 2НCL+Zn=ZnCL2+h3 HCL+Cu= нельзя! | Металл растворяется, образуется соль и водород (шипение)! |
С оксидами металлов | Со всеми | 2НCL+ZnO=ZnCL2+h3O | Оксид растворяется, газ не выделяется! |
С гидроксидами металлов | Со всеми | 2НCL+Zn(OH)2=ZnCL2+2h3O | Реакция нейтрализации |
С солями | Более сильная кислота вытесняет менее сильную из ее соли | 2HCL+CaCO3=CaCL2+h3O+CO2 CaCL2+h3CO3= нельзя! |
Концентрированная серная кислота и азотная кислота любой концентрации образуют с металлами : соль, воду и третий продукт в зависимости от активности металла!!!
Соли
Средние (нормальные) | Кислые | Основные | Комплексные | Гидраты | Двойные |
Na2CO3 | NaHCO3 | (CuOH)2CO3 | Na[AL(OH)4] | CuSO4*5h3O | NaCL*KCL |
Химические свойства
Большинство реакций солей проходят в растворах!!
С кислотами | 2HCL+CaCO3=CaCL2+h3O+CO2 CaCL2+h3CO3= нельзя! | Более сильная кислота вытесняет менее сильную из ее соли! | ||
С щелочами | 2NaOH+CuCL2=2NaCL+Cu(OH)2 | С нерастворимыми гидроксидами реакция не идет! | ||
С металлами | Zn+CuSO4=ZnSO4+Cu Cu+ZnSO4= нельзя! | Более активный металл вытесняет менее активный из раствора ее соли! | ||
С неметаллами | ZnBr2+CL2=ZnCL2+Br2 | Более активный галоген вытесняет менее активный | ||
Разложение | ||||
Нитраты | Активных металлов= нитрит, кислород | Металлов средней активности (включая медь!)= оксид, NO2,кислород | Неактивных металлов= металл, NO2, кислород | |
Соли аммония | Разлагаются без твердого остатка | |||
Карбонаты | Разлагаются с выделением СО2 | |||
Амфотерные соединения
Растворяются и в кислотах, и в щелочах!
Металл | Оксиды и гидроксиды металлов | ||
В растворах (+Н2О) | |||
Al+NaOH=Na[AL(OH)4]+h3 Zn+NaOH=Na2[Zn(OH)4]+h3 | Водород выделяется | Al2O3+NaOH=Na[AL(OH)4] Zn(OH)2+NaOH=Na2[Zn(OH)4] | Водород не выделяется |
В расплавах (при температуре) | |||
Образуются соли | |||
Al+NaOH=NaALO2+h3 Zn+NaOH=Na2ZnO2+h3 | Al2O3+NaOH=NaALO2+h3O Zn(OH)2+NaOH=Na2ZnO2+h3O | ||
По теме: методические разработки, презентации и конспекты
Важнейшие классы неорганических соединений, способы их получения и химические свойства.
 Оксиды.
Оксиды.Особенности программы под редакцией Новошинского И. И. состоят в нетрадиционном подходе к изложению материала (от простого к сложному, от общего к частному). В основе программы лежит идея зависи…
Важнейшие классы неорганических соединений, способы их получения и химические свойства. Основания.
Особенности программы под редакцией Новошинского И. И. состоят в нетрадиционном подходе к изложению материала (от простого к сложному, от общего к частному). В основе программы лежит идея зависи…
Важнейшие классы неорганических соединений, способы их получения и химические свойства. Соли.
Ресурс предназначен для учителей химии, работающих по программе И.И.Новошинского, по которой важнейшие классы изучаются в 2 этапа. Если Вы работаете по другой программе можно объеденить 2 презентации …
Важнейшие классы неорганических соединений, способы их получения и химические свойства. Кислоты..
Этой презентацией я заканчиваю публикации по важнейшим классам неорганических соединений. Эта презентация 2го этапа изучения класса кислот, первая была размещена ранее. Дополненна гиперссылками на рес…
Эта презентация 2го этапа изучения класса кислот, первая была размещена ранее. Дополненна гиперссылками на рес…
Контрольная работа. Неорганические соединения и их химические свойства.
Раздаточный материал на контрольную работу….
тест по теме «Классификация и свойства основных классов неорганических соединений»
Тест по химии для 11 класса…
Основные классы неорганических соединений: классификация, номенклатура, свойства
Тема «Основные классы неорганических соединений» является одной из важнейших. Так как многие учащиеся испытывают трудности при запоминании такого объемного материала, то он был собран в таблицу-шпарга…
Поделиться:
Химические свойства основных классов неорганических соединений. Оксиды, кислоты, основания, соли
Кислотные оксиды
- Кислотный оксид + вода = кислота (исключение — SiO2)
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4 - Кислотный оксид + щелочь = соль + вода
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O - Кислотный оксид + основный оксид = соль
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH- Основный оксид + кислота = соль + вода
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O - Основный оксид + кислотный оксид = соль
MgO + CO2 = MgCO3
Na2O + N2O5 = 2NaNO3
 Классификация, получение, свойства. Часть I
Классификация, получение, свойства. Часть I
Амфотерные оксиды
- Амфотерный оксид + кислота = соль + вода
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O - Амфотерный оксид + щелочь = соль (+ вода)
ZnO + 2KOH = K2ZnO2 + H2O (Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O (Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]) - Амфотерный оксид + кислотный оксид = соль
ZnO + CO2 = ZnCO3 - Амфотерный оксид + основный оксид = соль (при сплавлении)
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
- Кислота + основный оксид = соль + вода
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O - Кислота + амфотерный оксид = соль + вода
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O - Кислота + основание = соль + вода
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O - Кислота + амфотерный гидроксид = соль + вода
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O - Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3 - Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб. ) + Fe = FeSO4 + H2
) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
- Амфотерный гидроксид + кислота = соль + вода
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2 - Амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O - Амфотерный гидроксид + щелочь = соль (в водном растворе)
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
- Щелочь + кислотный оксид = соль + вода
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O - Щелочь + кислота = соль + вода
3KOH + H 3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O - Щелочь + амфотерный оксид = соль + вода
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4]) - Щелочь + амфотерный гидроксид = соль (в водном растворе)
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4] - Щелочь + растворимая соль = нерастворимое основание + соль
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl - Щелочь + металл (Al, Zn) + вода = соль + водород
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
- Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3) - Растворимая соль + растворимая соль = нерастворимая соль + соль
Pb(NO3)2 + K2S = PbS + 2KNO3
СaCl2 + Na2CO3 = CaCO3 + 2NaCl - Растворимая соль + щелочь = соль + нерастворимое основание
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3 - Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Возможно, вам также будут интересны другие разделы справочника по химии:
- Методы получения основных классов неорганических соединений
- Названия некоторых неорганических кислот и солей
- Оксиды. Классификация, получение, свойства
- Таблица Менделеева
- Таблица растворимости
- Химический калькулятор — быстрое вычисление относительных молекулярных масс
- Степени окисления элементов
- Валентность — основные понятия
Химическое соединение | Определение, примеры и типы
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Луи Бернар Гайтон де Морво Карл Вильгельм Шееле Мартин Генрих Клапрот Николя-Луи Воклен
- Похожие темы:
- химическая связь химический анализ координационное соединение металлоорганическое соединение химическая реакция
Просмотреть весь связанный контент →
химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
Вся материя во Вселенной состоит из атомов более 100 различных химических элементов, которые встречаются как в чистом виде, так и в виде химических соединений. Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы, составляющие углерод, отличаются от атомов, составляющих железо, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода — это просто C, H и O соответственно. Символом железа является Fe, от его первоначального латинского названия 9.0025 железо
. Фундаментальный принцип науки химии состоит в том, что атомы различных элементов могут соединяться друг с другом, образуя химические соединения. Метан, например, который образуется из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 . Формула соединения, такая как CH
Формула соединения, такая как CH Исследуйте магнитоподобную ионную связь, образующуюся при переносе электронов от одного атома к другому
Просмотреть все видео к этой статьеПосмотрите, как работают молекулярные связи, когда два атома водорода соединяются с атомом серы, образуя сероводород
Просмотреть все видео к этой статье Вода , представляющий собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O. Хлорид натрия представляет собой химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1:1. Хотя формула хлорида натрия — NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионы хлора с отрицательным зарядом единицы (Cl — ). ( См. ниже Тенденции химических свойств элементов для обсуждения процесса превращения незаряженных атомов в ионы [т. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
( См. ниже Тенденции химических свойств элементов для обсуждения процесса превращения незаряженных атомов в ионы [т. соединения: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. Хлорид натрия, с другой стороны, содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются, образуя тысячи слов, атомы элементов могут соединяться различными способами, образуя множество соединений. . На самом деле известны миллионы химических соединений, и возможно еще много миллионов, но еще не открытых и не синтезированных. Большинство встречающихся в природе веществ, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества можно разделить на составляющие их соединения физическими методами, то есть методами, которые не изменяют способ агрегации атомов внутри соединений. Соединения можно разложить на составляющие их элементы путем химических превращений. Химическое изменение (то есть химическая реакция) — это изменение организации атомов. Примером химической реакции является горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Химическое изменение (то есть химическая реакция) — это изменение организации атомов. Примером химической реакции является горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Britannica Quiz
Все тонкости химии
Химические соединения демонстрируют ошеломляющий набор характеристик. При обычных температурах и давлениях некоторые из них являются твердыми, некоторые — жидкими, а некоторые — газообразными. Цвета различных соединений охватывают цвета радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества. Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
Для того чтобы из этого большого разнообразия можно было извлечь некоторый смысл, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также классифицируются как органические или неорганические. Органические соединения ( см. ниже Органические соединения), названные так потому, что многие из них были первоначально выделены из живых организмов, обычно содержат цепочки или кольца атомов углерода. Из-за большого разнообразия способов, которыми углерод может связываться с самим собой и другими элементами, существует более девяти миллионов органических соединений. Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. ниже Неорганические соединения).
В широких классификациях органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат O 2- ионов или атомов кислорода, гидриды содержат ионы H — или атомы водорода, сульфиды содержат ионы S 2- и так далее.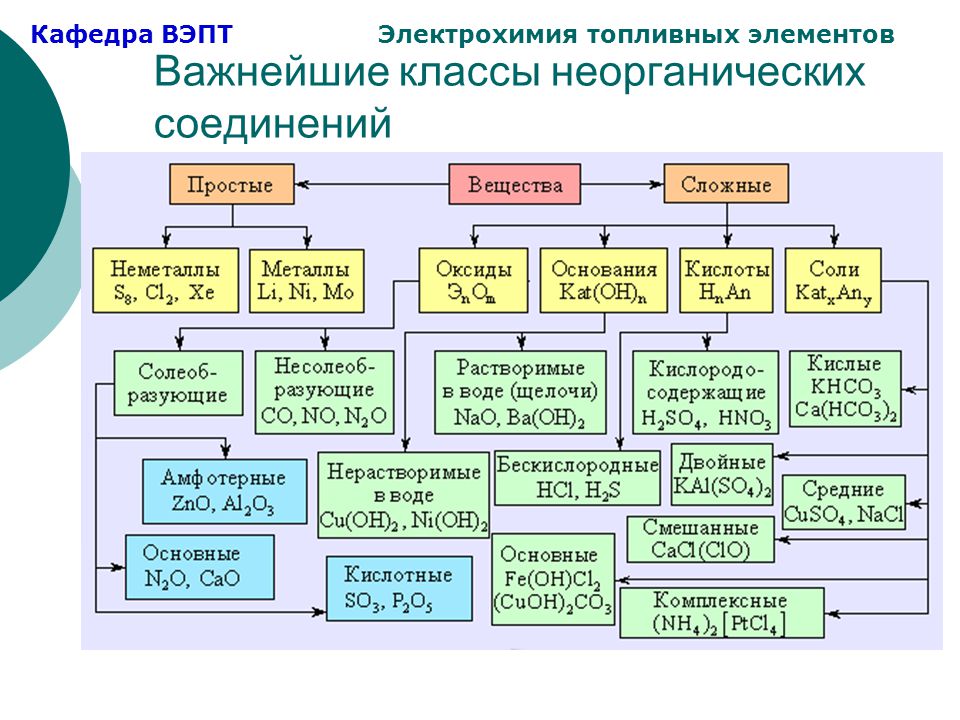 К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
К подклассам органических соединений относятся спирты (содержащие группу «ОН»), карбоновые кислоты (содержащие группу «СООН»), амины (содержащие группу «NH 2 ») и т. д.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Различные способности различных атомов объединяться в соединения лучше всего можно понять с точки зрения периодической таблицы. Периодическая таблица была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития науки химии было замечено, что элементы можно группировать в соответствии с их химической реакционной способностью. Элементы со схожими свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей строения атома стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента (9).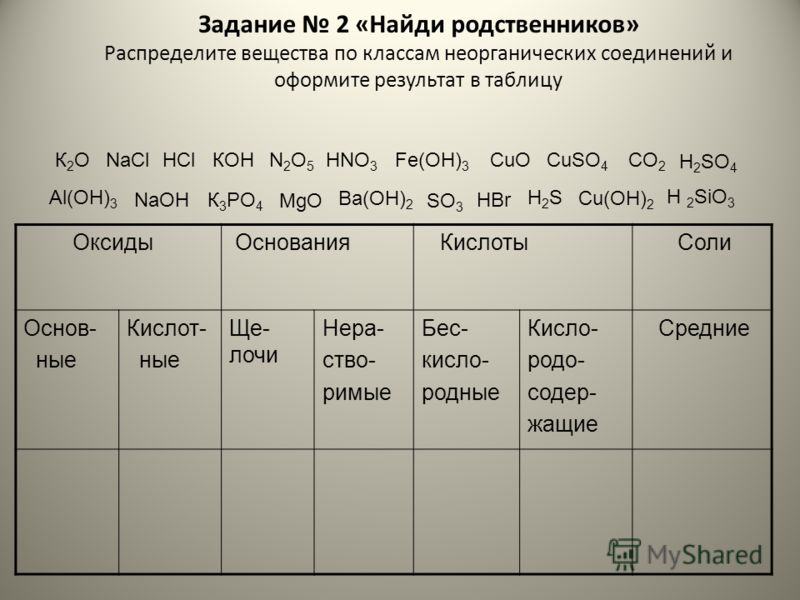 0025 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
0025 см. атом). В частности, было замечено, что электроны, определяющие химическое поведение атома, находятся в его самой внешней оболочке. Такие электроны называются валентными электронами.
Например, атомы элементов 1-й группы периодической таблицы имеют один валентный электрон, атомы элементов 2-й группы имеют два валентных электрона и так далее до 18-й группы, элементы которой содержат восемь валентных электронов. , достигается. Самое простое и наиболее важное правило для предсказания того, как атомы образуют соединения, состоит в том, что атомы склонны объединяться таким образом, что позволяют им либо опустошить свою валентную оболочку, либо заполнить ее (т. е. заполнить ее), в большинстве случаев имея в общей сложности восемь электронов. . Элементы в левой части периодической таблицы имеют тенденцию терять свои валентные электроны в химических реакциях. Например, натрий (в группе 1) имеет тенденцию терять свой единственный валентный электрон, образуя ион с зарядом +1. Каждый атом натрия имеет 11 электронов ( e − ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — . Калий, расположенный непосредственно под натрием в 1-й группе, также образует в своих реакциях ионы +1 (К + ), как и остальные члены 1-й группы: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами.
Каждый атом натрия имеет 11 электронов ( e − ), каждый из которых имеет заряд -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет у него 10 отрицательных зарядов и 11 положительных зарядов, что дает суммарный заряд +1: Na → Na + + e — . Калий, расположенный непосредственно под натрием в 1-й группе, также образует в своих реакциях ионы +1 (К + ), как и остальные члены 1-й группы: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы, как правило, вступают в реакции, в результате которых они получают (или делят) достаточное количество электронов, чтобы завершить свою валентную оболочку. Например, кислород в 16-й группе имеет шесть валентных электронов и, следовательно, нуждается в еще двух электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает такого расположения, реагируя с элементами, которые могут терять или делиться электронами. Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0039 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующиеся Mg 2+ и O 2− затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2– ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Атом кислорода, например, может реагировать с атомом магния (Mg) (в группе 2), принимая два валентных электрона магния, образуя Mg 9ионы 0039 2+ и О 2– . (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2– .) Образующиеся Mg 2+ и O 2− затем объединяют в соотношении 1:1, чтобы получить ионное соединение MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, он не имеет суммарного заряда, поскольку содержит равные количества Mg 2+ и O 2– ионов.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксида кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы данной группы имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное деление элементов на металлы, составляющие большинство элементов, и неметаллы. Типичными физическими свойствами металлов являются блестящий внешний вид, ковкость (способность превращаться в тонкий лист), пластичность (способность вытягиваться в проволоку) и эффективная тепло- и электропроводность. Важнейшим химическим свойством металлов является склонность отдавать электроны с образованием положительных ионов. Медь (Cu), например, является типичным металлом. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко формуются изделия различной формы, такие как трубы для водопроводных систем. Медь содержится во многих ионных соединениях в виде Cu + или ион Cu 2+ .
Металлические элементы находятся слева и в центре таблицы Менделеева. Металлы групп 1 и 2 называются репрезентативными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
Неметаллы, которых относительно немного, находятся в верхнем правом углу периодической таблицы, за исключением водорода, единственного неметаллического члена группы 1. Физические свойства, характерные для металлов, у неметаллов отсутствуют. В химических реакциях с металлами неметаллы приобретают электроны, образуя отрицательные ионы. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор — типичный неметалл. При обычных температурах элементарный хлор содержит Cl 2 молекул и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl —.
Разделение элементов на металлы и неметаллы является приблизительным. Несколько элементов вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
Неорганическое соединение. Определение и примеры
Неорганическое соединение
сущ., множественное число: неорганические соединения
[ˌɪnɔːˈɡænɪk kŏm′pound′]
Определение: соединение без связей С-С или С-Н.
Содержание
Определение неорганического соединения
Неорганическое соединение представляет собой химическое соединение, в котором отсутствуют ковалентные связи углерод-углерод (C-C) и углерод-водород (C-H). Химическое соединение состоит из двух или более элементов, которые химически связаны друг с другом. Один из способов классификации соединений состоит в том, чтобы идентифицировать их либо как органический или неорганический .
Некоторые определяют органическое соединение как тип соединения, которое содержит атом углерода. И наоборот, неорганическим соединением будет соединение, не содержащее углерода.
Однако не все углеродсодержащие соединения являются органическими. Например, двуокись углерода является неорганическим соединением; хотя он имеет атом углерода, он не имеет связей C-C или C-H.
Например, двуокись углерода является неорганическим соединением; хотя он имеет атом углерода, он не имеет связей C-C или C-H.
Этимология: назван в честь раннего представления о том, что неорганические соединения не имеют биологического происхождения
Сравните: органическое соединение
Посмотрите это видео о неорганических соединениях:
Витализм против результатов Вёлера
9000 2 Одной из преобладающих теорий первых столетий является витализм . Согласно этой теории, живые существа обладали своего рода жизненной силой — vis-vitalis — которая отличала их от неживых существ. Эта жизненная сила позволяла им производить определенные химические вещества, которые не могли производить неживые существа. Химические вещества, производимые живыми существами, были названы органическими , поскольку они произошли от организмов. Те, что можно было получить из неживых существ, назывались неорганическими , что означает «неорганические». Это была фундаментальная граница, которая отделяла органические соединения от неорганических.
Те, что можно было получить из неживых существ, назывались неорганическими , что означает «неорганические». Это была фундаментальная граница, которая отделяла органические соединения от неорганических.
Неорганические соединения считались соединениями, которые не были получены из организмов. Они могут быть получены, например, из геологических систем, т.е. отложения и руды.
Это убеждение существовало на протяжении многих веков, пока Фридрих Вёлер (1800 – 1882) не оспорил его, используя эмпирические данные своих экспериментов. В одном из своих экспериментов он обнаружил, что мочевина, которая когда-то считалась вырабатываемой только живыми существами, может быть получена из неорганических предшественников. В 1828 году он обнаружил, что мочевина может быть получена химическим путем из солей цианата калия и сульфата аммония. Это считается решающим поворотным моментом, который позже привел к возникновению современной органической химии.
Путаница
На пике витализма существовало четкое разграничение между органическими и неорганическими соединениями. С дискредитацией витализма среди химиков не было достигнуто консенсуса относительно современного определения органических и неорганических соединений. Просто сказать, что органическим соединением является любое соединение, содержащее атом углерода, будет не совсем правильно, поскольку это будет намекать на включение некоторых углеродсодержащих неорганических соединений.
С дискредитацией витализма среди химиков не было достигнуто консенсуса относительно современного определения органических и неорганических соединений. Просто сказать, что органическим соединением является любое соединение, содержащее атом углерода, будет не совсем правильно, поскольку это будет намекать на включение некоторых углеродсодержащих неорганических соединений.
База данных неорганической кристаллической структуры , база данных данных о неорганической кристаллической структуре, основанная Гюнтером Бергерхоффом и И.Д.Брауном в 1978 году, определила неорганических соединений углерода как соединения, содержащие связи С-Н или С-С. (Ref.1)
Углеродосодержащие соединения, считающиеся неорганическими, следующие: карбонаты, цианиды, цианаты, карбиды, тиоцианаты, монооксид углерода и диоксид углерода.
Аллотропы углерода , как и алмаз, не соединения, а чистый элемент углерода. Таким образом, они представляют собой не неорганические соединения, а неорганические вещества.
Органические и неорганические соединения
Общие различия между органическими и неорганическими соединениями показаны ниже:
Таблица 1: Органические соединенияи неорганические соединения | ||
|---|---|---|
| Органические соединения | Неорганические соединения | |
| Наличие атомов углерода | В основном содержащие атомы углерода | В основном отсутствуют атомы углерода |
| Химическое соединение | Ковалентная связь; в основном с углерод-водородными (C-H) связями | Преимущественно ионная связь; в основном отсутствуют связи C-H |
| Происхождение | По существу биологический (в результате биологической активности) | Химический (в результате лабораторных работ или экспериментов) или геологический (в результате природного процесса, не связанного с жизнью) |
| Соляные образования | Не может образовывать соль | Может образовывать соль |
| Атомы металлов | Не содержат атомов металлов | Может содержать атомы металлов |
| Прочие характеристики | В большинстве водных растворов плохие проводники тепла и электричества | В основном хорошие проводники тепла и электричества |
| Примеры | углеводы, жиры, белки, нуклеиновые кислоты, мочевина, четыреххлористый углерод | хлорид натрия, латунь, стекло, карбонаты, цианиды, цианаты, карбиды, тиоцианаты, окись углерода, двуокись углерода, вода |
Как указывалось ранее, нет четкого различия между органическим и неорганическим соединением. Исключения существуют в каждой функции. Таким образом, приведенные в таблице различия между ними следует считать верными для большинства случаев, но не для всех.
Исключения существуют в каждой функции. Таким образом, приведенные в таблице различия между ними следует считать верными для большинства случаев, но не для всех.
Типы неорганических соединений
Химическое соединение представляет собой вещество, состоящее из атомов или ионов двух или более элементов, которые химически связаны друг с другом, тогда как химический элемент представляет собой вещество только с одним типом атома. Большинство элементов являются неорганическими, но технически не являются неорганическими соединениями, поскольку состоят из атомов только одного типа. Таким образом, классификация неорганических соединений влечет за собой группировку веществ, состоящих из более чем одного типа атомов. И наоборот, простые неорганические вещества (не обязательно соединения) классифицируются либо как металл или неметалл . Однако четкого различия между металлами и неметаллами нет.
Большинство неорганических соединений представляют собой ионные соединения . Это означает, что химическая связь, которая удерживает атомы вместе, является ионной связью. По составу неорганических соединений ионные соединения можно разделить на основания, кислоты и соли.
Это означает, что химическая связь, которая удерживает атомы вместе, является ионной связью. По составу неорганических соединений ионные соединения можно разделить на основания, кислоты и соли.
Ионная связь – это связь, при которой происходит полный перенос электрона от одного атома к другому. Это электростатическое притяжение между противоположно заряженными ионами, то есть катионом и анионом. А 9Катион 0025 является положительно заряженным ионом, тогда как анион является отрицательно заряженным ионом. Например, хлорид натрия представляет собой ионное соединение, в котором катион Na + и анион Cl – удерживаются вместе ионной связью .
Ионное соединение, имеющее ионы водорода (H + ), классифицируется как кислота. И наоборот, ионное соединение, имеющее гидроксид (OH –) или оксид (O 2-), классифицируется как основание. Ионное соединение, образованное в результате кислотно-основных реакций и не содержащее этих ионов, называется соль .
Вода, безусловно, является одним из самых важных неорганических соединений для всех живых существ. Это соединение, состоящее из двух атомов водорода и одного атома кислорода. Однако это не ионное соединение, а молекула, удерживаемая ковалентной связью между водородом и кислородом .
Науки
Изучение свойств и синтеза органических соединений известно как органическая химия , тогда как изучение свойств и синтеза неорганической химии называется неорганическая химия .
Пройди тест по биологии неорганических соединений!
Викторина
Выберите лучший ответ.
1. Наиболее распространенный тип химических связей, присутствующих в неорганических соединениях
Ковалентные связи C-H
Ковалентные связи C-C
Ионные связи
2.


 ) + Fe = FeSO4 + H2
) + Fe = FeSO4 + H2