Химическая связь наименее прочна в молекуле бромоводорода: Какой вид химической связи в молекуле бромоводорода? 1) ионная 2) ковалентная полярная 3) ковалентная неполярная…
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная 2. Вещества только с ионной связью приведены в ряду: 1) F2, ССl4, КС1 2) NaBr,Na2O,KI 3) SO2.P4.CaF2 4) H2S,Br2,K2S 3. Соединение с ионной связью образуется при взаимодействии 1) СН4 и О2 2) SO3 и Н2О 3) С2Н6 и HNO3 4. 1) HCl,NaCl.Cl2 2) O2.H2O.CO2 3) H2O.NH3.CH4 4) NaBr.HBr.CO 5. В каком ряду записаны формулы веществ только с ковалентной полярной 1) С12, NO2, НС1 2) HBr,NO,Br2 3) H2S.H2O.Se 4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для 1) С12 2) SO3 3) СО 4) SiO2 7. Веществом с ковалентной полярной связью является 1) С12 2) NaBr 3) H2S 4) MgCl2 8. Веществом с ковалентной связью является 1) СаС12 2) MgS 3) H2S 4) NaBr 9. 1) NH3 2) Сu 3) H2S 4) I2 10. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан 11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
12. Ковалентная полярная связь характерна для 1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь 1)ковалентную полярную 2) ковалентную неполярную 3) ионную 4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая? 1} ацетилена 2) этана 3) этена 4) бензола
15. 1) азота 2) сероводорода 3) метана 4) хлора
16. Водородные связи образуются между молекулами 1) диметилового эфира 2) метанола 3) этилена 4) этилацетата
17. Полярность связи наиболее выражена в молекуле 1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
19. Водородная связь не характерна для вещества 1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых 1) KI и Н2О 2) СО2 и К2О 3) H2S и Na2S 4) CS2 и РС15
21. 1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая? 1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду: 1) C4H10, NO2, NaCl 2) СО, CuO, CH3Cl 3) BaS,C6H6,H2 4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) СаО,С3Н6, S8 2) Fe.NaNO3, CO 3) N2, CuCO3, K2S 4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) С3Н4, NO, Na2O 2) СО, СН3С1, PBr3 3) Р2Оз, NaHSO4, Сu 4) C6H5NO2, NaF, СС14
26. 1) C3Ha,NO2, NaF 2) КС1, CH3Cl, C6H12О6 3) P2O5, NaHSO4, Ba 4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода 2) хлора 3) фосфина 4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4 2)CCl4 3)CBr4 4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30.
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
|
Химическая связь В природе не существуют одиночные атомы. Все они находятся в составе простых и сложных соединений, где их объединение в молекулы обеспечивается образованием химических связей друг с другом. Образование
химических связей между атомами – естественный, самопроизвольный процесс, так
как при этом происходит понижение энергии молекулярной системы, т.е. энергия
молекулярной системы меньше суммарной энергии изолированных атомов. Природа химических связей – электростатическая, т.к. атомы есть совокупность заряженных частиц, между которыми действуют силы притяжения и отталкивания, которые приходят в равновесие. В образовании связей участвуютнеспаренные электроны, находящиеся на внешних атомных орбиталях (или готовые электронные пары) – валентные электроны.Говорят, что при образовании связей происходит перекрывание электронных облаков, в результате чего между ядрами атомов возникает область, где вероятность нахождения электронов обоих атомов максимальна.
Химическая
связь — это взаимодействие атомов, осуществляемое путем обмена
электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную – Н, Не) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа, т.е. завершить свой внешний уровень. Классификация химических связей. 1. По механизму образования химической связи. а) обменный , когда оба атома, образующие связь, предоставляют для неё неспаренные электроны. Например, образование молекул водорода Н 2 и хлора Cl 2: б) донорно – акцепторный , когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь. Например, образование иона аммония (NH 4) + (заряженная частица): 2. По способу перекрывания электронных орбиталей. а) σ — связь (сигма) , когда максимум перекрывания лежит на линии, соединяющей центры атомов. Например, H 2 σ (s -s ) Cl 2 σ(p-p) HClσ(s-p) б) π — связи (пи) ,
если максимум перекрывания не лежит на линии, соединяющей центры атомов. 3. По способу достижения завершенной электронной оболочки. Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может бытьнесколько.
| ||||
Полярная и неполярная ковалентная связь — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Вспомните: как изменяются металлические и неметаллические свойства элементов, а также радиус атомов в периодах и группах (§ 15).
Электроотрицательность химических элементов
Способность атома притягивать общие электронные пары называют электроотрицательностью. Сильнее всего притягивают электроны атомы наиболее активных неметаллических элементов — Флуора, Оксигена, Хлора, так как для завершения внешнего уровня им не хватает одного или двух электронов. И электроны, которые они будут принимать, разместятся достаточно близко к ядру — на втором или третьем электронном уровне. Поэтому электроотрицательность этих элементов наибольшая. Легче всего отдают электроны атомы активных металлических элементов, в первую очередь щелочных — Лития, Натрия, Калия и др. Они проявляют наименьшую электроотрицательность.
Поскольку электроотрицательность — это свойство, связанное с присоединением и потерей электронов, то и изменяться она будет так же, как и неметаллические свойства: в периодах электроотрицательность увеличивается слева направо, а в группах — снизу вверх. Таким образом, элемент с наибольшей электроотрицательностью — Флуор, а с наименьшей — Франций (рис. 19.1).
19.1).
Рис. 19.1. Изменение значения электроотрицательности химических элементов в соответствии с их местом в Периодической системе (длинный вариант)
Способ количественного определения электроотрицательности впервые разработал американский химик Лайнус Полинг. По шкале Полинга электроотрицательность Флуора принята за 3,98 (округленно 4), вторым по электроотрицательности является Оксиген (3,44), третьим — Хлор (3,16). Гидроген и типичные неметаллические элементы расположены в середине шкалы; значения их электроотрицательностей близки к 2. Активные металлические элементы имеют значение электроотрицательности меньше 1,6. (Значения электроотрицательностей для химических элементов приведены в Периодической системе на форзаце 1.)
Лайнус Карл Полинг (1901-1994)
Американский химик и физик, дважды лауреат Нобелевской премии: по химии в 1954 г. (за изучение природы химической связи) и премия мира в 1962 г. (за борьбу против распространения ядерного оружия). С детства интересовался наукой, проводил химические опыты на кухне. В период учебы подрабатывал мытьем посуды и сортировкой бумаг. С 1922 г. работал в Калифорнийском технологическом институте, где со временем стал деканом химического факультета. С конца 60-х гг. исследовал влияние витаминов на организм человека и возможность лечения ими раковых заболеваний. Имя Полинга — в числе 20 величайших ученых всех времен.
С детства интересовался наукой, проводил химические опыты на кухне. В период учебы подрабатывал мытьем посуды и сортировкой бумаг. С 1922 г. работал в Калифорнийском технологическом институте, где со временем стал деканом химического факультета. С конца 60-х гг. исследовал влияние витаминов на организм человека и возможность лечения ими раковых заболеваний. Имя Полинга — в числе 20 величайших ученых всех времен.
Полярность ковалентной связи
Ковалентная связь может образоваться между одинаковыми или разными атомами. Атомы разных химических элементов обладают разной электроотрицательностью, так как по-разному притягивают общую электронную пару. Благодаря этому для ковалентной связи характерно свойство, которое называют полярностью ковалентной связи.
Давайте рассмотрим, чем отличается химическая связь в молекулах водорода Н2, фтора F2 и гидроген флуорида HF:
Во всех этих молекулах между атомами образуется одинарная ковалентная связь благодаря возникновению одной общей электронной пары. Но в равной ли мере она принадлежит обоим атомам?
Но в равной ли мере она принадлежит обоим атомам?
В молекулах фтора и водорода общая электронная пара одинаково притягивается к обоим атомам и принадлежит им в равной мере. Такую ковалентную связь называют неполярной. Во всех простых веществах, образованных неметаллическими элементами (например, Н2, N2, O2, S2), химические связи неполярные.
В молекуле гидроген флуорида атомы Гидрогена и Флуора притягивают электроны по-разному. У Флуора электроотрицательность больше, чем у Гидрогена, поэтому атомы Флуора сильнее притягивают общую электронную пару, чем атомы Гидрогена. Это приводит к смещению общей электронной пары в сторону атома Флуора и увеличению на нем электронной плотности (рис. 19.2). Как следствие, на атоме Флуора появляется некоторый избыточный отрицательный заряд. На атоме Гидрогена, наоборот, электронная плотность уменьшается, следовательно, на нем появляется некоторый положительный заряд. Схематически это изображают так:
Рис. 19.2. В молекуле водорода электронная плотность на обоих атомах одинаковая (а), а в молекуле гидроген флуорида на атоме Флуора электронная плотность больше, благодаря чему на атоме Флуора появляется избыточный отрицательный заряд (б)
19.2. В молекуле водорода электронная плотность на обоих атомах одинаковая (а), а в молекуле гидроген флуорида на атоме Флуора электронная плотность больше, благодаря чему на атоме Флуора появляется избыточный отрицательный заряд (б)
Ковалентная неполярная связь:
• общие электроны принадлежат обоим атомам в равной мере
• существует между атомами неметаллических элементов с незначительной разностью электроотрицательностей
Ковалентная полярная связь:
• общая электронная пара смещена в сторону более электроотрицательного элемента
• существует между атомами неметаллических элементов с разной электроотрицательностью
Ковалентная связь, образованная атомами разных элементов, называется полярной (поскольку в молекуле появляются полюса электрического заряда). В ковалентной полярной связи общая электронная пара смещена к тому атому, который сильнее притягивает электроны, т. е. к атомам элемента с большей электроотрицательностью. Чем сильнее это смещение общей электронной пары, тем больше полярность связи. Так, в ряду галогеноводородов разность электроотрицательностей между Гидрогеном и Флуором значительно больше, чем между Гидрогеном и Йодом. Таким образом, в гидроген флуориде полярность связи больше, чем в гидроген йодиде:
е. к атомам элемента с большей электроотрицательностью. Чем сильнее это смещение общей электронной пары, тем больше полярность связи. Так, в ряду галогеноводородов разность электроотрицательностей между Гидрогеном и Флуором значительно больше, чем между Гидрогеном и Йодом. Таким образом, в гидроген флуориде полярность связи больше, чем в гидроген йодиде:
Поскольку электрон, принадлежавший атому Гидрогена, лишь частично смещается в сторону атома Флуора, то избыточный отрицательный заряд, который появляется на атоме Флуора, меньше элементарного заряда, т. е. меньше заряда электрона (-1). В данном случае он составляет лишь 44 % от заряда электрона. Чтобы не указывать точное значение заряда (а во многих случаях определить его довольно сложно), используют букву δ (дельта). Несомненно то, что заряд на атоме Гидрогена точно равен заряду на атоме Флуора, но противоположен по знаку, то есть сумма зарядов равна нулю. Следовательно, молекула остается электронейтральной. Чем больше разность электроотрицательностей двух атомов, тем больше заряд на атомах.
Зависимость полярности связи от электроотрицательности элементов
Нитроген — довольно активный химический элемент, но азот N2 — одно из самых инертных веществ, близкое по инертности к инертным газам. Азот даже иногда используют для создания инертной атмосферы при проведении химических реакций вместо более дорогих аргона или гелия. Это объясняется чрезвычайно прочной связью между атомами Нитрогена в молекуле N2, что и определяет его низкую реакционную способность.
Выводы
1. Полярность ковалентной связи обусловлена разной способностью атомов притягивать общие электроны (электроотрицательностью). Ковалентная связь между одинаковыми атомами является неполярной, а между разными атомами — полярной.
2. В молекуле на атоме более электроотрицательного элемента появляется избыточный отрицательный заряд, а на менее электроотрицательном атоме — положительный. Чем больше разность электроотрицательностей, тем более полярной является связь.
Контрольные вопросы
1. Какую ковалентную связь называют неполярной? полярной? Приведите примеры веществ с такими типами связи.
2. От чего зависит полярность ковалентной связи?
3. Как определить, на каком из атомов, соединенных ковалентной связью, появляется отрицательный заряд, а на каком — положительный?
4. Какое свойство химических элементов называют электроотрицательностью? Как она изменяется в периодах и группах? Назовите наиболее и наименее электроотрицательные элементы. Ответ обоснуйте.
Задания для усвоения материала
1. Выпишите отдельно формулы веществ с полярной и неполярной связью: S8, NH3, O2, OF2, F2, ClF3, P4, NO2, NO, N2.
2. Запишите формулы веществ в порядке увеличения полярности связи в их молекулах: Н2O, СН4, HF, NH3.
3. Пользуясь форзацем 1, вычислите разность между электроотрицательностями элементов в парах: Li-Cl, Be-Cl, B-Cl, С-Сl, N-Cl, О-Сl, F-Cl. Укажите пару элементов с наиболее полярной и наименее полярной связью.
Укажите пару элементов с наиболее полярной и наименее полярной связью.
4. Определив разность электроотрицательностей, укажите формулу наиболее полярной молекулы: Н2, НСl, HF, ClF, Cl2, F2.
5. Среди данных веществ выберите соединения с наибольшей и наименьшей полярностью связи: йодоводород НІ, хлороводород HCl, бромоводород НВr, вода Н2O, сероводород H2S, хлор Сl2, метан СН4, фосфин РН3.
6. Определите знак частичного заряда на атоме Хлора в молекулах HCI и CIF. Как вы считаете, в какой из этих молекул частичный заряд Хлора больше абсолютной величины?
7. Как изменяется в ряду Н2O, H2S, H2Se, Н2Те полярность связи? Почему?
Попередня
СторінкаНаступна
СторінкаЗміст
Цей контент створено завдяки Міністерству освіти і науки України
3.7 Химическая связь и строение вещества
3. 7. Химическая связь и строение вещества.
Ковалентная связь
7. Химическая связь и строение вещества.
Ковалентная связь
Вещества состоят из связанных атомов. Силы, которые обусловливают связь между атомами, получили название «химическая связь». По своей природе эти силы являются электростатическими. Они представляют собой различные виды взаимодействия электрических зарядов (электронов и ядер взаимодействующих атомов).
Результатом связывания атомов является образование более сложных структур – молекул, молекулярных ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решеток.
Существование этих структур обусловлено различными типами химической связи. Важнейшие из них: ковалентная, ионная, металлическая, водородная связи.
·
Ковалентная
связь является причиной образования большинства молекул, молекулярных ионов,
свободных радикалов и атомных кристаллических решеток.
·
Ионная связь обусловливает существование молекул ионных соединений и ионных кристаллических решеток.
·
Металлическая связь существует в простых веществах-металлах.
·
Водородная связь существует внутри молекул определенных веществ, а также возникает между молекулами некоторых веществ.
Типы химической связи и их основные отличительные признаки
Химическая связь | Связываемые атомы | Характер элементов | Процесс в электронной оболочке | Образующиеся частицы | Кристаллическая решетка | Характер вещества | Примеры |
Ионная | Атом металла и атом неметалла | Электрополо- | Переход валентных электронов | Положительные и отрицательные ионы | Ионная | Солеобраз- | NaCl CaO NaOH |
Ковалентная | Атомы неметаллов (реже-атомы металлов) | Электроотрица- | Образование общих электронных пар, заполнение молекулярных орбиталей | Молекулы | Молекулярная | Летучий или нелетучий | Br2 CO2 C6H6 |
——— | Атомная | Алмазоподоб | Алмаз Si SiC | ||||
Металличес | Атомы металлов | Электрополо- | Отдача валентных электронов | Положительные ионы и электронный газ | Металлическая | Металличес- | Металлы и сплавы |
Ковалентная связь
Ковалентная связь образуется за счёт общих электронных пар, возникающих в
оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др. |
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, |
Необходимо ввести
понятие электроотрицательность. Электроотрицательность — это
способность атомов химического элемента оттягивать к себе общие электронные
пары, участвующие в образовании химической связи.
ряд электроотрицательностей
Относительные электроотрицательности элементов (по Полингу)группа | |||||||||||
период | |||||||||||
Li | Be | ||||||||||
Na | Mg | Al | Si | Cl | |||||||
Ca | Sc | Ti | Cr | Mn | Fe | Co | Ni | ||||
Cu | Zn | Ga | Ge | As | Se | Br | |||||
Rb | Sr | Zr | Nb | Mo | Tc | Ru | Rh | Pd | |||
Ag | Cd | In | Sn | Sb | Te | ||||||
Cs | Ba | La* | Hf | Ta | Re | Os | Ir | Pt | |||
Au | Hg | Tl | Pb | Bi | Po | At | |||||
Fr | Ra | Ac** | *Лантаноиды
— 1,08 — 1,14 | ||||||||
Элементы с большей электроотрицательностью будут оттягивать общие электроны
от элементов с меньшей электроотрицательностью.
Для наглядного изображения ковалентной связи в химических формулах используются
точки ( каждая точка отвечает валентному электрону, а также черта отвечает
общей электронной паре ).
Существует несколько способов образования ковалентных связей за счёт перекрывания электронных облаков.
σ — связь значительно прочнее π-связи, причём π-связь может быть только с σ-связью, За счёт этой связи образуются двойные и тройные кратные связи.
Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.
За счёт смещения электронов от водорода к хлору атом хлора заряжается частично отрицательно, водорода-частично положительно.
В
слове «ковалентная» приставка «ко-» означает «совместное участие». А
«валента» в переводе на русский – сила, способность. В данном случае
имеется в виду способность атомов связываться с другими атомами.
При образовании ковалентной связи атомы объединяют свои электроны как бы в общую «копилку» – молекулярную орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки.
Рассмотрим возникновение ковалентной связи на примере образования молекулы водорода из двух атомов водорода (рис. 3-1). Этот процесс уже является типичной химической реакцией, потому что из одного вещества (атомарного водорода) образуется другое – молекулярный водород. Внешним признаком энергетической выгодности этого процесса является выделение большого количества теплоты.
Возникновение ковалентной связи при образовании молекулы водорода
из двух атомов водорода. Электронные оболочки атомов водорода (с одним
s-электроном у каждого атома) сливаются в общее электронное облако
(молекулярную орбиталь), где оба электрона «обслуживают» ядра
независимо от того, «свое» это ядро или «чужое».
Когда электронные оболочки двух атомов водорода сближаются и образуют новую, теперь уже молекулярную электронную оболочку (рис. 3-1), эта новая оболочка подобна завершенной электронной оболочке атома благородного газа гелия (1s2).
Завершенные оболочки, как мы помним, устойчивее незавершенных. Таким образом, суммарная энергия новой системы – молекулы водорода – оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода. Избыток энергии при этом выделяется в виде теплоты.
Минимум энергии молекулы отвечает определенному расстоянию между
ядрами атомов водорода (рис. 3-2). Если атомы в молекуле с помощью внешней силы
сдвинуть еще ближе, то в действие вступает мощное отталкивание между одноименно
заряженными ядрами атомов и общая энергия системы начинает возрастать. Это
невыгодно системе, поэтому длина связи представляет собой строго определенное,
равновесное значение. Для молекулы водорода равновесная длина химической связи
составляет 0,74 ангстрема (1 А = 10–8 см), как это видно на рис. 3-2
3-2
.
Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с образованием молекулы водорода
В образовавшейся системе из двух водородных атомов каждое ядро обслуживается двумя электронами. В новой (молекулярной) оболочке уже невозможно различить, какой из электронов ранее принадлежал тому или другому атому. Принято говорить, что электроны обобществлены. Поскольку оба ядра претендуют на пару электронов в равной степени, электронная плотность сосредоточена как вокруг ядер, так и в пространстве между атомами.
Другой способ изображения атомных и
молекулярной орбиталей: густота точек отражает «электронную
плотность», то есть вероятность нахождения электрона в какой-либо точке
пространства около ядер атомов водорода. Видно, что значительная электронная
плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода.
Американский химик Дж. Льюис в 1916 году предложил обозначать электроны точками рядом с символами элементов. Одна точка обозначает один электрон. В этом случае образование молекулы водорода из атомов записывается так:
Оказалось, что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электроновпозволяет образовать ковалентную связь. Впоследствии это предположение подтвердилось квантовой теорией.
Ковалентной связью называется связывание атомов с помощью общих (поделенных между ними) электронных пар.
Рассмотрим связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной оболочки:
На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Поскольку электроны
нижних уровней не принимают участия в химическом взаимодействии, точками мы
обозначили только электроны внешнего,
третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех
электронных пар и одного неспаренного электрона.
Поскольку электроны
нижних уровней не принимают участия в химическом взаимодействии, точками мы
обозначили только электроны внешнего,
третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех
электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:
При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании.
Льюис не только предложил теорию ковалентной связи, но и первым
сформулировал правило октета-дублета, которым мы уже пользовались в прошлой
главе для объяснения устойчивости атомов. Это правило применительно к
химическим связям можно сформулировать так:
Это правило применительно к
химическим связям можно сформулировать так:
атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
Два атома водорода, объединившись в молекулу, приобрели “завершенную” молекулярную оболочку, подобную завершенной электронной оболочке атома благородного газа гелия (1s2). Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную оболочку атома аргона (…3s23p6).
Полярная ковалентная связь занимает промежуточное положение
между чисто ковалентной связью и ионной связью. Так же, как и ионная, она может
возникнуть между двумя атомами разных видов. В полярной ковалентной связи
электроны смещаются от атома к атому не так сильно, как в ионной. Это
происходит тогда, когда атомам энергетически невыгодно далеко “отпускать” свои
собственные электроны, отданные в общую “копилку” – молекулярную орбиталь. Если
электроны слишком далеко сдвинутся к одному из атомов, молекулярная орбиталь
перестанет быть похожей на “октетную”. В то же время у разных атомов разные
донорные и акцепторные свойства, поэтому связывающая электронная пара не
располагается точно посередине между ядрами, как в ковалентной связи.
Это
происходит тогда, когда атомам энергетически невыгодно далеко “отпускать” свои
собственные электроны, отданные в общую “копилку” – молекулярную орбиталь. Если
электроны слишком далеко сдвинутся к одному из атомов, молекулярная орбиталь
перестанет быть похожей на “октетную”. В то же время у разных атомов разные
донорные и акцепторные свойства, поэтому связывающая электронная пара не
располагается точно посередине между ядрами, как в ковалентной связи.
В качестве примера рассмотрим образование воды в реакции между атомами водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s1) и кислорода (…2s2 2p4). Затем на помощь приходят формулы Льюиса, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в молекуле воды:
Оказывается, для этого необходимо взять именно два
атома водорода на один атом кислорода. Однако природа такова, что акцепторные
свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть
позже). Поэтому связывающие электронные пары в формуле Льюиса для воды слегка
смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а
на атомах появляются частичные положительные и отрицательные заряды.
Однако природа такова, что акцепторные
свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть
позже). Поэтому связывающие электронные пары в формуле Льюиса для воды слегка
смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а
на атомах появляются частичные положительные и отрицательные заряды.
О том, как предсказать акцепторные свойства атомов и где проходит “граница” между полярной ковалентной и ионной связями мы поговорим в параграфе 3.4.
По теории Льюиса и правилу октета связь между атомами может осуществляться не обязательно одной, но и двумя и даже тремя поделенными парами, если этого требует правило октета. Такие связи называются двойными и тройными. Например, только что рассмотренный нами кислород может образовывать двухатомную молекулу с октетом электронов у каждого атома только тогда, когда между атомами помещаются две поделенные пары:
Атомы азота (. ..2s2 2p3 на последней оболочке) также связываются в двухатомную
молекулу, но для организации октета электронов им требуется расположить между
собой уже три поделенные пары:
..2s2 2p3 на последней оболочке) также связываются в двухатомную
молекулу, но для организации октета электронов им требуется расположить между
собой уже три поделенные пары:
В настоящее время принято изображать электронные пары (то есть химические связи) между атомами черточками. Каждая черточка – это поделенная пара электронов. В этом случае уже знакомые нам молекулы выглядят так:
Формулы с черточками между атомами называются структурными формулами. Чаще в структурных формулах не изображают неподеленные пары электронов, но в ряде случаев (мы столкнемся с ними при обсуждении донорно-акцепторных связей) неподеленные пары играют важную роль.
Структурные формулы очень хороши для изображения молекул: они четко показывают – как атомы связаны между собой, в каком порядке, какими связями.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна
черточка в структурных формулах.
Двойные и тройные связи имеют общее название – кратные связи. О молекуле азота говорят, что она имеет порядок связи, равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается.
Таблица Длины и прочности связей между атомами азота в различных соединениях
Длина связи в ангстремах 1А = 10–8см | Прочность связи в кДж на одинаковое число молекул | ||
Проcтая | |||
Двойная | |||
Тройная |
Рассмотрим данные по длинам и прочностям связей между атомами азота в
различных его соединениях. В таблице длины связей приведены в специальных
единицах – ангстремах (1А = 10–8см). Относительную прочность связей
можно оценить по энергии, которая необходима для разрыва связей между атомами
азота в разных соединениях. Эта энергия дается для одинакового числа молекул
таких соединений. Чем выше кратность связи, тем она короче и прочнее.
В таблице длины связей приведены в специальных
единицах – ангстремах (1А = 10–8см). Относительную прочность связей
можно оценить по энергии, которая необходима для разрыва связей между атомами
азота в разных соединениях. Эта энергия дается для одинакового числа молекул
таких соединений. Чем выше кратность связи, тем она короче и прочнее.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
УПРАЖНЕНИЯ
1.
Атомы водорода и фосфора имеют одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина РН3?
Решение: В молекуле фосфина РН3 ковалентная неполярная химическая связь.
_____________________________________________________________
2.
В какой из молекул – хлороводорода HCl или фтороводорода HF — ковалентная химическая связь более полярна?
Решение: На основании ряда электроотрицательности неметаллов фтор электроотрицательнее хлора, потому ковалентная связь в молекуле фтороводорода HF более полярная, чем в молекуле хлороводорода HCl.
_____________________________________________________________
3.
Определите тип химической связи и запишите схему ее образования для веществ с формулами: а) S2, K2O, H2S; б) N2, Li3N, Cl3N.
Решение:
а)ковалентная неполярная: S2
ковалентная полярная: H2S
ионная: K2O.
б)ковалентная неполярная: N2
ковалентная полярная: Cl3N
ионная: Li3N.
_____________________________________________________________
4.
В следующих предложениях вставьте пропущенные слова и выражения: «Ковалентная химическая связь образуется за счет … . По числу общих электронных пар она бывает … . По ЭО ковалентную связь делят на … и …».
Решение: Ковалентная химическая связь образуется за счет образования общих электронных пар. По числу общих электронных пар она бываетодинарной, двойной, тройной. По ЭО ковалентную связь делят на полярную и неполярную.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какова природа сил, которые обусловливают химическую связь.
2.
Какие структуры могут образоваться в результате связывания атомов.
3.
Какие электроны называются валентными электронами.
4.
Как объяснял образование ковалентной связи Г. Льюис.
5.
Как изменяется энергия системы взаимодействующих атомов при образовании химической связи.
6.
Что происходит с электронными облаками при образовании ковалентной связи.
7.
Что представляет собой область перекрывания электронных облаков.
8.
Что характеризует
электроотрицательность элемента.
9.
Определите, как изменяется прочность соединений в ряду: НF, HCl, HBr, HI.
10. Какая из химических связей H-Cl, H-Br, H-I, H-S, H-P является наиболее полярной. Укажите, в какую сторону смещается электронная плотность связи.
1. Какая химическая связь наименее прочная: | |
а) металлическая | б) ионная |
в) водородная | г) ковалентная |
2. Охарактеризуйте связь в молекуле азота: | |
а) тройная | б) 1σ и 2π |
в) все ответы верны | г) очень прочная |
3. Атомы какого элемента проявляет наибольшую склонность к образованию ионных связей: | |
а) С | б) Si |
в) F | г) P |
4. Выберите формулы веществ, в которых все связи ковалентные полярные: | |
а) Н2О2 | б) NH4NO3 |
в)N2 | г) H2O |
5. Только ковалентные неполярные связи содержатся в молекулах: | |
а) P4 | б) NH3 |
в) NH4NO | г) H2O |
6. Укажите формулу молекулы с наибольшим числом ковалентных связей: | |
а) Н2О2 | б) NH3 |
в) P4 | г) N2 |
7. Между молекулами каких веществ могут образоваться водородные связи: | |
а) воды | б) пероксида водорода |
в) водорода | г) фтора |
8. Охарактеризуйте химические связи в молекуле воды: | |
а) водородная | б) ковалентная неполярная |
в) 2 связи σ-типа | г) 1σ и 1π связь |
9. Молекула СО2 содержит связи: | |
а) 1σ и 1π | б) 2σ и 2π |
в) 3σ и 1π | г) 4σ |
10. Только ковалентные полярные связи содержатся в молекулах: | |
а) Н2О2 | б) NH3 |
в) NH4NO3 | г) P4 |
Ответы:
1 | в |
2 | в |
3 | в |
4 | г |
5 | а |
6 | в |
7 | а |
8 | в |
9 | б |
10 | б |
Глава 2 | Пособие по химии для подготовки к ЕГЭ
§2.
 1. Ионная связь
1. Ионная связь
Причиной, по которой одни атомы взаимодействуют с другими, является стремление к устойчивости, а в итоге – к минимуму энергии. Атомы стремятся приобрести восьмиэлектронную оболочку благородных газов. При взаимодействии атомов металлов с атомами неметаллов происходит полная передача валентных электронов от атома металла, легко теряющего электроны, к атому неметалла, способного присоединять электроны, и образуются противоположно заряженные ионы. Например, атомы натрия и хлора имеют электронные конфигурации:
Обозначим валентные электроны точками:
Электронная схема образования NaCl:
Атом металла Na отдал валентный электрон атому хлора и оба атома при этом приобрели устойчивую внешнюю электронную оболочку благородных газов неона Ne и аргона Ar:
Как известно из физики, противоположно заряженные частицы притягиваются друг к другу и оказываются связанными друг с другом. Так возникает химическая связь, называемая ионной.
Так возникает химическая связь, называемая ионной.
Химическая связь, образованная путем электростатического притяжения катионов и анионов, называется ионной.
Ион можно упрощенно представить в виде заряженного шарика, который любой точкой своей поверхности способен притянуть ион противоположного заряда, то есть один ион может притянуть столько противоположно заряженных ионов, сколько позволит его поверхность и даже больше; может образоваться второй, третий и последующие слои противоположно заряженнных ионов. Но с расстоянием сила притяжения уменьшается, связь с дальними ионами менее прочная, чем с первым слоем ионов. Из вышесказанного следует, что ионная связь не имеет направления (ненаправлена) и ненасыщаема.
В случае образования молекулы MgCl2, атом магния, чтобы стать устойчивым, отдает два своих валентных электрона двум атомам хлора и превращается в двухзарядный катион:
Электронная схема образования MgCl2:
Рассмотрим образование молекулы MgO.
Расположение валентных электронов атома O:
Атому кислорода не хватает двух электронов до устойчивой восьмиэлектронной оболочки. Забирая их у атома магния, он превращается в двухзарядный анион. С магнием кислород образует ионную химичес кую связь по схеме:
Вещества NaCl, MgO и MgCl2 построены из ионов. Катионы чередуются с анионами. Понятие «молекула» применяется к ним условно.
Таким образом, ионная связь образуется между атомами металлов и атомами неметаллов.
84) Самостоятельно составьте электронные схемы образования Na2O, BaBr2, CaS, KI, Li3N.
§2.2. Ковалентная химическая связь.
Разновидности связи, характеристика связи.
Валентность. Степень окисления
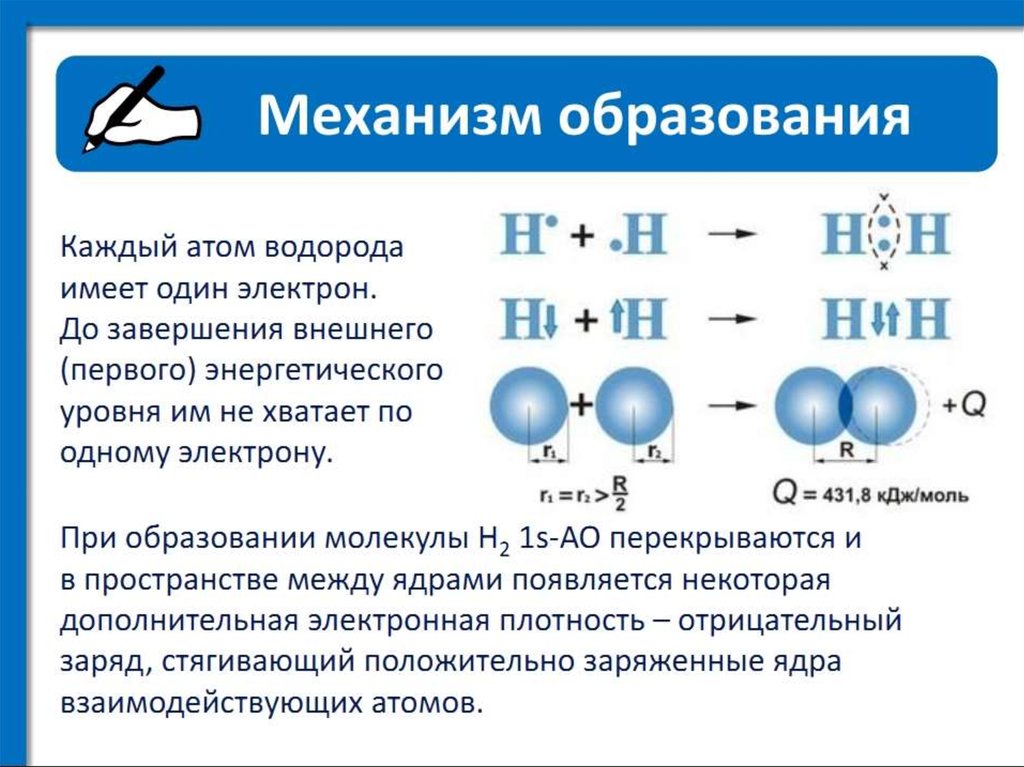
Рассмотрим, как соединяются в молекулу два атома водорода.
Электронная конфигурация атома h2s1 или: . Такое состояние атома неустойчиво. Положительное ядро атома водорода притягивает отрицательный электрон от другого атома водорода, два атома сближаются. При этом на определенном расстоянии друг от друга начинает действовать сила взаимного отталкивания ядер, которая возрастает при дальнейшем сближении атомов. Наконец, силы отталкивания и притяжения сравняются. При этом электронные облака двух атомов перекрываются:
Область перекрывания облаков лежит точно посередине между ядрами и удерживает их друг около друга, так как эта область повышенного отрицательного заряда.
Образовалась химическая связь. Механизм образования связи – обменный (один электрон – от одного атома, второй электрон – от другого). Область повышенной электронной плотности (область перекрывания облаков) означает, что оба электрона принадлежат двум атомам и чаще всего их можно обнаружить именно в этом пространстве между ядрами. Каждый атом приобрел устойчивую внешнюю электронную оболочку благородного газа гелия He.
Каждый атом приобрел устойчивую внешнюю электронную оболочку благородного газа гелия He.
Электронная схема образования молекулы H2:
Заменив общую электронную пару черточкой, получим структурную формулу молекулы H2:
Одна общая электронная пара равносильна одной химической связи. Так как каждый атом H образовал одну химическую связь, то он одновалентен. Валентность пишется римской цифрой над атомом.
Валентность – это число химических связей, образованных атомом.
Химическая связь, образованная за счет общей электронной пары, называется ковалентной.
По способу перекрывания электронных облаков ковалентные связи подразделяются на σ- (сигма) и (пи)-связи. В молекуле H2 реализуется σ-связь. Химическая связь, при которой область перекрывания электронных облаков лежит на линии, соединяющей два ядра, называется сигма (σ)-связью. В данном случае перекрываются два s-облака, поэтому связь σ s-s.
В данном случае перекрываются два s-облака, поэтому связь σ s-s.
В образовании химической связи в молекуле Cl2 принимает участие неспаренный p-электрон каждого атома.
Электронная конфигурация валентных электронов атома хлора:
Атом хлора имеет три пары спаренных электронов и один неспаренный, укажем их точками:
Неспаренные p-электроны двух атомов спариваются и становятся общими для двух атомов. При этом каждый атом приобретает устойчивую внешнюю восьмиэлектронную структуру инертного газа аргона Ar (3s23p6).
Электронная схема образования молекулы Cl2:
Одна общая электронная пара, следовательно, одна химическая связь. Структурная формула молекулы Cl2: .
Структурная формула молекулы Cl2: .
Каждый атом образует одну химическую связь, поэтому он одновалентен. Одна химическая связь может быть только сигма связью. Общие электроны связи в одинаковой мере принадлежат обоим атомам, находятся точно посредине между двух ядер, так как атомы одинаковые и с одинаковой силой тянут на себя электроны.Такая связь называется ковалентной неполярной.
В молекуле Cl2 происходит перекрывание p-облаков и образуется сигма (σ)-связь p-p:
При образовании молекулы O2 два неспаренных валентных p-элек-трона каждого атома O образуют две пары общих электронов, т.е. две химические связи.
Электронная конфигурация атома О:
Электронная схема образования молекулы O2:
Две пары общих электронов равносильны двум химическим связям.
— структурная формула молекулы О2
Так как атом кислорода образует две химические связи, он двухвалентен. Связь двойная ковалентная неполярная, так как образована одинаковыми атомами. Электронные облака двух неспаренных электронов атома кислорода взаимно перпендикулярны друг другу. Одно из них образует -связь p-p:
Другое p-облако образует с таким же облаком второго атома кислорода (пи)-связь, в плоскости, перпендикулярной первой:
(пи)- связь отличается от -связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.
(пи)-связь менее прочная, чем (сигма), так как в случае p-связи между положительно заряженными ядрами нет отрицательного заря-да, поэтому они отталкиваются друг от друга и ослабляют её, тогда как в σ-связи на пути между положительными ядрами расположена отри-цательная область перекрывания облаков, которая стягивает два ядра. Если между двумя атомами образуются две связи, то одна из них σ, а другая – -связь.
Если между двумя атомами образуются две связи, то одна из них σ, а другая – -связь.
В общем случае, если между двумя атомами три химические связи, то одна из них всегда , а две другие – -связи
Электронная схема образования HCl:
— электронная формула молекулы
H — Cl – структурная формула молекулы
Перекрывание электронных облаков:
Общая электронная пара в молекуле HCl одна, то есть образуется одна химическая связь по обменному механизму, следовательно, атом H и атом Cl одновалентны:
Общая электронная пара не находится посредине между ядрами двух атомов, а смещена к более электроотрицательному атому хлора .
Отчего на атоме хлора образуется частичный отрицательный заряд, а на атоме водорода – частичный положительный, то есть образуются полюса – положительный и отрицательный, такая связь называется ковалентной полярной.
Электроотрицательность – свойство атома притягивать общую электронную пару. Наибольшей электроотрицательностью обладает элемент с наименьшим радиусом атома – F. Его относительная электроотрицательность принята равной 4.0, а наименьшей электроотрицательностью обладает атом с наибольшим радиусом – франций Fr. Так как относительная электроотрицательность связана с радиусом атома, который изменяется периодически в зависимости от заряда ядра атома, то относительная электроотрицательность (э.о.) также изменяется периодически.
Таблица 6. Относительная электроотрицательность атомов (э.о.)
В таблице 6 даны относительные электроотрицательности атомов. В периоде слева направо э.о. возрастает, а в подгруппе А сверху вниз э.о. уменьшается. Свойство притягивать электроны – свойство неметалла и, как видим из таблицы, в периоде слева направо усиливаются неметаллические свойства и увеличивается электроотрицательность. В главных подгруппах сверху вниз неметаллические свойства веществ, образованных данными атомами, уменьшаются, и уменьшается их электроотрицательность.
В главных подгруппах сверху вниз неметаллические свойства веществ, образованных данными атомами, уменьшаются, и уменьшается их электроотрицательность.
Ряд электротрицательности, который необходимо запомнить:
Вернемся к молекуле . Молекула представляет из себя диполь («ди» в переводе с греческого означает «два», два полюса – положительный и отрицательный). От атома водорода к атому хлора сместился один электрон и принес отрицательный заряд, поэтому степень окисления хлора равна (-1), а от атома водорода сместился также один электрон, степень окисления водорода (+1):
Степень окисления – это число смещенных электронов, или заряд, который получит атом, если предположить, что связь ионная. В случае молекул H2, O2, Cl2, когда атомы, образующие связь, одинаковы и нет смещения общей электронной пары от центра симметрии молекулы, степень окисления атома равна нулю:
В молекуле H2O атом кислорода образует две химические связи с двумя атомами водорода за счёт своих двух неспаренных электронов. Он двухвалентен. Атом водорода всегда одновалентен, так как имеет только один электрон. Неспаренные электроны атома кислорода находятся на взаимноперпендикулярных p-орбиталях, поэтому молекула H2O имеет угловое строение.
Он двухвалентен. Атом водорода всегда одновалентен, так как имеет только один электрон. Неспаренные электроны атома кислорода находятся на взаимноперпендикулярных p-орбиталях, поэтому молекула H2O имеет угловое строение.
Электронная схема образования молекулы H2O:
Общие электроны связей смещены к более электроотрицательному атому кислорода. Поэтому связи ковалентные полярные:
От двух атомов водорода по двум связям смещено два электрона, которые приносят отрицательный заряд, поэтому степень окисления кислорода равна (-2). От каждого атома водорода смещено по одному электрону, они уносят с собой отрицательный заряд и оставляют положительный заряд протонов, поэтому степень окисления водорода (+1).
Молекула H2O имеет угловое строение. Если сложить два вектора связей, результирующий вектор не равен нулю и будет направлен к кислороду. Поэтому молекула воды полярна, то есть представляет из себя диполь:
Поэтому молекула воды полярна, то есть представляет из себя диполь:
85) Составьте электронные схемы образования молекул N2, HI, NH3, CH4. Покажите, что атомы приобрели устойчивую восьмиэлектронную оболочку, запишите структурные формулы молекул и определите валентность и степень окисления каждого атома.
86) Из предложенного перечня выберите три элемента-неметалла и расположите их в порядке уменьшения их электроотрицательности:
1) N 2) Be 3) O 4) Rb 5) Cl
Ответ:
Укажите номера правильных ответов (несколько цифр).
87) Из предложенного перечня выберите три элемента-неметалла и расположите их в порядке увеличения их электроотрицательности:
1) H 2) I 3) S 4) Sc 5) Ge
Ответ:
Укажите номера правильных ответов (несколько цифр).
Характеристика химической связи
Химическая связь характеризуется длиной, прочностью, кратностью, полярностью, направленностью, насыщаемостью.
Энергия связи – это энергия, которую необходимо затратить на разрыв химической связи, измеряется в кДж/моль.
При образовании любой химической связи энергия всегда выделяется. Чем в бóльшей степени перекрываются электронные облака, тем больше энергии при этом выделяется, тем прочнее химическая связь.
Длина связи – это расстояние между ядрами двух атомов, образовавших химическую связь.
Кратность связи определяется числом общих электронных пар между двумя атомами.Связь бывает одинарная (-связь), двойная (одна — и одна -связь), тройная (одна — и две -связи).
Примеры веществ:
Мерой прочности связи является энергия связи. Чем больше энергия связи, тем прочнее связь.
Чем больше энергия связи, тем прочнее связь.
Тройная связь прочнее двойной, а двойная – прочнее одинарной.
Прочность связи также связана с длиной связи. Например, в ряду однотипных молекул H—F, H—Cl, H—Br, H—I увеличивается длина связи, так как увеличивается радиус атома в ряду F, Cl, Br, I:
С увеличением длины связи уменьшается притяжение ядер атомов к области перекрывания электронных облаков, следовательно, уменьшается прочность связи.
Мерой полярности химической связи является разность электроотрицательностей атомов, образующих данную связь. Чем больше эта разность, тем больше смещена общая электронная пара к одному из атомов, тем более полярна связь.
Сравним полярность связей HF и HCl, для чего рассчитаем разность электроотрицательностей (э.о.), пользуясь таблицей электроотрицательности (см. табл. 6): э. о. (H) = 2,1; э.о. (F) = 4,0; э.о. (Cl) = 3,0.
о. (H) = 2,1; э.о. (F) = 4,0; э.о. (Cl) = 3,0.
Связь HF: э.о. (F) – э.о. (H) = 4,0 – 2,1 = 1,9.
Связь HCl: э.о. (Cl) – э.о. (H) = 3,0 – 2,1 = 0,9.
1,9 > 0,9 – полярность связи HF больше, чем HCl.
Но в данном случае в двух сравниваемых молекулах имеется атом водорода и можно обойтись без расчётов. Фтор более электроотрицателен, чем хлор, поэтому молекула HF более полярна.
Ионную химическую связь можно считать крайним случаем полярности связи. Мы знаем также, что ионная связь ненаправлена и ненасыщаема. При образовании ковалентной связи область перекрывания облаков находится в определенном направлении по отношению к взаимодействующим ядрам:
Поэтому ковалентная связь обладает направленностью.
Число ковалентных связей, которые может образовать атом по обменному механизму, ограничено максимальным числом неспаренных валентных электронов в максимально возбужденном состоянии атома (см. таблицу ниже), поэтому ковалентная связь насыщаема.
таблицу ниже), поэтому ковалентная связь насыщаема.
Итак, ковалентную химическую связь образуют атомы неметаллов. Разные по электроотрицательности неметаллы образуют ковалентную полярную связь, а одинаковые атомы образуют ковалентную неполярную связь. Ковалентная связь направлена и насыщаема. Атомы неметаллов с металлами образуют ионную связь, которая ненаправлена и ненасыщаема.
В образовании связей участвуют валентные электроны, происходит снижение полной энергии молекулы по сравнению с суммарной энергией взаимодействующих атомов. Лишняя энергия выделяется и называется энергией связи.
Чем больше энергии выделяется, тем прочнее связь.
88) Составьте электронные схемы образования молекул HBr, NF3, LiF, BaO, SiCl4, H2Se, I2, CO2, K2S. Определите тип связи. В случае ковалентной химической связи определите валентность и степень окисления атомов и нарисуйте структурную формулу молекулы и перекрывание электронных облаков.
Определите тип связи. В случае ковалентной химической связи определите валентность и степень окисления атомов и нарисуйте структурную формулу молекулы и перекрывание электронных облаков.
89) В каком ряду записаны формулы веществ только с ковалентной полярной связью:
1) HCl, KCl, SF6; 2) NH3, ClF, HF; 3) NO2, P4, HBr; 4) CCl4, I2, H2S.
Укажите номера правильных ответов (одна цифра).
90) Тремя общими электронными парами образована ковалентная связь в молекуле:
1) NH3; 2) N2; 3) K3N; 4) O2.
Укажите номера правильных ответов (одна цифра).
91) Ковалентная неполярная связь реализуется в соединении:
1) B2O3; 2) S8; 3) CH4; 4) HI.
Укажите номера правильных ответов (одна цифра).
92) Число σ-связей в молекуле CO2:
1) 1 2) 2 3) 3 4) 4.
Укажите номера правильных ответов (одна цифра).
93) Ионный характер связи наиболее выражен в соединении:
1) KF; 2) HF; 3) As2O5; 4) NO.
Укажите номера правильных ответов (одна цифра).
94) Атомы химических элементов III-го периода периодической системы Д.И. Менделеева образуют соединение с наиболее выраженным ионным характером связи:
1) MgF2; 2) SiO2; 3) Al2S3; 4) NaCl.
Укажите номера правильных ответов (одна цифра).
95) Длина связи увеличивается в ряду:
1) NH3, AsH3, PH3; 2) H2O, H2S, HCl; 3) H2O, H2S, H2Se; 4) HCl, HI, HBr.
Укажите номера правильных ответов (одна цифра).
96) Число связей увеличивается в ряду:
1) CO2, CCl4; 2) NO2, NH3; 3) N2, H2O; 4) PCl3, SO2.
Укажите номера правильных ответов (одна цифра).
97) Прочность связи увеличивается в ряду:
1) Cl2, O2, N2; 2) HF, HBr, HCl; 3) O2, N2, Cl2; 4) HI, HF, HCl.
Укажите номера правильных ответов (одна цифра).
98) Установите соответствие между формулой вещества и числом σ-связей в молекуле этого вещества:
| Вещество | Число σ-связей | |
| А) SO3 | 1) 1 | |
| Б) N2 | 2) 2 | |
| В) CO2 | 3) 3 | |
| 4) 4 | ||
| 5) 5 | ||
| 6) 6 |
Ответ:
К каждой позиции, обозначенной буквой, выберите позицию, обозначенную цифрой. Например, в ответе нужно записать 132.
Например, в ответе нужно записать 132.
99) Ионную связь образуют:
1) Rb и Br; 2) As и Cl; 3) Si и O; 4) Te и F.
Укажите номера правильных ответов (одна цифра).
100) Оцените правильность суждений о химической связи:
А) При образовании химической связи энергия всегда выделяется;
Б) -связь прочнее σ-связи;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
101) Оцените правильность суждений о химической связи:
А) При разрыве некоторых связей происходит выделение энергии;
Б) Ионная химическая связь ненаправлена и ненасыщаема;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
102) Оцените правильность суждений о химической связи:
А) Двойная связь прочнее, чем одинарная;
Б) Чем больше энергии выделяется при образовании связи, тем прочнее связь;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
103) Из предложенного перечня выберите два соединения с наиболее полярной связью:
1) PH3; 2) BrCl3; 3) SiO2; 4) HF; 5) P2S3.
Укажите номера правильных ответов (две цифры).
104) Из предложенного перечня выберите три соединения с ковалентной полярной связью.
Расположите их в порядке увеличения длины связи:
1) SCl4; 2) P4; 3) CsCl; 4) SiCl4; 5) PCl3.
Ответ:
Укажите номера правильных ответов (три цифры).
105) Из предложенного перечня выберите три соединения с ковалентной полярной связью. Расположите их в порядке увеличения полярности связи:
1) S8; 2) KH; 3) HI; 4) PH3; 5) HBr.
Ответ:
Укажите номера правильных ответов (три цифры).
106) Из предложенного перечня выберите три вещества с ковалентной полярной связью. Расположите их в порядке увеличения прочности связи в молекуле:
1) Cl2O; 2) SCl4 3) SrCl2; 4) Cl2; 5) SeCl4.
Ответ:
Укажите номера правильных ответов (три цифры).
107) Из предложенного перечня веществ выберите три, в молекулах которых имеется -связь. Расположите их в порядке увеличения полярности связи:
Расположите их в порядке увеличения полярности связи:
1) O2; 2) P4; 3) CO2; 4) PF5; 5) SO3.
Ответ:
Укажите номера правильных ответов (три цифры).
§2.3. Донорно-акцепторный механизм образования ковалентной связи
Ранее был рассмотрен обменный механизм образования ковалентной связи, когда каждый атом, образующий химическую связь, дает по одному электрону в общее пользование, получается общая электронная пара, связывающая ядра двух атомов. Электронную пару в общее пользование может дать один атом (донор), а другой предоставит свободную орбиталь (акцептор). Образованная таким способом химическая связь является разновидностью ковалентной связи, так как образована общей парой электронов и отличается лишь механизмом образования, который называется донорно-акцепторным механизмом.
Рассмотрим несколько случаев образования донорно-акцепторной связи:
1) В молекуле NH3 атом азота образует три химические связи с тремя атомами водорода, у него остается одна пара валентных спаренных электронов, так как электронная конфигурация валентных электронов атома азота следующая:
Электронная схема образования NH3:
Cвободная валентная пара электронов атома азота может участвовать в образовании ковалентной связи по донорно-акцепторному механизму, а именно атом азота в молекуле :NH3 может быть донором электронов. Акцептором электронов может быть катион водорода (протон), у которого не осталось электронов, но имеется свободная валентная орбиталь.
Акцептором электронов может быть катион водорода (протон), у которого не осталось электронов, но имеется свободная валентная орбиталь.
Электронная схема образования :
Заменив общие пары электронов черточками, получим структурную формулу иона аммония:
Ион водорода принес с собой положительный заряд. В образованном ионе аммония азот четырехвалентен, так как имеет четыре химические связи. Четвёртая связь, образованная по донорно-акцепторному механизму, в итоге ничем не отличается от трех других. Чтобы показать донорно-акцепторную связь, отмечаем ее стрелкой, направленной от донора к акцептору.
На рисунке справа показано смещение электронных пар. Четыре связи ковалентные полярные, общие пары электронов смещены в сторону более электроотрицательного атома азота.
В четвертой химической связи атом водорода не дал ни одного электрона (изначально был ион водорода H+, не имеющий электронов), поэтому к атому азота от атомов водорода смещены только три электрона, значит, степень окисления азота равна (-3):
2) По донорно-акцепторному механизму образуется и ион H3O+ (ион гидроксония) из молекулы H2O и протона H+.
Конфигурация валентных электронов атома кислорода
то есть атом кислорода имеет два неспаренных электрона и две пары спаренных электронов:
В молекуле H2O у атома кислорода остались незадействованными две пары валентных электронов, поэтому он может быть донором электронов при образовании иона H3O+.
Электронная схема образования иона гидроксония:
В ионе H3O+ атом кислорода образовал три химические связи, поэтому он трехвалентен. Все три связи ковалентные полярные, общие электроны связей смещены к более электроотрицательному атому кислорода. Два атома водорода дали в общее пользование каждый по одному электрону, третий атом H не имел электронов, был ионом H+, оба электрона связи были от атома кислорода, поэтому степень окисления атома кислорода
(-2) – по числу смещенных электронов, степень окисления атома H – (+1).
3) Ион [BF4]–
Электронная конфигурация валентных электронов атома бора в основном состоянии: . В возбужденном состоянии: .
Атом бора в возбужденном состоянии имеет три неспаренных электрона и одну свободную валентную орбиталь
Электронная конфигурация валентных электронов атома фтора:
Электронная схема образования молекулы BF3:
Атом бора в молекуле BF3 не приобрел устойчивую внешнюю восьмиэлектронную оболочку благородного газа, а имеет только шесть электронов на внешнем энергетическом уровне, но у него осталась свободная валентная орбиталь и он может выступить в качестве акцептора при образовании химической связи с донором электронов ионом F–.
Электронная схема образования иона BF4–:
Ион F— принес c собой отрицательный заряд. В ионе BF4– атом бора приобрел устойчивую восьмиэлектронную внешнюю оболочку, образовал четыре химические связи, поэтому он четырехвалентен. Все четыре общие электронные пары смещены в сторону более электроотрицательного атома фтора, его степень окисления (-1), столько электронов смещено в сторону одного атома фтора. Степень окисления атома бора равна (+3), так как от атома бора смещено по трем связям три электрона, а четвертая связь образовалась по донорно-акцепторному механизму и бор был акцептором электронов.
В ионе BF4– атом бора приобрел устойчивую восьмиэлектронную внешнюю оболочку, образовал четыре химические связи, поэтому он четырехвалентен. Все четыре общие электронные пары смещены в сторону более электроотрицательного атома фтора, его степень окисления (-1), столько электронов смещено в сторону одного атома фтора. Степень окисления атома бора равна (+3), так как от атома бора смещено по трем связям три электрона, а четвертая связь образовалась по донорно-акцепторному механизму и бор был акцептором электронов.
4) Молекула CO. Электронная конфигурация валентных электронов:
Два неспаренных электрона атомов C и O образуют две химические связи:
Атом углерода не приобрел устойчивую восьмиэлектронную внешнюю оболочку, на внешнем энергетическом уровне у него только шесть электронов, но он может образовать еще одну химическую связь по донорно-акцепторному механизму (обозначена стрелкой), так как имеет свободную валентную орбиталь и может быть акцептором электронов, а атом кислорода имеет свободную валентную электронную пару и может быть донором электронов:
Атом углерода приобрел устойчивую восьмиэлектронную внешнюю оболочку. В молекуле CO три химические связи, поэтому атомы углерода и кислорода имеют валентность III. От атома углерода к более электроотрицательному атому кислорода по двум химическим связям смещено два электрона, а по третьей связи ни одного, так как в этой связи углерод являлся акцептором. По количеству смещенных электронов углерод имеет степень окисления (+2), а кислород – (-2):
В молекуле CO три химические связи, поэтому атомы углерода и кислорода имеют валентность III. От атома углерода к более электроотрицательному атому кислорода по двум химическим связям смещено два электрона, а по третьей связи ни одного, так как в этой связи углерод являлся акцептором. По количеству смещенных электронов углерод имеет степень окисления (+2), а кислород – (-2):
То, что в молекуле CO три химические связи, как и в молекуле N2, подтверждают близкие значения их энергий связи.
Eсв. (CO) = 1076 кДж./моль; Eсв. (N2) = 945 кДж./моль.
Для сравнения: Eсв. (O2) = 498 кДж./моль O = O
Eсв. (Cl2) = 243 кДж./моль Cl – Cl
Самое низкое значение Eсв. (Cl2), где одинарная химическая связь, выше – значение Eсв. (O2), где двойная химическая связь, и ещё выше Eсв. (N2) ≈ Eсв. (CO), где тройная химическая связь.
(N2) ≈ Eсв. (CO), где тройная химическая связь.
5) O3
Электронная конфигурация валентных электронов атома O: или – в основном состоянии. Возбужденное состояние атома возможно не только при распаривании электронных пар, но и при спаривании неспаренных электронов: или . Два неспаренных электрона двух атомов кислорода в основном состоянии образуют две химические связи:
Затем молекула O2 образует донорно-акцепторную связь с возбужденным атомом кислорода:
Заменим общие электронные пары черточками, получим структурную формулу молекулы. Донорно-акцепторную связь покажем стрелкой:
Все атомы кислорода имеют разную валентность, а степень окисления у всех равна нулю, так как связи ковалентные неполярные, смещения электронов нет.
6) Образование молекулы NO (одна из гипотез).
Электронная схема образования молекулы NO:
Получается химическая связь – не двойная, не тройная, а промежуточная между ними (порядок связи 2,5). Такая гипотеза подтверждается энергией связи Eсв.(NO) = 678 кДж./моль. Это значение является промежуточным между энергией тройной связи Eсв.(N2) = 945 кДж./моль и двойной связи Eсв.(O2) = 498 кДж./моль. Молекула NO, имеющая неспаренный электрон, называется радикалом, и обладает магнитными свойствами, втягивается в магнитное поле.
7) NO2 является, как и NO, радикалом, и также обладает магнитными свойствами. Одна из гипотез образования NO2:
Энергии двух связей NO одинаковы и указывают на наличие не одинарной и не двойной, а полуторных связей.
8)HNO3. Структурная формула молекулы изображается так:
Атом азота четырехвалентен. Одна из четырех связей его с кислородом – донорно-акцепторная. Донором является атом азота, так как имеет электронную пару, а акцептором – атом кислорода в возбужденном состоянии:
Степень окисления атома азота в этом соединении равна (+5), так как все пять его электронов смещены к более электроотрицательным атомам кислорода. Причем по одинарной донорно-акцепторной связи от азота к кислороду смещено 2e. По всем остальным связям от азота к кислороду по каждой связи смещено по 1e, так как эти связи образованы по обменному механизму:
108) Самостоятельно составьте электронные схемы образования молекул и ионов, фигурирующих в тексте, и определите валентность и степень окисления элементов.
109) Из предложенного перечня выберите два, в которых имеется донорно-акцепторная связь.
1) B2O3;
2) NH3;
3) O3;
4) (NH4)2S;
5) (NH2)2CO
Ответ:
Укажите номера правильных ответов (несколько цифр).
110) Из предложенного перечня выберите три соединения с ковалентной полярной связью. Расположите их в порядке увеличения прочности связи в молекуле.
1) S8;
2) CO;
3) CS2;
4) CO2;
5) Li2S
Ответ:
Укажите номера правильных ответов.
111) Из предложенного перечня выберите три соединения с наибольшим числом связей в молекуле.
1) HNO3;
2) NCl3;
3) SO3;
4) PCl5;
5) CS2.
Ответ:
Укажите номера правильных ответов. Расположите их в порядке увеличения числа -связей в молекуле.
112) Выберите две частицы, в которых валентность элемента численно не совпадает со степенью окисления этого же элемента:
1) NH3;
2) H3O+;
3) SO3;
4) Cl2O;
5) N2O5.
Ответ:
Укажите номера правильных ответов(две цифры).
§2.4. Валентные возможности атомов
В §2.2. мы рассмотрели образование ковалентной связи по обменному механизму. Число химических связей, образуемых атомом, зависит в этом случае от числа неспаренных электронов. Если углерод имеет в возбужденном состоянии 4 неспаренных электрона, то может образовать четыре химические связи по обменному механизму и проявляет валентность IV.
Число химических связей, образуемых атомом, зависит в этом случае от числа неспаренных электронов. Если углерод имеет в возбужденном состоянии 4 неспаренных электрона, то может образовать четыре химические связи по обменному механизму и проявляет валентность IV.
Валентность IV, равная номеру группы – это максимальная валентность атома углерода.
У атома водорода всего 1e, поэтому он всегда одновалентен. Для водорода и других атомов-неметаллов, кроме элементов II-го периода, инертных газов He, Ne, Ar, максимальная валентность равна номеру группы:
Для элементов II-го периода B, N, O и F максимальная валентность не совпадает с номером группы. Для бора и азота их высшая валентность определяется числом валентных орбиталей и равна IV, так как бор, имея свободную валентную орбиталь, может образовать дополнительно одну ковалентную связь по донорно-акцепторному механизму, являясь акцептором электронов, а атом азота может быть донором электронов за счет неподеленной валентной пары электронов и также образовать дополнительно одну ковалентную связь по донорно-акцепторному механизму (см. §2.3.)
§2.3.)
Таким образом, азот – элемент V-ой группы – не может быть пятивалентным, а бор – элемент III-ей – группы может проявлять и валентность IV. Кислород – элемент VI-ой группы – также не может быть шестивалентным, так как не имеет d-подуровня для распаривания электронных пар. Максимальная его валентность равна III. Одна из трех химических связей образуется по донорно-акцепторному механизму (см. §2.3.)
Чаще всего кислород двухвалентен:
F – элемент VII-ой группы – также не может быть семивалентным:
Так как у него только один неспаренный электрон, он всегда одновалентен.
В таблице 7 показаны электронные конфигурации валентных орбиталей некоторых атомов в основном и возбужденном состояниях и их валентные состояния, а также возможные степени окисления и формулы
веществ, в которых проявляюся эти валентности и степени окисления.
Инертные газы He, Ne и Ar не образуют соединений. Максимальная валентность благородных газов Xe, Rn равна VIII и проявляется в немногочисленных соединениях со фтором и кислородом: XeF8, XeO4.
Атомы неметаллов могут проявлять как положительные, так и отрицательные степени окисления. Их максимальная положительная степень окисления равна числу валентных электронов и, значит, равна номеру группы (кроме атомов кислорода и фтора). Рассмотрим на примере атома серы. Сера находится в 6-ой группе периодической системы, максимальная степень окисления равна (+6), например, в соединении
Атом S, находясь в маскимально возбужденном состоянии, образует 6 ковалентных связей, то есть является шестивалентным. Общие электронные пары связей смещены в сторону более электроотрицательных атомов фтора, по шести связям от атома серы смещено 6е, поэтому степень окисления серы (+6). Таким образом, валентность и степень окисления серы в молекуле SF6 совпадают.
Низшая степень окисления элемента-неметалла определяется числом электронов, которое может принять атом от менее электроотрицательного элемента до устойчивого восьмиэлектронного состояния и вычисляется по формуле: – (8 – № группы). Для серы: – (8 – 6) = –2. Так, в молекуле H2S, к атому серы по двум химическим связям смещено 2е. В этом соединении валентность и степень окисления также численно совпадают:
У атома серы может быть ещё одно возбужденное состояние, где 4 неспаренных электрона. В этом состоянии она проявляет валентность IV, а степень окисления +4.
Так как фтор – самый электроотрицательный элемент, то он не может иметь положительную степень окисления, а поскольку он всегда одновалентен, то его степень окисления всегда равна (-1) и только в простом веществе F2 степень окисления равна 0.
Таблица 7. Возможные валентные состояния и степени окисления некоторых элементов
Окончание табл. 7
7
Атомы любых металлов могут иметь только положительные степени окисления, так как не могут принимать электроны, и их низшая степень окисления равна 0. Металлы s-элементы имеют постоянную положительную степень окисления, равную номеру группы.
d-элементы, как правило, имеют непостоянные степени окисления, их максимальная степень окисления не всегда совпадает с номером группы. Так, элемент I-ой группы Cu устойчив в степени окисления (+2).
В таблице 8 даны возможные степени окисления некоторых d-элементов.
Таблица 8. Возможные степени окисления некоторых d-элементов и электронные конфигурации валентных электронов в основном состоянии
Хорошо объяснимо, что цинк может иметь только одну степень окисления (+2). Электронная конфигурация Zn … 3s23p63d104s2. Третий энергетический уровень завершен, на нем 18 электронов, и отрыв хотя бы одного из этих электронов нарушает завершенность 3d-подуровня и 3-го уровня, нарушает устойчивость атома, следовательно, энергетически невыгоден. Валентными фактически являются 4s2-электроны, хотя Zn – d-элемент, а у d-элементов валентные электроны – это электроны последнего энергетического уровня и предпоследнего d-подуровня. Отдавая 4s2-электроны, Zn проявляет степень окисления (+2).
Третий энергетический уровень завершен, на нем 18 электронов, и отрыв хотя бы одного из этих электронов нарушает завершенность 3d-подуровня и 3-го уровня, нарушает устойчивость атома, следовательно, энергетически невыгоден. Валентными фактически являются 4s2-электроны, хотя Zn – d-элемент, а у d-элементов валентные электроны – это электроны последнего энергетического уровня и предпоследнего d-подуровня. Отдавая 4s2-электроны, Zn проявляет степень окисления (+2).
113) Исходя из основного и возбужденного состояний атомов Si, As, Se, Br определите их возможные валентные состояния и степени окисления.
114) Из указанных в ряду химических элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4:
1) N;
2) O;
3) Cr;
4) S;
5) P.
Ответ:
Укажите номера правильных ответов.
115) Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6:
1) O;
2) Fe;
3) Se;
4) Sn;
5) Sr.
Ответ:
Укажите номера правильных ответов.
116) Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять отрицательные степени окисления:
1) O;
2) Fe;
3) Se;
4) Sn;
5) Sr.
Ответ:
Укажите номера правильных ответов.
117) Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления:
1) O;
2) Cr;
3) Zn;
4) Sn;
5) Sr.
Ответ:
Укажите номера правильных ответов.
118) Из указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы:
1) Se;
2) Cu;
3) N;
4) Mn;
5) O.
Ответ:
Укажите номера правильных ответов (две цифры).
119) Из указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы:
1) F;
2) Fe;
3) B;
4) Br;
5) Ba.
Ответ:
Укажите номера правильных ответов (две цифры).
120) Из числа указанных в ряду химических соединений выберите два, в которых степень окисления азота и его валентность численно не совпадают:
1) NH3;
2) N2;
3) NF3;
4) HNO3;
5) NOF.
Ответ:
Укажите номера правильных ответов (две цифры).
121) Из числа указанных в ряду химических соединений выберите два, в которых степень окисления кислорода и его валентность численно не совпадают.
1) O2;
2) H2O;
3) OF2;
4) CO2;
5) H2O2.
Ответ:
Укажите номера правильных ответов (две цифры).
§2.5. Металлическая связь
Атомы металлов, вследствие их больших радиусов, легко теряют валентные электроны. В простых веществах-металлах, а также в сплавах, часть атомов находится в виде катионов. Освободившиеся электроны легко передвигаются между атомами и ионами (они обобществлены), и как цемент связывают кирпичики-катионы между собой.
Связь между ионами металлов, осуществляемая свободнодвижущимися электронами, называется металлической.
При наложении на металл разности потенциалов относительно свободные электроны начинают двигаться от отрицательного полюса к положительному. Так объясняется электропроводность металлов. Наличием свободных электронов объясняется и теплопроводность металлов и сплавов.
Большинство металлов имеют мало валентных электронов на внешнем энергетическом уровне и много свободных валентных орбиталей. В простом веществе металле атомы и ионы настолько близко подходят
друг к другу, что происходит перекрывание их валентных орбиталей, а валентные электроны могут свободно передвигаться по всем валентным орбиталям. При деформации металла (ковка, прокатка) слои атомов и ионов могут передвигаться относительно друг друга без ущерба для металлической связи. Например, из алюминия можно получить фольгу толщиной 0,01 мм, а из золота путем ковки или прокатки – фольгу толщиной 0,0001 мм.
Таким образом, физические свойства металлов – электро- и теплопроводность, ковкость, пластичность объясняются особым их строением, металлической связью между атомами и ионами.
§2.6. Межмолекулярные силы
Вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. В газах расстояние между молекулами гораздо больше размеров самих молекул. В жидкостях и твердых веществах расстояние между молекулами соизмеримо с размерами самих молекул. В жидкостях молекулы могут перемещаться относительно друг друга (текучесть), в твердых веществах движение отсутствует, имеются лишь легкие колебания относительно определенного положения.
Наличие трех агрегатных состояний веществ говорит о том, что между молекулами существуют силы взаимного притяжения. В твердых веществах они самые сильные, в жидкостях – слабее, в газах – самые слабые.
Все эти силы электрического происхождения.
Если в веществе реализуется ионная связь (например, NaCl), то оно построено не из молекул, а из ионов, которые электростатически притягиваются друг к другу и сила их притяжения (по закону Кулона) пропорциональна произведению их зарядов и обратно пропорциональна квадрату расстояния между их центрами.
Если вещество построено из полярных молекул, которые представляют из себя диполи, например, HCl:
то между такими молекулами-диполями действуют постоянные межмолекулярные силы притяжения, называемые ориентационными, так как один диполь ориентирует соседний диполь определенным образом, отрицательным концом к своему положительному концу. Ясно, что ориентационные силы слабее сил электростатического притяжения полноценных ионов, так как в диполях заряд только частичный, меньше одинарного.
Если вещество построено из неполярных молекул (H2, Cl2), где нет ионов и диполей, между их молекулами также существуют силы притяжения. А иначе – как объяснить, что инертные газы, состоящие из неполярных одноатомных молекул, при достаточном понижении температуры переходят в жидкое или твердое состояние?
Вследствие непрерывного вращения отрицательных электронов и колебательного движения положительных ядер, в каждом из атомов всегда возможно временное смещение электронных орбит относительно ядра и обусловленное этим временное возникновение наведенных диполей:
Хотя возникающие диполи могут существовать ничтожно малое время, их возникновение повторяется практически непрерывно. Такого рода межмолекулярные силы называются дисперсионными и являются самыми слабыми. В веществах с полярными молекулами действуют и дисперсионные силы. Все виды дисперсионных сил называются «силами Ван-дер-Ваальса».
Такого рода межмолекулярные силы называются дисперсионными и являются самыми слабыми. В веществах с полярными молекулами действуют и дисперсионные силы. Все виды дисперсионных сил называются «силами Ван-дер-Ваальса».
Межмолекулярные силы влияют на расстояние между частицами вещества, а, следовательно, по тому, из каких частиц построено вещество (из ионов, полярных молекул или неполярных молекул), можно предположить, каково его агрегатное состояние при комнатной температуре.
Так как в ионных соединениях существуют сильные связи между частицами вещества, то все вещества ионного строения твердые при обычной температуре. Самые слабые силы действуют между неполярными молекулами, и при комнатной температуре большинство таких веществ являются газами, где между молекулами большие расстояния: инертные газы, H2, N2, O2, F2.
Чем выше межмолекулярные силы, тем больше усилий необходимо приложить для их разрыва и перевода вещества из твердого состояния в жидкое и из жидкого в газообразное (переход этот происходит при температурах плавления (t°пл. ) и кипения (t°кип.) соответственно), тем выше t°пл. и t°кип. вещества. При нагревании вещества его частицы (ионы, молекулы, атомы) получают тепловую энергию. Чем сильнее связаны между собой частицы вещества, тем больше энергии им требуется, чтобы разорвались связи между ними, следовательно, тем выше t°пл. и t°кип. этого вещества. У веществ ионного строения высокие t°пл. и t°кип., у веществ молекулярного строения они ниже.
) и кипения (t°кип.) соответственно), тем выше t°пл. и t°кип. вещества. При нагревании вещества его частицы (ионы, молекулы, атомы) получают тепловую энергию. Чем сильнее связаны между собой частицы вещества, тем больше энергии им требуется, чтобы разорвались связи между ними, следовательно, тем выше t°пл. и t°кип. этого вещества. У веществ ионного строения высокие t°пл. и t°кип., у веществ молекулярного строения они ниже.
Рассмотрим простые вещества F2, Cl2, Br2, I2. Их молекулы однотипны, неполярны, с одинарной ковалентной связью: F–F, Cl–Cl, Br–Br, I–I. В этом ряду радиусы атомов возрастают. Чем больше радиус атома (а значит, и его масса), тем слабее связаны с ядром валентные электроны, тем легче образуется из такого атома кратковременный диполь (атом поляризуется, становится полярным), тем сильнее межмолекулярные силы (дисперсионные), тем выше t°пл. и t°кип. вещества.
и t°кип. вещества.
В таблице 9 даны температуры плавления и кипения галогенов и их агрегатные состояния при комнатной температуре.
Таблица 9. Физические свойства галогенов
§2.7. Водородная связь
Как видим из таблицы 9, с увеличением молекулярной массы вещества в ряду F2, Cl2, Br2, I2 увеличивается и интенсивность окраски вещества от светло-желтого до темно-филетового, так как уменьшается расстояние между молекулами вследствие увеличения сил межмолекулярного притяжения. Расстояние между молекулами брома (жидкость) меньше, чем между молекулами газов F2 и Cl2, а между молекулами I2 (твердое вещество) меньше, чем в жидкости.
Среди однотипных полярных молекул HCl, HBr, HI, где имеют место и ориентационные силы, и дисперсионные, с увеличением массы вещества, так же, как и в предыдущем случае с галогенами – F2, Cl2, Br2, I2, увеличиваются дисперсионные силы.
В HCl на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, в HBr – 95%, а в HI – 99,5%. В связи с этим в ряду HCl, HBr, HI наблюдается закономерное увеличение t°пл. и t°кип., что видно из таблицы 10:
Таблица 10. Температуры плавления и кипения галогеноводородов
Из этого ряда выпадает HF. У него самая низкая молекулярная масса. Ожидаемо, что самые низкие должны быть t°пл. и t°кип.
HF, H2O и NH3 плавятся и кипят при аномально высоких температурах. Это объясняется образованием дополнительной межмолекулярной связи, называемой водородной, которая гораздо сильнее Ван-дер-Ваальсовой.
Водородная связь образуется между атомом водорода одной молекулы, соединенным с сильно электроотрицательным атомом F, O или N,
и сильно электроотрицательным атомом (F, O или N) другой молекулы.
Образование достаточно прочной водородной связи объясняется тем, что связь H–F (H–O, H–N) является сильно полярной вследствие высокой электроотрицательности элементов F, O, N, и общая пара электронов сильно смещена в сторону F, O и N, повышая частичный заряд на атомах и оголяя положительное ядро атома водорода, ведь у него всего один электрон.
Благодаря водородной связи образуются димеры (удвоенные молекулы), тримеры и т.д. Объединение молекул затрудняет отрыв их друг от друга и является причиной высоких t°пл. и t°кип.
Как же можно объяснить, что H2O с молекулярной массой 18 имеет t°кип. = 100 °C, а HF с большей молекулярной массой (Mr(HF) = 20) имеет t°кип. = 19,5 °C – гораздо ниже, ведь водородные связи имеются и в том, и в другом веществе, в HF даже более сильные водородные связи, так как связь H – F более полярная?
В молекуле H2O – два атома водорода, связанных с кислородом, а в HF – только один атом водорода связан с электроотрицательным атомом – в результате этого каждая молекула H2O может образовать три водородные связи с соседними молекулами, а одна молекула HF – только две водородные связи:
Все рассмотренные виды химических связей можно расположить в ряд по мере возрастания их энергии связи: Межмолекулярная Водородная Металлическая Ионная и Ковалентная.
Самые прочные связи – ионные и ковалентные.
122) Водородная связь реализуется:
1) В молекуле H2;
2) В молекуле H2O;
3) Между молекулами H2;
4) Между молекулами H2O.
Укажите номер правильного ответа.
123) Прочность водородной связи зависит от:
1) От электроотрицательности атома элемента, связанного с водородом;
2) От величины частичного положительного заряда на атоме водорода;
3) От полярности связи водород-элемент;
4) Все перечисленные выше ответы верны.
Укажите номер правильного ответа.
124) Наиболее прочные водородные связи образуются между атомом водорода и атомом:
1) Хлора;
2) Кислорода;
3) Серы;
4) Азота.
Укажите номер правильного ответа.
125) В ряду HF – HCl происходит увеличение:
1) Длины связи;
2) Полярности связи;
3) Степени окисления галогена;
4) Температуры кипения.
Укажите номер правильного ответа.
126) Образование водородной связи между молекулами веществ не оказывает влияние на
физическое свойство:
1) Температуру кипения;
2) Температуру плавления;
3) Плотность;
4) Пластичность.
Укажите номер правильного ответа.
127) Водородная связь образуется между молекулами:
1) CH4;
2) CH3OH;
3) H2S;
4) H2.
Укажите номер правильного ответа.
128) Между атомами элементов с порядковыми номерами 12 и 9 возникает связь:
1) Металлическая;
2) Ионная;
3) Ковалентная;
4) Донорно-акцепторная.
Укажите номер правильного ответа.
129) Степень окисления азота в ионе NH4+:
1) +4;
2) -4;
3) +3;
4) -3.
Укажите номер правильного ответа.
130) Установите соответствие между веществом и видом связи в этом веществе:
| Формула | Класс вещества | |
| 1) Zn | А) Ионная | |
| 2) NH3 | Б) Ковалентная полярная | |
| 3) O2 | В) Ковалентная неполярная | |
| 4) CaBr2 | Г) Металлическая |
К каждой позиции, обозначенной цифрой, выберите позицию, обозначенную буквой. Например, в ответе нужно записать АВГБ.
Например, в ответе нужно записать АВГБ.
131) Установите соответствие между видом связи в веществе и формулой химического вещества:
| Вид связи | Формула вещества | |
| А) Ионная | 1) N2 | |
| Б) Ковалентная полярная | 2) Cu | |
| В) Ковалентная неполярная | 3) MgO | |
| Г) Металлическая | 4) N2O |
К каждой позиции, обозначенной буквой, выберите позицию, обозначенную цифрой. Например, в ответе нужно записать 1243.
132) Из предложенного перечня веществ выберите два вещества, в молекулах которых имеется ковалентная неполярная связь:
1) S8;
2) K2S;
3) SO2;
4) H2S;
5) H2.
Ответ:
Укажите номера правильных ответов.
133) Из предложенного перечня веществ выберите два вещества, в молекулах которых имеется ковалентная полярная связь:
1) O3;
2) BaS;
3) SF6;
4) AsCl3;
5) CsF.
Ответ:
Укажите номера правильных ответов.
134) Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
1) Cl2O;
2) Rb2S;
3) CS2;
4) SiO2;
5) CrCl3.
Ответ:
Укажите номера правильных ответов.
135) Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная связь.
1) B2O3;
2) BaS;
3) CS2;
4) Mn2Si;
5) SiC.
Ответ:
Укажите номера правильных ответов.
136) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке возрастания температур кипения.
1) N2;
2) H2O;
3) O2;
4) H2;
5) H2S;
Ответ:
Укажите номера правильных ответов.
137) Из предложенного перечня выберите три вещества с наименьшей температурой кипения. Расположите их в порядке уменьшения температур кипения:
Расположите их в порядке уменьшения температур кипения:
1) H2O;
2) Ne;
3) K2S;
4) F2;
5) Cl2;
Ответ:
Укажите номера правильных ответов.
138) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке увеличения температур кипения:
1) HF;
2) CO;
3) NaCl;
4) H2;
5) HBr;
Ответ:
Укажите номера правильных ответов.
139) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке увеличения температур кипения:
1) NH3;
2) He;
3) H2O;
4) PH3;
5) CaO;
Ответ:
Укажите номера правильных ответов.
вернуться на Главную страницу сайта
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь / Справочник :: Бингоскул
Химические связи – это приоритетная проблема в современной химии. От полученных знаний зависит выяснение причин разнообразия соединений, также строения и возникновения веществ. Выявленные типы: ионный, ковалентный, металлический, водородный.
Химические вещества состоят из не связанных между собой атомов химических элементов. Такое строение имеют только благородные газы: гелий, неон, аргон, криптон, ксенон и радон. Чаще всего химические вещества состоят не из отдельных атомов, а из их соединений, которые образуют различные группировки. Такие объединения атомов могут состоят из нескольких единиц, сотен, тысяч или даже больше атомов. Сила, которая держит эти атомы в составе таких группировок, называется химическая связь.
Сила, которая держит эти атомы в составе таких группировок, называется химическая связь.
Химическая связь — связь отдельных атомов между собой за счет силы взаимного притяжения из-за разности электродных потенциалов в более сложные структуры (молекулы, ионы, радикалы, кристаллы и др.).
Причиной образования химической связи
- энергия более сложных структур меньше суммарной энергии отдельных, образующих ее атомов. Когда образуется сложное вещество, то суммарная энергия атомов падает, а когда атомы находятся в не связанном состоянии энергия их выше, так как компенсационного эффекта для образования молекулы не происходит.
Например: взаимодействуют атомы А и В. Энергия такого атома выше, чем соединения АВ, потому что при взаимодействии более электроотрицательный атом оттягивает на себя электроотрицательность и происходит смещение электронной плотности, а значит и понижение энергии всей молекулы. Поэтому в молекуле АВ энергия ниже, чем у отдельных атомов А и В.
E(АВ)
Поэтом при образовании химических связей между отдельными атомами выделятся энергия.
Химические связи – определение, возникновение
Теорию отдельно выдвинули Гильберт Ньютон Льюис и Вальтер Коссель в 1916 году. Для описания соединения двух атомов используется термин «химическая связь». В образовании участвуют электроны, которые расположены на внешних энергетических уровнях, а потому наименее связанные с ядром – это валентные электроны. При соединении образуется три вида частиц:
- молекула – небольшого размера электронейтральная частица вещества с характерными для него химическими свойствами;
- ионы – заряженные частицы, атомы и группы связанных атомов с обилием (анионы) или дефицитом (катионы) электронов;
- свободный радикал – частица с ненасыщенной (свободной) валентностью.
Возникновение химической связи между атомами ведёт к образованию частиц: молекул, ионов и свободных радикалов. При этом уменьшается полная энергия системы – объединение атомов в частицу протекает энергетически выгодно. Образование связи на примере водородной молекулы (Рис. 1):
Образование связи на примере водородной молекулы (Рис. 1):
- Пребывание двух мелких частиц на дальнем друг от друга промежутке – энергия взаимосвязи приближается к нулю (взаимосвязи нет).
- Сближение атомов на отдаление, соизмеримое с размером электронного пространства – вступают силы притяжения и отталкивания.
- Начало действия силы притяжения между электронной оболочкой одного атома и ядром другого атома, конкурирующие силы отталкивания между ядрами и между электронами.
- Силы притяжения преобладают над силами отталкивания – сближаются атомы, а потенциальная энергия снижается до возникновения стабильной молекулы при r = r0.
- Дальнейшее сближение – энергия системы стремительно повышается за счёт преобладания сил отталкивания.
Энергетический минимум идентичен устойчивому состоянию системы – в этой ситуации из пары обособленных водородных частиц получается молекула h3. Во время реакции производится 436 кДж/моль.
Во время реакции производится 436 кДж/моль.
Как определить тип связи
Характеристики химических связей между частицами веществ зависят от электроотрицательности – возможности сохранять валентные электроны. Этот показатель зависит от заряженности ядра и радиуса атома. Для количественной оценки применяют шкалу Полинга (Табл. 1).
Таблица 1
Определение вида взаимосвязи по разнице электроотрицательност (ЭО):В многообразии источников попадаются разные таблицы. Использовать можно каждую шкалу, потому что важнее разница электроотрицательностей, которая в среднем сходна в изобретённых системах, а не значение.
- Δ ЭО = 0 – неполярная ковалентная;
- Δ ЭО
- Δ ЭО ≥ 1,7 – ионная.
Химические связи различаются по связываемым атомам, образующимся частицам, кристаллической решётке, характере вещества. Выделяют 4 типа:
- Ковалентная (полярная и неполярная).
- Ионная.
- Механическая.
- Водородная.
Определяют тип по веществу, принимающему участие в связи. Если это 2 неметалла, то связь ковалентная. Если метал с неметаллом, то ионный тип, но если 2 металла, то металлический тип. Водородная связь – соединение молекул водорода с фтором, хлором, кислородом или азотом.
Если это 2 неметалла, то связь ковалентная. Если метал с неметаллом, то ионный тип, но если 2 металла, то металлический тип. Водородная связь – соединение молекул водорода с фтором, хлором, кислородом или азотом.
Ковалентная химическая связь
Между атомами элементов неметаллов возникает ковалентных характер связи. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия, потому что атомы разных элементов имеют различную способность притягивать к себе общую электронную пару. Это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. На другом атоме формируется частичный положительный заряд.
Ковалентный тип – это химическая связь, в результате которой возникают общие пары электронов. Два пути появления:
- Обменный способ – каждая частица предоставляет по одному электрону в совместное использование.

- Донорно-акцепторный механизм – одна частица предоставляет уже по 2 электрона, а второй атом отдаёт свободную орбиталь.
Пример обменного способа – объединение атомов в молекулу водорода. Сближаясь, электронные оболочки перекрываются, а электронная плотность между ядрами повышается. Идёт притяжение, и энергия системы понижается. При близком сближении ядра отталкиваются – появляется расстояние (Рис. 2).
Рис. 2. Связывание атомов водорода обменным способомХарактеристики ковалентной связи:
- Полярность – неравномерное сосредоточение между частицами с разной электроотрицательностью электронной плотности.
- Кратность – количество общих электронных пар между двумя атомами.
- Длина – протяжённость между центральными частями ядер атомов.
- Насыщаемость – возможность атомов создавать условное число связей.
- Энергия связи – мера прочности, энергия, требуемая для разрыва связи во всех молекулах, составляющих 1 моль вещества.

Ковалентная связь включает две разновидности по полярности: полярная и неполярная. Определяют по электроотрицательности атомов – одинаковая она или нет.
Характеристика:
1. Неполярная ковалентная – связь между одинаковыми мелкими частицами (неметаллами) с размеренным распространением электронной плотности и равной электроотрицательностью. Примеры: Cl2, H2, I2, O2, N2 (Рис. 3).
Рис. 3. Неполярная ковалентная связь2. Полярная ковалентная – это соединение неравных частиц (неметаллов) с разницей в электроотрицательности и смещением общей пары электронов. Примеры: NH3, HCl, CO2, H2O (Рис. 4).
Рис. 4. Полярная ковалентная связьПолярность – характеристика, определяющая физические или химические свойства вещества. Она влияет на механизм реакций, реакционную способность ближайших связей. Полярность молекулы, температуры плавления и кипения, а также растворимость – показатели, зависящие от полярности связей.
Полярность молекулы, температуры плавления и кипения, а также растворимость – показатели, зависящие от полярности связей.
Ионная связь
Ионный тип – тип, при котором разница электроотрицательности атомов больше 1,7–2 по шкале Полинга. Если точнее, то притяжение появляется между ионами с разными зарядами. В возникновении ионного типа участвуют металлы, неметаллы. Примеры: NaCl, LiF, K2O, другие (Рис. 5).
Рис. 5. Ионная связьГлавные характеристики: ненаправленность и ненасыщаемость. Ионная связь во многом сходна с ковалентной, поэтому считается предельным случаем. Энергия связи (прочность) доходит до 800 кДж/моль.
Металлическая связь
Характеристики металлов: блеск, ковкость, пластичность и сравнительно высокая температура плавления, тепло- и электропроводность. Общность этих качеств объясняется сходством организации атомов:
- малое количество электронов на внешнем уровне;
- слабое притяжение между валентными электронами и ядром;
- низкая ионизация и электроотрицательность.

Металлический тип – это связь сравнительно свободных отрицательно заряженных частиц между ионами металлов с образованием кристаллической решётки. Примеры – Fe, Na, Ca, Sc и Au3Cu, другие (Рис. 6).
Рис. 6. Металлическая связьОбщность металлического и ковалентного вида связей – обобществление валентных электронов в основе. Различия заключаются в меньшей прочности и отсутствии направленности. Прочность (энергия) у металлической связи в 3–4 раза ниже этого же показателя у ковалентного типа. Образование металлической связи между атомами металлов возможна из-за наличия кинетической энергии внутри каждого атома металла, при увеличении центробежной силы электроны последнего электронного слоя вылетают за пределы атома и связывают атомы металлов между собой. Каждый атом, который потерял электрон превращается в положительно заряженную частицу – протон. И происходит взаимное притяжение протона и электрона, который только что покинул атом. Электроны могут притягиваться обратно и таким образом происходит снова образование атома. Существованием свободных электронов объяснятся свойство металлов к электропроводности (электрический ток – направленное движение электронов). Поэтому металлическую кристаллическую решетку химически невозможно разрушить, её можно только механически распилить.
Существованием свободных электронов объяснятся свойство металлов к электропроводности (электрический ток – направленное движение электронов). Поэтому металлическую кристаллическую решетку химически невозможно разрушить, её можно только механически распилить.
Водородная связь
Водородные соединения с электроотрицательными атомами фтора, хлора, азота, кислорода образуются благодаря водородным связям. В молекуле общая пара электронов движется к более электроотрицательному атому. Классический пример – жидкий фторид водорода (Рис. 7).
Рис. 7. Водородная химическая связьЭнергия водородной связи составляет до 40 кДж/моль, поэтому этот тип в 10–20 раз слабее ковалентного. Водородные связи возникают между или внутри молекул. От этого зависят физико-химические свойства вещества.
Смотри также:
- Электроотрицательность. Степень окисления и валентность химических элементов
- Вещества молекулярного и немолекулярного строения.
 Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Является ли HBr ионным или ковалентным, почему, как, характеристики и подробные факты – Lambda Geeks
Является ли HBr ионным или ковалентным? Это подробно обсуждалось в этой статье наряду с другими свойствами, такими как полярность, ионный характер и т. д.
Является ли HBr ионным или ковалентным . Очень частый вопрос, который приходит нам в голову, когда мы рассматриваем тип образования связи. Поэтому в этой статье мы обсудим это вместе с важными характеристиками HBr. Да, HBr является ковалентным соединением. Подробное объяснение и факты представлены в следующих разделах.
Во-первых, давайте рассмотрим методы приготовления, используемые для получения HBr.
- Смесь готовится путем смешивания водорода и брома, затем эта конкретная смесь должна быть пропущена по платиновой спирали (предварительно нагретой электрическим током).
 Затем два элемента объединяются вместе, чтобы дать нам HBr.
Затем два элемента объединяются вместе, чтобы дать нам HBr.
- Существует еще один метод приготовления, который считается лабораторным. Проводят гидролиз бромида фосфора. Берут колбу, содержащую красный фосфор + вода, и закрепляют над ней воронку, затем из воронки по каплям и медленно добавляют в нее бром. Образовавшиеся пары HBr затем пропускают через U-образную трубку (которая содержит шарики + влажный красный фосфор). Этот HBr собирается путем настройки сборки, как показано на рисунке.
Изображение предоставлено: Википедия
Физические свойства HBr
- Это бесцветный (газ) по своей природе
- Его наблюдаемая плотность составляет 25 градусов по Цельсию
- Его температура плавления составляет -86,9 градусов по Цельсию, а температура кипения -66,8 градусов по Цельсию.

- Растворим в воде (при температуре около 0 градусов Цельсия, 221 г/100 мл)
- Растворим/растворим в спирте (даже в органических растворителях)
- Наблюдаемая молекулярная геометрия является линейной.
Химические свойства HBr: Считается негорючим и не поддерживает горение.
Кислотные свойства: 1) Замечено, что влажный синий лакмус окрашивается в красный цвет.
2) Говоря о реакционной способности, он может реагировать с металлом и его оксидами (гидроксидами, карбонатами)
Является ли HBr ковалентным?Чтобы понять, является ли HBr ковалентным или нет, нам сначала нужно понять, что мы подразумеваем под ковалентной связью. Итак, ковалентная связь (это химическая связь), образование связи происходит за счет обмена парами электронов между атомами. (Иногда электроны называют связывающими парами).
Давайте посмотрим на некоторые из их основных свойств.
- В большинстве случаев они имеют более низкие температуры плавления и кипения, а это означает, что для разрыва связей потребуется очень меньше энергии, поскольку они очень слабые (по сравнению с металлическими соединениями ионного типа). Также было замечено, что эти соединения, имеющие ковалентные связи, в большинстве случаев представляют собой жидкость/газ (при комнатной температуре).
- Энтальпия испарения и плавления довольно низкая по сравнению с ионными соединениями.
- Межмолекулярные силы (относительно твердой формы) между ковалентными соединениями довольно слабы и, следовательно, могут быть легко разрушены/искажены. (Это означает, что соединения этого типа несколько хрупкие).
- Говоря о теплопроводности, они являются очень плохими проводниками, или мы также можем сказать, что они не проводят электричество. (Причина этого — отсутствие заряженных частиц, способных переносить электроны).

Итак, после понимания концепции ковалентной связи, можем ли мы теперь предсказать, является ли HBr ковалентным? Да, HBr образован ковалентной связью. Где водород и бром разделяют свою пару электронов между собой и образуют связь. Как мы знаем, их температура плавления и температура кипения также ниже (обсуждалось в предыдущем разделе), и большую часть времени они находятся в газообразной форме.
Энтальпии парообразования и плавления HBr составляют 17,15 кДж/моль и 2,41 кДж/моль соответственно, что значительно меньше, и этим свойством в целом обладают ковалентные соединения. Таким образом, HBr обладает большинством общих свойств ковалентного соединения, поэтому мы можем сказать, что HBr является ковалентным соединением.
Подробнее о: Кислота HBr: слабая или сильная, почему, как и подробные факты
Является ли HBr полярной или неполярной ковалентной? Давайте сначала разберемся с концепцией полярности и неполярности.
Полярность в молекулах (общие факты):
Прежде всего, что мы понимаем под полярностью? Полярность означает разделение электрических зарядов в молекуле, что приводит к дипольному (электрическому) моменту, который имеет положительные и отрицательные заряды на своем конце. Сила притяжения, с которой любой атом притягивает электроны, неодинакова для всех атомов, и сила/притяжение атомов к электронам называется электроотрицательностью атомов.
Когда мы говорим о более высокой электроотрицательности, мы имеем в виду, что сила/притяжение, с помощью которой атомы притягивают электроны, больше, а когда мы говорим о более низкой электроотрицательности, мы имеем в виду, что сила/притяжение, с помощью которой атомы притягивают электроны, мала.
Итак, рассмотрим связь, из-за этой концепции электроотрицательности происходит то, что распределение электронов между атомами не равно, поскольку атомы, имеющие более высокую электроотрицательность, будут притягивать к себе электроны. И мы знаем, что электроны несут отрицательный заряд, это неравное распределение электронов в связи приводит к образованию электрического диполя.
И мы знаем, что электроны несут отрицательный заряд, это неравное распределение электронов в связи приводит к образованию электрического диполя.
Теперь перейдем к концепции полярных и неполярных молекул.
- Полярная (молекула) означает, что она имеет на одном конце положительный заряд (больше), а на другом конце имеет отрицательный заряд, который приводит или приводит к образованию электрического диполя.
- Неполярная молекула означает, что она не будет иметь зарядов на концах молекул по той причине, что распределение электронов правильное/точное и, следовательно, (симметрично) они компенсируют друг друга.
Поняв концепцию полярности, можем ли мы теперь предсказать, является ли HBr полярной или неполярной ковалентной связью?
Что касается полярности HBr, то атомы молекулы HBr, то есть водород и бром, имеют неодинаковую электроотрицательность (это означает, что они могут образовывать дипольный момент). Электроотрицательность атома брома намного больше, чем электроотрицательность атома водорода, и, следовательно, электроны притягиваются (немного) больше к атому брома. Таким образом, HBr становится полярной ковалентной молекулой.
Таким образом, HBr становится полярной ковалентной молекулой.
Подробнее о: 5 Примеры полярной ковалентной связи: подробные сведения и факты
Почему HBr является ковалентным?Как мы знаем, молекула HBr состоит из атомов водорода и атомов брома, и оба являются неметаллами. Таким образом, связь образуется путем обмена (парами) электронов между атомами неметаллов. Образующаяся связь такого типа представляет собой ковалентную связь, которая имеет низкие температуры плавления и кипения. Следовательно, HBr состоит из ковалентной связи.
Почему HBr полярный?В предыдущих разделах мы видели, что полярность возникает из-за разницы в электроотрицательности и порождает электрический диполь. Наблюдается, что электроотрицательность водорода в молекуле HBr равна 2,1, а электроотрицательность атома брома равна 2,8, а разница получается равной 0,7.
Как мы видим, электроотрицательность атома брома намного больше, чем у водорода, поэтому он имеет потенциал притягивать/притягивать его к себе, что приводит/вызывает образование электрического диполя. Таким образом, HBr является полярной молекулой.
Таким образом, HBr является полярной молекулой.
Под ионным характером соединения мы понимаем процент разницы электроотрицательности между атомами, связанными ковалентной связью.
Мы знаем, что разность электроотрицательностей водорода и брома в молекуле HBr составляет 0,7, что гораздо меньше. Если ионный характер больше, соединение будет ионным, а если меньше, то это будет ковалентное соединение. Итак, мы знаем, что ионный характер HBr гораздо меньше, следовательно, это полярные соединения.
Является ли HBr полярным или неполярным?
Бромид водорода представляет собой химическое соединение, известное по химической формуле, поскольку HBr представляет собой двухатомную молекулу. Это бесцветное соединение смешанного и кислотного характера. У многих из вас могут возникнуть сомнения относительно полярности бромистого водорода (HBr). Итак, я отвечу на этот вопрос и развею все ваши сомнения, а также затрону окружающие темы.
Итак, HBr полярный или неполярный? HBr (бромистый водород) представляет собой полярную молекулу из-за неодинаковой электроотрицательности атомов водорода и брома. Бром имеет более высокую электроотрицательность, чем водород, из-за чего пара электронов немного больше притягивается к атому брома, что делает HBr полярной молекулой и приводит к чистому дипольному моменту.
HBr хорошо растворим в воде. Это кислота, смешанная с водой. При комнатной температуре бромистый водород, присутствующий в воде, насыщается до 68,85% HBr по весу.
Это химическое соединение в основном используется для получения неорганических и органических соединений брома.
Бромистоводородная кислота — сильнодействующая кислота, образующаяся при растворении брома в воде. HBr является удушающим газом в природе. Он очень легко растворяется в воде. Он также легко диссоциирует в воде.
Этот коррозионный газ может вызвать серьезные ожоги при контакте с ним.
Молекула HBr состоит из одного атома водорода и одного атома брома. Молекулярная масса HBr 80,9119 г/моль.
Молекулярная масса HBr 80,9119 г/моль.
Электроотрицательность водорода равна 2,2, тогда как электроотрицательность брома равна 2,96. Эта разница в электроотрицательности между двумя атомами, образующими химическую связь, вызывает ее полярность.
Более электроотрицательный атом больше притягивает к себе связанную пару электронов, в результате чего атом приобретает частичный отрицательный заряд, тогда как другой атом приобретает частичный положительный заряд.
По сути, электроотрицательность можно определить как силу атома, насколько сильно он может притягивать связанную пару электронов.
Что такое полярные и неполярные молекулы?
Атомы внутри молекулы удерживаются силами. Эти силы связи могут быть ионными, ковалентными, водородными и металлическими.
Ионные и ковалентные связи являются самыми сильными среди них.
Ионная связь образуется между противоположно заряженными молекулами. Эти атомы притягиваются друг к другу из-за электростатических сил между ними.
Ковалентная связь образуется между двумя атомами, когда они разделяют электроны друг друга, чтобы стабилизироваться.
Ковалентная связь, при которой оба соединенных атома имеют одинаковую электроотрицательность и имеют одинаковый заряд. Это означает, что распределение заряда на обоих атомах является равномерным.
В случае, если атомы, связанные ковалентно, имеют разные значения электроотрицательности. Более электроотрицательный атом немного сильнее притягивает к себе связанную электронную пару и приобретает частичный отрицательный заряд.
Тогда как другой атом с меньшей электроотрицательностью приобретает частичный положительный заряд.
Таким образом, дипольный момент таких полярных молекул отличен от нуля. Примерами таких химических соединений являются HCl, HBr, Nh4. вы можете проверить причину полярности аммиака.
А неполярные молекулы имеют нулевой дипольный момент. Эти атомы разделяют связанную электронную пару с равной силой. Примерами таких неполярных соединений являются CO2, h3.
Вот статья за неполярность h3.
Полярные соединения также имеют асимметричную геометрическую форму, а неполярные соединения имеют симметричную форму.
Почему HBr является полярным соединением?
Молекула HBr состоит из атомов водорода и брома, различающихся по своей электроотрицательности.
Электроотрицательность брома 2,96, водорода 2,2. Из-за этой разницы в их электроотрицательности атом брома несколько сильнее притягивает к себе связанный электрон.
В результате атом брома приобретает относительно отрицательный заряд, а атом водорода – положительный.
В молекуле бромистого водорода происходит неравное распределение заряда между обоими атомами. Это означает, что атом брома разделяет большую часть связанных электронов.
Таким образом, ковалентная связь H-Br создает полярность поперек.
Благодаря такой полярности молекулы HBr значение дипольного момента этой молекулы отлично от нуля.
Дипольный момент можно определить как меру полярности химического соединения. Чем больше дипольный момент молекулы, тем больше полярность этой молекулы.
Как проверить полярность соединения
Существуют различные факторы, которые помогают нам определить полярность молекулы. Они обсуждаются ниже.
Электроотрицательность : Это сила атома притягивать к себе связанные электроны. Чем больше электроотрицательность атома, тем сильнее он может притягивать электроны.
Следовательно, если существует разница в электроотрицательности двух атомов, образующих связь, образующаяся связь является полярной. А полярность молекулы прямо пропорциональна разности электроотрицательностей образующих ее атомов.
Дипольный момент : Это мера полярности химического соединения. Он рассчитывается как произведение заряда атомов на разницу между ними.
Полярность молекулы также прямо пропорциональна ее дипольному моменту. Наблюдаемый дипольный момент молекулы HBr составляет около 2,6×10-30 см.
Геометрическая форма : Форма молекулы является важным параметром для определения полярности молекулы.
Полярная молекула имеет асимметричную форму, что приводит к результирующему дипольному моменту. Тогда как неполярная молекула симметрична по форме и имеет нулевой дипольный момент.
Однако в случае HBr форма этой молекулы является линейной, поскольку молекулы, образованные двумя атомами, образуют молекулу линейной формы.
Ниже представлена геометрическая структура молекулы HBr.
Синтез бромистого водорода
Молекулу HBr получают различными методами в лаборатории путем перегонки раствора бромида калия в присутствии серной кислоты.
Реакция описанного выше процесса выглядит следующим образом:
KBr + h3SO4 (серная кислота) ——-> KHSO4 + HBr
Помимо описанного выше метода, эта кислота также может быть получена бромированием тетралина.
C10h22 (тетралин) + 4Br2 ——> C10H8Br4 + 4HBr
Еще один способ образования бромистоводородной кислоты – восстановление брома в присутствии фосфористой кислоты по внешнему виду бесцветный газ.
Использование HBr
- Он широко используется в качестве катализатора и реагента во многих органических реакциях.
- Кислота бромистоводородная безводная считается опасным соединением и поэтому транспортируется в баллонах высокого давления.
- Он также действует как промежуточное соединение.
- Широко используется при приготовлении дезинфицирующих средств и многих дезинфицирующих средств.
Заключение
В молекуле HBr атом брома более электроотрицателен, чем водород, и он больше притягивает к себе связанные электронные пары и в результате приобретает частичный отрицательный заряд, а атом водорода приобретает частичный положительный заряд.
Из-за такого неравномерного распределения заряда в молекуле HBr развивается полярность, что приводит к ненулевому значению дипольного момента.
Если у вас есть какие-либо вопросы относительно полярности HBr, вы можете задать их в разделе комментариев. Мы свяжемся с вами как можно скорее.
Водородная связь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1660
Водородная связь — это межмолекулярная сила (IMF), которая образует особый тип диполь-дипольного притяжения, когда атом водорода, связанный с сильно электроотрицательным атомом, существует вблизи другого электроотрицательного атома с неподеленной парой электронов. Межмолекулярные силы (IMF) возникают между молекулами. Другие примеры включают обычные диполь-дипольные взаимодействия и дисперсионные силы. Водородные связи, как правило, прочнее обычных диполь-дипольных и дисперсионных сил, но слабее истинных ковалентных и ионных связей.
Межмолекулярные силы (IMF) возникают между молекулами. Другие примеры включают обычные диполь-дипольные взаимодействия и дисперсионные силы. Водородные связи, как правило, прочнее обычных диполь-дипольных и дисперсионных сил, но слабее истинных ковалентных и ионных связей.
Доказательства водородной связи
Многие элементы образуют соединения с водородом. Если вы начертите точки кипения соединений элементов группы 14 с водородом, вы обнаружите, что точки кипения увеличиваются по мере того, как вы спускаетесь по группе.
Рис. 1: Температуры кипения галогенидов 14-й группы.Повышение температуры кипения происходит из-за того, что молекулы становятся больше с большим количеством электронов, и поэтому дисперсионные силы Ван-дер-Ваальса становятся больше. Если вы повторите это упражнение с соединениями элементов групп 15, 16 и 17 с водородом, произойдет нечто странное.
Рисунок 2: Температуры кипения галогенидов элементов 15-17 групп. Хотя те же рассуждения применимы к группе 4 таблицы Менделеева, температура кипения соединения водорода с первым элементом в каждой группе аномально высока. В случаях \(NH_3\), \(H_2O\) и \(HF\) должны существовать какие-то дополнительные силы межмолекулярного притяжения, требующие значительно большей тепловой энергии для разрыва ММП. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
В случаях \(NH_3\), \(H_2O\) и \(HF\) должны существовать какие-то дополнительные силы межмолекулярного притяжения, требующие значительно большей тепловой энергии для разрыва ММП. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
Происхождение водородных связей
Молекулы, способные образовывать водородные связи, включают следующее:
Рисунок 3: Неподеленные пары, ответственные за водородные связи в \(NH_3\), \(H_2O\) и \(HF\). Сплошная линия представляет собой связь в плоскости экрана или бумаги. Точечные связи уходят обратно в экран или бумагу от вас, а клиновидные выходят к вам.Обратите внимание, что в каждой из этих молекул:
- Водород присоединяется непосредственно к сильно электроотрицательным атомам, в результате чего водород приобретает сильно положительный заряд.
- Каждый из сильно электроотрицательных атомов приобретает высокий отрицательный заряд и имеет по крайней мере одну «активную» неподеленную пару.
 У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
У неподеленных пар на уровне 2 электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Неподеленные пары на более высоких уровнях более рассеяны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
(нормированные к пиковому значению). Сигнал возбуждения флуоресценции, по сути, зависит как от плотности возбужденного состояния (как оптическая плотность), так и от эффективности релаксации из возбужденного состояния излучающего <2005PCB6004>.Если вы не знакомы с электроотрицательностью, вам следует перейти по этой ссылке, прежде чем продолжить. 9+\) водород настолько сильно притягивается к неподеленной паре, что создается впечатление, будто вы начинаете формировать координационную (дательную ковалентную) связь. Это не заходит так далеко, но притяжение значительно сильнее, чем обычное диполь-дипольное взаимодействие. Водородные связи имеют примерно одну десятую прочности средней ковалентной связи и постоянно разрываются и восстанавливаются в жидкой воде. Если вы сравните ковалентную связь между кислородом и водородом со стабильным браком, водородная связь имеет статус «просто хороших друзей». 9+\) атомов водорода и неподеленных пар, каждый из которых участвует в образовании водородных связей.
Вот почему температура кипения воды выше, чем у аммиака или фтористого водорода. В случае аммиака количество водородных связей ограничено тем фактом, что каждый атом азота имеет только одну неподеленную пару. В группе молекул аммиака не хватает неподеленных пар, чтобы удовлетворить все атомы водорода. Во фтороводороде проблема заключается в нехватке водорода. В воде две водородные связи и две неподеленные пары позволяют образовывать взаимодействия водородных связей в решетке молекул воды. Таким образом, вода считается идеальной системой с водородными связями.
Более сложные примеры водородных связей
Гидратация отрицательных ионов
Когда ионное вещество растворяется в воде, молекулы воды группируются вокруг разделенных ионов. Этот процесс называется гидратацией. Вода часто присоединяется к положительным ионам координационными (дательными ковалентными) связями. Он связывается с отрицательными ионами с помощью водородных связей.
Если вас интересует связь в гидратированных положительных ионах, вы можете перейти по этой ссылке, чтобы ознакомиться с координационной (дательной ковалентной) связью.
На схеме показаны потенциальные водородные связи, образованные ионом хлора Cl-. Хотя неподеленные пары в ионе хлорида находятся на уровне 3 и обычно недостаточно активны для образования водородных связей, в этом случае они становятся более привлекательными за счет полного отрицательного заряда хлора.
Рис. 5: Водородная связь между ионами хлора и водой.Каким бы сложным ни был отрицательный ион, всегда будут неподеленные пары, с которыми атомы водорода из молекул воды могут водородно связываться.
Водородная связь в спиртах
Спирт представляет собой органическую молекулу, содержащую группу -ОН. Любая молекула, в которой атом водорода присоединен непосредственно к кислороду или азоту, способна образовывать водородные связи. Водородные связи также возникают, когда водород связан со фтором, но группа HF не появляется в других молекулах. Молекулы с водородными связями всегда будут иметь более высокую температуру кипения, чем молекулы аналогичного размера, которые не имеют группы -ОН или -NH.
Водородная связь делает молекулы «более липкими», так что для их разделения требуется больше тепла (энергии). Это явление можно использовать для анализа температуры кипения различных молекул, определяемой как температура, при которой происходит фазовый переход от жидкости к газу.
Этанол, \(\ce{Ch4Ch3-O-H}\), и метоксиметан, \(\ce{Ch4-O-Ch4}\), имеют одинаковую молекулярную формулу, \(\ce{C2H6O}\).
У них одинаковое количество электронов и одинаковая длина. Притяжение Ван-дер-Ваальса (как дисперсионные силы, так и диполь-дипольное притяжение) в каждом из них будет одинаковым. Однако у этанола атом водорода присоединен непосредственно к кислороду; здесь у кислорода все еще есть две неподеленные пары, как у молекулы воды. Водородная связь может возникать между молекулами этанола, хотя и не так эффективно, как в воде. Водородная связь ограничена тем фактом, что в каждой молекуле этанола имеется только один водород с достаточным зарядом +.
В метоксиметане неподеленные пары кислорода все еще присутствуют, но атомов водорода недостаточно + для образования водородных связей.
За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к самому электроотрицательному элементу, чтобы возникла водородная связь. Температуры кипения этанола и метоксиметана показывают резкое влияние водородных связей на липкость молекул этанола:
этанол (с водородными связями) 78,5°С метоксиметан (без водородной связи) -24,8°С Водородная связь в этаноле подняла его точку кипения примерно на 100°C. Важно понимать, что помимо притяжения Ван-дер-Ваальса существуют водородные связи. Например, все следующие молекулы содержат одинаковое количество электронов, а первые две имеют одинаковую длину цепи. Более высокая температура кипения бутан-1-ола обусловлена дополнительной водородной связью.
При сравнении двух спиртов (содержащих группы -ОН) оба имеют высокие температуры кипения из-за дополнительной водородной связи; однако значения не совпадают.
Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление молекулы делает ван-дер-ваальсово притяжение менее эффективным, чем у более длинного бутан-1-ола.
Водородная связь в органических молекулах, содержащих азот
Водородная связь также возникает в органических молекулах, содержащих группы N-H; вспомните водородные связи, возникающие с аммиаком. Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин) в большие молекулы, такие как белки и ДНК. Две нити знаменитой двойной спирали в ДНК удерживаются вместе водородными связями между атомами водорода, присоединенными к азоту на одной цепи, и неподеленными парами на другой азот или кислород на другой.
Доноры и акцепторы
Для образования водородной связи должны присутствовать как донор водорода, так и акцептор. Донором в водородной связи обычно является сильно электроотрицательный атом, такой как N, O или F, который ковалентно связан с водородной связью.
Акцептор водорода – электроотрицательный атом соседней молекулы или иона, содержащий неподеленную пару, участвующую в водородной связи.
Почему возникает водородная связь?
Поскольку донор водорода (N, O или F) является сильно электроотрицательным, он притягивает ковалентно связанную электронную пару ближе к своему ядру и от атома водорода. Затем атом водорода остается с частичным положительным зарядом, создавая диполь-дипольное притяжение между атомом водорода, связанным с донором, и неподеленной электронной парой акцептора. Это приводит к образованию водородной связи (см. Взаимодействие между молекулами с постоянными диполями)
Типы водородных связей
Хотя водородные связи хорошо известны как тип IMF, эти связи также могут возникать внутри одной молекулы, между двумя идентичными молекулами или между двумя разнородными молекулами.
Внутримолекулярные водородные связи
Внутримолекулярные водородные связи возникают внутри одной единственной молекулы.
Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для этого в одной молекуле должны присутствовать как донор водорода, так и акцептор водорода, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь возникает в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за молекулярной геометрии.
Межмолекулярные водородные связи
Межмолекулярные водородные связи возникают между отдельными молекулами вещества. Они могут возникать между любым количеством одинаковых или разных молекул, если доноры и акцепторы водорода находятся в положениях, в которых они могут взаимодействовать друг с другом. Например, межмолекулярные водородные связи могут возникать между NH 3 молекул отдельно, между H 2 молекулами O или между NH 3 и H 2 молекулами O.
Свойства и влияние водородных связей
О температуре кипения
Когда мы рассматриваем точки кипения молекул, мы обычно ожидаем, что молекулы с большей молярной массой будут иметь более высокие нормальные точки кипения, чем молекулы с меньшей молярной массой. Это, без учета водородных связей, связано с большими дисперсионными силами (см. Взаимодействие между неполярными молекулами). Более крупные молекулы имеют больше места для распределения электронов и, следовательно, больше возможностей для мгновенного дипольного момента. Однако, если мы рассмотрим приведенную ниже таблицу, то увидим, что это не всегда так.
Соединение Молярная масса Нормальная температура кипения \(H_2O\) 18 г/моль 373 К \(ВЧ\) 20 г/моль 292,5 К \(NH_3\) 17 г/моль 239,8 К \(H_2S\) 34 г/моль 212,9 К \(HCl\) 36,4 г/моль 197,9 К \(PH_3\) 34 г/моль 185,2 К Мы видим, что H 2 O, HF и NH 3 имеют более высокие точки кипения, чем одно и то же соединение, образованное водородом и следующим элементом, движущимся вниз по соответствующей группе, что указывает на то, что первые обладают большими межмолекулярными силами.
. Это потому, что Н 2 O, HF и NH 3 все имеют водородные связи, тогда как другие нет. Кроме того, \(H_2O\) имеет меньшую молярную массу, чем HF, но имеет больше водородных связей на молекулу, поэтому его температура кипения выше.
О вязкости
Тот же эффект, который наблюдается при температуре кипения в результате образования водородных связей, можно наблюдать и при вязкости некоторых веществ. Вещества, способные образовывать водородные связи, как правило, имеют более высокую вязкость, чем те, которые не образуют водородных связей. Как правило, вещества, которые могут иметь несколько водородных связей, обладают еще более высокой вязкостью.
Факторы, препятствующие образованию водородной связи
Электроотрицательность
Водородная связь не может возникнуть без значительных различий в электроотрицательности между водородом и атомом, с которым он связан. Таким образом, мы видим такие молекулы, как PH 3 , которые не участвуют в водородных связях.
PH 3 имеет тригонально-пирамидальную молекулярную геометрию, как у аммиака, но в отличие от NH 3 не может образовывать водородные связи. Это связано со сходством электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение атомом водорода частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)
Размер атома
Размер доноров и акцепторов также может влиять на способность к образованию водородных связей. Это может объяснить относительно низкую способность Cl образовывать водородные связи. Когда радиусы двух атомов сильно различаются или велики, их ядра не могут достичь непосредственной близости при взаимодействии, что приводит к слабому взаимодействию.
Водородные связи в природе
Водородные связи играют решающую роль во многих биологических процессах и могут объяснить многие природные явления, такие как необычные свойства воды.
Помимо того, что они присутствуют в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белков и спаривании оснований ДНК.
Растения
Когезионно-адгезионная теория транспорта в сосудистых растениях использует водородные связи для объяснения многих ключевых компонентов движения воды через ксилему растения и другие сосуды. Молекулы воды внутри сосуда водородно связываются не только друг с другом, но и с цепочкой целлюлозы, из которой состоит стенка растительной клетки. Поскольку сосуд относительно мал, притяжение воды к целлюлозной стенке создает своего рода капиллярную трубку, обеспечивающую капиллярное действие. Этот механизм позволяет растениям втягивать воду в свои корни. Кроме того, водородные связи могут создать длинную цепочку молекул воды, которая может преодолеть силу гравитации и подняться на большие высоты листьев.
Белки
Водородные связи в изобилии присутствуют во вторичной структуре белков, а также редко в третичной конформации.
Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными остовами, которые содержат пары, связанные азотом и водородом, и атомы кислорода. Поскольку и N, и O сильно электроотрицательны, атомы водорода, связанные с азотом в одной полипептидной цепи, могут водородно связываться с атомами кислорода в другой цепи, и наоборот. Хотя они относительно слабые, эти связи обеспечивают существенную устойчивость вторичной белковой структуры, поскольку они повторяются много раз и работают коллективно.
В третичной структуре белка взаимодействия в основном происходят между функциональными R-группами полипептидной цепи; одно такое взаимодействие называется гидрофобным взаимодействием. Эти взаимодействия происходят из-за водородных связей между молекулами воды вокруг гидрофоба, что еще больше укрепляет конформацию белка.
Ссылки
- Brown, et al. Химия: центральная наука. 11-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2008 г.
.- Чанг, Рэймонд. Общая химия: основные понятия. 3-е изд. Нью-Йорк: Макгроу Хилл, 2003 г.
- Петруччи и др. Общая химия: принципы и современные приложения. 9-е изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007.
.Hydrogen Bonding распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором выступили Джим Кларк и Хосе Пьетри.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- нет на странице
- Теги
- автор @ Джим Кларк
- автор@Хосе Пьетри
- водородная связь
1.
33: Радикальные реакции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 81799
- Кирк МакМайкл
- Университет штата Вашингтон
Гомолитический разрыв связи — Символы рыболовного крючка
В прошлый раз мы рассмотрели, как бензольное кольцо изменяет реакционную способность атома или группы, к которой оно непосредственно присоединено. Сегодня мы закончим изложение нового материала курса, кратко рассмотрев реакции, в которых процессы образования и разрыва связи включают электроны, движущиеся поодиночке, а не парами. Чтобы представить это в перспективе, давайте вспомним, как мы представляли разрыв ковалентной связи в реакциях, с которыми мы сталкивались до сих пор.
Диссоциация HCl на H + и Cl — являются примером.
Мы интерпретировали это как означающее, что общая электронная пара, которая образует ковалентную связь между атомами водорода и хлора, перемещается вместе, чтобы стать неподеленной электронной парой на хлоре. Такой разрыв связи часто называют «гетеролитическим», так как в продуктах электронная пара распределяется весьма неравномерно. Мы использовали символ изогнутой стрелки, чтобы показать происхождение и назначение электронных пар на этих этапах. Все механизмы реакций, с которыми мы работали до сих пор, включали создание и разрыв связей посредством процессов, подобных этому, в которых пары электронов движутся вместе.
Теперь давайте рассмотрим разрыв связи, при котором каждый участник связи забирает один электрон из пары связывающих электронов. Хорошим примером является диссоциация молекулярного хлора (Cl 2 ). Это происходит при сильном нагревании Cl 2 или при его освещении ярким светом.
Это называется «гомолитическим» разрывом связи, так как в продуктах электронная пара распределяется достаточно равномерно. Мы используем «рыболовный крючок» (изогнутая стрелка с одной «зазубриной» на наконечнике), чтобы показать движение одного электрона. Такие гомолитические разрывы связи происходят, когда задействованная связь неполярна и нет под рукой электрофила или нуклеофила, способствующих гетеролитическим паттернам.
Прочность связи и энергия радикалов
При образовании связи продукт имеет более низкую энергию, чем реагенты. Отсюда следует, что для разрыва связей требуется энергия. Когда процесс разрыва связи является гомолитическим, остаточное ионное притяжение отсутствует, поскольку на продуктах отсутствуют заряды, поэтому энергия, необходимая для разрыва связи, является хорошей мерой прочности этой связи. В таблице 9.1 на странице 237 Atkins & Carey перечислены такие «энергии диссоциации связи».
Беглый взгляд на эту таблицу показывает нам некоторые интересные тенденции.
Во-первых, все связи галоген-галоген (например, связь Cl-Cl) относительно слабы. Связи углерод-углерод и углерод-водород прочнее, как и связи углерод-кислород и водород-кислород. Во-вторых, если мы рассмотрим тенденцию изменения энергий диссоциации связи С-Н по мере изменения структуры алкильной группы, мы заметим, что самая прочная (435 кДж/моль) связь С-Н возникает между углеродом метильной группы и атомом водорода. Самый слабый (343 кДж/моль) находится между центральным углеродом трет-бутильной группы и атомом водорода.
Мы можем интерпретировать это как означающее, что свободный радикал третичного бутила более стабилен, чем свободный радикал метила. (Термин «свободный радикал» или «радикал» используется для обозначения атома или группы, в которой одна из связывающих орбиталей занята одним электроном. Радикалы обычно незаряжены.) Это могло бы объяснить, почему легче разрушить третичную орбиталь. связь С-Н, чем метильная связь С-Н; продукты разрыва третичной связи CH более стабильны.
Глядя на структуры, которые образуются при разрыве связей С-Н, лежащих между метил-Н-связью и трет-бутил-Н-связью, мы видим знакомую картину. Как и карбокатионы, порядок устойчивости свободных радикалов углерода следующий:
третичный > вторичный > первичный > метил
Мы видели, что промежуточные соединения, которые являются более стабильными, также образуются быстрее всего, и этот факт часто доминирует в составе смесей продуктов. Напомним, что эта идея легла в основу нашего объяснения правила Марковникова, а также директивного и активационно-деактивационного эффектов в электрофильном ароматическом замещении. Более стабильный интермедиат (в этих случаях карбокатион) образовывался быстрее. Больше реакций происходило по более быстрому пути, поэтому в смеси продуктов преобладал продукт, образованный более стабильным промежуточным продуктом. В следующем разделе мы увидим, как эту идею можно использовать для понимания некоторых свободнорадикальных реакций.
Радикальное присоединение к алкенам
Мы много говорили о правиле Марковникова.
Когда мы применяем это правило к добавлению HBr к пропилену, мы с уверенностью предсказываем, что продуктом будет 2-бромпропан. Бывает, что иногда образуются значительные количества 1-бромпропана. На самом деле может случиться так, что 1-бромпропан является единственным продуктом при некоторых обстоятельствах. Это озадачивает и говорит нам, что происходит что-то необычное.
Потребовалось много экспериментов, чтобы определить детали, определяющие, следует ли реакция по схеме Марковникова или по необычному ходу. В конце концов было установлено, что модель Марковникова соблюдается, если реагенты тщательно очищаются непосредственно перед их использованием. Необычная картина наблюдается, если реагенты «состариваются» перед использованием. Позже стало известно, что «старение» приводит к образованию пероксидов, соединений, в которых две алкильные группы или аналогичные группы соединены через два атома кислорода, которые имеют общую связь О-О.
Связь O-O слабая (энергия диссоциации связи = 154 кДж/моль, очень похожа на связь I-I) и неполярна, поэтому нас не удивляет, что она гомолитически разрывается с образованием двух свободных кислородных радикалов.
Затем один из этих свободных радикалов кислорода реагирует с HBr с образованием спирта (сильная связь O-H) и радикала с атомом брома.
Эти стадии (названные стадиями инициирования цепи по причинам, к которым мы вернемся позже) подготовили почву для реакции с пропеном. Радикал атома брома может либо атаковать первичный углерод пропилена с образованием вторичного свободного радикала, либо вторичный углерод пропилена с образованием первичного свободного радикала. Мы знаем, что вторичный свободный радикал является промежуточным продуктом с более низкой энергией, и мы знаем, что реакции, протекающие через промежуточные продукты с более низкой энергией, протекают быстрее, чем те, которые проходят через промежуточные продукты с более высокой энергией. Мы прогнозируем, что атака брома на первичный углерод с образованием вторичного свободного радикала будет происходить быстрее, и основной продукт будет образовываться по этому пути.
Реакция завершается, когда вторичный свободный радикал реагирует с другой молекулой HBr с образованием продукта — 1-бромпропана — и нового атома брома.
Обратите внимание, что на втором этапе регенерируется атом брома, который может начать новый цикл, атакуя новую молекулу пропилена. Эти два шага вместе называются механизмом цепной реакции, потому что продукт каждого из них является реагентом другого, создавая цепь событий, которая останавливается, когда реагенты израсходованы. Сумма этих двух стадий представляет собой антимарковниковское присоединение HBr к пропилену. Хотя результат отличается от модели Марковникова, которую мы изучали ранее, основной принцип тот же: Мы видим продукты более быстрых реакций, реакций, протекающих через более стабильные промежуточные соединения. В этом случае промежуточные соединения представляют собой свободные радикалы, а вторичный свободный радикал образуется быстрее, чем первичный свободный радикал. В реакциях, протекавших по типу карбокатионов (правило Марковникова), образовывался более устойчивый карбокатион.
Радикальное замещение алканов
Существуют также свободнорадикальные механизмы реакций замещения алканов.
Они используются для синтеза только в довольно ограниченных случаях, но продукты, которые мы наблюдаем, также контролируются конкуренцией, при которой более стабильные промежуточные продукты образуются быстрее. Примером может служить хлорирование бутана.
Мы видим, что вторичный водород заменяется хлором чаще, чем первичный водород, хотя первичных водородов шесть, а вторичных только четыре. Это имело бы смысл, если бы механизм реакции проходил через свободный радикал, поскольку мы ожидали бы, что более стабильный вторичный свободный радикал будет образовываться быстрее (чаще), чем менее стабильный первичный свободный радикал. Такой механизм будет следующим:
Опять же, более распространенный продукт производится за счет более стабильного (вторичного) свободного радикала, а не за счет менее стабильного (первичного) свободного радикала. Обратите внимание, что эта реакция также является цепной реакцией, поскольку на втором этапе образуется атом хлора, который может реагировать с другой молекулой бутана, продолжая цепочку.
В этом случае реакция инициируется гомолитическим разрывом слабой связи Cl-Cl под действием света с образованием атомов хлора.
Радикальная полимеризация
Наконец, давайте вернемся к другому применению свободнорадикальных присоединений к алкенам. Ранее мы видели, что HBr присоединяется к алкенам через свободнорадикальный цепной механизм, инициированный пероксидом, с образованием антимарковниковского продукта. Ключевой стадией в этой реакции было добавление радикала атома брома к алкену, чтобы получить более стабильный из двух возможных свободных радикалов. Предположим, что не было HBr. Затем образовавшийся свободный углеродный радикал должен будет вступить в реакцию с алкеном, чтобы образовалась новая углерод-углеродная связь. Вот пример, где этилен является алкеном.
Новая молекула также будет свободным радикалом и может присоединяться к другой молекуле этилена. Продуктом этой реакции также будет свободный радикал, который может присоединяться к другой молекуле этилена и т.
д. В результате каждая реакция удлиняет растущую цепь на два атома углерода и производит промежуточный свободный радикал на конце цепи, который может продолжить реакцию. Таким образом образуются очень длинные молекулы. Эти полимеры, такие как полиэтилен и полистирол, производятся в количестве миллиардов фунтов в год и являются очень важными коммерческими продуктами.
Другие реакции полимеризации также важны, и многие из них перечислены в таблице 9.2 на стр. 251 Atkins & Carey. Мы можем понять структуру алкена, из которого был сделан полимер, ища «повторяющееся звено» в полимере и мысленно возвращаясь к алкену, который «добавлялся» при создании полимера. Вот как это работает для поливинилхлорида:
Поскольку повторяющееся звено образуется путем присоединения к каждому концу двойной связи мономера, структуру мономера можно обнаружить, мысленно вырезав повторяющееся звено из полимер и размещение двойной связи между его атомами углерода.
Авторы
Эта страница под названием 1.
33: Radical Reactions распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором этой страницы является Кирк МакМайкл.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Кирк МакМайкл
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- нет на странице
- Теги
На этой странице нет тегов.
3.3 Электроотрицательность | Комбинации атомов
3.3 Электроотрицательность (ESBMD)
До сих пор мы рассматривали ковалентные молекулы. Но откуда мы знаем, что они ковалентны? Ответ происходит от электроотрицательности. Каждый элемент (кроме благородных газов) имеет электроотрицательность ценность.
Электроотрицательность является мерой того, насколько сильно атом притягивает общую электронную пару к ней. В таблице ниже показаны электроотрицательности некоторых элементов.
Полный список электроотрицательностей см. в периодической таблице в начале книги. На этом периодической таблицы значения электроотрицательности приведены в правом верхнем углу. Не путайте эти значения с другими номерами, показанными для элементов.
Электроотрицательность всегда будет между \(\text{0}\) и \(\text{4}\) для любого элемента. Если вы используете число больше, чем \(\text{4}\), то вы не используете электроотрицательность.
В зависимости от того, какой источник электроотрицательности вы используете, вы можете увидеть немного разные ценности.
Элемент
Электроотрицательность
Элемент
Электроотрицательность
Водород (\(\text{H}\))
\(\текст{2,1}\)
Литий (\(\text{Li}\))
\(\текст{1,0}\)
Бериллий (\(\text{Be}\))
\(\текст{1,5}\)
Бор (\(\text{B}\))
\(\текст{2,0}\)
Углерод (\(\text{C}\))
\(\текст{2,5}\)
Азот (\(\text{N}\))
\(\текст{3,0}\)
Кислород (\(\text{O}\))
\(\текст{3,5}\)
Фтор (\(\text{F}\))
\(\текст{4,0}\)
Натрий (\(\text{Na}\))
\(\текст{0,9}\)
Магний (\(\text{Mg}\))
\(\текст{1,2}\)
Алюминий (\(\text{Al}\))
\(\текст{1,5}\)
Кремний (\(\text{Si}\))
\(\текст{1,8}\)
Фосфор (\(\text{P}\))
\(\текст{2,1}\)
Сера (\(\text{S}\))
\(\текст{2,5}\)
Хлор (\(\text{Cl}\))
\(\текст{3,0}\)
Калий (\(\text{K}\))
\(\текст{0,8}\)
Кальций (\(\text{Ca}\))
\(\текст{1,0}\)
Бром (\(\text{Br}\))
\(\текст{2,8}\)
Таблица 3.
2: Таблица электроотрицательностей некоторых элементов.
- Электроотрицательность
Электроотрицательность — это химическое свойство, описывающее способность атома притягивать к себе электроны.
Понятие электроотрицательности было введено Линусом Полингом в 1932 году, и это стал очень полезным для объяснения природы связей между атомами в молекулах. За за эту работу Полинг был удостоен Нобелевской премии по химии в 1954. Он также получил Нобелевская премия мира 1962 года за кампанию против наземных ядерных испытаний.
Чем больше электроотрицательность атома элемента, тем сильнее его притяжение к электроны.
Например, в молекуле бромистого водорода (\(\text{HBr}\)) электроотрицательность брома (\(\text{2,8}\)) выше, чем у водорода (\(\text{2,1}\)), и поэтому общие электроны будут проводить больше времени ближе к атому брома. Бром будет иметь слегка отрицательный заряд, а водород будет иметь слегка положительный заряд. В молекула, подобная водороду (\(\text{H}_{2}\)), где электроотрицательность атомов в молекулы одинаковы, оба атома имеют нейтральный заряд.
Рабочий пример 9: Расчет разности электроотрицательностей
Рассчитайте разницу электроотрицательностей водорода и кислорода.
Прочтите электроотрицательность каждого элемента периодической таблицы.
Из таблицы Менделеева мы находим, что водород имеет электроотрицательность \(\text{2,1}\), а кислород имеет электроотрицательность \(\text{3,5}\).
Рассчитать разность электроотрицательностей
\(\text{3,5} — \text{2,1} = \text{1,4}\)
Учебник Упражнение 3.7
Рассчитайте разницу электроотрицательностей между: \(\text{Be}\) и \(\text{C}\), \(\text{H}\) и \(\text{C}\), \(\text{Li}\) и \(\text{F}\), \(\text{Al}\) и \(\text{Na}\), \(\text{C}\) и \(\текст{О}\).
\(\text{Be}\) и \(\text{C}\): \(\text{2,5} — \text{1,5} = \text{1,0}.\)
\(\text{H}\) и \(\text{C}\): \(\text{2,5} — \text{2,1} = \text{0,4}.\)
\(\text{Li}\) и \(\text{F}\): \(\text{4,0} — \text{1,0} = \text{3,0}.
\)
\(\text{Al}\) и \(\text{Na}\): \(\text{1,5} — \text{0,9} = \текст{0,6}.\)
\(\text{C}\) и \(\text{O}\): \(\text{3,5} — \text{2,5} = \текст{1,0}.\)
Электроотрицательность и связывание (ESBMF)
По разнице электроотрицательности двух атомов можно определить тип связь существует между атомами. В таблице ниже приведены приблизительные значения. Несмотря на то что здесь мы указали диапазоны. Связь больше похожа на спектр, чем на набор ящиков.
Разность электроотрицательностей Тип облигации \(\текст{0}\) Неполярная ковалентная \(\text{0}\) — \(\text{1}\) Слабая полярная ковалентная \(\text{1,1}\) — \(\text{2}\) Сильная полярная ковалентная \(>\) \(\text{2,1}\) Ионный Обратите внимание, что металлическое соединение здесь не указано.
Металлы имеют низкую электроотрицательность и поэтому валентные электроны не притягиваются сильно к какому-либо одному атому. Вместо этого валентные электроны свободно распределяются между всеми атомами в металлической сети.
Неполярные и полярные ковалентные связи (ESBMG)
Важно уметь определять, является ли молекула полярной или неполярной, поскольку полярность молекул влияет на такие свойства как растворимость , точки плавления и точки кипения .
Электроотрицательность можно использовать для объяснения разницы между двумя типами ковалентных связей. Неполярные ковалентные связи возникают между двумя одинаковыми атомами неметаллов, например \(\text{H}_{2}\), \(\text{Cl}_{2}\) и \(\text{O}_{2}\).
Потому что два атома имеют одинаковую электроотрицательность, электронная пара в ковалентной связи является общей поровну между ними. Однако, если два разных атома неметалла связаны, то общая электронная пара будет сильнее притягиваться к атому с более высоким электроотрицательность. В результате 9{-}}\).
Символ \(\delta\) читается как дельта.
Полярные молекулы (ESBMH)
Некоторые молекулы с полярными ковалентными связями являются полярными молекулами , например \(\текст{Н}_{2}\текст{О}\). Но не все молекулы с полярными ковалентными связями являются полярными. Примером является \(\text{CO}_{2}\). Хотя \(\text{CO}_{2}\) имеет два полярных ковалентные связи (между атом \(\text{C}^{\delta^{+}}\) и два атома \(\text{O}^{\delta^{-}}\)), сама молекула неполярна.
Причина в том, что \(\text{CO}_{2}\) представляет собой линейную молекулу с обоими концевыми атомами одинакова и, следовательно, симметрична. Таким образом, нет никакой разницы в заряде между двумя заканчивается молекулы.
- Полярные молекулы
Полярная молекула — это молекула, один конец которой немного положительный заряд, а один конец со слегка отрицательным зарядом. Примеры включают воду, аммиак и хлористый водород.
- Неполярные молекулы
Неполярная молекула — это молекула, заряд которой равен распространяется поперек молекулы или симметричная молекула с полярными связями.
Примеры включают углекислый газ и кислород.
Чтобы определить, является ли молекула симметричной, посмотрите сначала на атомы вокруг центральной атом. Если они разные, то молекула несимметрична. Если они то же самое тогда молекула может быть симметричной и нам нужно смотреть на форму молекулы.
Мы можем легко предсказать, какие молекулы, скорее всего, будут полярными, а какие — неполярный, глядя на молекулярную форму. Следующее упражнение поможет вам определите это и поможет вам лучше понять симметрию.
Полярные и неполярные молекулы
В следующей таблице перечислены молекулярные формы.
Постройте молекулу, данную для каждого случае с помощью желе и зубочистки. Определите, является ли фигура симметричной. (Выглядит ли она одинаково с любой стороны?) Теперь решите, является ли молекула является полярным или неполярным.
Геометрия
Молекула
Симметричный
Полярный или неполярный
Линейный
\(\текст{HCl}\)
Линейный
\(\текст{CO}_{2}\) Линейный
\(\текст{HCN}\) Изогнутые или угловатые
\(\текст{Н}_{2}\текст{О}\)
Тригональная планарная
\(\текст{БФ}_{3}\)
Тригональная планарная
\(\text{BF}_{2}\text{Cl}\)
Треугольная пирамидальная
\(\text{NH}_{3}\)
Тетраэдрический
\(\текст{СН}_{4}\)
Тетраэдрический
\(\текст{СН}_{3}\текст{Кл}\)
Тригонально-бипирамидальный
\(\текст{PCl}_{5}\)
Тригонально-бипирамидальный
\(\текст{PCl}_{4}\текст{F}\)
Октаэдрический
\(\текст{СФ}_{6}\)
Октаэдрический
\(\text{SF}_{5}\text{Cl}\)
Моделирование: 23ПР
Рабочий пример 10: полярные и неполярные молекулы
Укажите, является ли водород (\(\text{H}_{2}\)) полярным или неполярным.
Определите форму молекулы
Молекула линейна. Существует одна связывающая пара электронов и нет пары.
Запишите электроотрицательность каждого атома
Водород: \(\text{2,1}\)
Определите разницу электроотрицательностей каждой связи
Существует только одна связь, и разница составляет \(\text{0}\).
Определите полярность каждой связи
Связь неполярная.
Определить полярность молекулы
Молекула неполярная.
Рабочий пример 11: полярные и неполярные молекулы
Укажите, является ли метан (\(\text{CH}_{4}\)) полярным или неполярным.
Определите форму каждой молекулы
Молекула тетраэдрическая.
Есть четыре связывающие пары электронов и нет одинокие пары.
Определите разность электроотрицательностей каждой связи
Имеется четыре связи. Поскольку каждая связь находится между углеродом и водородом, мы только необходимо вычислить одну разность электроотрицательностей. Это: \(\текст{2,5} — \текст{2,1} = \текст{0,4}\)
Определите полярность каждой связи
Каждая связь полярна.
Определите полярность молекулы
Молекула симметрична и поэтому неполярна.
Рабочий пример 12: полярные и неполярные молекулы
Укажите, является ли цианистый водород (\(\text{HCN}\)) полярным или неполярным.
Определите форму молекулы
Молекула линейна.
Имеются четыре пары связей, три из которых образуют тройная связь и считается как \(\text{1}\). Есть одна одинокая пара на атом азота.
Определите разность электроотрицательностей и полярность для каждая облигация
Имеется две облигации. Один между водородом и углеродом, а другой между углерода и азота. Разница в электроотрицательности углерода и водород равен \(\text{0,4}\), а разница в электроотрицательности между углерод и азот — это \(\text{0,5}\). Обе связи полярны.
Определите полярность молекулы
Молекула несимметрична и поэтому полярна.
Электроотрицательность
Учебник Упражнение 3.
8
Какова электроотрицательность бериллия?
\(\text{1,5}\)
Какова электроотрицательность хлора?
\(\text{3,0}\)
Какой атом будет иметь слегка положительный заряд и который будет иметь слегка отрицательный заряд в молекула? Изобразите это на эскизе молекула с частичными зарядами.
Бериллий будет иметь слегка положительный заряд и хлор будет иметь слегка отрицательный заряд.
Является ли связь неполярной или полярной ковалентной связью?
Ковалентная полярная связь. Разница в электроотрицательности это: \(\text{3,0}-\text{1,5} = \text{1,5}\).
связь сильно полярна.
Молекула полярная или неполярная?
Хлорид бериллия линейный и симметричный. Следовательно, это неполярный молекула.
Заполните таблицу ниже:
Молекула
Разница в электроотрицательность между атомами
Неполярный/полярный ковалентный облигация
Полярный/неполярный молекула
\(\текст{Н}_{2}\текст{О}\)
\(\text{HBr}\)
\(\text{F}_{2}\)
\(\текст{СН}_{4}\)
\(\текст{ПФ}_{5}\)
\(\text{BeCl}_{2}\)
\(\текст{СО}\)
\(\текст{С}_{2}\текст{Н}_{2}\)
\(\text{SO}_{2}\)
\(\текст{БФ}_{3}\)
Молекула
Разница в электроотрицательность между атомами
Неполярный/полярный ковалентный облигация
Полярный/неполярный молекула
\(\текст{Н}_{2}\текст{О}\)
\(\текст{3,5}-\текст{2,1}=\текст{1,4}\)
Полярная ковалентная связь
Полярная молекула.
Вода имеет искривление или угловатая форма.
\(\текст{HBr}\)
\(\текст{2,8}-\текст{2,1}=\текст{0,7}\)
Полярная ковалентная связь
Полярная молекула.
бромистый водород линейный.
\(\text{F}_{2}\)
\(\текст{4,0}-\текст{4,0}=\текст{0}\)
Неполярная ковалентная связь
Неполярная молекула.
\(\текст{СН}_{4}\)
\(\текст{2,5}-\текст{2,1}=\текст{0,4}\)
Полярная ковалентная связь
Неполярная молекула.
Метан это тетраэдрический.
\(\текст{ПФ}_{5}\)
\(\текст{4,0}-\текст{2,1}=\текст{1,9}\)
Полярная ковалентная связь
Неполярная молекула.
Фосфор пентафторид является тригональным бипрамидальные и симметричные.
\(\text{BeCl}_{2}\)
\(\текст{3,0}-\текст{1,5}=\текст{1,5}\)
Полярная ковалентная связь
Неполярная молекула.
Бериллий хлорид является линейным и симметричный.
\(\текст{СО}\)
\(\текст{3,5}-\текст{2,5}=\текст{1,0}\)
Полярная ковалентная связь
Полярная молекула.
Угарный газ линейный, но не симметричный.
\(\текст{С}_{2}\текст{Н}_{2}\)
\(\текст{2,5}-\текст{2,1}=\текст{0,4}\)
Полярная ковалентная связь
Неполярная молекула.
Ацетилен это линейные и симметричные.
\(\text{SO}_{2}\)
\(\текст{3,5}-\текст{2,5}=\текст{1,0}\)
Полярная ковалентная связь
Полярная молекула.
Диоксид серы согнуты или угловаты и не симметричный.
\(\текст{БФ}_{3}\)
\(\текст{4,0}-\текст{2,0}=\текст{2,0}\)
Полярная ковалентная связь
Неполярная молекула.
трехфтористый бор является тригонально-пирамидальным, а не симметричный.
Полярная ковалентная связь — обзор
ScienceDirectРегистрацияВход
Полярная ковалентная связь возникает, когда атомы с разной электроотрицательностью совместно используют электроны в ковалентной связи.
Из: Основы органической химии, 2015 г.
PlusAdd to Mendeley
Роберт Дж. Уэллетт, Дж. Дэвид Рон, в Принципах органической химии, 2015 г.
Полярные ковалентные связи
Полярная ковалентная связь существует, когда атомы с разной электроотрицательностью разделяют электроны в ковалентной связи.
Рассмотрим молекулу хлороводорода (HCl). Каждому атому HCl требуется еще один электрон, чтобы сформировать электронную конфигурацию инертного газа. Хлор имеет более высокую электроотрицательность, чем водород, но притяжения атома хлора к электронам недостаточно, чтобы отнять электрон у водорода. Следовательно, связывающие электроны в хлороводороде распределяются неравномерно в полярной ковалентной связи. Молекула представлена обычной структурой Льюиса, хотя общая электронная пара в большей степени связана с хлором, чем с водородом. Неравное распределение связывающей пары приводит к частичному отрицательному заряду атома хлора и частичному положительному заряду атома водорода. Эти дробные заряды обозначаются символом δ (греческая строчная дельта).
Молекула хлористого водорода имеет диполь (два полюса), который состоит из пары разноименных зарядов, отделенных друг от друга. Диполь показан стрелкой с крестом на одном конце. Крест находится рядом с концом молекулы, который является частично положительным, а наконечник стрелки находится рядом с частично отрицательным концом молекулы.
Одиночные или множественные связи между атомами углерода неполярны. Водород и углерод имеют одинаковые значения электроотрицательности, поэтому связь С—Н обычно не считается полярной ковалентной связью. Таким образом, этан, этилен и ацетилен имеют неполярные ковалентные связи, а соединения неполярны.
Связи между углеродом и другими элементами, такими как кислород и азот, полярны. Полярность связи зависит от электроотрицательности связанных атомов. Большие различия между электроотрицательностями связанных атомов увеличивают полярность связей. Направление полярности общих связей, обнаруженных в органических молекулах, легко предсказать. Обычные неметаллы более электроотрицательны, чем углерод. Следовательно, когда атом углерода связан с обычными атомами неметалла, он имеет частичный положительный заряд.
Водород также менее электроотрицателен, чем обычные неметаллы. Следовательно, когда атом водорода связан с обычными неметаллами, образующаяся полярная связь имеет частичный положительный заряд на атоме водорода.
Величина полярности связи равна дипольному моменту , (D). Дипольные моменты нескольких типов связи приведены в таблице 1.2. Дипольный момент конкретной связи относительно постоянен от соединения к соединению. Когда углерод образует множественные связи с другими элементами, эти связи являются полярными. И двойная связь углерод-кислород в формальдегиде (метанале), и тройная связь углерод-азот в ацетонитриле (цианометан) полярны.
Таблица 1.2. Average Dipole Moments (D)
Structural Unit 1 Bond Moments (D) H—C 0.4 H—N 1.3 H—O 1.5 H—F 1.7 H—S 0.7 H—Cl 1.1 H—Br 0.8 H—I 0. 4
C—C 0.0 C—N 0.2 C—O 0.7 C—F 1.4 C—Cl 1.5 C—Br 1.4 C—I 1.2 C = O 2.3 C ≡ N 3.5
- 1
- Более отрицательный элемент находится справа.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B978012802444700001X Химия, 2015
Диполь-дипольные силы
Связывающие электроны в полярных ковалентных связях не делятся поровну, и в результате возникает момент связи. Однако молекула может быть полярной или неполярной в зависимости от ее геометрии. Например, тетрахлорметан (четыреххлористый углерод, CCl 4 ) имеет полярные связи C—Cl, но тетраэдрическое расположение четырех связей вокруг центрального атома углерода приводит к тому, что моменты отдельных связей компенсируются.
Напротив, дихлорметан (метиленхлорид, CH 2 Cl 2 ) представляет собой полярную молекулу с чистой полярностью от частично положительного атома углерода к частично отрицательным атомам хлора.
Полярные молекулы имеют отрицательный «конец» и положительный «конец». Они склонны связываться, потому что положительный конец одной молекулы притягивает отрицательный конец другой молекулы. Физические свойства полярных молекул отражают эту ассоциацию. Повышенная связь между молекулами снижает их давление паров, что, в свою очередь, приводит к более высокой температуре кипения, поскольку для испарения молекул требуется больше энергии. Молекулярные массы и формы молекул ацетона и изобутана схожи (рис. 2.1), но ацетон кипит при более высокой температуре, чем изобутан. Ацетон содержит полярную карбонильную группу, тогда как изобутан представляет собой неполярную молекулу. Более высокая температура кипения ацетона является результатом сильного диполь-дипольного взаимодействия полярной карбонильной группы.
Рисунок 2.1. Физические свойства изобутана и ацетона
Физические свойства этих двух молекул отражают их дипольные моменты. Изобутан, дипольный момент которого близок к нулю, имеет низкую температуру кипения — 11,7 °C. Однако ацетон имеет большой дипольный момент 2,91 Д и температуру кипения 56–57 °С.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B9780128024447000021
Sue Ann Bidstrup Allen, in Handbook of Thermal Analysis and Calorimetry, 1998
2.1.1 Нерелаксированная диэлектрическая проницаемость
В присутствии электрического поля электронные облака и атомы в полярных ковалентных связях могут слегка смещаться, вызывая небольшая поляризация, совпадающая с электрическим полем. Это служит для накопления энергии и способствует емкостной природе материала. Время отклика электронных и атомных сдвигов чрезвычайно мало, так что при нормальных частотах измерения диэлектрических свойств этот эффект присутствует всегда.
Эти индуцированные диполи ответственны за неполярные или симметрично полярные полимеры, имеющие диэлектрическую проницаемость 2 или выше. Диэлектрическая проницаемость, обусловленная этими индуцированными диполями, известна как нерелаксированная или бесконечная частотная диэлектрическая проницаемость ( ϵ и ). В диапазоне частот, обычно встречающемся в диэлектрических экспериментах (от 10 90 700 −3 90 701 до 10 90 700 8 90 701 Гц), индуцированные диполи реагируют на электрическое поле так быстро, что 90 443 ϵ 90 444 90 417 u 90 418 не зависит от частоты.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/S1573437498800101
M. Jansen, J.C. ), 2013
9.35.5.2.4 Ковалентные твердые вещества
В хорошем первом приближении и с правдоподобными результатами соединения, образующие полярные ковалентные связи, часто могут быть успешно описаны с помощью ионных эмпирических потенциалов.
Это особенно верно, пока локальные координационные полиэдры анионов, окружающих отдельные катионы, высокосимметричны, а общее распределение заряда в твердом теле примерно изотропно. В таком случае ковалентные и ионные модели во многих случаях дают один и тот же набор кандидатов в низкоэнергетические структуры, просто с некоторыми разными энергетическими рейтингами в вышележащих минимумах и, возможно, с разными энергетическими барьерами между минимумами. Однако это не относится к системам, в которых важные локальные минимумы демонстрируют различные типы анизотропных связей, например, sp 2 — и sp 3 — гибридизованные атомы углерода, и затем необходимо выполнить глобальную оптимизацию энергетического ландшафта ab initio.
Например, в нитриде бора присутствует несколько видов, в основном ковалентных, вкладов в полную энергию, и глобальные поиски необходимо проводить на уровне ab initio. Система BN особенно интересна как тестовая система, поскольку экспериментально наблюдаемые модификации включают как слоистые структуры (гексагональные BN), так и трехмерные сетки (типа вюрцита и сфалерита).
В глобальной оптимизации, использующей как функционалы Хартри-Фока, так и функционалы плотности, 247 действительно обнаружены все экспериментально наблюдаемые типы структур. Кроме того, было предсказано несколько новых модификаций, таких как слоистые структуры, но с порядком укладки, отличным от экспериментально наблюдаемой структуры h-BN. Сила общего ландшафтного подхода была впечатляюще продемонстрирована открытием двух замечательных новых каркасных структур с низкими энергиями, демонстрирующих структуру β-BeO и частичную структуру Al в SrAl 2 соответственно.
Другое недавнее исследование использовало комбинацию интеллектуального анализа данных, генерации сети и локальной оптимизации с расчетами энергии ab initio (DFT) для предсказания кристаллических структур нитридов и фосфидов группы 14. 384 Важным шагом стала генерация новых кандидатов путем разумной замены атомов различных типов в известных базовых сетях, что привело к множеству интересных структур.
Эта процедура чем-то похожа на один из подходов, используемых для поиска кристаллических кандидатов в Si 3 B 3 N 7 система. 55
Просмотреть главуКнига покупок
Прочитать всю главу
URL: https://www.sciencedirect.com/science/article/pii/B9780080977744009402
3 KC.900 Маджумдар, С.К. Chattopadhyay, in Comprehensive Heterocyclic Chemistry III, 2008
12.14.3.5 Исследования флуоресценции и фосфоресценции
Спектры флуоресценции и поглощения DTT- S,S -диоксида 20a с полярными ковалентными связями изучали в ТГФ, толуоле и декалине. Спектральная линия и энергия пика практически не зависят от полярности растворителя. Спектры флуоресценции растворов декалина и толуола (почти одинаковой полярности) сдвинуты в красную область примерно на 5 нм по отношению к раствору ТГФ более высокой полярности.
Явного сольватохромизма не наблюдается. Спектры поглощения и возбуждения флуоресценции (на длине волны пика флуоресценции) для ДТТ- S,S -диоксида 9Сравнивали 0005 20a
Спектр поглощения свободного DTTPP (3,5-диметил-2,6-дифенил-дитиено[3,2- b ;2′,3′- d ]тиофен-4,4-диоксид 83 сравнивали с DTTPP, связанным с антителом анти -CD 3 . Спектры показали, что поглощение флуорофора после конъюгации не изменилось, за исключением некоторого уширения низкоэнергетической полосы поглощения, вероятно, за счет увеличения числа поворотных конформеров. Облучение при λ exc = 404 нм приводило к интенсивному сигналу фотолюминесценции, который сохраняет значительную интенсивность при облучении образца при λ exc = 480 нм. Значимость этого результата обусловлена тем фактом, что 480 нм — это длина волны источника возбуждения аргон-ионного лазера имеющихся в настоящее время коммерческих проточных циклометров. Установлено, что активность антитела полностью сохранялась в конъюгате, как в случае конъюгата с антителом анти--CD 8 и антитело анти--CD 3 <2002CEJ5072>.
Значимость этого результата обусловлена тем фактом, что 480 нм — это длина волны источника возбуждения аргон-ионного лазера имеющихся в настоящее время коммерческих проточных циклометров. Установлено, что активность антитела полностью сохранялась в конъюгате, как в случае конъюгата с антителом анти--CD 8 и антитело анти--CD 3 <2002CEJ5072>.
Стационарные спектры флуоресценции, квантовый выход флуоресценции (Φ F ) и время жизни (τ F ) DTT 15 и DTP 23a были оценены, как показано в Таблице 8 . Φ F для DTT выше, чем DTP. Φ F для DTP очень мало, и было трудно точно оценить время жизни флуоресценции методом подсчета фотонов из-за слабой флуоресценции. Отмечается, что Φ F для DTP в значительной степени зависит от растворителя и составляет 7,7 × 10 -5 в ацетонитриле. Это низкое значение Φ F объясняется реакцией присоединения с растворителем.
Таблица 8. Положения пиков (λ F ) и квантовые выходы (φ F ) флуоресценции производных битиофенов
| λ F (nm) | λ F (nm) | λ F (nm) | λ F (nm) | λ F (nm) | λ (nm)| λ . ) | | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ДТТ | 333 | 1,0 × 10 −3 | |||||||||||
| DTP | 337 | 7,7 × 10 –5 |
| Triplet Enrgy/ev | λ T (nm) | ε T (dm 3 mol −1 cm −1 ) | |
|---|---|---|---|
| DTT | 2.57 | 384 | 2.2 × 10 4 |
| DTP | 2.58 | 400 | 1,4 × 10 4 |
Посмотреть в книгу
. John J. Eisch, In Comprehensive Organometallic Chemistry II, 1995
6.1.2.3 Реакции метатезиса связей AlC и AlH с неметаллическими соединениями
Связи AlC и AlH алюминийорганических соединений вступают в большое количество реакций метатезиса с органическими субстратами содержащие полярные ковалентные связи (E 1 E 2 , уравнение (29)), такие как содержащие HO, HN, HS и даже некоторые группы HC, а также функциональные группы RO, RX, NX, XCN, XSO 2 R и XCOR . Легкость реакции, по-видимому, увеличивается либо с увеличением электроотрицательности E 2 (E 1 E 2 : ClR, ClCOR, ClSO 2 R), либо с увеличением числа таких связей (E 1 E ). 2 : ROR по сравнению с (RO) 2 CR 2 ; ClMe по сравнению с CCl 4 ). ССl 4 может реагировать со взрывом с Me 3 Al, но CH 2 Cl 2 реагирует очень медленно. Точно так же обычные эфиры не расщепляются Bu и 2 AlH, а кетали плавно расщепляются при 70–80 °C 53 (уравнение (30)). Из-за этих сильных эффектов заместителей, реакции метатезиса R 1 2 AlR 2 сильно ограничены в своей полезности из-за осуществимости и факторов безопасности. Тем не менее, в случае успеха, такие преобразования обеспечивают свободный доступ к углеводородам с различной функциональностью (уравнения (31) 54 и (32) 55 и Схемы 11 56 и 12).
Легкость реакции, по-видимому, увеличивается либо с увеличением электроотрицательности E 2 (E 1 E 2 : ClR, ClCOR, ClSO 2 R), либо с увеличением числа таких связей (E 1 E ). 2 : ROR по сравнению с (RO) 2 CR 2 ; ClMe по сравнению с CCl 4 ). ССl 4 может реагировать со взрывом с Me 3 Al, но CH 2 Cl 2 реагирует очень медленно. Точно так же обычные эфиры не расщепляются Bu и 2 AlH, а кетали плавно расщепляются при 70–80 °C 53 (уравнение (30)). Из-за этих сильных эффектов заместителей, реакции метатезиса R 1 2 AlR 2 сильно ограничены в своей полезности из-за осуществимости и факторов безопасности. Тем не менее, в случае успеха, такие преобразования обеспечивают свободный доступ к углеводородам с различной функциональностью (уравнения (31) 54 и (32) 55 и Схемы 11 56 и 12). В последней реакции способ расщепления, по-видимому, связывает группу R 2 Al с более электроотрицательным фрагментом XCN. 57 58
В последней реакции способ расщепления, по-видимому, связывает группу R 2 Al с более электроотрицательным фрагментом XCN. 57 58
(29)
(30)
(31)
(32)
Схема 11.
Схема 12.
Однако наиболее распространенные и, в некоторых отношениях,
. наиболее полезный метатезис R 3 Al с протонным субстратом, ROH, R 2 NH, NCH и некоторыми углеводородами. Эти протодеалюминирования являются важными путями получения алюминийорганических алкоксидов, амидов, цианидов и ацетилидов, которые используются в качестве реагентов в селективном синтезе (уравнения (33), 59 (34), 60 (35),
0 6100055). и (36) 52 ). Впечатляющим применением такого метатезиса является применение Вудворда и его сотрудников при синтезе цефалоспорина С, посредством которого образовалось β-лактамное кольцо (схема 13). 62
62 (33)
(34)
(35)
(36)
Схема 13.
Просмотр Книга Глава объявления
. Полная глава
URL: https: //www. sciencedirect.com/science/article/pii/B9780080465197000976
Грегори Роос, Кэтрин Роос, в Organic Chemistry Concepts, 2015
2.5 Алкилгалогениды относятся к первому функциональному классу гетероатомов. Относительно высокая электроотрицательность галогенов дает сильно полярную ковалентную связь (индуктивный эффект, глава 1). Это не меняет
sp 3 Гибридное состояние или тетраэдрическая форма углерода, но это дает реактивный центр, который контролирует химический состав алкилгалогенидов. В табл. 2.6 показано наименование IUPAC алкилгалогенидов, происходящих от родительских углеводородов, с атомом галогена, рассматриваемым как заместитель.
Таблица 2.6. Избранные общие алкилгалогениды
| Формула | Общее название | Название IUPAC | B.P. (°С) |
|---|---|---|---|
| CH 3 Cl | Methyl chloride | Chloromethane | −24 |
| CH 3 Br | Methyl bromide | Bromomethane | 5 |
| CH 3 I | Methyl iodide | Iodomethane | 42 |
| CH 2 Cl 2 | Methylene chloride | Dichloromethane | 40 |
| (CH 3 ) 2 CHBr | Isopropyl bromide | 2-Bromopropane | 60 |
| (CH 3 ) 3 CCl | tert -Butyl chloride | 2-Chloro-2- метилпропан | 51 |
ИЮПАК, Международный союз теоретической и прикладной химии.
На рис. 2.7 показано, что, подобно алканам, алкилгалогениды и спирты могут быть классифицированы как 1° (первичные), 2° (вторичные) и 3° (третичные). Обратите внимание, что номинальная степень окисления углерода, связанного с галогеном, изменяется от -1 в первичной до +1 в третичной. Это изменение объясняет разницу в реакционной способности различных алкилгалогенидов.
РИСУНОК 2.7. Классификация 1°, 2° и 3° алкилгалогенидов.
Просмотр книги Глава Чита
Читать полная главаURL: https://www.sciendirect.com/science/article/pii/b9780128016902x
M. Dračínský, в годовых отчетах на годовые сообщения на годовые сообщения на годовых отчетах на годовых сообщениях на годовые сообщения на годовых отчетах на годовых сообщениях на годовые сообщения на годовых отчетах на годовых сообщениях. Связи в большинстве органических соединений описываются как ковалентные. В простейшем представлении о ковалентной связи пара электронов находится в пространстве между двумя атомами совместно. Ионная связь возникает в результате полного переноса связывающих электронов от одного атома к другому. Образовавшиеся положительно и отрицательно заряженные ионы затем электростатически притягиваются. Ионные связи редко имеют какую-то определенную направленность, потому что они возникают в результате электростатического притяжения каждого иона ко всем окружающим ионам с противоположным зарядом. При металлической связи электроны связи делокализованы по решетке атомов. В металлах каждый атом обеспечивает один или несколько электронов, которые находятся между многими атомными центрами. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/S0066410316300278 James E. House, in Inorganic Chemistry (020020 Third Edition), 0 с электронными структурой атома бора 1 S 2 2 S 2 2 P 4444 2 2 P 4444 2 2 P 44444 2 2 P 444444 . теряют три электрона с образованием соединений, содержащих B 3+ ионы. Однако для удаления трех электронов требуется более 6700 кДж моль -1 , и это настолько много, что исключает соединения, которые являются строго ионными. Полярные ковалентные связи существуют, и гибридизацию можно рассматривать как приводящую к набору sp 2 гибридных орбиталей. Должно быть ясно, что мы ожидаем, что бор образует три эквивалентные ковалентные связи с валентными углами в 120 градусов. В результате галогениды бора имеют тригонально-плоскую структуру ( D 3 h симметрия) для BF 3 . В этих молекулах атом бора имеет только шесть окружающих его электронов, поэтому он легко взаимодействует с частицами, которые могут действовать как доноры электронных пар. Например, когда F — реагирует с BF 3 , продукт — BF 4 — , в котором SP 3 Гибриды сформированы, так что такие виды являются три вида ( 3 . ). В большинстве случаев молекулы, содержащие бор, проявляют один из этих типов связи с бором. Гидриды бора представляют собой особую ситуацию, которая будет описана ниже. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B9780128143698000133 James E. House, Kathleen A. Chemscriptic Inorganic Третье издание), 2016 Электронная структура атома бора составляет 1 S 2 2 S 2 2 P44444 2 2 P44444 2 2 P44449. 2 2 P44444 2.1 «Сильные» связи
 Формально каждый атом обеспечивает связь одним электроном, и эти отрицательно заряженные электроны одновременно притягиваются к положительным зарядам обоих ядер. Это преодолевает отталкивание между двумя ядрами. В полярной ковалентной связи часть электронной плотности связывающей электронной пары находится ближе к одному из связанных ядер, создавая частично положительные и отрицательные атомные центры с величиной переноса заряда, зависящей от относительных электроотрицательностей двух атомов.
Формально каждый атом обеспечивает связь одним электроном, и эти отрицательно заряженные электроны одновременно притягиваются к положительным зарядам обоих ядер. Это преодолевает отталкивание между двумя ядрами. В полярной ковалентной связи часть электронной плотности связывающей электронной пары находится ближе к одному из связанных ядер, создавая частично положительные и отрицательные атомные центры с величиной переноса заряда, зависящей от относительных электроотрицательностей двух атомов. Свободное движение делокализованных электронов приводит к таким важным свойствам металлов, как электрическая и теплопроводность.
Свободное движение делокализованных электронов приводит к таким важным свойствам металлов, как электрическая и теплопроводность. 13.2.2 Связывание в соединениях бора
 Однако бор легко сгорает с образованием B 2 O 3 , стабильного оксида с теплотой образования -1264 кДж моль -1 .
Однако бор легко сгорает с образованием B 2 O 3 , стабильного оксида с теплотой образования -1264 кДж моль -1 .
9,2 Связывание в соединениях бора
 Происходит гибридизация атомных орбиталей, и в случае бора гибридизацию можно представить следующим образом. Продвижение 2 s электрона на один из вакантных 2 p орбитали могут быть получены с увеличением энергии с последующей гибридизацией орбиталей для получения набора sp 2 гибридных связывающих орбиталей.
Происходит гибридизация атомных орбиталей, и в случае бора гибридизацию можно представить следующим образом. Продвижение 2 s электрона на один из вакантных 2 p орбитали могут быть получены с увеличением энергии с последующей гибридизацией орбиталей для получения набора sp 2 гибридных связывающих орбиталей.
Энергия, необходимая для перевода электрона 2 s на уровень 2 p , более чем компенсируется дополнительной энергией, высвобождаемой при образовании трех эквивалентных связей.
На приведенном выше рисунке мы ожидаем, что бор образует три ковалентные связи, которые равны по энергии и направлены на 120° друг от друга. Соответственно, тригалогениды бора, BX 3 , имеют следующую тригональную плоскую структуру ( D 3 h симметрия).
На самом деле все соединения, содержащие бор, связанный с тремя другими атомами, имеют такую конфигурацию.


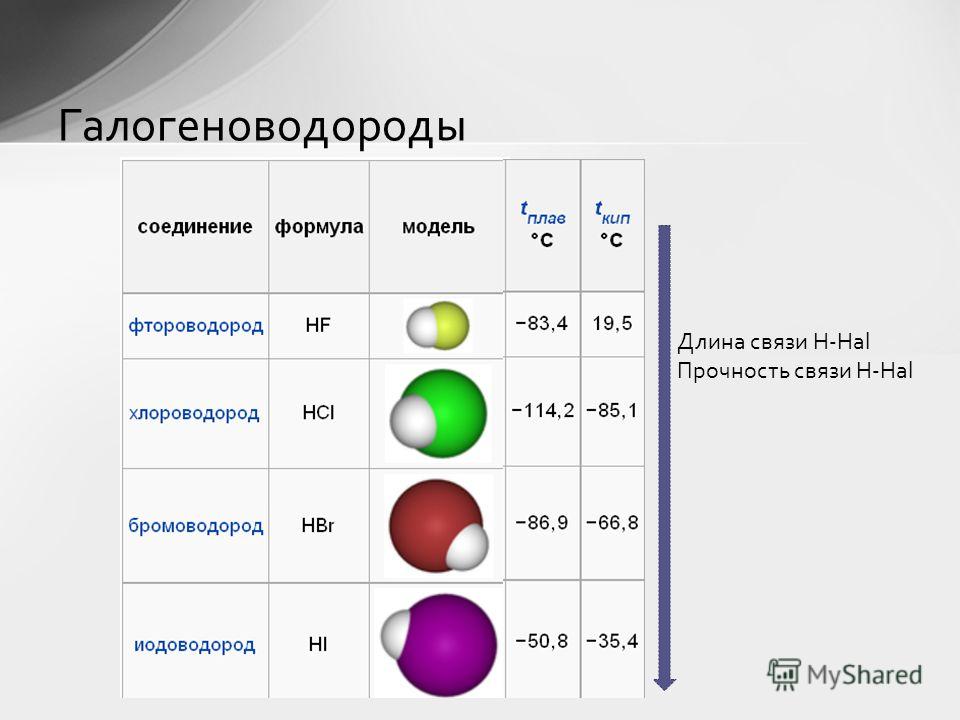 Вещество с ковалентной неполярной связью имеет формулу
Вещество с ковалентной неполярной связью имеет формулу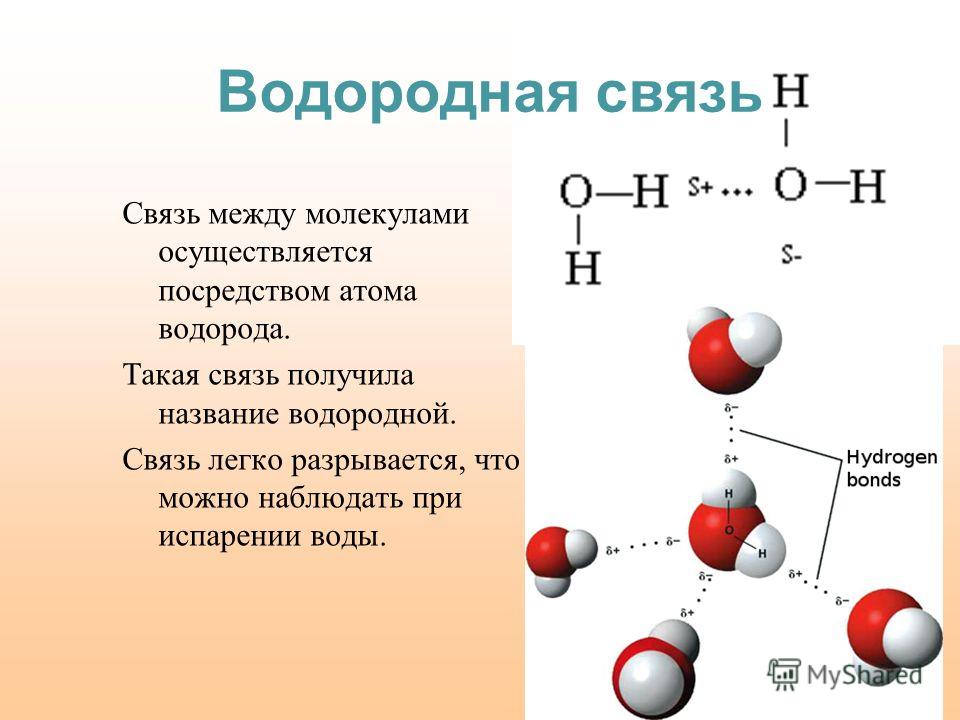 Тремя общими электронными парами образована ковалентная связь в молекуле
Тремя общими электронными парами образована ковалентная связь в молекуле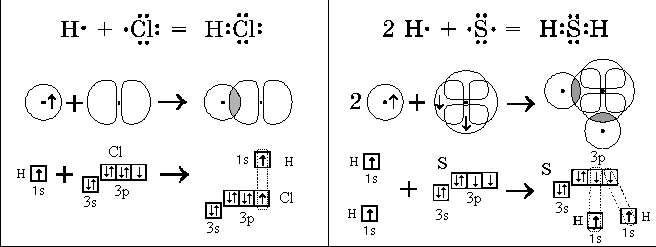 Наименее прочная химическая связь в молекуле
Наименее прочная химическая связь в молекуле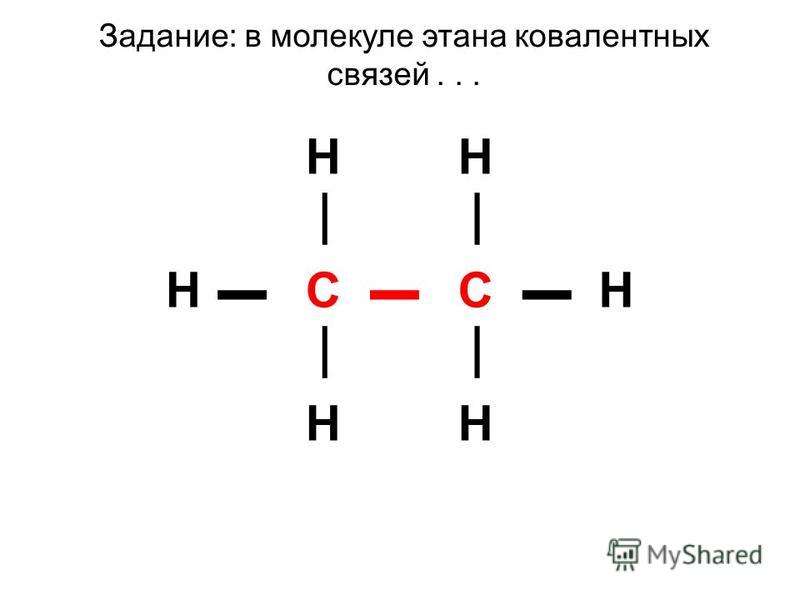 Ковалентные связи имеет каждое из веществ, указанных в ряду:
Ковалентные связи имеет каждое из веществ, указанных в ряду: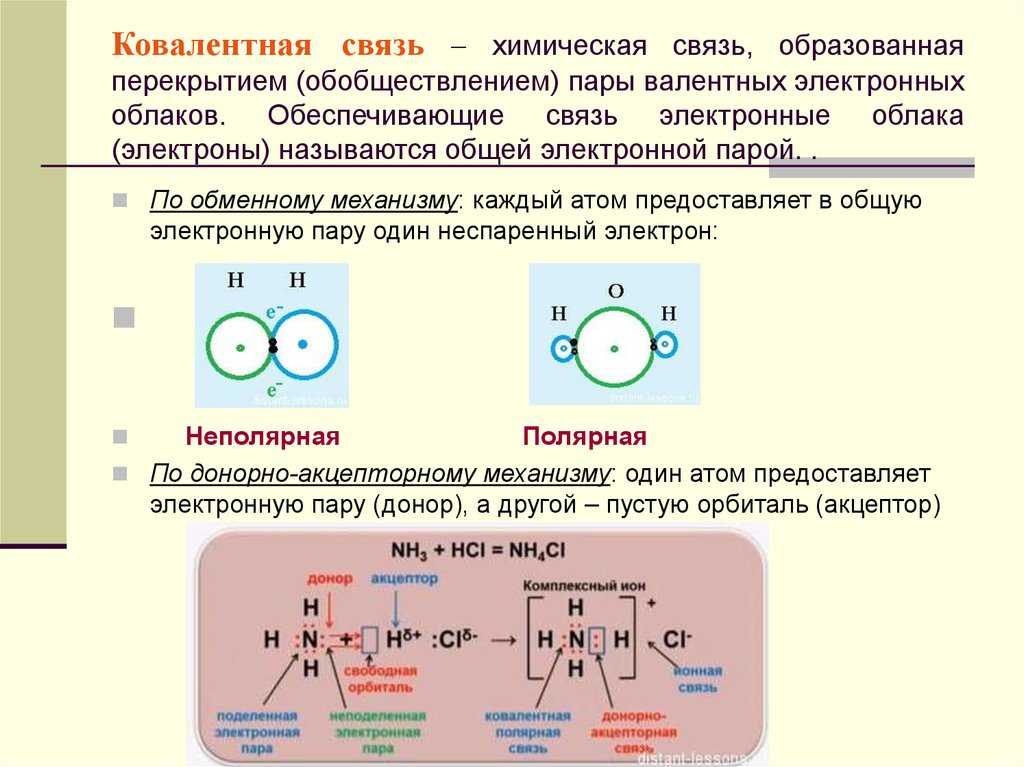 Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно При этом взаимодействии образуются более сложные частицы.
При этом взаимодействии образуются более сложные частицы. Между ними и возникает притяжение.
Между ними и возникает притяжение.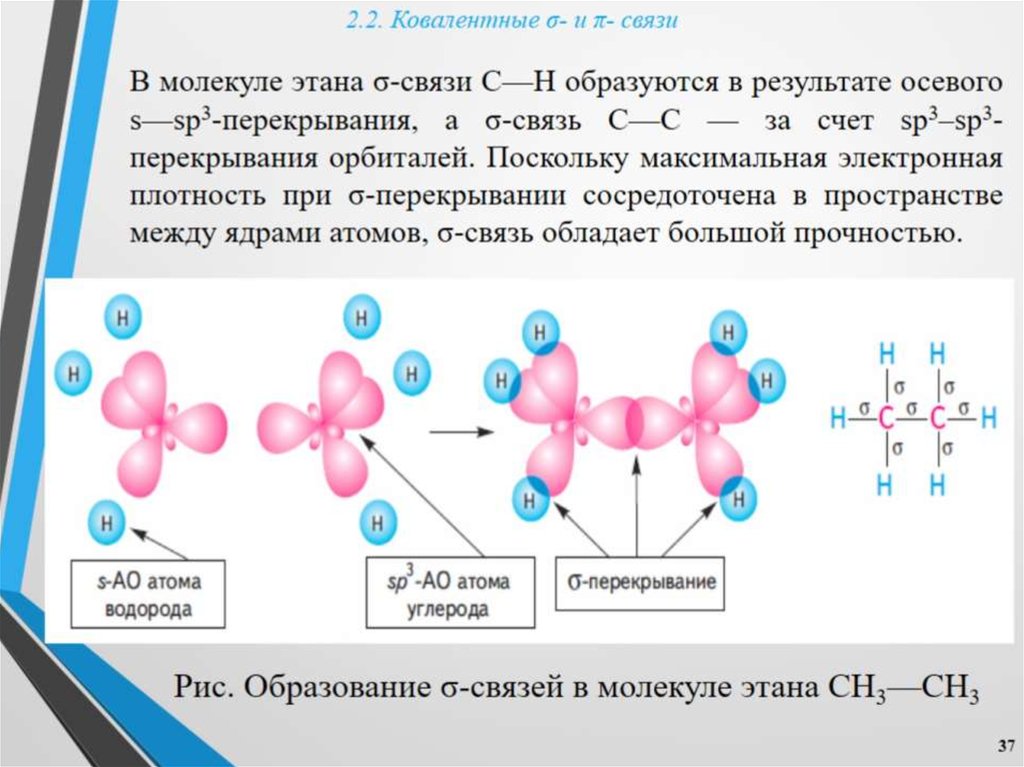
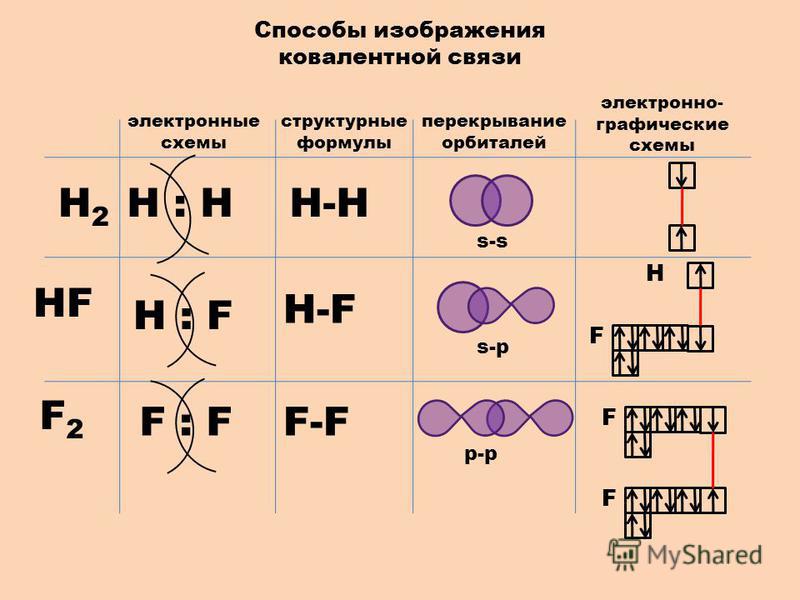
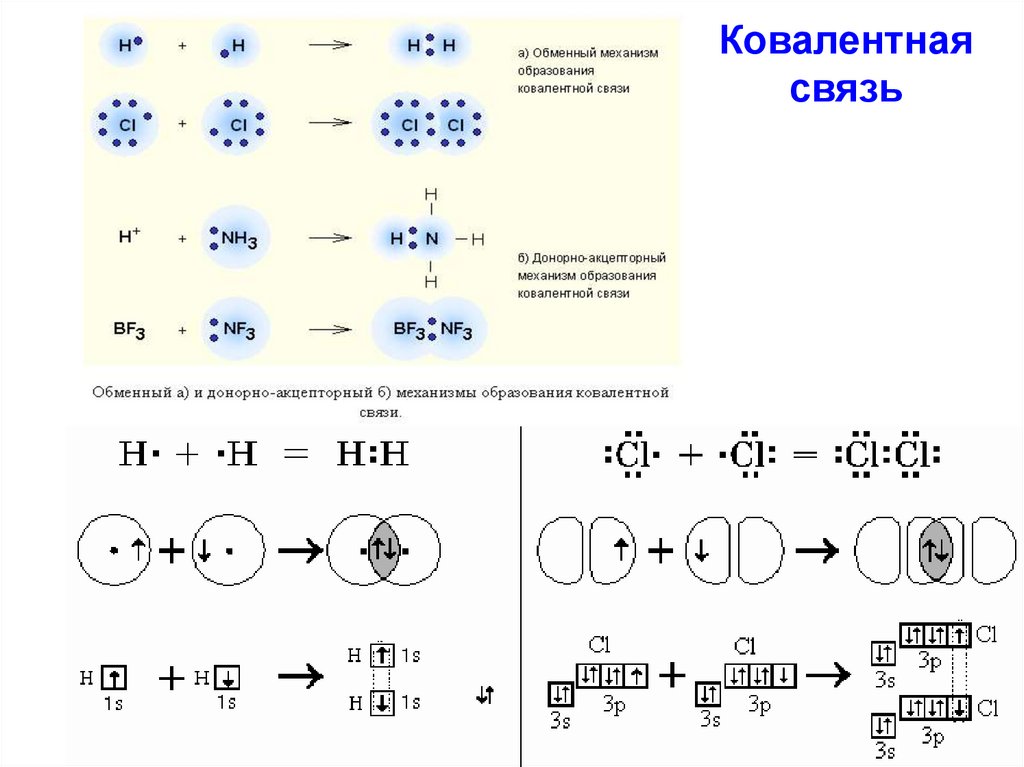
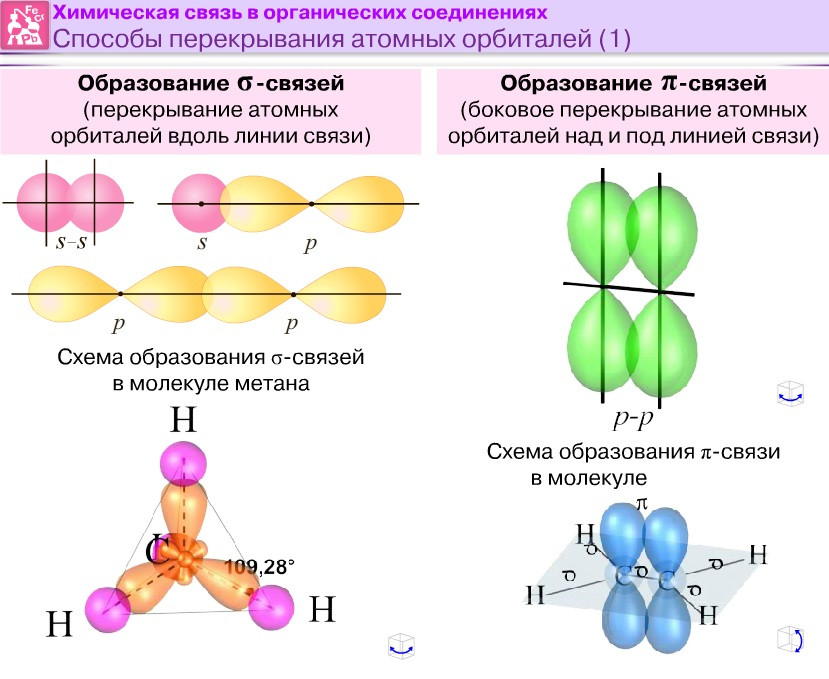
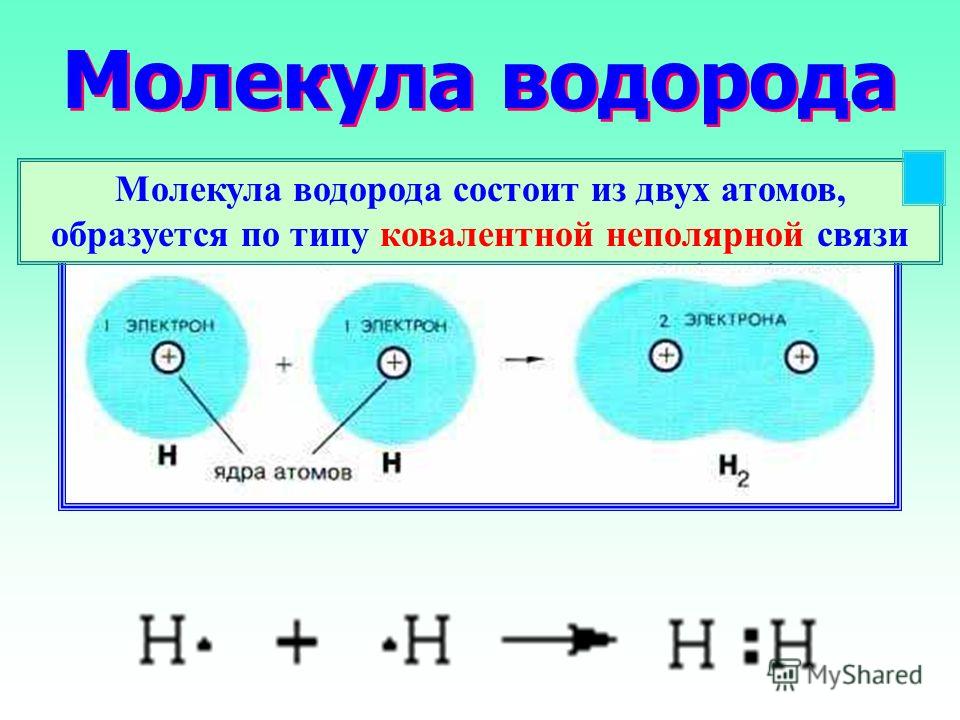 Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O. Это
движущая сила образования химической связи.
Это
движущая сила образования химической связи.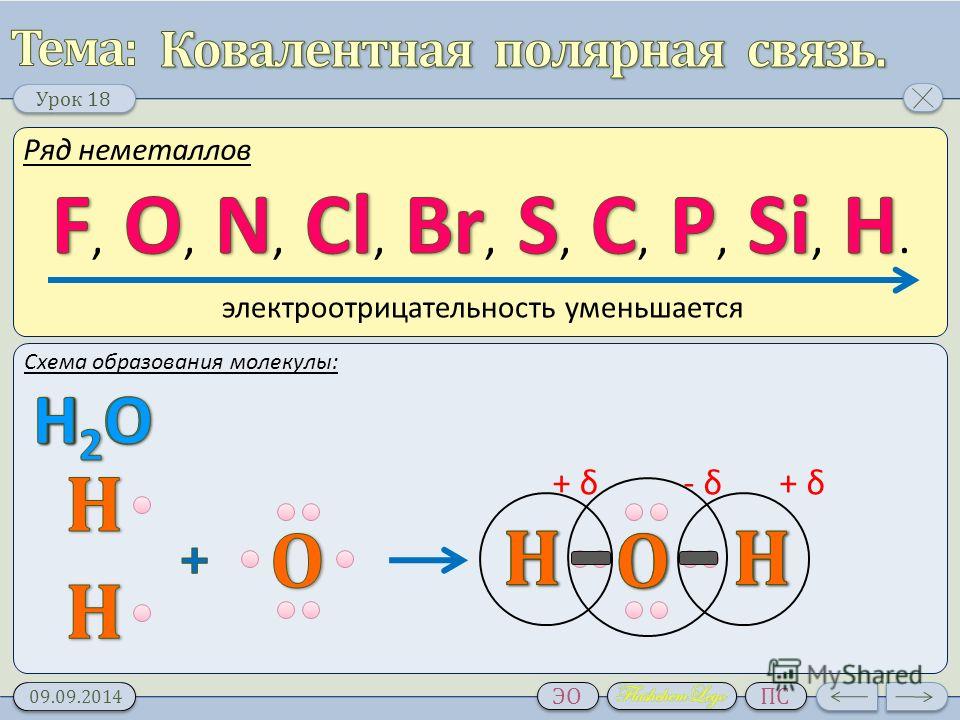
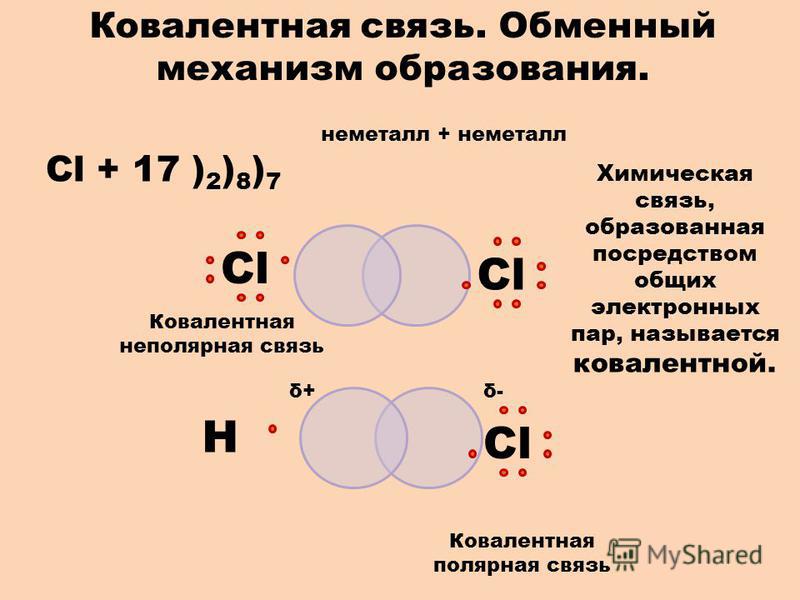
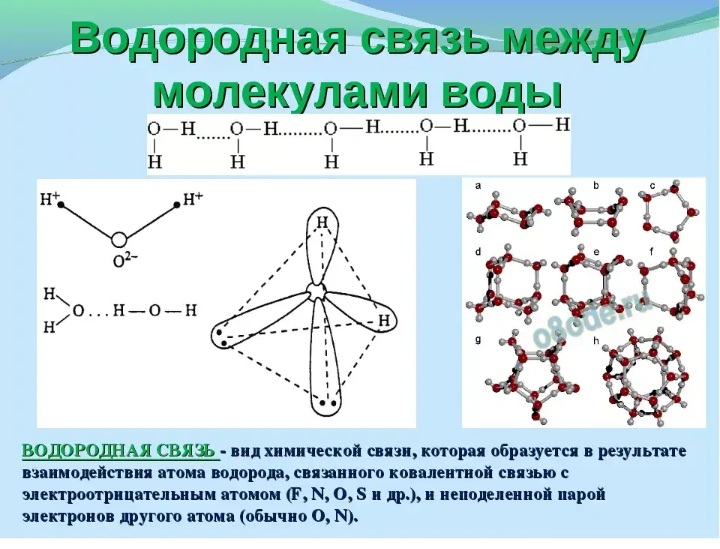 Связь осуществляют
свободно перемещающиеся в межузловом пространстве электроны.
Связь осуществляют
свободно перемещающиеся в межузловом пространстве электроны.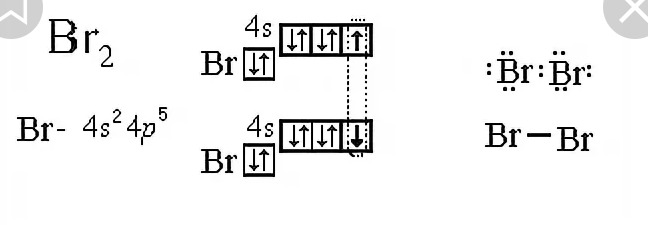
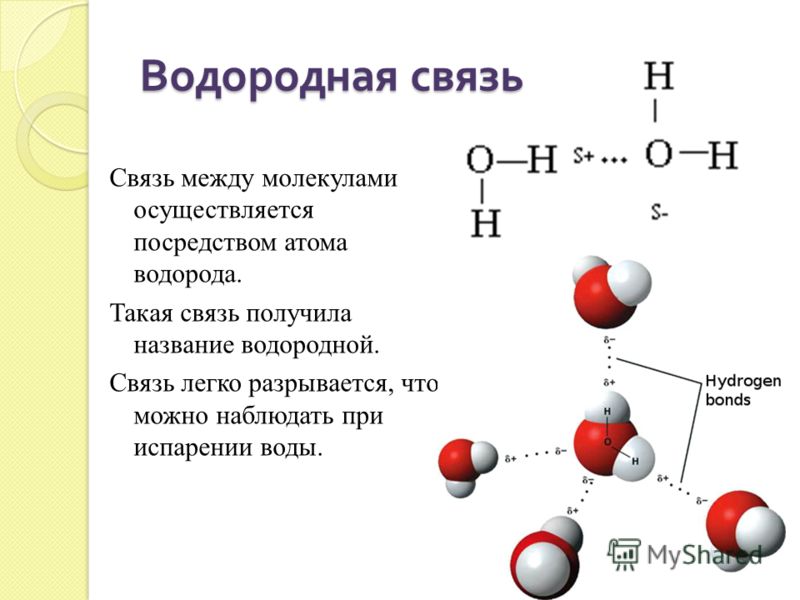 Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.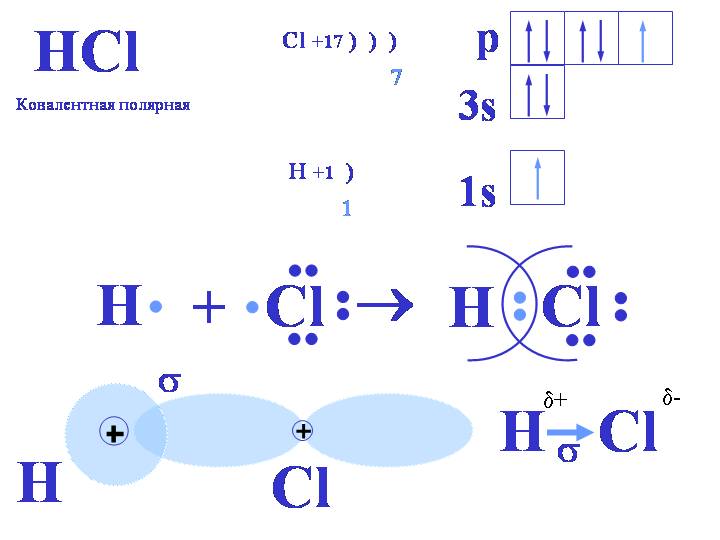 Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.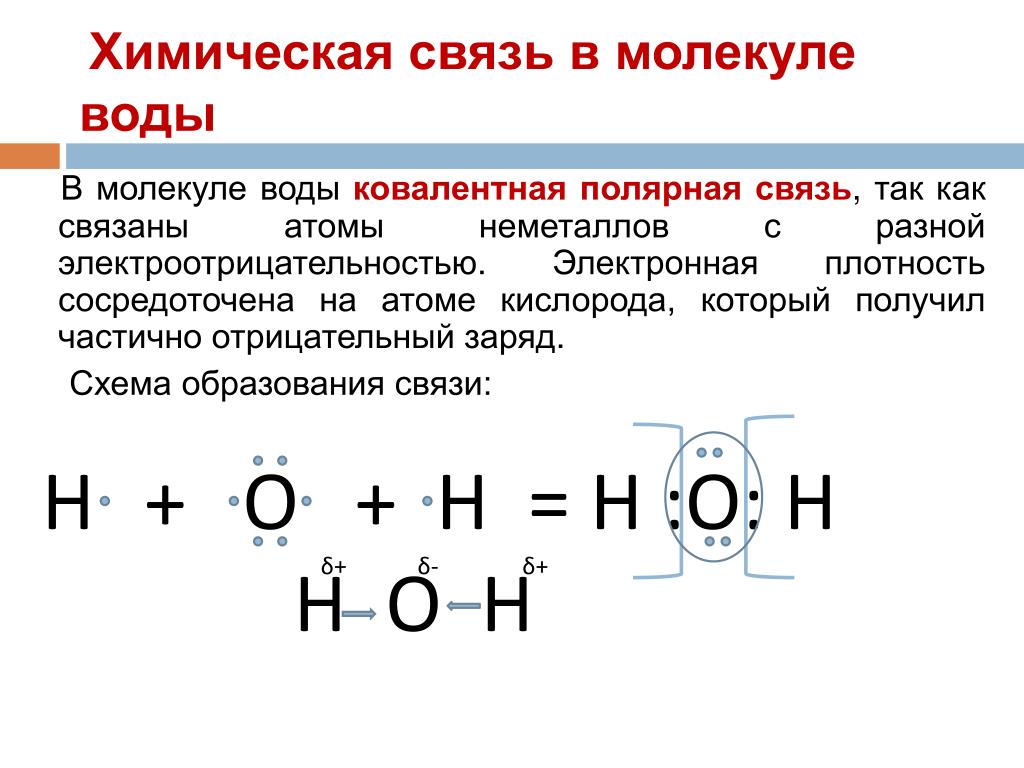
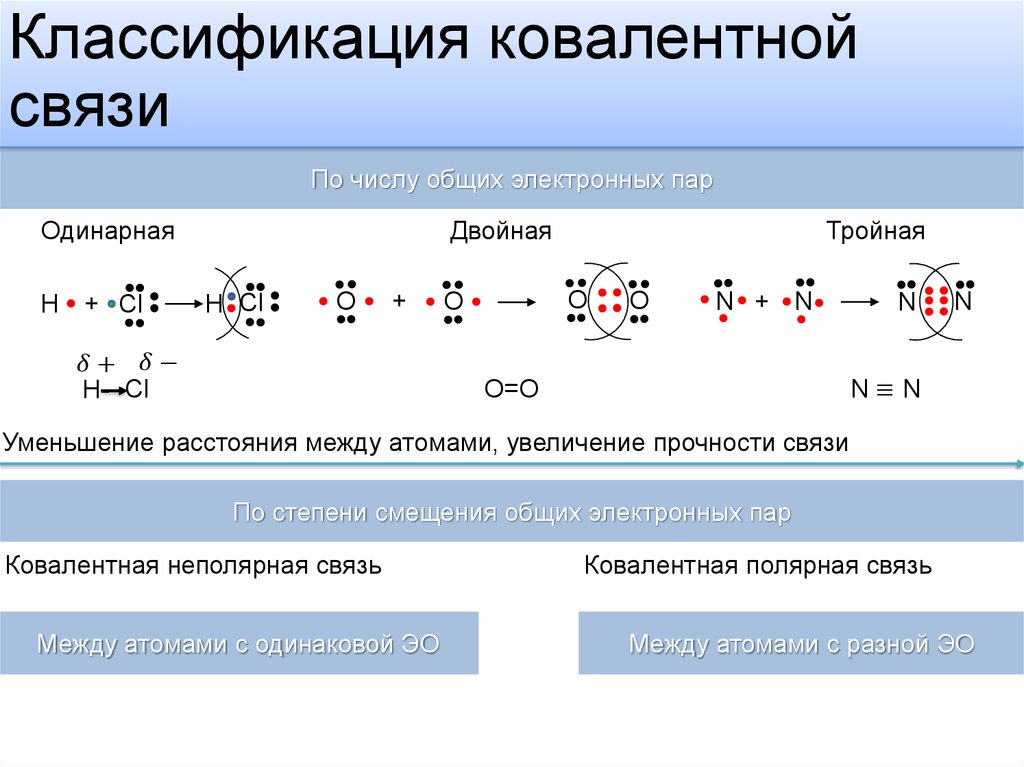
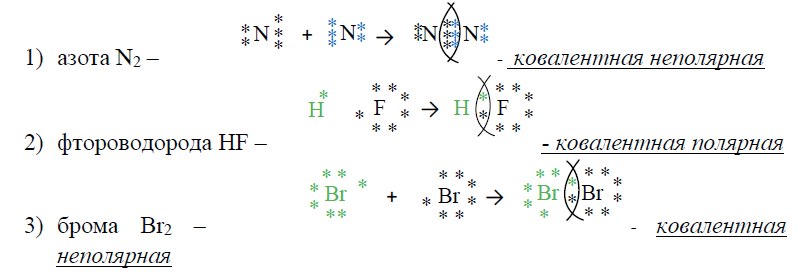 д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;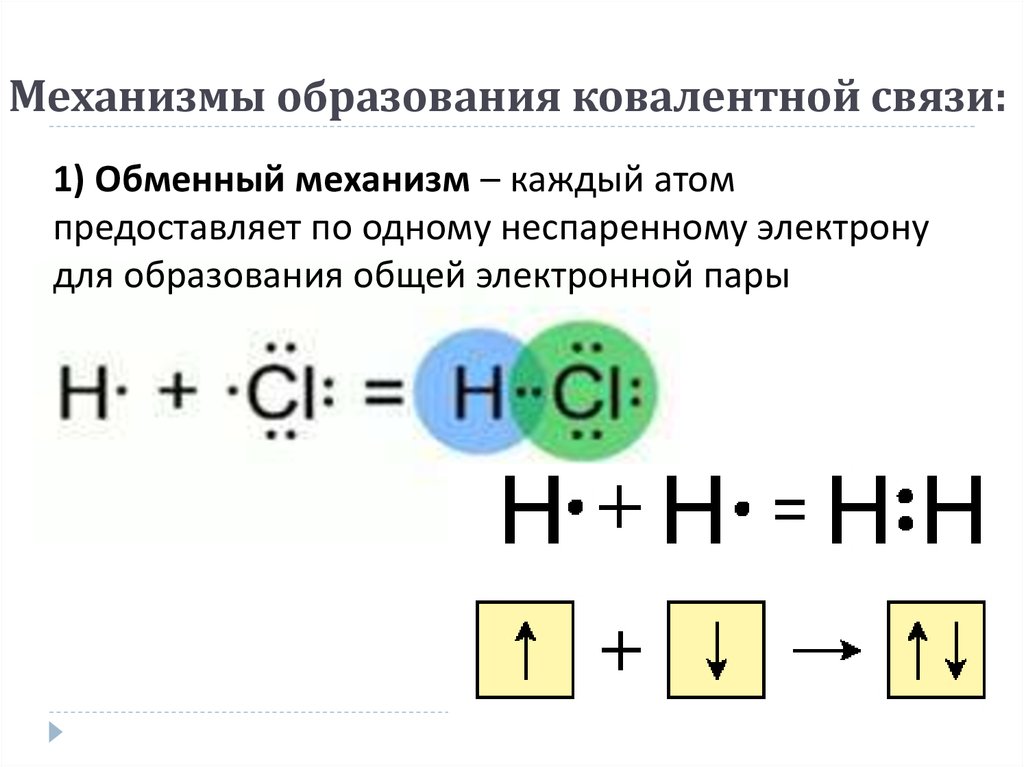 +$.
+$.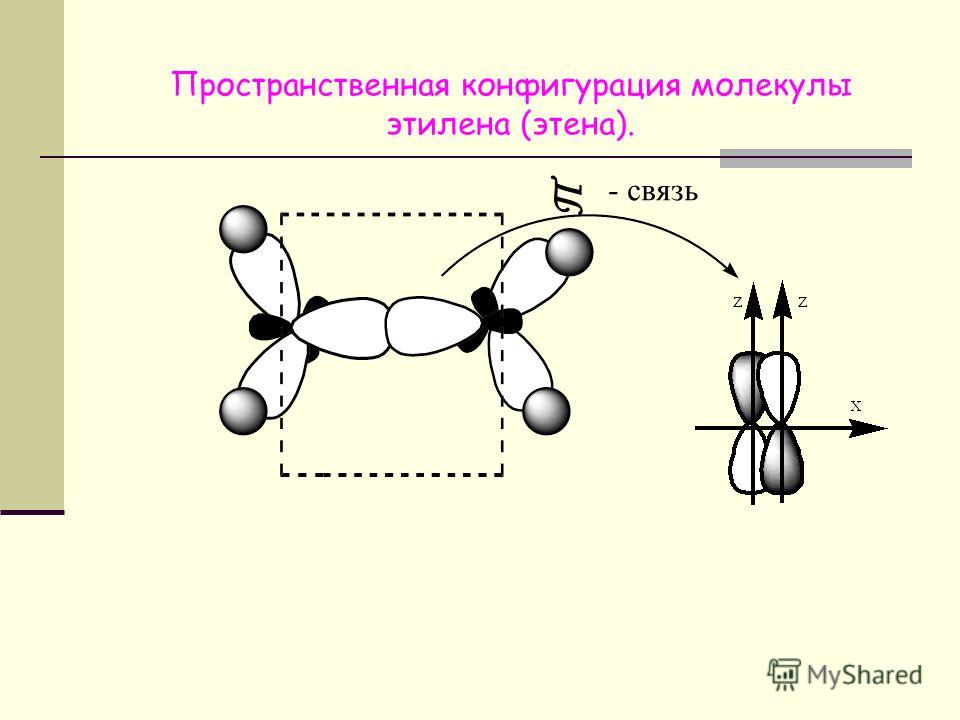
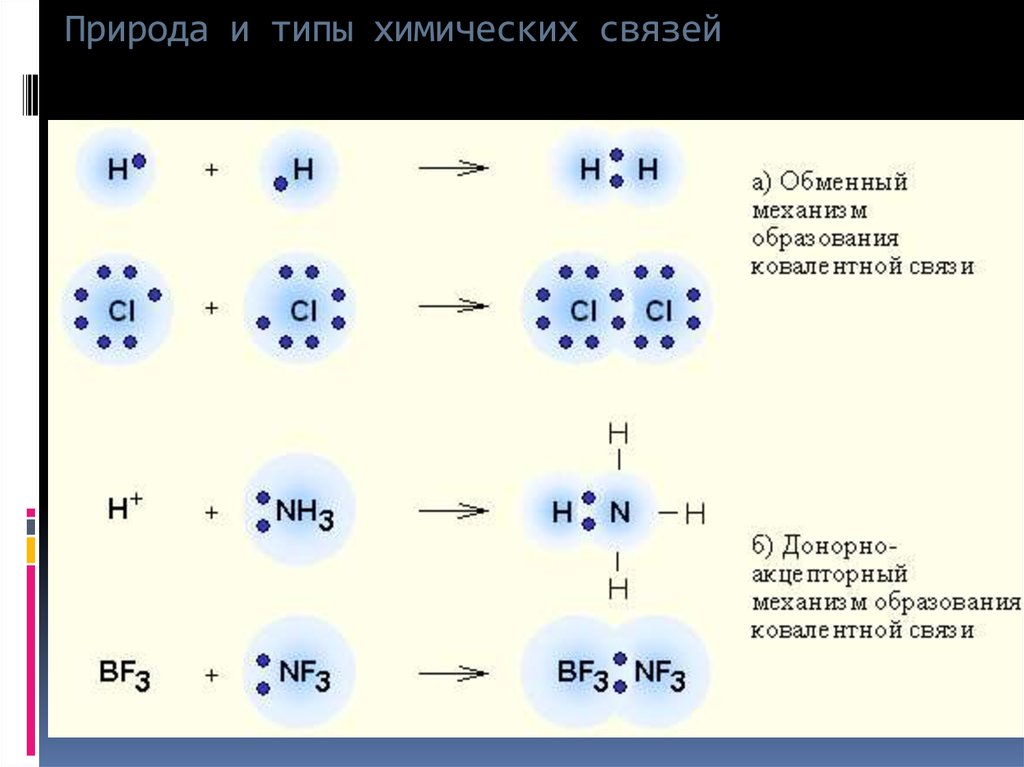 074, 0.198$ и $0.109$ нм, а энергии связи соответственно равны $436, 242$ и $946$ кДж/моль.
074, 0.198$ и $0.109$ нм, а энергии связи соответственно равны $436, 242$ и $946$ кДж/моль.