Презентация генная и клеточная инженерия: Презентация на тему «Генная и клеточная инженерия»
Генная и клеточная инженерия — презентация онлайн
Похожие презентации:
Эндокринная система
Анатомо — физиологические особенности сердечно — сосудистой системы детей
Хронический панкреатит
Топографическая анатомия верхних конечностей
Анатомия и физиология сердца
Мышцы головы и шеи
Эхинококкоз человека
Черепно-мозговые нервы
Анатомия и физиология печени
Топографическая анатомия и оперативная хирургия таза и промежности
Генная инженерия – это искусственный
перенос нужных генов от одного вида
живых организмов
(бактерий, животных, растений) в
другой вид, часто очень отдаленный по
происхождению.
Трансгенные организмы — животные,
растения, микроорганизмы, вирусы,
геном которых изменен.
4. Генная инженерия в медицине.
• Получение человеческого инсулинав промышленных масштабах;
• Разработка интерферона.
• Около 200 новых
диагностических препаратов (не
белковых, а генных) уже введены в
медицинскую практику,
• Более 100 генно-инженерных
лекарственных веществ
находится на стадии
клинического изучения.

5. Клеточная инженерия
6. Клеточная инженерия
• Большой вклад в биологию клетки вносят методыклеточной инженерии.
Клеточная инженерия – область биотехнологии,
основанная на культивировании клеток и тканей на
питательных средах.
Клеточная инженерия тесно
связанна с генной инженерией.
7. Культура тканей
• Выращивание из отдельных клеток культур тканей(например, женьшеня), которые продуцируют
лекарственные вещества, как и целое растение.
8. Гибридизация клеток различных видов растений
• Сливаются клетки растений, относящихся кразным видам, например, картофеля и томата.
Это путь к созданию новых видов растений.
9. Создание гибридом
• Гибридизация животных клеток.• Гибридомы, полученные в результате объединения
лимфоцитов и раковых клеток, вырабатывают
антитела, как лимфоциты, и бессмертны, как раковые
клетки. Интерферон, который получают с помощью
гибридом, применяется для лечения заболеваний.

10. Клонирование
11. Что такое клонирование?
• КЛОНИРОВАНИЕ — воспроизведение генетическиоднородных организмов путём бесполого размножения.
При клонировании исходный организм служит
родоначальником клона – ряда организмов,
повторяющих из поколения в поколение и генотип, и
клонирования заключается в повторении одной и той же
генетической информации.
1)
2)
3)
4)
Яйцеклетка
Клетка тела
Ядра клеток удаляются
Ядро клетки тела
внедряется в яйцеклетку
5) Клонированная клетка
становится эмбрионом
6) Стволовые клетки,
полученные из эмбрионов.
Этично ли проводить
генетические
эксперименты на
человеке?
Этичны ли эксперименты над
животными?
Домашнее задание § 19,
небольшое рассуждение на
тему:
«Этичность применения
генных и клеточных
технологий».
English Русский Правила
Генная и клеточная инженерия презентация, доклад
Тема урока:
« Генная и клеточная инженерия»
Генная
инженерия
Генная инженерия – это искусственный перенос нужных генов от одного вида живых организмов
(бактерий, животных, растений) в другой вид, часто очень отдаленный по происхождению.
Трансгенные организмы — животные, растения, микроорганизмы, вирусы, геном которых изменен.
Генная инженерия в медицине.
Получение человеческого инсулина в промышленных масштабах;
Разработка интерферона.
Около 200 новых диагностических препаратов (не белковых, а генных) уже введены в медицинскую практику,
Более 100 генно-инженерных лекарственных веществ находится на стадии клинического изучения.
Клеточная инженерия
Клеточная инженерия
Большой вклад в биологию клетки вносят методы клеточной инженерии.
Клеточная инженерия – область биотехнологии, основанная на культивировании клеток и тканей на питательных средах.
Клеточная инженерия тесно связанна с генной инженерией.
Культура тканей
Выращивание из отдельных клеток культур тканей (например, женьшеня), которые продуцируют лекарственные вещества, как и целое растение.
Гибридизация клеток различных видов растений
Сливаются клетки растений, относящихся к разным видам, например, картофеля и томата. Это путь к созданию новых видов растений.
Создание гибридом
Гибридизация животных клеток.
Клонирование
Что такое клонирование?
КЛОНИРОВАНИЕ — воспроизведение генетически однородных организмов путём бесполого размножения. При клонировании исходный организм служит родоначальником клона – ряда организмов, повторяющих из поколения в поколение и генотип, и все признаки родоначальника. Таким образом, сущность клонирования заключается в повторении одной и той же генетической информации.
Таким образом, сущность клонирования заключается в повторении одной и той же генетической информации.
Яйцеклетка
Клетка тела
Ядра клеток удаляются
Ядро клетки тела внедряется в яйцеклетку
Стволовые клетки, полученные из эмбрионов.
Подумаем !
Этично ли проводить генетические эксперименты на человеке?
Подумаем !
Этичны ли эксперименты над животными?
«Этичность применения генных и клеточных технологий».
Ваше мнение?
Домашнее задание § 19, небольшое рассуждение на тему:
Скачать презентацию
Генетическая модификация стволовых клеток для трансплантации
1. Balsam LB, Wagers AJ, Christensen JL, Kofidis T, Weissman IL, Robbins RC. Кроветворные стволовые клетки принимают зрелые гемопоэтические судьбы в ишемизированном миокарде. Природа. 2004; 428: 668–673. [PubMed] [Google Scholar]
Balsam LB, Wagers AJ, Christensen JL, Kofidis T, Weissman IL, Robbins RC. Кроветворные стволовые клетки принимают зрелые гемопоэтические судьбы в ишемизированном миокарде. Природа. 2004; 428: 668–673. [PubMed] [Google Scholar]
2. Тан Ю.Л., Шен Л., Цянь К., Филлипс М.И. Новая двухэтапная процедура для клонального размножения сердечных клеток Sca-1+. Biochem Biophys Res Commun. 2007; 359: 877–883. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Мессина Э., Де Анджелис Л., Фрати Г., Морроне С., Чименти С., Фиодалисо Ф., Салио М., Батталья М., Латронико М.В., Колетта М., Виварелли Э., Фрати Л., Коссу Г., Джакомелло А. Изоляция и расширение взрослых сердечных стволовых клеток из человеческого и мышиного сердца. Сир рез. 2004; 95: 852–854. [PubMed] [Google Scholar]
4. Моретти А., Кэрон Л., Накано А., Лам Дж. Т., Бернсхаузен А., Чен И., Кьянг Ю., Бу Л., Сасаки М., Мартин-Пуиг С., Сан И., Эванс С. М., Лаугвитц КЛ, Цзянь КР. Мультипотентные эмбриональные клетки-предшественники is1+ приводят к диверсификации кардиальных, гладкомышечных и эндотелиальных клеток. Клетка. 2006; 127:1151–1165. [PubMed] [Академия Google]
Клетка. 2006; 127:1151–1165. [PubMed] [Академия Google]
5. Murry CE, Soonpaa MH, Reinecke H, Nakajima H, Nakajima HO, Rubart M, Pasumarthi KB, Virag JI, Bartelmez SH, Poppa V, Bradford G, Dowell JD, Williams DA, Field LJ. Кроветворные стволовые клетки не трансдифференцируются в сердечные миоциты при инфаркте миокарда. Природа. 2004; 428: 664–668. [PubMed] [Google Scholar]
6. Ван И, О’Мэлли Б.В., младший, Цай С.Ю., О’Мэлли Б.В. Регуляторная система для использования в переносе генов. Proc Natl Acad Sci USA. 1994; 91:8180–8184. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Тан Ю., Джексон М., Цянь К., Филлипс М.И. Индуцируемая гипоксией двойная плазмидная система для генной терапии ишемии миокарда. Гипертония. 2002; 39: 695–698. [PubMed] [Google Scholar]
8. Филлипс М.И., Танг Ю., Шмидт-Отт К., Цянь К., Кагияма С. Бдительный вектор: специфический для сердца промотор в аденоассоциированном вирусном векторе для кардиозащиты. Гипертония. 2002; 39: 651–655. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
9. Смитис О. Много мелочей: взгляд одного генетика на сложные болезни. Нат Рев Жене. 2005;6:419–425. [PubMed] [Google Scholar]
10. Gu H, Marth JD, Orban PC, Mossmann H, Rajewsky K. Делеция сегмента β-гена ДНК-полимеразы в Т-клетках с использованием нацеливания на тип клеток. Наука. 1994; 265:103–106. [PubMed] [Google Scholar]
11. Сакаи К., Агасандиан К., Моримото С., Синная П., Касселл М.Д., Дэвиссон Р.Л., Зигмунд К.Д. Локальная продукция ангиотензина II в подфорникальном органе вызывает повышенное питье. Джей Клин Инвест. 2007; 117:1088–1095. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Sinnayah P, Lindley TE, Staber PD, Davidson BL, Cassell MD, Davisson RL. Направленная вирусная доставка рекомбиназы Cre вызывает условную делецию гена в сердечно-сосудистых цепях мозга мыши. Физиол Геномика. 2004; 18:25–32. [PubMed] [Google Scholar]
13. Филлипс М.И., Самнерс С. Ангиотензин ll в физиологии центральной нервной системы. Регул Пепт. 1998; 78:1–11. [PubMed] [Google Scholar]
Регул Пепт. 1998; 78:1–11. [PubMed] [Google Scholar]
14. Phillips MI. Раствор Cre-loxP для определения ренин-ангиотензиновой системы головного мозга. Фокус на «Целенаправленная вирусная доставка рекомбиназы Cre вызывает условную делецию гена в сердечно-сосудистых цепях мозга мыши» Физиологическая геномика. 2004; 18:1–3. [PubMed] [Академия Google]
15. Zamecnik PC, Stephenson ML. Ингибирование репликации вируса саркомы Рауса и трансформации клеток специфическим олигодезоксинуклеотидом. Proc Nat Acad Sci USA. 1978; 75: 280–284. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Wahlestedt C, Pich EM, Koob GF, Yee F, Heilig M. Модуляция тревожных и нейропептидных рецепторов Y-Y1 антисмысловыми олигодезоксинуклеотидами. Наука. 1993; 259: 528–531. [PubMed] [Google Scholar]
17. Gyurko R, Wielbo D, Phillips MI. Антисмысловое ингибирование мРНК рецептора АТ1 и мРНК ангиотензиногена в головном мозге крыс со спонтанной гипертензией снижает гипертензию нейрогенного происхождения. Регул Пепт. 1993;49:167–174. [PubMed] [Google Scholar]
Регул Пепт. 1993;49:167–174. [PubMed] [Google Scholar]
18. Kimura B, Mohuczy D, Tang X, Phillips MI. Ослабление гипертензии и гипертрофии сердца аденоассоциированным вирусом, доставляющим антисмысловой ангиотензиноген. Гипертония. 2001; 37: 376–380. [PubMed] [Google Scholar]
19. Crooke ST. Прогресс в антисмысловой технологии. Анну Рев Мед. 2004; 55: 61–95. [PubMed] [Google Scholar]
20. Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Мощная и специфическая генетическая интерференция двухцепочечной РНК у Caenorhabditis elegans. Природа. 1998;391:806–811. [PubMed] [Google Scholar]
21. Арнольд А.С., Тан Ю.Л., Цянь К., Шен Л., Валенсия В., Филлипс М.И., Чжан Ю.К. Специфическое подавление бета1-адренергических рецепторов с помощью малой интерферирующей РНК снижает высокое кровяное давление и улучшает сердечную функцию при ишемии миокарда. Дж Гипертензия. 2007; 25: 197–205. [PubMed] [Google Scholar]
22. Lee RC, Feinbaum RL, Ambros V. Гетерохронный ген lin-4 C. elegans кодирует малые РНК с антисмысловой комплементарностью lin-14. Клетка. 1993; 75: 843–854. [PubMed] [Академия Google]
elegans кодирует малые РНК с антисмысловой комплементарностью lin-14. Клетка. 1993; 75: 843–854. [PubMed] [Академия Google]
23. Эскела-Кершер А., Слэк Ф.Дж. Онкомиры — микроРНК, играющие роль в развитии рака. Нат Рев Рак. 2006; 6: 259–269. [PubMed] [Google Scholar]
24. Lagos-Quintana M, Rauhut R, Yalcin A, Meyer J, Lendeckel W, Tuschi T. Идентификация тканеспецифических микроРНК мыши. Карр Биол. 2002; 12: 735–739. [PubMed] [Google Scholar]
25. Kumar MS, Lu J, Mercer KL, Golub TR, Jacks T. Нарушение процессинга микроРНК усиливает клеточную трансформацию и онкогенез. Нат Жене. 2007;39: 673–677. [PubMed] [Google Scholar]
26. Хендерсон С.А., Спенсер М., Сен А., Кумар С., Сиддики М.А., Чиен К.Р. Структура, организация и экспрессия гена легкой цепи сердечного миозина-2 крысы. Идентификация фрагмента из 250 пар оснований, который обеспечивает специфичную для сердца экспрессию. Дж. Биол. Хим. 1989; 264:18142–18148. [PubMed] [Google Scholar]
27. Rincón-Arano H, Valadez-Graham V, Guerrero G, Escamilla-Del-Arenal M, Recillas-Targa F. Взаимодействие YY1 и GATA-1 модулирует 3′-стороннюю альфа-группу цыпленка. -глобинэнхансерная активность. Дж Мол Биол. 2005;349: 961–975. [PubMed] [Google Scholar]
Взаимодействие YY1 и GATA-1 модулирует 3′-стороннюю альфа-группу цыпленка. -глобинэнхансерная активность. Дж Мол Биол. 2005;349: 961–975. [PubMed] [Google Scholar]
28. Госсен М., Фрейндлиб С., Бендер Г., Мюллер Г., Хиллен В., Бужар Х. Активация транскрипции тетрациклинами в клетках млекопитающих. Наука. 1995; 268:1766–1769. [PubMed] [Google Scholar]
29. No D, Yao TP, Evans RM. Индуцируемая экдизоном экспрессия генов в клетках млекопитающих и трансгенных мышах. Proc Natl Acad Sci USA. 1996;93:3346–3351. [Статья бесплатно PMC] [PubMed] [Google Scholar]
30. Поллок Р., Исснер Р., Золлер К., Натесан С., Ривера В.М., Клаксон Т. Доставка строго регулируемой димеризатором системы экспрессии генов в одном ретровирусном векторе. Proc Natl Acad Sci USA. 2000;97:13221–13226. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Тан Ю., Шмитт-Отт К., Цянь К., Кагияма С., Филлипс М.И. Бдительные векторы: аденоассоциированный вирус с биосенсором для включения амплифицированных терапевтических генов в определенных тканях при опасных для жизни заболеваниях. Методы. 2002; 28: 259–266. [PubMed] [Google Scholar]
Методы. 2002; 28: 259–266. [PubMed] [Google Scholar]
32. Семенца Г.Л. O2-регулируемая экспрессия генов: транскрипционный контроль кардиореспираторной физиологии с помощью HIF-1. J Appl Physiol. 2004; 96: 1173–1177. [PubMed] [Академия Google]
33. Тан Ю.Л., Тан Ю., Чжан Ю.С., Агарвал А., Касахара Х., Цянь К., Шен Л., Филлипс М.И. Индуцируемая гипоксией бдительная векторная система для активации терапевтических генов при ишемии. Джин Тер. 2005; 12:1163–1170. [PubMed] [Google Scholar]
34. Zhang M, Methot D, Poppa V, Fujio Y, Walsh K, Murry CE. Трансплантация кардиомиоцитов для восстановления сердца: гибель клеток трансплантата и стратегии борьбы с гибелью. Дж Мол Селл Кардиол. 2001; 33: 907–921. [PubMed] [Google Scholar]
35. Ниагара М.И., Хайдер Х.К., Цзян С., Ашраф М. Фармакологически прекондиционированные скелетные миобласты устойчивы к окислительному стрессу и способствуют ангиомиогенезу за счет высвобождения паракринных факторов в инфарктном сердце. Цирк Рез. 2007; 100: 545–555. [PubMed] [Академия Google]
2007; 100: 545–555. [PubMed] [Академия Google]
36. Suzuki K, Smolenski RT, Jayakumar J, Murtuza B, Brand NJ, Yacoub MH. Лечение тепловым шоком повышает выживаемость клеток трансплантата при трансплантации скелетных миобластов в сердце. Тираж. 2000;102:III216–III221. [PubMed] [Google Scholar]
37. Datta SR, Brunet A, Greenberg ME. Клеточное выживание: пьеса в трех актах. Гены Дев. 1999;13:2905–2927. [PubMed] [Google Scholar]
38. Mangi AA, Noiseux N, Kong D, He H, Rezvani M, Ingwall JS, Dzau VJ. Мезенхимальные стволовые клетки, модифицированные Akt, предотвращают ремоделирование и восстанавливают работоспособность перенесших инфаркт сердец. Нат Мед. 2003;9: 1195–1201. [PubMed] [Google Scholar]
39. Meuillet EJ, Mahadevan D, Vankayalapati H, Berggren M, Williams R, Coon A, Kozikowski AP, Powis G. Специфическое ингибирование домена гомологии плекстрина Akt1 с помощью D-3-дезокси- аналоги фосфатидил-мио-инозитола. Мол Рак Тер. 2003; 2: 389–399. [PubMed] [Google Scholar]
40. Оттербейн Л.Е., Чой А.М. Гемоксигеназа: цвета защиты от клеточного стресса. Am J Physiol Lung Cell Mol Physiol. 2000; 279:L1029–L1037. [PubMed] [Академия Google]
Оттербейн Л.Е., Чой А.М. Гемоксигеназа: цвета защиты от клеточного стресса. Am J Physiol Lung Cell Mol Physiol. 2000; 279:L1029–L1037. [PubMed] [Академия Google]
41. Тан Ю.Л., Тан Ю., Чжан Ю.С., Цянь К., Шен Л., Филлипс М.И. Улучшенная выживаемость мезенхимальных стволовых клеток трансплантата в ишемическом сердце с помощью регулируемого гипоксией вектора гемоксигеназы-1. J Am Coll Кардиол. 2005;46:1339–1350. [PubMed] [Google Scholar]
42. Lenfant C. NHLBI в 50 лет: размышления о полувековых исследованиях сердца, легких и крови. Национальный институт сердца, легких и крови. Интервью Чарльза Марвика. ДЖАМА. 1998; 280:2062–2064. [PubMed] [Google Scholar]
43. Коранский М.Л., Роббинс Р.С., Блау Х.М. Доставка гена VEGF для лечения ишемического сердечно-сосудистого заболевания. Тенденции Cardiovasc Med. 2002; 12:108–114. [PubMed] [Академия Google]
44. Тан Ю.Л., Чжао К., Чжан Ю.С., Ченг Л., Лю М., Ши Дж., Ян Ю.З., Пан С., Гэ Дж., Филлипс М.И. Трансплантация аутологичных мезенхимальных стволовых клеток индуцирует VEGF и неоваскуляризацию в ишемизированном миокарде. Регул Пепт. 2004; 117:3–10. [PubMed] [Google Scholar]
Регул Пепт. 2004; 117:3–10. [PubMed] [Google Scholar]
45. Lange C, Bassler P, Lioznov MV, Bruns H, Kluth D, Zander AR, Fiegel HC. Экспрессия гепатоцитарного гена в культивируемых мезенхимальных стволовых клетках крысы. Пересадка Proc. 2005; 37: 276–279. [PubMed] [Google Scholar]
46. Тан Ю.Л., Чжао К., Цинь Х., Шэнь Л., Ченг Л., Гэ Дж., Филлипс М.И. Паракринное действие усиливает эффекты аутологичной трансплантации мезенхимальных стволовых клеток на регенерацию сосудов в крысиной модели инфаркта миокарда. Энн Торак Серг. 2005;80:229–236. [PubMed] [Google Scholar]
47. Lei Y, Haider HK, Shujia J, Sim ES. Терапевтический ангиогенез. Разработка новых стратегий на основе прошлого опыта. Базовый Рез Кардиол. 2004; 99: 121–132. [PubMed] [Google Scholar]
48. Wang Y, Haider HK, Ahmad N, Xu M, Ge R, Ashraf M. Комбинация фармакологической мобилизации с интрамиокардиальной доставкой клеток костного мозга, сверхэкспрессирующих VEGF, более эффективна для восстановления сердца. Дж Мол Селл Кардиол. 2006; 40: 736–745. [PubMed] [Академия Google]
Дж Мол Селл Кардиол. 2006; 40: 736–745. [PubMed] [Академия Google]
49. Elmadbouh I, Haider HK, Jiang S, Idris NM, Lu G, Ashraf M. Фактор-1альфа, полученный из стромальных клеток, доставляемый ex vivo, способствует самонаведению стволовых клеток и индуцирует ангиомиогенез в инфарктном миокарде. Дж Мол Селл Кардиол. 2007; 42: 792–803. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Цзян С., Хайдер Х.К., Идрис Н.М., Салим А., Ашраф М. Поддерживающее взаимодействие между передачей сигналов выживания клеток и ангиокомпетентными факторами повышает выживаемость донорских клеток и способствует ангиомиогенезу для восстановления сердца. . Цирк Рез. 2006;99: 776–784. [PubMed] [Google Scholar]
51. Zhang M, Mal N, Kiedrowski M, Chacko M, Askari AT, Popovic ZB, Koc ON, Penn MS. Экспрессия SDF-1 мезенхимальными стволовыми клетками приводит к трофической поддержке сердечных миоцитов после инфаркта миокарда. FASEB J. 2007 [PubMed] [Google Scholar]
52. Sun L, Cui M, Wang Z, Feng X, Mao J, Chen P, Kangtao M, Chen F, Zhou C.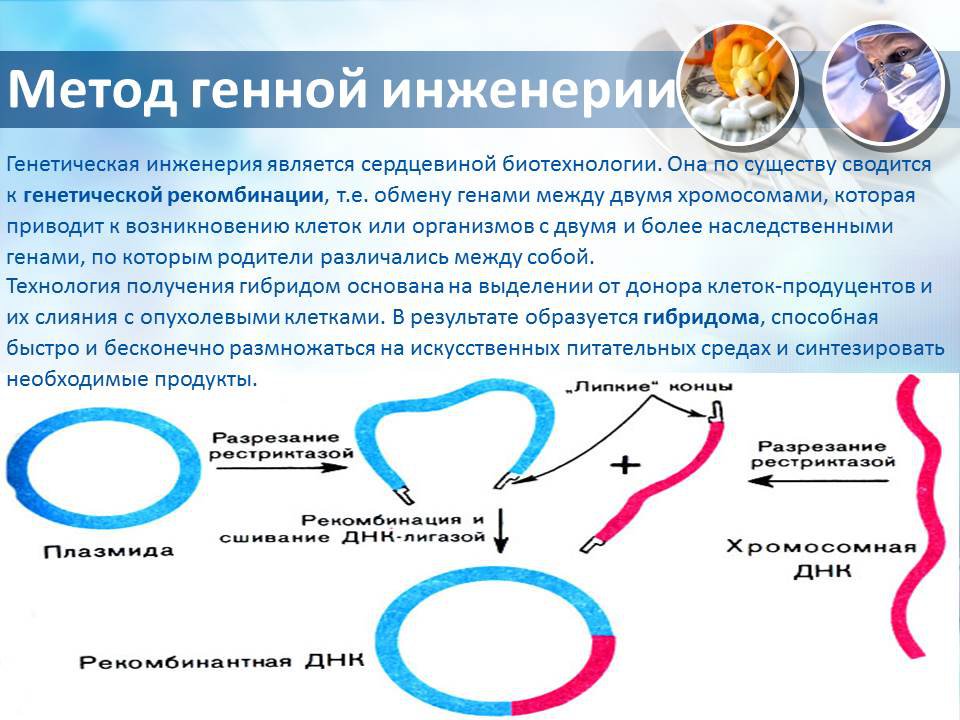 Мезенхимальные стволовые клетки, модифицированные ангиопоэтином-1. улучшить ремоделирование в крысиной модели острого инфаркта миокарда. Biochem Biophys Res Commun. 2007;357:779–784. [PubMed] [Google Scholar]
Мезенхимальные стволовые клетки, модифицированные ангиопоэтином-1. улучшить ремоделирование в крысиной модели острого инфаркта миокарда. Biochem Biophys Res Commun. 2007;357:779–784. [PubMed] [Google Scholar]
53. Huang SD, Lu FL, Xu XY, Liu XH, Zhao XX, Zhao BZ, Wang L, Gong DJ, Yuan Y, Xu ZY. Трансплантация мезенхимальных стволовых клеток со сверхэкспрессией ангиогенина синергически увеличивает сердечную функцию в модели хронической ишемии у свиней. J Грудной сердечно-сосудистый хирург. 2006; 132:1329–1338. [PubMed] [Google Scholar]
54. Лавон Н., Янука О., Бенвенисты Н. Влияние сверхэкспрессии Pdx1 и Foxa2 на дифференцировку эмбриональных стволовых клеток человека в клетки поджелудочной железы. Стволовые клетки. 2006;24:1923–1930. [PubMed] [Google Scholar]
55. Анг С.Л., Вирда А., Вонг Д., Стивенс К.А., Касио С., Россант Дж., Зарет К.С. Формирование и поддержание линии дефинитивной энтодермы у мышей: участие белков HNF3/forkhead. Разработка. 1993; 119:1301–1315. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
56. Чакрабарти С.К., Мирмира Р.Г. Факторы транскрипции управляют развитием и функцией бета-клеток поджелудочной железы. Тенденции Эндокринол Метаб. 2003; 14:78–84. [PubMed] [Google Scholar]
57. Ahlgren U, Jonsson J, Jonsson L, Simu K, Edlund H. Специфическая для бета-клеток инактивация гена Ipf1/Pdx1 мыши приводит к потере фенотипа и зрелости бета-клеток. начавшийся диабет. Гены Дев. 1998;12:1763–1768. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Wang J, Elghazi L, Parker SE, Kizilocak H, Asano M, Sussel L, Sosa-Pineda B. Согласованная деятельность Pax4 и Nkx2.2 имеет важное значение. для инициации дифференцировки бета-клеток поджелудочной железы. Дев биол. 2004; 266: 178–189. [PubMed] [Google Scholar]
59. Друккер М., Кац Г., Урбах А., Шульдинер М., Маркел Г., Ицковиц-Элдор Дж., Реубинофф Б., Мандельбойм О., Бенвенисти Н. Характеристика экспрессии белков MHC в эмбриональных клетках человека. стволовые клетки. Proc Natl Acad Sci U S A.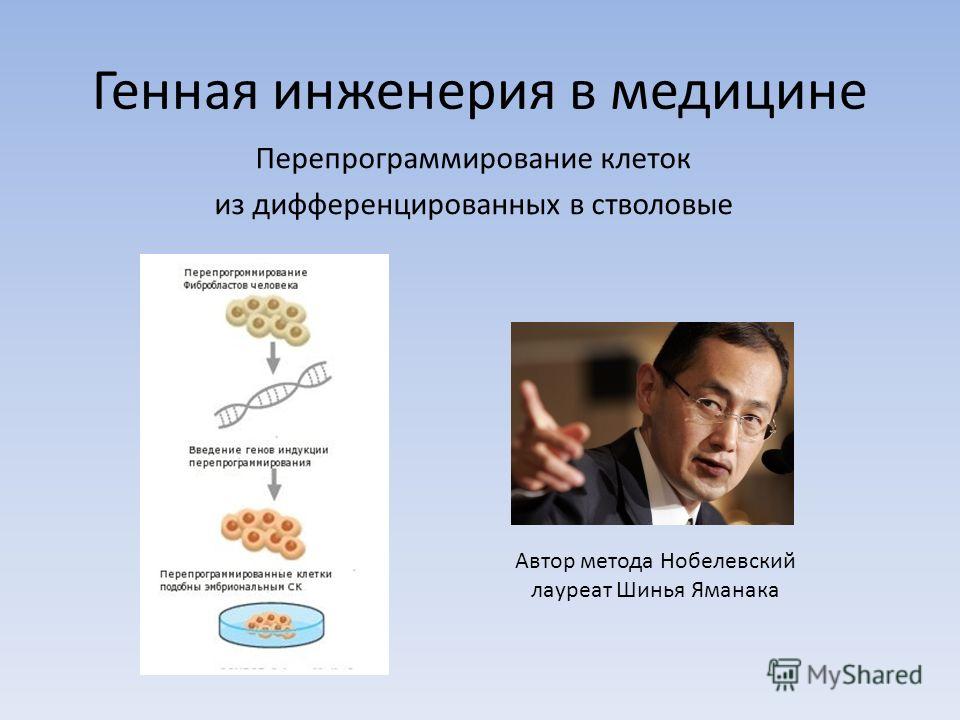 2002;99:9864–9869. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2002;99:9864–9869. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Tang DQ, Lu S, Sun YP, Rodrigues E, Chou W, Yang C, Cao LZ, Chang LJ, Yang LJ. Перепрограммирование WB-клеток ствола печени в функциональные клетки, продуцирующие инсулин, за счет постоянной экспрессии Pdx1- и Pdx1-VP16, опосредованной лентивирусными векторами. Лаборатория Инвест. 2006; 86: 83–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Li Y, Zhang R, Qiao H, Zhang H, Wang Y, Yuan H, Liu Q, Liu D, Chen L, Pei X. Генерация инсулина. производство клеток из модифицированных геном PDX-1 мезенхимальных стволовых клеток человека. J Cell Physiol. 2007; 211:36–44. [PubMed] [Академия Google]
62. Noguchi H, Xu G, Matsumoto S, Kaneto H, Kobayashi N, Bonner-Weir S, Hayashi S. Индукция стволовых клеток поджелудочной железы/клеток-предшественников в инсулин-продуцирующие клетки с помощью аденовирусно-опосредованной технологии переноса генов. Трансплантация клеток. 2006; 15: 929–938. [PubMed] [Google Scholar]
63. Dinsmore J, Ratliff J, Deacon T, Pakzaban P, Jacoby D, Galpern W, Isacson O. Эмбриональные стволовые клетки, дифференцированные in vitro, как новый источник клеток для трансплантации. Трансплантация клеток. 1996; 5: 131–143. [PubMed] [Академия Google]
Dinsmore J, Ratliff J, Deacon T, Pakzaban P, Jacoby D, Galpern W, Isacson O. Эмбриональные стволовые клетки, дифференцированные in vitro, как новый источник клеток для трансплантации. Трансплантация клеток. 1996; 5: 131–143. [PubMed] [Академия Google]
64. McDonald JW, Liu XZ, Qu Y, Liu S, Mickey SK, Турецкий D, Gottlieb DI, Choi DW. Трансплантированные эмбриональные стволовые клетки выживают, дифференцируются и способствуют восстановлению в поврежденном спинном мозге крыс. Нат Мед. 1999; 5:1410–1412. [PubMed] [Google Scholar]
65. Тан X, Cai PQ, Lin YQ, Oudega M, Blits B, Xu L, Yang YK, Zhou TH. Генно-инженерные нейральные стволовые клетки, модифицированные лентивирусом, для восстановления повреждений спинного мозга у крыс. Chin Med Sci J. 2006; 21:120–124. [PubMed] [Академия Google]
66. Cai PQ, Tang X, Lin YQ, Martin O, Sun GY, Xu L, Yang YK, Zhou TH. Экспериментальное исследование генной инженерии нервных стволовых клеток человека, опосредованных лентивирусом, для экспрессии мультигена. Чин Дж Трауматол. 2006; 9:43–49. [PubMed] [Google Scholar]
Чин Дж Трауматол. 2006; 9:43–49. [PubMed] [Google Scholar]
67. Блитц Б., Китай Б.М., Фарахвар А., Капертон К.В., Дитрих В.Д., Бунге М.Б. Опосредованная лентивирусным вектором трансдукция нейральных клеток-предшественников перед имплантацией в поврежденный спинной и головной мозг для обнаружения их миграции, доставки нейротрофических факторов и восстановления тканей. Рестор Нейрол Нейроски. 2005; 23: 313–324. [PubMed] [Академия Google]
68. Эглитис М.А., Мезей Э. Гемопоэтические клетки дифференцируются как в микроглию, так и в макроглию в головном мозге взрослых мышей. Proc Natl Acad Sci U S A. 1997; 94:4080–4085. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Brazelton TR, Rossi FM, Keshet GI, Blau HM. От костного мозга к мозгу: экспрессия фенотипов нейронов у взрослых мышей. Наука. 2000; 290:1775–1779. [PubMed] [Google Scholar]
70. Chen J, Li Y, Wang L, Lu M, Zhang X, Chopp M. Терапевтическая польза внутримозговой трансплантации стромальных клеток костного мозга после церебральной ишемии у крыс. J Neurol Sci. 2001;189: 49–57. [PubMed] [Google Scholar]
J Neurol Sci. 2001;189: 49–57. [PubMed] [Google Scholar]
71. Li Y, Chen J, Chen XG, Wang L, Gautam SC, Xu YX, Katakowski M, Zhang LJ, Lu M, Janakiraman N, Chopp M. Терапия стромальными клетками костного мозга человека для инсульт у крыс: нейротрофины и функциональное восстановление. Неврология. 2002; 59: 514–523. [PubMed] [Google Scholar]
72. Иихоши С., Хонмоу О., Хоукин К., Хаши К., Кочиш Д.Д. Терапевтическое окно для внутривенного введения аутологичного костного мозга после церебральной ишемии у взрослых крыс. Мозг Res. 2004;1007:1–9. [PubMed] [Google Scholar]
73. Бейкер А.Х., Сика В., Ворк Л.М., Уильямс-Игнарро С., де Нигрис Ф., Лерман Л.О., Казамассими А., Ланца А., Скиано С., Риенцо М., Игнарро Л.Дж., Наполи К. Защита головного мозга с использованием аутологичных клеток костного мозга, ингибиторов металлопротеиназ и метаболическая терапия при церебральной ишемии. Proc Natl Acad Sci U S A. 2007;104:3597–3602. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Кобуне М., Кавано Ю., Ито Ю., Тиба Х., Накамура К., Цуда Х., Сасаки К., Дехари Х., Учида Х., Хонмо О., Такахаши С., Бизен А., Такимото Р., Мацунага Т., Като Дж., Като К., Хоукин К., Ниицу Й., Хамада Х. Теломеризованные мультипотентные мезенхимальные клетки человека могут дифференцироваться в гемопоэтические клетки и клетки, поддерживающие область булыжника. эксп Гематол. 2003; 31: 715–722. [PubMed] [Академия Google]
Кобуне М., Кавано Ю., Ито Ю., Тиба Х., Накамура К., Цуда Х., Сасаки К., Дехари Х., Учида Х., Хонмо О., Такахаши С., Бизен А., Такимото Р., Мацунага Т., Като Дж., Като К., Хоукин К., Ниицу Й., Хамада Х. Теломеризованные мультипотентные мезенхимальные клетки человека могут дифференцироваться в гемопоэтические клетки и клетки, поддерживающие область булыжника. эксп Гематол. 2003; 31: 715–722. [PubMed] [Академия Google]
75. Харлей CB. Потеря теломер: митотические часы или генетическая бомба замедленного действия? Мутат рез. 1991; 256: 271–282. [PubMed] [Google Scholar]
76. Jiang XR, Jimenez G, Chang E, Frolkis M, Kusler B, Sage M, Beeche M, Bodnar AG, Wahl GM, Tlsty TD, Chiu CP. Экспрессия теломеразы в соматических клетках человека не вызывает изменений, связанных с трансформированным фенотипом. Нат Жене. 1999; 21:111–114. [PubMed] [Google Scholar]
77. Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE. Увеличение продолжительности жизни путем введения теломеразы в нормальные клетки человека. Наука. 1998;279:349–352. [PubMed] [Google Scholar]
Наука. 1998;279:349–352. [PubMed] [Google Scholar]
78. Honma T, Honmou O, Iihoshi S, Harada K, Houkin K, Hamada H, Kocsis JD. Внутривенное вливание иммортализованных мезенхимальных стволовых клеток человека защищает от повреждения в модели церебральной ишемии у взрослых крыс. Опыт Нейрол. 2006; 199: 56–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Crigler L, Robey RC, Asawachaicharn A, Gaupp D, Phinney DG. Субпопуляции мезенхимальных стволовых клеток человека экспрессируют различные нейрорегуляторные молекулы и способствуют выживанию нейронных клеток и нейритогенезу. Опыт Нейрол. 2006;198:54–64. [PubMed] [Google Scholar]
80. Курозуми К., Накамура К., Тамия Т., Кавано Й., Кобунэ М., Хираи С., Учида Х., Сасаки К., Ито Й., Като К., Хонмо О., Хоукин К., Дата I, Мезенхимальные стволовые клетки с модифицированным геном Hamada H. BDNF способствуют функциональному восстановлению и уменьшают размер инфаркта в модели окклюзии средней мозговой артерии у крыс. Мол Тер. 2004; 9: 189–197. [PubMed] [Google Scholar]
Мол Тер. 2004; 9: 189–197. [PubMed] [Google Scholar]
81. Курозуми К., Накамура К., Тамия Т., Кавано Ю., Исии К., Кобуне М., Хираи С., Учида Х., Сасаки К., Ито Ю., Като К., Хонмо О., Хоукин К., Дата I, Хамада Х. Мезенхимальные стволовые клетки, продуцирующие нейротрофические факторы, уменьшают ишемическое повреждение в модели окклюзии средней мозговой артерии у крыс. Мол Тер. 2005;11:96–104. [PubMed] [Google Scholar]
82. Schwarz EJ, Alexander GM, Prockop DJ, Azizi SA. Мультипотенциальные стромальные клетки костного мозга, трансдуцированные для производства L-ДОФА: приживление в крысиной модели болезни Паркинсона. Гул Джин Тер. 1999;10:2539–2549. [PubMed] [Google Scholar]
83. Schwarz EJ, Reger RL, Alexander GM, Class R, Azizi SA, Prockop DJ. Стромальные клетки костного мозга крыс, быстро трансдуцированные самоинактивирующимся ретровирусом, синтезируют L-ДОФА in vitro. Джин Тер. 2001; 8: 1214–1223. [PubMed] [Академия Google]
84. Шен Ю, Мурамацу С.И., Икегучи К. , Фудзимото К.И., Фан Д.С., Огава М., Мизуками Х., Урабе М., Куме А., Нагацу И., Урано Ф., Судзуки Т., Ичиносе Х., Нагацу Т., Монахан Дж., Накано I, Ozawa K. Тройная трансдукция с аденоассоциированными вирусными векторами, экспрессирующими тирозингидроксилазу, декарбоксилазу ароматических L-аминокислот и циклогидролазу GTP I для генной терапии болезни Паркинсона. Гул Джин Тер. 2000; 11:1509–1519. [PubMed] [Google Scholar]
, Фудзимото К.И., Фан Д.С., Огава М., Мизуками Х., Урабе М., Куме А., Нагацу И., Урано Ф., Судзуки Т., Ичиносе Х., Нагацу Т., Монахан Дж., Накано I, Ozawa K. Тройная трансдукция с аденоассоциированными вирусными векторами, экспрессирующими тирозингидроксилазу, декарбоксилазу ароматических L-аминокислот и циклогидролазу GTP I для генной терапии болезни Паркинсона. Гул Джин Тер. 2000; 11:1509–1519. [PubMed] [Google Scholar]
85. Sun M, Kong L, Wang X, Holmes C, Gao Q, Zhang GR, Pfeilschifter J, Goldstein DS, Geller AI. Коэкспрессия тирозингидроксилазы, циклогидролазы GTP I, декарбоксилазы ароматических аминокислот и переносчика везикулярных моноаминов 2 из вспомогательного вектора вируса простого герпеса типа 1, не содержащего вируса, поддерживает высокоуровневую долгосрочную биохимическую и поведенческую коррекцию крысиной модели болезни Паркинсона. . Гул Джин Тер. 2004; 15:1177–119.6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Fisher LJ, Raymon HK, Gage FH. Клетки, сконструированные для производства ацетилхолина: терапевтический потенциал при болезни Альцгеймера. Энн Н.Ю. Академия наук. 1993; 695: 278–284. [PubMed] [Google Scholar]
Энн Н.Ю. Академия наук. 1993; 695: 278–284. [PubMed] [Google Scholar]
87. Lad SP, Neet KE, Mufson EJ. Фактор роста нервов: структура, функция и терапевтические последствия болезни Альцгеймера. Curr Drug нацелен на расстройство нервной системы ЦНС. 2003; 2: 315–334. [PubMed] [Google Scholar]
88. Тушински М.Х., Тал Л., Пей М., Лосось Д.П., Х.С. У, Бакай Р., Патель П., Блеш А., Валсинг Х.Л., Хо Г., Тонг Г., Поткин С.Г., Фэллон Дж., Хансен Л., Мафсон Э.Дж., Кордауэр Дж.Х., Галл С., Коннер Дж. Клинические испытания фазы 1 генной терапии фактора роста нервов при болезни Альцгеймера. Нат Мед. 2005; 11: 551–555. [PubMed] [Академия Google]
89. Брудер С.П., Курт А.А., Ши М., Хейс В.К., Джайсвал Н., Кадияла С. Регенерация костей путем имплантации очищенных культурально расширенных мезенхимальных стволовых клеток человека. J Ортоп Res. 1998; 16: 155–162. [PubMed] [Google Scholar]
90. Gazit D, Turgeman G, Kelley P, Wang E, Jalenak M, Zilberman Y, Moutsatsos I. Сконструированные плюрипотентные мезенхимальные клетки интегрируются и дифференцируются в регенерирующую кость: новая клеточно-опосредованная генная терапия .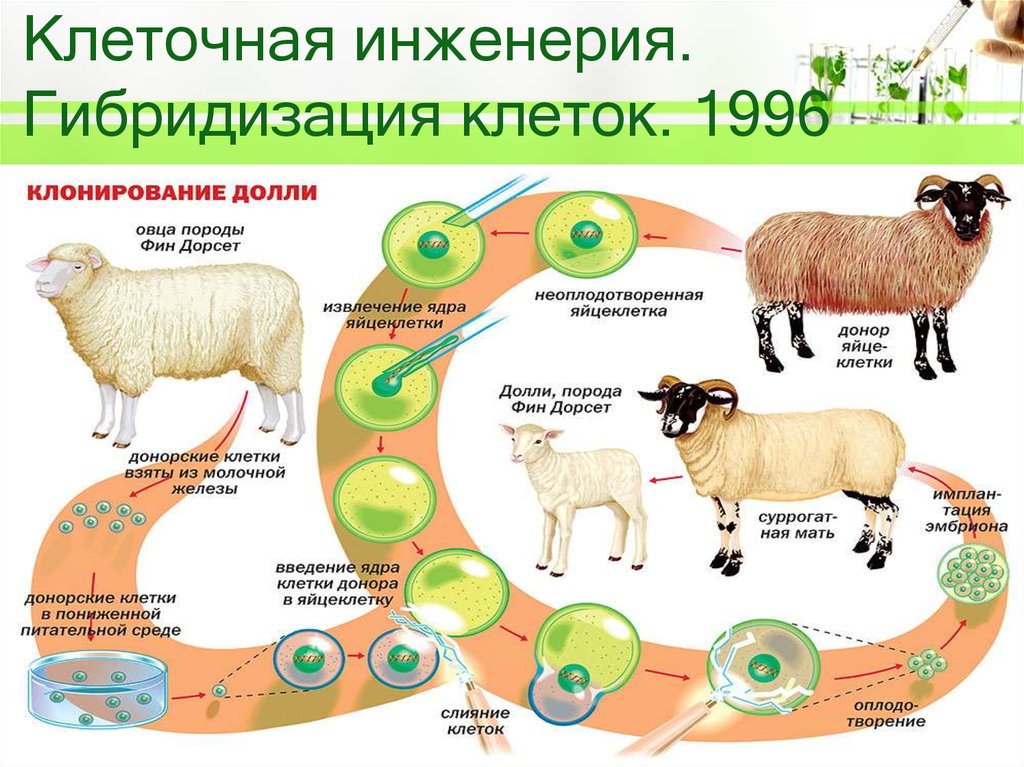 Дж Джин Мед. 1999; 1:121–133. [PubMed] [Академия Google]
Дж Джин Мед. 1999; 1:121–133. [PubMed] [Академия Google]
91. Муцацос И.К., Тургеман Г., Чжоу С., Куркалли Б.Г., Пеллед Г., Цур Л., Келли П., Штумм Н., Ми С., Мюллер Р., Зильберман Ю., Газит Д. Экзогенно регулируемая генная терапия, опосредованная стволовыми клетками для костей. регенерация. Мол Тер. 2001; 3: 449–461. [PubMed] [Google Scholar]
92. Хашарони А., Зильберман Ю., Тургеман Г., Хелм Г.А., Либергалл М., Газит Д. Слияние позвоночника мышей, индуцированное сконструированными мезенхимальными стволовыми клетками, которые условно экспрессируют костный морфогенетический белок-2. J Нейрохирург позвоночника. 2005; 3:47–52. [PubMed] [Академия Google]
93. Хун С.К., Дэн В.П., Ян В.К., Лю Р.С., Ли К.К., Су Т.К., Лин Р.Дж., Ян Д.М., Чанг Ч.В., Чен В.Х., Вэй Х.Дж., Геловани Д.Г. Нацеливание мезенхимальных стволовых клеток на микроскопические опухоли и развитие стромы опухоли под контролем неинвазивной позитронно-эмиссионной томографии in vivo. Клин Рак Рез. 2005; 11:7749–7756.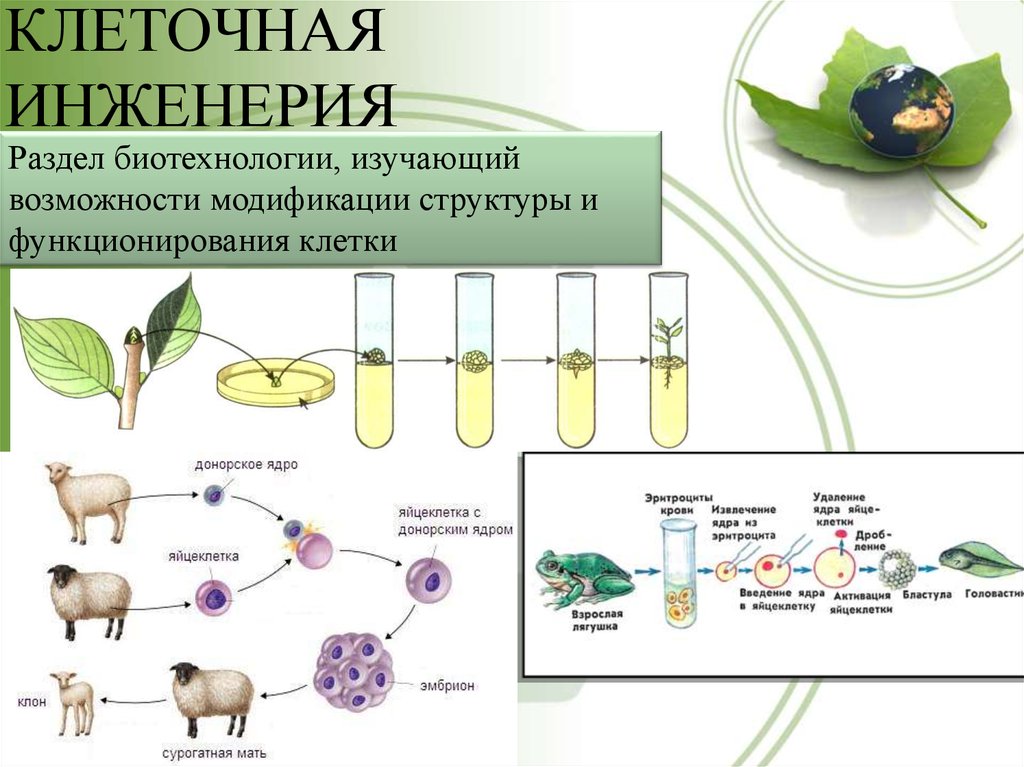 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
94. Вонг В.Л., Риман Д.Дж., Аронсон Л., Далтон Б.Дж., Грейг Р., Анзано М.А. Ингибирующая рост активность интерферона-бета в отношении клеточных линий колоректальной карциномы человека. Инт Джей Рак. 1989;43:526–530. [PubMed] [Google Scholar]
95. Локшин А., Майотт Дж. Э., Левитт М. Л. Механизм индуцированной интерфероном бета плоскоклеточной дифференцировки и запрограммированной гибели клеток в клеточных линиях немелкоклеточного рака легкого человека. J Natl Cancer Inst. 1995; 87: 206–212. [PubMed] [Google Scholar]
96. Studeny M, Marini FC, Champlin RE, Zompetta C, Fidler IJ, Andreeff M. Мезенхимальные стволовые клетки, полученные из костного мозга, как средства доставки интерферона-бета в опухоли. Рак рез. 2002;62:3603–3608. [PubMed] [Академия Google]
97. Studeny M, Marini FC, Dembinski JL, Zompetta C, Cabreira-Hansen M, Bekele BN, Champlin RE, Andreeff M. Мезенхимальные стволовые клетки: потенциальные предшественники стромы опухоли и средства адресной доставки противоопухолевых агентов. J Natl Cancer Inst. 2004; 96: 1593–1603. [PubMed] [Google Scholar]
J Natl Cancer Inst. 2004; 96: 1593–1603. [PubMed] [Google Scholar]
98. Накамизо А., Марини Ф., Амано Т., Хан А., Студени М., Гумин Дж., Чен Дж., Хентшель С., Весил Г., Дембински Дж., Андреефф М., Ланг Ф.Ф. Мезенхимальные стволовые клетки костного мозга человека в лечении глиом. Рак рез. 2005;65:3307–3318. [PubMed] [Академия Google]
99. Xin H, Kanehira M, Mizuguchi H, Hayakawa T, Kikuchi T, Nukiwa T, Saijo Y. Направленная доставка CX3CL1 в множественные опухоли легких с помощью мезенхимальных стволовых клеток. Стволовые клетки. 2007; 25:1618–1626. [PubMed] [Google Scholar]
100. Stagg J, Lejeune L, Paquin A, Galipeau J. Стромальные клетки костного мозга для доставки интерлейкина-2 в иммунотерапии рака. Гул Джин Тер. 2004; 15: 597–608. [PubMed] [Google Scholar]
101. Куцерова Л., Альтанерова В., Матуськова М., Тычакова С., Альтанер С. Мезенхимальные стволовые клетки человека, полученные из жировой ткани, опосредованы генной терапией пролекарственного рака. Рак рез. 2007;67(13):6304–6313. [PubMed] [Академия Google]
Рак рез. 2007;67(13):6304–6313. [PubMed] [Академия Google]
102. Лонгли Д.Б., Харкин Д.П., Джонстон П.Г. 5-фторурацил: механизмы действия и клиническая стратегия. Нат Рев Рак. 2003;3:330–338. [PubMed] [Google Scholar]
103. Моайери М., Хоули Т.С., Хоули Р.Г. Коррекция мышиной гемофилии А с помощью генной терапии гемопоэтическими стволовыми клетками. Мол Тер. 2005; 12:1034–1042. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Gangadharan B, Parker ET, Ide LM, Spencer HT, Doering CB. Высокий уровень экспрессии свиного фактора VIII из генетически модифицированных стволовых клеток, полученных из костного мозга. Кровь. 2006;107:3859–3864. [PubMed] [Google Scholar]
Генная терапия и генная инженерия
Введение
Клетки человека или другого организма имеют части, называемые «генами», которые контролируют химические реакции в клетке, которые заставляют ее расти и функционировать и в конечном итоге определяют рост и функцию организма. Организм наследует некоторые гены от каждого родителя, и, таким образом, родители передают определенные черты своему потомству.
Организм наследует некоторые гены от каждого родителя, и, таким образом, родители передают определенные черты своему потомству.
Генная терапия и генная инженерия — две тесно связанные технологии, которые включают изменение генетического материала организмов. Различие между ними основано на цели. Генная терапия направлена на изменение генов для исправления генетических дефектов и, таким образом, предотвращения или лечения генетических заболеваний. Генная инженерия стремится модифицировать гены, чтобы расширить возможности организма сверх того, что обычно.
Этические споры окружают возможное использование обеих этих технологий на растениях, нечеловеческих животных и людях. В частности, в отношении генной инженерии, например, возникает вопрос, правильно ли было бы возиться с человеческими генами, чтобы сделать людей способными превзойти лучших олимпийских спортсменов или намного умнее Эйнштейна.
Запутанная терминология
Если под генной инженерией понимать в очень широком смысле любое преднамеренное генетическое изменение, то она включает генную терапию.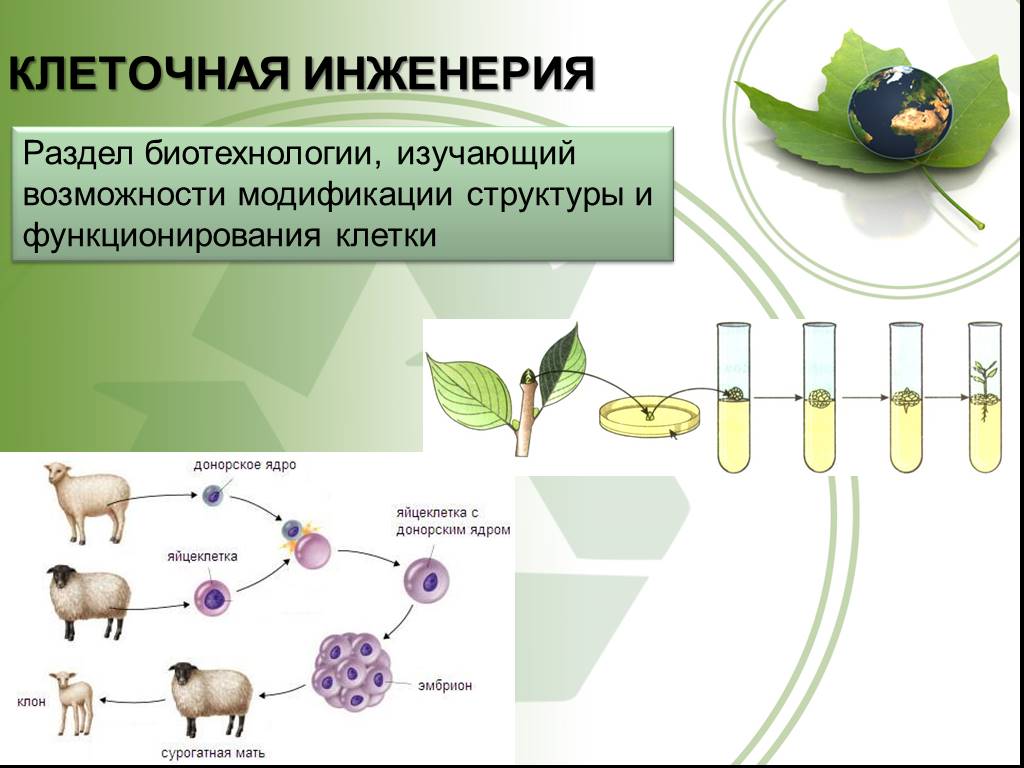 Таким образом, можно услышать о «терапевтической генной инженерии» (генной терапии) и «негативной генной инженерии» (генной терапии), в отличие от «генной инженерии усиления» и «позитивной генной инженерии» (то, что мы называем просто «генной инженерией»).
Таким образом, можно услышать о «терапевтической генной инженерии» (генной терапии) и «негативной генной инженерии» (генной терапии), в отличие от «генной инженерии усиления» и «позитивной генной инженерии» (то, что мы называем просто «генной инженерией»).
Мы используем фразу «генная инженерия» в более узком смысле для вида изменения, которое направлено на улучшение, а не на лечение. Мы используем термин «генная терапия» для обозначения усилий, направленных на то, чтобы привести людей к норме, а «генная инженерия» или «улучшение генной инженерии» — для усилий, направленных на расширение возможностей людей за пределами нормы.
Соматические клетки и репродуктивные клетки
Два основных типа клеток — это соматические клетки и репродуктивные клетки. Большинство клеток в нашем организме соматические — клетки, из которых состоят такие органы, как кожа, печень, сердце, легкие и т. д., и эти клетки отличаются друг от друга. Изменение генетического материала в этих клетках не передается потомству человека. Репродуктивные клетки — это сперматозоиды, яйцеклетки и клетки очень ранних эмбрионов. Изменения в генетическом составе репродуктивных клеток будут передаваться потомству человека. Эти изменения репродуктивных клеток могут привести к другой генетике соматических клеток потомства, чем это могло бы произойти в противном случае, потому что генетический состав соматических клеток напрямую связан с генетическим составом зародышевых клеток, из которых они произошли.
Репродуктивные клетки — это сперматозоиды, яйцеклетки и клетки очень ранних эмбрионов. Изменения в генетическом составе репродуктивных клеток будут передаваться потомству человека. Эти изменения репродуктивных клеток могут привести к другой генетике соматических клеток потомства, чем это могло бы произойти в противном случае, потому что генетический состав соматических клеток напрямую связан с генетическим составом зародышевых клеток, из которых они произошли.
Методы генетического изменения
При изменении генов необходимо столкнуться с двумя проблемами. Во-первых, какие изменения нужно внести в ген. Во-вторых, как включить это изменение во все другие ячейки, которые необходимо изменить для достижения желаемого эффекта.
Есть несколько вариантов изменения гена. ДНК в гене может быть заменена другой ДНК извне (так называемая «гомологическая замена»). Или ген может быть вынужден мутировать (изменить структуру — «селективная обратная мутация»). Или можно просто добавить ген. Или можно использовать химическое вещество, чтобы просто отключить ген и предотвратить его действие.
Или можно использовать химическое вещество, чтобы просто отключить ген и предотвратить его действие.
Существует также несколько вариантов распространения генетических изменений на все клетки, которые необходимо изменить. Если измененная клетка является репродуктивной клеткой, то несколько таких клеток могут быть изменены, и это изменение достигнет других соматических клеток, поскольку эти соматические клетки были созданы по мере развития организма. Но если бы изменение было произведено в соматической клетке, изменение всех других соответствующих соматических клеток по отдельности, как и первой, было бы непрактично из-за огромного количества таких клеток. Клетки крупного органа, такого как сердце или печень, слишком многочисленны, чтобы изменяться одна за другой. Вместо этого для достижения таких соматических клеток общепринятым подходом является использование носителя или вектора, который представляет собой молекулу или организм. Например, в качестве вектора можно использовать вирус. Вирус был бы безобидным или измененным, чтобы не вызывать болезни. Ему вводили генетический материал, а затем, когда он размножался и «заражал» клетки-мишени, он вводил новый генетический материал. Это должен быть очень специфический вирус, который заражал бы, например, клетки сердца, не заражая и не изменяя все остальные клетки тела. Жировые частицы и химические вещества также использовались в качестве переносчиков, потому что они могут проникать через клеточную мембрану и перемещаться в ядро клетки с новым генетическим материалом.
Вирус был бы безобидным или измененным, чтобы не вызывать болезни. Ему вводили генетический материал, а затем, когда он размножался и «заражал» клетки-мишени, он вводил новый генетический материал. Это должен быть очень специфический вирус, который заражал бы, например, клетки сердца, не заражая и не изменяя все остальные клетки тела. Жировые частицы и химические вещества также использовались в качестве переносчиков, потому что они могут проникать через клеточную мембрану и перемещаться в ядро клетки с новым генетическим материалом.
Аргументы в пользу генной терапии и генной инженерии
Генная терапия часто считается морально не вызывающей возражений, хотя и требует осторожности. Основные аргументы в его пользу заключаются в том, что он дает возможность излечивать некоторые заболевания или расстройства у тех, у кого есть проблемы, и предотвращать заболевания у тех, чьи гены предрасполагают к этим проблемам. Если проводить генную терапию на репродуктивных клетках, то она может уберечь детей от переноса таких генов (неблагоприятных генетических заболеваний и нарушений), которые дети получили от своих пациентов.
Генная инженерия для улучшения организмов уже широко используется в сельском хозяйстве, прежде всего в генетически модифицированных (ГМ) культурах (также известных как ГМО – генетически модифицированные организмы). Например, сельскохозяйственные культуры и домашние животные были спроектированы таким образом, чтобы они были устойчивы к гербицидам и пестицидам, а это означает, что фермеры могут затем использовать эти химические вещества для борьбы с сорняками и насекомыми на этих культурах, не рискуя нанести вред этим растениям. В будущем генетическое усовершенствование может быть использовано для создания сельскохозяйственных культур с большей урожайностью и питательной ценностью, а также для селекции сельскохозяйственных животных, скаковых лошадей и выставочных животных.
Генетически модифицированные бактерии и другие микроорганизмы в настоящее время используются для производства человеческого инсулина, гормона роста человека, белка, используемого для свертывания крови, и других фармацевтических препаратов, и количество таких соединений может увеличиться в будущем.
Улучшение людей все еще в будущем, но основной аргумент в пользу этого заключается в том, что это может значительно улучшить жизнь за счет улучшения определенных характеристик людей. Мы ценим ум, красоту, силу, выносливость и определенные личностные характеристики и поведенческие тенденции, и если бы оказалось, что эти черты обусловлены генетическим компонентом, мы могли бы улучшить людей, наделив их такими чертами. Сторонники генной инженерии отмечают, что многие люди уже пытаются улучшить себя такими способами — с помощью диеты, физических упражнений, образования, косметики и даже пластической хирургии. Люди стараются делать это для себя, а родители стараются обеспечить этим своих детей. Если упражнения для улучшения силы, ловкости и общей физической подготовки являются стоящей целью, и если кого-то хвалят за получение образования для повышения его умственных способностей, то почему бы не сделать это с помощью генетики?
Сторонники генной инженерии также рассматривают усовершенствование как вопрос основной репродуктивной свободы. Мы уже чувствуем себя вправе выбирать себе пару отчасти на основании возможности родить желанных детей. Мы считаем, что нет ничего плохого в выборе партнера, который, как мы надеемся, может родить умных, привлекательных детей, а не другого партнера, который может родить менее желанных детей. Выбор партнера для того типа детей, который может получиться, является вопросом базовой репродуктивной свободы, и у нас есть свобода выбирать лучшие гены, которые мы можем, для наших детей. Почему, рассуждает аргумент, у нас должно быть меньше свободы, чтобы дать нашим детям лучшие гены, которые мы можем получить путем генетического улучшения?
Мы уже чувствуем себя вправе выбирать себе пару отчасти на основании возможности родить желанных детей. Мы считаем, что нет ничего плохого в выборе партнера, который, как мы надеемся, может родить умных, привлекательных детей, а не другого партнера, который может родить менее желанных детей. Выбор партнера для того типа детей, который может получиться, является вопросом базовой репродуктивной свободы, и у нас есть свобода выбирать лучшие гены, которые мы можем, для наших детей. Почему, рассуждает аргумент, у нас должно быть меньше свободы, чтобы дать нашим детям лучшие гены, которые мы можем получить путем генетического улучшения?
Тех, кто выступает за значительное изменение человека с помощью таких технологий, как генная инженерия, иногда называют «трансгуманистами».
Аргументы против генной терапии
Три аргумента, иногда приводимые против генной терапии, заключаются в том, что она слишком опасна с технической точки зрения, что она дискриминирует или провоцирует дискриминацию в отношении людей с ограниченными возможностями и что в некоторых случаях она может становиться все более неуместной.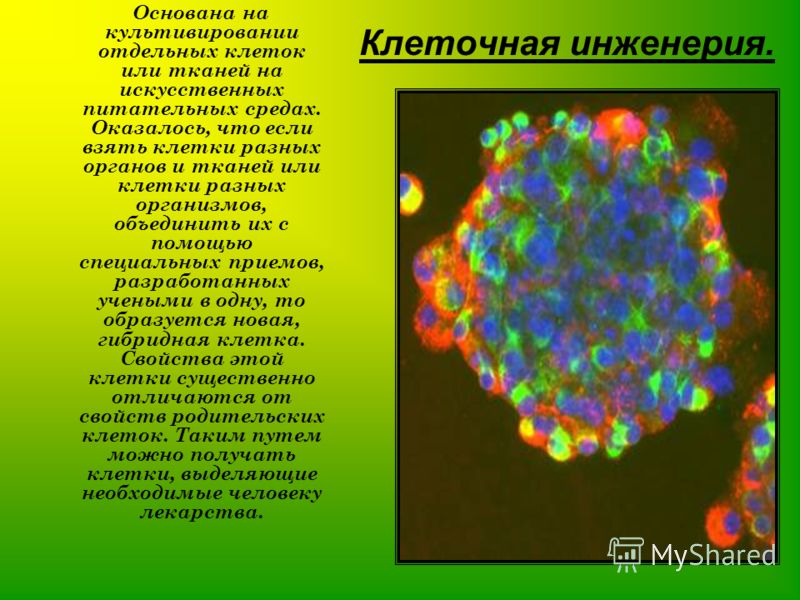
Возражение об опасности указывает на то, что несколько недавних попыток генной терапии в клинических испытаниях попали в заголовки газет из-за трагической гибели некоторых людей, участвовавших в испытаниях. Неизвестно, в какой степени это было связано с самой генной терапией, в отличие от ранее существовавших условий или неправильных методов исследования, но в свете таких событий некоторые критики призвали прекратить генную терапию до тех пор, пока не станет известно больше. . Мы просто недостаточно знаем о том, как работает генная терапия и что может пойти не так. Особое беспокойство вызывает то, что
- векторы могут доставлять ДНК в клетки, отличные от клеток-мишеней, с непредвиденными результатами
- вирусы как переносчики могут быть не такими безобидными, как предполагалось, и могут вызывать заболевания
- добавление новых генов в ядро не гарантирует, что они попадут туда, куда нужно, с потенциально катастрофическими последствиями, если они будут вставлены в неправильное место
- , если изменения не интегрированы с другой ДНК, уже находящейся в ядре, изменения могут не переноситься на новые клетки, и человеку может потребоваться дополнительное лечение позже
- изменение репродуктивных клеток может привести к событиям, которые проявятся лишь спустя годы, а нежелательные эффекты уже могут быть переданы детям пациента
Возражение о дискриминации заключается в следующем. Некоторые люди с физическими, умственными или эмоциональными нарушениями являются таковыми в результате генетических факторов, которые они унаследовали. Такое нарушение может привести к инвалидности в нашем обществе. Люди с инвалидностью часто подвергаются дискриминации из-за того, что у них меньше возможностей, чем у других людей. Устранение генетических нарушений и, как следствие, нарушений, верно, что генная терапия может способствовать устранению одного из источников дискриминации и неравенства в обществе. Но неявное предположение, как утверждает возражение, заключается в том, что людей с нарушениями, вызванными генетическими факторами, нужно лечить и делать нормальными. Возражение рассматривает генную терапию как форму дискриминации людей с ограниченными возможностями и людей с ограниченными возможностями.
Некоторые люди с физическими, умственными или эмоциональными нарушениями являются таковыми в результате генетических факторов, которые они унаследовали. Такое нарушение может привести к инвалидности в нашем обществе. Люди с инвалидностью часто подвергаются дискриминации из-за того, что у них меньше возможностей, чем у других людей. Устранение генетических нарушений и, как следствие, нарушений, верно, что генная терапия может способствовать устранению одного из источников дискриминации и неравенства в обществе. Но неявное предположение, как утверждает возражение, заключается в том, что людей с нарушениями, вызванными генетическими факторами, нужно лечить и делать нормальными. Возражение рассматривает генную терапию как форму дискриминации людей с ограниченными возможностями и людей с ограниченными возможностями.
Неуместное возражение состоит в том, что генная терапия репродуктивных клеток в некоторых случаях уже может быть заменена экстракорпоральным оплодотворением и отбором эмбрионов. Если генетическое заболевание таково, что его можно обнаружить у раннего эмбриона, и не все эмбрионы от родительской пары будут иметь его, то родители должны произвести несколько эмбрионов посредством экстракорпорального оплодотворения и имплантировать только те из них, которые свободны от нарушения. В таком случае генная терапия была бы ненужной и неуместной.
Если генетическое заболевание таково, что его можно обнаружить у раннего эмбриона, и не все эмбрионы от родительской пары будут иметь его, то родители должны произвести несколько эмбрионов посредством экстракорпорального оплодотворения и имплантировать только те из них, которые свободны от нарушения. В таком случае генная терапия была бы ненужной и неуместной.
Аргументы против генной инженерии
Специалисты по этике, как правило, даже больше обеспокоены возможными проблемами и последствиями генной инженерии улучшения, чем генной терапией. Во-первых, есть опасения, подобные тем, что связаны с генной терапией, что недостаточно известно и могут быть непредвиденные опасные последствия. Эти опасения могут быть еще более серьезными, учитывая, что предпринимаются попытки не только вернуться к нормальной жизни, но и проникнуть на неизведанную новую территорию, куда люди никогда раньше не ступали. Мы просто не знаем, какие причудливые существа могут появиться в результате неудачных экспериментов.
Ниже приведены некоторые другие важные возражения:
- Генная инженерия противоречит естественному или сверхъестественному порядку. Идея здесь в том, что Бог, или эволюция, создал набор генов для людей, которые либо являются тем, что мы должны иметь, либо предлагают нам наилучшую ценность для выживания. Это против того, что Бог или природа намеревались возиться с этим генетическим кодом, не доводить его до нормы (как в генной терапии), а создавать новые виды существ. Этот тип возражений совместим как с «креационизмом», верой в то, что Бог создал людей такими, какие они есть, так и с верой в эволюцию. Согласно последней точке зрения, люди, сознательно улучшающие свои гены, считаются отличными от того, чтобы позволить естественному процессу эволюции «выбрать» имеющиеся у нас гены.
- Генная инженерия бесчеловечна, потому что она создаст нечеловеческих, отчужденных существ. Генетически модифицированные люди будут отчуждены от самих себя, или будут чувствовать себя запутанными, или перестанут чувствовать себя людьми, или человеческая раса почувствует себя отчужденной от себя.

- Созданные с помощью генной инженерии существа устареют. Компьютеры быстро устаревают по мере появления новых моделей. Но это может случиться с генетически модифицированными людьми. Горячее улучшение генов за один год станет старой новостью через несколько лет. Родители устареют по меркам своих детей, а подростки будут безнадежно отставать от своих младших братьев и сестер.
- Генная инженерия является разновидностью евгеники и вызывает воспоминания об историческом движении евгеники в начале двадцатого века в Америке и нацистской Германии. «Евгеника» — это мнение о том, что мы должны улучшить генетику человеческого рода; часто пропагандируются такие практики, как селекционное разведение, принудительная стерилизация «неполноценных» и «нежелательных» (людей с генетическими нарушениями или нежелательными характеристиками или чертами, людей с ограниченными возможностями, людей других рас, людей других этнических групп, гомосексуалистов) и эвтаназия.




