Предметно методическая комиссия: Утверждены составы центральных предметно-методических комиссий Всероссийской олимпиады
Состав центральной предметно-методической комиссии по литературе Всероссийской олимпиады школьников
Состав центральной предметно-методической комиссии по литературе Всероссийской олимпиады школьников
(утвержден приказом Министерства образования и науки Российской Федерации от 20 января 2014 г. № 27)
|
Волков Сергей Владимирович |
|
учитель литературы Государственного образовательного учреждения города Москвы центра образования № 57 «Пятьдесят седьмая школа» |
|
Павловец Михаил Георгиевич |
|
заведующий кафедрой русской и зарубежной литературы и методики Института гуманитарных наук государственного бюджетного образовательного учреждения высшего профессионального образования города Москвы «Московский городской педагогический университет», кандидат филологических наук |
|
Абелюк Евгения Семеновна |
|
учитель литературы Государственного бюджетного образовательного учреждения города Москвы лицея № 1525 «Воробьевы горы» |
|
Бак Дмитрий Петрович |
|
заведующий кафедрой истории русской литературы новейшего времени федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Российский государственный гуманитарный университет», кандидат филологических наук |
|
Беляева Наталья Васильевна |
|
главный научный сотрудник лаборатории дидактики литературы федерального государственного научного учреждения Института содержания и методов обучения Российской академии образования, доктор педагогических наук |
|
Граблина Нина Васильевна |
|
учитель русского языка и литературы муниципального бюджетного общеобразовательного учреждения «Гимназия № 5», г. |
|
Добрынина Ирина Владимировна |
|
заведующая кафедрой филологии муниципального автономного общеобразовательного учреждения города Новосибирска гимназии № 6 «Горностай» |
|
Дмитренко Сергей Федорович |
|
шеф-редактор журнала «Литература» Издательского дома «Первое сентября», кандидат филологических наук |
|
Зыкова Галина Владимировна |
|
профессор филологического факультета федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Московский государственный университет имени М.В. Ломоносова», доктор филологических наук |
|
Леденев Александр Владимирович |
|
профессор кафедры истории русской литературы XX-XXI веков федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Московский государственный университет имени М. |
|
Пашук Нелли Михайловна |
|
заведующая кафедрой литературы муниципального бюджетного общеобразовательного учреждения лицея № 31 г. Челябинска |
|
Пенская Елена Наумовна |
|
декан факультета филологии федерального государственного автономного учреждения высшего профессионального образования «Национальный исследовательский университет «Высшая школа экономики», доктор филологических наук, профессор |
|
Свирина Наталья Михайловна |
|
заведующая кафедрой общей и специальной педагогики негосударственного образовательного учреждения высшего профессионального образования «Институт специальной педагогики и психологии», доктор педагогических наук |
|
Сухих Игорь Николаевич |
|
профессор кафедры истории русской литературы филологического факультета федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Санкт-Петербургский государственный университет», доктор филологических наук |
|
Храмцова Римма Анатольевна |
|
учитель русского языка и литературы государственного бюджетного образовательного учреждения города Москвы гимназии № 1514 |
Методические цикловые комиссии
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
УЛЬЯНОВСКИЙ КОЛЛЕДЖ ГРАДОСТРОИТЕЛЬСТВА И ПРАВА[ ВЕРСИЯ САЙТА ДЛЯ СЛАБОВИДЯЩИХ ]
| Методически цикловые комиссии | |
Методические материалы МЦК Общеобразовательных учебных дисциплин и общих гуманитарных социально-экономических дисциплинМЦК математических и общих естественно-научных дисциплин МЦК специальности 21.  02.06 «Информационные системы обеспечения градостроительной деятельности» 02.06 «Информационные системы обеспечения градостроительной деятельности»профессии 08.01.24 «Мастер столярно-плотничных, паркетных и стекольных работ» профессии 08.01.25 «Мастер отделочных строительных и декоративных работ» профессии 35.02.03 «Технология деревообработки» МЦК специальности 08.02.05 «Строительство и эксплуатация автомобильных дорог и аэродромов», специальности 08.02.08 «Монтаж и эксплуатация оборудования и систем газоснабжения» МЦК 07.02.01 «Архитектура», 08.02.01 «Строительство и эксплуатация зданий и сооружений»Архив отчетов за 2013-2019 учебный год Положение о предметно-цикловой комиссии | Научно-методическая работа является важной составляющей деятельности образовательного учреждения СПО. Ее содержание определяется целями и задачами работы колледжа, особенностями его развития и образовательной политикой региона. Методическая деятельность в Ульяновском колледже градостроительства и права организована через работу методических цикловых комиссий, которые определяют основные направления и формы методической работы. Методические цикловые комиссии — это объединения преподавателей нескольких смежных учебных дисциплин по специальности. Они созданы для учебно-программного, учебно-методического и воспитательного обеспечения освоения учебных дисциплин по специальностям, а также для совершенствования методического и профессионального мастерства преподавателей. Особым направлением деятельности методических цикловых комиссий является организация научно-исследовательской деятельности студентов. В рамках работы методической цикловой комиссии ежемесячно обсуждаются вопросы, касающиеся оптимизации учебного процесса, совершенствования методической базы, новинок в сфере образования. В колледже традиционно проводятся недели МЦК. Неделя МЦК – это неделя педагогического творчества, возможность показать себя и научиться новому, передовому. В последнее время стали популярны массовые учебно-воспитательные мероприятия (деловые игры, викторины, конкурсы, научно-практические конференции, олимпиады), подготовленные преподавателями из разных методических цикловых комиссий. Это способствует всестороннему развитию студента, так как в процессе подготовки такого мероприятия комплексно раскрываются способности каждого обучающегося
|
Методология исследования: III. Предметы | Encyclopedia.com
Отбор лиц для участия в исследованиях включает не только научные решения о соответствующих критериях участия, но и этические решения о распределении выгод и бремени. В The Belmont Report (1979) Национальная комиссия США по защите людей, являющихся субъектами биомедицинских и поведенческих исследований, назвала три этических принципа основой исследовательской этики. Первое, уважение к людям, и второе, благодеяние, анализировались чаще и глубже, чем третье, справедливость. Следователи, регулирующие органы и институциональные наблюдательные советы (IRB) привыкли применять принцип благодеяния, изучая соотношение риска и пользы, и применять принцип уважения к людям, изучая информированное согласие. Но третий принцип — выбор субъектов по справедливости — часто рассматривался последним и только в одном из его аспектов — защите уязвимых групп от эксплуатации в качестве субъектов.
Первое, уважение к людям, и второе, благодеяние, анализировались чаще и глубже, чем третье, справедливость. Следователи, регулирующие органы и институциональные наблюдательные советы (IRB) привыкли применять принцип благодеяния, изучая соотношение риска и пользы, и применять принцип уважения к людям, изучая информированное согласие. Но третий принцип — выбор субъектов по справедливости — часто рассматривался последним и только в одном из его аспектов — защите уязвимых групп от эксплуатации в качестве субъектов.
Эта ситуация меняется по мере того, как лица и группы, ранее исключенные из исследований по причине уязвимости, ищут доступ к тому, что они считают исследовательскими преимуществами, в первую очередь к возможности испытать новые лекарства от серьезных и опасных для жизни заболеваний. Однако сама концепция уязвимости подвергается более тщательному анализу как нечеткая и слишком широкая. В своей статье 2001 года « Уязвимость в субъектах исследования, » Кеннет Кипнис предложил новую таксономию уязвимости, которую он определил как ограничения возможности дать информированное согласие. Он выделил шесть типов уязвимости, основанных на характеристиках личности или общества:
Он выделил шесть типов уязвимости, основанных на характеристиках личности или общества:
- когнитивные: способность понимать информацию и принимать решения;
- юридический: нахождение под законной властью кого-либо, например тюремного надзирателя;
- почтительный: обычное подчинение медицинским или другим властям;
- медицинский: заболевание, от которого нет лечения;
- распределение: бедность или отсутствие образования; и
- инфраструктура: пределы исследовательской установки для выполнения протокола.
По данным Национальной комиссии США, правосудие имеет отношение к выбору субъектов на двух уровнях: социальном и индивидуальном. На индивидуальном уровне «исследователи [должны] проявлять справедливость: таким образом, они не должны предлагать потенциально полезные исследования только некоторым пациентам, которые им нравятся, или выбирать только «нежелательных» лиц для рискованных исследований» (Национальная комиссия США, стр. 7). ). На социальном уровне «[должны] проводиться различия между классами субъектов, которые должны и не должны участвовать в каком-либо конкретном виде исследований, исходя из способности членов этого класса нести бремя и на уместности возложения дальнейшее бремя уже обремененных лиц» (Национальная комиссия США, стр. 7). В частности, по соображениям социальной справедливости классы субъектов должны ранжироваться (например, взрослые перед детьми), а некоторые классы потенциальных субъектов (например, заключенные и помещенные в лечебные учреждения психически больные) должны выбираться только при определенных условиях и, возможно, не должны вообще выбран.
7). ). На социальном уровне «[должны] проводиться различия между классами субъектов, которые должны и не должны участвовать в каком-либо конкретном виде исследований, исходя из способности членов этого класса нести бремя и на уместности возложения дальнейшее бремя уже обремененных лиц» (Национальная комиссия США, стр. 7). В частности, по соображениям социальной справедливости классы субъектов должны ранжироваться (например, взрослые перед детьми), а некоторые классы потенциальных субъектов (например, заключенные и помещенные в лечебные учреждения психически больные) должны выбираться только при определенных условиях и, возможно, не должны вообще выбран.
Очень немногие философы или другие ученые предложили стандарты для установления приоритетов при выборе предметов. Ганс Йонас (1970) предложил «убывающий порядок допустимости» для «призыва» субъектов. По его мнению, сами исследователи должны быть первыми, кто испытает новую терапию, поскольку они могут лучше всего понять риски и преимущества. Полагая, что очень больные или умирающие пациенты особенно уязвимы для приглашений исследователей, Джонас выступал против использования их в исследованиях, не связанных напрямую с их лечением.
Полагая, что очень больные или умирающие пациенты особенно уязвимы для приглашений исследователей, Джонас выступал против использования их в исследованиях, не связанных напрямую с их лечением.
Другой подход заключался в утверждении обязательства участвовать в биомедицинских исследованиях. Артур Л. Каплан (1984) утверждал, что исследование является формой добровольного социального сотрудничества, которое порождает обязательства справедливости и взаимности. Если компетентный человек добровольно обращается за помощью в больницу или учреждение, проводящее биомедицинские исследования, он или она получает выгоду от исследования и должен участвовать в его расходах (т. е. участвовать). Это обязательство является общим, а не обязательством добровольно участвовать в первом доступном испытании или каком-либо конкретном испытании.
Выбор наименее уязвимых
В основе этих различных взглядов лежит предположение, что исследования рискованны или, по крайней мере, обременительны. Если это так, субъекты должны выбираться таким образом, чтобы защищать тех, чьи социальные, демографические или экономические характеристики делают их особенно уязвимыми для принуждения и эксплуатации. Добровольное участие в исследованиях рассматривается либо как обязанность, которую нужно выполнять, либо как альтруистический поступок, заслуживающий одобрения. Этот акцент на защите уязвимых лиц понятен, учитывая знаменательное событие в современной истории этики клинических исследований — жестокие и часто фатальные эксперименты, проведенные над несогласными заключенными нацистскими врачами во время Второй мировой войны (Caplan, 19).92). Общественное мнение в Соединенных Штатах также было сформировано разоблачениями неэтичных экспериментов, таких как исследование сифилиса в Таскиги среди бедных чернокожих издольщиков (Джонс), исследования гепатита В в Уиллоубруке в учреждении для умственно отсталых детей (Rothman, 1982) и еврейское исследование. Больничные исследования хронических заболеваний, в которых живые раковые клетки вводили неосведомленным пожилым пациентам (Кац, Капрон и Гласс).
Если это так, субъекты должны выбираться таким образом, чтобы защищать тех, чьи социальные, демографические или экономические характеристики делают их особенно уязвимыми для принуждения и эксплуатации. Добровольное участие в исследованиях рассматривается либо как обязанность, которую нужно выполнять, либо как альтруистический поступок, заслуживающий одобрения. Этот акцент на защите уязвимых лиц понятен, учитывая знаменательное событие в современной истории этики клинических исследований — жестокие и часто фатальные эксперименты, проведенные над несогласными заключенными нацистскими врачами во время Второй мировой войны (Caplan, 19).92). Общественное мнение в Соединенных Штатах также было сформировано разоблачениями неэтичных экспериментов, таких как исследование сифилиса в Таскиги среди бедных чернокожих издольщиков (Джонс), исследования гепатита В в Уиллоубруке в учреждении для умственно отсталых детей (Rothman, 1982) и еврейское исследование. Больничные исследования хронических заболеваний, в которых живые раковые клетки вводили неосведомленным пожилым пациентам (Кац, Капрон и Гласс). Самой влиятельной отдельной статьей была статья Генри Ноулза Бичера, уважаемого анестезиолога, опубликованная в Медицинский журнал Новой Англии в 1966 году; в нем описана серия исследований в крупных научно-исследовательских учреждениях, в ходе которых испытуемые подвергались риску и в которых исследователям не удалось получить информированное согласие (Rothman, 1991).
Самой влиятельной отдельной статьей была статья Генри Ноулза Бичера, уважаемого анестезиолога, опубликованная в Медицинский журнал Новой Англии в 1966 году; в нем описана серия исследований в крупных научно-исследовательских учреждениях, в ходе которых испытуемые подвергались риску и в которых исследователям не удалось получить информированное согласие (Rothman, 1991).
Отношение к исследованиям как к рискованным по своей природе, а к объектам исследования как к нуждающимся в защите по своей сути начало меняться в начале 1980-х годов, но маятник может вернуться к более осторожному взгляду в свете редких, но получивших широкую огласку смертей субъектов исследования. 19 сентября99 Джесси Гелсингер, восемнадцать лет, умер при переносе генов. Эллен Рош и Хойян Ван, молодые «нормальные, здоровые добровольцы», умерли в ходе испытаний в Университете Джона Хопкинса и Рочестерском университете соответственно (Steinbrook, 2002a, 2002b). Научные исследования в нескольких известных медицинских центрах были временно прекращены после того, как были выявлены недостатки в их процедурах.
Фактический риск в большинстве научных исследований обычно считается довольно низким, но недавние данные отсутствуют. Комиссия президента США по изучению этических проблем в медицине, биомедицинских и поведенческих исследованиях (1982) попросил три крупных научно-исследовательских учреждения обобщить свой опыт в области связанных с исследованиями травм. Каждая группа обнаружила очень низкую частоту побочных эффектов. В одном учреждении из более чем 8000 субъектов, участвующих в 157 протоколах, было зарегистрировано только три побочных эффекта, в том числе две головные боли после спинномозговой пункции. Однако определение «побочного эффекта» является расплывчатым, особенно среди больных людей, и возможно, что о многих побочных эффектах не сообщается, поскольку они считаются не связанными с исследованием.
Совместное использование результатов исследований
Преимущества в уравнении приобретают больший вес при принятии индивидуальных решений. Пациенты и группы защиты требуют большей автономии и меньшего патернализма в выборе предметов. Отчаянно больные пациенты настойчиво заявляют, что они готовы променять более высокий уровень риска на потенциальные преимущества многообещающих новых процедур, устройств или лекарств. Защитники прав женщин и детей отмечают, что обычное исключение или недостаточная представленность этих групп населения в клинических испытаниях означает, что лекарства, когда они будут одобрены, будут назначаться им без прямых данных о дозировке, эффективности или побочных эффектах. Эти тенденции были вызваны энергичными, иногда конфронтационными усилиями лиц с синдромом приобретенного иммунодефицита (СПИД). Эта пропаганда также подчеркивала включение групп с ограниченным доступом к судебным разбирательствам, в основном женщин и меньшинств (C. Levine, 1988, 1993).
Отчаянно больные пациенты настойчиво заявляют, что они готовы променять более высокий уровень риска на потенциальные преимущества многообещающих новых процедур, устройств или лекарств. Защитники прав женщин и детей отмечают, что обычное исключение или недостаточная представленность этих групп населения в клинических испытаниях означает, что лекарства, когда они будут одобрены, будут назначаться им без прямых данных о дозировке, эффективности или побочных эффектах. Эти тенденции были вызваны энергичными, иногда конфронтационными усилиями лиц с синдромом приобретенного иммунодефицита (СПИД). Эта пропаганда также подчеркивала включение групп с ограниченным доступом к судебным разбирательствам, в основном женщин и меньшинств (C. Levine, 1988, 1993).
Повышенное внимание к проблемам женского здоровья дало некоторую информацию о вербовке субъектов. Изучая включение женщин в клинические испытания, Главное бухгалтерское управление США проанализировало практику Национальных институтов здравоохранения (NIH) и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (Nadel; Главное бухгалтерское управление США, 1992). В обоих случаях было установлено, что женщины недостаточно представлены. Обзор FDA показал, что женщины были представлены в каждом клиническом испытании пятидесяти трех препаратов, одобренных FDA за предыдущие три с половиной года. Однако для более чем 60 процентов препаратов доля женщин в испытании была меньше, чем доля женщин с соответствующим заболеванием. Женщины были особенно недостаточно представлены в испытаниях сердечно-сосудистых препаратов, хотя сердечно-сосудистые заболевания являются основной причиной смерти среди женщин.
В обоих случаях было установлено, что женщины недостаточно представлены. Обзор FDA показал, что женщины были представлены в каждом клиническом испытании пятидесяти трех препаратов, одобренных FDA за предыдущие три с половиной года. Однако для более чем 60 процентов препаратов доля женщин в испытании была меньше, чем доля женщин с соответствующим заболеванием. Женщины были особенно недостаточно представлены в испытаниях сердечно-сосудистых препаратов, хотя сердечно-сосудистые заболевания являются основной причиной смерти среди женщин.
Приводя доводы в пользу более широких критериев включения в клинические испытания, защитники интересов пациентов и некоторые клиницисты отметили, что в интересах качественного медицинского обслуживания лекарства следует тестировать на группах населения, которые будут их использовать. Это убеждение противоречит более традиционному исследовательскому взгляду на отбор субъектов, который фокусируется на тестировании лекарств на небольшой однородной популяции, чтобы как можно быстрее выявить различия в эффективности и побочных эффектах.
Даже при расширенных критериях включения не все пациенты, желающие получить доступ к многообещающим новым препаратам, могут быть включены в клинические испытания, поскольку они не соответствуют критериям включения, живут слишком далеко от исследовательского центра или испытания уже закрыты. Было разработано несколько других механизмов, таких как «параллельный путь», при котором квалифицированные пациенты, которые не могут участвовать в клинических испытаниях, могут получить многообещающее лекарство через своего врача («Расширенная доступность», 19).92). Общественные исследования, особенно в области рака и СПИДа, также сделали клинические испытания более доступными для пациентов.
NIH формализовал движение к более широкому выбору предметов, обязав получателей исследовательских грантов включать соответствующее количество женщин и представителей меньшинств (Kirschstein). Закон о возрождении NIH 1993 г. (Pub. L. 103–43) расширил пересмотренную политику NIH, потребовав от директора NIH обеспечить, чтобы женщины и представители групп меньшинств были включены в каждый проект, финансируемый из федерального бюджета. Директор может отказаться от требования, если включение является неуместным по состоянию здоровья, цели исследования или любым другим обстоятельствам. Однако стоимость не считается допустимой причиной для отказа от включения женщин и представителей групп меньшинств.
Директор может отказаться от требования, если включение является неуместным по состоянию здоровья, цели исследования или любым другим обстоятельствам. Однако стоимость не считается допустимой причиной для отказа от включения женщин и представителей групп меньшинств.
Однако эта тенденция имеет ограничения. Включение беременных женщин в клинические испытания по-прежнему вызывает споры, если только исследование не направлено на пользу плоду, например испытания по предотвращению передачи вируса иммунодефицита человека (ВИЧ) от матери к плоду, связанного со СПИДом. Некоторые возражения против включения беременных женщин основаны на этических опасениях, например, по поводу того, что плод, который не может дать согласие, подвергается риску. Большинство опасений основано на страхе перед юридической ответственностью, если плод родится с травмой, которая может быть связана с исследуемым препаратом. Другие группы субъектов, защита которых по-прежнему считается необходимой, включают детей (Левин, 19 лет). 91), заключенных и психически больных. Другие группы, которые иногда называют уязвимыми, включают пожилых людей, военнослужащих, сотрудников фармацевтических компаний и студентов-медиков. Хотя для этих людей некоторые условия и некоторые протоколы могут быть принудительными, в целом они могут делать выбор добровольно. В некоторых случаях были установлены специальные процедуры для обеспечения добровольности (см., например, Winter, о Министерстве обороны США).
91), заключенных и психически больных. Другие группы, которые иногда называют уязвимыми, включают пожилых людей, военнослужащих, сотрудников фармацевтических компаний и студентов-медиков. Хотя для этих людей некоторые условия и некоторые протоколы могут быть принудительными, в целом они могут делать выбор добровольно. В некоторых случаях были установлены специальные процедуры для обеспечения добровольности (см., например, Winter, о Министерстве обороны США).
С социальной точки зрения справедливый выбор субъектов означает, что группы, несущие бремя исследования, также должны получать его выгоды. Противники исследований в тюрьмах утверждают, что плоды исследований — недавно одобренные лекарства — редко доступны в таких условиях. Точно так же, хотя многие испытания лекарств проводились в странах третьего мира, эти страны часто настолько бедны или настолько не имеют медицинских услуг, что они не могут позволить себе обеспечить своих граждан испытанными лекарствами.
В последнее время представители стран третьего мира и плохо обслуживаемых сообществ в Соединенных Штатах требуют большей роли в распределении пособий (Лурье и др. ; Национальная комиссия США по СПИДу; Томас и Куинн). Их согласие участвовать в клинических испытаниях лекарств иногда обусловлено обещанием спонсоров испытаний предоставить что-то полезное для населения — лекарство, если оно окажется эффективным, или инфраструктуру здравоохранения, необходимую для проведения терапии. Испытания эффективности вакцин, для которых требуются тысячи субъектов, не могут проводиться без доброй воли и участия лидеров сообщества. Консультации с общественностью, в ходе которых исследователи и представители общественности сотрудничают в разработке и проведении испытания, становятся частой стратегией, направленной на то, чтобы обеспечить решение вопросов, вызывающих обеспокоенность группы потенциальных испытуемых и их представителей.
; Национальная комиссия США по СПИДу; Томас и Куинн). Их согласие участвовать в клинических испытаниях лекарств иногда обусловлено обещанием спонсоров испытаний предоставить что-то полезное для населения — лекарство, если оно окажется эффективным, или инфраструктуру здравоохранения, необходимую для проведения терапии. Испытания эффективности вакцин, для которых требуются тысячи субъектов, не могут проводиться без доброй воли и участия лидеров сообщества. Консультации с общественностью, в ходе которых исследователи и представители общественности сотрудничают в разработке и проведении испытания, становятся частой стратегией, направленной на то, чтобы обеспечить решение вопросов, вызывающих обеспокоенность группы потенциальных испытуемых и их представителей.
Признавая важность социальной справедливости при распределении бремени и выгод, Совет международных организаций медицинских наук (CIOMS) в руководстве для международных исследований заявляет:
Перед проведением исследования среди населения или сообщества с ограниченными ресурсами, спонсор и исследователь должен приложить все усилия для обеспечения того, чтобы:
- исследование отвечало потребностям здравоохранения и приоритетам населения или сообщества, в котором оно должно проводиться; и
- любое вмешательство или продукт, или полученное знание, будут доступны в разумных пределах в интересах этого населения или сообщества.
 (CIOMS, стр. 19)
(CIOMS, стр. 19)
Директор 19 последнего переформулирования Хельсинкской декларации (1964 г., пересмотренной исследование проводится для того, чтобы извлечь выгоду из результатов исследования».
Справедливый отбор субъектов теперь включает оценку как необходимости защиты уязвимых лиц и групп, так и важности предоставления им максимального выбора при принятии окончательного решения об участии. В будущем еще больше внимания будет уделяться справедливому распределению результатов научных исследований.
Кэрол Левин
Томас У. ogletree (1995)
пересмотренная библиография
СМОТРИТЕ ТАКЖЕ: Старение и пожилые: вопросы здравоохранения и исследований; СПИД: вопросы здравоохранения и исследований; автоэксперимент; Автономность; Дети: вопросы здравоохранения и исследований; Принуждение; Коммерциализм в научных исследованиях; Эмбрион и плод: исследование эмбрионов; Эмпирические методы в биоэтике; Свобода и свободная воля; Генетика и поведение человека: научно-исследовательские проблемы; Холокост; Младенцы: государственная политика и правовые вопросы; Информированное согласие: вопросы согласия в исследованиях человека; Психически больные и умственно отсталые: вопросы исследования; военнослужащие как объекты исследования; меньшинства как объекты исследования; Патернализм; Педиатрия, Обзор этических проблем в; Государственная политика и биоэтика; Заключенные как объекты исследования; Раса и расизм; Исследования человека: исторические аспекты; Методология исследования; Исследования, многонациональные; Исследования, Неэтично; Обязанность; Научное издательство; сексизм; Студенты как объекты исследования; Добродетель и характер ; и др. Политика исследований подстатьи
Политика исследований подстатьи
БИБЛИОГРАФИЯ
Бичер, Генри К. 1966. «Этика и клинические исследования». Медицинский журнал Новой Англии 274 (24): 1354–1360.
Каплан, Артур Л. 1984. «Есть ли обязанность служить субъектом биомедицинских исследований?» IRB: Обзор исследований на людях 6(5): 1–5.
Каплан, Артур Л., изд. 1992. Когда медицина сошла с ума: биоэтика и Холокост. Тотова, Нью-Джерси: Humana.
Совет международных организаций медицинских наук (CIOMS) в сотрудничестве со Всемирной организацией здравоохранения. 2002. Международные этические рекомендации для биомедицинских исследований с участием человека. Женева, Швейцария: Автор.
«Расширенная доступность исследуемых новых препаратов посредством параллельного механизма для людей со СПИДом и другими заболеваниями, связанными с ВИЧ». 1992. Федеральный регистр 57(73): 13250–13259.
Йонас, Ганс. 1970. «Философские размышления об экспериментах с людьми». В экспериментах с людьми, изд. . Пол А. Фройнд. Нью-Йорк: Джордж Бразиллер.
В экспериментах с людьми, изд. . Пол А. Фройнд. Нью-Йорк: Джордж Бразиллер.
Джонс, Джеймс Х. 1993. Плохая кровь: Эксперимент по сифилису в Таскиги, новое и расширенное издание. Нью-Йорк: Свободная пресса.
Кац, Джей; Капрон, Александр М .; и Гласс, Элеонора Свифт, ред. 1972. Эксперименты с людьми: авторитет исследователя, предмет, профессии и положение в процессе экспериментов над людьми. Нью-Йорк: Фонд Рассела Сейджа.
Кипнис, Кеннет. 2001. Уязвимость субъектов исследования: биоэтическая таксономия. Bethesda, MD: Национальная консультативная комиссия по биоэтике.
Киршштейн, Рут Л. 1991. «Исследования женского здоровья». Американский журнал общественного здравоохранения 81(3): 291–293.
Левин, Кэрол. 1988. «Изменил ли СПИД этику исследований на людях?» Право, медицина и здравоохранение 16(3–4): 167–173.
Левин, Кэрол. 1991. «Дети в клинических испытаниях ВИЧ / СПИДа: все еще уязвимы после всех этих лет». Право, медицина и здравоохранение 19(3–4): 231–237.
Право, медицина и здравоохранение 19(3–4): 231–237.
Левин, Кэрол. 1993. «Женщины как предметы исследования: новые приоритеты, новые вопросы». В «Новые проблемы биомедицинской политики: ежегодный обзор», изд. . Роберт Х. Бланк и Андреа Л. Бонниксен. Нью-Йорк: Издательство Колумбийского университета.
Левин, Роберт Дж. 1984. «Какие типы субъектов могут понять этот протокол?» IRB: Обзор исследований на людях 6(5): 6–8.
Левин, Роберт Дж. 1988. Этика и регулирование клинических исследований, 2-е издание. Нью-Хейвен, Коннектикут: Издательство Йельского университета.
Лурье, Питер; Бишоу, Маконнен; Чесни, Маргарет А .; и другие. 1994. «Этические, поведенческие и социальные аспекты испытаний вакцины против ВИЧ в развивающихся странах». Журнал Американской медицинской ассоциации 271(4): 295–301.
Надель, Марк В. 1990. «Национальные институты здравоохранения: проблемы реализации политики в отношении женщин в исследуемых группах населения». Заявление Марка В. Наделя, заместителя директора по вопросам национального и общественного здравоохранения, отдел кадров, перед Подкомитетом по здравоохранению и окружающей среды, Комитет по энергетике и торговле, Палата представителей». ГАО/Т-HRD–90–38. Вашингтон, округ Колумбия: Главное бухгалтерское управление США.
Заявление Марка В. Наделя, заместителя директора по вопросам национального и общественного здравоохранения, отдел кадров, перед Подкомитетом по здравоохранению и окружающей среды, Комитет по энергетике и торговле, Палата представителей». ГАО/Т-HRD–90–38. Вашингтон, округ Колумбия: Главное бухгалтерское управление США.
Закон о возрождении национальных институтов здравоохранения. 1993. Публичное право США 103–43.
Ротман, Дэвид Дж. 1982. «Были ли Таскиги и Уиллоубрук« исследованиями природы »?» Отчет Гастингс-центра 12(2): 5–7.
Ротман, Дэвид Дж. 1991. Незнакомцы у постели больного: история того, как закон и биоэтика изменили процесс принятия медицинских решений. Нью-Йорк: Базовый.
Стейнбрук, Роберт. 2002а. «Защита объектов исследования: кризис в Университете Джонса Хопкинса». Медицинский журнал Новой Англии 346(10): 716–720.
Стейнбрук, Роберт. 2002б. «Улучшение защиты объектов исследования». Медицинский журнал Новой Англии 346(18): 1425–1430.
Томас, Стивен Б., и Куинн, Сандра Краус. 1991. «Исследование сифилиса в Таскиги, 1932–1972 годы: последствия для программ просвещения по вопросам ВИЧ и риска СПИДа в чернокожем сообществе». Американский журнал общественного здравоохранения 81(11): 1498–1504.
Главное бухгалтерское управление США. 1992. «Женское здоровье: FDA необходимо обеспечить дополнительное изучение гендерных различий в тестировании лекарств, отпускаемых по рецепту: отчет для инициаторов Конгресса». GAO/HRD–93–17. Вашингтон, округ Колумбия: Автор.
Национальная комиссия США по защите людей, являющихся субъектами биомедицинских и поведенческих исследований. 1979. Доклад Белмонта: Этические принципы и рекомендации по защите людей, являющихся субъектами исследований. Вашингтон, округ Колумбия: Типография правительства США.
Национальная комиссия США по СПИДу. 1992. Проблема ВИЧ/СПИДа в цветных сообществах, изд. . Линда С. Хамфри и Фрэнсис Порчер. Вашингтон, округ Колумбия: Автор.
Комиссия президента США по изучению этических проблем в медицине, биомедицинских и поведенческих исследованиях. 1982. Компенсация за исследовательские травмы: отчет об этических и правовых последствиях программ возмещения травм, причиненных биомедицинскими и поведенческими исследованиями. Вашингтон, округ Колумбия: Автор.
Уинтер, Филип Э. 19 лет84. «Обзор исследований человека в Министерстве обороны». IRB: Обзор исследований на людях 6(3): 9–10.
Всемирная медицинская ассоциация (WMA). 1964 г. (пересмотрено в 2000 г.). «Хельсинкская декларация: этические принципы медицинских исследований с участием людей». Ферне-Вольтер, Франция: Автор.
Хельсинкская декларация WMA – Этические принципы медицинских исследований с участием человека – WMA – Всемирная медицинская ассоциация
Принято 18 th WMA General Assembly, Helsinki, Finland, June 1964
and amended by the:
29 th WMA General Assembly, Tokyo, Japan, October 1975
35 th Генеральная ассамблея WMA, Венеция, Италия, октябрь 1983 г.
41 st Генеральная ассамблея WMA, Гонконг, сентябрь 1989 г. 19 октября96
52 nd WMA General Assembly, Edinburgh, Scotland, October 2000
53 rd WMA General Assembly, Washington DC, USA, October 2002 (Note of Clarification added)
55 th Генеральная ассамблея WMA, Токио, Япония, октябрь 2004 г. (добавлено разъяснение)0208
64 th Генеральная ассамблея WMA, Форталеза, Бразилия, октябрь 2013 г. исследования с участием людей, включая исследования идентифицируемых человеческих материалов и данных.
Декларация предназначена для чтения в целом, и каждый из ее составляющих пунктов должен применяться с учетом всех других соответствующих пунктов.
2. В соответствии с мандатом WMA, Декларация адресована в первую очередь врачам. WMA призывает всех, кто занимается медицинскими исследованиями с участием людей, принять эти принципы.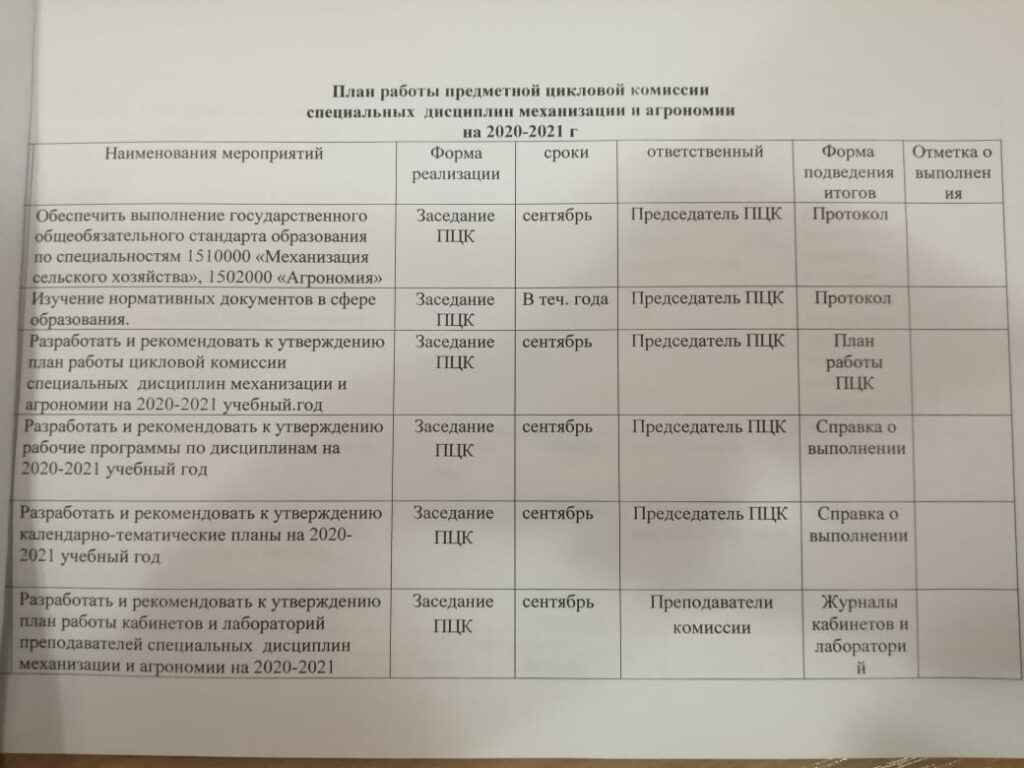
Общие положения
Принципы3. Женевская декларация ВМА обязывает врача словами: «Здоровье моего пациента будет моим главным соображением», а Международный кодекс медицинской этики заявляет, что «Врач должны действовать в интересах пациента при оказании медицинской помощи».
4. Обязанностью врача является укрепление и защита здоровья, благополучия и прав пациентов, в том числе тех, кто участвует в медицинских исследованиях. Знания и совесть врача посвящены выполнению этой обязанности.
5. Медицинский прогресс основан на исследованиях, которые в конечном итоге должны включать исследования с участием людей.
6. Основная цель медицинских исследований с участием людей состоит в том, чтобы понять причины, развитие и последствия заболеваний и улучшить профилактические, диагностические и терапевтические вмешательства (методы, процедуры и лечение). Даже самые лучшие проверенные вмешательства должны постоянно оцениваться посредством исследований на предмет их безопасности, эффективности, действенности, доступности и качества.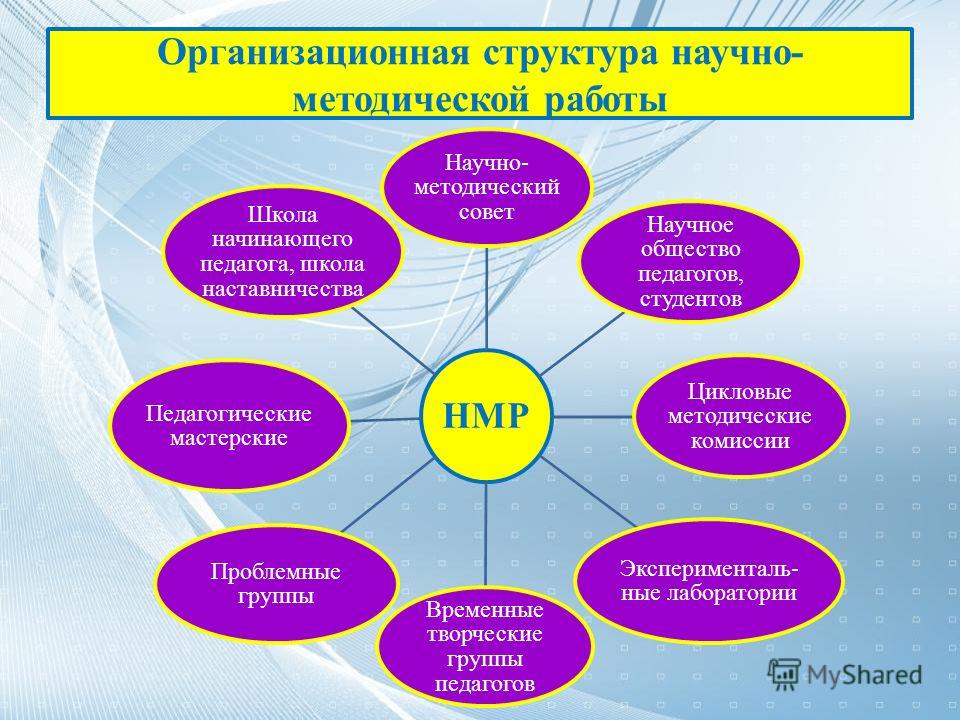
7. Медицинские исследования регулируются этическими стандартами, которые поощряют и обеспечивают уважение ко всем людям и защищают их здоровье и права.
8. Хотя основной целью медицинских исследований является получение новых знаний, эта цель никогда не может преобладать над правами и интересами отдельных субъектов исследования.
9. Врачи, участвующие в медицинских исследованиях, обязаны защищать жизнь, здоровье, достоинство, целостность, право на самоопределение, неприкосновенность частной жизни и конфиденциальность личной информации субъектов исследования. Ответственность за защиту испытуемых всегда должна лежать на враче или другом медицинском работнике, а не на испытуемых, даже если они дали согласие.
10. Врачи должны учитывать этические, правовые и нормативные нормы и стандарты для исследований с участием людей в своих странах, а также применимые международные нормы и стандарты. Никакие национальные или международные этические, юридические или нормативные требования не должны ограничивать или отменять какие-либо средства защиты субъектов исследований, изложенные в настоящей Декларации.
11. Медицинские исследования должны проводиться таким образом, чтобы свести к минимуму возможный вред окружающей среде.
12. Медицинские исследования с участием людей должны проводиться только лицами с соответствующим этическим и научным образованием, подготовкой и квалификацией. Исследования на пациентах или здоровых добровольцах требуют наблюдения компетентного врача с соответствующей квалификацией или другого медицинского работника.
13. Группам, недостаточно представленным в медицинских исследованиях, должен быть предоставлен соответствующий доступ к участию в исследованиях.
14. Врачи, которые совмещают медицинские исследования с оказанием медицинской помощи, должны привлекать своих пациентов к исследованиям только в той мере, в какой это оправдано их потенциальной профилактической, диагностической или терапевтической ценностью, и если у врача есть веские основания полагать, что участие в исследовании не окажет неблагоприятного воздействия на здоровье пациентов, являющихся субъектами исследования.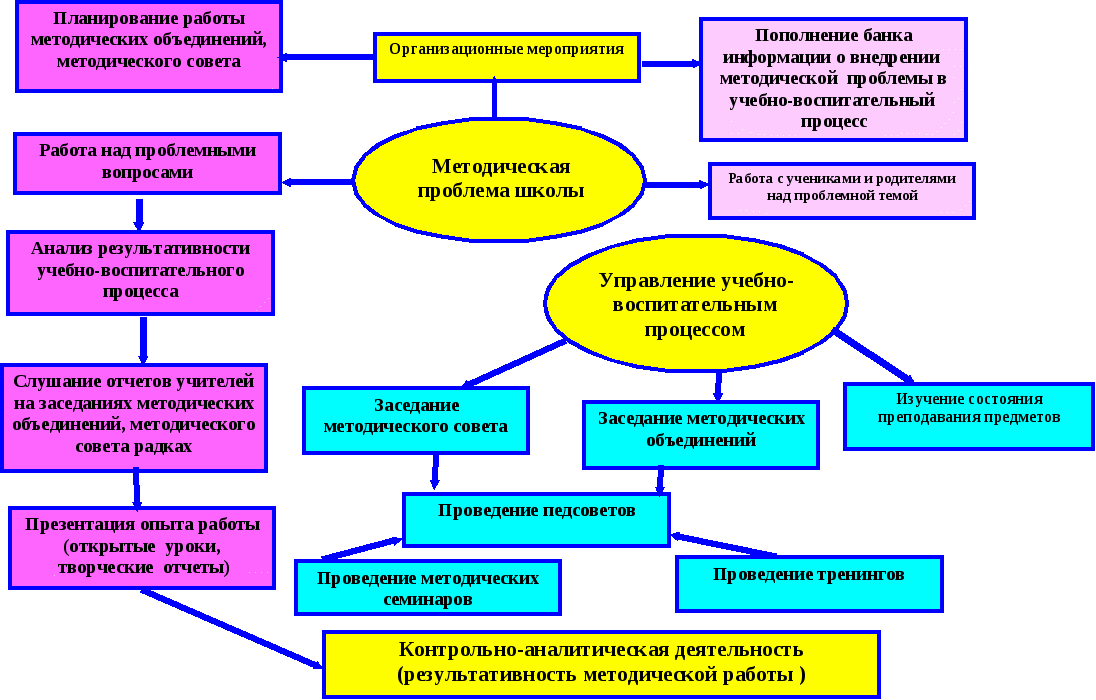
15. Субъектам, пострадавшим в результате участия в исследованиях, должны быть обеспечены соответствующая компенсация и лечение.
Риски,
Бремя и выгоды16. В медицинской практике и медицинских исследованиях большинство вмешательств связано с рисками и бременем.
Медицинские исследования с участием людей могут проводиться только в том случае, если важность цели перевешивает риски и бремя для субъектов исследования.
17. Всем медицинским исследованиям с участием людей должна предшествовать тщательная оценка предсказуемых рисков и бремени для отдельных лиц и групп, участвующих в исследовании, по сравнению с предсказуемой пользой для них и других лиц или групп, затронутых исследуемым заболеванием.
Необходимо принять меры по минимизации рисков. Риски должны постоянно отслеживаться, оцениваться и документироваться исследователем.
18. Врачи не могут участвовать в исследованиях с участием людей, если они не уверены, что риски были адекватно оценены и могут быть удовлетворительно устранены.
Когда обнаруживается, что риски перевешивают потенциальные выгоды, или когда имеются убедительные доказательства окончательных результатов, врачи должны решить, следует ли продолжать, модифицировать или немедленно прекратить исследование.
Уязвимые
Группы и отдельные лица19. Некоторые группы и отдельные лица особенно уязвимы и могут иметь повышенную вероятность того, что к ним будут применены несправедливости или они могут причинить дополнительный вред.
Все уязвимые группы и лица должны получать специально продуманную защиту.
20. Медицинские исследования с участием уязвимой группы оправданы только в том случае, если исследование отвечает потребностям или приоритетам этой группы в области здравоохранения и исследование не может быть проведено среди неуязвимой группы. Кроме того, эта группа должна получать пользу от знаний, практики или вмешательств, являющихся результатом исследования.
Научные
Требования и протоколы исследований 21. Медицинские исследования с участием людей должны соответствовать общепринятым научным принципам, основываться на глубоком знании научной литературы, других соответствующих источников информации, адекватных лабораториях и, при необходимости, , эксперименты на животных. Необходимо уважать благополучие животных, используемых для исследований.
Медицинские исследования с участием людей должны соответствовать общепринятым научным принципам, основываться на глубоком знании научной литературы, других соответствующих источников информации, адекватных лабораториях и, при необходимости, , эксперименты на животных. Необходимо уважать благополучие животных, используемых для исследований.
22. Дизайн и проведение каждого исследования с участием людей должны быть четко описаны и обоснованы в протоколе исследования.
Протокол должен содержать изложение связанных с этим этических соображений и должно указывать, как учитывались принципы, изложенные в настоящей Декларации. Протокол должен включать информацию о финансировании, спонсорах, принадлежности к учреждениям, потенциальных конфликтах интересов, стимулах для субъектов и информацию о положениях о лечении и/или компенсации субъектам, которые пострадали в результате участия в исследовании.
В клинических испытаниях протокол должен также описывать соответствующие меры для пост-испытательных условий.
23. Протокол исследования должен быть представлен для рассмотрения, комментирования, руководства и одобрения соответствующему комитету по этике исследований до начала исследования. Этот комитет должен быть прозрачным в своей работе, должен быть независимым от исследователя, спонсора и любого другого неправомерного влияния и должен быть должным образом квалифицирован. Он должен принимать во внимание законы и постановления страны или стран, в которых должно проводиться исследование, а также применимые международные нормы и стандарты, но они не должны сокращать или отменять какие-либо средства защиты объектов исследования, изложенные в настоящей Декларации.
Комитет должен иметь право контролировать текущие исследования. Исследователь должен предоставить комитету информацию о мониторинге, особенно информацию о любых серьезных нежелательных явлениях. Никакие изменения в протокол не могут быть внесены без рассмотрения и одобрения комитетом. После окончания исследования исследователи должны представить комитету окончательный отчет, содержащий краткое изложение результатов и выводов исследования.
После окончания исследования исследователи должны представить комитету окончательный отчет, содержащий краткое изложение результатов и выводов исследования.
24. Необходимо принять все меры предосторожности для защиты частной жизни субъектов исследования и конфиденциальности их личной информации.
Информированное
Согласие25. Участие лиц, способных дать информированное согласие, в качестве испытуемых в медицинских исследованиях должно быть добровольным. Хотя может быть уместно проконсультироваться с членами семьи или общественными деятелями, ни одно лицо, способное дать информированное согласие, не может быть включено в исследование, если оно добровольно не согласится.
26. В медицинских исследованиях с участием людей, способных дать информированное согласие, каждый потенциальный субъект должен быть надлежащим образом проинформирован о целях, методах, источниках финансирования, любых возможных конфликтах интересов, институциональной принадлежности исследователя, ожидаемых выгодах и потенциальных возможностях. риски исследования и дискомфорт, который оно может повлечь за собой, условия после исследования и любые другие соответствующие аспекты исследования. Потенциальный субъект должен быть проинформирован о праве отказаться от участия в исследовании или отозвать согласие на участие в любое время без каких-либо репрессалий. Особое внимание следует уделять конкретным информационным потребностям отдельных потенциальных субъектов, а также методам, используемым для предоставления информации.
риски исследования и дискомфорт, который оно может повлечь за собой, условия после исследования и любые другие соответствующие аспекты исследования. Потенциальный субъект должен быть проинформирован о праве отказаться от участия в исследовании или отозвать согласие на участие в любое время без каких-либо репрессалий. Особое внимание следует уделять конкретным информационным потребностям отдельных потенциальных субъектов, а также методам, используемым для предоставления информации.
Убедившись, что потенциальный субъект понял информацию, врач или другое лицо, имеющее соответствующую квалификацию, должно затем получить добровольное информированное согласие потенциального субъекта, предпочтительно в письменной форме. Если согласие не может быть выражено в письменной форме, неписьменное согласие должно быть официально задокументировано и засвидетельствовано.
Всем субъектам медицинских исследований должна быть предоставлена возможность быть проинформированными об общих результатах и результатах исследования.
27. При получении информированного согласия на участие в научном исследовании врач должен проявлять особую осторожность, если потенциальный субъект находится в зависимых отношениях с врачом или может дать согласие под принуждением. В таких ситуациях информированное согласие должно быть запрошено лицом с соответствующей квалификацией, которое полностью не зависит от этих отношений.
28. Для потенциального субъекта исследования, который не может дать информированное согласие, врач должен получить информированное согласие от законно уполномоченного представителя. Эти лица не должны быть включены в исследование, которое не принесет им никакой пользы, за исключением случаев, когда оно направлено на укрепление здоровья группы, представленной потенциальным субъектом, вместо этого исследование не может проводиться с участием лиц, способных дать информированное согласие, и исследование влечет за собой лишь минимальный риск и минимальное бремя.
29. Когда потенциальный субъект исследования, который считается неспособным дать информированное согласие, может дать согласие на решения об участии в исследовании, врач должен получить такое согласие в дополнение к согласию законно уполномоченного представителя. Несогласие потенциального субъекта следует уважать.
Несогласие потенциального субъекта следует уважать.
30. Исследования с участием субъектов, которые физически или психически неспособны дать согласие, например пациентов без сознания, могут проводиться только в том случае, если физическое или психическое состояние, препятствующее предоставлению информированного согласия, является необходимой характеристикой исследовательской группы. В таких обстоятельствах врач должен получить информированное согласие от законно уполномоченного представителя. Если такой представитель недоступен и если исследование не может быть отложено, исследование может быть продолжено без информированного согласия при условии, что конкретные причины привлечения субъектов с состоянием, которое делает их неспособными дать информированное согласие, были указаны в протоколе исследования и в самом исследовании. был одобрен комитетом по этике научных исследований. Согласие на продолжение исследования должно быть получено как можно скорее от испытуемого или его законного представителя.
31. Врач должен полностью проинформировать пациента о том, какие аспекты его лечения связаны с исследованием. Отказ пациента от участия в исследовании или решение пациента выйти из исследования ни в коем случае не должно отрицательно сказываться на отношениях между пациентом и врачом.
32. Для медицинских исследований с использованием идентифицируемых человеческих материалов или данных, таких как исследования материалов или данных, содержащихся в биобанках или аналогичных хранилищах, врачи должны получить информированное согласие на их сбор, хранение и/или повторное использование. Могут быть исключительные ситуации, когда согласие на такое исследование будет невозможно или неосуществимо. В таких ситуациях исследование может быть проведено только после рассмотрения и утверждения комитетом по этике исследований.
Использовать из Плацебо33. Польза, риски, бремя и эффективность нового вмешательства должны быть проверены в сравнении с лучшими проверенными вмешательствами, за исключением следующих обстоятельств:
При отсутствии доказательств вмешательство существует, допустимо использование плацебо или отсутствие вмешательства; или
Если по убедительным и научно обоснованным методологическим причинам использование любого вмешательства менее эффективно, чем наиболее проверенное, использование плацебо или отсутствие вмешательства необходимо для определения эффективности или безопасности вмешательства
, и пациенты, получающие какое-либо менее эффективное вмешательство, чем наиболее доказанное, плацебо или отсутствие вмешательства, не будут подвергаться дополнительным рискам серьезного или необратимого вреда в результате неполучения наилучшего доказавшего свою эффективность вмешательства.
Необходимо соблюдать крайнюю осторожность, чтобы не злоупотреблять этой опцией.
Пост-испытание Условия34. Перед клиническим испытанием спонсоры, исследователи и правительства принимающей страны должны обеспечить доступ после испытания для всех участников, которые все еще нуждаются во вмешательстве, которое было признано полезным в ходе испытания. Эта информация также должна быть раскрыта участникам в процессе получения информированного согласия.
Исследование Регистрация и публикация и распространение результатов35. Каждое исследование с участием людей должно быть зарегистрировано в общедоступной базе данных до набора первого субъекта.
36. Исследователи, авторы, спонсоры, редакторы и издатели несут этические обязательства в отношении публикации и распространения результатов исследований. Исследователи обязаны обнародовать результаты своих исследований на людях и несут ответственность за полноту и точность своих отчетов. Все стороны должны придерживаться общепринятых принципов этической отчетности. Отрицательные и неубедительные, а также положительные результаты должны быть опубликованы или иным образом обнародованы. Источники финансирования, институциональная принадлежность и конфликты интересов должны быть указаны в публикации. Отчеты об исследованиях, не соответствующие принципам настоящей Декларации, не должны приниматься к публикации.
Все стороны должны придерживаться общепринятых принципов этической отчетности. Отрицательные и неубедительные, а также положительные результаты должны быть опубликованы или иным образом обнародованы. Источники финансирования, институциональная принадлежность и конфликты интересов должны быть указаны в публикации. Отчеты об исследованиях, не соответствующие принципам настоящей Декларации, не должны приниматься к публикации.
37. При лечении отдельного пациента, когда не существует доказанных вмешательств или другие известные вмешательства оказались неэффективными, врач, после обращения за советом к специалисту, с информированного согласия пациент или его законный представитель может использовать недоказанное вмешательство, если, по мнению врача, оно дает надежду на спасение жизни, восстановление здоровья или облегчение страданий. Это вмешательство впоследствии должно стать объектом исследования, предназначенного для оценки его безопасности и эффективности.


 Дзержинский, Московская область, кандидат педагогических наук
Дзержинский, Московская область, кандидат педагогических наук В. Ломоносова», доктор филологических наук
В. Ломоносова», доктор филологических наук
 В процессе подготовки и проведения недели предметов МЦК проявляются профессиональные умения и черты личности каждого преподавателя, глубина знаний предмета, творческое отношение к работе, трудолюбие, внутренняя дисциплина.
В процессе подготовки и проведения недели предметов МЦК проявляются профессиональные умения и черты личности каждого преподавателя, глубина знаний предмета, творческое отношение к работе, трудолюбие, внутренняя дисциплина. (CIOMS, стр. 19)
(CIOMS, стр. 19)