Оксид элемента э с зарядом: Оксид элемента Э с зарядом ядра +16 соответствует общей формуле: 1. Э2О 2. ЭО 3. ЭО2 4. ЭО3
Тестовая контрольная работа по теме «Металлы» в 9 классе
Вариант 1.
Часть А. Тестовые задания с выбором ответа.
1 Химический элемент, имеющий схему строения атома +14 )2)8)4, в Периодической системе занимает положение:
А. 4-й период, главная подгруппа III группы.
Б. 2-й период, главная подгруппа IV группы.
В. 3-й период, главная подгруппа IV группы.
Г. 3-й период, главная подгруппа II группы.
2 Строение внешнего энергетического уровня 3s23p5 соответствует атому элемента:
А. Магния. В. Фосфора.
Б. Серы. Г. Хлора.
3 Элемент с наиболее ярко выраженными неметаллическими свойствами:
А. Кремний. В. Сера.
Б. Магний. Г. Фосфор.
4 Оксид элемента Э с зарядом ядра +16 соответствует общей формуле:
А. Э2О. Б. ЭО. В. ЭО2.
Г. ЭО3.
ЭО3.
5 характер свойств высшего оксида химического элемента с порядковым номером 7 в Периодической системе:
А. Амфотерный.
Б. Кислотный.
В. Основный.
6 Основные свойства наиболее ярко выражены у гидроксида:
А. Бария. В. Кальция.
Б. Бериллия. Г. Магния.
7 Схема превращения Cu+2 → Сu0 соответствует химическому уравнению:
А. CuO + H2 = Cu + H2O
Б. Cu + CL2 = CuCL2
В. CuO + 2HCL = CuCL2 + H2O
Г. 2Cu + O2 = 2CuO
8 Сокращённое ионное уравнение реакции Ba2+ + SO24— = BaSO4↓ соответствует взаимодействию:
А. Бария и раствора серной кислоты.
Б. Оксида бария и соляной кислоты.
В. Оксида бария и раствора серной кислоты.
Г. Хлорида бария и раствора серной кислоты.
9 Формула вещества, реагирующего с раствором гидроксида кальция:
А. HCL. В. H2O.
Б. CuO. Г. Mg.
10 Элементом Э в схеме превращений Э → ЭО2 → H2ЭО3 является:
А. Азот. В. Алюминий.
Б. Магний. Г. Углерод.
Часть Б. Задания со свободным ответом.
11 Напишите уравнение реакции между растворами гидроксида элемента с порядковым номером 3 и водородного соединения с порядковым номером 9 в Периодической системе. Назовите все вещества, укажите тип реакции.
12 В приведенной схеме V2O5 + AL = AL2O 3 + V определите степень окисления каждого элемента и расставьте коэффициенты методом электронного баланса.
13 Составьте
уравнение химической реакции, соответствующей схеме C0 → C+4. Укажите окислитель и восстановитель.
Укажите окислитель и восстановитель.
14 По схеме превращений BaO →1 Ba(OH) 2 →2 BaCO 3 →3 CaCL 2 составьте уравнения реакций в молекулярном виде. Для превращения 3 запишите полное и сокращенное ионные уравнения.
15 По уравнению реакции 2Mg + O2 = 2MgO рассчитайте объём кислорода (н. у.), необходимого для полного сгорания 1,2 г магния.
Вариант 2.
Часть А. Тестовые задания с выбором ответа.
1 Химический элемент, имеющий схему строения атома +8 )2)6, в Периодической системе занимает положение:
А. 2-й период, главная подгруппа VII группы.
Б. 2-й период, главная подгруппа VI группы.
В. 3-й период, главная подгруппа VI группы.
Г. 2-й период, главная подгруппа II группы.
2 Строение внешнего энергетического уровня 2s22p1 соответствует атому элемента:
А. Бора. В. Кремния.
Б. Серы. Г. Углерода.
3 Элемент с наиболее ярко выраженными металлическими свойствами:
А. Калий. В. Натрий.
Б. Литий. Г.Рубидий.
4 Оксид элемента Э с зарядом ядра +11 соответствует общей формуле:
А. Э2О. Б. ЭО. В. ЭО2. Г. ЭО3
5 Характер свойств высшего оксида химического элемента с порядковым номером 6 в Периодической системе:
А. Амфотерный.
Б. Кислотный.
В. Основный.
6 Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Алюминия. В. Углерода.
Углерода.
Б.Кремния. Г. Фосфора.
7 Схема превращения C0 → С+4 соответствует химическому уравнению:
А. CO2 + CaO= CaCO3
Б. CO2 + H2O = H2CO3
В. C + 2CuO = 2Cu+ CO 2
Г. 2C + O2 = 2CO
8 Сокращённое ионное уравнение реакции H+ + OH— = H2O соответствует взаимодействию:
А. Гидроксида меди (II) и раствора серной кислоты.
Б. Гидроксида натрия и раствора азотной кислоты.
В. Оксида меди (II) и соляной кислоты.
Г. Цинка и раствора серной кислоты.
9 Формула вещества, реагирующего с оксидом меди (II):
А. H2O. В.CaCL2.
Б. MgO. Г. H2SO4.
10 Элементом Э в схеме превращений Э → Э2О5 → H3ЭО4 является:
А.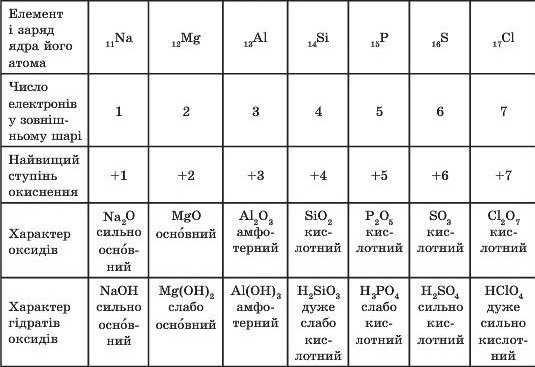 Азот. В. Углерод.
Азот. В. Углерод.
Б.Сера. Г. Фосфор.
Часть Б. Задания со свободным ответом.
11 Запишите уравнение реакции между растворами гидроксида элемента с порядковым номером 20 и водородного соединения элемента с порядковым номером 17 в Периодической системе. Назовите все вещества, укажите тип реакции.
12 В приведенной схеме PH3 + O2 → P2O 5 + H2O определите степень окисления каждого элемента и расставьте коэффициенты методом электронного баланса.
13 Составьте уравнение химической реакции, соответствующей схеме S0 →S-2. Укажите окислитель и восстановитель.
14 По схеме
превращений SO2 →1 SO3 →2 H2SO4 →3 Na2SO4составьте уравнения реакций в молекулярном
виде.
15 По уравнению реакции CaCO3 = CaO + CO2 рассчитайте массу оксида кальция, который образуется при разложении 200 г карбоната кальция.
Вариант 3.
Часть А. Тестовые задания с выбором ответа.
1 Химический элемент, имеющий схему строения атома +12 )2)8)2, в Периодической системе занимает положение:
А. 2-й период, главная подгруппа II группы.
Б. 2-й период, главная подгруппа VIII группы.
В. 3-й период, главная подгруппа II группы.
Г. 4-й период, главная подгруппа II группы.
2 Строение внешнего энергетического уровня 3s23p3 соответствует атому элемента:
А. Алюминия. В. Кремния.
Алюминия. В. Кремния.
Б. Железа. Г.Фосфора.
3 Элемент с наиболее ярко выраженными неметаллическими свойствами:
А.Германий. В.Олово.
Б.Кремний. Г.Углерод.
4 Оксид элемента Э с зарядом ядра +15 соответствует общей формуле:
А. ЭО. Б. ЭО2. В. Э2О5. Г. Э2О7.
5 Характер свойств высшего оксида химического элемента с порядковым номером 12 в Периодической системе:
А. Амфотерный.
Б. Кислотный.
В. Основный.
6 Основные свойства наиболее ярко выражены у гидроксида:
А.Алюминия. В. Магния.
Б.Кремния. Г. Натрия.
7 Схема превращения S+4 → S+6 соответствует химическому уравнению:
А. SO2 + CaO= CaSO3
Б. 2SO2+ O2 = 2SO3
В. H2SO4 + 2KOH =
K2SO4 + 2H2O
H2SO4 + 2KOH =
K2SO4 + 2H2O
Г. Fe + S= FeS
8 Сокращённое ионное уравнение реакции Cu2+ + 2OH— = Cu(OH) 2 ↓ соответствует взаимодействию:
А. Гидроксида меди (II) и соляной кислоты.
Б. Раствора нитрата меди (II) и гидроксида железа.
В. Оксида меди (II) и воды.
Г. Растворов хлорида меди (II) и гидроксида калия.
9 Формула вещества, реагирующего с оксидом углерода (IV):
А.NaOH. В. SO3.
Б. H2SO4. Г. HCL.
10 Элементом Э в схеме превращений Э → ЭO → Э(OH) 2
А. Алюминий. В. Железо.
Б.Барий. Г. Медь.
Часть Б. Задания со свободным ответом.
11 Напишите
уравнение реакции между растворами гидроксида элемента с порядковым номером 11
и водородного соединения с порядковым номером 16 в Периодической системе. Назовите все вещества, укажите тип реакции.
Назовите все вещества, укажите тип реакции.
12 В приведенной схеме Fe2O3 + CO → Fe + CO2 определите степень окисления каждого элемента и расставьте коэффициенты методом электронного баланса.
13 Составьте уравнение химической реакции, соответствующей схеме Fe0 → Fe+2. Укажите окислитель и восстановитель.
14 По схеме превращений C →1 CO2 →2 Na 2CO3 →3 CaCO3 составьте уравнения реакций в молекулярном виде. Для превращения 3 запишите полное и сокращенное ионные уравнения.
15 По уравнению реакции 2Cu + O2 = 2CuO рассчитайте массу оксида меди (II), который образуется при взаимодействии меди, взятой количестве, 11,2 л кислорода (н.у.).
Вариант
4.
Часть А. Тестовые задания с выбором ответа.
1 Химический элемент, имеющий схему строения атома +17 )2)8)7, в Периодической системе занимает положение:
А. 2-й период, главная подгруппа IIIгруппы.
Б. 2-й период, главная подгруппа VII группы.
В. 3-й период, главная подгруппа V группы.
Г. 3-й период, главная подгруппа VII группы.
2 Строение внешнего энергетического уровня 3s23p6 соответствует атому элемента:
А. Аргона. В. Никеля.
Б. Кислорода. Г. Хлора.
3 Элемент с наиболее ярко выраженными металлическими свойствами:
А. Алюминий. В. Магний.
Б. Кремний. Г. Натрий.
4 Оксид элемента Э с зарядом ядра +17 соответствует общей формуле:
А. ЭО. Б. ЭО2. В. Э2О5.
Г. Э2О7.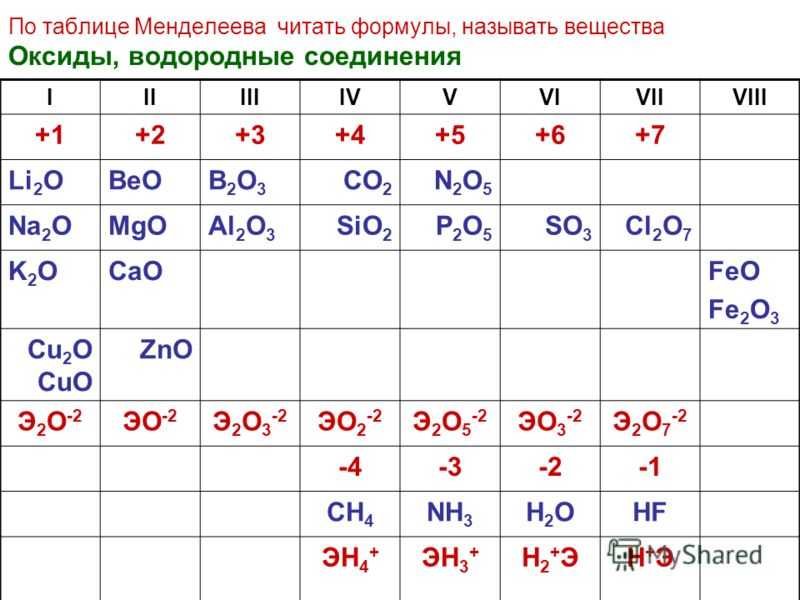
5 Характер свойств высшего оксида химического элемента с порядковым номером 13 в Периодической системе:
А. Амфотерный.
Б. Кислотный.
В. Основный.
6 Кислотные свойства наиболее ярко выражены у высшего гидроксида:
А. Азота. В.Бора.
Б. Бериллия. Г. Углерода.
7 Схема превращения N-3 → N+2 соответствует химическому уравнению:
А. NH3 + NCL = NH4CL
Б. N2 + 3H2 = 2NH3
В. 4NH3 + 3O2 = 2N2 + 6H2O
Г. 4NH3 + 5O2 = 4NO + 6H2O
8 Сокращённое ионное уравнение реакции Fe3+ + 3OH— = Fe(OH) 3 ↓ соответствует взаимодействию:
А. Оксида железа (III) и воды.
Б. Соляной кислоты и гидроксида железа (III).
В. Фосфата железа (III) и
раствора гидроксида натрия.
Г. Хлорид железа (III) и раствора гидроксида калия.
9 Формула вещества, реагирующего с разбавленной серной кислотой:
А. O2. В.Cu.
Б. CaO. Г. CO2.
10 Элементом Э в схеме превращений Э → Э2О→ ЭОH является:
А. Барий. В. Серебро.
Б.Литий. Г. Углерод.
Часть Б. Задания со свободным ответом.
11 Запишите уравнение реакции между растворами гидроксида элемента с порядковым номером 19 и водородного соединения элемента с порядковым номером 35 в Периодической системе. Назовите все вещества, укажите тип реакции.
12 В приведенной
схеме H 2 + O2 → H2O + S определите степень окисления
каждого элемента и расставьте коэффициенты методом электронного баланса.
13 Составьте уравнение химической реакции, соответствующей схеме Cu+2 →Cu0. Укажите окислитель и восстановитель.
14 По схеме превращений Li→1 Li 2O→2 LiOH →3 Li 2SO4составьте уравнения реакций в молекулярном виде. Для превращения 3 запишите полное и сокращенное ионные уравнения.
15 По уравнению реакции 2AL + 3CL2 = 2ALCL 3 рассчитайте объём хлора (н.у.), необходимого для получения 0,1 моль хлорида алюминия.
Контрольная работа по теме «Введение»
Контрольная работа №1 по теме «Введение». ВАРИАНТ -1
Часть 1
А 1. Химический элемент, имеющий схему строения атома + 8 )2)6, в Периодической системе занимает положение:
1) 2-й период, главная подгруппа VII группа
2) 2-й период, главная подгруппа VI группа
3) 3-й период, главная подгруппа VI группа
4) 2-й период, главная подгруппа II группа
А 2. Элемент с наиболее ярко выраженными металлическими свойствами:
Элемент с наиболее ярко выраженными металлическими свойствами:
1) калий 3) натрий
2) литий 4) рубидий
А 3. Оксид элемента Э с зарядом ядра + 11 соответствует общей формуле:
1) Э2О 3) ЭО2
2) ЭО 4) ЭО3
А 4. Схема превращений C0 → C+4 соответствует химическому уравнению:
1) CO2 + СаО = CаСО3 3) C + 2CuO = 2Cu + CO2
2) CO2 + Н2О = Н2СО3 4) 2C + O2 = 2CO
А 5. Элементом Э в схеме превращений Э → Э2О5 → Н3ЭО4 является:
1) азот 3) углерод
2 ) сера 4) фосфор
Контрольная работа №1 по теме «Введение». ВАРИАНТ -2
Часть 1
А 1. Химический элемент, имеющий схему строения атома + 12 )2)8)2, в Периодической системе занимает положение:
1) 2-й период, главная подгруппа II группа
2) 2-й период, главная подгруппа VIII группа
3) 3-й период, главная подгруппа II группа
4) 4-й период, главная подгруппа II группа
А 2. Элемент с наиболее ярко выраженными неметаллическими свойствами:
Элемент с наиболее ярко выраженными неметаллическими свойствами:
1) германий 3) олово
2) кремний 4) углерод
А 3. Оксид элемента Э с зарядом ядра + 15 соответствует общей формуле:
1) ЭО 3) Э2О5
2) ЭО2 4) Э2О7
А 4. Схема превращений S+4 → S+6 соответствует химическому уравнению:
1) SO2 + CaO = CaSO3 3) H2SO4 + 2KOH = K2SO4 + 2H2O
2) 2SO2 + O2 = 2SO3 4) Fe + S = FeS
А 5. Элементом Э в схеме превращений Э → ЭО→ Э(ОH)2 является:
1) алюминий 3) железо
2) барий 4) медь
А 6. Верны ли следующие высказывания?
А. В периоде с увеличением порядкового номера элемента радиус атома увеличивается.
Б. В периоде с увеличением порядкового номера элемента радиус атома не изменяется.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2
В1. Установите соответствие между атомом и строением внешнего энергетического уровня:
Частица: Распределение электронов:
А) C 1) … 1s1
Б) Li2) … 2s1
В) O3) … 2s22p4
Г) Si4) … 3s23p2
5) … 4s2 4p4
6) … 2s22p2
В 2. В реакцию с раствором соляной кислоты вступают:
1) цинк 4) карбонат натрия
2) гидроксид магния 5) хлорид бария
3) оксид натрия6) оксид серы (VI)
Часть 3
С 1. По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения.
По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения.
С → СО2 → Na2CO3 → CaCO3
А 6. Верны ли следующие высказывания?
А. В группе с увеличением порядкового номера элемента кислотные свойства гидроксидов усиливаются.
Б. В группе с увеличением порядкового номера элемента кислотные свойства гидроксидов ослабевают.
1) верно только А 3) верно только Б
2) верны оба суждения 4) оба суждения не верны
Часть 2
В1. Установите соответствие между атомом и строением внешнего энергетического уровня:
Частица: Распределение электронов:
А) Mg 1) … 3s23p5
Б) K2) … 3s2
В) Cl3) … 4s1
Г) S4) … 4s2 4p2
5) … 2s22p6
6) … 3s23p4
В 2. С раствором гидроксида натрия реагируют (приведитереакции):
С раствором гидроксида натрия реагируют (приведитереакции):
1) сульфат меди (II) 4) азотная кислота
2) оксид меди (II) 5) магний
3) гидроксид калия6) оксид углерода (IV)
Часть 3
С 1. По схеме превращений составьте уравнения реакций в молекулярном виде. Для превращения № 3 запишите полное и сокращенное ионные уравнения.
SO2 → SO3 → H2SO4 → Na2SO4
Ответы.
Система оценивания работы.
Часть 1 включает 6 заданий базового уровня (А1 – А6). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За каждый правильный ответ дается 1 балл. Максимальный балл за 1 часть – 6 баллов.
Часть 2 состоит из 2 заданий повышенного уровня (В1 – В2), на которые надо дать краткий ответ в виде числа или последовательности цифр. За каждый правильный ответ ты получишь 2 балла. Максимальный балл за 2 часть – 4 балла.
За каждый правильный ответ ты получишь 2 балла. Максимальный балл за 2 часть – 4 балла.
Часть 3 содержит 1 наиболее сложное, объемное задание С1 , которое требует полного ответа. За правильное выполнение задания ты можешь получить 3 балла.
Баллы, полученные за выполненные задания, суммируются. Постарайся набрать наибольшее количество баллов. Максимальный первичный балл – 13 баллов.
0 – 6 баллов – «2» 7 – 9 баллов – «3»
10 – 11 баллов – «4» 12 – 13 баллов – «5»
Часть 1
А1 | А2 | А3 | А4 | А5 | А6 | |
Вариант 1 | 2 | 4 | 1 | 3 | 4 | 1 |
Вариант 2 | 3 | 4 | 3 | 2 | 2 | 4 |
Часть 2
В1 | В2 | |
Вариант 1 | 2316 | 146 |
Вариант 2 | 3234 | 124 |
Часть 3
Вариант 1
2SO2+O2→ 2SO3
SO3+ H2O→ H2SO4
H2SO4+2NaOH→ Na2SO4+ 2H2O
Вариант 2
С+O2 → СО2
СО2+ 2NaOH→ H2O + Na2CO3
Na2CO3 + Ca(OH)2 →CaCO3+2NaOH
Оксид | химическое соединение | Британика
оксид железа
Посмотреть все СМИ
- Ключевые люди:
- Джозеф Пристли
- Похожие темы:
- воды оксид серы глинозем оксид титана оксидный минерал
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
оксид , любое из большого и важного класса химических соединений, в которых кислород связан с другим элементом. За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
За исключением более легких инертных газов (гелия [He], неона [Ne], аргона [Ar] и криптона [Kr]), кислород (O) образует по крайней мере один бинарный оксид с каждым из элементов.
И металлы, и неметаллы могут достигать наивысших степеней окисления (т. е. отдавать максимальное количество доступных валентных электронов) в соединениях с кислородом. Щелочные и щелочноземельные металлы, а также переходные и постпереходные металлы (в их низших степенях окисления) образуют ионные оксиды, т. е. соединения, содержащие О 2- анион. Металлы с высокими степенями окисления образуют оксиды, связи которых имеют более ковалентный характер. Неметаллы также образуют ковалентные оксиды, которые обычно имеют молекулярный характер. Плавное изменение типа связи в оксидах от ионных к ковалентным наблюдается по мере того, как периодическая таблица перемещается от металлов слева к неметаллам справа. Такая же вариация наблюдается в реакции оксидов с водой и обусловленном этим кислотно-основном характере продуктов. Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ion) и образующиеся в результате основные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. в таблице).
Ионные оксиды металлов реагируют с водой с образованием гидроксидов (соединений, содержащих OH − ion) и образующиеся в результате основные растворы, в то время как большинство оксидов неметаллов реагируют с водой с образованием кислот и образующихся кислотных растворов ( см. в таблице).
| группа 1 | группа 2 | группа 13 | группа 14 | группа 15 | группа 16 | группа 17 | |
|---|---|---|---|---|---|---|---|
Источник: Из W. Robinson, J. Odom, and H. Holtzclaw, Jr., Chemistry: Concepts and Models, DC Heath and Co. , 1992. , 1992. | |||||||
| реакция оксидов с водой и кислотно-щелочной характер гидроксидов | Na 2 O дает NaOH (сильное основание) | MgO дает Mg(OH) 2 (слабое основание) | Al 2 O 3 нереагирующий | SiO 2 нереагирующий | P 4 O 10 дает H 3 PO 4 (слабая кислота) | SO 3 дает H 2 SO 4 (сильная кислота) | Кл 2 O 7 дает HClO 4 (сильная кислота) |
| связывание в оксидах | Na 2 O ионный | ионный MgO | Al 2 O 3 ионный | SiO 2 ковалентная | P 4 O 10 ковалентная | СО 3 ковалентный | Cl 2 O 7 ковалентная |
Некоторые органические соединения реагируют с кислородом или другими окислителями с образованием веществ, называемых оксидами. Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Так, амины, фосфины и сульфиды образуют аминооксиды, фосфиноксиды и сульфоксиды соответственно, в которых атом кислорода ковалентно связан с атомом азота, фосфора или серы. Так называемые оксиды олефинов представляют собой циклические эфиры.
Оксиды металлов представляют собой твердые кристаллические вещества, содержащие катион металла и анион оксида. Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Щелочные металлы и щелочноземельные металлы образуют три различных типа бинарных соединений кислорода: (1) оксиды, содержащие оксид-ионы, O 2– , (2) пероксиды, содержащие пероксид-ионы, O 2 2– , которые содержат ковалентные одинарные связи кислород-кислород, и (3) супероксиды, содержащие ионы супероксида, O 2 − , которые также имеют ковалентные связи кислород-кислород, но имеют на один отрицательный заряд меньше, чем ионы перекиси. Щелочные металлы (имеющие степень окисления +1) образуют оксиды M 2 O, пероксиды M 2 O 2 и супероксиды MO 2 . (M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2 Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
(M представляет собой атом металла.) Щелочноземельные металлы (со степенью окисления +2) образуют только оксиды, MO, и пероксиды, MO 2 . Все оксиды щелочных металлов могут быть получены нагреванием соответствующего нитрата металла с элементарным металлом.
2МНО 3 + 10M + тепло → 6M 2 O + N 2 Общее получение оксидов щелочноземельных металлов включает нагревание карбонатов металлов.
MCO 3 + тепло → MO + CO 2 Как оксиды щелочных металлов, так и оксиды щелочноземельных металлов являются ионными и реагируют с водой с образованием основных растворов гидроксида металла.
M 2 O + H 2 O → 2MOH (где M = металл группы 1)
MO + H 2 O → M(OH) 2 (где M = металл группы 2)
Поэтому эти соединения часто называют основными оксидами. В соответствии со своим основным поведением они реагируют с кислотами в типичных кислотно-щелочных реакциях с образованием солей и воды; Например,
М 2 O + 2HCl → 2MCl + H 2 O (где M = металл группы 1). Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Эти реакции также часто называют реакциями нейтрализации. Наиболее важными основными оксидами являются оксид магния (MgO), хороший проводник тепла и электрический изолятор, который используется в огнеупорном кирпиче и теплоизоляции, и оксид кальция (CaO), также называемый негашеной известью или известью, широко используемый в сталелитейной промышленности и в воде. очищение.
Тщательно изучены периодические тренды оксидов. В любой данный период связь в оксидах прогрессирует от ионной к ковалентной, а их кислотно-основной характер меняется от сильно основного к слабоосновному, амфотерному, слабокислому и, наконец, сильнокислому. Как правило, основность увеличивается вниз по группе (например, в оксидах щелочноземельных металлов BeO < MgO < CaO < SrO < BaO). Кислотность увеличивается с увеличением степени окисления элемента. Например, из пяти оксидов марганца MnO (в котором марганец имеет степень окисления +2) является наименее кислотным, а Mn 2 O 7 (содержащий Mn 7+ ) наиболее кислый. Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; Например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; Например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах.
Оксиды переходных металлов со степенями окисления +1, +2 и +3 представляют собой ионные соединения, состоящие из ионов металлов и ионов оксидов. Эти оксиды переходных металлов со степенями окисления +4, +5, +6 и +7 ведут себя как ковалентные соединения, содержащие ковалентные связи металл-кислород. Как правило, ионные оксиды переходных металлов являются основными. То есть они будут реагировать с водными кислотами с образованием растворов солей и воды; Например,
СоО + 2Н 3 О + → Co 2+ + 3H 2 О.
Оксиды со степенями окисления +5, +6 и +7 являются кислыми и реагируют с растворами гидроксида с образованием солей и воды; Например,
CrO 3 + 2OH — → CrO 4 2− + H 2 O.
Оксиды со степенью окисления +4 обычно являются амфотерными (от греческого amphoteros, «в обоих направлениях»), что означает, что эти соединения могут вести себя либо как кислоты, либо как основания. Амфотерные оксиды растворяются не только в кислых, но и в основных растворах. Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2− . Амфотеризм среди оксидов основной группы в первую очередь обнаруживается у металлоидных элементов или их близких соседей.
Например, оксид ванадия (VO 2 ) представляет собой амфотерный оксид, растворяющийся в кислоте с образованием синего иона ванадила, [VO] 2+ , и в основании с образованием желто-коричневого гипованадат-иона, [V 4 O 9 ] 2− . Амфотеризм среди оксидов основной группы в первую очередь обнаруживается у металлоидных элементов или их близких соседей.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
номеров окисления
номеров окисленияНомера окисления
Часто полезно следить за химическими реакциями, наблюдая за изменениями в окислении
числа атомов в каждом соединении во время реакции. Окислительные числа также играют важную роль.
важную роль в систематической номенклатуре химических соединений. По определению окисление Число атома 90 248 — это заряд, который атом имел бы, если бы соединение состояло из
ионы.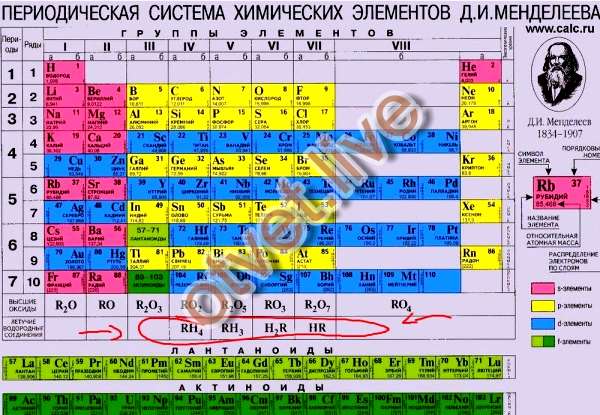
1. Степень окисления атома равна нулю в нейтральном веществе, содержащем атомы. только одного элемента. Таким образом, атомы в O 2 , О 3 , П 4 , С 8 , и металлический алюминий имеют степень окисления 0,
.2. Степень окисления простых ионов равна заряду иона. Окисление число натрия в ионе Na + равно +1, например, а степень окисления хлор в ионе Cl — равен -1.
3. Степень окисления водорода +1, когда он объединен с неметаллом как в CH 4 , NH 3 , H 2 O и HCl.
4. Степень окисления водорода равна -1, когда он соединяется с металлом как дюймов LiH, NaH, CaH 2 и LiAlH 4 .
5. Металлы группы IA образуют соединения (такие как Li 3 N и Na 2 S) в котором атом металла имеет степень окисления +1.
6. Элементы группы IIA образуют соединения (такие как Mg 3 Н 2 и
CaCO 3 ), в котором атом металла имеет степень окисления +2.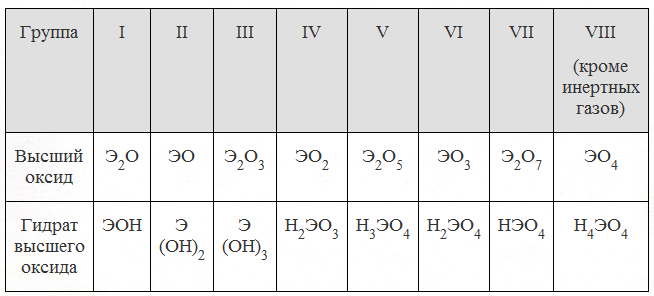
7. Кислород обычно имеет степень окисления -2. Исключение составляют молекулы и многоатомные ионы, содержащие связи O-O, такие как O 2 , O 3 , H 2 O 2 , и ион O 2 2-.
8. Элементы группы VIIA часто образуют соединения (такие как AlF 3 , HCl и ZnBr 2 ), в котором неметалл имеет степень окисления -1.
9. Сумма степеней окисления нейтрального соединения равна нулю.
Н 2 О: 2(+1) + (-2) = 0
10. Сумма степеней окисления в многоатомном ионе равна заряду на ион. Степень окисления атома серы в ионе SO 4 2- должна быть +6, например, потому что сумма степеней окисления атомов в этом ионе должна равно -2.
SO 4 2- : (+6) + 4(-2) = -2
11. Элементы в нижнем левом углу периодической таблицы.
с большей вероятностью имеют положительные степени окисления, чем те, которые расположены в правом верхнем углу
угол стола. Сера имеет положительную степень окисления в SO 2 , для
Например, потому что он ниже кислорода в периодической таблице.
Сера имеет положительную степень окисления в SO 2 , для
Например, потому что он ниже кислорода в периодической таблице.
ТАК 2 : (+4) + 2(-2) = 0
| Практическая задача 6: Назовите следующие ионные соединения. (а) Fe(NO 3 ) 3 (б) SrCO 3 (в) Na 2 SO 3 (г) Ca(ClO) 2 Нажмите здесь, чтобы проверить свой ответ на практическое задание 6 |
| Практическая задача 7: Присвойте степени окисления атомов в следующих соединениях. (а) Ал 2 О 3 (б) XeF 4 (в) К 2 Cr 2 О 7 Нажмите здесь, чтобы проверить ваш ответ на практическое задание 7 |
| Практическая задача 8: Расположите следующие соединения в
порядке возрастания степени окисления атома углерода. |


