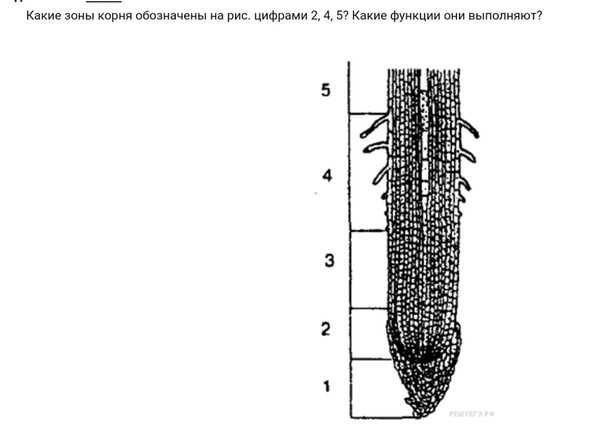
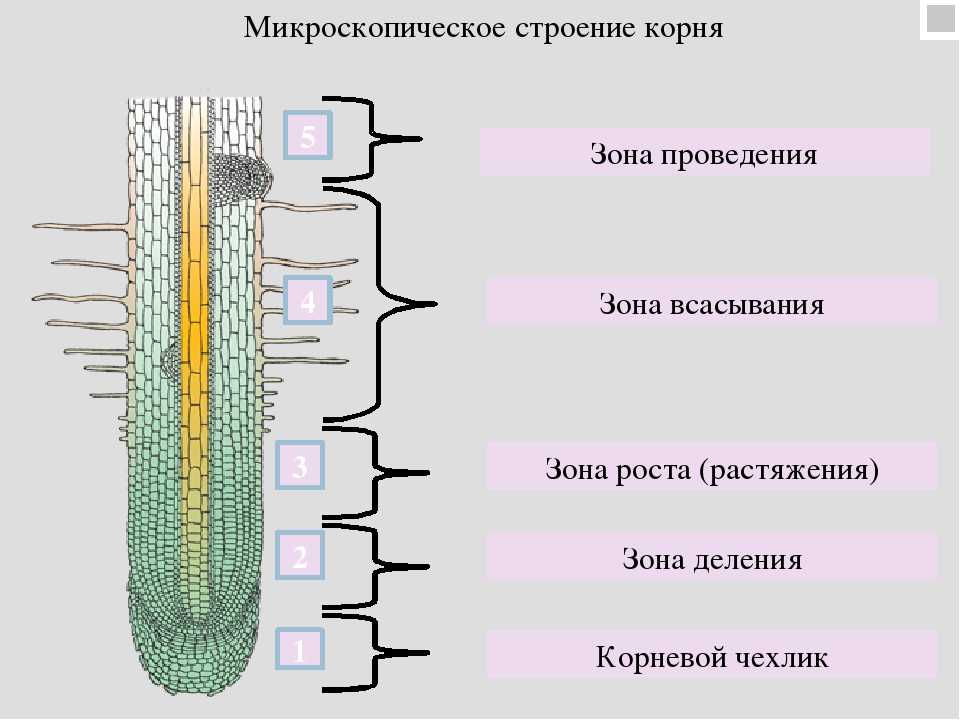
На рисунке изображен фрагмент микроскопического строения корня: На рисунке изображен фрагмент микроскопического строения корня. Какой цифрой на нем обозначена зона всасывания? 1) 1 2) 2 3) 3 4) 4
Ткани (растения и животные)
Задание № 2
Ткани (растения и животные)
1. Какой тип ткани изображён на рисунке?
1) соединительная
2) мышечная
3) нервная
4) Эпителиальная
2. Какой орган человека в своём строении не содержит гладкую мышечную ткань?
- аорта 2) желудок 3) сердце 4) пищевод
3. Какая ткань не участвует в образовании органов человека?
1) жировая
2) плотная волокнистая
3) проводящая
4) Хрящевая
4. Какая ткань изображена на рисунке?
1) эпителиальная
2) мышечная
3) Нервная
4) соединительная
5. Высшие растения отличаются от грибов тем, что
1) их организмы образованы из тканей и органов
2) они состоят из клеток, имеющих ядро
3) у них в процессе дыхания образуется углекислый газ
4) они не способны к активному движению
6.
1) жировая
2) эпителиальная
3) образовательная
4) Хрящевая
7. На рисунке под каким номером изображён реснитчатый эпителий?
8. На рисунке под каким номером изображён железистый эпителий?
1) 2) 3) 4)
9. Какая ткань изображена на рисунке?
- Эпителиальная
2) соединительная
3) нервная
4) Мышечная
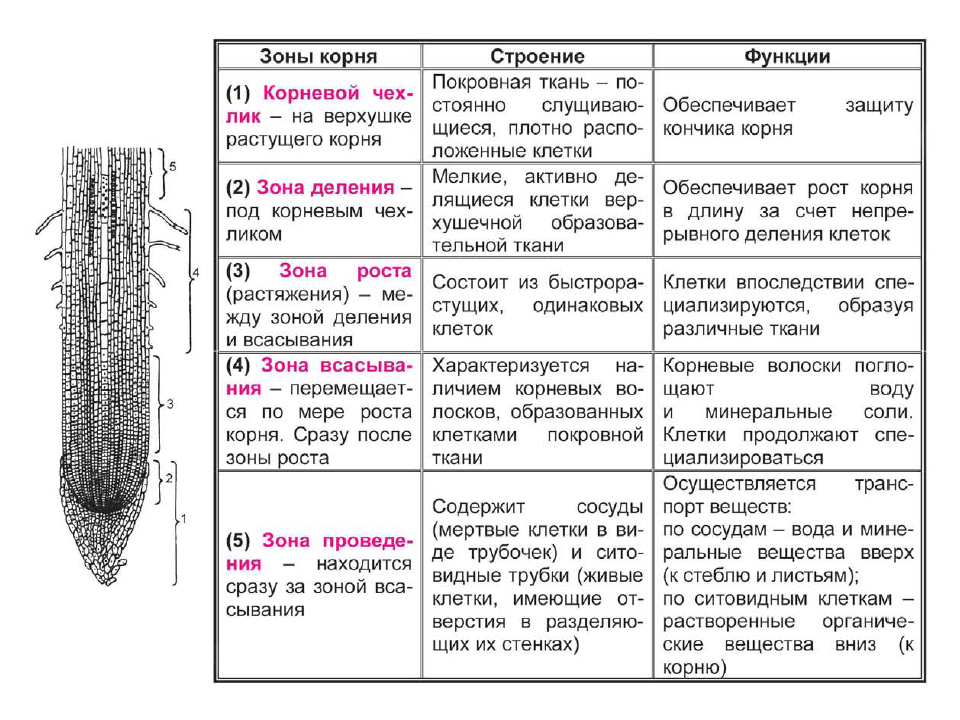
10. Какая ткань выполняет в организме человека защитную и секреторную функции?
1) поперечнополосатая мышечная
2) гладкая мышечная
3) эпителиальная
4) Соединительная
11. Какая ткань в организме человека выстилает стенку желудка изнутри?
1) рыхлая волокнистая
2) плотная волокнистая
3) эпителиальная
4) Мышечная
12. Вставьте в текст «Животные ткани» пропущенные термины из предложенного перечня, используя для этого цифровые обозначения.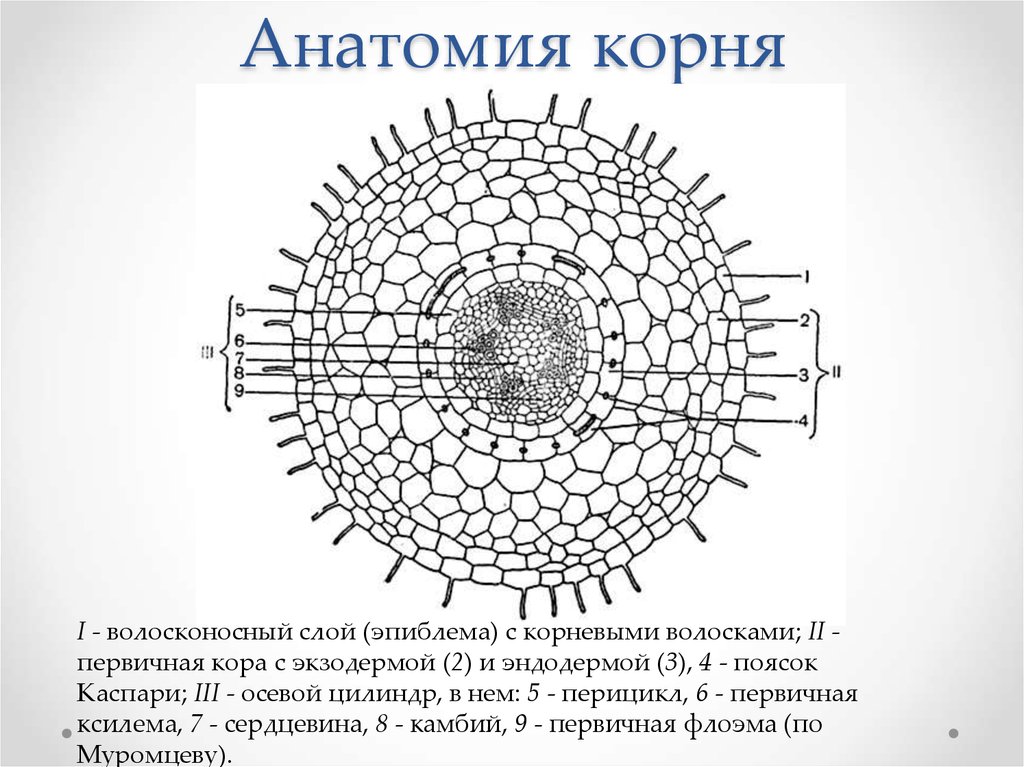
ЖИВОТНЫЕ ТКАНИ
У взрослого человека более 200 различных типов клеток, которые объединяют в
__________ (А) группы. К самым разнообразным по строению относят __________ (Б) ткани. Их главной особенностью является хорошо развитое __________ (В). У крови и __________ (Г) межклеточное вещество называют плазмой. В животном организме ткани выполняют разнообразные функции.
ПЕРЕЧЕНЬ ТЕРМИНОВ:
1) жировая ткань 2) мышечные 3) межклеточное вещество
4) Четыре 5) питательное вещество 6) соединительные
7) Три 8) лимфа
13. Соединительную ткань от эпителиальной можно отличить по
- количеству ядер в клетках
2) количеству межклеточного вещества
3) поперечной исчерченности
4) размерам клеток
14. Какая растительная ткань постоянно делится?
1) запасающая
2) основная
3) образовательная
4) Проводящая
15. Какая ткань образует поверхностный слой кожи человека?
Какая ткань образует поверхностный слой кожи человека?
1) соединительная
2) мышечная
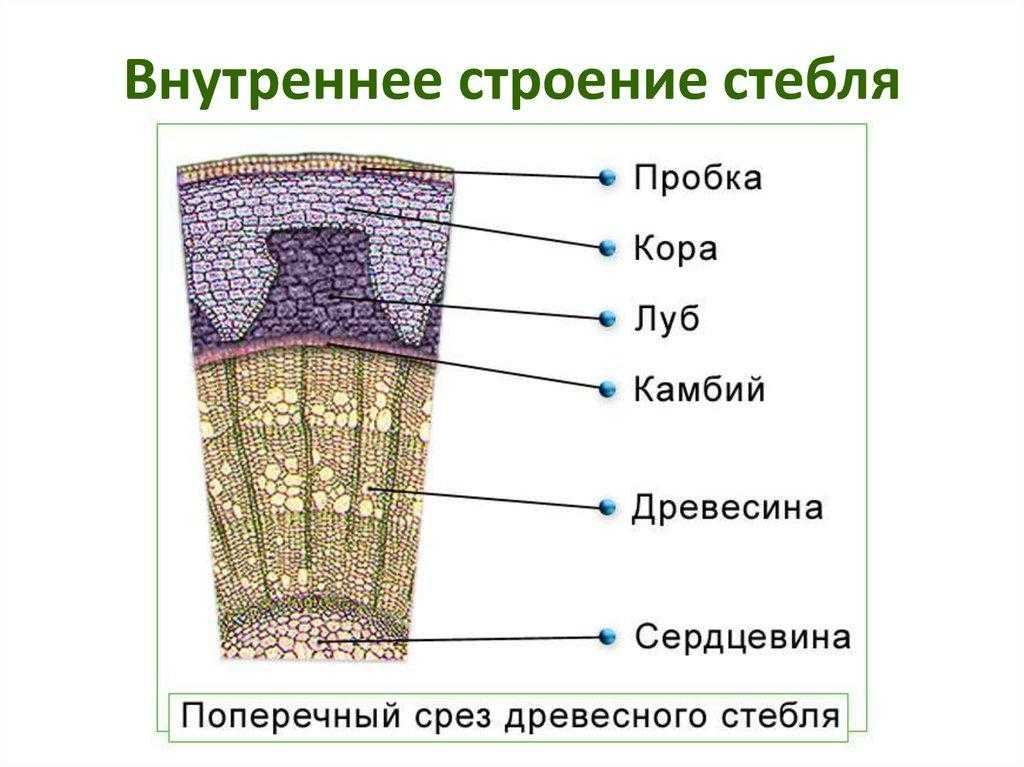
3) Нервная
4) Эпителиальная
16. Какую ткань относят к животным?
1) механическую
2) проводящую
3) основную
4) Лимфу
17. Клетки какой ткани способны выделять в полость органов ферменты?
1) соединительная
2) эпителиальная
3) мышечная
4) нервная
18. Какая ткань изображена на рисунке?
1) эпителиальная
2) соединительная
3) нервная
4) Мышечная
19. Какая особенность строения характеризует все виды соединительных тканей?
1) состоят из одинаковых по форме клеток
2) имеют хорошо развитое межклеточное вещество
3) включают в себя клетки, пропитанные минеральными солями
4) содержат в межклеточном веществе эластические волокна
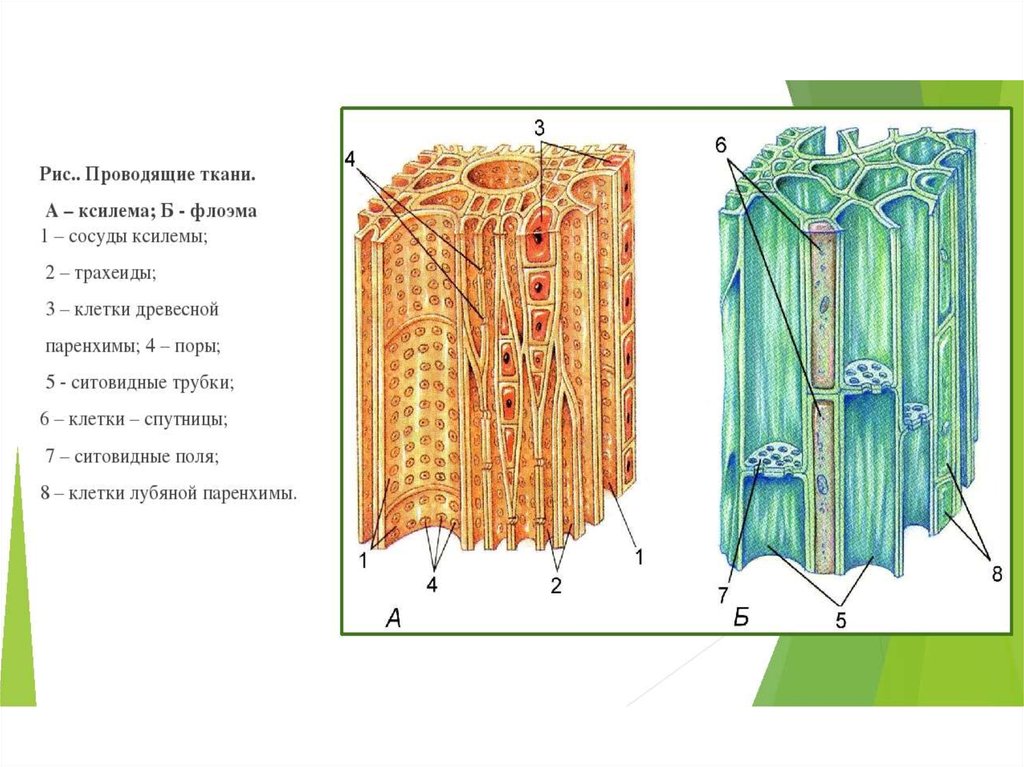
20. Проводящая ткань растений, по клеткам которой осуществляется передвижение органических веществ, состоит из
1) сосудов
2) ситовидных трубок
3) волокон
4) клеток с волосками
21.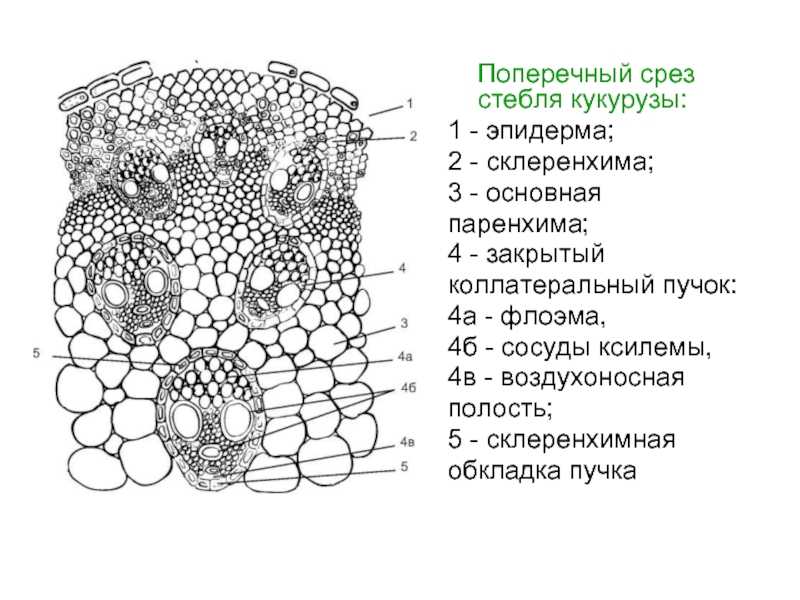 Волокно как особый вид механической ткани сильно развито в стебле
Волокно как особый вид механической ткани сильно развито в стебле
1) кукурузы
2) томата
3) льна-долгунца
4) тюльпана
22. Установите соответствие между характеристикой и видом растительной ткани, к которому её относят: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ХАРАКТЕРИСТИКА ВИД РАСТИТЕЛЬНОЙ ТКАНИ
1) Механическая 2) фотосинтезирующая
А) состоит из клеток, содержащих хлоропласты
Б) образована клетками с толстыми прочными стенками
В) входит в состав древесины
Г) обеспечивает синтез органических веществ из
неорганических на свету
Д) заполняет внутреннее пространство листовой пластинки
Е) образована в основном мёртвыми клетками
23. Составной частью какой ткани являются лимфоциты?
1) мышечной
2) нервной
3) эпителиальной
4) Соединительной
24. Какой тканью образованы сухожилия опорно-двигательного аппарата человека?
1) эпителиальной
2) соединительной
3) гладкой мышечной
4) поперечнополосатой мышечной
25. Вставьте в текст «Нервная ткань человека » пропущенные термины из предложенного перечня, используя для этого цифровые обозначения. Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность цифр (по тексту) впишите в приведённую ниже таблицу.
Вставьте в текст «Нервная ткань человека » пропущенные термины из предложенного перечня, используя для этого цифровые обозначения. Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность цифр (по тексту) впишите в приведённую ниже таблицу.
НЕРВНАЯ ТКАНЬ ЧЕЛОВЕКА
Главные клетки, образующие нервную ткань, называют __________ (А). Они состоят из тела и цитоплазматических отростков. Один из отростков нервной клетки обычно длиннее всех остальных, это __________ (Б). Также от нервной клетки отходят один или несколько коротких, сильно ветвящихся отростков; их называют __________ (В). Скопление тел и коротких отростков в центральной нервной системе образуют __________ (Г).
ПЕРЕЧЕНЬ ТЕРМИНОВ:
1) клетка-спутник 2) нейрон 3) нефрон
4) Дендрит 5) аксон 6) серое вещество
7) белое вещество 8) нервный узел
26. В какой ткани межклеточное вещество настолько мало развито, что его трудно обнаружить?
1) эпителиальной
2) мышечной
3) нервной
4) соединительной
27.
МЫШЕЧНЫЕ ТКАНИ ЧЕЛОВЕКА
Волокна скелетных мышц под микроскопом __________ (А). Их длина составляет
__________ (Б). Волокна сердечной мышечной ткани, в отличие от поперечнополосатой, имеют контактные участки. Совокупность клеток, образующих ткань мышц внутренних органов, называют __________ (В) мышечной тканью. Для всех типов мышечных тканей характерные свойства возбудимость и __________ (Г).
ПЕРЕЧЕНЬ ТЕРМИНОВ:
1) Поперечнополосатая 2) гладкая 3) не поперечно исчерчены
4) поперечно исчерчены 5) 10 — 12 см 6) 0,1 мм
7) Проводимость 8) сократимость
28. К многослойной эпителиальной ткани относят эпителий
1) стенок желудка
2) стенок кишечника
3) наружного слоя кожи
4) стенок дыхательных путе
29. Верны ли следующие суждения о свойствах мышечных тканей человека?
Верны ли следующие суждения о свойствах мышечных тканей человека?
А. Основные свойства мышечной ткани это возбудимость и проводимость.
Б. Стенки кровеносных сосудов, кишечника, мочевого пузыря образованы
поперечнополосатой мышечной тканью.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
30. К основной ткани в цветковом растении относят
1) образовательную ткань
2) фотосинтезирующую ткань
3) кожицу
4) Пробку
31. Какой тканью выстланы головка и суставная ямка суставов?
1) хрящевой
2) нервной
3) гладкой мышечной
4) поперечнополосатой мышечной
32. Для какой ткани характерно наличие межклеточного вещества в виде жидкости?
1) эпителиальной
2) жировой
3) крови
4) хрящевой
33. Вставьте в текст «Ткани человека» пропущенные термины из предложенного перечня, используя для этого цифровые обозначения. Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность цифр (по тексту) впишите в приведённую ниже таблицу.
Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность цифр (по тексту) впишите в приведённую ниже таблицу.
ТКАНИ ЧЕЛОВЕКА
В организме человека выделяют четыре основные группы тканей. В __________ (А) тканях хорошо развито межклеточное вещество. В __________ (Б) и лимфе межклеточное вещество __________ (В). В __________ (Г) тканях клетки плотно прилегают друг к другу. Эти ткани образуют покровы тела и выстилают полости внутренних органов.
ПЕРЕЧЕНЬ ТЕРМИНОВ:
1) Эпителиальные 2) соединительные 3) покровные
4) Образовательные 5) кровь 6) жидкое
7) Прочное 8) эластичное
34. Расположите в правильном порядке уровни организации животной ткани, начиная с наибольшего. В ответе запишите соответствующую последовательность цифр.
1) соединительная ткань
2) ион железа
3) эритроциты
4) гемоглобин
5) форменные элементы
6) кровь
35. В клетках какой ткани происходит образование органических веществ из неорганических?
1) проводящей
2) механической
3) образовательной
4) Фотосинтезирующей
36. Ведущей тканью, образующей сердце человека, является
Ведущей тканью, образующей сердце человека, является
1) соединительная
2) мышечная
3) нервная
4) Эпителиальная
37. Ведущей тканью, образующей мозг человека, является
1) соединительная
2) мышечная
3) нервная
4) эпителиальная
38. Вставьте в текст «Строение нервной ткани» пропущенные термины из предложенного перечня, используя для этого цифровые обозначения. Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность цифр (по тексту) впишите в приведённую ниже таблицу.
СТРОЕНИЕ НЕРВНОЙ ТКАНИ
Функциональной единицей нервной ткани является __________ (А). Это клетка, состоящая из тела и отходящих от неё отростков. Короткие отростки называют __________ (Б), они проводят сигнал к телу нейрона, а длинный отросток называют __________ (В). Он проводит нервный сигнал от тела нейрона. В местах многочисленных контактов нервных клеток образуются __________ (Г).
ПЕРЕЧЕНЬ ТЕРМИНОВ:
1) Миоцит 2) сома 3) нейрон
4) Рефлекс 5) синапс 6) аксон
7) Ткань 8) дендрит
39. Образовательная ткань находится в зоне корня
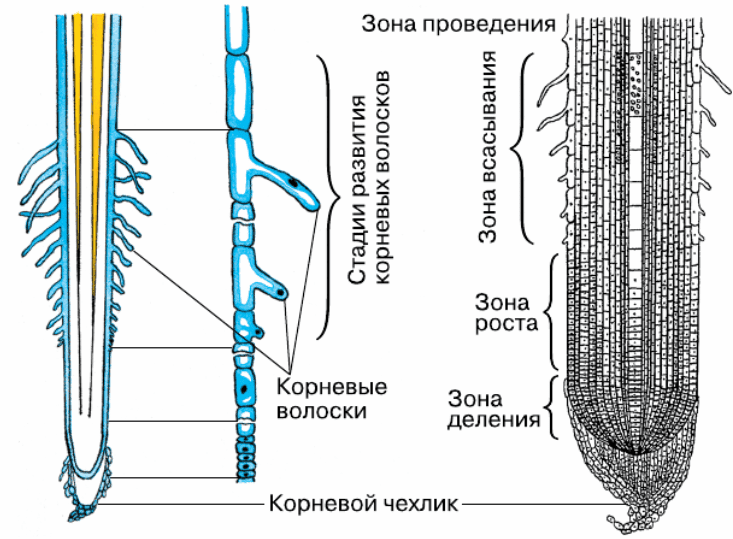
Образовательная ткань находится в зоне корня
- Деления 2) растяжения 3) проведения 4) всасывания
40. Основной тканью, образующей череп человека, является
1) соединительная
2) мышечная
3) нервная
4) эпителиальная
41. Вставьте в текст «Животные ткани» пропущенные термины из предложенного перечня, используя для этого цифровые обозначения. Запишите в текст цифры выбранных ответов, а затем получившуюся последовательность цифр (по тексту) впишите в приведённую ниже таблицу.
ЖИВОТНЫЕ ТКАНИ
Тела большинства животных образованы четырьмя типами тканей. Кожные покровы, слизистые и железы выстилаются __________ (А) тканью, выполняющей защитную и секреторную функции. Основу скелета позвоночных животных составляет __________ (Б) ткань. Взаимосвязь организмов с окружающей средой и согласованную работу всех внутренних органов обеспечивает __________ (В) ткань. Важнейшими свойствами этой ткани являются возбудимость и проводимость.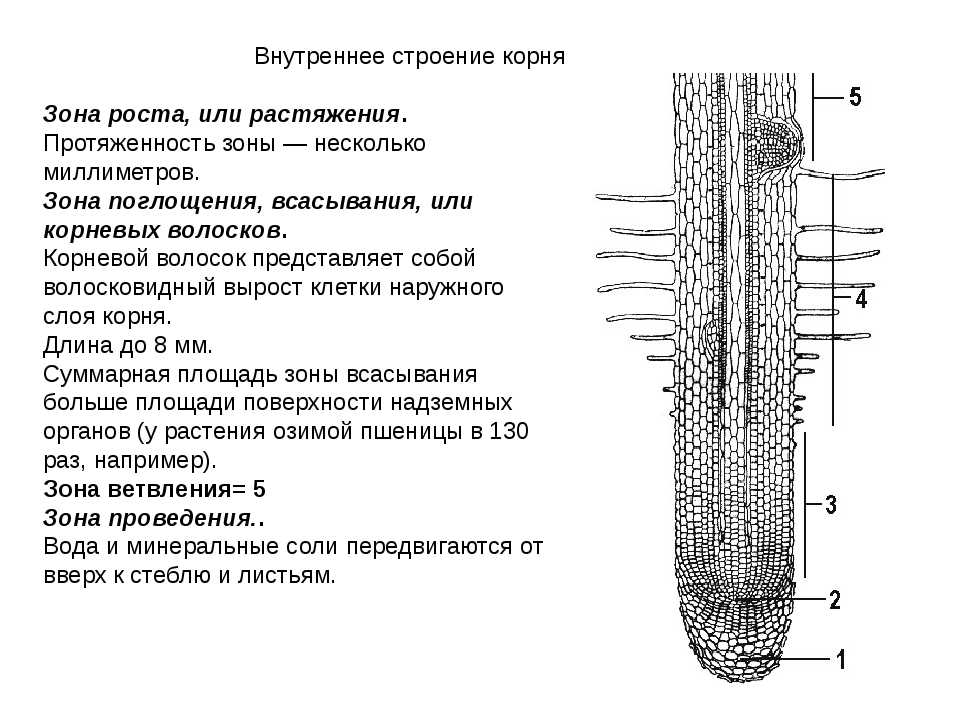 А такие свойства, как возбудимость и сократимость, характерны для __________ (Г) ткани.
А такие свойства, как возбудимость и сократимость, характерны для __________ (Г) ткани.
ПЕРЕЧЕНЬ ТЕРМИНОВ:
1) Мышечная 2) проводящая 3) опорная
4) Соединительная 5) нервная 6) запасающая
7) Образовательная 8) эпителиальная
42. К какому типу ткани относят фотосинтезирующую ткань?
1) Проводящая 2) основная 3) покровная 4) механическая
43. Какая ткань обеспечивает рост растения?
1) образовательная
2) запасающая
3) проводящая
4) Покровная
44. В составе какой ткани можно наблюдать изображённую на рисунке клетку?
1) нервной
2) проводящей
3) соединительной
4) Основной
45. Какая ткань транспортирует вещества в организме человека?
1) мышечная
2) эпителиальная
3) соединительная
4) Нервная
46. Какие клетки растительного организма способны к многократным делениям?
1) сосудов
2) камбия
3) коры
4) кожицы
47. Какая ткань изображена на рисунке?
Какая ткань изображена на рисунке?
1) покровная
2) проводящая
3) мышечная
4) Образовательная
48. На рисунке изображён фрагмент микроскопического строения стебля растения. Какой цифрой на нём обозначены клетки проводящей ткани?
49. Какую из приведённых ниже тканей относят к животным?
1) образовательную
2) проводящую
3) основную
4) нервную
50. Какой тип ткани входит в состав многоклеточного растительного организма?
- Основная
2) мышечная
3) соединительная
4) Нервная
51. Рассмотрите изображение микропрепарата. Как называют вид
растительной ткани, являющийся основой этого микроскопического объекта?
1) механическая
2) проводящая
3) основная
4) Образовательная
52. Какой важнейший признак отличает нервную ткань от всех остальных животных тканей?
1) многоядерность
2) проводимость
3) возбудимость
4) Сократимость
53. Хрящевую ткань относят к
Хрящевую ткань относят к
1) группе эпителиальных тканей
2) нервной ткани
3) группе соединительных тканей
4) группе мышечных тканей
54. У представителей какого из царств живой природы есть соединительная ткань?
- Животные 2) Растения 3) Бактерии 4) Грибы
55. Костная ткань разновидность ткани
1) эпителиальной
2) мышечной
3) соединительной
4) Нервной
56. Какой тип ткани присутствует в составе многоклеточного растительного организма?
1) соединительная
2) проводящая
3) нервная
4) Мышечная
57. В приведённой ниже таблице между позициями первого и второго столбца имеется взаимосвязь.
Целое Часть
Биоценоз Фитоценоз
Нейрон …
Какое понятие следует вписать на место пропуска в этой таблице?
1) серое вещество
2) головной мозг
3) аксон
4) нервная система
58. Какие функции выполняют эпителиальные ткани? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
1) защита от механических повреждений
2) обеспечение произвольных движений
3) транспорт газов по всему организму
4) передача возбуждения от рецепторов к головному мозгу
5) выделение пота и кожного сала
6) выделение слюны и пищеварительных соков
59. Каковы характерные признаки соединительной ткани? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
1) Представлена кровью, лимфой, губчатым веществом кости.
2) Выстилает слизистые оболочки желудка, ротовой полости.
3) Бывает жидкой и твёрдой.
4) Обладает возбудимостью и проводимостью.
5) Межклеточное вещество слабо выражено.
6) Выполняет транспортную функцию.
60. Каковы отличительные особенности волокон поперечно-полосатой мышечной ткани человека? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
1) содержат много ядер
2) медленнее сокращаются
3) образуют скелетную мускулатуру
4) форма волокон веретеновидная
5) входят в состав стенок внутренних органов
6) имеют вытянутую форму и большую длину (10 — 12 см)
61. Чем эпителиальные ткани отличаются от соединительных? Выберите три верных ответа из шести.
Чем эпителиальные ткани отличаются от соединительных? Выберите три верных ответа из шести.
1) состоят из клеток, плотно прилегающих друг к другу
2) состоят из клеток, разделённых межклеточным веществом
3) содержат пигмент меланин
4) образуют верхний слой кожи, выстилают поверхности внутренних органов
5) имеют сильно развитое жидкое или твёрдое межклеточное вещество
6) образуют прослойки между органами, хрящи и кости
62. Чем эпителиальные ткани отличаются от соединительных? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
1) состоят из клеток, плотно прилегающих друг к другу
2) образованы из длинных волокон
3) практически не имеют межклеточного вещества
4) образуют верхний слой кожи, выстилают внутренние органы
5) имеют сильно развитое межклеточное вещество
6) выполняют функцию опоры, образуют хрящи и кости
63. Какие из приведённых тканей относят к соединительным? Выберите три верных элемента ответа из шести и запишите цифры, под которыми они указаны.
1) кровь
2) камбий
3) костная
4) железистая
5) кожица
6) лимфа
64. Какие животные ткани относят к соединительным? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
1) нервная
2) многослойная эпителиальная
3) кровь
4) поперечно-полосатая мышечная
5) жировая
6) Костная
65. Какие функции выполняет эпителиальная ткань? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
1) образует покровы тела
2) накапливает жир
3) выстилает полости внутренних органов
4) обеспечивает движение тела
5) выполняет секреторную функцию
6) регулирует деятельность нервной системы
66. Что образуют эпителиальные ткани? Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны
1) покровы тела
2) слизистые оболочки внутренних органов
3) среднюю часть стенки желудка
4) хрящевые диски между позвонками
5) железы внешней секреции
6) подкожную клетчатку
67. Установите соответствие между характеристикой нервной ткани и типом клеток, к которому её относят: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
Установите соответствие между характеристикой нервной ткани и типом клеток, к которому её относят: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ХАРАКТЕРИСТИКА НЕРВНОЙ ТКАНИ ТИП КЛЕТКИ
1) Нейрон 2) клетка спутник
А) выполняет питательную функцию
Б) воспринимает раздражения
В) составляет основную массу нервной ткани
Г) состоит из тела и отростков
Д) превращает раздражения в нервные импульсы
Е) проводит электрическое возбуждение к телу клетки и к другим клеткам
68. Установите соответствие между особенностью ткани растения и её видом: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ОСОБЕННОСТЬ ТКАНИ ВИД ТКАНИ
1) Покровная 2) проводящая
А) клетки плотно прилегают друг к другу
Б) клетки имеют удлинённую форму
В) защищает органы растения от неблагоприятных воздействий среды
Г) осуществляет газообмен и испарение воды
Д) осуществляет восходящий и нисходящий ток веществ
Е) включает сосуды и ситовидные трубки
69. Установите соответствие между характеристикой ткани растения и её видом: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
Установите соответствие между характеристикой ткани растения и её видом: к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ХАРАКТЕРИСТИКА ТКАНИ ВИД ТКАНИ
1 ) Механическая 2) фотосинтезирующая
А) состоит из клеток, содержащих хлоропласты
Б) образована клетками с толстыми прочными стенками
В) выполняет роль каркаса
Г) выполняет функцию образования органических веществ
из неорганических на свету
Д) служит опорой для растения
Е) придаёт растению постоянную форму
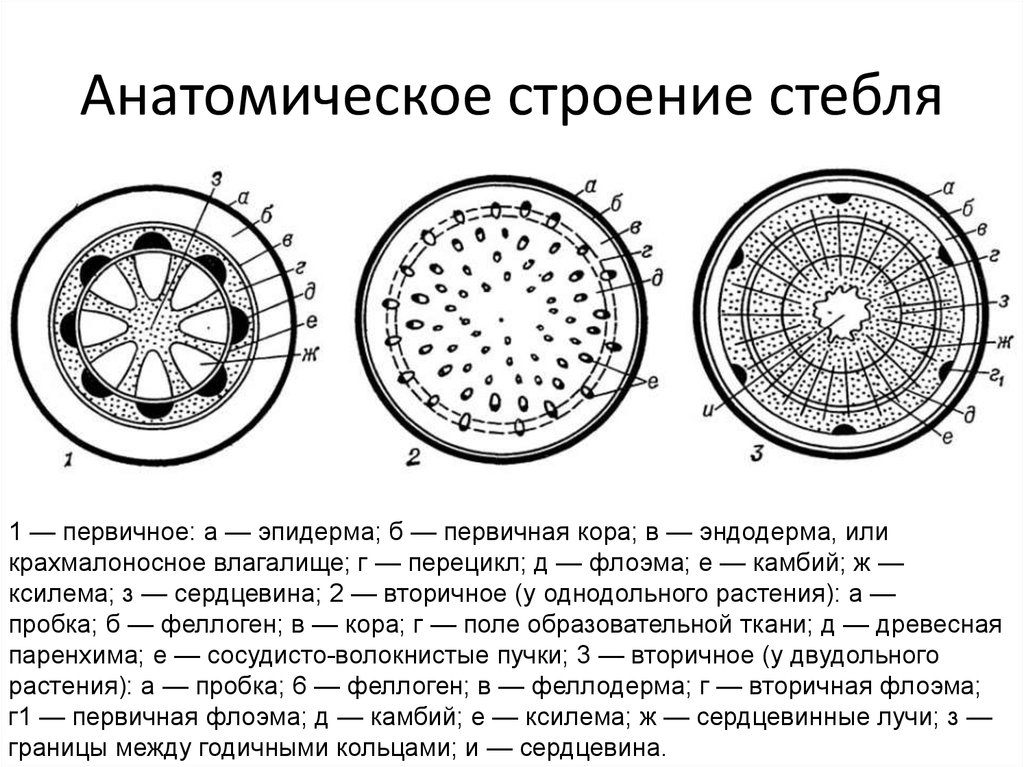
71. Рост стебля в толщину осуществляется за счёт тканей
- Древесины 2) сердцевины 3) луба 4) камбия
72. У представителей какого из царств живой природы в составе организма есть
соединительная ткань?
1) Животные 2) Растения 3) Бактерии 4) Грибы
73. В приведённой ниже таблице между позициями первого и второго столбца имеется взаимосвязь .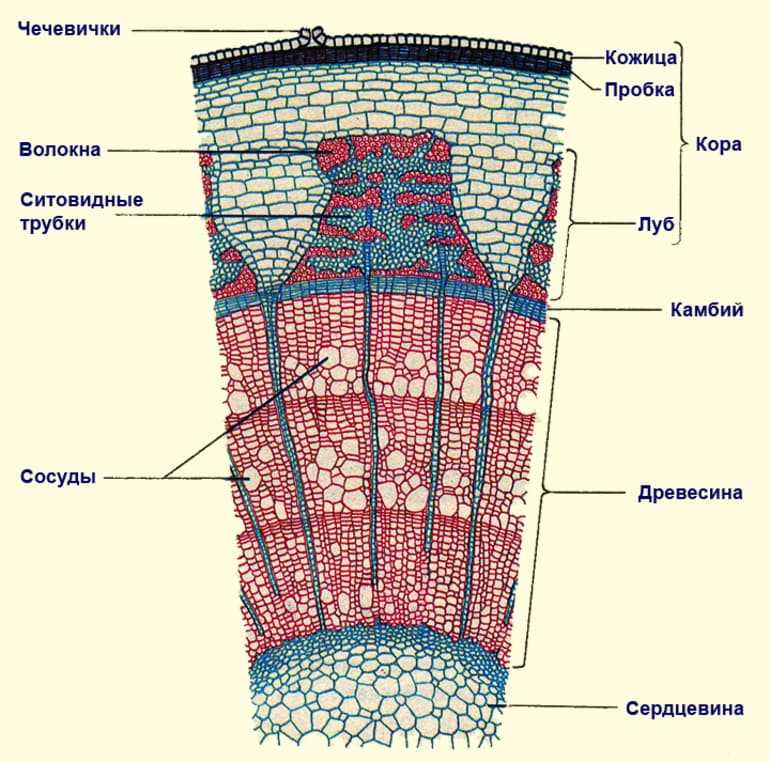
Ткань Функции
… Опора, транспорт, защита
Эпителиальная Защита, выделение секрета
Какое понятие следует вписать на место пропуска в этой таблице?
1) механическая
2) мышечная
3) нервная
4) Соединительная
74. В приведённой ниже таблице между позициями первого и второго столбца имеется взаимосвязь.
Ткань Функция
Ксилема …
Механические Обеспечивают прочность
Какое понятие следует вписать на место пропуска в этой таблице?
1) обеспечивает рост растения в толщину
2) обеспечивает передвижение продуктов фотосинтеза
3) обеспечивает передвижение воды с минеральными веществами
4) защищает от воздействий окружающей среды
75. В приведённой ниже таблице между позициями первого и второго столбца имеется взаимосвязь.
Ткань Функция
… Проведение продуктов фотосинтеза
Механические Обеспечивают прочность
Какое понятие следует вписать на место пропуска в этой таблице?
1) ситовидные трубки
2) камбий
3) сосуды
4) Основная
76. Верны ли суждения о тканях организма человека?
Верны ли суждения о тканях организма человека?
А. Оболочки мышц, сухожилия, хрящи и кости образованы различными видами
соединительной ткани.
Б. Эпителиальные ткани образуют железы: слюнные, потовые, слёзные и другие, их клетки выделяют различные жидкости.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
77. Верны ли суждения о мышечной ткани человека?
А. Волокна мышц внутренних органов не имеют поперечную исчерченность, они образуют гладкую мускулатуру.
Б. Основные свойства мышечной ткани возбудимость и проводимость.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
78. Установите последовательность биологических систем в порядке усложнения их организации. В ответе запишите соответствующую последовательность цифр.
1) клетка
2) ткань
3) ген
4) орган
5) Ядро
79. Какой тканью не образованы органы человека?
Какой тканью не образованы органы человека?
1) жировая
2) плотная волокнистая
3) механическая
4) костная
Подземный, видоизмененный многолетний побег — корневище — изображен
1) 1 2) 2 3) 3 4) 4
Как называется плод, обозначенный на рисунке буквой Г?
1) боб 2) стручок 3) коробочка 4) зерновка
6.В приведенной ниже таблице между содержанием первого и второго столбцов имеется определенная связь.
| Целое | Часть |
| Пестик | Рыльце |
| Тычинка | _____ |
Какое понятие следует вписать на место пропуска в этой таблице?
1) столбик 2) лепесток 3) завязь 4) пыльник
Верны ли следующие суждения о корнеплодах?
А. Корнеплод является видоизменённым подземным побегом.
Б. Основная функция корнеплода — запасающая.
1) верно только А 2) верно только Б 3) верны оба суждения
4) оба суждения неверны
Как называется запасающая ткань семени?
1) луб 2) семядоля 3) кожура 4) эндосперм
Какую из функций стебель НЕ выполняет?
1) опорную 2) проводящую 3) полового размножения 4) фотосинтезирующую
10.В приведенной ниже таблице между содержанием первого и второго столбцов имеется определенная связь.
| Объект | Процесс |
| Хлоропласт | Фотосинтез |
| Митохондрия | _____ |
Какое понятие следует вписать на место пропуска в этой таблице?
1) дыхание 2) питание 3) размножение 4) рост
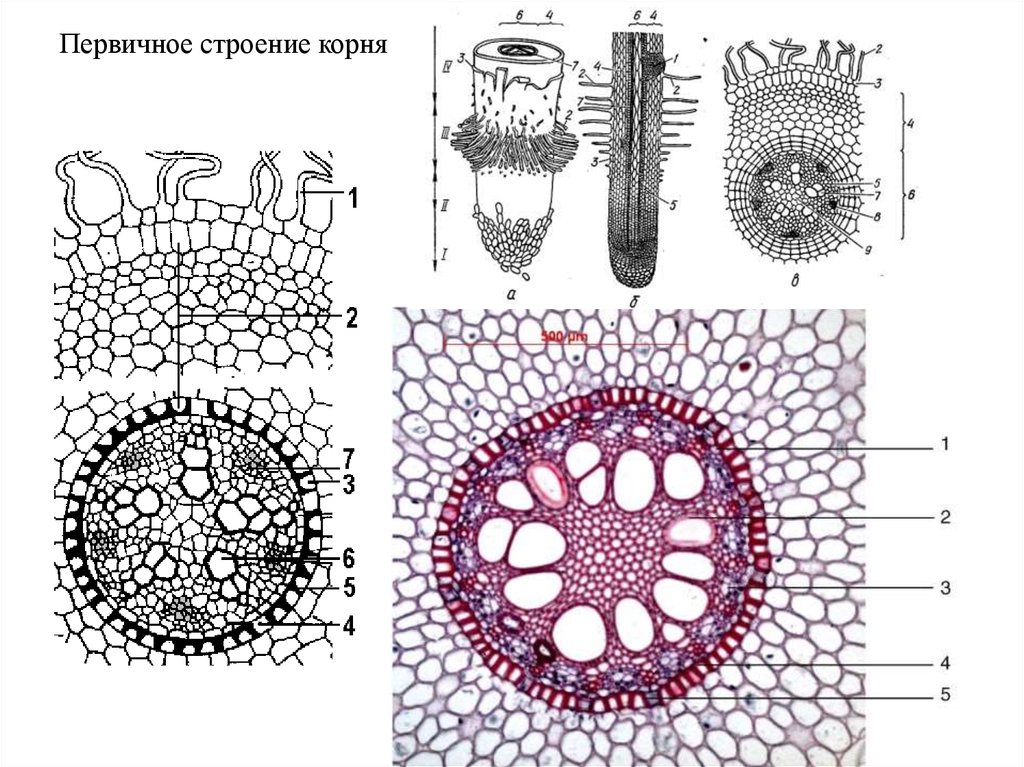
На рисунке изображен фрагмент микроскопического строения корня. Какой цифрой на нем обозначена зона всасывания?
1) 1 2) 2 3) 3 4) 4
Из семядолей, стебелька, корешка и почечки состоит
1) эндосперм 2) рубчик 3) зародыш семени 4) семявход
Как называется плод, обозначенный на рисунке буквой В?
1) боб 2) стручок 3) коробочка 4) зерновка
Какое понятие следует вписать на место пропуска в этой таблице?
| Орган | Разновидность |
| Соцветие | _____ |
| Плод | Яблоко |
1) опыление 2) ягода 3) оплодотворение 4) корзинка
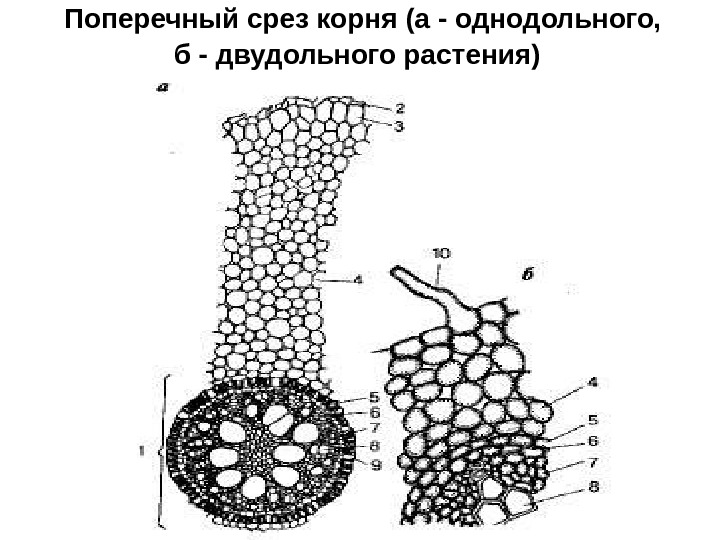
Какая растительная ткань на рисунке обозначена буквой Б?
1) механическая 2) основная 3) покровная 4) проводящая
Какой тип соцветия изображён на рисунке под номером 4?
1) корзинка 2) зонтик 3) початок 4) кисть
На рисунке представлено видоизменение
1) корня 2) стебля 3) листьев 4) побега
Вишня и груша относятся к одному
1) роду 2) семейству 3) классу 4) отделу
Между позициями первого и второго столбцов приведённой ниже таблицы имеется определённая связь.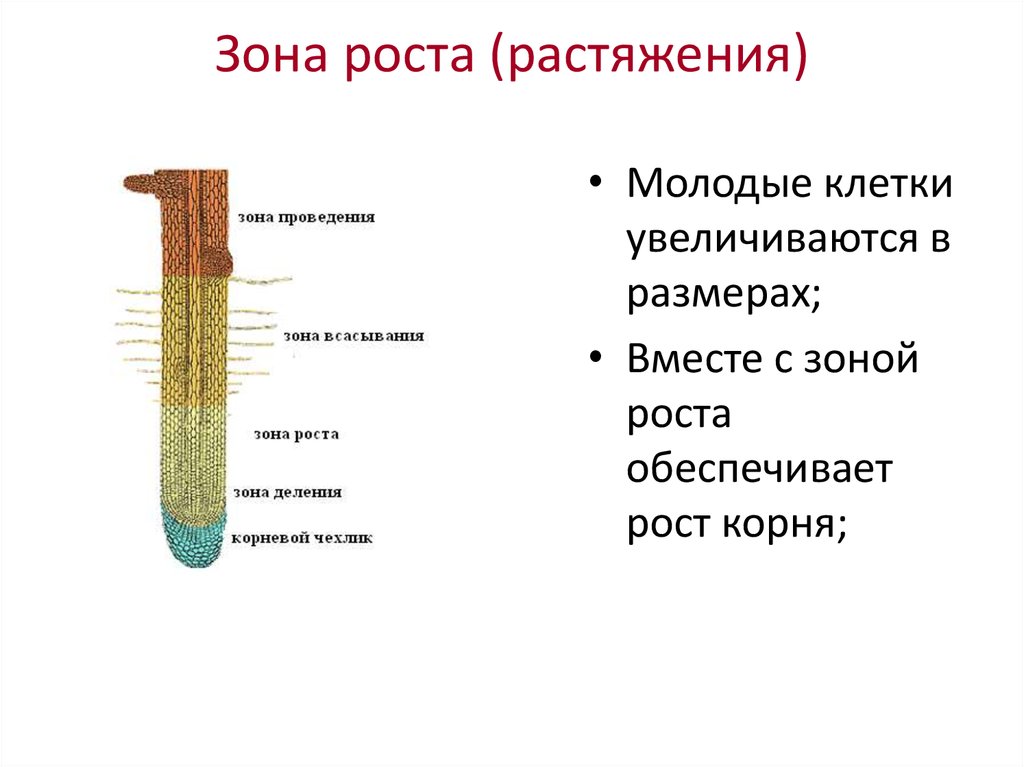
| Объект | Процесс |
| лист | фотосинтез, газообмен, транспирация |
| … | соединяет все органы растения |
Какое понятие следует вписать на место пропуска в этой таблице?
1) стебель 2) корень 3) цветок 4) плод
Какие ткани защищают растение от неблагоприятных воздействий среды?
1) покровные 2) проводящие 3) механические 4) основные
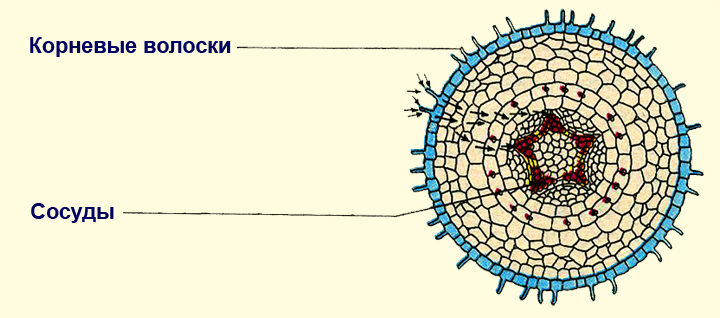
Какая зона корня у растений покрыта корневыми волосками?
1) деления 2) роста 3) всасывания 4) проведения
Извлечение сломанного файла в нижнем правом первом моляре с помощью ультразвукового инструмента и эндодонтических микрощипцов
На этой странице отказ. Цель . В этом отчете объясняется, как удалить сломанные файлы с помощью ультразвуковых инструментов и эндодонтических микрощипцов. История болезни . Больной 25-ти лет 1 неделю назад было проведено незавершенное лечение корневых каналов нижнего правого первого моляра. В бифуркации и апикальном корне были рентгенопрозрачные участки, а в 1/3 коронарного мезиолингвального корня имелись сломанные файлы. Извлечение началось с изготовления промежуточной платформы с ультразвуковой насадкой ET20. Были использованы эндодонтические микрощипцы, включая винтовой клин, который работает, зажимая фрагменты файла через механический замок и подтягивая их к коронке. Заключение . Успешно удалить сломанные файлы из корневого канала можно с помощью ультразвуковых инструментов и эндодонтических микрощипцов.
Больной 25-ти лет 1 неделю назад было проведено незавершенное лечение корневых каналов нижнего правого первого моляра. В бифуркации и апикальном корне были рентгенопрозрачные участки, а в 1/3 коронарного мезиолингвального корня имелись сломанные файлы. Извлечение началось с изготовления промежуточной платформы с ультразвуковой насадкой ET20. Были использованы эндодонтические микрощипцы, включая винтовой клин, который работает, зажимая фрагменты файла через механический замок и подтягивая их к коронке. Заключение . Успешно удалить сломанные файлы из корневого канала можно с помощью ультразвуковых инструментов и эндодонтических микрощипцов.
1. Введение
Успех лечения корневых каналов зависит от результатов процесса очистки и формирования. Однако существует риск поломки файлов, поскольку их наличие тормозит процесс очистки, формирования и заполнения, что приводит к неэффективности лечения [1]. Сломанный файл часто возникает в коренных зубах, особенно на нижней челюсти из-за плохого доступа, малого диаметра и резкой кривизны корневого канала. Как ручные инструменты, так и машинные инструменты для лечения корневых каналов в основном изготавливаются из нержавеющей стали и никель-титана; поэтому существует вероятность того, что они могут сломаться. Было зафиксировано, что частота поломки файлов составляет 0,25% для ручных инструментов и 1,68-2,4% для вращающихся инструментов [2].
Как ручные инструменты, так и машинные инструменты для лечения корневых каналов в основном изготавливаются из нержавеющей стали и никель-титана; поэтому существует вероятность того, что они могут сломаться. Было зафиксировано, что частота поломки файлов составляет 0,25% для ручных инструментов и 1,68-2,4% для вращающихся инструментов [2].
Существует несколько альтернативных методов лечения этого случая, в том числе взятие фрагмента сломанного файла и обход его внутри корневого канала [1]. Тем не менее, при ведении таких случаев необходимо учитывать несколько факторов, в том числе видимость, расположение сломанных зубов файла и структуру оставшейся ткани зуба [1]. Кроме того, это лечение часто требует специальной помощи из-за риска осложнений, таких как проталкивание файла апикально, выдавливание фрагментов за пределы апекса, риск перелома зуба из-за избыточного захвата дентина, перфорации корня и возникновения уступа [3].
Технологический прогресс сделал возможным использование нескольких инструментов для извлечения файлов, включая ультразвуковые устройства, микротрубки и щипцы, с помощью микроскопа, чтобы облегчить визуализацию и свести к минимуму удаление дентина корневого канала [1].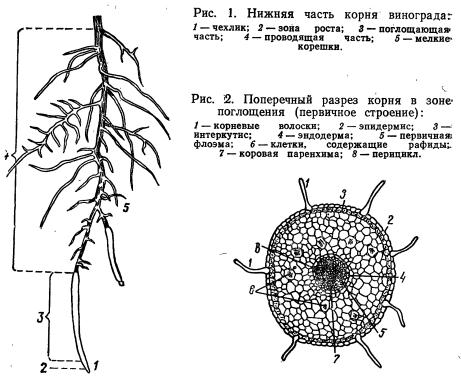 Таким образом, в этом отчете обсуждалось лечение сломанных файлов в молярах нижней челюсти с использованием ультразвукового устройства и эндодонтических микропинцетов с помощью микроскопа.
Таким образом, в этом отчете обсуждалось лечение сломанных файлов в молярах нижней челюсти с использованием ультразвукового устройства и эндодонтических микропинцетов с помощью микроскопа.
2. История болезни
Больная 25-ти лет обратилась с жалобами на дискомфорт при жевании нижними правыми задними зубами; поэтому лечение корневых каналов было проведено неделю назад после года спонтанной боли. При внутриротовом осмотре кариес достиг пульпы нижних правых первых моляров с отрицательной витальностью и положительной перкуссией. Рентгенологическое исследование показало рентгенопрозрачные изображения в области бифуркации и апикальных медиальных и дистальных корней, а также сломанный файл от устья до середины мезиолингвального корня (рис. 1(а) и 1(б)).
На основании субъективного, объективного и рентгенологического исследования диагноз правого первого моляра нижней челюсти — симптоматический апикальный периодонтит, сопровождающийся сломанным файлом на мезиолингвальном корне. Проведено лечение нежизнеспособных корневых каналов реставрацией накладками Ceramage (Shofu Inc., Япония).
Проведено лечение нежизнеспособных корневых каналов реставрацией накладками Ceramage (Shofu Inc., Япония).
Зуб был подготовлен для получения адекватного коронкового доступа с использованием 2,5% NaOCl в качестве ирриганта для удаления дебриса. Рабочая длина измерялась с помощью электронного апекслокатора (Root ZX II, Morita). Корневой канал препарировали в мезиощечном и дистальном корнях с помощью ProTaper Next (Dentsply Maillefer, Швейцария) до тех пор, пока не был получен мастер-апикальный файл в мезиощечном корне X3/16,5 мм и дистальном корне X3/17,5 мм. Была проведена ирригация, и устья обоих корневых каналов были закрыты бумажным штифтом и ватой, чтобы предотвратить попадание фрагментов файла. В мезиальном корневом канале извлечение началось с изготовления промежуточной платформы с помощью ультразвуковой насадки Satelec ET20 (Satelec Acteon, Франция) до тех пор, пока не обнажилось 2–3 мм сломанного файла. Это было направлено на отделение файла от стенки корневого канала дентина и обеспечение пространства для устройства.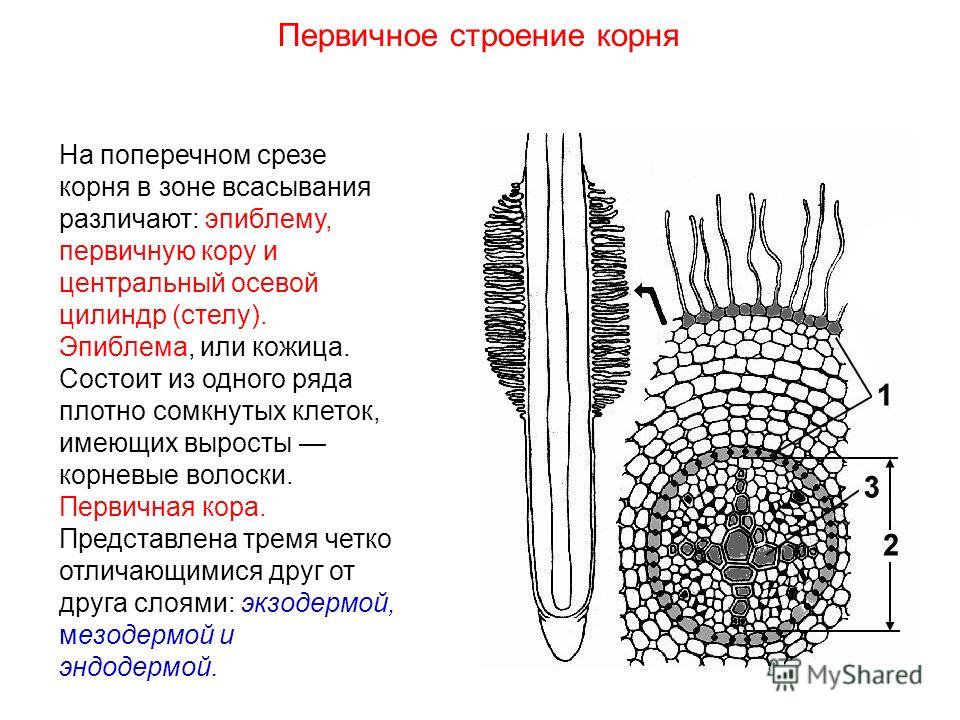 Промежуточная платформа представляет собой пространство между верхушкой обнаженного файла и стенкой корневого канала, которое затем вращалось вокруг файла против часовой стрелки, чтобы создать эффект силы отвинчивания. Это помогает извлекать файлы с помощью резки по часовой стрелке. Приложенная энергия может помочь ослабить файл и создать пространство между ним и стенкой корневого канала. Ультразвуковая насадка Satelec ET25 (Satelec Acteon, Франция) затем может быть использована для ослабления насадки на части стены.
Промежуточная платформа представляет собой пространство между верхушкой обнаженного файла и стенкой корневого канала, которое затем вращалось вокруг файла против часовой стрелки, чтобы создать эффект силы отвинчивания. Это помогает извлекать файлы с помощью резки по часовой стрелке. Приложенная энергия может помочь ослабить файл и создать пространство между ним и стенкой корневого канала. Ультразвуковая насадка Satelec ET25 (Satelec Acteon, Франция) затем может быть использована для ослабления насадки на части стены.
Ирригацию проводили с использованием 2,5% NaOCl и 17% ЭДТА, а активацию проводили с помощью EndoActivator (Dentsply Maillefer, Швейцария). Поскольку прямое применение ультразвуковых устройств не имеет возможности удалить файл, были использованы эндодонтические микрощипцы (Broken Instrument Removal Kit, Zumax, Китай), включающие винтовой клин, который работает путем зажима фрагментов файла через механический замок и вытягивания. их к коронарной (рис. 2(а)). После того, как фрагмент файла был успешно поднят (рис.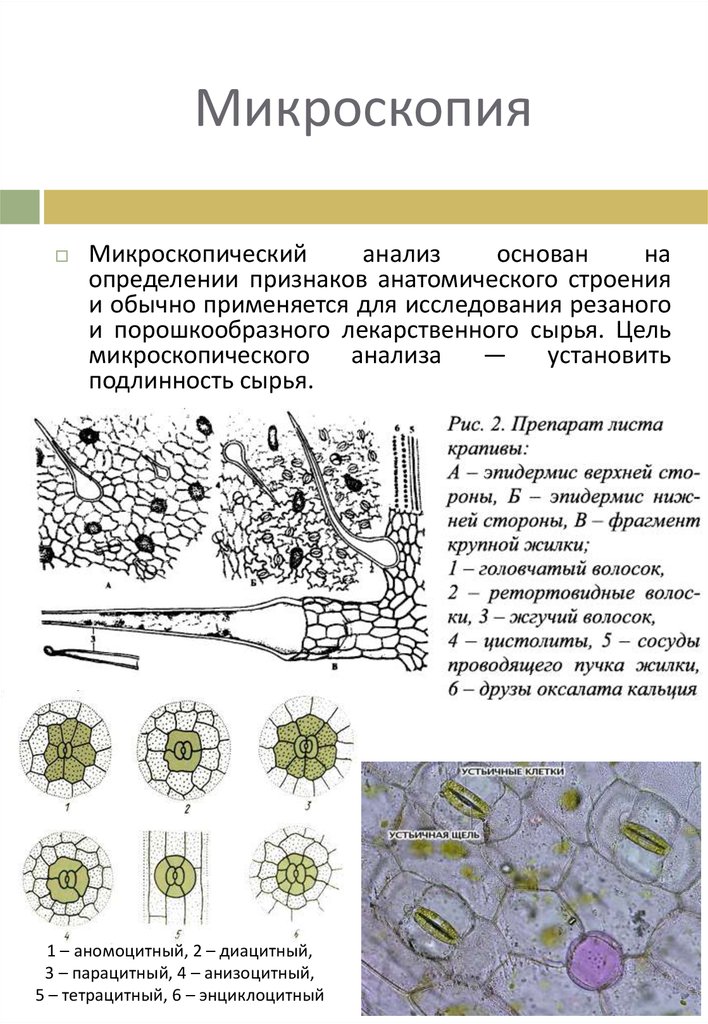 2(б)), это было подтверждено фотографией рентгенограммы.
2(б)), это было подтверждено фотографией рентгенограммы.
Мезиолингвальный корневой канал препарировали с помощью ProTaper Next (Dentsply Maillefer, Швейцария) до X3/16,5 мм и мастер-гуттаперчевым штифтом, подтвержденным рентгенографическими фотографиями.
Он был обработан пастой гидроксида кальция (Calcipex®, Nippon Shika-Yakuhin, Shimonoseki, Japan) и временно восстановлен.
Через две недели после первого визита корневой канал был запломбирован методом непрерывной волны с помощью гуттаперчи (ProTaper Next ® Gutta Percha, Dentsply Tulsa Dental, Швейцария) с помощью силера MTA Fillapex и закрыт с помощью RMGIC (Fuji II LC , GC, Япония) и временной реставрации (Caviton, GC Corporation, Япония).
Через неделю после обтурации была завершена подготовка к изготовлению накладки Ceramage® (Shofu Inc., Япония). Через две недели после изготовления накладки накладка была зацементирована полимерным цементом (рис. 3(b)). Оценка через месяц показала отрицательный результат при субъективном осмотре, перкуссии и пальпации.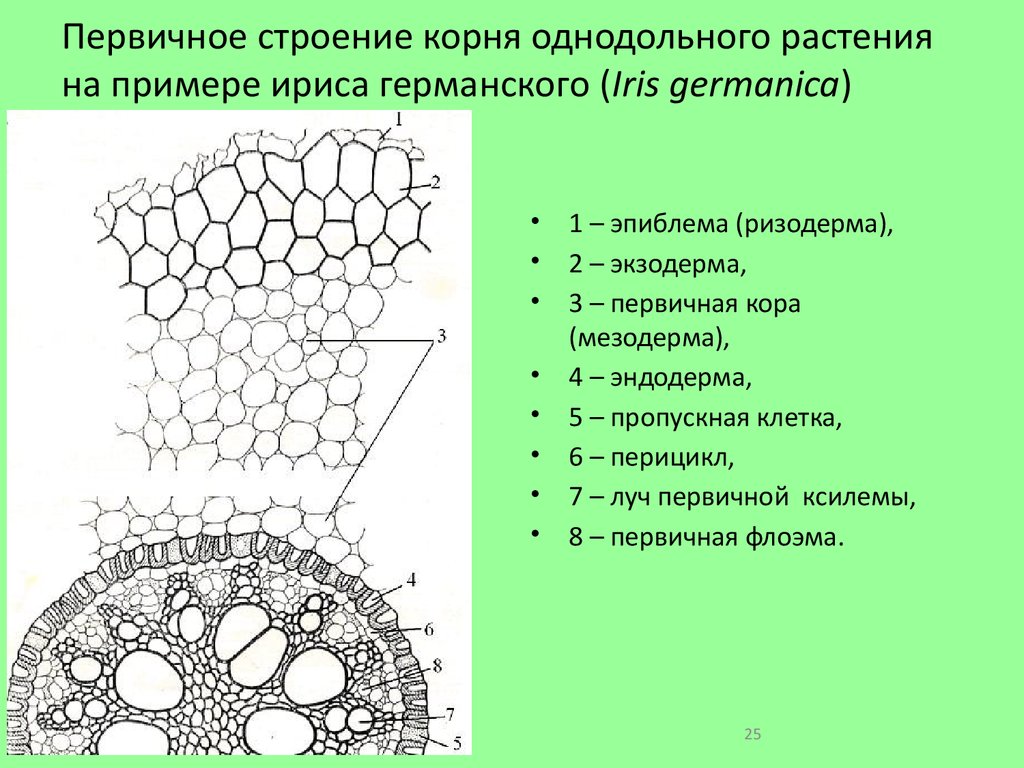 Рентгенограмма показала бифуркацию, просветление апикальной части было уменьшено.
Рентгенограмма показала бифуркацию, просветление апикальной части было уменьшено.
3. Обсуждение
Использование ультразвукового инструмента в сочетании с микроскопом является консервативным методом обработки сломанного файла по сравнению с другими альтернативами [4, 5]. Он может консервативно разрушать структуру дентина и с меньшей вероятностью повреждает структуру корня и ткань пародонта [5]. Однако его приложение не смогло ослабить файл, пока он не достиг коронки; поэтому был необходим инструмент для зажима файла и вытягивания его фрагментов в коронарном направлении через микротрубку либо с винтовым клином, либо с петлевым устройством (DentalCadre, Сиэтл, Вашингтон) [2]. Это характерно для сломанных файлов длиной более 4,5 мм или видимых при ультразвуковой активации, но не может быть извлечено устройством [2].
Удаление сломанных файлов можно проводить в сухих или влажных условиях [2]. Сухие условия обеспечивают лучшую видимость в микроскоп, что предотвращает процедурные ошибки [2]. Однако тепло, выделяемое ультразвуковыми колебаниями, неизбежно, а температура на внешней поверхности корня может повышаться более чем на 10°C, вызывая повреждение тканей пародонта [2]. Файлы также чувствительны к вторичному нагреву, если ультразвуковой наконечник соприкасается с файлом [2]. Поэтому орошение ЭДТА проводилось, когда ультразвуковой наконечник был активирован на минимальной мощности [2]. Это улучшило чистоту стенки корневого канала [2].
Однако тепло, выделяемое ультразвуковыми колебаниями, неизбежно, а температура на внешней поверхности корня может повышаться более чем на 10°C, вызывая повреждение тканей пародонта [2]. Файлы также чувствительны к вторичному нагреву, если ультразвуковой наконечник соприкасается с файлом [2]. Поэтому орошение ЭДТА проводилось, когда ультразвуковой наконечник был активирован на минимальной мощности [2]. Это улучшило чистоту стенки корневого канала [2].
Использовались насадки ЕТ20 и ЕТ25 из комплекта повторной обработки Endo Success ™ (Satelec Acteon, Франция), изготовленные из титано-ниобиевого сплава и покрытые алмазом, что делает их абразивными. ET20 перемещали против часовой стрелки на 1/3 коронки, а ET25 — на среднюю 1/3 корневого канала, чтобы придать файлу силу откручивания [2].
Корневой канал был запломбирован методом непрерывной волны и с использованием силера MTA Fillapex (Angelus, Бразилия), который хорош для дентина из-за его способности затвердевать. Они также обладают хорошей плотностью, что предотвращает подтекание в периапикальной области и закрывает сообщение между пульпой и тканью пародонта. Содержание МТА в силере способствует заживлению и формированию твердых тканей в очаге поражения.
Они также обладают хорошей плотностью, что предотвращает подтекание в периапикальной области и закрывает сообщение между пульпой и тканью пародонта. Содержание МТА в силере способствует заживлению и формированию твердых тканей в очаге поражения.
MTA Fillapex имеет ряд преимуществ, таких как стимуляция образования новой ткани, быстрое восстановление тканей без воспалительных реакций, высокая рентгеноконтрастность, обеспечение хорошей визуализации на рентгенограмме, высвобождение ионов кальция для индукции быстрой регенерации тканей в областях с периапикальными поражений и микробной активности, облегчая введение и обращение, имея достаточное рабочее время и легко извлекаясь (при повторном лечении, особенно при использовании гуттаперчи) [6, 7]. Он также может быть использован для антимикробной активности против M. luteus , S. aureus , E. coli , P. aeruginosa , C. albicans и E. faecalis из-за его щелочного pH [7, 8].
В этом случае правые первые моляры нижней челюсти с симптоматическим апикальным периодонтитом со сломанным файлом на устье до середины мезиолингвального корневого канала были извлечены с помощью комбинации ультразвуковых насадок и эндодонтических микрощипцов в сопровождении микроскопа для улучшения видимости. . Лечение было успешным, так как сломанный инструмент был полностью удален с исчезновением субъективных жалоб. Рентгенограмма также показала уменьшение апикальной рентгенопрозрачности.
. Лечение было успешным, так как сломанный инструмент был полностью удален с исчезновением субъективных жалоб. Рентгенограмма также показала уменьшение апикальной рентгенопрозрачности.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
A. Shenoy, P. Mandava, N. Bolla и S. Vemuri, «Новая техника удаления сломанного инструмента из корневого канала второго моляра нижней челюсти», Indian Journal of Dental Research , об. 25, нет. 1, стр. 107–110, 2014 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Коэн и К. Харгривз, Pathway’s of the Pulp , Elsevier, Kansas, MO, USA, 11th edition, 2016.
T. Lambrianidis, Management of Fractured Endodontic Instruments , Springer, Cham, Switzerland, 2018.
M. McGugan, B. McGugan 9000 и H.F. Duncan, «Принятие клинических решений после перелома эндодонтического инструмента», British Dental Journal , vol.А. Х. Глускин, С. Дж. Раддл и Э. Дж. Зинман, «Термическое повреждение в результате внутрикорневой передачи тепла с использованием ультразвуковых устройств: меры предосторожности и практические профилактические стратегии», Журнал Американской стоматологической ассоциации , том. 136, нет. 9, стр. 1286–1293, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С. Банерджи, «Обход сломанного инструмента в сильно искривленном корневом канале: отчет о клиническом случае», Индийский журнал консервативной и эндодонтии , том. 2, нет. 2017. Т. 3. С. 115–118.
Посмотреть по адресу:
Google Scholar
Радева Е.
 Шунтирование сломанного инструментария (клинические случаи) // С. 9.0007 Международный журнал науки и исследований , том. 6, нет. 2, стр. 2015–2017, 2017.
Шунтирование сломанного инструментария (клинические случаи) // С. 9.0007 Международный журнал науки и исследований , том. 6, нет. 2, стр. 2015–2017, 2017.Просмотр по адресу:
Google Scholar
П. Парашос, «Прогноз лечения корневых каналов с помощью оставшихся фрагментов инструментов», в Управление сломанными эндодонтическими инструментами , T. Lambrianidis, Ed., Springer, 2018.
Посмотреть по адресу:
Google Scholar
 214, нет. 8, стр. 395–400, 2013.
214, нет. 8, стр. 395–400, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2019 Ratna Meidyawati et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Определение качества порошков Xanthium Strumarium и Xanthium Spinosum путем микроскопического исследования и предварительных испытаний
Введение
Xanthium принадлежит к семейству Asteraceae (ранее Compositae).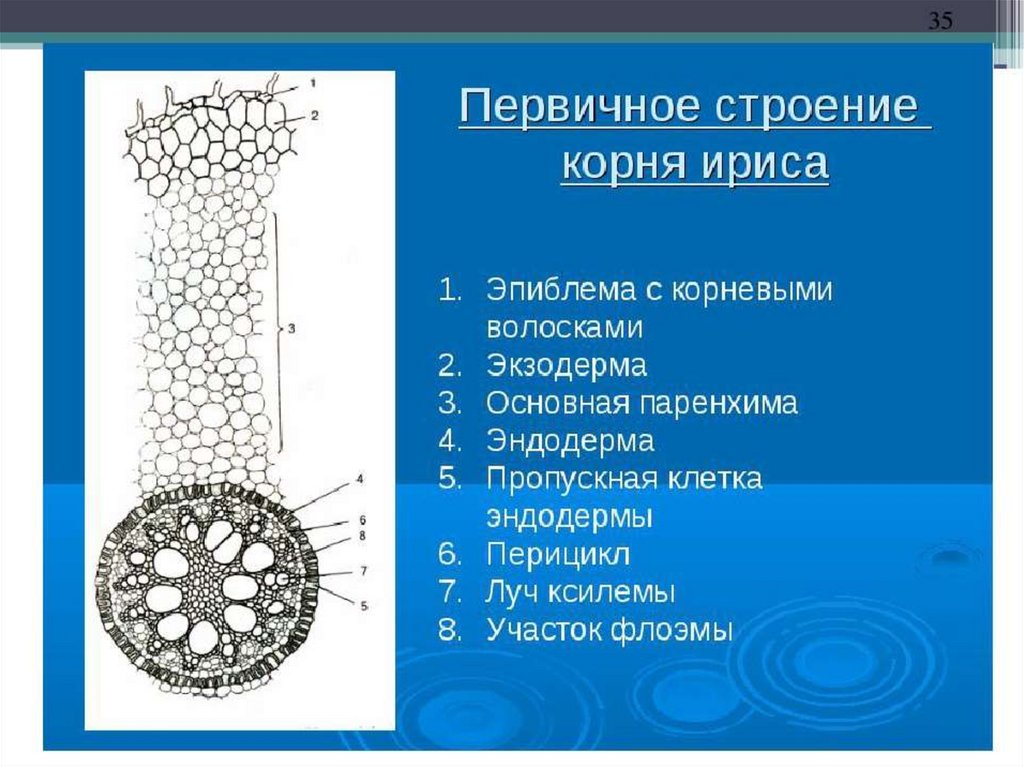 В Северной Америке насчитывается более 20 видов рода Xanthium , которые можно различить по морфологическим характеристикам колючек [18], но Лав и Дансеро [10] выделили в этом роде два совершенно разных вида: Xanthium strumarium и Xanthium spinosum. spinosum относительно стабилен, тогда как strumarium сильно видоизменяется и делится на подвиды. Мутерде [12] упоминает в сирийской и ливанской флоре , что в Сирии есть три вида этого рода: X. strumarium, X. echinatum, X. spinosum, , но сайт The Plant List.org посчитал, что X. echinatum относится к тому же виду, что и X. strumarium 9.0008 , поэтому в Сирии действительно есть только два уникальных основных вида.
В Северной Америке насчитывается более 20 видов рода Xanthium , которые можно различить по морфологическим характеристикам колючек [18], но Лав и Дансеро [10] выделили в этом роде два совершенно разных вида: Xanthium strumarium и Xanthium spinosum. spinosum относительно стабилен, тогда как strumarium сильно видоизменяется и делится на подвиды. Мутерде [12] упоминает в сирийской и ливанской флоре , что в Сирии есть три вида этого рода: X. strumarium, X. echinatum, X. spinosum, , но сайт The Plant List.org посчитал, что X. echinatum относится к тому же виду, что и X. strumarium 9.0008 , поэтому в Сирии действительно есть только два уникальных основных вида.
Согласно Al-Hakim et al. [1] Морфология X. strumarium представляет собой однолетнее травянистое растение длиной 30–100 см (рис. 11), с листьями простыми, чередующимися, без колючек, в целом треугольной формы. Края листьев неравномерно зубчатые и лопастные.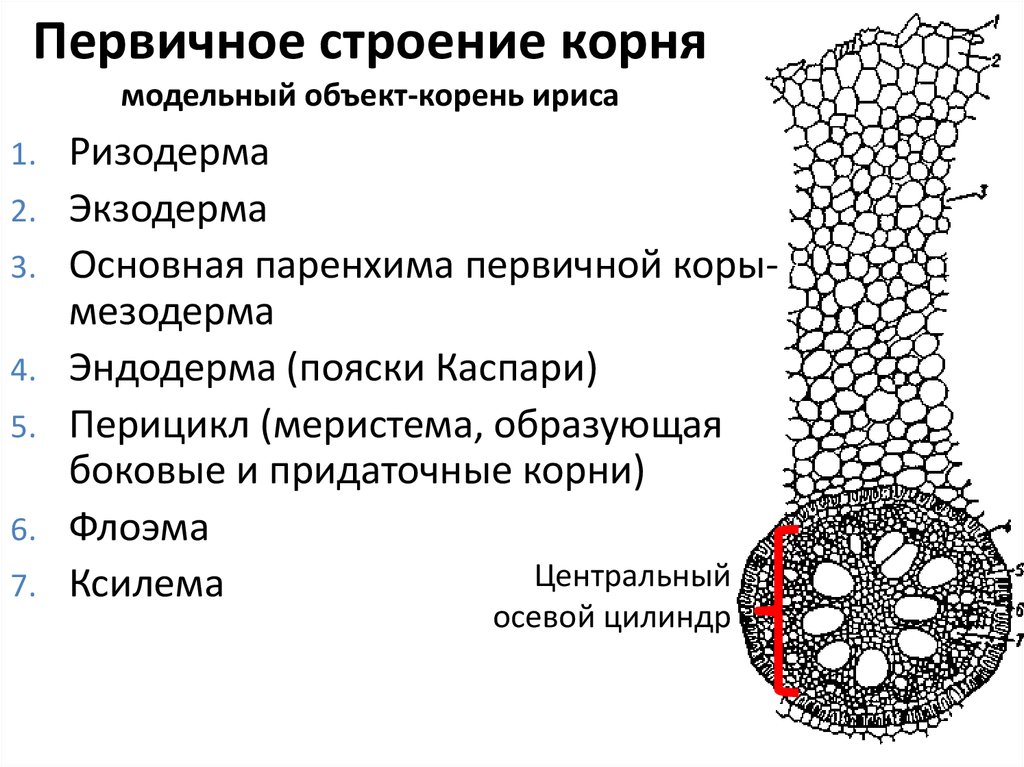 Цветки однополые, некоторые соцветия несут только мужские цветки, в то время как другие несут женские цветки на одном и том же растении, что означает, что растение однополое и однодомное. Цветки расположены в головках, собранных в пазухи. Мужские головки шаровидные, цветки трубчатые, расположены на концах ветвей. Женские головы расположены ниже мужских голов, и на каждой голове есть два цветка. Соцветие содержит только пестик без венчика и чашечки, и все два цветка заключены в колючую обертку. Плод содержит две семянки, окруженные твердой оболочкой, оканчивающейся двумя крючковатыми клювами, и покрыты крючковатыми шипами.
Цветки однополые, некоторые соцветия несут только мужские цветки, в то время как другие несут женские цветки на одном и том же растении, что означает, что растение однополое и однодомное. Цветки расположены в головках, собранных в пазухи. Мужские головки шаровидные, цветки трубчатые, расположены на концах ветвей. Женские головы расположены ниже мужских голов, и на каждой голове есть два цветка. Соцветие содержит только пестик без венчика и чашечки, и все два цветка заключены в колючую обертку. Плод содержит две семянки, окруженные твердой оболочкой, оканчивающейся двумя крючковатыми клювами, и покрыты крючковатыми шипами.
Согласно Al-Hakim et al. [1] также, морфология X. spinosum : Однолетнее травянистое растение, длина 30–60 см (рис. 12). Листья: содержит три доли неправильной формы, каждая из которых имеет четкую основную жилку посередине. Верхняя поверхность листьев темно-зеленая, а нижняя поверхность листьев светлее верхней. На каждом листе по три ответвления желтых шипов длиной 0,7–2,5 см.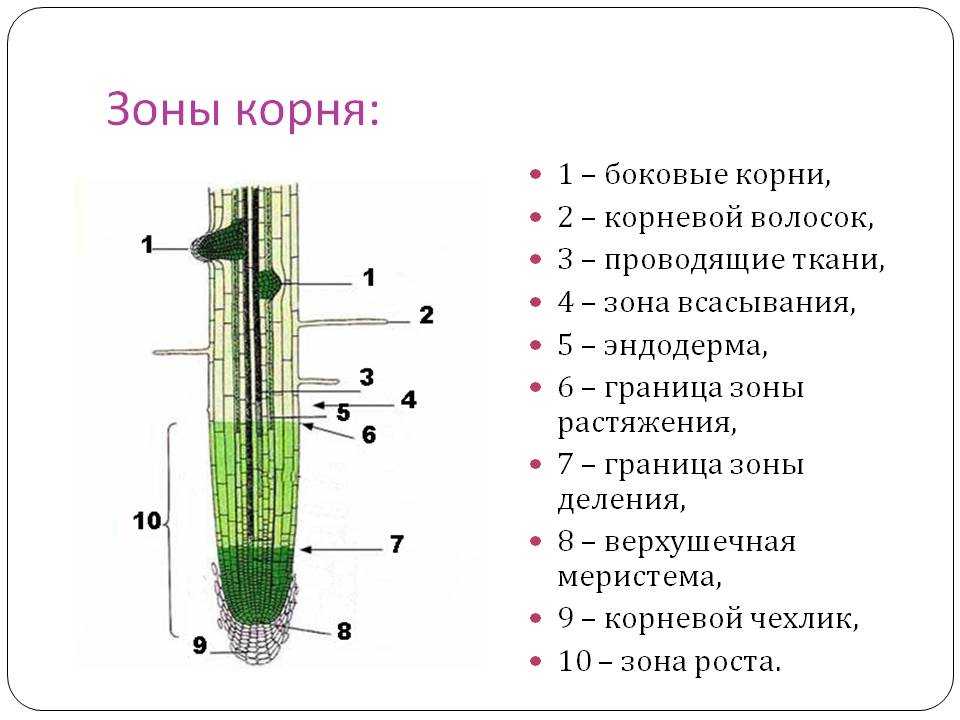 Плоды аналогичны плодам первого вида, а это растение отличается от других видов относительно небольшими по размеру плодами.
Плоды аналогичны плодам первого вида, а это растение отличается от других видов относительно небольшими по размеру плодами.
Хотя химические методы анализа, особенно хроматография, в настоящее время приняты в качестве стандартных методов идентификации многих растительных материалов, микроскопическая структура уже давно признана наиболее полезным и надежным критерием [2].
Это исследование направлено на идентификацию микроскопических элементов порошков частей X. strumarium и порошка листьев X. spinosum , чтобы их качество и чистота соответствовали этим стандартам. Саженцы и цветы X. strumarium ранее не изучались под микроскопом. Наконец, определить тип химических компонентов с помощью предварительных тестов, чтобы помочь отличить порошок двух видов.
Материалы и методы
Образцы растений и приготовление порошков
Проростки (Se) X. strumarium были собраны в августе 2017 г. в районе Аль-Бахлулия к востоку от Латакии, Сирия. Затем из того же региона были собраны взрослые растения. Плоды получены в ноябре того же года. Что касается цветов, то они были собраны в сентябре 2018 года. Второй вид X. spinosum был собран в конце августа 2017 г. в районе Аль-Хусейн, к северу от Тартуса, и в районе Вади Аль-Надара, к западу от Хомса. Образцы сушили в тени в течение 14 дней в хорошо проветриваемом помещении.
Затем из того же региона были собраны взрослые растения. Плоды получены в ноябре того же года. Что касается цветов, то они были собраны в сентябре 2018 года. Второй вид X. spinosum был собран в конце августа 2017 г. в районе Аль-Хусейн, к северу от Тартуса, и в районе Вади Аль-Надара, к западу от Хомса. Образцы сушили в тени в течение 14 дней в хорошо проветриваемом помещении.
Выделены части X. strumarium : листья (Le)–стебли (St)–корни (Ro)–плоды (Fr)–цветочные почки (Flo). листьев X. spinosum (Spi, сокращение от spinosum ) отделяли от стебля и колючек. Образцы растений взвешивали после сушки: Le: 500 г, St: 300 г, Ro: 175 г, Fr: 600 г, Flo: 150 г, Spi: 100 г.
Все детали измельчали на электрической мельнице до получения мелкодисперсных порошков, которые затем хранили в плотно закрытых стеклянных емкостях, завернутых в темные пакеты, чтобы не подвергать воздействию воздуха и света, и хранили вдали от источников тепла и влаги до время использования.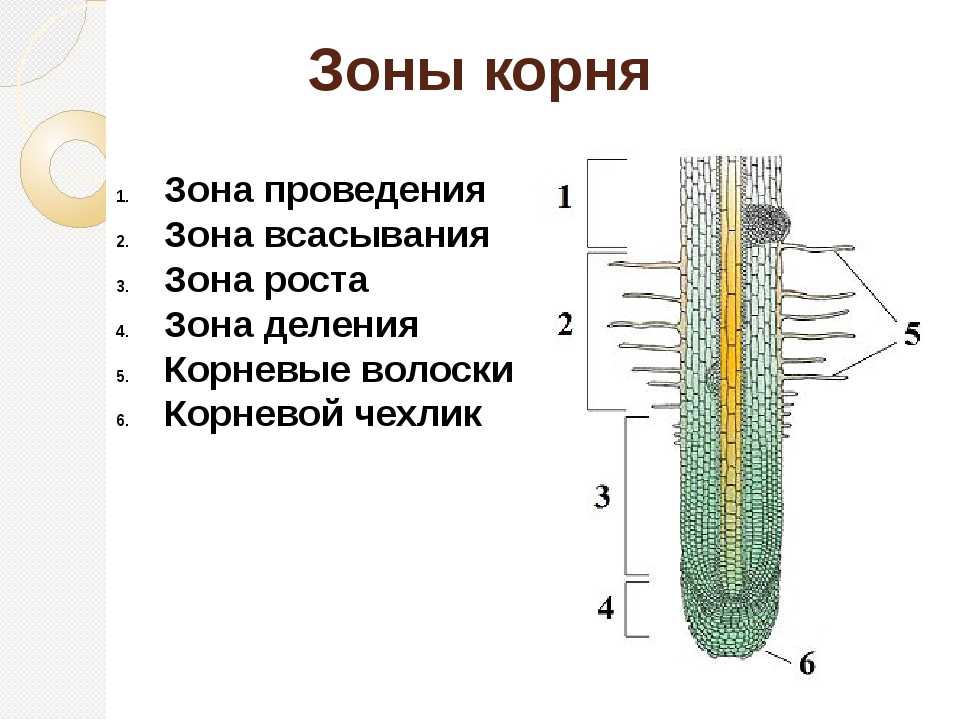
Микроскопическое исследование
Для микроскопии использовали два типа растворов:
Хлоралгидрат и глицерин : Хлоралгидрат растворяет крахмал, белки, хлорофилл, смолы и летучие масла и вызывает расширение сморщенных клеток. Он не растворяет оксалат кальция и поэтому является хорошим реагентом для обнаружения этих кристаллов. Глицерин полезен для препаратов, которые можно оставить на некоторое время [7].
Флороглюцин и соляная кислота : Порошок увлажняли спиртовым раствором флороглицина и оставляли на 2 минуты для высыхания, затем добавляли концентрированный раствор соляной кислоты. Все лигнифицированные стенки окрашиваются в розовый или красный цвет [7].
С каждым раствором; для трех образцов каждого порошка было проведено микроскопическое исследование и для каждого элемента было сделано несколько микрофотографий. Для микроскопического измерения отбирали самые лучшие и четкие микрофотографии.
Микроскопическое измерение
Это было выполнено с использованием микрометра-окуляра и его калибровки с помощью точно измеренного предметного столика-микрометра [17].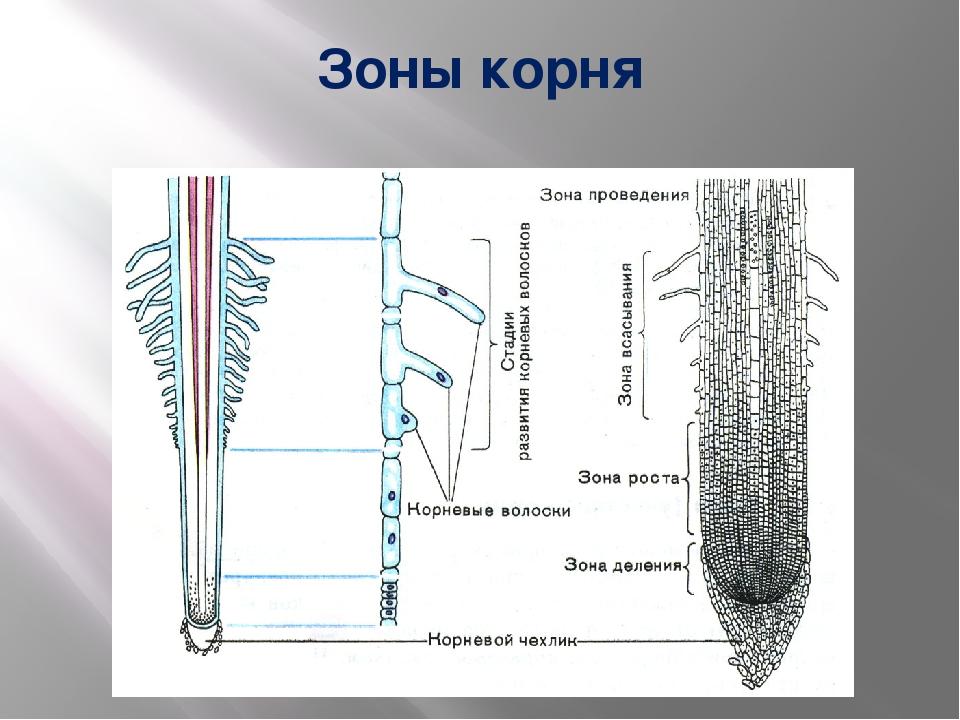 После калибровки было определено, что одна единица на окулярном микрометре равна приблизительно 9 мкм на предметном микрометре с объективом 10x и 2,35 мкм с объективом 40 x.
После калибровки было определено, что одна единица на окулярном микрометре равна приблизительно 9 мкм на предметном микрометре с объективом 10x и 2,35 мкм с объективом 40 x.
Предварительные испытания
Предварительные испытания были проведены для порошков. Были обнаружены и классифицированы следующие компоненты: алкалоиды-флавоноиды-антрахиноны-сапонины-таннины по методикам, указанным в руководстве Munajjed and Agha [13].
Обнаружение алкалоидов
Реакцией осаждения:
Небольшое количество порошка кипятили с количеством Соляной кислоты 2N + Воды, затем определяли из фильтрата реактивами Драгендорфа, Майера, Вагнера.
Обнаружение флавоноидов
Порошок экстрагировали метанолом и добавлением петролейного эфира отделяли нежелательные вещества. Метанольный экстракт использовали для обнаружения в следующих тестах:
Тест Уилсона-Таубока : Метанольный экстракт смешивали с борной кислотой и щавелевой кислотой. Образование флуоресцентного раствора свидетельствует о наличии флавоноидов.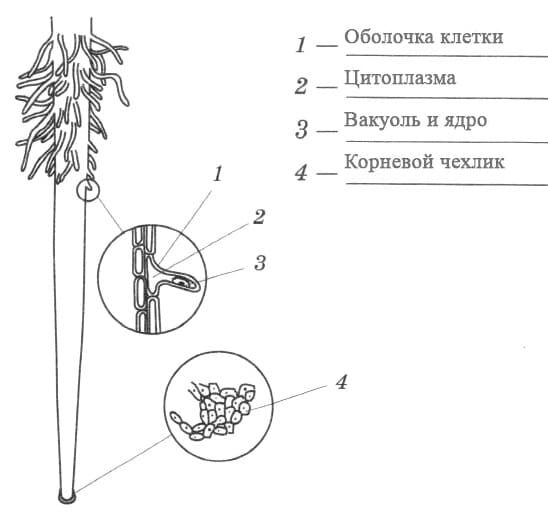
Испытание на хлорид алюминия : Метанольный экстракт смешивали с хлоридом алюминия. Затем каплю полученного раствора помещают на фильтровальную бумагу и наблюдают УФ-флуоресценцию.
Обнаружение дубильных веществ
Порошок экстрагировали этанолом, а дубильные вещества определяли раствором хлорида железа. Образование синей или зеленой окраски, быстро переходящей в черную, свидетельствует о наличии дубильных веществ.
Обнаружение антрахинонов
Путем кипячения порошка с 7%-ным количеством соляной кислоты, экстракции эфиром, отделения слоя этилового эфира и добавления к эфирному раствору примерно одной трети его объема аммиака. После встряхивания образование розового цвета в водном слое свидетельствует о наличии антрахинонов.
Обнаружение сапонинов
Испытание на пенообразование: порошок встряхивали с горячей водой. Образование пены, сохраняющееся в течение 10 мин, указывает на присутствие сапонинов.
Результаты
Микроскопическое исследование
X.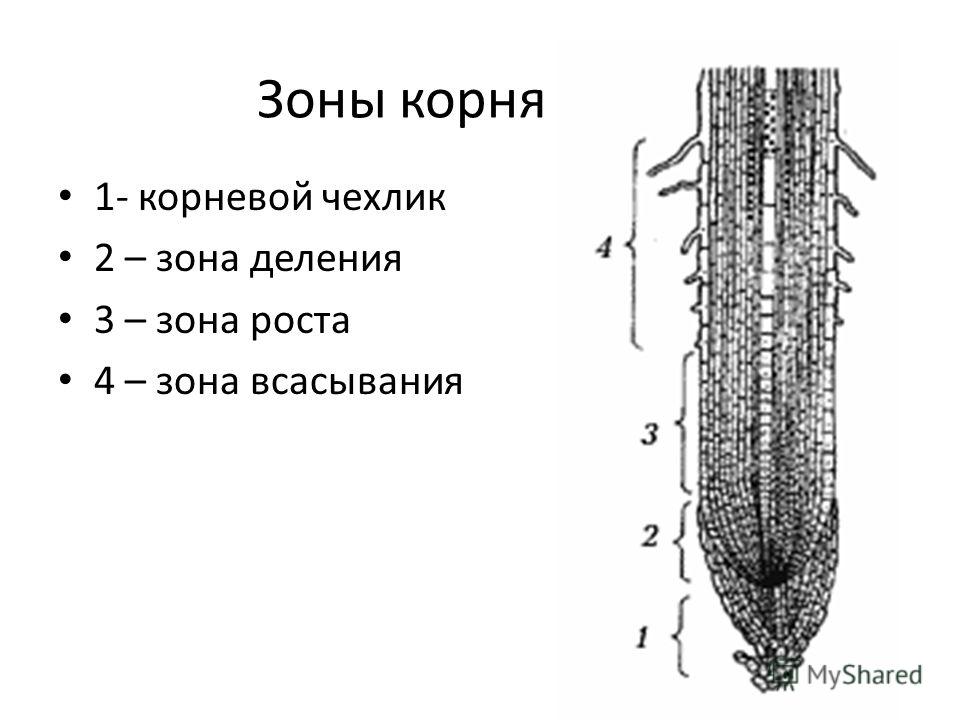 strumariun частей порошков
strumariun частей порошковМикроскопические характеристики порошка листьев
Нежелезистые трихомы трех типов:
- А.
Многоклеточные, однорядные, с острым колючим концом и четкими выступами. Общая длина не превышала 30 мкм (рис. 1а).
Рис. 1Микроскопические характеристики X.strumarium порошок листьев, a – c Нежелезистые трихомы. d Железистые трихомы. e Аномоцитарная стома. f Мезофилл, 10 ×
Изображение в полный размер
- Б.
Многоклеточные, однорядные, с очень острым колючим концом, четкими выступами и более широкими клетками, длиной примерно 15–20 мкм (рис.
 1б). Иногда эти трихомы кажутся меньше 7–9мкм (всего 2 клетки).
1б). Иногда эти трихомы кажутся меньше 7–9мкм (всего 2 клетки). - С.
Многоклеточные, однорядные, с гладкой стенкой (рис. 1в).
- А.
Железистые трихомы : Структура семейства сложноцветных: многоклеточная, двурядная головка и одноклеточное основание. Они были обнаружены в большом количестве на поверхности эпидермиса, прикрепленного к ткани мезофилла (рис. 1d).
Фрагменты эпидермиса с аномоцитарными устьицами (рис. 1д).
Фрагменты мезофилла в виде с поверхности (рис.
 1f).
1f).
Микроскопические характеристики порошка проростков
Предыдущие нежелезистые трихомы зрелых листьев выглядят одинаково, кроме наличия:
Железистые трихомы (семейство Asteraceae) кажутся свободными от эпидермальной ткани. Это отличает порошок проростков от порошка зрелых листьев (рис. 2)
Рис. 2Железистые трихомы X.strumarium Порошок проростков
Изображение в натуральную величину
Микроскопические характеристики корневого порошка
После окрашивания хлороглюцином кислоты можно наблюдать следующее:
Крупные фрагменты ямчатых сосудов (рис. 3а).
Рис. 3Микроскопические характеристики порошка корней X.strumarium . a Сосуды без косточек. b Каменные клетки
Изображение в натуральную величину
Фрагменты коры, содержащие рассеянные квадратные каменные клетки (рис.
 3b).
3b).
Микроскопические характеристики цветочного порошка
Сферические пыльцевые зерна с гладкой экзиной, некоторые зерна кажутся трехлопастными, диаметром примерно 25–27 мкм (рис. 4а).
Рис. 4Микроскопические характеристики порошка цветков X.strumarium . a Пыльцевые зерна. b Эндотеций. c Пыльник, 10 ×, 40 ×. d Эпидермис венчика
Изображение в натуральную величину
Фрагменты эндотеция пыльника (вид сверху) (рис. 4б).
Фрагменты целого пыльника (рис. 4в).
Эпидермис венчика цветка с клетками с волнистыми стенками (рис. 4d).

Микроскопические характеристики порошка плодов
После окрашивания флороглюцинолом и соляной кислотой можно наблюдать следующее:
Фрагменты мезокарпия, прикрепленного к эндокарпию (рис. 5а, б).
Рис. 5Микроскопические характеристики порошка плодов X.strumarium . a Эндокарпий, 10 ×. b Эндокарпий, 40 ×. c Волокно с окрашиванием. d Волокно, без окрашивания
Изображение в полный размер
Веретенообразные волокна длиной примерно 35–45 мкм (рис. 5в, г).
Микроскопические характеристики порошка стебля
После окрашивания флороглюцинолом и соляной кислотой можно наблюдать следующее:
Волокна, имеющие зубчатую стенку и обозначенные ямками просвета (рис.
Рис. 6 6а).
6а).Микроскопические характеристики порошка стебля X.strumarium . и Волокна. b Сосуды без косточек, спиральные. c Паренхиматозная клетка содержит розеточные кристаллы. d Фиолетовый пигмент
Изображение в натуральную величину
Сосуды двух типов: ямчатые и спиральные (рис. 6б).
- Клетка паренхимы
содержит розеточные кристаллы (рис. 6в).
Фрагменты полигональных клеток содержат фиолетовый пигмент. Эти пигменты представляют собой пятна, которые появляются на поверхности стебля (рис. 6г)
Микроскопические характеристики порошка листьев
X. spinosumФрагменты мезофилла, прикрепленные к эпидермису, и многочисленные трихомы, расположенные на его поверхности (рис.
Рис. 7 7а).
7а).Микроскопические характеристики порошка листьев X.spinosum . а Мезофилл, 10 ×. b Нежелезистая трихома. c Волокна
Полноразмерное изображение
Нежелезистые, многоклеточные, однорядные трихомы. Их поверхность гладкая, примерно 30–40 мкм в длину, а некоторые трихомы имеют размер 15–20 мкм (рис. 7б).
Железистые трихомы (семейство Asteraceae).
Волокна указывают на наличие наземных колючек с листьями (рис. 7в).
Микроскопическое различие между порошком листьев
X. strumariun и порошком листьев X. spinosumПолноразмерный стол
Результаты предварительных испытаний
Реакции обнаружения алкалоидов: в таблице 2 представлены следующие результаты.
Таблица 2 Обнаружение алкалоидов
Полноразмерная таблица
Реакции обнаружения флавоноидов: были показаны следующие результаты интенсивности УФ-флуоресценции теста Уилсона-Таубока и цвета УФ-флуоресценции теста хлорида алюминия (таблица 3, рис. 8).
Таблица 3 Обнаружение флавоноидовПолноразмерная таблица
Рис. 8Цвет УФ-флуоресценции хлорида алюминия тест
Полноразмерное изображение
- Результаты определения
антрахинонов и сапонинов были отрицательными во всех частях растения, но результаты определения дубильных веществ были положительными только в плодах и листьях X. spinosum (таблица 4).
Таблица 4 Обнаружение антрахинонов, сапонинов, дубильных веществПолноразмерная таблица
Обсуждение
В народной медицине листья, плоды и корни – это части, которые использовались от первого вида X. strumarium [9]. На этих частях, а также на листьях второго вида X. spinosum было проведено множество исследований эффективности. Следовательно, необходимо установить стандарты для контроля качества порошков этих деталей, и это исследование является дополнением к предыдущим исследованиям, проведенным на них. Микроскопическое исследование каждой части X. strumarium и листьев X. spinosum , и предварительные тесты, проведенные в этом исследовании, полезны для определения следующих стандартов: стадия, на которой растение было собрано, обнаружение загрязнения порошком во время сбора или измельчения растений, определение видов Xanthium , и тип химических компонентов, содержащихся в двух видах.
strumarium [9]. На этих частях, а также на листьях второго вида X. spinosum было проведено множество исследований эффективности. Следовательно, необходимо установить стандарты для контроля качества порошков этих деталей, и это исследование является дополнением к предыдущим исследованиям, проведенным на них. Микроскопическое исследование каждой части X. strumarium и листьев X. spinosum , и предварительные тесты, проведенные в этом исследовании, полезны для определения следующих стандартов: стадия, на которой растение было собрано, обнаружение загрязнения порошком во время сбора или измельчения растений, определение видов Xanthium , и тип химических компонентов, содержащихся в двух видах.
Листья X. strumarium чаще всего используются в лечебных целях, а по микроскопическим характеристикам представлены три типа многоклеточных нежелезистых трихом (рис. 1a-c). Бхогаонкар и Ахмад [3], предоставившие иллюстрации (без микрофотографии) трихом, указали на наличие четвертого типа: нежелезистые многоклеточные с многоклеточным основанием, но Рис.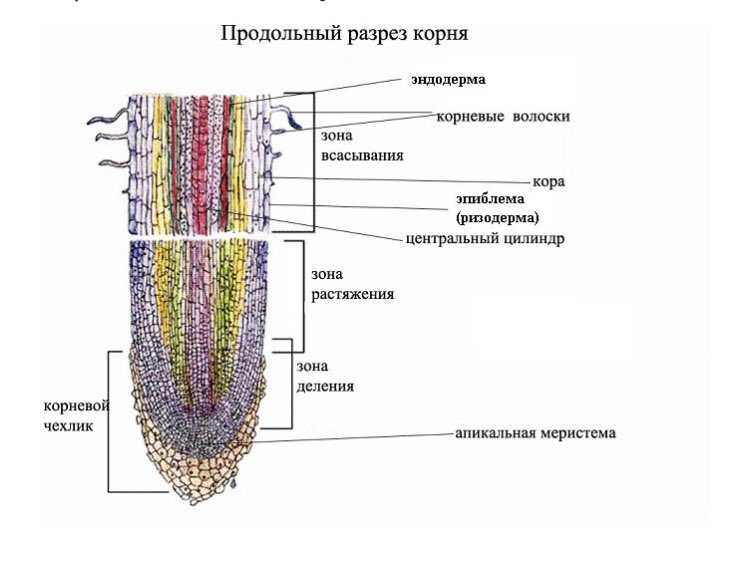 9показывает, что этот тип тот же, что и на рис. 1, тогда как основание трихомы может появляться, а может и не появляться. Bhogaonkar и Ahmad [3] также указали, что существует второй тип железистых трихом, представляющий собой чешуйчатый тип, но этот тип не появился в нашем исследовании. Возможное предлагаемое объяснение их наблюдений состоит в том, что это была сломанная часть нежелезистой трихомы или базальная область трихомы на листе, как показано на рис. 10. Шравани и Лакшми [15] упомянули, что тип устьиц был аномоцитарным и иногда может появиться анизоцитарный, как это наблюдали Bhogaonkar и Ahmad [3]. В то время как Рита и соавт. [14] обнаружили, что устьица были анизоцитарными. Однако в нашем исследовании был отмечен только аномоцитарный тип (рис. 1e, 11, 12).
9показывает, что этот тип тот же, что и на рис. 1, тогда как основание трихомы может появляться, а может и не появляться. Bhogaonkar и Ahmad [3] также указали, что существует второй тип железистых трихом, представляющий собой чешуйчатый тип, но этот тип не появился в нашем исследовании. Возможное предлагаемое объяснение их наблюдений состоит в том, что это была сломанная часть нежелезистой трихомы или базальная область трихомы на листе, как показано на рис. 10. Шравани и Лакшми [15] упомянули, что тип устьиц был аномоцитарным и иногда может появиться анизоцитарный, как это наблюдали Bhogaonkar и Ahmad [3]. В то время как Рита и соавт. [14] обнаружили, что устьица были анизоцитарными. Однако в нашем исследовании был отмечен только аномоцитарный тип (рис. 1e, 11, 12).
Присутствие основания Trichome
Полноразмерное изображение
Рис. 10Разбитая часть Trichome
Полноразмерное изображение Рис.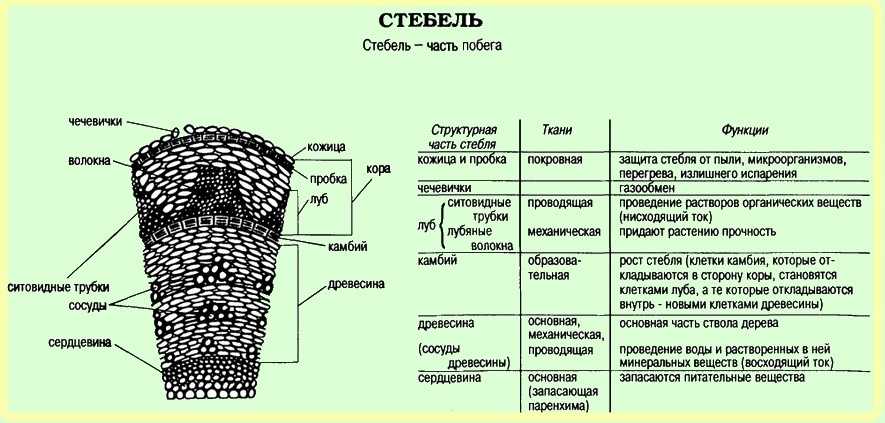 целое растение. B Фрукты X. Strumarium
целое растение. B Фрукты X. Strumarium
Полноразмерное изображение
Рис. 12X. Spinosum
Полноразмерный изображение
Зрелые листья x. Strumarium . время, поэтому микроскопическое исследование показывает время, когда растение было собрано. Цветочный порошок характеризовался фрагментами эндотеция пыльников в большом количестве, в дополнение к отчетливым пыльцевым зернам в их сферической или трехлопастной форме. Эти зерна появляются свободно в большом количестве и внутри фрагмента тычинки (рис. 4).
Стебли X. strumarium менее важны с медицинской точки зрения, и их предпочтительно отделять от листьев. Микроскопическое исследование может выявить, имело ли место разделение стебля во время сбора или листья измельчались вместе со стеблем. Появление волокон с зубчатой стенкой и полигональных клеток, содержащих пурпурные пигменты в элементах листовой муки, свидетельствует о том, что они были измельчены со стеблями (рис.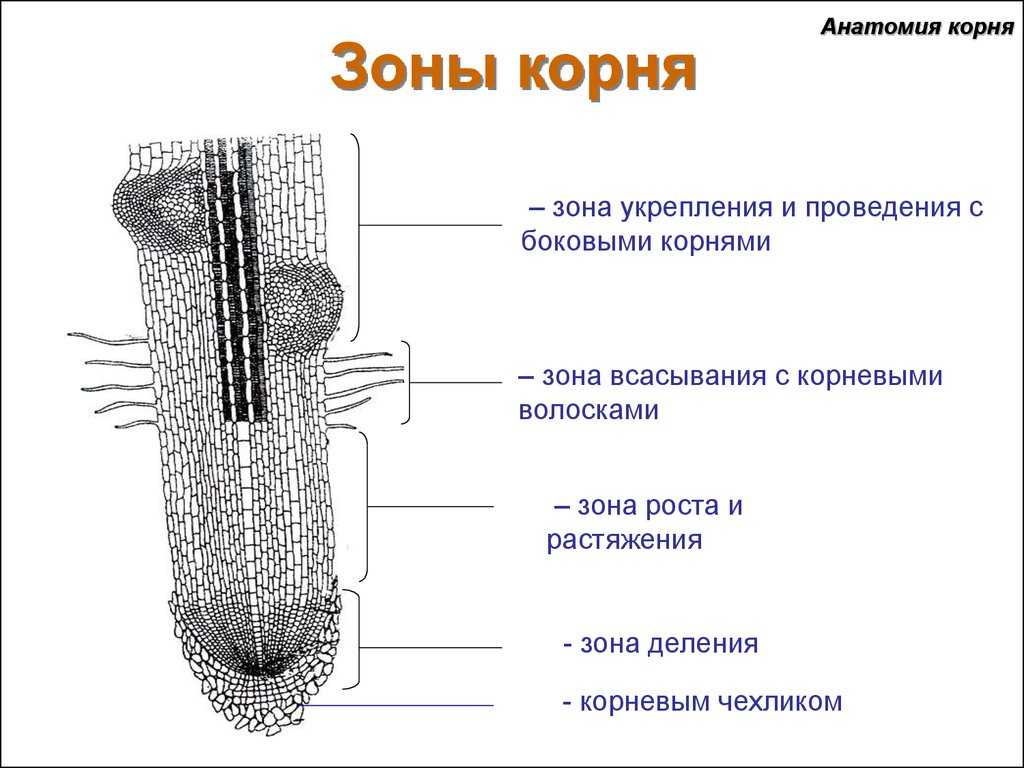 6).
6).
Корни X. strumarium традиционно использовались как горькое тонизирующее и жаропонижающее средство [9].], поэтому его можно использовать отдельно без листьев, и когда растения собирали для этого исследования, корни были полностью отделены от надземных частей. Следовательно, листовой порошок был чист от элементов корней. Микроскопическое исследование измельченных корней характеризовалось появлением каменистых клеток, рассеянных в кортикальной ткани, в дополнение к наличию крупных ямчатых сосудов (рис. 3).
Порошок рассады можно отличить по наличию свободных и четко обособленных железистых трихом при микроскопическом исследовании (рис. 2), поскольку количество железистых трихом больше на этой стадии роста и в молодых листьях [4].
Дхармананда [6] упомянул, что плоды используются в традиционной китайской медицине, но они содержат в своих шипах токсичное вещество, называемое карбоксиатрактилозидом (CAT), и лучший способ безопасного использования фруктов — это обжаривание с перемешиванием, затем шипы просеивают и удаляют.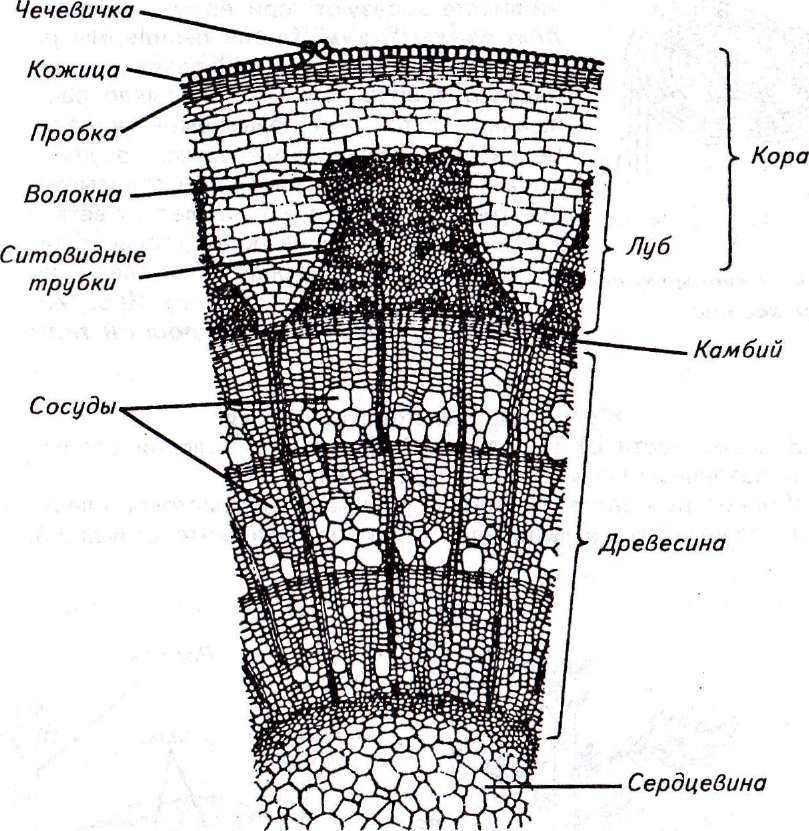 Только мытье или кипячение (отваривание) плодов или даже их обжаривание без удаления шипов не считается достаточным для избавления от токсичности. Плоды применяют в дозе 3–10 г, с 10-кратным запасом прочности по сравнению с дозой, вызывающей выраженную реакцию человека (100 г). Микроскопическое исследование плодового порошка показало наличие веретенообразных волокон и фрагментов мезокарпия, прикрепленных к эндокарпию плода (рис. 5). Коллекция надземных частей X. strumarium в период плодоношения не является подходящим временем для получения листьев. Если при микроскопическом исследовании обнаруживается наличие плодовых элементов с листовыми элементами, это свидетельствует о низком качестве порошка, так как растение не было вовремя собрано и листья были перемешаны с плодами, у которых перед измельчением необходимо удалить колючки.
Только мытье или кипячение (отваривание) плодов или даже их обжаривание без удаления шипов не считается достаточным для избавления от токсичности. Плоды применяют в дозе 3–10 г, с 10-кратным запасом прочности по сравнению с дозой, вызывающей выраженную реакцию человека (100 г). Микроскопическое исследование плодового порошка показало наличие веретенообразных волокон и фрагментов мезокарпия, прикрепленных к эндокарпию плода (рис. 5). Коллекция надземных частей X. strumarium в период плодоношения не является подходящим временем для получения листьев. Если при микроскопическом исследовании обнаруживается наличие плодовых элементов с листовыми элементами, это свидетельствует о низком качестве порошка, так как растение не было вовремя собрано и листья были перемешаны с плодами, у которых перед измельчением необходимо удалить колючки.
Микроскопическое исследование показывает четкие различия между нежелезистыми трихомами измельченных листьев X. strumarium и X. spinosum (таблица 1).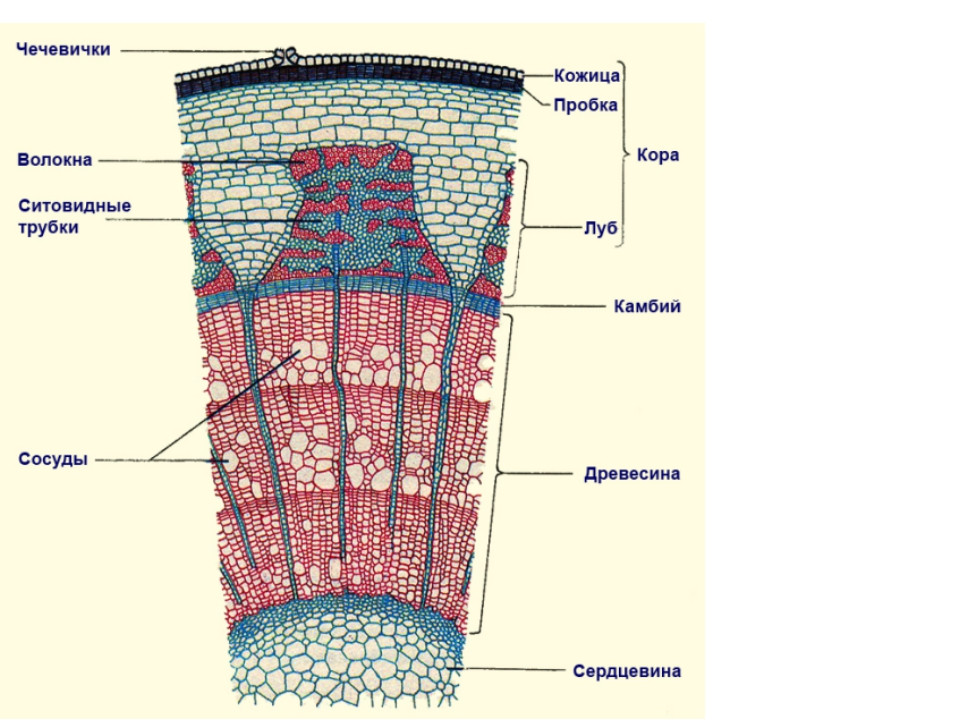 На поверхности трихом X. strumarium были видны четкие выступы, причем базальные клетки были шире апексных, тогда как нежелезистые трихомы X. spinosum характеризовались гладкой поверхностью и все клетки были примерно одинаковыми по размерам. .
На поверхности трихом X. strumarium были видны четкие выступы, причем базальные клетки были шире апексных, тогда как нежелезистые трихомы X. spinosum характеризовались гладкой поверхностью и все клетки были примерно одинаковыми по размерам. .
Морфология X. spinosum характеризуется наличием шипов, и эти шипы не несут медицинской пользы, поэтому их предпочтительно отделять от листьев. Микроскопия дает четкое указание на чистоту порошка листьев от шипов, так как она показывает, были ли листья измельчены вместе с шипами.
В таблице 2 показано, что листья, проростки и плоды X.strumarium содержат алкалоиды, поскольку есть два положительных результата, и это соответствует отчету Камбоя и Салуджи [9], что надземные части содержат смесь неидентифицированных алкалоидов. Фарук и др. [8], Devkota и Das [5] и Malpani et al. [11] также упомянули, что листья содержат алкалоиды, а Reeta et al. [14] и Шравани и Лакшми [15] пришли к выводу, что листья не содержат алкалоидов. Из предыдущей таблицы видно, что листья X. spinosum не содержат алкалоидов.
Из предыдущей таблицы видно, что листья X. spinosum не содержат алкалоидов.
В таблице 3 показано, что флавоноиды присутствуют в листьях двух видов, но их тип различается из-за различной флуоресценции.
Результаты определения антрахинонов и сапонинов были отрицательными, что свидетельствует об их отсутствии во всех частях, в то время как дубильные вещества обнаружены в плодах X. strumarium и листьях X. spinosum .
Предварительные испытания показали четкие различия, которые можно использовать для различения измельченных в порошок листьев двух видов. В X. strumarium , обнаружение алкалоидов было положительным, проба с хлоридом алюминия на обнаружение флавоноидов дала коричневую флуоресценцию в УФ. Результат проверки на дубильные вещества отрицательный. Что касается X. spinosum , то обнаружение алкалоидов было отрицательным, проба с хлоридом алюминия дала зеленую флуоресценцию, обнаружение дубильных веществ было положительным.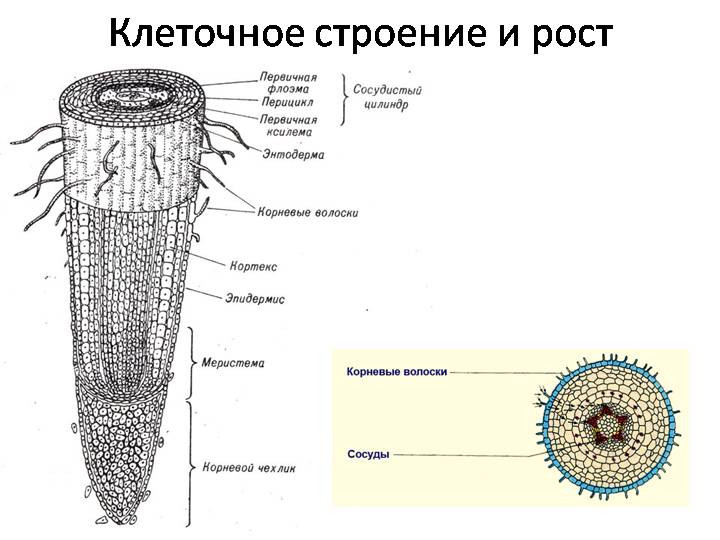
Выводы
Микроскопическое исследование дало четкие результаты и выявило порошки X. strumarium частей и порошки листьев X. spinosum . В зависимости от микрофотографии элементов можно контролировать качество порошков и выявлять наличие каких-либо загрязнений порошками. Предварительные испытания листьев двух видов дали дополнительный метод для дифференциации двух видов Xanthium .
Ссылки
Аль-Хаким В., Аль-Кади И., Ага Э. (2012) Атлас лекарственных и ароматических растений. Арабский центр исследований засушливых зон и засушливых земель (ACSAD), Дамаск, стр. 19.5–196
Google ученый
Джексон Б.П., Сноудон Д.В. (1990) Атлас микроскопии лекарственных растений, кулинарных трав и специй. Белхейвен Пресс, Лондон
Google ученый
«>Chen F, Hao F, Li C, Gou J, Lu D, Gong F, Tang H, Zhang Y (2013) Идентификация трех экологических хемотипов железистых трихом Xanthium strumarium с использованием комбинированного метода ЯМР и ЖХ-МС . PLoS ONE 8(10):e76621
Артикул Google ученый
Девкота А., Дас Р.К. (2016) Противогрибковая активность и фитохимический скрининг Xanthium Strumarium . Био Бык 2(1):121–127
Google ученый
Дхармананда С. (2003) Проблемы безопасности, связанные с китайскими травами: случай с ксантиумом. Институт традиционной медицины (ITM) — европейское отделение.
 1: 1–8
1: 1–8Evans WC (2009) Trease and Evans’ Pharmagnosy, Elsevier Health Sciences, 16-е изд. Elsevier Limited, Сондерс, Лондон
Google ученый
Фарук У., Васим Б., Музаффар Р., Трипати Дж., Тарани М., Шарма М. (2014) Сравнительное исследование фитохимических исследований Xanthium strumarium лекарственное растение. Int J Res Pharm Chem 4(1):96–100
Google ученый
Камбой А., Салуя А.К. (2010) Фитофармакологический обзор Xanthium strumarium L. (дурнишник). Int J Green Pharm 4:129–139
Статья Google ученый
Лав Д., Дансеро П. (1959) Биосистематические исследования Xanthium : таксономическая оценка и экологический статус. Джан Джей Бот 37: 173–208
Артикул Google ученый
«>Mouterde (1983) Nouvelle flore du Liban et de la Syrie. Dar El-machreq Editeurs, Бейрут, стр. 39.6–397
Google ученый
Мунаджед Х., Ага Э. (1997) Руководство по фитохимии и экстракции. Дамасский университет, Дамаск
Google ученый
Reeta S, Kavita G, Arjun P, Rimpal J (2010) Фармакогностическая стандартизация листьев Xanthium strumarium Linn. Phcog J 2(12):492–497
Статья Google ученый
Шравани П.

Бхогаонкар П.Ю., Ахмад С.А. (2012) Фармакогностические исследования Xanthium strumarium L — народного лекарственного растения унани. Biosci Discov 3(1):101–106
Google ученый
Малпани М.О., Раджпут П.Р., Чинхоле К.В., Капсе С.С., Амбаркар К.С. (2019) Фитохимический скрининг и антиоксидантная активность экстрактов Xanthium strumarium , C hrysanthemum и их смеси. Rasayan J Chem 12(4):1901–1908
Статья Google ученый


 Шунтирование сломанного инструментария (клинические случаи) // С. 9.0007 Международный журнал науки и исследований , том. 6, нет. 2, стр. 2015–2017, 2017.
Шунтирование сломанного инструментария (клинические случаи) // С. 9.0007 Международный журнал науки и исследований , том. 6, нет. 2, стр. 2015–2017, 2017. 1б). Иногда эти трихомы кажутся меньше 7–9мкм (всего 2 клетки).
1б). Иногда эти трихомы кажутся меньше 7–9мкм (всего 2 клетки).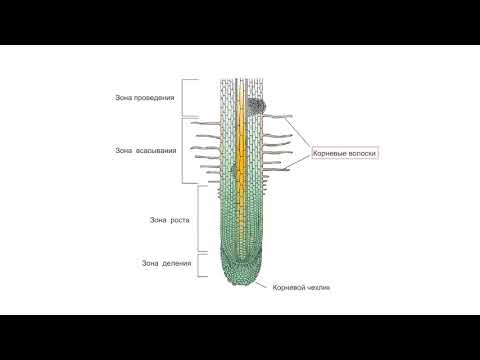 1f).
1f).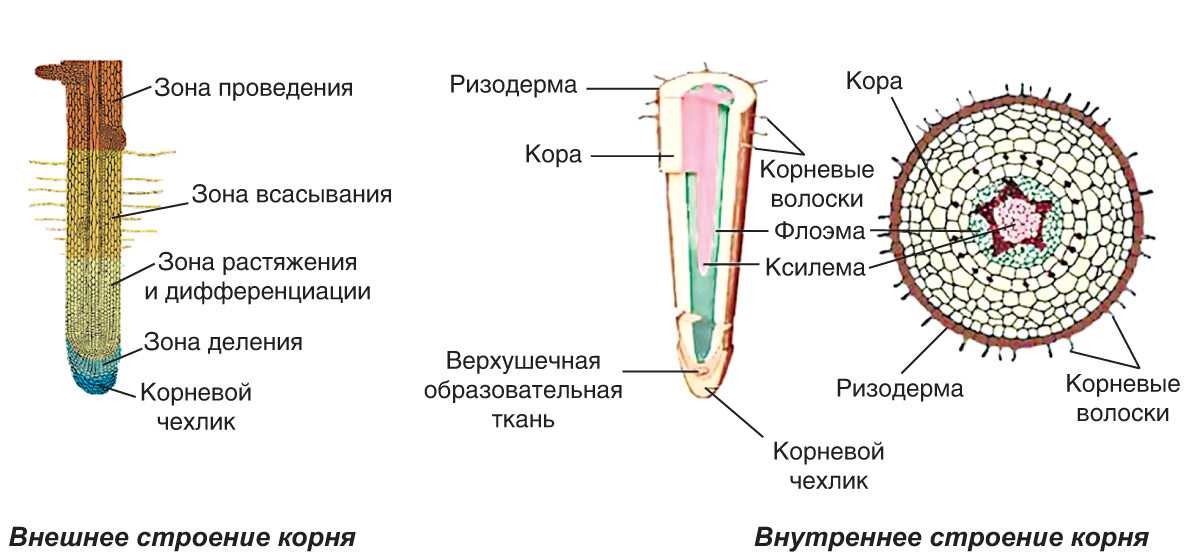 3b).
3b).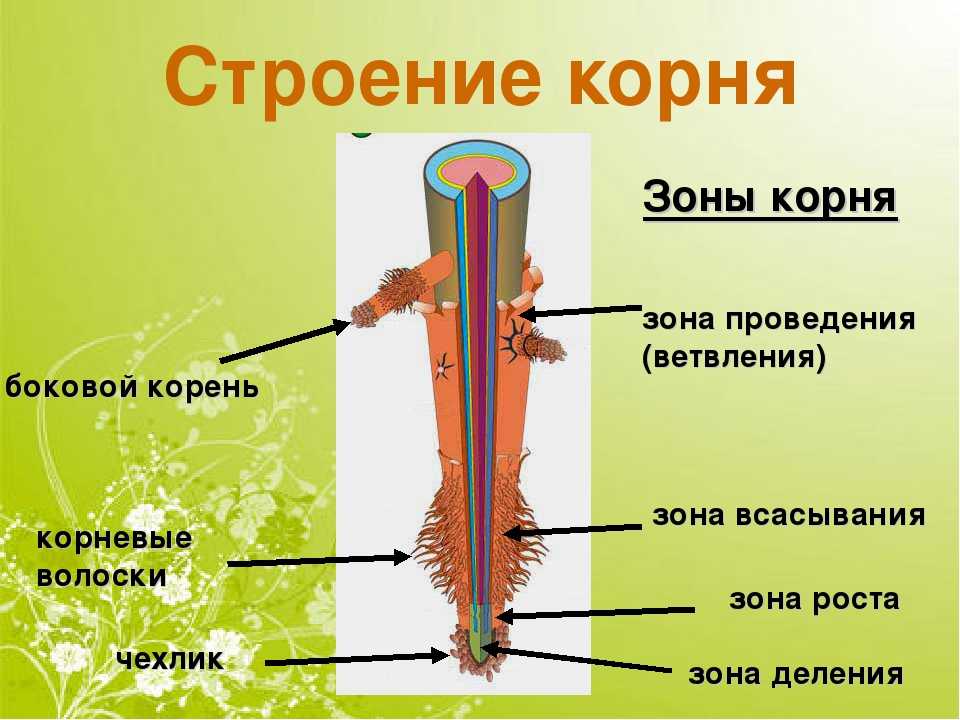
 6а).
6а).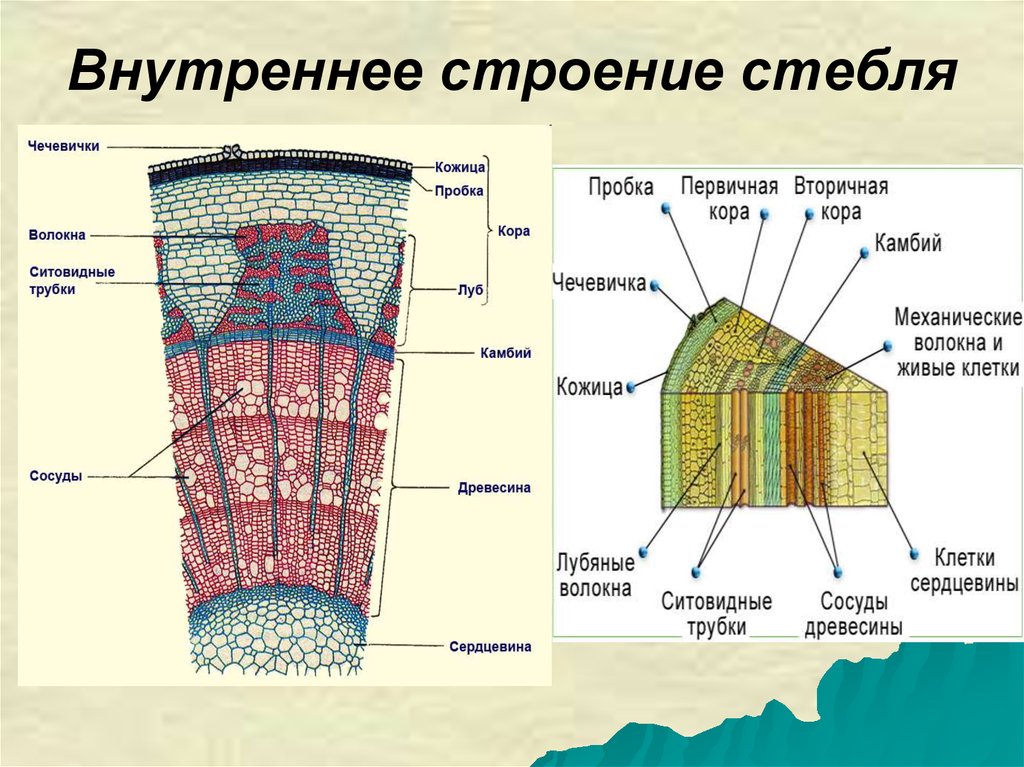 7а).
7а).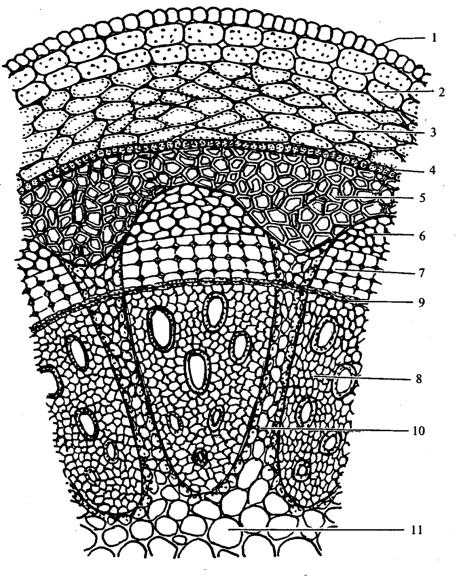
 1: 1–8
1: 1–8