Как определяется место химического элемента в периодической системе: Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ
Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп.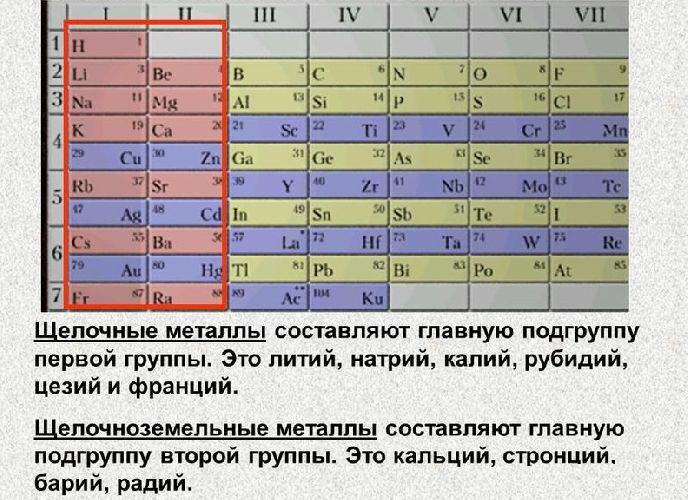 Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.

- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции.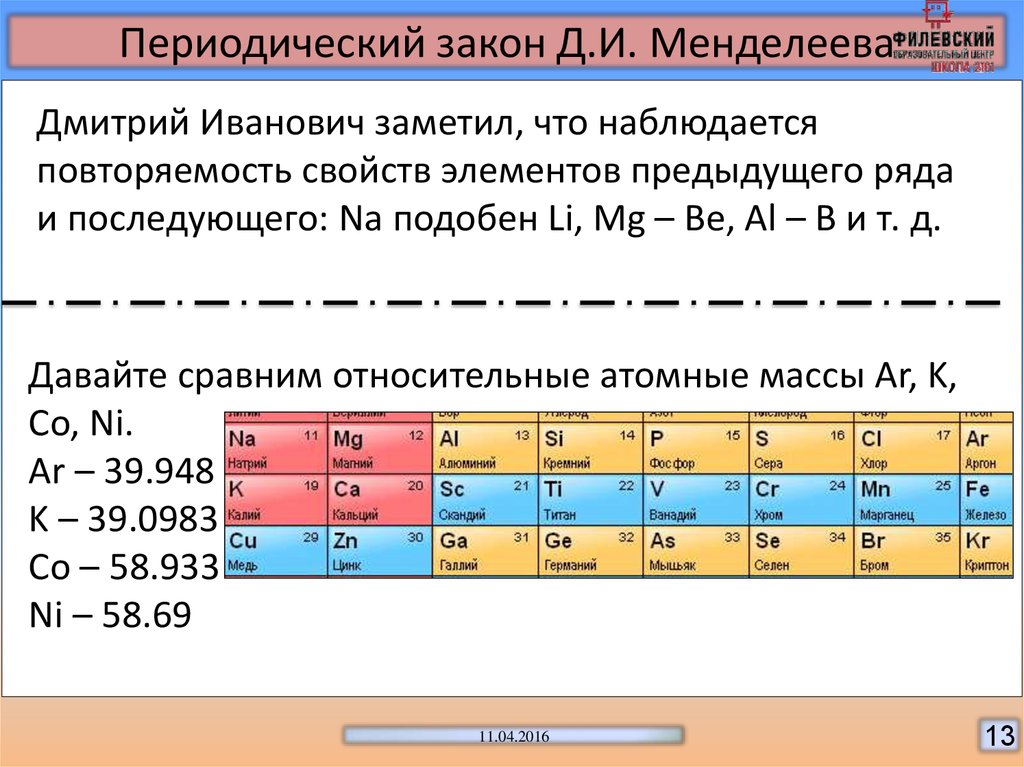 Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду
CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
Строение атома
В результате открытия в 1911 г. Э. Резерфордом
атомного ядра образовалась новая концепция строения материи: атом состоит из
массивного положительно заряженного атомного ядра, окруженного электронными
оболочками. Положительный заряд атомного ядра определяет суммарное число
электронов в атомных оболочках. В целом атом является электрически нейтральной
системой. Н. Бор, 1913 г.: «Квантовая теория строения атомов. 1. Среди мыслимых состояний движения атомной
системы имеется ряд так называемых стационарных состояний, относительно которых
предполагается, что движение частиц в этих состояниях, подчиняясь в значительном
объеме классическим механическим законам, отличается, однако, своеобразной
механически необъяснимой устойчивостью, в результате которой следует, что всякое
остаточное изменение движения системы должно состоять в полном переходе из
одного состояния в другое. 2. В самих стационарных состояниях, в противоречие с классической электромагнитной теорией, излучения не происходит, однако процесс перехода между двумя стационарными состояниями может сопровождаться электромагнитным излучением, обладающим теми же свойствами, как излучение, посылаемое на основании классической теории электрической частицей, совершающей гармонические колебания с постоянной частотой. Эта частота ν не находится, однако, в простом отношении к движению частиц атома и определяется условием hν = E’ – E» где h – постоянная Планка, E’ и E» – значение атомной энергии в двух стационарных состояниях, образующих начальное и конечное состоянии процесса излучения. Обратно, освещение атома электромагнитными волнами этой частоты может привести к процессу поглощения, переводящее атом из конечного состояния в начальное». Электрон согласно модели Н. Бора в атоме водорода вращается вокруг ядра по классическим траекториям, не излучая энергию, если на его орбите укладывается целое число длин волн де Бройля nλ = 2πrn, n = 1, 2, 3. Разным разрешённым орбитам n соответствуют разные энергии электронов En n = 1, 2, 3… Радиус первой боровской орбиты атома водорода r1 ≈ 0.53·10-8см. Электромагнитное взаимодействие электронов и атомных ядер определяет энергию связи и размеры атомов, размеры молекулярных структур. Э. Резерфорд, 1914 г.: «Из рассмотрения атомов водорода и гелия, где водород имеет один
электрон, а гелий – два, очевидно, что число электронов не может быть всегда
точно равно половине атомного веса. Это приводит к интересному предположению,
которое высказал Размеры атома составляют несколько ангстрем (1 Å = 10–8 см). Химические свойства атомов,
способность атомов образовывать различные химические соединения – молекулы
определяются внешней электронной оболочкой атома и зависят от числа электронов в
ней. Э. Резерфорд впервые использовал ядерные реакции под действием
α‑частиц
для изучения свойств атомного ядра. Следующим шагом в познании строения материи
стало открытие в 1919 г. протона Э. Резерфордом и в 1932 г. Z + N = A. Атомные ядра обладают магнитными моментами, которые измеряются в ядерных магнетонах где mp – масса протона. где me – масса электрона. Магнитные момента атомов в тысячи раз больше магнитных моментов ядер. Таблица 1 Характеристики протона, нейтрона и электрона
Протон, нейтрон и электрон являются фермионами, имеют спин J = 1/2 и подчиняются принципу Паули. Нейтрон имеет массу на 1.3 МэВ больше, чем протон, поэтому в свободном состоянии он распадается на протон p, электрон e− и электронное антинейтрино | |||||||||||||||||||||||||||||||||||||||||||
Периодическая таблица элементов | Live Science
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Периодическая таблица, также называемая периодической таблицей элементов, представляет собой упорядоченное расположение 118 известных химических элементов. Химические элементы расположены слева направо и сверху вниз в порядке возрастания атомного номера или числа протонов в ядре атомов , что обычно совпадает с увеличением атомной массы.
Горизонтальные строки в периодической таблице называются периодами, где каждый номер периода указывает количество орбиталей для элементов в этой строке, согласно Лос-Аламосской национальной лаборатории (открывается в новой вкладке). (Атомы имеют протоны и нейтроны в своем ядре, а вокруг него электроны расположены на орбиталях, где атомная орбиталь — это математический термин, описывающий местоположение электрона, а также его волнообразное поведение.)
Для например, период 1 включает элементы, которые имеют одну атомную орбиталь, на которой вращаются электроны; период 2 имеет две атомные орбитали, период 3 имеет три и так далее до периода 7. Столбцы или группы периодической таблицы представляют собой атомные элементы, которые имеют одинаковое количество валентных электронов, или те электроны, которые находятся на самой внешней орбитальной оболочке. . Например, все элементы группы 8A (или VIIIA) имеют полный набор из восьми электронов на орбите с самой высокой энергией, согласно химику Уильяму Ройшу на его веб-странице в Мичиганском государственном университете .
Родственный: Как сгруппированы элементы?
Кто создал периодическую таблицу?
Дмитрий Менделеев, русский химик и изобретатель, по мнению Королевского химического общества, считается «отцом» периодической таблицы . В 1860-х годах Менделеев был популярным лектором в университете в Санкт-Петербурге, Россия. В то время не существовало современных учебников органической химии на русском языке, поэтому Менделеев решил написать один. По словам Академии Хана, работая над этой книгой под названием «Принципы химии» (два тома, 1868–1870 гг.), Он одновременно занимался проблемой неупорядоченных элементов .
(Изображение предоставлено: Oxford Science Archive/Print Collector/Getty Images) Расположить элементы в любом порядке оказалось бы довольно сложно. В то время было известно 63 химических элемента, каждый из которых имел атомный вес, рассчитанный с использованием гипотезы Авогадро, согласно которой равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул.
В то время было известно 63 химических элемента, каждый из которых имел атомный вес, рассчитанный с использованием гипотезы Авогадро, согласно которой равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул.
В то время существовало всего две стратегии классификации этих элементов: разделение их на металлы и неметаллы или группировка по количеству валентных электронов элемента (или тех электронов, которые находятся на самой внешней оболочке). Первый раздел книги Менделеева касался только восьми известных элементов — углерода, водорода, кислорода, азота, хлора, фтора, брома и йода — и эти две стратегии работали для этих конкретных элементов, согласно Майклу Д. Гордину в его книге. «Хорошо упорядоченная вещь: Дмитрий Менделеев и тень периодической таблицы» (Princeton University Press, исправленное издание, 2018 г.). Но их было недостаточно, чтобы с пользой отсортировать 55 дополнительных химических элементов, известных в то время.
Итак, согласно Королевскому химическому обществу, Менделеев записал свойства каждого элемента на карточках, а затем начал упорядочивать их по возрастанию атомного веса.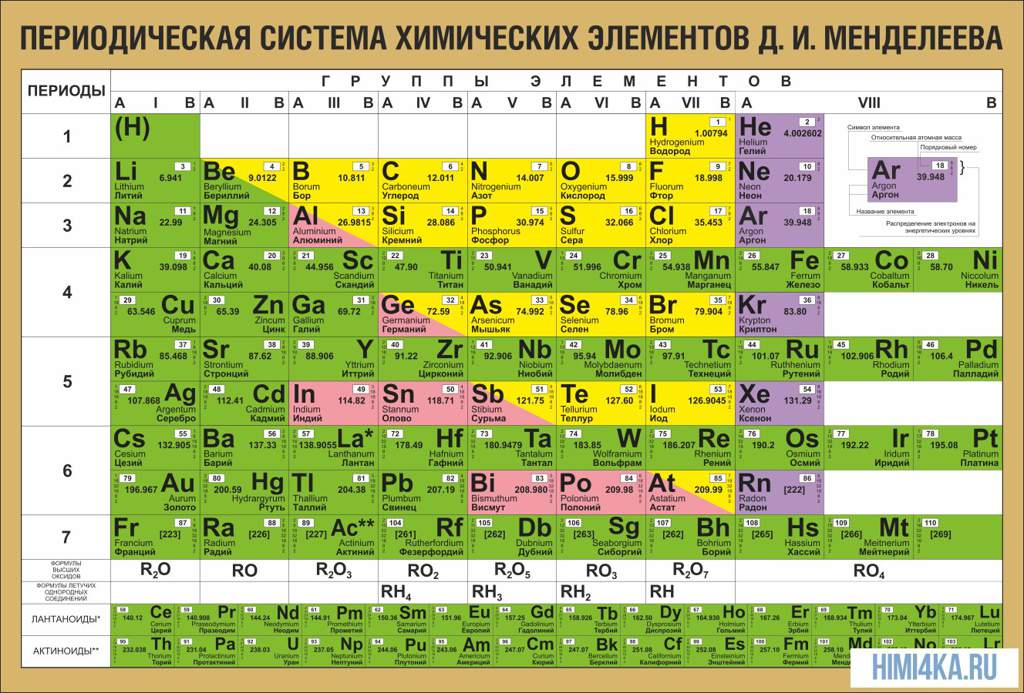 Именно тогда он заметил регулярное появление определенных типов элементов и заметил корреляцию между атомным весом и химическими свойствами.
Именно тогда он заметил регулярное появление определенных типов элементов и заметил корреляцию между атомным весом и химическими свойствами.
Но точно Эврика! Момент, который привел Менделеева к стратегии сортировки, позволившей создать его полную периодическую таблицу, окутан тайной. «Чрезвычайно трудно реконструировать процесс, посредством которого Менделеев пришел к своей периодической организации элементов по их атомному весу», — писал Гордин о полной периодической таблице. «Проблема с точки зрения историка заключается в том, что, хотя Менделеев хранил почти все документы и черновики, которые попадали ему в руки после того, как он верил, что станет знаменитым, он не делал этого до формулировки периодического закона».
Здесь показана первая Периодическая таблица элементов Менделеева. (Изображение предоставлено: Photo12/Universal Images Group через Getty Images)(открывается в новой вкладке)
Гордин продолжил: «Есть два основных пути, которыми Менделеев мог уйти от признания важности атомного веса как хорошего инструмента классификации. к наброску периодической системы: либо он выписал элементы в порядке их атомного веса рядами и заметил периодическое повторение, либо он собрал несколько «естественных групп» элементов, таких как галогены и щелочные металлы, и заметил закономерность увеличения масса.» Оказывается, единственное известное высказывание Менделеева, связанное с его методом, было сделано в апреле 1869 года.; он писал, что «собрал тела с наименьшим атомным весом и расположил их в порядке увеличения их атомного веса», согласно книге Гордина.
к наброску периодической системы: либо он выписал элементы в порядке их атомного веса рядами и заметил периодическое повторение, либо он собрал несколько «естественных групп» элементов, таких как галогены и щелочные металлы, и заметил закономерность увеличения масса.» Оказывается, единственное известное высказывание Менделеева, связанное с его методом, было сделано в апреле 1869 года.; он писал, что «собрал тела с наименьшим атомным весом и расположил их в порядке увеличения их атомного веса», согласно книге Гордина.
Каким бы ни был его мыслительный процесс, Менделеев в конечном итоге расположил элементы в соответствии как с атомным весом, так и с валентными электронами. Он не только оставил место для еще не открытых элементов, но и предсказал свойства пяти из этих элементов и их соединений. В марте 1869 года он представил находки Русскому химическому обществу. Позже в том же году его новая периодическая система была опубликована в виде реферата в немецком периодическом химическом журнале 9. 0005 Zeitschrift fϋr Chemie (открывается в новой вкладке) (Journal of Chemistry), согласно Калифорнийского университета, Сан-Диего (открывается в новой вкладке).
0005 Zeitschrift fϋr Chemie (открывается в новой вкладке) (Journal of Chemistry), согласно Калифорнийского университета, Сан-Диего (открывается в новой вкладке).
Чтение периодической таблицы
Периодическая таблица содержит огромное количество информации:
Атомный номер: Количество протонов в ядре атома называется атомным номером этого элемента. Количество протонов определяет, какой это элемент, а также определяет химическое поведение элемента. Например, атомов углерода всегда имеют шесть протонов; атомов водорода всегда имеют один; а атомов кислорода всегда имеют восемь. Различные версии одного и того же элемента, называемые изотопами, могут иметь разное количество нейтронов; также элемент может приобретать или терять электроны, чтобы стать заряженными, и в этом случае они называются ионами.
Символ атома: Символ атома (или символ элемента) представляет собой аббревиатуру, выбранную для обозначения элемента («C» для углерода, «H» для водорода и «O» для кислорода и т. д.). Эти символы используются на международном уровне и иногда являются неожиданными. Например, символ вольфрама — «W», потому что другое название этого элемента — вольфрам. Кроме того, атомный символ золота — «Au», потому что слово «золото» на латыни — «aurum».
д.). Эти символы используются на международном уровне и иногда являются неожиданными. Например, символ вольфрама — «W», потому что другое название этого элемента — вольфрам. Кроме того, атомный символ золота — «Au», потому что слово «золото» на латыни — «aurum».
Атомная масса: Стандартная атомная масса элемента – это средняя масса элемента, выраженная в единицах атомной массы (а.е.м.). Несмотря на то, что каждый атом имеет примерно целое число атомных единиц массы, вы заметите, что атомная масса в периодической таблице является десятичной; это потому, что это число представляет собой средневзвешенное значение различных встречающихся в природе изотопов элемента на основе их распространенности. Изотоп — это разновидность элемента с другим числом нейтронов в ядре. (Чтобы рассчитать среднее количество нейтронов в элементе, вычтите количество протонов (атомный номер) из атомной массы.)
Например, вот как можно рассчитать атомную массу углерода, который имеет два изотопа:
Умножьте распространенность изотопа на его атомную массу:
Углерод-12: 0,9889 x 12,0000 = 11,8668
Углерод-13 : 0,0111 x 13,0034 = 0,1443
Затем сложите результаты:
11,8668 + 0,1443 = 12,0111 = атомный вес углерода
, который имеет атомный номер 92), нет «естественной» численности, Лос-Аламосская национальная лаборатория (LANL) отметила . Для этих элементов атомный вес самого долгоживущего изотопа указан в периодической таблице, согласно Международному союзу теоретической и прикладной химии (IUPAC) — мировому авторитету в области химической номенклатуры и терминологии. Эти атомные веса следует считать условными, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада (сколько времени требуется для разложения 50% этого элемента), согласно LANL
Для этих элементов атомный вес самого долгоживущего изотопа указан в периодической таблице, согласно Международному союзу теоретической и прикладной химии (IUPAC) — мировому авторитету в области химической номенклатуры и терминологии. Эти атомные веса следует считать условными, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада (сколько времени требуется для разложения 50% этого элемента), согласно LANL
Сверхтяжелые элементы или элементы с атомным номером выше 104 также попадают в эту неприродную категорию. Чем больше ядро атома — которое увеличивается с увеличением количества протонов внутри — тем обычно более нестабилен этот элемент. Таким образом, согласно ИЮПАК, эти негабаритные элементы мимолетны, длятся всего миллисекунды, прежде чем распасться на более легкие элементы. Например, сверхтяжелые элементы 113, 115, 117 и 118 прошли проверку IUPAC в декабре 2015 года, заполнив седьмую строку или точку в таблице. Несколько разных лабораторий производили сверхтяжелые элементы. Атомные номера, временные названия и официальные названия:
Атомные номера, временные названия и официальные названия:
- 113: унунтрий (Uut), нихоний (Nh)
- 115: унунпентий (Uup), московий (Mc)
- 117: унунсептий (Uus), теннессин (Ts)
- 118: унунпентий (Usonoctium) (Og)
Как устроена Периодическая таблица?
Водород делит свой единственный валентный электрон с одним из валентных электронов кислорода; когда два атома водорода образуют эти ковалентные связи с одним атомом кислорода, в результате получается h3O или вода. (Изображение предоставлено: Encyclopaedia Britannica/UIG через Getty Images) Периодическая таблица упорядочена по атомному весу и валентным электронам. Эти переменные позволили Менделееву разместить каждый элемент в определенной строке (называемой периодом) и столбце (называемой группой). Таблица состоит из семи строк и 18 столбцов. Каждый элемент в одной строке имеет такое же количество атомных орбиталей (пространств, где существуют электроны), что и другие элементы в этой строке или периоде. Это означает, что все элементы третьего периода — натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон — имеют три атомные орбитали, на которых находятся их электроны. Между тем столбец или группа означает количество электронов в самой внешней оболочке атома; они называются валентными электронами, и это электроны, которые могут химически связываться с валентными электронами других элементов. Валентные электроны могут быть либо разделены с другим элементом, что является типом ковалентной связи, либо заменены типом ионной связи, согласно 9.0005 Lumen Learning (открывается в новой вкладке).
Это означает, что все элементы третьего периода — натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон — имеют три атомные орбитали, на которых находятся их электроны. Между тем столбец или группа означает количество электронов в самой внешней оболочке атома; они называются валентными электронами, и это электроны, которые могут химически связываться с валентными электронами других элементов. Валентные электроны могут быть либо разделены с другим элементом, что является типом ковалентной связи, либо заменены типом ионной связи, согласно 9.0005 Lumen Learning (открывается в новой вкладке).
Например, все элементы во втором столбце имеют два валентных электрона; в третьем столбце у них три валентных электрона. Есть некоторые исключения из этого правила для переходных элементов, которые заполняют более короткие столбцы в центре периодической таблицы. Эти переходные элементы
Давайте рассмотрим пример: мы можем выбрать селена , который имеет атомный номер 34, что означает, что в нейтральном атоме селена всего 34 электрона. Этот неметалл находится в периоде 4, группе 6А. Это означает, что селен удерживает свои электроны на четырех атомных орбиталях и имеет шесть валентных электронов или шесть электронов на самой внешней орбитали. Вы также можете выяснить, сколько электронов находится на его первой, второй и третьей орбиталях: первая орбиталь может содержать максимум два электрона, а вторая имеет четыре суборбитали и, таким образом, может содержать в общей сложности восемь электронов. Третья оболочка атома, состоящая из девяти суборбиталей, может содержать максимум 18 электронов, согласно Факультет химии и биохимии Университета штата Флорида (открывается в новой вкладке). Это означает, что селен имеет 2, 8, 18 и 6 электронов на первой, второй, третьей и четвертой атомной орбитали соответственно.
Этот неметалл находится в периоде 4, группе 6А. Это означает, что селен удерживает свои электроны на четырех атомных орбиталях и имеет шесть валентных электронов или шесть электронов на самой внешней орбитали. Вы также можете выяснить, сколько электронов находится на его первой, второй и третьей орбиталях: первая орбиталь может содержать максимум два электрона, а вторая имеет четыре суборбитали и, таким образом, может содержать в общей сложности восемь электронов. Третья оболочка атома, состоящая из девяти суборбиталей, может содержать максимум 18 электронов, согласно Факультет химии и биохимии Университета штата Флорида (открывается в новой вкладке). Это означает, что селен имеет 2, 8, 18 и 6 электронов на первой, второй, третьей и четвертой атомной орбитали соответственно.
Как сегодня используется Периодическая таблица?
Зная, что некоторые элементы, собранные вместе на столе, обладают определенными характеристиками и поведением, ученые могут выяснить, какие из них лучше всего подходят для определенных отраслей и процессов.
В общем, химики и другие ученые могут использовать таблицу, чтобы предсказать, как определенные элементы будут реагировать друг с другом. Щелочные металлы, например, находятся в первой колонке или группе таблицы и, как правило, имеют один валентный электрон и поэтому несут заряд +1. Этот заряд означает, что они «энергично реагируют с водой и легко соединяются с неметаллами», — написала химик Энн Мари Хельменстайн 9 сентября.0005 МысльКо. Магний, который находится в той же группе в таблице, что и кальций, становится полезным в составе сплавов для костных имплантатов, сообщает NIST. Поскольку эти сплавы являются биоразлагаемыми, они служат каркасом, а затем исчезают после того, как на структурах нарастает естественная кость.
Дополнительный отчет Трейси Педерсен, автора Live Science
Химический элемент | Определение, происхождение, распространение и факты
химический элемент
Посмотреть все СМИ
- Ключевые люди:
- Лотар Мейер Антуан Лавуазье Дмитрий Менделеев Луи Бернар Гайтон де Морво Джозеф Лошмидт
- Похожие темы:
- редкоземельный элемент изотоп переходный металл периодическая таблица водород
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
химический элемент , также называемый элемент , любое вещество, которое не может быть разложено на более простые вещества с помощью обычных химических процессов. Элементы — это основные материалы, из которых состоит вся материя.
В этой статье рассматривается происхождение элементов и их изобилие во Вселенной. Подробно рассмотрено геохимическое распространение этих элементарных веществ в земной коре и недрах, их нахождение в гидросфере и атмосфере. В статье также рассматривается периодический закон и основанное на нем табличное расположение элементов. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Подробно рассмотрено геохимическое распространение этих элементарных веществ в земной коре и недрах, их нахождение в гидросфере и атмосфере. В статье также рассматривается периодический закон и основанное на нем табличное расположение элементов. Для получения подробной информации о соединениях элементов, см. химическое соединение.
Редакторы Британской энциклопедии
Общие наблюдения
В настоящее время известно 118 химических элементов. Около 20% из них не существуют в природе (или присутствуют лишь в следовых количествах) и известны только потому, что получены синтетическим путем в лаборатории. Из известных элементов 11 (водород, азот, кислород, фтор, хлор и шесть инертных газов) являются газами при обычных условиях, два (бром и ртуть) являются жидкостями (еще два, цезий и галлий, плавятся при температуре около или около выше комнатной температуры), а остальные – твердые вещества. Элементы могут соединяться друг с другом, образуя широкий спектр более сложных веществ, называемых соединениями. Количество возможных соединений почти бесконечно; известно, возможно, миллион, и каждый день открываются новые. Когда два или более элемента объединяются, образуя соединение, они теряют свою самостоятельную идентичность, и продукт приобретает характеристики, совершенно отличные от характеристик составляющих его элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут соединяться, образуя сложную воду, свойства которой совершенно отличаются от кислорода или водорода. Вода явно не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества ни одним известным химическим процессом. Большинство образцов природного вещества представляют собой физические смеси соединений. Морская вода, например, представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия, или поваренная соль.
Количество возможных соединений почти бесконечно; известно, возможно, миллион, и каждый день открываются новые. Когда два или более элемента объединяются, образуя соединение, они теряют свою самостоятельную идентичность, и продукт приобретает характеристики, совершенно отличные от характеристик составляющих его элементов. Газообразные элементы водород и кислород, например, с совершенно разными свойствами, могут соединяться, образуя сложную воду, свойства которой совершенно отличаются от кислорода или водорода. Вода явно не является элементом, потому что она состоит из двух веществ, водорода и кислорода, и может быть химически разложена на них; эти два вещества, однако, являются элементами, потому что они не могут быть разложены на более простые вещества ни одним известным химическим процессом. Большинство образцов природного вещества представляют собой физические смеси соединений. Морская вода, например, представляет собой смесь воды и большого количества других соединений, наиболее распространенным из которых является хлорид натрия, или поваренная соль. Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других соединений в морской воде.
Смеси отличаются от соединений тем, что их можно разделить на составные части с помощью физических процессов; например, простой процесс испарения отделяет воду от других соединений в морской воде.
Историческое развитие концепции элемента
Современная концепция элемента недвусмысленна, поскольку она зависит от использования химических и физических процессов в качестве средства различения элементов от соединений и смесей. Однако существование фундаментальных субстанций, из которых состоит вся материя, было основой многих теоретических предположений с самого начала истории. Древнегреческие философы Фалес, Анаксимен и Гераклит предполагали, что вся материя состоит из одного существенного начала — или элемента. Фалес считал, что этим элементом является вода; Анаксимен предложил воздух; и Гераклит, огонь. Другой греческий философ, Эмпедокл, высказывал другое мнение, что все вещества состоят из четырех элементов: воздуха, земли, огня и воды. Аристотель соглашался и подчеркивал, что эти четыре элемента являются носителями основных свойств: сухость и тепло связаны с огнем, тепло и влага с воздухом, влага и холод с водой, холод и сухость с землей.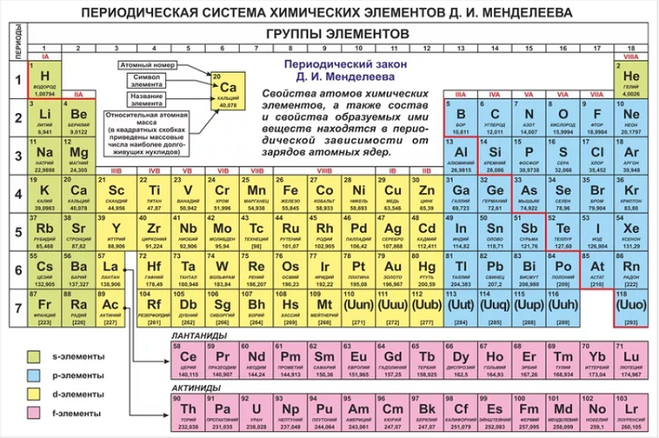 В мышлении этих философов предполагалось, что все остальные субстанции представляют собой комбинации четырех элементов, а свойства субстанций отражали их составы элементов. Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята с точки зрения элементарных качеств; в этом смысле сами элементы мыслились как нематериальные. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
В мышлении этих философов предполагалось, что все остальные субстанции представляют собой комбинации четырех элементов, а свойства субстанций отражали их составы элементов. Таким образом, греческая мысль заключала в себе идею о том, что вся материя может быть понята с точки зрения элементарных качеств; в этом смысле сами элементы мыслились как нематериальные. Греческое понятие элемента, которое было принято почти 2000 лет, содержало только один аспект современного определения, а именно, что элементы обладают характерными свойствами.
Во второй половине Средневековья, когда алхимики стали более изощренными в своих знаниях о химических процессах, греческие представления о составе материи стали менее удовлетворительными. Дополнительные свойства элементов были введены для учета вновь открытых химических превращений. Таким образом, сера стала представлять качество горючести, ртуть — летучести или текучести, а соль — устойчивости к огню (или негорючести). Эти три алхимических элемента или принципа также представляли собой абстракции свойств, отражающие природу материи, а не физических субстанций.
В конце концов была понята важная разница между смесью и химическим соединением, и в 1661 году английский химик Роберт Бойль признал фундаментальную природу химического элемента. Он утверждал, что четыре греческих элемента не могут быть настоящими химическими элементами, потому что они не могут соединяться с образованием других веществ и не могут быть извлечены из других веществ. Бойль подчеркивал физическую природу элементов и связывал их с соединениями, которые они образовывали современным оперативным путем.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
В 1789 году французский химик Антуан-Лоран Лавуазье опубликовал то, что можно считать первым списком элементарных веществ, основанным на определении Бойля. Список элементов Лавуазье был составлен на основе тщательного количественного изучения реакций разложения и рекомбинации. Поскольку он не мог разработать опыты по разложению некоторых веществ или их образованию из известных элементов, Лавуазье включил в свой список элементов такие вещества, как известь, оксид алюминия и кремнезем, которые теперь известны как очень устойчивые соединения.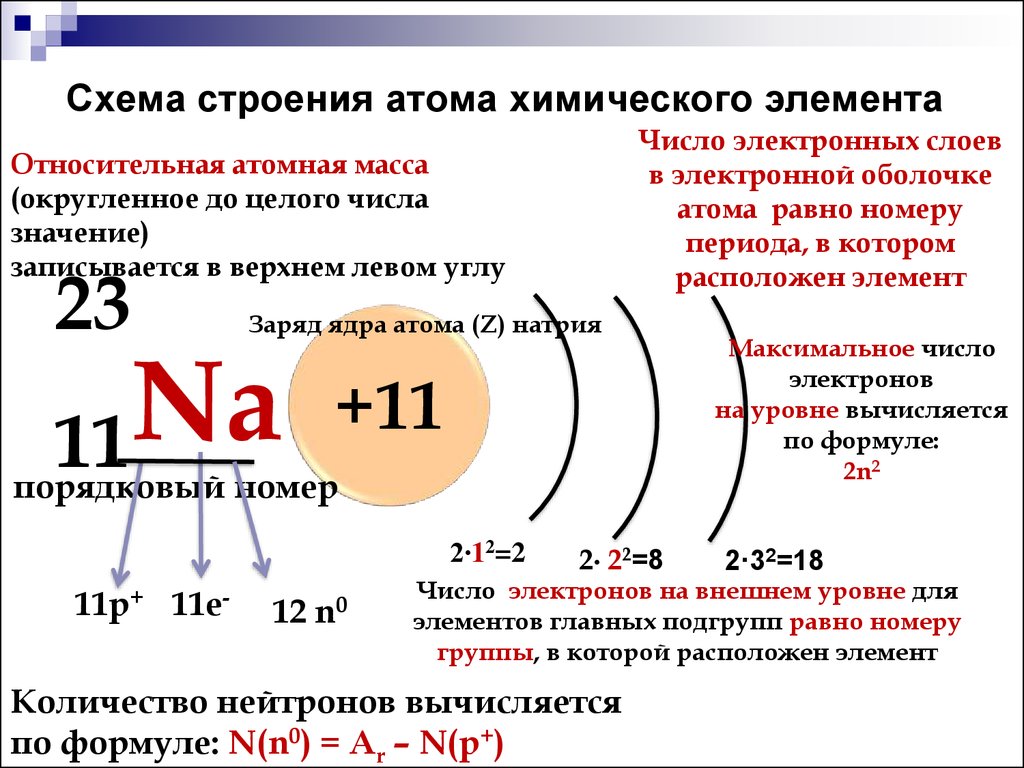






 ..
.. для
других элементов, если только мы не пропускаем каких-либо элементов. Эта точка
зрения была принята Бором в его теории простых атомов и молекул».
для
других элементов, если только мы не пропускаем каких-либо элементов. Эта точка
зрения была принята Бором в его теории простых атомов и молекул». нейтрона
Дж. Чадвиком. Оказалось, что на уровне 10–12 см вещество состоит из
протонов, нейтронов и электронов. Число
протонов в атомном ядре Z определяет
заряд атомного ядра. Суммарное число протонов Z и
нейтронов N определяет
массовое число A атомного
ядра
нейтрона
Дж. Чадвиком. Оказалось, что на уровне 10–12 см вещество состоит из
протонов, нейтронов и электронов. Число
протонов в атомном ядре Z определяет
заряд атомного ядра. Суммарное число протонов Z и
нейтронов N определяет
массовое число A атомного
ядра 272
272 6·10 26 лет
6·10 26 лет