Доклад на тему генная инженерия: Генная инженерия: что это, методы, примеры, достижения
Генная инженерия: что это, методы, примеры, достижения
Современная генная инженерия позволяет «включать» и «выключать» отдельные гены, программируя новый генотип, в том числе, и человеческий. Это вызывает немало опасений, хотя многие открытия уже принесли человечеству пользу
Содержание:
- История развития
- Технологии генной инженерии
- Сферы применения генной инженерии
- Изменение ДНК человека
- Этическая сторона вопроса
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.
История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.
Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
- ZFN разрезает ДНК и вставляет туда заготовленный заранее новый фрагмент с помощью белков с ионами цинка (отсюда название — Zinc Finger Nuclease).
- TALEN делает то же самое, только используя TAL-белки. Для обеих технологий приходится создавать отдельные белки, а это очень долгая работа, поэтому пока два этих метода особого применения не нашли.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.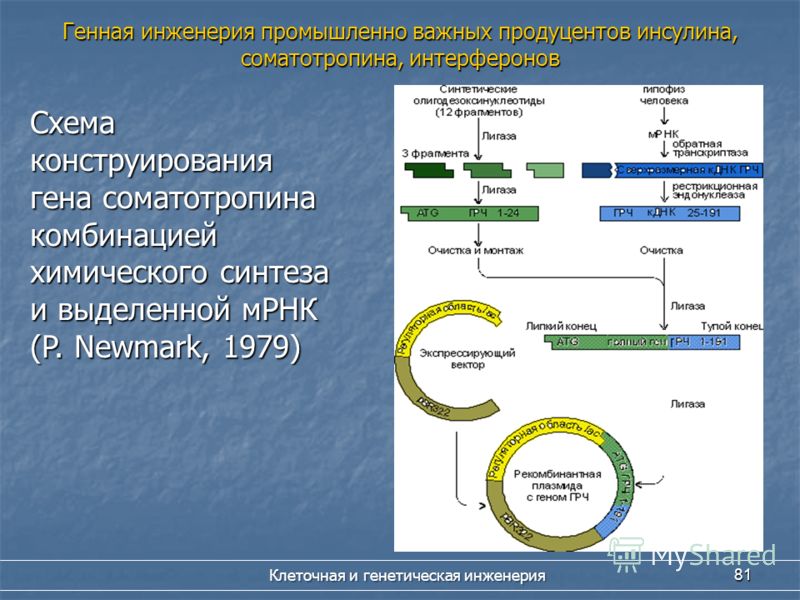
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
- Замена мутировавшего гена, вызывающего заболевание, здоровой копией.
- Инактивация или «выбивание» мутировавших генов, которые функционируют неправильно.
- Введение нового гена в организм, помогающего бороться с болезнью.
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
биофак СПбГУ
| ||||||||||||
| |||||||||||||||||||||||||||||||
Авторизация
| |||||||||||||||||||||||||||||||
| | |||||||||||||||||||||||||||||||
| |
биофак СПбГУ |
[ Развернуть все ] [ Свернуть все ]
|
контакты карта сайта почтовый сервер управление поддержка
199034, Санкт-Петербург, Университетская наб., 7-9
© Санкт-Петербургский государственный университет, 2006-2017
Большинство американцев принимают генную инженерию животных, которая полезна для здоровья человека, но многие выступают против других видов использования
Когда американцы рассматривают возможность использования генной инженерии у животных, их реакции не являются ни единодушно приемлемыми, ни устойчивыми; вместо этого общественная реакция варьируется в зависимости от механизма и предполагаемой цели технологии, особенно от того, в какой степени она принесет пользу для здоровья людей.
Имея пять различных сценариев генной инженерии животных, которые в настоящее время доступны, разрабатываются или считаются возможными в будущем, американцы в большинстве своем поддерживают только те два, которые обладают явным потенциалом для предотвращения или облегчения болезней человека.
Наиболее широко распространенное использование генетического вмешательства в животных связано с комарами. Семь из десяти американцев (70%) считают, что генная инженерия комаров для предотвращения их размножения и, следовательно, распространения некоторых болезней, переносимых комарами, была бы подходящим применением технологий, в то время как примерно три из десяти (29%) считают, что использование генной инженерии для этой цели как слишком далекое развитие технологии.
Большинство 57% считают целесообразным генетически сконструировать животных для выращивания органов или тканей, которые можно было бы использовать для людей, нуждающихся в трансплантации.
Но другие виды использования животноводческой биотехнологии менее приемлемы для общественности, включая создание более питательного мяса для потребления человеком (43% считают, что это уместно) или восстановление вымерших видов животных из близкородственных видов (32% считают, что это приемлемо). соответствующий). И одно приложение, которое уже коммерчески доступно, в значительной степени встретило сопротивление: всего 21% американцев считают целесообразным использование технологии для генной инженерии аквариумных рыб, чтобы они светились с помощью флуоресцентного гена, в то время как 77% считают, что это слишком далеко.
И одно приложение, которое уже коммерчески доступно, в значительной степени встретило сопротивление: всего 21% американцев считают целесообразным использование технологии для генной инженерии аквариумных рыб, чтобы они светились с помощью флуоресцентного гена, в то время как 77% считают, что это слишком далеко.
Вот некоторые результаты нового опроса исследовательского центра Pew Research Center, проведенного с 23 апреля по 6 мая среди репрезентативной в национальном масштабе выборки из 2537 взрослых американцев, в ходе которого изучалось общественное мнение о генной инженерии животных — термин, который охватывает целый ряд биотехнологий. которые могут добавлять, удалять или изменять существующий генетический материал животного и тем самым вводить новые черты или характеристики.
Хотя большинство американцев в основном согласны с тем, что использование генной инженерии комаров для предотвращения распространения болезней, переносимых комарами, уместно, мнения о других видах использования генной инженерии животных, рассматриваемых в опросе, различаются в зависимости от пола, уровня научных знаний и религиозности. . Мужчины более восприимчивы к такому использованию технологий, чем женщины, люди с высокими научными знаниями более восприимчивы, чем люди со средними или низкими научными знаниями, а люди с низким уровнем религиозной приверженности более восприимчивы, чем люди со средним или высоким уровнем религиозной приверженности.
. Мужчины более восприимчивы к такому использованию технологий, чем женщины, люди с высокими научными знаниями более восприимчивы, чем люди со средними или низкими научными знаниями, а люди с низким уровнем религиозной приверженности более восприимчивы, чем люди со средним или высоким уровнем религиозной приверженности.
Например, около двух третей мужчин (65%) используют генную инженерию животных для выращивания человеческих органов или тканей для трансплантации, по сравнению с примерно половиной женщин (49%). Кроме того, американцы с высокими научными знаниями (72%) более склонны считать это уместным, чем американцы со средними (55%) или низкими (47%) научными знаниями. И большая доля людей с низкой религиозной приверженностью (68%), чем со средней (54%) или высокой (48%) религиозной приверженностью, считают подходящей генную инженерию животных для выращивания человеческих органов или тканей для трансплантации.
Новые разработки в области биотехнологии животных поднимают перед обществом новые социальные, этические и политические вопросы, включая потенциальное воздействие на благополучие животных.
Опрос показал, что 52% американцев, которые в целом выступают против использования животных в научных исследованиях, что неудивительно, также более склонны считать, что конкретное использование генной инженерии животных заходит слишком далеко.
Существуют большие различия между этими группами, когда речь идет об использовании биотехнологии животных для людей, нуждающихся в пересадке органов или тканей, и об идее использования такой технологии для производства более питательного мяса.
Обоснование общественного беспокойства по поводу биотехнологии животных
Чтобы лучше понять мнение людей о генной инженерии животных, в ходе опроса группе респондентов было предложено объяснить, своими словами, основную причину их мнения о том, что генная инженерия используется в каждом из этих обстоятельства завели бы технологию слишком далеко.
Общий рефрен в этих ответах указывал на возможность неизвестных рисков для животных, людей или экосистемы. Некоторые рассматривали эти технологии как ненадлежащее вмешательство человечества в мир природы или выражали общую озабоченность по поводу неизвестных рисков.
Около трех из десяти тех, кто сказал, что генная инженерия комаров зайдет слишком далеко, объяснили, что человечество будет разрушать природу (23%) или вмешиваться в Божий план (8%).
Один респондент выразился так:
«Природа — это баланс, и каждый раз, когда человек вмешивается в него, ничего хорошего не получается».
Около 24% тех, кто не согласен с идеей снижения плодовитости комаров с помощью генной инженерии с целью уменьшения болезней, переносимых комарами, выразили обеспокоенность по поводу возможного воздействия на экосистему.
Такие ответы включают:
«Я не думаю, что мы знаем достаточно о последствиях удаления целого класса насекомых из окружающей среды. Каковы будут последствия для этих животных и растений «вверх по цепочке»?»
«Комары являются частью сложной экосистемы и пищевой цепи. Предотвращая их размножение, мы рискуем разрушить всю экосистему».
Возражения против идеи использования биотехнологии животных для выращивания органов или тканей для трансплантации людям были связаны с убеждениями об использовании животных на благо человека (21%) и потенциальными рисками для здоровья человека при создании человеческих органов из животных (16%).
Например:
«При производстве органов существование этих животных было бы жалким… чтобы выращивать такие органы, животные должны были находиться в лабораторных условиях и, скорее всего, никогда не увидят дневного света. Я не могу с этической точки зрения сказать, что согласен с такой практикой».
«Когда вы смешиваете человеческую и нечеловеческую генетику, я считаю, что это вызовет серьезные проблемы в будущем».
«Органы животных не созданы для людей, хотя некоторые органы животных и человека могут быть очень похожи. Кто знает, какие побочные эффекты это может вызвать? Даже трансплантаты органов от человека к человеку часто отторгаются, поэтому я могу только представить себе тяжелые побочные эффекты, которые может вызвать трансплантация от животного к человеку. Старайтесь, чтобы все было просто и так, как задумано природой».
Генная инженерия может производить более питательное мясо, изменяя животные белки. Те, кто считает, что технология заходит слишком далеко, выразили ряд опасений. Некоторые сослались на общие опасения по поводу пока неизвестных рисков (20% опрошенных), в то время как аналогичная доля (19%) расценила это как вмешательство в природу или Божий план таким образом, который выходит за рамки того, что должны делать люди.
Некоторые сослались на общие опасения по поводу пока неизвестных рисков (20% опрошенных), в то время как аналогичная доля (19%) расценила это как вмешательство в природу или Божий план таким образом, который выходит за рамки того, что должны делать люди.
Один респондент выразился так:
«Должны ли мы, люди, изменить ход «естественного отбора» в природе и привести к непреднамеренным серьезным последствиям? »
Примерно каждый десятый (12%) возражает против этой идеи на том основании, что люди должны меньше полагаться на мясо в своем рационе или что любая генная инженерия в продуктах питания представляет собой вероятный риск для здоровья.
Один из примеров таких опасений:
«Мясо само по себе питательно. Нет необходимости пытаться увеличить питание. Скорее, мы должны уменьшить зависимость человечества от мяса как от продукта питания».
Те, кто возражал против идеи возвращения вымерших видов, часто высказывали опасения по поводу непреднамеренного вреда экосистеме. Примерно двое из десяти (18%) опрошенных объяснили свое мнение тем, что есть причина, по которой эти животные в настоящее время вымерли, при этом некоторые заявили, что эти животные вряд ли выживут, если их вернут, и еще 12% из этой группы. повысили потенциальные риски для других видов и экосистемы из-за переноса вымершего животного в другой мир.
Примерно двое из десяти (18%) опрошенных объяснили свое мнение тем, что есть причина, по которой эти животные в настоящее время вымерли, при этом некоторые заявили, что эти животные вряд ли выживут, если их вернут, и еще 12% из этой группы. повысили потенциальные риски для других видов и экосистемы из-за переноса вымершего животного в другой мир.
Например:
«Остерегайтесь непредвиденных последствий». Вселенная находится в равновесии с ними потухшими. Подумайте о проблемах, созданных человеком путем реинтродукции видов, которые вымерли [в] данной области, то есть волков и горных львов, в районы, которые сейчас заняты людьми и домашним скотом».
Другие обсуждали эти идеи с точки зрения плана Бога и человеческого вмешательства в мир природы (23%).
Несколько примеров:
«Бог — создатель всего живого, а не человечество. Вымирание — это часть эволюции Вселенной».
«Природа выбрала виды, которые вымирают в течение миллионов и миллионов лет. Мы не имеем права возвращать животных и играть в Бога».
Мы не имеем права возвращать животных и играть в Бога».
А 14% заявили, что считают возвращение вымерших видов чересчур технологичным, потому что не видят в этом необходимости или цели, тем более, что это не приносит никакой пользы людям, или что ресурсы должны быть сосредоточены в другом месте.
Выборка этих проблем:
«С какой целью это будет сделано? Есть ли какая-то польза для человечества, кроме наличия редкого экземпляра в зоопарке? Перестанут ли вымершие виды вымирать в результате естественного воспроизводства — если нет, то все усилия бесполезны».
«Я не вижу смысла возвращать какое-либо животное. Обеспечит ли это лучший образ жизни для людей?»
Возражения против идеи изменения внешнего вида аквариумных рыб с помощью генной инженерии, чтобы заставить их светиться, часто были связаны с отсутствием очевидной необходимости или пользы для людей или животных.
Около половины (48%) тех, кто говорит, что создание светящейся рыбы зашло слишком далеко, заявили, что не видят смысла для людей или общества, сомневаются в его необходимости или считают его несерьезным или пустой тратой ресурсов.
Некоторые примеры:
«… [Хотя] превращение рыбы в светящуюся может показаться чем-то, что люди захотят увидеть, это не принесет пользы человечеству. На данный момент это будет просто [быть] игрой в Бога, чтобы развлечь, [а не] помочь нам».
«Это легкомысленно. Технологии следует использовать для помощи людям, животным и окружающей среде, а не для того, чтобы устраивать светящееся шоу».
«Почему? Если вы делаете что-то только потому, что можете, это не очень хорошая причина. Если разрешить любую генную инженерию, она выйдет из-под контроля. Это будет тонкая грань, которую, я уверен, мы перейдем».
«Это кажется легкомысленным поступком, очень похожим на пластическую операцию по удалению морщин или других признаков старения. Жизнь человека не продлевается «лучшей» внешностью. Аквариумные рыбки тоже не выигрывают от своего изменившегося внешнего вида».
Генная инженерия – генетика, сельское хозяйство и биотехнология
Уолтер Суза; Дональд Ли; Марджори Ханнеман; и Патрисия Хейн
- Дайте определение генной инженерии.

- Перечислите и кратко объясните пять основных этапов генной инженерии. Опишите, почему каждый из них необходим.
- Определите фундаментальные различия между культурами, полученными с помощью генной инженерии, и культурами, не полученными с помощью генной инженерии.
- Объясните ограничения традиционной селекции, которые преодолевает генная инженерия.
- Определите приблизительную продолжительность времени, необходимого для получения пригодной для продажи линии трансгенной культуры (завершите весь процесс генной инженерии культуры).
Введение
Производство генетически модифицированных растений стало возможным после того, как Бобу Фрэли и другим удалось использовать Agrobacterium tumefaciens для трансформации растительных клеток рекомбинантной ДНК в начале 1980-х годов (Васил, 2008a). После этого прорыва в биотехнологии растений ГМ-культуры теперь регулярно разводятся и выращиваются во многих частях земного шара. Текущие статистические данные о внедрении генетически модифицированных культур в США можно найти на веб-сайте Службы экономических исследований Министерства сельского хозяйства США.
После этого прорыва в биотехнологии растений ГМ-культуры теперь регулярно разводятся и выращиваются во многих частях земного шара. Текущие статистические данные о внедрении генетически модифицированных культур в США можно найти на веб-сайте Службы экономических исследований Министерства сельского хозяйства США.
Генная инженерия успешно использовалась для разработки новых генов, имеющих экономическое значение, которые можно использовать для улучшения генетики сельскохозяйственных растений. Генная инженерия — это целенаправленное добавление чужеродного гена или генов в геном организма. Гены могут быть выделены из одного организма и перенесены в другой или могут быть генами одного вида, которые модифицированы и повторно вставлены в тот же вид. Новые гены, обычно называемые трансгенами, встраиваются в растение с помощью процесса, называемого трансформацией. Вставленный ген содержит информацию, которая придаст организму признак (рис. 1).
Рисунок 1. Признаки, такие как цвет цветков и семян , контролируются ДНК. Адаптировано из NIH-NGHRI.
Адаптировано из NIH-NGHRI.Генетическое улучшение сельскохозяйственных культур (селекция растений) является важным инструментом, но имеет ограничения. Во-первых, говоря обычным языком, генетическое улучшение возможно только между двумя растениями, которые могут спариваться друг с другом половым путем. Это ограничивает новые черты, которые могут быть добавлены к тем, которые уже существуют у этого вида. Во-вторых, когда растения скрещиваются (скрещиваются), многие признаки передаются вместе с интересующим признаком, включая признаки с нежелательным влиянием на потенциальную урожайность.
Генная инженерия, с другой стороны, не связана этими ограничениями. Он физически удаляет ДНК из одного организма и переносит ген(ы) одного или нескольких признаков в другой. Поскольку скрещивание не требуется, «половой» барьер между видами преодолевается. Следовательно, признаки любого живого организма могут быть перенесены в растение. Этот метод более специфичен, поскольку растению можно добавить один признак.
Общий процесс генной инженерии. Дается базовое объяснение пяти шагов генной инженерии сельскохозяйственных культур. Пять шагов:
- Поиск организма с определенным признаком и выделение его ДНК.
- Клонирование гена, контролирующего признак.
- Разработка гена для экспрессии определенным образом.
- Трансформация, вставка гена в клетки культурного растения.
- Скрещивание трансгена с элитным фоном.
Этап 1: Экстракция ДНК
Процесс генной инженерии требует успешного завершения серии из пяти шагов и открытий. Чтобы лучше понять каждый из них, в качестве примера будет использована разработка Bt-кукурузы.
Чтобы лучше понять каждый из них, в качестве примера будет использована разработка Bt-кукурузы.
Прежде чем можно будет начать процесс генной инженерии, необходимо обнаружить живой организм, обладающий желаемой чертой. Признак кукурузы Bt (устойчивость к кукурузному мотыльку) был обнаружен около 100 лет назад. Фермеры-шелкопряды на Востоке заметили, что популяции тутовых шелкопрядов вымирают. Ученые обнаружили, что естественные почвенные бактерии вызывают гибель тутового шелкопряда. Эти почвенные бактерии, называемые Bacillus thuringiensis, или сокращенно Bt, производили белок, токсичный для тутового шелкопряда, белок Bt.
Хотя ученые этого не знали, они сделали одно из первых открытий, необходимых в процессе производства Bt кукурузы. Тот же белок Bt, который оказался токсичным для шелковичных червей, также токсичен для кукурузного мотылька, поскольку оба насекомые принадлежат к отряду чешуекрылых. Производство белка Bt в бактериях контролируется бактериальными генами.
Чтобы иметь возможность работать с геном, ответственным за создание токсина Bt, ученые должны извлечь ДНК из бактерий Bt (рис. 2). Это достигается путем взятия образца бактерий, содержащих интересующий ген, и прохождения его через серию шагов, которые отделяют ДНК от других частей клетки.
Шаг 2: Клонирование генов
Рисунок 2. Использование ДНК из B. thuringiensis для клонирования гена Bt. Изображение Уолтера Сьюзы.Вторым этапом процесса генной инженерии является клонирование генов. При экстракции ДНК вся ДНК из организма извлекается сразу. Это означает, что образец ДНК, извлеченный из бактерий Bacillus thuringiensis , будет содержать ген белка Bt, а также гены всех других бактерий. Ученые используют клонирование генов , чтобы отделить один интересующий ген от остальной части извлеченной ДНК (рисунок 2).
Следующие этапы генной инженерии будут включать дальнейшее изучение и эксперименты с этим геном. Для этого ученому нужны тысячи его точных копий. Это копирование также выполняется на этапе клонирования генов.
Для этого ученому нужны тысячи его точных копий. Это копирование также выполняется на этапе клонирования генов.
Шаг 3: Генный дизайн
Генный дизайноснован на еще одном крупном открытии. Это была Теория «Один ген — один фермент», впервые предложенная Джорджем У. Бидлом и Эдвардом Л. Тейтумом в XIX веке.40-х годов. Открытия, сделанные в ходе их исследований, заложили основу для теории о том, что один ген хранит информацию, которая направляет клетку к производству одного фермента (белка ). Следовательно, существует единственный ген, который контролирует производство белка Bt. Он называется геном Bt.
Рисунок 3. Замена существующего промоутера новым промоутером. Изображение Пэтти Хейн. После того, как ген был клонирован (рисунок 2), генные инженеры приступают к третьему этапу, проектируя ген для работы внутри другого организма. Это делается в пробирке путем разрезания гена с помощью рестрикционных ферментов и замены определенных участков (рис. 3).
3).
Ученые заменили промотор бактериального гена на промоторы, включающие ген Bt в выбранных частях растения, или промоторы, которые всегда могут включать ген Bt во всех тканях. В результате первый выпущенный ген Bt был разработан для производства уровня белка Bt , летального для европейского кукурузного мотылька, и для производства белка Bt только в зеленых тканях растения кукурузы (стебли, листья и т. д.). Позже были разработаны гены Bt для производства летального уровня белка во всех тканях растения кукурузы (листья, стебли, кисточка, початок, корни и т. д.).
Трансформация растений и культура тканей
Процесс трансформации включает в себя вставку желаемого трансгена конструкции (рис. 5) в клетки видов растений-реципиентов. В этом процессе ученые выделяют ткань или клетки сорта, который они хотят трансформировать, и используют один из нескольких методов для введения трансгена в ткань или клетки. Трансгенная конструкция содержит следующие ключевые особенности.
Трансгенная конструкция содержит следующие ключевые особенности.
- Промотор , который включает и выключает ген в клетке . Промотор CaMV 35s из вируса мозаики цветной капусты (CaMV) обычно используется в генной инженерии. Другие типы промоторов, такие как промотор нопалинсинтазы (NOS-Pro), также могут быть использованы для экспрессии трансгенов в тканях растений.
- Селектируемый маркер , который используется для отбора клеток, которые успешно получили конструкцию в процессе трансформации . На фигуре 4 выбираемым маркером в конструкции является NPT II (Kanr), который контролирует устойчивость к антибиотику канамицину. Клетки растения, используемые для трансформации, будут выращивать на среде, содержащей антибиотик. Другие селектируемые маркеры, которые успешно использовались в растениях, включают гены, контролирующие устойчивость к гербицидам.

- Терминаторная последовательность , такая как нопалинсинтаза (NOS), включена для маркировки конца последовательности трансгена для надлежащей экспрессии в растительных клетках.
Два широко используемых метода трансформации включают трансформацию, опосредованную Agrobacterium tumefaciens, и биолистическую трансформацию (она же генная пушка ), обычно называемую бомбардировкой частицами (рис. 5). Биолистический метод включает использование высокого давления для перемещения вольфрамовых или золотых шариков, покрытых ДНК генной конструкции, в растительные клетки.
Рисунок 5. Использование метода генной пушки для трансформации растительных клеток. Изображение Пэтти Хейн.Опосредованная агробактериями трансформация растений
Корончатые галлы — это опухоли растений, возникающие в месте заражения некоторыми видами агробактерий. Агробактерии не проникают в клетки растений, но переносят сегмент ДНК, называемый Т-ДНК, из своей кольцевой экстрахромосомной индуцирующей опухоль плазмиды (Ti) в геном клеток-хозяев. Плазмиды Ti поддерживаются в Agrobacteria , поскольку часть их Т-ДНК содержит гены, кодирующие необычные аминокислоты, используемые Agrobacterium. Т-ДНК также кодирует гены, влияющие на физиологию гормонов растения-хозяина, что приводит к индуцированному росту инфицированных клеток и образованию опухолей. Ученые воспользовались способностью Agrobacterium стабильно интегрировать свою Т-ДНК в геном растения для введения рДНК в растительные клетки. Сначала они удалили из Т-ДНК гены, вызывающие опухоль или корончатую болезнь растений, и сконструировали плазмиду для репликации в обоих Escherichia coli и клетки Agrobacterium. Первоначальная репликация конструкции в E. coli полезна для проверки наличия клонированного гена и увеличения количества ДНК конструкции для последующего использования, включая секвенирование и трансформацию в Agrobacterium.
Агробактерии не проникают в клетки растений, но переносят сегмент ДНК, называемый Т-ДНК, из своей кольцевой экстрахромосомной индуцирующей опухоль плазмиды (Ti) в геном клеток-хозяев. Плазмиды Ti поддерживаются в Agrobacteria , поскольку часть их Т-ДНК содержит гены, кодирующие необычные аминокислоты, используемые Agrobacterium. Т-ДНК также кодирует гены, влияющие на физиологию гормонов растения-хозяина, что приводит к индуцированному росту инфицированных клеток и образованию опухолей. Ученые воспользовались способностью Agrobacterium стабильно интегрировать свою Т-ДНК в геном растения для введения рДНК в растительные клетки. Сначала они удалили из Т-ДНК гены, вызывающие опухоль или корончатую болезнь растений, и сконструировали плазмиду для репликации в обоих Escherichia coli и клетки Agrobacterium. Первоначальная репликация конструкции в E. coli полезна для проверки наличия клонированного гена и увеличения количества ДНК конструкции для последующего использования, включая секвенирование и трансформацию в Agrobacterium.
Этапы опосредованной Agrobacterium трансформации растений описаны на рисунке 6.
Рисунок 6 . Перенос генов в растительные клетки методом Agrobacterium. После инфицирования выбранной ткани бактерией, несущей трансгенную конструкцию с геном устойчивости к антибиотику в качестве селектируемого маркера, ткань выращивают в среде, содержащей антибиотик, убивающий все нетрансформированные ткани или клетки. Следовательно, в присутствии антибиотика выживают только ткани, клетки которых были трансформированы трансгенной конструкцией. Выжившая ткань удаляется из-под антибиотика и позволяет регенерировать в целые растения. Обычно трансгенные растения контролируют в контролируемой среде, такой как камера для выращивания или теплица, прежде чем они будут выращены в полевых условиях. Изображение Кан Ванга.
В настоящее время очень немногие клетки-хозяева получают конструкцию в процессе трансформации. Каждое случайное встраивание конструкции в геном клеток растений называют событием. Полезные события происходят редко из-за случайного характера процесса трансформации. Выбираемые маркеры очень важны, поскольку они позволяют идентифицировать редкие события (рис. 7). Ученые должны провести скрининг многих потенциальных трансформантов, чтобы выявить события, полезные для селекции.
Полезные события происходят редко из-за случайного характера процесса трансформации. Выбираемые маркеры очень важны, поскольку они позволяют идентифицировать редкие события (рис. 7). Ученые должны провести скрининг многих потенциальных трансформантов, чтобы выявить события, полезные для селекции.
Оттуда новая ДНК может или не может быть успешно вставлена в хромосому. Клетки, которые получают новый ген, называются 9.0155 трансгенных и выбраны из тех, которые не являются трансгенными (Фигура 7). Многие типы растительных клеток являются тотипотентными, что означает, что одна растительная клетка может превратиться в целое растение. Следовательно, каждая трансгенная клетка может затем развиться в целое растение, содержащее трансген в каждой клетке. Трансгенные растения выращивают до зрелости в теплицах и собирают полученные ими семена, унаследовавшие трансген. Работа генетического инженера завершена. Он/она передаст трансгенные семена селекционеру, ответственному за последний этап.
Следовательно, каждая трансгенная клетка может затем развиться в целое растение, содержащее трансген в каждой клетке. Трансгенные растения выращивают до зрелости в теплицах и собирают полученные ими семена, унаследовавшие трансген. Работа генетического инженера завершена. Он/она передаст трансгенные семена селекционеру, ответственному за последний этап.
Наследование трансгена у растений
Трансформация считается успешной, если трансген встраивается в одну из хромосом. Клетки, имеющие только одну копию трансгена в своем геноме, называются гемизиготными (геми = половина, зигота = зигота). Поскольку расщепление в потомстве гемизиготного растения такое же, как и для гетерозиготного растения, термин гетерозиготный будет использоваться в этом курсе, когда речь идет о растении, не гомозиготном по трансгену. Признак будет сегрегировать в потомстве таким же образом, как и любой другой ген в растении, как показано ниже (рис. 8).
Рисунок 8 . Отношение возможного потомства при самоопылении гемизиготного диплоидного растения. Изображение Уолтера Сьюзы.
Изображение Уолтера Сьюзы.Шаг 5: Обратное скрещивание
Пятая и последняя часть производства генно-инженерной культуры — обратное скрещивание (рис. 9). Трансгенные растения скрещивают с элитными селекционными линиями с использованием традиционных методов селекции растений для объединения желаемых признаков элитных родителей и трансгена в одну линию. Потомство повторно скрещивают с элитой линии для получения высокопродуктивной трансгенной линии . В результате получится растение с потенциалом урожайности, близким к существующим гибридам, которое выражает признак, кодируемый новым трансгеном .
Рисунок 9 . Использование метода обратного скрещивания. Изображение Пэтти Хейн.Процесс генной инженерии растений
Весь процесс генной инженерии одинаков для любого растения. Время, необходимое для выполнения всех пяти шагов от начала до конца, зависит от гена, вида сельскохозяйственных культур и доступных ресурсов. Может пройти от 6 до 15+ лет, прежде чем появятся новые трансгенный гибрид готов к выпуску для выращивания на производственных полях.
Может пройти от 6 до 15+ лет, прежде чем появятся новые трансгенный гибрид готов к выпуску для выращивания на производственных полях.
Процесс регенерации трансгенных растений из каллуса в культуре ткани может привести к генетической изменчивости, не связанной с трансгеном. Кроме того, родительская линия, используемая для трансформации, обычно выбирается по частоте получения полезных событий, а не по ее агрономическим характеристикам. Таким образом, трансгены включаются в коммерческие сорта с помощью обычных процедур селекции, таких как обратное скрещивание.
Рисунок 10 . Генная инженерия сельскохозяйственных культур включает: 1) выделение ДНК, 2) клонирование генов, 3) дизайн генов, 4) трансформацию и 5) селекцию растений. Изображение Уолтера Сьюзы и Пэтти Хейн.
Генная инженерия – направленное добавление чужеродной ДНК (генов) в организм.
Пять основных этапов генной инженерии сельскохозяйственных культур:
- » data-font=»Arial» data-listid=»33″ data-aria-posinset=»1″ data-aria-level=»1″> Экстракция ДНК. ДНК извлекается из организма, о котором известно, что он обладает желаемым признаком.
- Клонирование гена — обнаружен и скопирован интересующий ген.
- Модификация гена — ген модифицируется для экспрессии желаемым образом путем изменения и замены участков гена.
- Трансформация — ген(ы) доставляются в клетки культуры ткани с использованием одного из нескольких методов, где, как мы надеемся, они окажутся в ядре и встроятся в хромосому.
- Обратное скрещивание. Трансгенные линии скрещиваются с элитными линиями для получения высокопродуктивных трансгенных линий.





