Амфотерное соединение: амфотерное соединение | это… Что такое амфотерное соединение?
Амфотерные соединения | Дистанционные уроки
05-Дек-2014 | комментария 4 | Лолита Окольнова
и их свойства
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + h3O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
h3SO4 + 2KOH → K2SO4 + 2h3O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3
, Fe(OH)3)И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO,
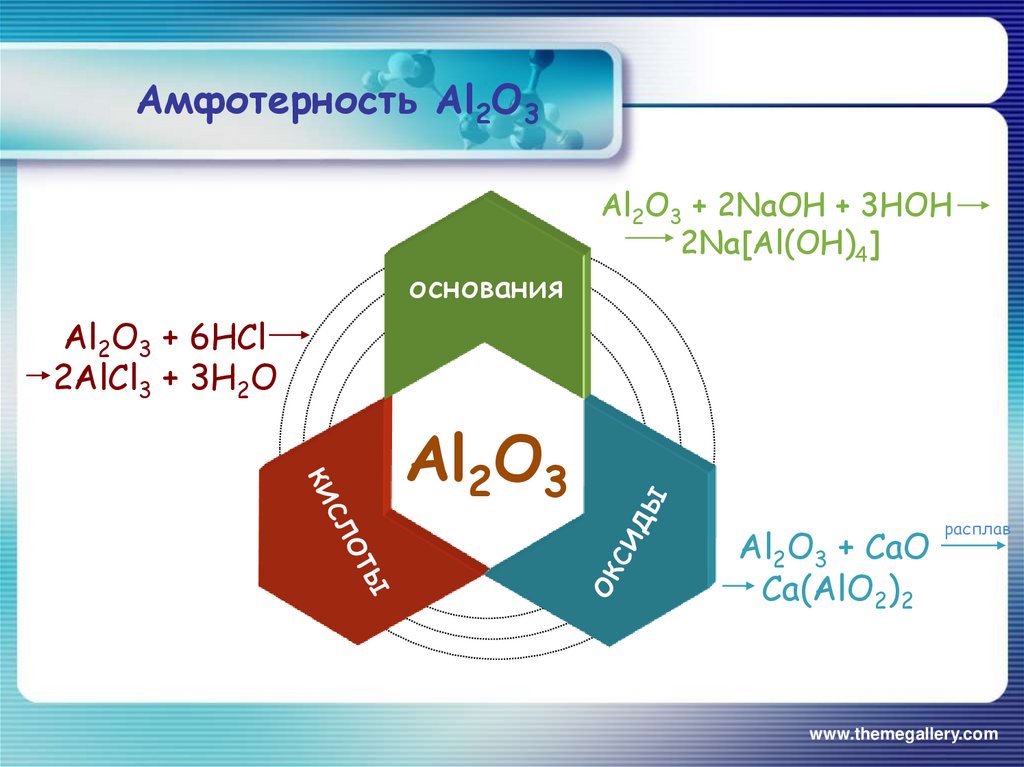
Наиболее часто встречающиеся амфотерные оксиды (и соответствующие им гидроксиды): ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, Al2O3, Al(OH)3, Fe2O3, Fe(OH)3, Cr2O3, Cr(OH)3.
Свойства амфотерных соединений запомнить не сложно: они взаимодействуют с кислотами и щелочами.
- с взаимодействием с кислотами все просто, в этих реакциях амфотерные соединения ведут себя как основные:
Оксиды:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
ZnO + H2SO4 → ZnSO4 + H2O
BeO + HNO3 → Be(NO3)2 + H2O
Точно так же реагируют гидроксиды:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Pb(OH)2 + 2HCl → PbCl2 + 2H2O
- С взаимодействием со щелочами немного сложнее.

Или реакция происходит в растворе, или реагирующие вещества берутся твердые и сплавляются.
Разберем на примере гидроксида цинка. Как уже говорилось ранее, амфотерные соединения взаимодействуя с основными, ведут себя как кислоты. Вот и запишем гидроксид цинка Zn(OH)2 как кислоту. У кислоты водород спереди, вынесем его: H2ZnO2. И реакция щелочи с гидроксидом будет протекать как будто он – кислота. «Кислотный остаток» ZnO22- двухвалентный:
2KOH(тв.) + H2ZnO2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
Полученное вещество K2ZnO2 называется метацинкат калия (или просто цинкат калия). Это вещество – соль калия и гипотетической «цинковой кислоты» H 2ZnO2 (солями такие соединения называть не совсем правильно, но для собственного удобства мы про это забудем). Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
Только гидроксид цинка записывать вот так: H2ZnO2 – нехорошо. Пишем как обычно Zn(OH)2, но подразумеваем (для собственного удобства), что это «кислота»:
2KOH(тв.) + Zn(OH)2(тв.) (t,сплавление)→ K2ZnO2 + 2H2O
С гидроксидами, в которых 2 группы ОН, все будет так же как и с цинком:
Be(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2BeO2 (метабериллат натрия, или бериллат)
Pb(OH)2(тв.) + 2NaOH(тв.) (t,сплавление)→ 2H2O + Na2PbO2 (метаплюмбат натрия, или плюмбат)
С амфотерными гидроксидов с тремя группами OH (Al(OH)3, Cr(OH)3, Fe(OH)3) немного иначе.
Разберем на примере гидроксида алюминия: Al(OH)3, запишем в виде кислоты: H3AlO3, но в таком виде не оставляем, а выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
Вот с этой «кислотой» (HAlO2) мы и работаем:
HAlO2 + KOH → H2O + KAlO 2 (метаалюминат калия, или просто алюминат)
Но гидроксид алюминия вот так HAlO2 записывать нельзя, записываем как обычно, но подразумеваем там «кислоту»:
Al(OH)3(тв.) + KOH(тв.) (t,сплавление)→ 2H2O + KAlO2(метаалюминат калия)
То же самое и с гидроксидом хрома:
Cr(OH)3 → H3CrO3 → HCrO2
Cr(OH)3(тв. ) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
) + KOH(тв.) (t,сплавление)→ 2H2O + KCrO2(метахромат калия,
НО НЕ ХРОМАТ, хроматы – это соли хромовой кислоты).
С гидроксидами содержащими четыре группы ОН точно так же: выносим вперед водород и убираем воду:
Sn(OH)4 → H4SnO4 → H2SnO3
Pb(OH)4 → H4PbO4 → H2PbO3
Следует помнить, что свинец и олово образуют по два амфотерных гидроксида: со степенью окисления +2 (Sn(OH)2, Pb(OH)2), и +4 (Sn(OH)4, Pb(OH)4).
И эти гидроксиды будут образовывать разные «соли»:
Степень окисления | +2 | +4 | ||
Формула гидроксида |
|
|
|
|
Формула гидроксида в виде кислоты | H2SnO2 | H2PbO2 | H2SnO3 | H2PbO3 |
Соль (калиевая) | K2SnO2 | K2PbO2 | K2SnO3 | K2PbO3 |
Название соли | блюмбИТ | метастаннАТ | метаблюмбАТ | |
Те же принципы, что и в названиях обычных «солей», элемент в высшей степени окисления – суффикс АТ, в промежуточной – ИТ.
Такие «соли» (метахроматы, метаалюминаты, метабериллаты, метацинкаты и т.д.) получаются не только в результате взаимодействия щелочей и амфотерных гидроксидов. Эти соединения всегда образуются, когда соприкасаются сильноосновный «мир» и амфотерный (при сплавлении). То есть точно так же как и амфотерные гидроксиды со щелочами будут реагировать и амфотерные оксиды, и соли металлов, образующих амфотерные оксиды (соли слабых кислот). И вместо щелочи можно взять сильноосновный оксид, и соль металла, образующего щелочь (соль слабой кислоты).
Взаимодействия:
Запомните, реакции, приведенные ниже, протекают при сплавлении.
Амфотерного оксида с сильноосновным оксидом:
ZnO(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 (метацинкат калия, или просто цинкат калия)
Амфотерного оксида со щелочью:
ZnO(тв. ) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
Амфотерного оксида с солью слабой кислоты и металла, образующего щелочь:
ZnO(тв.) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
Амфотерного гидроксида с сильноосновным оксидом:
Zn(OH)2(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + H2O↑
Амфотерного гидроксида со щелочью:
Zn(OH)2(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + 2H2O↑
Амфотерного гидроксида с солью слабой кислоты и металла, образующего щелочь:
Zn(OH)2(тв.
 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
Соли слабой кислоты и металла, образующего амфотерные соединение с сильноосновным оксидом:
ZnCO3(тв.) + K2O(тв.) (t,сплавление)→ K2ZnO2 + CO2↑
Соли слабой кислоты и металла, образующего амфотерные соединение со щелочью:
ZnCO3(тв.) + 2KOH(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
Соли слабой кислоты и металла, образующего амфотерные соединение с солью слабой кислоты и металла, образующего щелочь:
ZnCO3(тв. ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + 2CO2↑
Ниже представлена информация по солям амфотерных гидроксидов, красным помечены наиболее встречающиеся в ЕГЭ.
Оксид | Гидроксид | Гидроксид в виде кислоты | Кислотный остаток | Соль | Название соли |
BeO | Be(OH)2 | H2BeO2 | BeO22- | K2BeO2 | Метабериллат (бериллат) |
ZnO | Zn(OH)2 | H2ZnO2 | ZnO22- | K2ZnO2 | Метацинкат (цинкат) |
Al2O3 | Al(OH)3 | HAlO2 | AlO2— | KAlO2 | Метаалюминат (алюминат) |
Fe2O3 | Fe(OH)3 | HFeO2 | FeO2— | KFeO2 | Метаферрат (НО НЕ ФЕРРАТ) |
SnO | Sn(OH)2 | H2SnO2 | SnO22- | K2SnO2 | СтаннИТ |
PbO | Pb(OH)2 | H2PbO2 | PbO22- | K2PbO2 | БлюмбИТ |
SnO2 | Sn(OH)4 | H2SnO3 | SnO32- | K2SnO3 | МетастаннАТ (станнат) |
PbO2 | Pb(OH)4 | H2PbO3 | PbO32- | K2PbO3 | МетаблюмбАТ (плюмбат) |
Cr2O3 | Cr(OH)3 | HCrO2 | CrO2— | KCrO2 | Метахромат (НО НЕ ХРОМАТ) |
В ЕГЭ это называют «растворением гидроксида алюминия (цинка, бериллия и т. д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
д.) щелочи». Это обусловлено способностью металлов в составе амфотерных гидроксидов в присутствии избытка гидроксид-ионов (в щелочной среде) присоединять к себе эти ионы. Образуется частица с металлом (алюминием, бериллием и т.д.) в центре, который окружен гидроксид-ионами. Эта частица становится отрицательно-заряженной (анионом) за счет гидроксид-ионов, и называться этот ион будет гидроксоалюминат, гидроксоцинкат, гидроксобериллат и т.д.. Причем процесс может протекать по-разному металл может быть окружен разным числом гидроксид-ионов.
Мы будем рассматривать два случая: когда металл окружен четырьмя гидроксид-ионами, и когда он окружен шестью гидроксид-ионами.
Запишем сокращенное ионное уравнение этих процессов:
Al(OH)3 + OH— → Al(OH)4—
Образовавшийся ион называется Тетрагидроксоалюминат-ион. Приставка «тетра-» прибавляется, потому что гидроксид-иона четыре.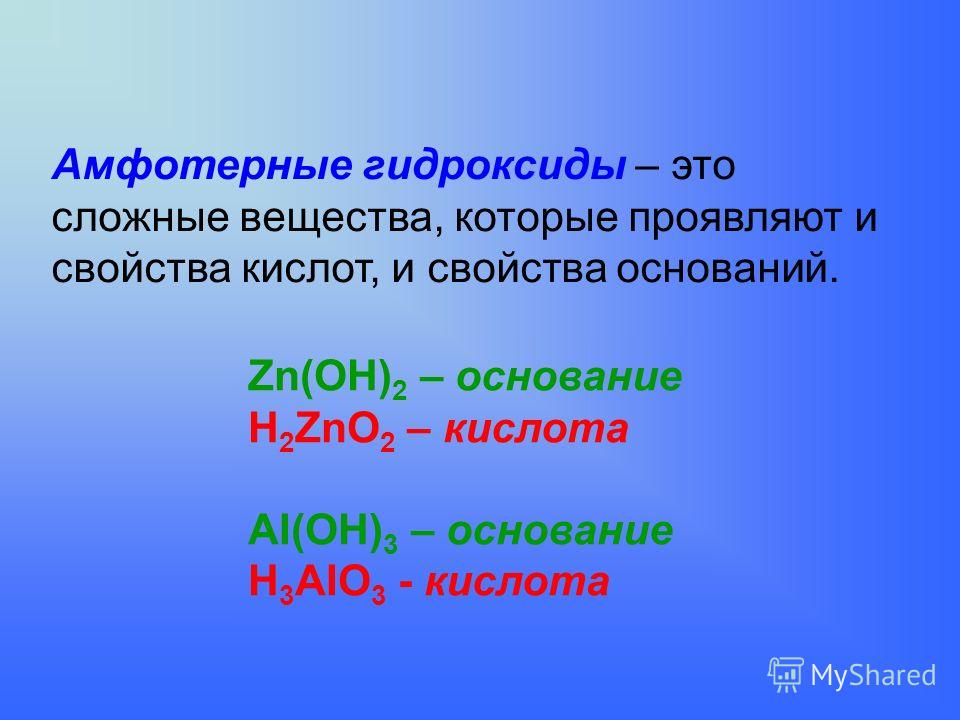 Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Тетрагидроксоалюминат-ион имеет заряд -, так как алюминий несет заряд 3+, а четыре гидроксид-иона 4-, в сумме получается -.
Al(OH)3 + 3OH— → Al(OH)63-
Образовавшийся в этой реакции ион называется гексагидроксоалюминат ион. Приставка «гексо-» прибавляется, потому что гидроксид-иона шесть.
Прибавлять приставку, указывающую на количество гидроксид-ионов обязательно. Потому что если вы напишете просто «гидроксоалюминат», не понятно, какой ион вы имеете в виду: Al(OH)4— или Al(OH)63-.
При взаимодействии щелочи с амфотерным гидроксидом в растворе образуется соль. Катион которой – это катион щелочи, а анион – это сложный ион, образование которого мы рассмотрели ранее. Анион заключается в квадратные скобки.
Al(OH)3 + KOH → K[Al(OH)4] (тетрагидроксоалюминат калия)
Al(OH)3 + 3KOH → K3[Al(OH)6] (гексагидроксоалюминат калия)
Какую именно (гекса- или тетра-) соль вы напишете как продукт – не имеет никакого значения. Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Даже в ответниках ЕГЭ написано: «…K3[Al(OH)6] (допустимо образование K[Al(OH)4]». Главное не забывайте следить, чтобы все индексы были верно проставлены. Следите за зарядами, и имейте ввиду, что сумма их должна быть равна нулю.
Кроме амфотерных гидроксидов, со щелочами реагируют амфотерные оксиды. Продукт будет тот же. Только вот если вы запишете реакцию вот так:
Al2O3 + NaOH → Na[Al(OH)4]
Al2O3 + NaOH → Na3[Al(OH)6]
Но эти реакции у вас не уравняются. Надо добавить воду в левую часть, взаимодейтсиве ведь происходит в растворе, воды там дотаточно, и все уравняется:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6]
Помимо амфотерных оксидов и гидроксидов, с растворами щелочей взаимодействуют некоторые особо активные металлы, которые образуют амфотерные соединения. А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
А именно это: алюминий, цинк и бериллий. Чтобы уравнялось, слева тоже нужна вода. И, кроме того, главное отличие этих процессов – это выделение водорода:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑
В таблице ниже приведены наиболее распространенные в ЕГЭ примеры свойства амфотерных соединений:
Амфотерное вещество | Соль | Название соли | Реакции |
Al Al2O3 Al(OH)3 | Na[Al(OH)4] | Тетрагидроксоалюминат натрия | Al(OH)3 + NaOH → Na[Al(OH)4] Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
Na3[Al(OH)6] | Гексагидроксоалюминат натрия | Al(OH)3 + 3NaOH → Na3[Al(OH)6] Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6] 2Al + 6NaOH + 6H2O → 2Na3[Al(OH)6] + 3H2↑ | |
Zn ZnO Zn(OH)2 | K2[Zn(OH)4] | Тетрагидроксоцинкат натрия | Zn(OH)2 + 2NaOH → Na2[Zn(OH)4] ZnO + 2NaOH + H2O → Na2[Zn(OH)4] Zn + 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑ |
K4[Zn(OH)6] | Гексагидроксоцинкат натрия | Zn(OH)2 + 4NaOH → Na4[Zn(OH)6] ZnO + 4NaOH + H2O → Na4[Zn(OH)6] Zn + 4NaOH + 2H2O → Na4[Zn(OH)6]+ H2↑ | |
Be BeO Be(OH)2 | Li2[Be(OH)4] | Тетрагидроксобериллат лития | Be(OH)2 + 2LiOH → Li2[Be(OH)4] BeO + 2LiOH + H2O → Li2[Be(OH)4] Be + 2LiOH + 2H2O → Li2[Be(OH)4]+ H2↑ |
Li4[Be(OH)6] | Гексагидроксобериллат лития | Be(OH)2 + 4LiOH → Li4[Be(OH)6] BeO + 4LiOH + H2O → Li4[Be(OH)6] Be + 4LiOH + 2H2O → Li4[Be(OH)6]+ H2↑ | |
Cr2O3 Cr(OH)3 | Na[Cr(OH)4] | Тетрагидроксохромат натрия | Cr(OH)3 + NaOH → Na[Cr(OH)4] Cr2O3 + 2NaOH + 3H2O → 2Na[Cr(OH)4] |
Na3[Cr(OH)6] | Гексагидроксохромат натрия | Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] Cr2O3 + 6NaOH + 3H2O → 2Na3[Cr(OH)6] | |
Fe2O3 Fe(OH)3 | Na[Fe(OH)4] | Тетрагидроксоферрат натрия | Fe(OH)3 + NaOH → Na[Fe(OH)4] Fe2O3 + 2NaOH + 3H2O → 2Na[Fe(OH)4] |
Na3[Fe(OH)6] | Гексагидроксоферрат натрия | Fe(OH)3 + 3NaOH → Na3[Fe(OH)6] Fe2O3 + 6NaOH + 3H2O → 2Na3[Fe(OH)6] |
Полученные в этих взаимодействиях соли реагируют с кислотами, образуя две другие соли (соли данной кислоты и двух металлов):
2Na3[Al(OH)6] + 6H2SO4 → 3Na2SO4 + Al2(SO4)3 + 12H2O
Вот и все! Ничего сложного. Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
Главное не путайте, помните что образуется при сплавлении, что в растворе. Очень часто задания по этому вопросу попадаются в B части.
- Подписка на рассылку
(Правила комментирования)
Амфотерные металлы, что это в химии
Амфотерные тела – это такие вещества, которые напоминают своим строением, характеристиками металлические элементы. К тому же им свойственна и химическая двойственность.
Амфотерные тела – это не металлы, а их формы: оксиды, соли и т. д. Ряд оксидов может сочетать в себе 2 свойства и при определенных условиях проявлять параметры как кислот, так и щелочей.
Известными не понаслышке амфотерными материалами является алюминий, хром, цинк и т. д.
Впервые сам термин «амфотерность» появился в начале 19 столетия. На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
Амфотерные металлы: особенности, виды
Перечень амфотерных металлов немалый, причем далеко не все из них являются чистыми амфотерными, а лишь условными.
Вещества все обозначены в таблице Менделеева под определенными порядковыми номерами. Так, железо, бериллий, хром и стронций считаются основными аморфными элементами. Также типичным и распространенным в природе представителем является алюминий.
Металл алюминий повсеместно применяется в быту и промышленности в самых различных областях. Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей. Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Не при всех условиях вещество вступает с реакцию с водородом.
Еще один типичный представитель амфотерных металлов – железо, который располагается под номером 26 в Таблице и находится между марганцем и кобальтом.
Железо считается одним из самых доступных элементов, залежи которого расположены в земной коре. Он одновременно является компонентом бело-серебристого цвета с хорошей ковкостью при высоких температурах. В то же время вещество может быть коррозировать при сильном нагревании. А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь. А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
Свойства амфотерных веществ
Главные характеристики этих веществ заключены в самом понятии амфотерности. Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
В процессе соединения амфотерных материалов с кислотными реагентами или оксидами они показывают химическую реакцию, характерную для оснований. В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
Если амфотерные гидроксиды подвергнуть нагреванию, то в результате они распадутся на оксид и воду.
Отметим, что амфотерные материалы обладают самыми различными свойствами, которые изучаются научными светилами до сих пор. Свойства также можно разобрать, сравнивая их с характеристиками обычных материалов. Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Амфотерные тела демонстрируют сразу 2 свойства: окислительное и восстановительное. При этом некоторые соединения имеют отрицательный уровень окисления.
Все металлы, представленные в таблице Менделеева, образуют основные оксиды и гидроксиды.
Интересный момент – металлы могут окисляться далеко не со всеми кислотами в реакциях. Само окисление может не давать взаимодействие с азотной кислотой.
Простые амфотерные материалы имеют различную структуру и характеристики.
Некоторые вещества имеют такие характеристики, что их принадлежность к определенному классу можно выявить даже визуально. Так, мы сразу понимаем, что медь и алюминий – это металл.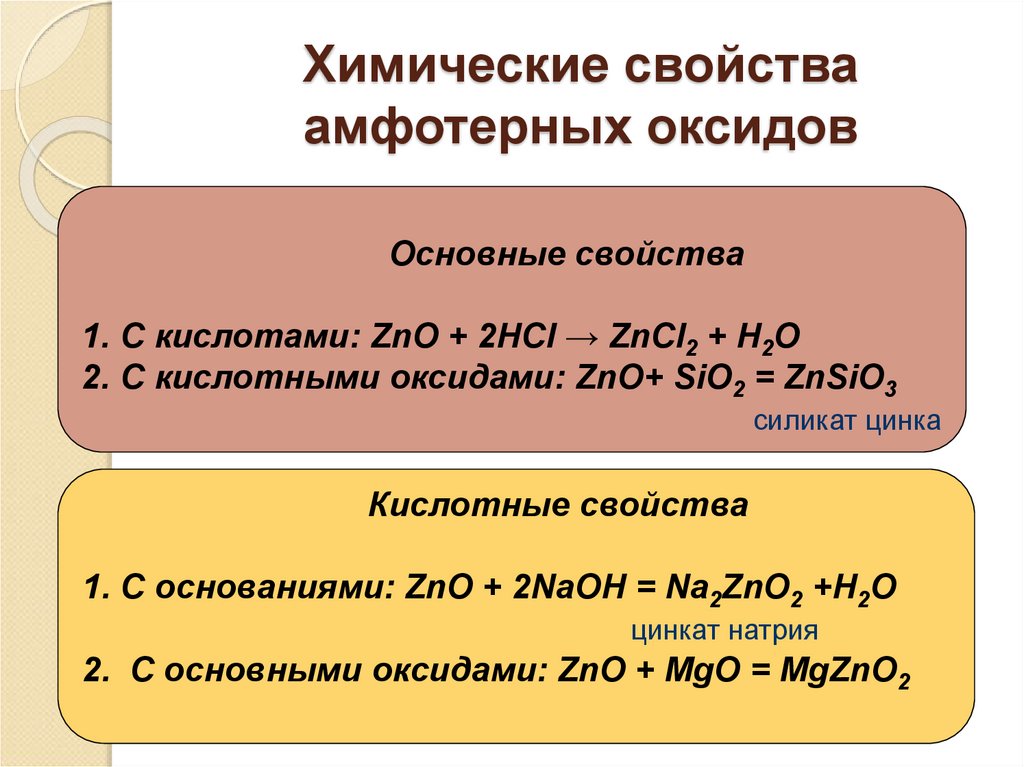
Неметалл и металл: в чем же разница
Известно, что металлы выделяют электроны со своего внешнего электронного поля (облака). В свою очередь неметаллы притягивают такие электроны.
Также металлы хорошо проводят электроток и тепло, в отличие от неметаллов, полностью лишенных таких свойств.
Основания амфотерных маметиралов
При располагающих условиях основания нерастворимы в воде, можно сказать, являются довольно слабыми электролитами. Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Амфотерные материалы реагируют с кислотами в роли оснований. В случае когда гидроксид цинка реагирует с соляной кислотой, то на выходе получится хлорид цинка. При реакции с основаниями материалы, напротив, выступают кислотами.
амфотерных соединений. Что это за амфотерные соединения? | by BICPUC
Что это за амфотерные соединения ?
Амфотерные соединения представляют собой химическое вещество, которое может представлять собой нейтральную молекулу или ионную молекулу, которая может действовать как кислота и как основание в химической реакции.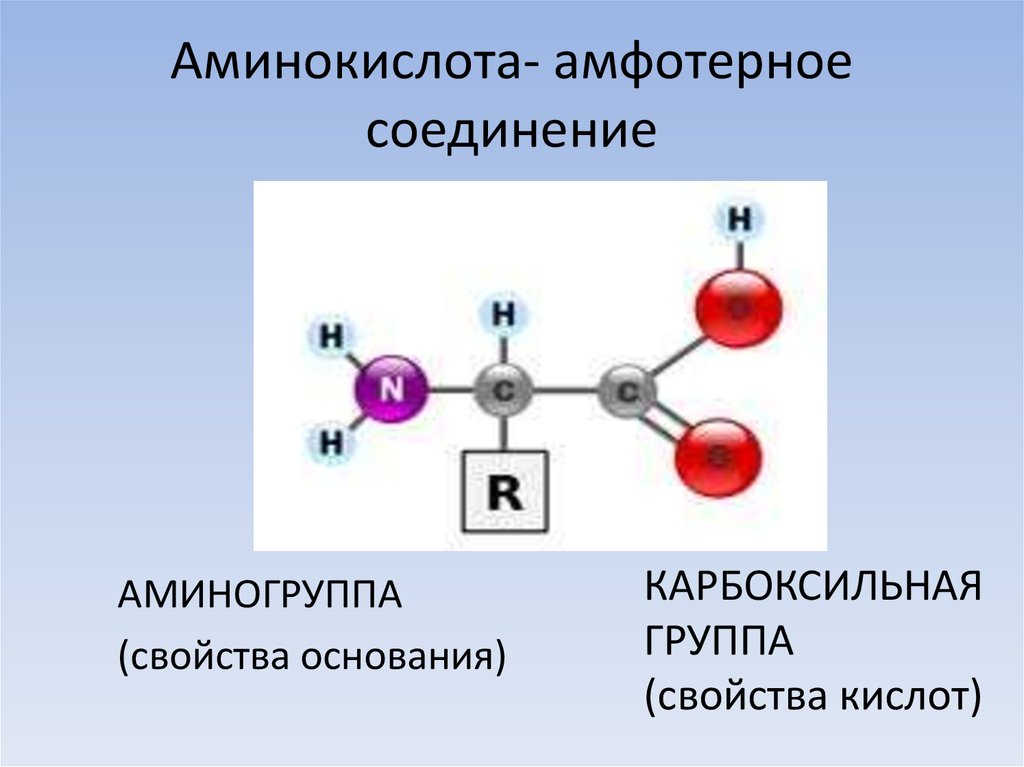 На самом деле термин «амфотерный» происходит от греческого слова «амфотерий», означающего «оба».
На самом деле термин «амфотерный» происходит от греческого слова «амфотерий», означающего «оба».
Примечание: Амфотерные вещества также называют Амфипротонные вещества .
Концепция амфотерного соединения может быть хорошо понята с помощью концепции Bronsted-Lowry о кислоте и основании.
Согласно теории Бренстеда-Лоури кислота является веществом, которое может отдавать протон , в то время как основание является веществом, которое может принимать протон.
Концепция кислоты и основания Бренстеда-Лоури может быть хорошо понята на следующих примерах, где донор протона называется кислотой, а акцептор протона называется основанием.
Теперь, когда мы ясно поняли, что такое кислота и основание в соответствии с концепцией Бренстеда-Лоури, давайте попробуем разобраться в этой теории Бренстеда-Лоури более подробно.
Теория кислоты и основания Бренстеда-Лоури включает в себя понятие сопряженной пары кислота-основа. Пара кислоты и основания, отличающаяся протоном, называется сопряженной кислотно-основной парой .
Теперь попробуем разобраться с сопряженной кислотно-основной парой. В показанном выше примере 1 HCl и Cl- образуют сопряженную кислотно-основную пару, поскольку они отличаются протоном.
Аналогично, Nh5+ и Nh4 в примере 2 также образуют другую сопряженную кислотно-основную пару.
Примечание: Если кислота Бренстеда-Лоури сильная, сопряженная с ней пара оснований будет слабой, и наоборот.
Итак, как эта сопряженная кислотно-основная пара поможет понять амфотерные вещества?
Чтобы узнать ответ на этот вопрос, давайте рассмотрим следующие примеры реакций:
В этом примере 1: есть две пары сопряженных кислотно-основных пар, которые обозначены их природой и номерами. Кислота-1 и Основание-1 образуют один набор сопряженных кислотно-основных пар, тогда как Кислота-2 и Основание-2 образуют другой набор сопряженных кислотно-основных пар, поскольку они также отличаются протоном. Обратите внимание, что в этом примере 1 h3O действует как кислота .
Обратите внимание, что в этом примере 1 h3O действует как кислота .
Этот пример 2: также имеет две пары сопряженных кислотно-основных пар, которые обозначены их природой и номерами. Кислота-1 и Основание-1 образуют один набор сопряженных кислотно-основных пар, тогда как Кислота-2 и Основание-2 образуют другой набор сопряженных кислотно-основных пар, поскольку они также отличаются протоном. Обратите внимание, что в этом примере 2 h3O действует как основание .
В примере 1 h3O действует как кислота, а в примере 2 h3O действует как основание, т. е. одна и та же молекула h3O действует и как кислота, и как основание в разных реакциях, проявляя таким образом свою амфотерную природу.
Давайте посмотрим на уравнение реакции примера 3:
В этом примере 3: реакция мы можем видеть, что h3O действует как кислота и основание в той же самой реакции, снова иллюстрируя ее амфотерную природу.
Помимо h3O, ионные молекулы, такие как HCO3-, HSO4-, также обладают амфотерной природой.
В этом примере 4: Как вы можете видеть, здесь две пары сопряженных кислотно-основных пар, которые обозначены их природой и номерами. Кислота-1 и Основание-1 образуют один набор сопряженных кислотно-основных пар, тогда как Кислота-2 и Основание-2 образуют другой набор сопряженных кислотно-основных пар, поскольку они также отличаются протоном. В этом примере 4 HCO3 — действует как база .
В этом примере 5: две пары сопряженных кислотно-основных пар, которые обозначены их природой и номерами, образуют соответствующий набор сопряженных кислотно-основных пар, поскольку они отличаются протоном. В этом примере 5 HCO3- действует как кислота .
Таким образом, примеры реакций 4 и 5 доказывают амфотерную природу иона бикарбоната (HCO3 -).
Работа: Напишите уравнения, показывающие амфотерную природу иона HSO4-.
Вам это нравится? Затем подпишитесь на BIC по адресу:
Подпишитесь на BIC на Youtube: https://www. youtube.com/user/pubic
youtube.com/user/pubic
Подпишитесь на BIC на Facebook: http://facebook.com/bicspuc
Подпишитесь на BIC в Instagram: https: //www.instagram.com/bicpuc1/
Подписывайтесь на BIC на SoundCloud: https://soundcloud.com/bicpuc
Амфотеризм — определение и примеры амфотеризма
(обновлено )
Амфотерное вещество может действовать как кислота или основание.
В химии амфотерное вещество представляет собой химический вид, который может действовать как кислота, так и как основание, в зависимости от условий реакции. Явление называется амфотеризмом .
Амфотерность относится к кислотам и основаниям Бренстеда-Лоури и Льюиса. Слово происходит от греческого слова amphoteros или amphoteroi , что означает «каждый или оба из двух» и означает, что вещество является «либо кислотным, либо щелочным».
Амфотерные вещества
Амфотерное вещество имеет переносимый водород (протон) и атом с неподеленными электронными парами. Примеры амфотерных веществ включают воду, аминокислоты, белки и многие оксиды и гидроксиды металлов.
Примеры амфотерных веществ включают воду, аминокислоты, белки и многие оксиды и гидроксиды металлов.
Оксиды и гидроксиды алюминия, сурьмы, мышьяка, сурьмы, висмута, бериллия, хрома, кобальта, меди, галлия, германия, золота, железа, свинца, серебра, теллура, олова и цинка являются амфотерными. Однако оксиды щелочных металлов и щелочноземельных металлов образуют только основные оксиды и не являются амфотерными. Наиболее амфотерные оксиды и гидроксиды металлов происходят из металлов, находящихся вблизи центра таблицы Менделеева.
Некоторые вещества, обычно считающиеся либо кислотами, либо основаниями, на самом деле являются амфотерными. Например, серная кислота (H 2 SO 4 ) действует как кислота в воде, но действует как основание или амфотерна в суперкислотах. В общем, кислоты, способные отдавать несколько ионов водорода, являются амфотерными. Точно так же основания с высокозаряженными катионами металлов являются амфотерными.
Примеры амфотеризма
Например, рассмотрим амфотеризм воды (H 2 O):
Вода принимает протон при взаимодействии с кислотой, такой как соляная кислота (HCl).
H 2 O + HCl ⇌ H 3 O + + Cl –
Вода отдает протон, когда реагирует с основанием, таким как аммиак (NH 1 3 9014).
H 2 O + NH 3 ⇌ NH 4 + + OH —
Аналогично, амфотерные оксиды металлов, такие как оксид -оксид (AL 2 . основание при реакции с кислотой и как кислота при реакции с основанием.
AL 2 O 3 (S) + 6H 3 0 + (AQ) + 3H 2 O (L) → 2 [AL 2 ) 6 6 ) ) ) ) ) ) ) ). + (водн.)
Al 2 O 3 (т) + 2OH – (водн.) + 3H 2 O(ж) → 2[Al(OH) 4 9 – 8 ] aq)
Как идентифицировать амфотерные вещества
Чтобы идентифицировать амфотерное вещество, обратите внимание на способность как добавлять, так и удалять ионы водорода из других молекул. Амфотерное вещество может содержать несколько ионов водорода, как кислотных, так и основных компонентов в одной и той же молекуле, или несколько зарядов на своем катионе или анионе.
Амфотерное вещество может содержать несколько ионов водорода, как кислотных, так и основных компонентов в одной и той же молекуле, или несколько зарядов на своем катионе или анионе.
Может оказаться полезным увидеть виды, которые не амфотерны. Например, азотистая кислота (HNO 2 ) — это кислота, а не амфотерная, потому что она не может служить основанием. Он диссоциирует с выделением катиона водорода и аниона NO 2 – . Азотистая кислота отдает только один ион водорода или протон. Он больше не может принимать протоны, а анион NO 2 – (сопряженное основание) не может их отдавать.
HNO 2 → H + + NO 2 −
Связанные термины
Амфипротный : Амфипротный вид представляет собой тип амфотерного вещества, которое либо принимает, либо отдает протон (H + ), в зависимости от условий. Согласно теории кислот и оснований Льюиса амфипротные соединения являются амфотерными, но не все амфотерные вещества являются амфипротонными.




 ) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑
) + K2CO3(тв.) (t,сплавление)→ K2ZnO2 + CO2↑ + H2O↑