Химия 9 класс презентация получение металлов – Презентация к уроку по химии (9 класс) по теме: Презентация «Способы получения металлов»
Презентация к уроку по химии (9 класс) на тему: Получение металлов.
Слайд 1
Получение металловСлайд 2
Цели урока: познакомить учащихся с природными соединениями металлов. Сформировать понятия о самородных металлах, минералах и рудах. Ознакомить ребят с металлургией и ее видами: пиро -, гидро -, электрометаллургией и тд .
Слайд 3
Проблемный вопрос: Могут ли металлы находиться в природе в свободном(или самородном) состоянии, т.е. в виде М 0 . Если могут, то, какие это металлы? Это металлы низкой химической активности .
Слайд 4
Металлы могут встречаться в природе или в виде простого вещества(самородка) или в виде сложного вещества это зависит от того где расположен металл в ряду напряжений : — металлы, стоящие в ряду напряжений до алюминия, встречаются в природе в виде солей – хлоридов, сульфатов, нитратов, карбонатов; — металлы от алюминия до ртути – в виде оксидов и сульфидов, реже в виде карбонатов; -металлы, располагающиеся в ряду напряжений после водорода, могут встречаться в самородном виде (золото, серебро, платина, реже – ртуть и медь).
Слайд 5
Природные образования, содержащие минералы металлов, пригодные для промышленного получения из них металлов, называют рудами. Железная руда Свинцовая руда
Слайд 6
— Как вы думаете, какой основной химический процесс лежит в основе получения металлов? Ответ: Большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной с.о , значит для того чтобы их получить в виде М 0 , необходимо провести процесс восстановления .
Слайд 7
Получение металлов из их соединений занимается важнейшая отрасль промышленности, называется металлургией.
Слайд 8
Общие способы получения металлов Пирометаллургия Гидрометаллургия Электрометаллургия Термическое разложение соединений Микробиологический
Слайд 9
Пирометаллургия – это методы извлечения металлов из руд под действием высоких температур. Сульфидные руды подвергают обжигу: 2 CuS +3 O 2=2 CuO +2 SO 2 Оксидные металлы и оксиды восстанавливают водородом, углем, угарным газом, более активным металлом – алюминием (алюминотермия), магнием( магнийтермия ), натрием( натрийтермия ): CuO + C = Cu + CO
Слайд 10
Гидрометаллургия – методы получения металлов, основанные на химических реакциях, происходящих в растворах. CuS+4h3SO4=CuSO4+4SO2+4h3O Конц . CuSO4+Fe=FeSO4+Cu Этим способом получают следующие металлы: Ag , Au , Zn , Mo . Золото Цинк
Слайд 11
Электрометаллургия – выделение металлов из их солей и оксидов под действием электрического тока . электролиз 2Al2O3=4Al+3O2 электролиз 2 NaCl =2 Na + Cl 2 Металлы, стоящие в ряду напряжений до алюминия включительно, можно получить электролизом только расплавов оксидов и солей. Менее активные металлы можно восстановить электрическим током из растворов солей: электролиз 2CuSO4+2h3O=2Cu+2h3SO4↓+O2 ↑
Слайд 12
Термическое разложение соединений : так получают Ме в особо чистой форме: титан, цирконий, торий – из галогеноидов , ванадий. Ниобий, тантал – из оксидов. Fe ( CO )5= Fe +5 CO Титан Торий Тантал
Слайд 13
Микробиологический метод : например тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты . Серные пузыри. Микробиологи обнаружили здесь активно идущий процесс образования серной кислоты за счет жизнедеятельности тионовых бактерий
Слайд 14
Закрепление новых знаний и способов действия. Закрепление знаний решение задач по теме «Металлы», упр. 1-3 . Домашнее задание § 9, упр.4-6 стр.40
Слайд 15
Рефлексия . Я считаю, что прошедший урок был…. На уроке мне понравилось….. Мне это пригодится…..
Слайд 16
Список используемой литературы 1. О. С. Габриелян “Химия 9 класс”. М. “Дрофа”, 2012 г. 2. А. С. Федоров “Творцы науки о металле”. М. “Наука”, 1980 год. 3.CD “Уроки химии Кирилла и Мефодия 8– 9 класс”. Интернет-ресурсы images.yandex.ru
nsportal.ru
Презентация к уроку по химии (9 класс) по теме: презентация по теме «Способы получения металлов. Сплавы»
Слайд 1
Учитель химии МОУ ВСОШ № 2 Колядкина И.В.Слайд 2
Самым распространенным Ме в земной коре является алюминий. За ним следует железо, натрий, калий, магний и титан. Содержание остальных металлов незначительно. Так, например, хрома в земной коре по массе всего лишь 0,3%, никеля – 0,2%, а меди – 0,01%. Ме встречаются в природе как в свободном виде, так и в различных соединениях
Слайд 3
Самородок платины Самородок серебра Самородок золота Самородок меди
Слайд 4
Металлургия Пирометаллургия Гидрометаллургия Электрометаллургия
Слайд 5
Пирометаллургия — получение металлов и сплавов под действием высоких температур. Восстановление углем (угарным газом): 2PbO + C = CO 2 + 2Pb Восстановление алюминием (кальцием): 2 Al + Fe 2 O 3 = Al 2 O 3 + 2Fe Восстановление водородом: С uO + H 2 = Cu + H 2 O
Слайд 6
Гидрометаллургия — получение металлов из водных растворов. 1 стадия: растворение в кислоте нерастворимых минералов, содержащих металлы: CuS + 2HCl = CuCl 2 + H 2 S 2 стадия: вытеснение металлов из растворов их солей более активными металлами: CuCl 2 + Fe = FeCl 2 + Cu
Слайд 7
Электрометаллургия — получение металлов под действием электрического тока. Этим способом в промышленности получают металлы, стоящие в ряду напряжений металлов до Al .
Слайд 8
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией
Слайд 9
Одним из наиболее широко распространенных коррозионных процессов является ржавление железа. Его можно описать суммарным уравнением: 4Fe + 6H 2 O (влага) + 3O 2 (воздух) = 4Fe(OH) 3
Слайд 10
Коррозия может возникать и под влиянием радиационного излучения, а также продуктов жизнедеятельности бактерий и других организмов. С развитием бактерий на поверхности металлических конструкций связано явление биокоррозии. Обрастание подводной части судов мелкими морскими организмами также оказывает влияние на коррозионные процессы.
Слайд 11
Защита поверхности металла металлическими покрытиями хромирование золочение никелирование Защита поверхности металлов неметаллическими покрытиями Защиты от коррозии: изготовление изделий из нержавеющих сталей, катодная защита
Слайд 12
Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, к уменьшению надежности работы оборудования: аппаратов высокого давления, паровых котлов, металлических контейнеров для токсичных и радиоактивных веществ.
Слайд 13
Сплавы – это материалы с характерными свойствами, состоящие из двух или более компонентов, из которых по крайней мере один – металл. однородные сплавы неоднородные при сплавлении образуется раствор одного Ме в другом. Припой: одна часть свинца и две части олова при сплавлении образуется механическая смесь Ме Дюралий: 95% алюминия, 4% меди, 0,5% марганца и 0,5% магния
Слайд 14
Сплавы на основе железа Чугун – это сплав железа, содержащий более 1,7 % углерода, а также кремний, марганец, небольшие количества серы и фосфора. Сталь — это сплав железа, содержащий 0,1-2 % углерода и небольшие количества кремния, марганца, фосфора и серы.
Слайд 15
Бронза – сплав на основе меди с добавлением (20%) олова. Латунь – медный сплав, содержащий от 10 до 50% цинка. Мельхиор – сплав, содержащий около 80% меди и 20% никеля Дюралюминий – сплав на основе алюминия, содержащий медь, марганец, магний и никель.
nsportal.ru
Презентация к уроку химии (9 класс) по теме: Урок с компьютерной поддержкой.Получение металлов
МОУ «Барашевская средняя общеобразовательная школа»
Провела: учитель химии
Бердова Н.Ю.
2009 год
Цель: сформировать представление о металлургии, способах получения металлов разной степени активности, развивать умение составления уравнений химических реакций.
Оборудование: коллекции руд металлов, натрий металлический, вода, железо, раствор сульфата меди, оксид меди раствор серной кислоты. Презентация. Слайд-1
Форма проведения: медиа- урок
I Организационный момент. Проверка домашнего задания.
1.«Маска, откройся» учащиеся задают вопросы о металлах.
2. Объясните, используя знания о химических свойствах металлов, почему нельзя:
а) хранить литий на воздухе( записать уравнение)
б) использовать для прекращения горения натрия воду.(опыт, записать уравнение)
в) хранить кислые щи в алюминиевой кастрюле.( записать уравнение)
г) готовить раствор сульфата меди в ведре, сделанном из оцинкованного железа.( записать уравнение)Слайд-2
II Девиз урока: « Жизнь учит только тех, кто ее изучает».
Слайд-3 Из этого стихотворения можно определить, что сегодня мы будем говорить о получении металлов.
Слайд-4 Отметьте на схеме какие из металлов встречаются в природе: а) только в соединениях;
б) и в соединениях и в свободном виде;
в) главным образом в свободном виде.
Вывод: Нужно найти способы получения металлов из соединений.
Слайд-5 Историческая справка.
Работа в парах с коллекцией. Дается определение металлургии. Записывается тема урока « Получение металлов».
В зависимости от способа извлечения металла из руд выделяют следующие виды металлургических процессов.
Слайд-6 Пирометаллургия
Слайд-7 Гидрометаллургия
Слайд-8 Электрометаллургия.
Слайд-9 Микробиологический метод
III Рефлексия
Слайд -10 Игра в крестики- нолики. Найдите выигрышный путь, состоящий из названий наиболее часто используемых в пирометаллургии восстановителей.
Слайд -11 Составьте уравнения реакций восстановления железа из его оксидов.
Слайд-12 Запишите уравнения реакций получения меди из оксида меди(II) способом гидрометаллургии. Рассмотрите реакцию обмена в свете ТЭД, а для ОВР составьте электронный баланс.
nsportal.ru
Сценария интерактивного урока по химии в 9 классе «Получение металлов»
Пешкина О.Ю., учитель химии МБОУ СОШ №3 г. Михайловска, Шпаковского района, Ставропольского края
Интерактивный урок по химии в 9 классе
Получение металлов
Цели: Познакомить обучающихся с природными соединениями металлов и как ихдобывают.
Сформировать понятия о самородных металлах, минералах и рудах.
Ознакомить с металлургическими видами получения металлов: пиро-, гидро-, электрометаллургией. Продолжить формирование навыков у обучающихся взаимодействовать в парах и малых группах; умение анализировать полученную информацию и делать выводы.
Ожидаемые результаты: По окончании урока обучающиеся будут знать особенности нахождения металлов в природе, названия некоторых природных соединений металлов; ознакомятся с коллекцией природных соединений металлов; смогут описать химические процессы, которые лежат в основе получения чистых металлов из руд; смогут сделать выводы о важности изучения данной темы для ;
Оборудование: Коллекция руд металлов, коллекция чистых металлов, презентация к уроку, раствор сульфата меди, порошок железа, спиртовка, спички, штатив с пробирками.
Проверка домашнего задания и Введение в тему урока (7 мин)
Учитель: Ребята, под каким девизом проходили наши уроки изучения металлов.
Ученики: «Металлы – основа цивилизации».
Учитель: Этот девиз прошел через несколько пройденных нами уроков. Мы изучили историю бронзового, медного и железного веков развития нашей цивилизации. Какие еще разделы о металлах нами изучены?
Ученики: Мы познакомились с Положением металлов в Периодической системе Д.И. Менделеева, изучили общие физические и химические свойства металлов.
Учитель: Дома вы закрепили знания по теме «химические свойства» и выполняли упражнения. Теперь я предлагаю вам индивидуальную работу по вариантам. Внимание на таблицу, где вам предлагается проанализировать ответы на вопросы и найти неточности или ошибки. Положительным считается тот ответ, в котором указаны все неточности. (2 мин). Укажите, с какими из перечисленных веществ:С, H2O, S, HCl, O2 будет реагировать
Al
Ca
Серебро
Калий
Na
Cu
находится в 3 периоде, в III группе, побочной подгруппе, порядковый номер – 13, металл, проявляет основные свойства.
MgSi
B Gа
находится в 3 периоде, в II группе, главной подгруппе, порядковый номер – 20, неметалл, проявляет основные свойства.
Mg<Са<Sr
K< Са>Sc
Серебро, металл серебристого цвета, твердый, ковкий, пластичный, имеет низкие температуры плавления, кипения, плохо проводит электрический ток, теплопроводен, хорошо растворим в воде.
калий, металл красного цвета, мягкий, с низкой плотность, имеет высокие темпер-ры плавления, кипения, плохо реагирует с водой, химически активен на воздухе, поэтому хранится в спец-ном резервуаре.
реагирует со всеми перечислен
ными веществами, кроме воды и соляной кислоты.
реагирует с соблюдением условий с C, S, O2
Введение в тему. Актуализация. (2 мин)
Учитель: А теперь, я предлагаю вам посмотреть видеосюжет и определить предмет дальнейшего нашего разговора (видео сюжет о значении алюминия и необходимости изучения его производства).
Учитель: Вы догадались, о чем мы сегодня будем говорить?
Ученики: Сегодня мы будем изучать, как получают металлы.
Основная интерактивная часть (25 мин).
Учитель: Могут ли металлы встречаться в природе в свободном состоянии? Если да, то, какие это металлы по своей химической активности должны быть?
Ученики: Это золото и платина, они обладают низкой химической активностью, поэтому спокойно лежат в недрах земли.
Учитель: А как же остальные металлы?
Ученики: В виде каких-нибудь соединений.
Учитель: Рассмотрите коллекции, которые лежат у вас на столах в группах и познакомьтесь с названиями некоторых природных соединений.(1 мин) (Во время просмотра учитель обращает внимание детей на названия и состав минералов)
Учитель: Давайте сделаем обобщение, составим схему нахождения металлов в природе.
Как называются металлы, встречающиеся только в свободном виде?
Ученики: Самородки.
Учитель: Какие химически неактивные металлы мы к ним уже отнесли?
Ученики: Золото, платина.
Учитель: Металлы, встречающиеся в виде соединений.
Ученики: Активные металлы.
Учитель(уточняет): Металлы, стоящие в ряду напряжений от калия до олова.
Еще, какой вид металлов может встречаться в природе?
Ученики: Металлы, встречающиеся и в самородном состоянии и в соединениях.
Учитель: И к ним относятся: Олово, свинец, ртуть, серебро.
У детей в тетради должны появиться схема:
Металлы в природе
Учитель: Сделайте вывод, в каком виде металлы встречаются чаще всего?
Ученики: В виде соединений – хлоридов, сульфидов, оксидов, карбонатов и т.д.
Учитель: Как вы думаете, какой химический процесс должен лежать в основе процесса получения чистых металлов из их соединений?
Ученики: Восстановление.
Учитель: Но прежде чем восстановить металл, необходимо перевести его в форму доступную для обработки: обжиг, обработка кислотами, содой.
Затем действие восстановителей. Какие вещества могут выступать в качестве восстановителя?
Ученики: H2, C, CO, Al, другие активные металлы
Учитель: Как можно назвать отрасль промышленность, которая занимается получением металлов из их соединений?
Ученики: Металлургия.
Учитель: Ребята, теперь предлагаю вам поиграть. Представьте, что вы работники металлургического комбината. Каждая ваша группа – производственный отдел. Отделом руководит главный технолог (учитель назначает главного в каждой группе и озвучивает метод, который разрабатывает каждая группа) и вы вместе разрабатываете этот метод восстановления металлов из соединений. Во второй группе работает заводская химическая лаборатория, которая может продемонстрировать один из методов. Поработайте с учебником (П.9) и маршрутными картами, которые лежат у вас на столе и, через 10 мин мы обсудим каждый из них.
Лаборантам приступить к своей работе.
Обратная связь.
Учитель: Совещание окончено, пора приступить к изложению ваших методов. На столе у каждого из вас есть заготовка сводной таблицы «Методы получения металлов», заполняем ее вместе с технологами.
Выступления учащихся – главных технологов и демонстрация опыта учениками- лаборантами. Заполняется сводная таблица на доске самими учениками.
2 PbS + 3О2 = 2PbO + 3SO2PbO + Н2 = Pb + Н2O
Fe, Zn, W, Ti и др.
Гидрометаллургия
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
Ag, Au, Zr, Zn, Mo
Электрометаллургия
2NaCl(расплав) → 2Na + Cl2
шелочные, щелочноземельные металлы и алюминий.
Термическое разложение соединений металлов
[Fe(CO)5] = Fe + 5CO
[Ni(CO)4] = Ni + 4CO
разложение галогенидов
разложение оксидов
Тi, Zr, Th
V, Ta, Nb.
Технолог первой группы: Пирометаллургия.
— это восстановление металлов из руд, происходящее при высоких температурах.
Например, получение свинца. Природное соединение PbS подвергают обжигу: 2 PbS + 3О2 = 2PbO + 3SO2
Затем, свинец из оксида восстанавливают водородом:
PbO + Н2 = Pb + Н2O ( реакция идет при нагревании)
Таким способом получают Fe, Zn, W, Ti и др.
Технолог второй группы: Гидрометаллургия.
— это метод восстановления металлов из растворов их солей другими более активными металлами:
Например, нерастворимый в воде оксид меди растворяют в разбавленном растворе серной кислоты до образования соли меди:
CuO + H2SO4 = CuSO4 + H2O
Затем, медь восстанавливают из раствора чистым железом.
CuSO4 + Fe = FeSO4 + Cu
Этим способом получают Ag, Au, Zr, Zn, Mo
Лаборанты 2 группы, одели белые химические халаты, подготовили опыт по инструкции по получению меди из ее раствора, восстанавливая чистым железом.
Заведующий лабораторией докладывает:
В пробирку с раствором сульфата меди(II) добавили порошок железа.
Чтобы реакция ускорилась, пробирку можно погреть над пламенем спиртовки. Через некоторое время раствор обесцвечивается, а на дне пробирки появляется красный осадок меди.
Ученик: Железо в ряду напряженностей металлов стоит левее меди, т.е. активнее. Поэтому может вытеснить медь из ее соли.
Учитель: Могла бы пройти реакция между сульфатом железа(II) и чистой медью?
Ученик: Нет, т.к. медь менее активна.
Технолог 3 группы: Электрометаллургия.
— это метод восстановления металлов с помощью электрического тока – электролиз.
Электролиз – это восстановление металлов из растворов или расплавов их соединений.
Например, расплав хлорида натрия при действии электрического тока разлагается на чистый натрий и хлор:
2NaCl(расплав) → 2Na + Cl2
Этим способом получают шелочные, щелочноземельные металлы и алюминий.
Учитель: Ребята, подробнее писать процесс электролиза мы с вами научимся в 11-ом классе.
Технолог 4 группы: Термическое разложение соединений металлов (материал не из учебника)
При термическом разложении карбонильных комплексов железа и никеля получают металлы особой чистоты:
[Fe(CO)5] = Fe + 5CO
[Ni(CO)4] = Ni + 4CO
Термическим разложением галогенидов получают Тi, Zr, Th; разложением оксидов – V, Ta, Nb.
Рефлексия. Выводы (8 мин)
Учитель: Поднимите руки те, кто сегодня узнал что-то новое. Спасибо.
Запомнили ли вы, на какие группы делятся металлы по способу их природного происхождения?
Ученики: Самородки, те, что встречаются только в соединении, металлы, встречающиеся как в самородном соединении, так и в соединениях.
Учитель: Давайте проверим, как вы разобрались с методами получения металлов. Я побывала на нескольких предприятиях. Узнаете ли вы по видеосюжету, о каком методе получения металлов идет речь?
Сюжет о получении титана( мин).
Ученики: Пирометаллургический.
Учитель: Кто-нибудь считает по другому? А какие приметы этого метода вы увидели?
Ученики: Печи для обжига, расплавление руды.
Сюжет о получении алюминия ( мин).
Ученики: Электрометаллургический.
Учитель: Кто-нибудь считает по другому? А какие приметы этого метода вы увидели?
Ученики: Электролизеры, силовые кабели. Говорят о действии электромагнитного поля.
Учитель: Ребята, нужны ли сейчас такие заводы нашей стране? Выгодно ли строить новые, модернизировать старые. Или может легче покупать готовую продукцию за границей?
Ученик: Россия – сырьевая страна. У нас много полезных ископаемых, которые выгодно перерабатывать самим. ( Возможны и другие мнения, необходимо выслушать все, учитель может сказать о том, что бы оценить объективно экономическую сторону этого вопроса необходимо получать новые знания и, что у ребят все еще впереди).
Учитель: Поднимите руки те, кому сегодня было интересно.
Спасибо вам за активное участие в нашем занятии, мне тоже было интересно с вами.
Домашнее задание
П. 9, упр. 1-6
infourok.ru
Презентация «Металлы». — Химия — 9 класс
Презентация к уроку по химии в 9 классе. Тема: «Положение металлов в ПСХЭ, нахождение и физические свойства». Тип урока: комбинированный. Рассматривается электронное строение, нахождение, получение и физические свойства металлов.
Просмотр содержимого документа
«Презентация «Металлы».»



- составляют большую часть химических элементов
- с увеличением номера периода металлов становится больше:
- 2-ой период – 2 металла (литий и бериллий),
- 3-ий период – 3 металла (натрий, магний, алюминий),
- 4-ой период – 13 металлов,
- 7-ой период – 29 металлов.

Электронное строение атомов металлов
На внешнем электронном слое: один – три электрона
Радиус атомов металлов
Больше, чем у неметаллов
Следовательно :
Атомы металлов легче отдают наружные электроны, чем атомы неметаллов
Следовательно:
являются сильными восстановителями
Следовательно:
атомы металлов при химических превращениях в положительно заряженные ионы:
Ме 0 – ne – →Me n+
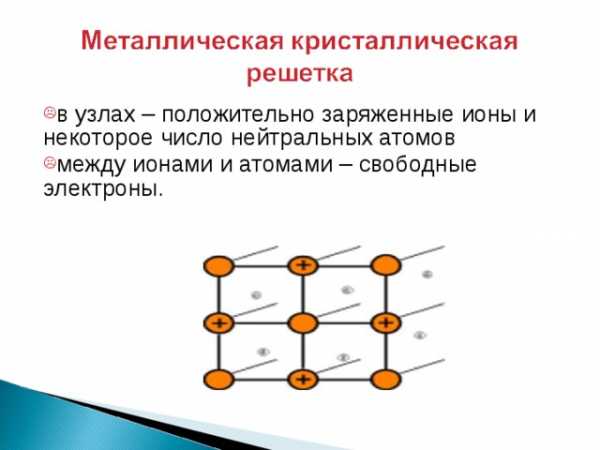
- в узлах – положительно заряженные ионы и некоторое число нейтральных атомов
- между ионами и атомами – свободные электроны.
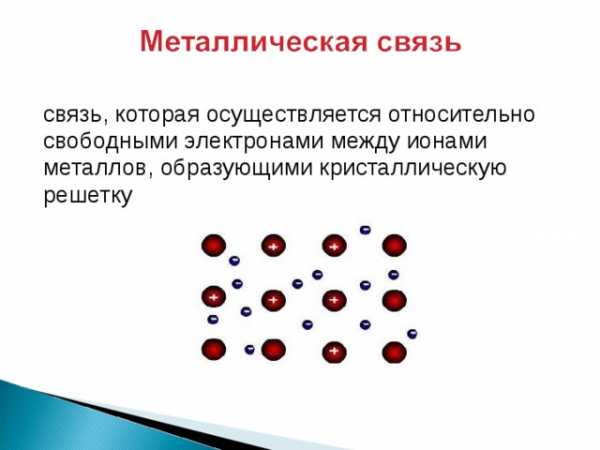
связь, которая осуществляется относительно
свободными электронами между ионами
металлов, образующими кристаллическую
решетку

- Самый распространенный металл в земной коре – алюминий.
- За ним следует железо, кальций, натрий, калий, магний и титан.
- Металлы встречаются в природе как в свободном виде, так и в различных соединениях.


Основаны на процессе восстановления из различных соединений:
1) Из оксидов:
а) действием водорода
б) действием оксида углерода ( II )
в) действием алюминия (магния)
2) Из солей:
а) гидрометаллургический
б) из сульфидов с предварительным обжигом

а) действием водорода (водородотермия)
CuO + H 2 = Cu + H 2 O
б) действием оксида углерода ( II )
Fe 2 O 3 + CO = Fe + CO 2
в) действием алюминия (алюмотермия) или магния ( магнийтермия )
MnO 2 +AI=AI 2 O 3 +Mn
Cr 2 O 3 + Mg = Cr + Mg O
Расставьте коэффициенты в уравнениях!

а) гидрометаллургический
- растворени е природного соединения с целью получения раствора соли этого металла :
CuO + H 2 SO 4 = CuSO 4 + H 2 O
- вытеснение металла более активным металлом
CuSO 4 + Fe = FeSO 4 + Cu
б) из сульфидов с предварительным обжигом

- Теплопроводность;
- Металлический блеск;
- Ковкость и пластичность;
- Электропроводность
Обусловлены:
- металлической связью,
- металлической кристаллической решеткой.


§34, §35, §36
Выполнить упражнение 9, задача 1 (стр.112)
multiurok.ru
Презентация по Химии «Металлы 9 класс»
Презентация по Химии «Металлы 9 класс» — скачать смотреть бесплатно53335531463039513235404944384142294843374734365045565452
XСкопируйте код и вставьте его на свой сайт.
Металлы 9 класс
Описание презентации по отдельным слайдам:
 1 слайд
1 слайдУчитель химии ГБОУ СОШ № 880 Город Москва Гершановская Евгения Владимировна
 2 слайд
2 слайдМ Е Т А Л Л Ы Расположение в периодической системе Строение атомов Нахождение в природе Металлическая решетка Физические свойства Сплавы Способы получения
 3 слайд
3 слайдРасположение элементов – металлов в периодической системе: 1 группа главная подгруппа – щелочные металлы 2 группа главная подгруппа – щелочно-земельные металлы 3 группа главная подгруппа – все кроме бора 4 группа главная подгруппа – все кроме углерода и кремния 5 группа главная подгруппа – сурьма и висмут 6 группа главная подгруппа – только полоний Во всех побочных подгруппах – только металлы
 4 слайд
4 слайдВ строении атомов металлов – на последнем электронном уровне находится малое число электронов, в основном от 1 до 3, редко 4. Na 2e 8e 1e +11 +13 Al 2e 8e 3e Атомы металлов отдают электроны с последнего уровня, являясь при этом восстановителями Na — 1e Na +
 5 слайд
5 слайдБольшая часть металлов существует в природе в виде минеральных образований — руд Некоторые неактивные металлы существуют в виде самородков: золото, серебро, платина, медь
 6 слайд
6 слайдР А З Н О О Б Р А З И Е М Е Т А Л Л О В
 7 слайд
7 слайдМеталлы, с которыми человек познакомился раньше всех остальных: серебро золото медь свинец олово железо ртуть
 8 слайд
8 слайдЗолото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль). Известно, что организм человека на 3 % состоит из металлов. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови. Э Т О П О Л Е З Н О З Н А Т Ь…
 9 слайд
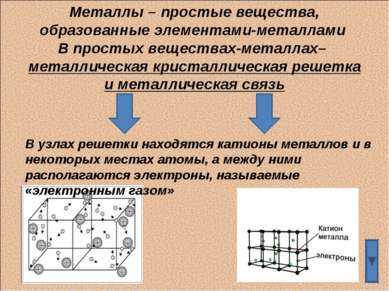
9 слайдМеталлы – простые вещества, образованные элементами-металлами В простых веществах-металлах– металлическая кристаллическая решетка и металлическая связь В узлах решетки находятся катионы металлов и в некоторых местах атомы, а между ними располагаются электроны, называемые «электронным газом»

 11 слайд
11 слайдМеталлический блеск Агрегатное состояние – твердое (кроме ртути) По цвету разделяют: черные металлы и цветные металлы У многих большая электро -и теплопроводность – т.е. металлы – хорошие проводники электрического тока Они многие пластичные, ковкие (меняют свою форму) Имеют разные температуры плавления: разделяют легкоплавкие и тугоплавкие металлы Металлы по плотности бывают легкие и тяжелые Металлы могут быть мягкими (например — калий, литий, натрий – они режутся ножом и твердыми (например — хром, которым можно резать стекло)
 12 слайд
12 слайдСамый легкий металл – литий Самые тяжелые металлы — осмий и иридий Самый твердый металл – хром, также твердые — ванадий и вольфрам Самые тугоплавкие металлы — вольфрам и рений Самый распространенный на земном шаре— алюминий Самые электропроводные – серебро, медь и алюминий Самые пластичные – золото, серебро и медь З А П О М Н И…. П Р И Г О Д И Т С Я…
 13 слайд
13 слайдНаиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
 14 слайд
14 слайдметаллические сплавы
 15 слайд
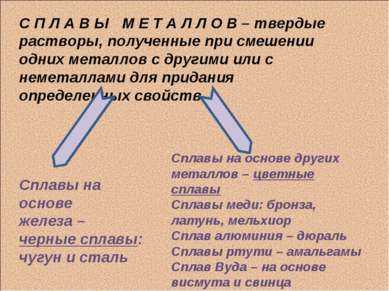
15 слайдС П Л А В Ы М Е Т А Л Л О В – твердые растворы, полученные при смешении одних металлов с другими или с неметаллами для придания определенных свойств Сплавы на основе железа – черные сплавы: чугун и сталь Сплавы на основе других металлов – цветные сплавы Сплавы меди: бронза, латунь, мельхиор Сплав алюминия – дюраль Сплавы ртути – амальгамы Сплав Вуда – на основе висмута и свинца
 16 слайд
16 слайдСамый распространенный металл на Земле? Самый пластичный металл? Какой век был раньше железный или медный? Из какого сплава делают памятники? Из каких металлов делают зеркала? Какие сплавы относятся к черной металлургии? Какие металлы есть в природе в самородном виде? Самый легкий металл? Перечислите металлы, которые раньше всех стали известны человеку Как называются металлы 1 группы главной подгруппы? Самый тугоплавкий металл? П Р О В Е Р Ь С Е Б Я: Самый твердый металл?


 19 слайд
19 слайдДля получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. ЛЕГИРОВАНИЕ (от лат. ligo — связываю, соединяю) — введение добавок в металлы, сплавы для придания им определенных физических, химических или механических свойств. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов).
 20 слайд
20 слайдМеталлургия Добыча руды и ее переработка Промышленные способы получения металлов Получение сплавов Способы получения металлов пирометаллургия гидрометаллургия электрометаллургия
 21 слайд
21 слайдПиро металлургия Гидро металлургия Электро металлургия Получение металлов при высокой температуре: сначала обжиг руды, а затем плавка (восстановление металлов из их оксидов) Пример: 2ZnS + 3O2 —-2ZnO + 2SO2 3ZnO + 2Al ——Al2O3 + 3Zn Получение металлов при использовании электрического тока: электролиз расплавов (для получения очень активных металлов) Пример: NaCl —-Na + Cl2 Получение металлов из растворов их солей: восстановление более активным металлом Пример: CuSO4 + Fe—FeSO4 + Cu
 22 слайд
22 слайдалюминий барий ртуть железо медь хром Н А Й Д И Т Е С О О Т В Е Т С Т В И Е М Е Ж Д У И З О Б Р А Ж Е Н И Е М М Е Т А Л Л А И Е Г О Н А З В А Н И Е М
 23 слайд
23 слайдМ Е Т А Л Л О В Р А З Н Ы Х М Н О Г О Н А П Л А Н Е Т Е, О Н И Х Д О Л Ж Н Ы З Н А Т Ь И В З Р О С Л Ы Е, И Д Е Т И…
 24 слайд
24 слайдhttp://s0.i-news.kz/illustrations/b/13/04/a9/1319482442-190.jpg http://www.globalmarket.com.ua/data/544990_1.jpg http://bigpicture.ru/wp-content/uploads/2010/11/0332.jpg http://i.dailymail.co.uk/i/pix/2009/04/22/article-1172604-0497EFCD000005DC-298_634x465.jpg http://i1.gorodnet.ru/pics/p/66/91/8004369_4b9bb1fd88c91 http://img2.board.com.ua/a/2000625335/wm/1-list-mednyij-1-5h600h2500-med-pt.jpg Ссылки на источники информации и изображений: Электронная энциклопедия ВИКИПЕДИЯ Учебник химии 9 класс – Габриелян О.С. dic.academic.ru http://www.uzex.com/userfiles/news/real_1024.jpg http://news.if.ua/images/news/12/12/23/FHYBJ3.JPG
Чтобы скачать материал, введите свой email, укажите, кто Вы, и нажмите кнопку
Нажимая кнопку, Вы соглашаетесь получать от нас email-рассылку
Если скачивание материала не началось, нажмите еще раз «Скачать материал».
825110837111321225013627138141712617781
336683380833837339533399334172341863420534206342353423634334
У вас есть презентация, загружайте:
Для того чтобы загрузить презентацию на сайт, необходимо зарегистрироваться.
uslide.ru
Презентация на тему Сплавы металлов (9 класс)
Слайд 1Сплавы металлов
Автор: Ежова С.В., учитель химии МБОУ СОШ № 11, г. Кемерово
Слайд 2План урока
Сплавы металлов, получение и их типы Свойства сплавов и их применение Домашнее задание
Слайд 3К сплавам относятся все системы, полученные сплавлением каких-либо веществ. Например, неметаллические сплавы: гранит, гнейс, базальт, силикатные стекла, металлургические шлаки и др. Но наибольшее значение имеют металлические сплавы.
Слайд 4Металлические сплавы
Это материалы с металлическими свойствами, состоящие из двух или более компонентов, из которых хотя бы один металл
Слайд 5Получение сплавов
Сплавы получают путем смешения различных металлов и других компонентов в расплавленном состоянии с затвердеванием их при последующем охлаждении
Слайд 6Типы сплавов
Расплавленные металлы неограниченно растворяются друг в друге, т.е. смешиваются в любых отношениях. Это сплавы состава: Ag — Cu, Ag – Au, Cu – Ni
Слайд 7Расплавленные металлы смешиваются между собой в любых отношениях, но при охлаждении образуют сплав, состоящий из мельчайших отдельных кристалликов каждого из металла Это сплавы состава: Pb – Sn, Pb – Ag, Bi — Cd
Слайд 8Расплавленные металлы вступают в химическое взаимодействие и образуют соединения интерметаллиды. Это сплавы: Zn и Cu, Ca и Sb, Pb и Na
Слайд 9Свойства сплавов
Химическая связь в сплавах – металлическая, поэтому они обладают теми же физическими свойствами, что и металлы: металлическим блеском, пластичностью, электро- и теплопроводностью и др. Но эти свойства несколько изменяются в более полезные для человека свойства.
Слайд 10Бронза
Сплав меди с другими металлами. Различают: Оловянную бронзу (20% олова), Алюминиевую бронзу (5-11 % алюминия) Свинцовую бронзу (до 33% свинца) Применение: изготовление частей машин, художественные отливки
Слайд 11Латунь
Сплав меди и цинка (до 30-35% цинка) Свойства: высокая пластичность Применение: декоративные предметы искусства
Слайд 12Дюралюминий
Сплав алюминия (до 95%) с добавками магния, меди, марганца. Свойства: легкий, прочный. Применение: в авиастроении, машиностроении, строительстве и др.
Слайд 13
Слайд 14Чугун и сталь
Самыми распространенными сплавами, содержащими железо являются: Чугун: сплав на основе железа, содержит от 2 до 4,5% углерода, марганец, кремний, фосфор, серу Свойства: тверже железа, очень хрупкий, не куется Применение: изготовление массивных деталей методом литья (литейный чугун), переработка в сталь (передельный чугун)
Слайд 15Сталь: сплав на основе железа, содержащий менее 2% углерода Виды: Углеродистая сталь – сплав железа с углеродом и меньшим количеством марганца, серы, кремния, фосфора. Применение: детали машин, трубы, болты, гвозди, скрепки, инструменты
Слайд 17Легированная сталь – сплав железа с углеродом с специальными легирующими добавками: хром, никель, вольфрам, молибден, ванадий В зависимости от добавок свойства стали изменяются: Хром и никель –жаростойкость, кислотоупорность, пластичность, коррозионная устойчивость. Вольфрам — твердость, жаропрочность, износоустойчивость. Титан – механическая прочность при высоких температурах, коррозионная стойкость
Слайд 19Вклад русских ученых
Большое значение в развитие металлургии в России внесли Д.К. Чернов – основоположник науки о металлах – металловедении. Разработал наилучшие условия отливки, ковки и термической обработки стали
Слайд 20П.П. Аносов – горный инженер, металлург. Первый применил микроскоп для изучения структуры стали, раскрыл секрет булатной стали, изобрел способ закалки стали в струе сжатого воздуха.
Слайд 21Домашнее задание
§ 7 Рабочая тетрадь: стр. 28- 30, задания № 4, 5, 6
Слайд 22Источники
Габриелян, О.С. Химия 9 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян.- 17 изд., стереотип.- М.: Дрофа,2010. Химия. 9 класс. Мультимедийное учебное пособие нового образца. Издание электронной библиотеки «Просвещение», ЗАО «Просвещение Медиа», 2005г Уроки химии 8-9 классы. Виртуальная школа Кирилла и Мефодия. ООО «Кирилл и Мефодий, 2004г
prezentacii.org

