Строение белков 9 класс презентация: Презентация по биологии 9 класс «Состав, строение и функции белков»
Строение и свойства белков. | Презентация к уроку по биологии (9 класс) по теме:
Опубликовано 18.12.2013 — 21:27 — Барышева Галина Викторовна
Презентация о составе, структурах и свойствах белков может использоваться на уроках биологии в 9-10 классах, а так же на уроках химии при изучеении темы: » Белки»
Скачать:
Предварительный просмотр:
Подписи к слайдам:
Слайд 1
Строение и свойства белков
Слайд 3
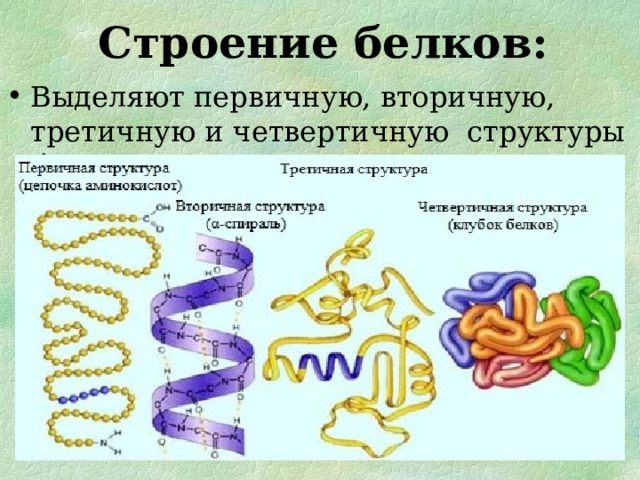
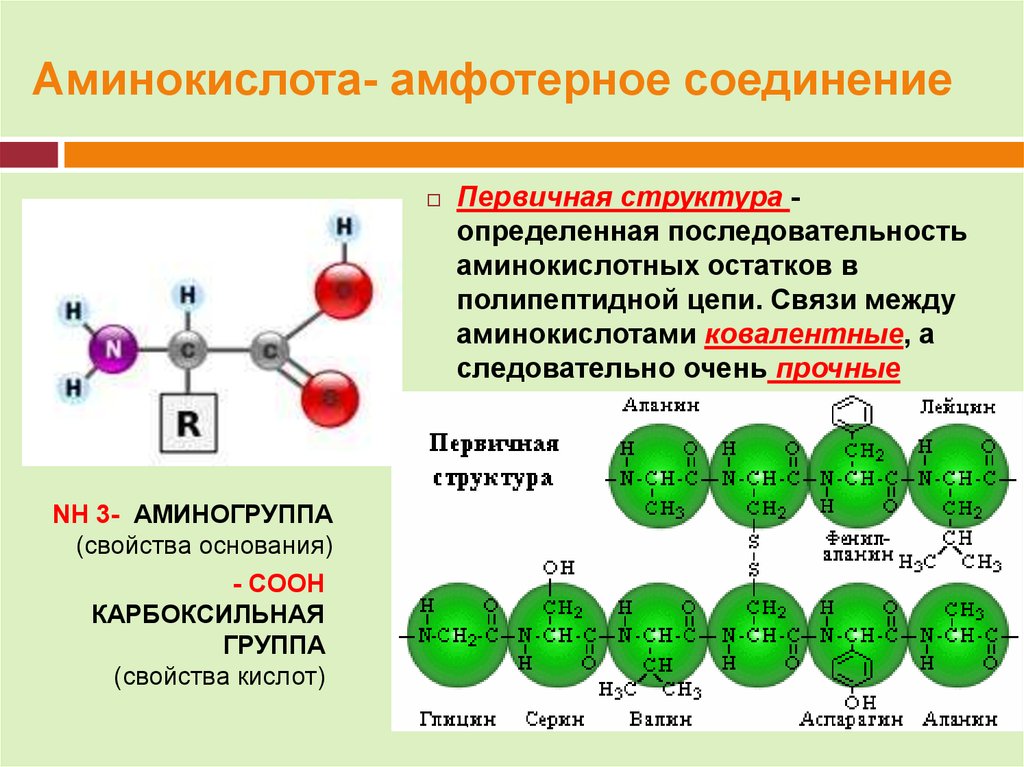
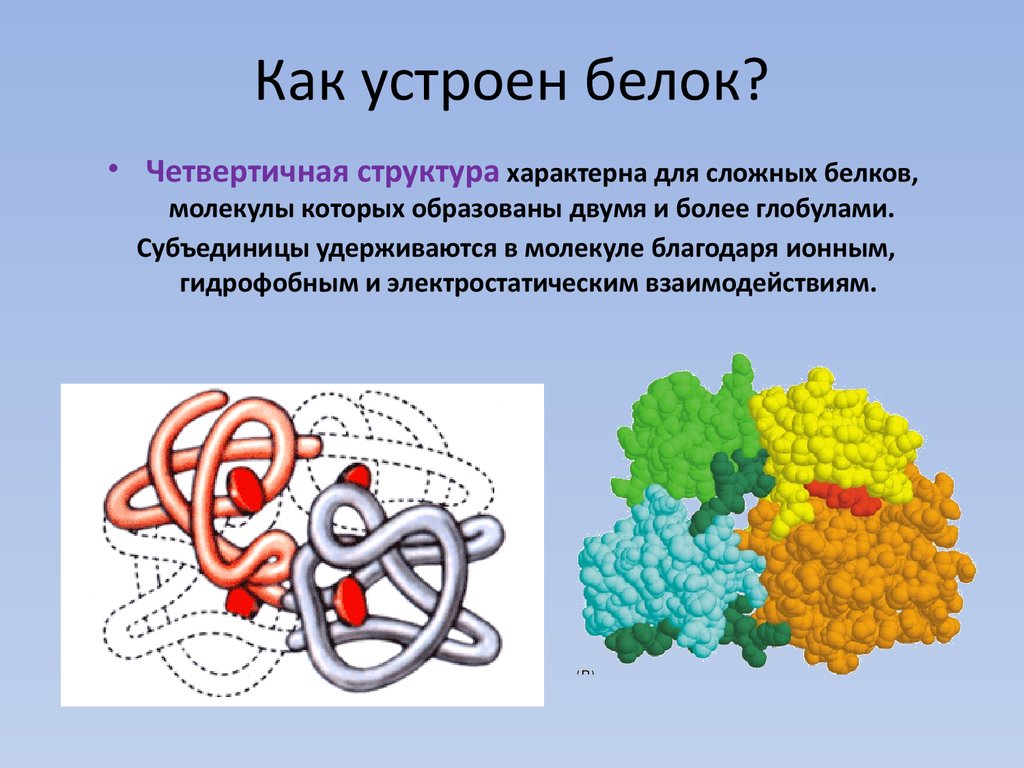
Строение белков. Белки состоят из остатков аминокислот, соединенных пептидными связями, отсюда их второе название- полипептиды. Белки имеют четыре структуры: первичную, вторичную, третичную и четвертичную.
Слайд 5
Пептидная связь
Слайд 8
Четвертичная структура белка
Слайд 11
Биуретовая реакция на белки
Слайд 12
Ксантопротеиновая реакция Если к раствору белка прилить концентрированную азотную кислоту и нагреть, то образуется характерная желтая окраска раствора.
Слайд 13
Разрушение белка- денатурация. Действие серной кислоты на белок.
Слайд 14
Денатурация белка сульфатом меди.
Слайд 15
Механизм денатурации белка.
Слайд 16
Проверьте свои знания! 1. Что такое белки? 2. Какое строение имеют белки? 3. Что такое структуры белка? 4. С помощью каких связей соединены структуры белка? 5. Как определить белок в растворе? 6. Что такое денатурация белка? 7. Какие виды денатурации существуют?
По теме: методические разработки, презентации и конспекты
Белки — природные высокомолекулярные вещества Химические свойства белков
Материал урока формирует знания о составе и строении белков как высшей ступени развития вещества….
Презентация «Белки. Состав, строение и свойства»
Белки, их состав, уровни организации, функции белков в организме, химические реакции и качественные реакции на белки….
Урок по теме: «Химические свойства белка. Биологическая роль белков»
Методическая разработка урока по теме: «Химические свойства белка.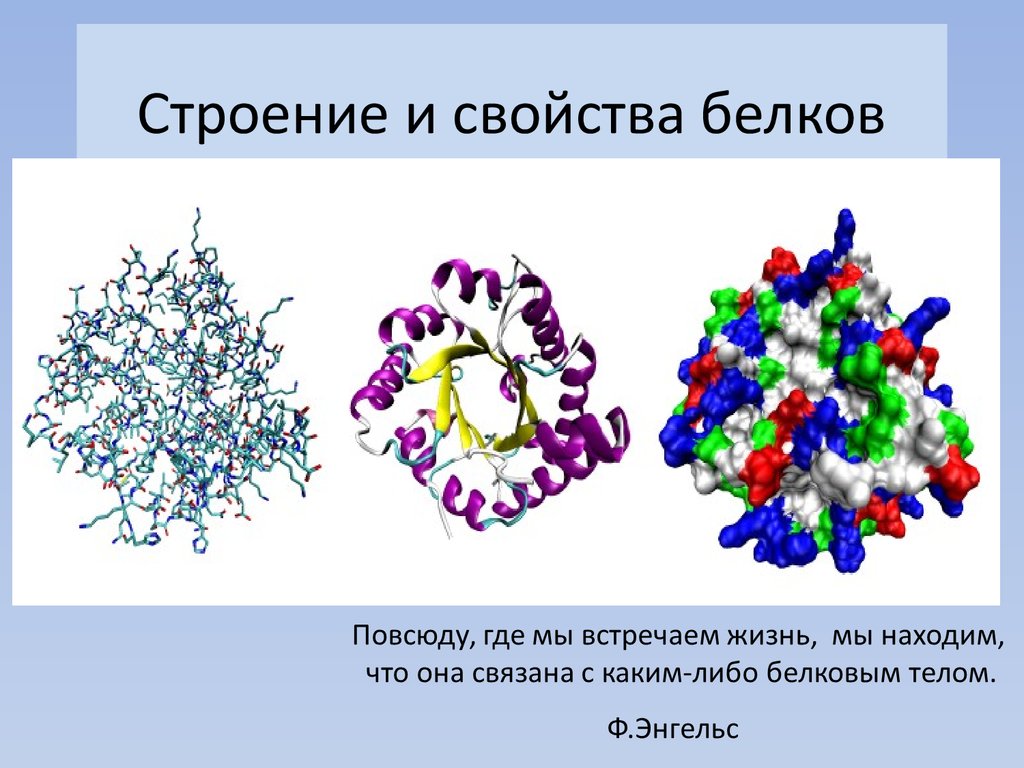 Биологическая роль белков» Методическая цель: реализация профильного изучения темы.Цель урока:1) показат…
Биологическая роль белков» Методическая цель: реализация профильного изучения темы.Цель урока:1) показат…
Урок по биологии в 10-м профильном классе по теме «Белки,их строение и свойства»
Урок проводится в профильном классе по технологии формирования УУД….
Белки. Свойства белков
интегрированный урок по химии и биологии для учащихся 10 классов…
Конспект урока по химии в 10 классе «Состав, строение и свойства белков»
Это конспект урока по химии в 10 классе на тему «Состав,строение и свойства белков"…
Разработка урока химии в 10 классе по теме»Химические свойства белков. Функции белков»
Разработка урока химии в 10 классе по теме»Химические свойства белков. Функции белков», определены цели и задачи урока. методы и приёмы, планируемые результаты….
Поделиться:
Аминокислоты и белки. 9 класс
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. 9 класс Аминокислоты. Белки.
2. План урока.
1.2.
3.
4.
5.
Состав и свойства аминокислот.
Амфотерность аминокислот.
Реакция поликонденсации.
Белки.
Химические свойства белков.
Д/З: § 38, В.1,2.
3. 1.Состав и свойства аминокислот.
Если один атом водорода вметильном радикале молекулы
уксусной кислоты заменить на
группу –Nh3, то получится формула
аминоуксусной кислоты:
Ch4COOH — уксусная кислота
Nh3Ch3COOH – аминоуксусная кислота
Nh3 – функциональная группа,
называемая аминогруппой.
4. Аминокислоты – это органические соединения, в состав которых входят две функциональные группы: карбоксильная –COOH и
аминогруппа – Nh3.Простейшая аминокислота – это
аминоуксусная кислота Nh3Ch3COOH,
называемая также глицином.
5. Глицин – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладковатого вкуса.
Глицин играет большую роль вобмене веществ. Используется в
качестве лекарственного
средства для
улучшения мозгового
кровообращения.
6. 2. Амфотерность аминокислот
Одновременное наличие в молекулахаминокислот двух функциональных
групп определяет их своеобразные
химические свойства.
Карбоксильная группа – СООН в
аминокислотах определяет их
кислотные свойства.
7. Аминогруппа – Nh3 определяет основные свойства вещества, так как способна присоединять к себе катион водорода за счёт наличия
свободнойэлектронной пары у атома азота:
..
— Nh3 + H+ — Nh4+
Так же ведёт себя аммиак, образуя при
+:
этом
ион
аммония
NH
4
.
 .
.Nh4 + H+ Nh5+
Аминокислоты – это
органические вещества, которые
обладают одновременно
кислотными и основными
свойствами.
8. Как нам уже известно из курса неорганической химии, такие вещества называются амфотерными.
Следовательно, аминокислоты –амфотерные вещества, которые могут
реагировать как с щелочами, так и с
неорганическими кислотами, образуя
соли.
h3NCh3COOH + KOH h3NCh3COOK + h3O
Глицинат калия
+
h3NCh3COOH + HCl [h4NCh3COOH]ClХлороводородная соль
глицина
9. 3. Реакция поликонденсации.
Благодаря наличию кислотной иосновной групп молекулы аминокислот
способны взаимодействовать друг с
другом и образовывать полимеры –
белки.
…+ HNH-Ch3 -COOH + HNH-Ch3-COOH +…
…-NH-Ch3CO- NH-Ch3CO-… + nh3O
10. Реакции получения полимеров, которые сопровождаются образованием низкомолекулярного продукта, например воды, называются
реакциями поликонденсации.При соединении молекул аминокислот друг
с другом возникает связь, называемая
пептидной.
Связь между остатком аминогруппы
-NH- одной молекулы аминокислоты и
остатком карбоксильной группы –СОдругой молекулы аминокислоты
называется пептидной связью: -CO-NH- .
11. 4. Белки.
Белки–продукты реакции поликонденсацииаминокислот. Белки имеют очень сложное
строение. На рисунке в качестве примера
показано строение белка инсулина.
12. Белки – важнейшая составная часть всех живых организмов. В любом живом организме содержатся тысячи белков, выполняющих
разнообразныефункции:
1.
2.
3.
4.
5.
6.
Строительная.
Каталитическая (ферментативная).
Защитная.
Транспортная.
Запасающая (энергетическая).
Сигнальная.
13. Белки выполняют ещё много важных функций: двигательную, сигнальную и т. д.
Они могут превращаться вжиры и углеводы, но те, в свою
очередь, превращаться в белки
не могут. Поэтому белковое
голодание особенно опасно
для живого организма.
14. 5.
 Химические свойства белков. Белки гидролизуются с образованием
Химические свойства белков. Белки гидролизуются с образованиемаминокислот. Это свойство лежит в
Белки денатурируются: при некоторых
воздействиях разрушается структура
белков.
Белки горят, при этом появляется
своеобразный запах жжёного пера.
Для белков характерны цветные
реакции, которые служат
качественными на белки.
English Русский Правила
уровней организации белка
уровень организации белка Уровни организации белков
A 2014 Foundations of Medicine eLAB
Первичная структура белка определяется как аминокислотная последовательность его полипептидной цепи; вторичная структура — локальное пространственное расположение атомов остова (основной цепи) полипептида; третичная структура относится к трехмерной структуре всей полипептидной цепи; а четвертичная структура представляет собой трехмерное расположение субъединиц в мультисубъединичном белке. В этой серии страниц мы исследуем различные уровни организации белка.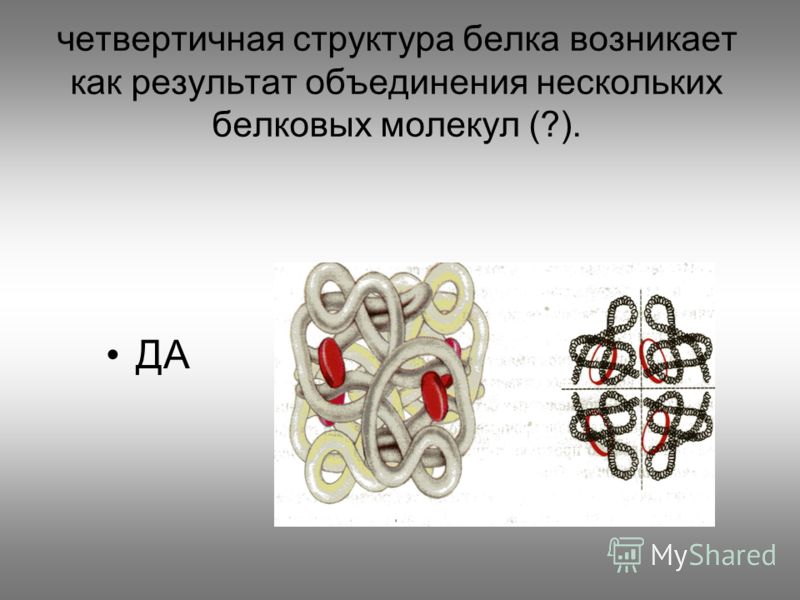
Этот модуль включает ссылки на KiNG (Kinemage, Next Generation), который отображает трехмерные структуры в анимированном интерактивном формате. Эти «кинемажи» (кинетические изображения) можно вращать, перемещать и масштабировать, а части можно скрывать или отображать. Первоначально Kinemages были реализованы под эгидой Фонда инновационных технологий и Белкового общества, а программированием и обслуживанием занимались Дэвид С. Ричардсон и Джейн С. Ричардсон.
Ссылка : «КИНЕМАЖ: ИНСТРУМЕНТ ДЛЯ НАУЧНОЙ КОММУНИКАЦИИ» Д.К. Ричардсон и Дж.С. Richardson (1992) Protein Science 1: 3-9. Также Тенденции в биохимии. науч. (1994) 19: 135-8.
Текст адаптирован из : Demo5_4a. kin
kin
Первичная структура пептида или белка представляет собой линейную последовательность его аминокислот (АА). По соглашению первичная структура белка читается и записывается от амино-конца (N) к карбокси-концу (С). Каждая аминокислота соединена со следующей пептидной связью.
В то время как первичная структура описывает последовательность аминокислот, образующих пептидную цепь, вторичная структура относится к локальному расположению цепи в пространстве. В белках идентифицировано несколько общих вторичных структур. Они будут описаны в следующих разделах и визуализированы с использованием программного обеспечения KiNG, упомянутого ранее.
Чтобы загрузить Java-апплет KiNG, просто нажмите здесь. После загрузки этой страницы Java-апплет KiNG должен появиться автоматически. Если вам нужна информация об использовании King, пожалуйста, наведите курсор сюда.
Альфа-Хеликс
Альфа-спираль – это элемент вторичной структуры, в котором цепь аминокислот расположена по спирали.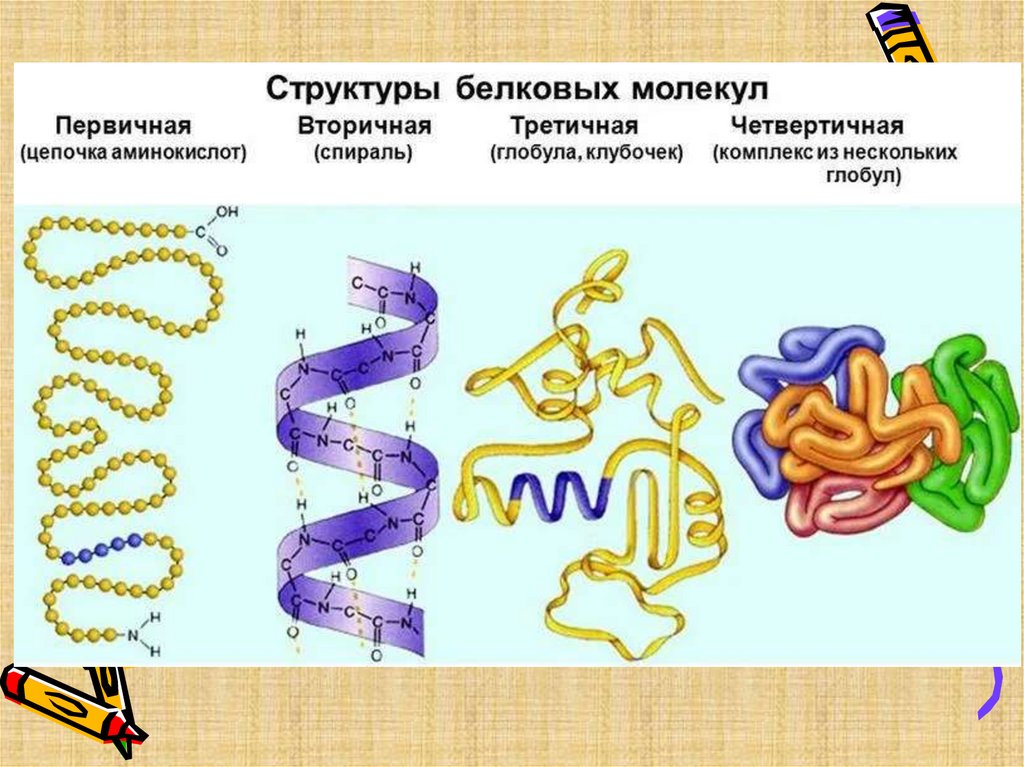 На приведенном выше кинемаже показана отдельная альфа-спираль, если смотреть с N-концевого конца, она напоминает «винтовое колесо» (см. Рисунок ниже). Атомы O и N основной цепи спирали показаны красными и синими шариками соответственно. Нецелое повторение 3,6 остатка на виток альфа-спирали означает, что Cα последовательных витков смещены примерно наполовину, что придает основной цепи характерный вид 7-конечной звезды на виде сбоку. Обратите внимание, что связи Cα-Cβ не направлены радиально от оси спирали, а «вертятся» вдоль линии одного из соседних пептидов, придавая боковым цепям асимметричное начало.
На приведенном выше кинемаже показана отдельная альфа-спираль, если смотреть с N-концевого конца, она напоминает «винтовое колесо» (см. Рисунок ниже). Атомы O и N основной цепи спирали показаны красными и синими шариками соответственно. Нецелое повторение 3,6 остатка на виток альфа-спирали означает, что Cα последовательных витков смещены примерно наполовину, что придает основной цепи характерный вид 7-конечной звезды на виде сбоку. Обратите внимание, что связи Cα-Cβ не направлены радиально от оси спирали, а «вертятся» вдоль линии одного из соседних пептидов, придавая боковым цепям асимметричное начало.
Гидрофобные боковые цепи показаны зеленым цветом, полярные – небесно-голубым, а заряженные – красным. Их можно включить, установив флажок «side ch». Теперь ВКЛЮЧИТЕ и ВЫКЛЮЧИТЕ различные группы и наборы дисплеев, нажав соответствующую кнопку.
Когда вы включали различные типы сайдчейнов, что вы наблюдали? Вы заметили, что у спирали одна сторона преимущественно с полярными остатками, а другая с преимущественно гидрофобными остатками? Это типичная глобулярно-белковая спираль; в его нативной конфигурации полярные остатки будут обращены к растворителю, а гидрофобные остатки будут обращены внутрь белка.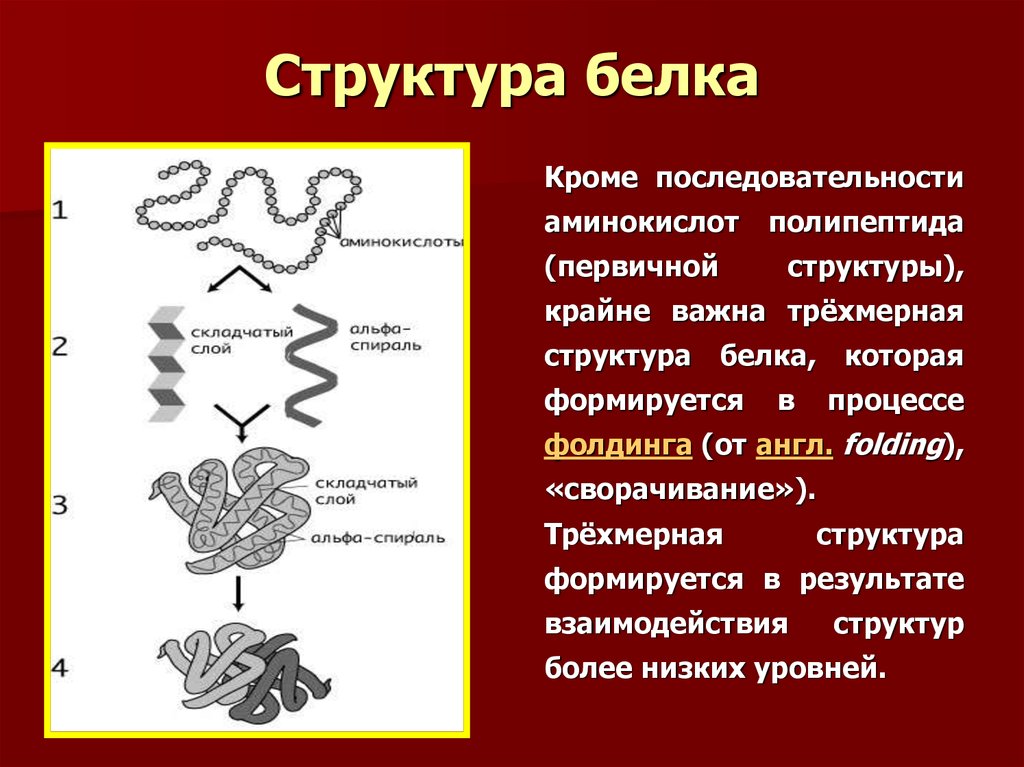 В меню просмотра в KiNG выберите View2 или View3, чтобы увидеть больше структуры.
В меню просмотра в KiNG выберите View2 или View3, чтобы увидеть больше структуры.
На рисунке слева показано изображение аминокислотной последовательности в виде спирального колеса, если смотреть вниз по оси альфа-спирали, перпендикулярной странице. Аминокислотные остатки пронумерованы от ближайшего к наиболее удаленному и расположены в виде идеальной альфа-спирали с 3,6 остатками на полный оборот. Этот рисунок представляет собой снимок Java-апплета, написанного Эдвардом К. О’Нилом и Чарльзом М. Гришамом (Университет Вирджинии в Шарлоттсвилле, штат Вирджиния).
В KiNG выберите View4 для крупного плана сбоку, где спиральные водородные связи (H-связи) выделены коричневым цветом. Включите «Hbonds» на панели кнопок, чтобы увидеть H-связи в коричневом цвете. Нажмите на атомы основной цепи на любом конце одной из Н-связей, чтобы убедиться, что альфа-спиральная модель Н-связи действительно идет от донора NH в остатке i к акцептору O в остатке i-4 (как показано на рисунке). рисунок справа).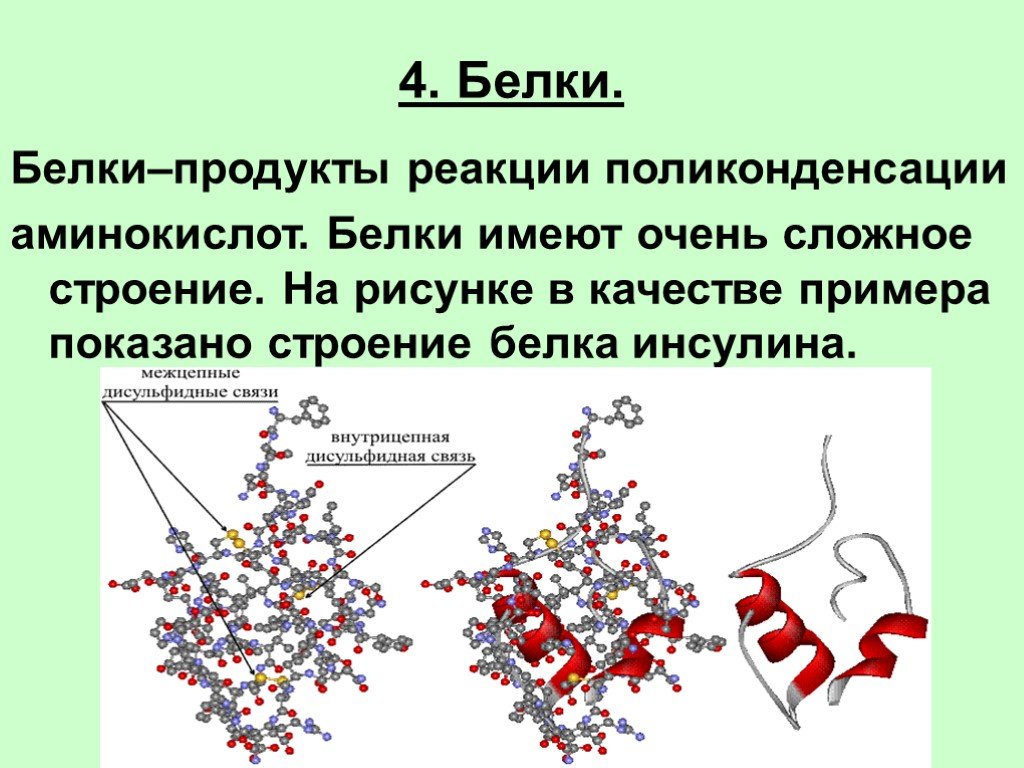 Проверьте, имеет ли эта альфа-спираль 3,6 остатка на виток. Если бы вы были уверены, подъем на полный оборот составляет 5,4 ангстрема (Â).
Проверьте, имеет ли эта альфа-спираль 3,6 остатка на виток. Если бы вы были уверены, подъем на полный оборот составляет 5,4 ангстрема (Â).
правосторонние. Чтобы увидеть, что это правша, держите правую руку так, чтобы большой палец был направлен вверх, а пальцы были свободно согнуты; стараясь соответствовать спирали спирали, медленно двигайтесь в направлении, указанном большим пальцем, и сгибайтесь вдоль линии пальцев, как бы затягивая винт. Когда это движение соответствует спирали позвоночника, если оно выполняется правой рукой, тогда спираль правосторонняя.
Чтобы измерить углы φ,psi для примера спирали KiNG, включите «Измерить угол и двугранный угол» в раскрывающемся меню «Инструменты». Начните с щелчка по карбонильному атому C вверху, затем по следующему N, затем по Cα и снова по C; в этой точке информационная линия покажет двугранный угол, который является углом фи центральной связи N-Cα этих 4 атомов. Для правосторонней альфа-спирали она должна находиться в диапазоне от -50 до -80 градусов.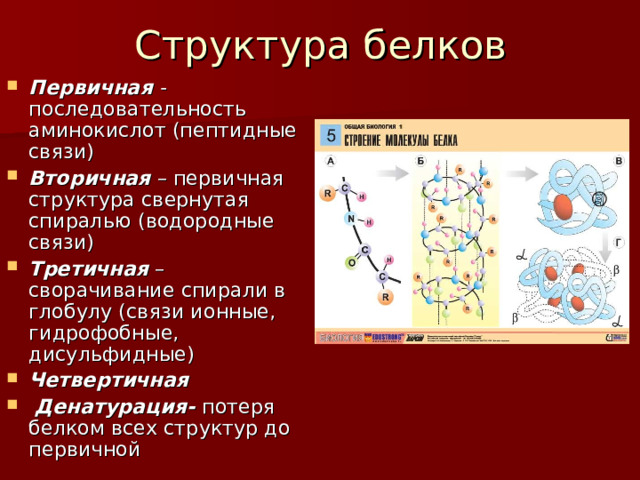
Таким образом, идеальная альфа-спираль обладает следующими свойствами:
- Делает один оборот каждые 3,6 остатка;
- Поднимается примерно на 5,4 Â с каждым оборотом;
- Это правосторонняя спираль;
- Он удерживается вместе водородными связями между C=O остатка i и NH остатка i+4;
- Обычно слегка изогнут.
Некоторые общие свойства альфа-спиралей:
- Средняя длина альфа-спирали составляет 10 остатков (15 Â), хотя в стандартном глобулярном белке длина альфа-спирали может варьироваться от 4 до 40 остатков.
- Все остатки, участвующие в альфа-спирали, имеют одинаковые углы (phi,psi). Эти углы, равные примерно -60 и -50, взяты из нижнего левого квадранта графика Рамачандрана.

- Некоторые аминокислоты предпочтительно расположены в альфа-спирали. Остатки, такие как Ala, Glu, Leu и Met, имеют высокую склонность к участию в спирали, в то время как остатки, такие как Pro и Gly, имеют небольшую такую тенденцию. Особый интерес представляет пролин, который не может вписаться в спираль и создает изгиб.
- Спираль имеет общий дипольный момент, который представляет собой векторную сумму выровненных дипольных моментов отдельных пептидных связей. Положительный полюс находится на N-конце, а отрицательный полюс — на С-конце. Иногда этот диполь играет функциональную роль.
Некоторый текст адаптирован из : Kinemage Supplement к Branden & Tooze «Введение в структуру белка», глава 2 — МОТИВЫ СТРУКТУРЫ БЕЛКА Джейн С. и Дэвида С. Ричардсона.
Бета-цепь представляет собой элемент вторичной структуры, в котором белковая цепь почти линейна. Соседние бета-нити могут образовывать водородные связи с образованием бета-листа (также называемого бета-складчатым листом). Участвующие бета-цепи не являются непрерывными в первичной последовательности и даже не должны быть близки друг к другу в последовательности, т.е. нити, образующие бета-лист, могут быть разделены в первичной структуре длинными последовательностями аминокислот, не входящих в состав листа. Примерно четверть всех остатков в типичном белке находится в бета-цепях, хотя это сильно различается между белками
Участвующие бета-цепи не являются непрерывными в первичной последовательности и даже не должны быть близки друг к другу в последовательности, т.е. нити, образующие бета-лист, могут быть разделены в первичной структуре длинными последовательностями аминокислот, не входящих в состав листа. Примерно четверть всех остатков в типичном белке находится в бета-цепях, хотя это сильно различается между белками
Чтобы просмотреть бета-лист в Java-апплете KiNG, нажмите здесь. Kinemage 1 показывает 6-цепочечный параллельный бета-лист из домена 1 лактатдегидрогеназы (файл 1LDM). Этот параллельный бета-лист с двойной обмоткой является наиболее распространенным паттерном складывания, встречающимся в известных белковых структурах. Эта «складка» также известна как «домен связывания нуклеотидов», потому что большинство примеров связывают мононуклеотид (например, FMN) или динуклеотид (например, NAD) около середины одного конца бета-листа. Лактатдегидрогеназа является классическим, первым обнаруженным примером структуры этого типа и имеет наиболее часто наблюдаемую топологию бета-соединений.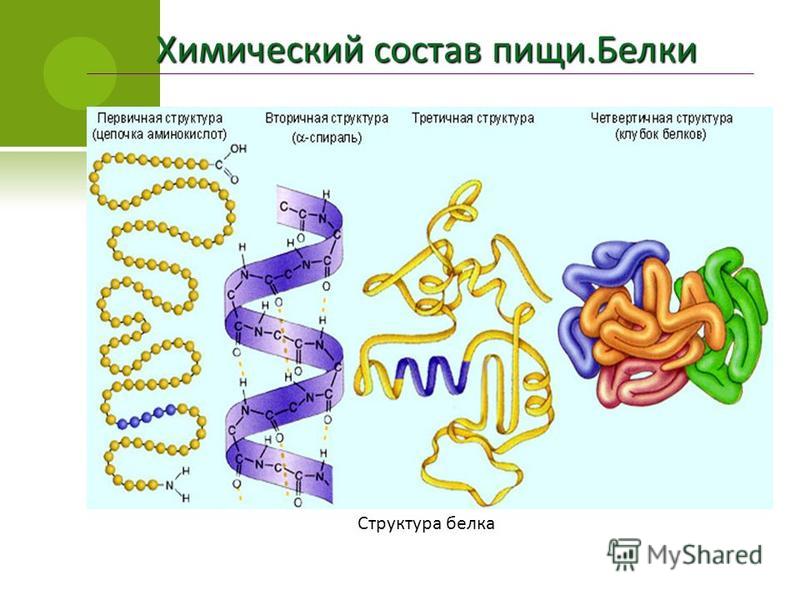
Обратите внимание, что водородные связи в этом параллельном слое наклонены в разных направлениях, а не перпендикулярно нитям, как мы увидим в антипараллельных слоях. Перетащите вправо или влево, чтобы лучше увидеть, что лист в целом скручивается. Этот поворот обычно описывается поворотом в ориентации плоскостей пептида (или плоскости Н-связи) по мере продвижения по цепи; по этому определению скручивание бета-листа всегда правостороннее, хотя и в разной степени. Щелкайте по атомам вдоль нити, чтобы узнать ее направление по остаточным числам, и убедитесь, что все шесть нитей действительно параллельны. Метки нитей показывают порядок последовательности нитей. Обратите внимание, что большинство последовательных пар расположены рядом друг с другом, и что цепочка начинается в середине, движется к одному краю, возвращается к середине и затем перемещается к другому краю. Есть три возможных способа сформировать бета-лист из бета-цепи, обсуждаемые ниже.
Типы бета-листов, наблюдаемые в белках
1) Параллельный бета-лист.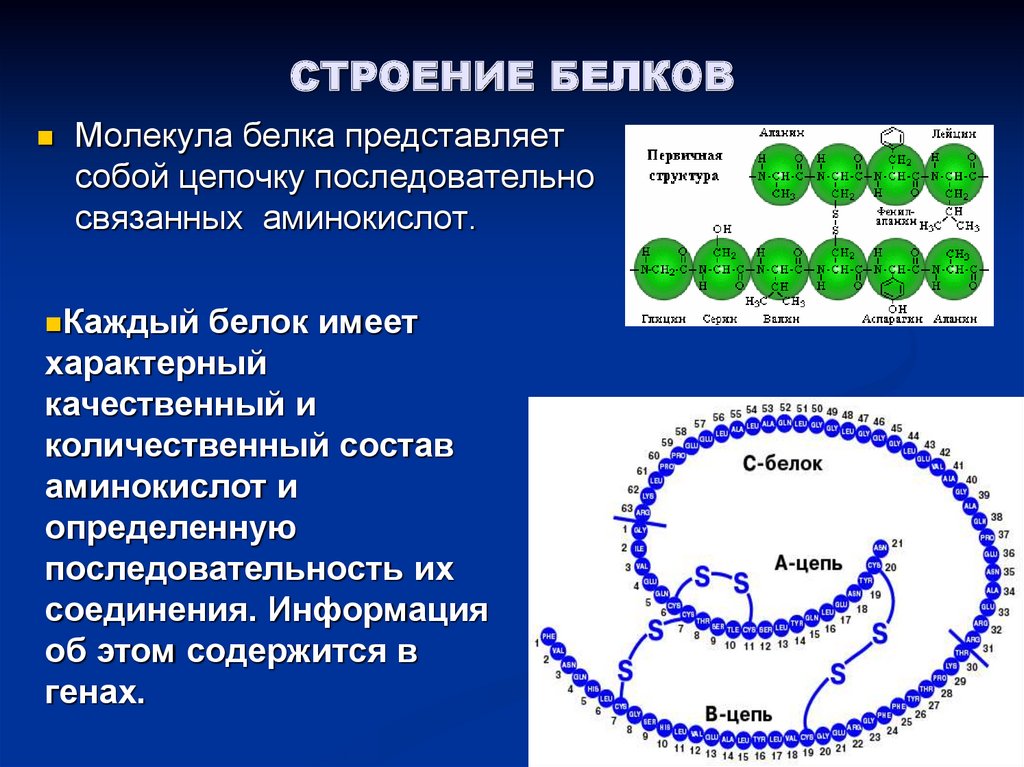 Все скрепленные нити имеют одинаковое направление от N к C. В результате они должны быть разделены длинными участками последовательности. Водородные связи равноудаленные.
Все скрепленные нити имеют одинаковое направление от N к C. В результате они должны быть разделены длинными участками последовательности. Водородные связи равноудаленные.
На рисунке слева показан трехцепочечный параллельный бета-лист из белка тиоредоксина. Три параллельные нити показаны как в мультяшном формате (слева), так и в виде палочек, содержащих атомы основной цепи N, CA, C и O’ (справа). Водородные связи обозначены стрелками, соединяющими донорный азот и акцепторный кислород. Нити нумеруются в соответствии с их относительным положением в полипептидной последовательности.
2) Антипараллельный бета-лист. Бета-цепи проходят в чередующихся направлениях и, следовательно, могут быть довольно близки к первичной последовательности. Расстояние между последовательными водородными связями то короче, то длиннее.
На рисунке справа показан трехцепочечный антипараллельный бета-лист тиоредоксина. Три антипараллельные нити показаны как в мультяшном формате (слева), так и в виде палочек, содержащих атомы основной цепи N, CA, C и O’ (справа). Водородные связи обозначены стрелками, соединяющими донорный азот и акцепторный кислород. Нити нумеруются в соответствии с их относительным положением в полипептидной последовательности.
Водородные связи обозначены стрелками, соединяющими донорный азот и акцепторный кислород. Нити нумеруются в соответствии с их относительным положением в полипептидной последовательности.
3) Смешанный бета-лист — смесь параллельных и антипараллельных водородных связей. Около 20% всех бета-листов являются смешанными.
Образцы водородных связей в смешанном бета-листе (рисунок слева). Здесь схематично изображен четырехнитевой бета-лист, содержащий три антипараллельные нити и одну параллельную. Водородные связи между антипараллельными нитями показаны красными линиями, между параллельными нитями — зелеными.
Некоторые из основных особенностей бета-листов включают в себя:
- Удлиненная конформация бета-цепи составляет около 3,5 Â на остаток, а длина бета-цепи может достигать 35 Â.
- Общая геометрия листа не плоская, а складчатая, с чередованием атомов углерода Cα выше и ниже средней плоскости листа.
- Из-за хиральности аминокислот (L-аминокислоты) все бета-цепи имеют правый поворот, тогда как бета-лист имеет в целом левый поворот.

- Поскольку нити не обязательно должны быть соседними в последовательности, существует множество возможных способов расположения нитей на листе, такие расположения называются топологиями и могут быть довольно сложными.
Включите боковые цепи в KiNG, чтобы проверить их расположение. Вдоль данной нити боковые цепи чередуются между одной стороной листа (золото) и другой (море или небо). На соседних нитях чередование совпадающее, так что боковые цепи образуют ряды, находящиеся в достаточно тесном контакте. На параллельном бета-листе геометрия такова, что боковые цепи с разветвленными бета-углеродами (Val, Ile или Thr) довольно благоприятно контактируют вдоль ряда; поскольку эти положения обычно скрыты и гидрофобны, в результате Val и Ile являются доминирующими остатками, обнаруживаемыми в этих положениях. Краевые нити или самые концы данной нити могут подвергаться воздействию растворителя и часто имеют значительно более гидрофильные остатки (как, например, в ряду 0 здесь или Ser на нити 3).
Некоторый текст адаптирован из : «The Protein Tourist: ДВОЙНАЯ ПАРАЛЛЕЛЬНЫЕ АЛЬФА/БЕТА-БЕЛКИ, ИЛИ НУКЛЕОТИД-СВЯЗЫВАЮЩИЕ ДОМЕНЫ» Дж.С. Ричардсон и Д. К. Ричардсон.
Бета-поворот
Повороты обычно возникают, когда белковой цепи необходимо изменить направление, чтобы соединить два других элемента вторичной структуры. Наиболее распространенным является бета-поворот, при котором изменение направления выполняется в пространстве четырех остатков. Некоторыми часто наблюдаемыми особенностями бета-поворотов являются водородная связь между C=O остатка i и NH остатка i+3 (т. е. между первым и четвертым остатком поворота) и сильная тенденция к вовлечению глицина и / или пролин. Иногда вы будете слышать фразу «бета-шпилька», которую можно использовать для описания бета-поворота, соединяющего вместе две антипараллельные бета-нити. Бета-повороты подразделяются на многочисленные типы на основе деталей их геометрии.
Гамма-повороты представляют собой повороты с тремя остатками, которые часто включают водородную связь между C=O остатка i и NH остатка i+2.
Случайная катушка
Некоторые участки белковой цепи не образуют регулярной вторичной структуры и не характеризуются какой-либо регулярной структурой водородных связей. Эти области известны как случайные клубки и находятся в двух местах в белках:
- Концевые плечи — как на N-конце, так и на С-конце белка;
- Петли. Петли представляют собой неструктурированные области, находящиеся между обычными элементами вторичной структуры.
Случайные катушки могут иметь длину от 4 до 20 остатков, хотя длина большинства петель не превышает 12 остатков. Большинство петель подвергаются воздействию растворителя и имеют полярные или заряженные боковые цепи. В некоторых случаях петли играют функциональную роль, но во многих случаях их нет. В результате области петель часто плохо сохраняются (т.е. более склонны к изменениям) в процессе эволюции.
Некоторый текст адаптирован из : «УПРАЖНЕНИЕ 3. ВТОРИЧНЫЕ СТРУКТУРЫ БЕЛКА» Ким М. Гернерт и Ким М. Китцлер.
Гернерт и Ким М. Китцлер.
Как мы узнали, порядок аминокислот является первичной структурой, и все остатки в полипептидной цепи имеют одинаковые атомы основной цепи. Что различается, так это боковые цепи (группы R). Определяют ли присутствующие специфические AA вторичную структуру? Как показано на рисунке, все аминокислоты можно найти во всех элементах вторичной структуры, но некоторые более или менее распространены в определенных элементах. Pro и Gly, например, не очень хороши для спиралей, но лучше подходят для бета-поворотов. Если мы сделаем еще один шаг и спросим, определяют ли комбинации 2, 3 или 4 аминокислот вторичную структуру, мы обнаружим более сильную корреляцию, но все же недостаточно сильную, чтобы надежно предсказать третичную структуру.
Белки имеются в изобилии во всех организмах и являются основой жизни. Разнообразие структуры белков лежит в основе очень большого спектра их функций: ферменты (биологические катализаторы), запасающие, транспортные, мессенджеры, антитела, регуляторные и структурные белки.
Белки представляют собой линейные гетерополимеры фиксированной длины; то есть один тип белка всегда имеет одинаковое количество и состав АК, но разные белки могут иметь от 100 до более 1000 АК. Следовательно, существует большое разнообразие возможных белковых последовательностей. Линейные цепи сворачиваются в специфические трехмерные конформации, которые определяются последовательностью аминокислот и поэтому также чрезвычайно разнообразны — от полностью волокнистых до глобулярных. Ковалентные дисульфидные связи могут быть введены между цистеиновыми остатками, расположенными в непосредственной близости в трехмерном пространстве, что обеспечивает жесткость полученной трехмерной структуры. Ленточные диаграммы, подобные показанной здесь, являются распространенным способом визуализации белков.
Белковые структуры могут быть определены на атомном уровне с помощью рентгеновской дифракции и нейтронной дифракции кристаллизованных белков, а в последнее время — с помощью спектроскопии ядерного магнитного резонанса (ЯМР) белков в растворе. Однако структура многих белков остается неясной.
Однако структура многих белков остается неясной.
Чтобы просмотреть пример третичной структуры в KiNG, нажмите здесь. Это рибонуклеаза А, фермент, ответственный за расщепление РНК. На изображении изображены все атомы одной половины молекулы (голубой для боковых цепей, коричневый для атомов водорода) и только основная цепь и боковые цепи для другой половины. Альтернативный вид показывает атомы основной цепи и Н-связи (фиолетовые). Нажмите «Анимировать», чтобы переключаться между представлениями.
Хотя водороды составляют около половины атомов в белке, они редко проявляются явно, потому что их трудно обнаружить с помощью рентгеновской кристаллографии (из-за низкой электронной плотности) и они очень усложняют картину. Это изображение рибонуклеазы представляет собой совместную структуру рентгеновской и нейтронной дифракции, в которую всегда включены атомы водорода. Даже без атомов H просмотр всех атомов слишком переполнен, чтобы быть очень полезным, но это хороший способ оценить, с чего начинаются упрощенные версии.
Некоторый текст адаптирован из : Приложение Kinemage к Branden & Tooze «Введение в структуру белка», глава 2 — МОТИВЫ СТРУКТУРЫ БЕЛКА, Джейн С. и Дэвид С. Ричардсон.
Сворачивание белка — это физический процесс, при котором линейный полипептид сворачивается в свою характерную и функциональную трехмерную структуру. Сворачивание полипептидной цепи сильно зависит от растворимости R-групп AA в воде. Каждый белок существует в виде развернутого полипептида или случайного клубка при трансляции последовательности мРНК в линейную цепь аминокислот. У этого полипептида отсутствует какая-либо стабильная (длительная) трехмерная структура (левая часть соседнего рисунка). Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Таким образом, вся информация о нативной складке, по-видимому, содержится в первичной структуре (Анфинсен получил за это Нобелевскую премию), а белки являются самосворачивающимися (хотя in vivo , укладке полипептида часто помогают дополнительные молекулы, известные как молекулярные шапероны).
Минимизация количества гидрофобных боковых цепей, подвергающихся воздействию воды (гидрофобный эффект), является важной движущей силой процесса складывания. Внутримолекулярные водородные связи также способствуют стабильности белка (вспомните об их важности во вторичных структурах). Ионные взаимодействия (притяжение между разноименными электрическими зарядами ионизированных R-групп) также способствуют устойчивости третичных структур. Дисульфидные мостики (ковалентные связи) между соседними остатками цистеина также могут стабилизировать трехмерные структуры. Обратите внимание, что дисульфидные связи редко наблюдаются во внутриклеточных белках из-за восстановительной внутриклеточной среды.
Правильная трехмерная структура белка необходима для его функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми. Неспособность свернуться в нативную структуру обычно приводит к неактивным белкам, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсическую функциональность (например, прионы и амилоидные фибриллы).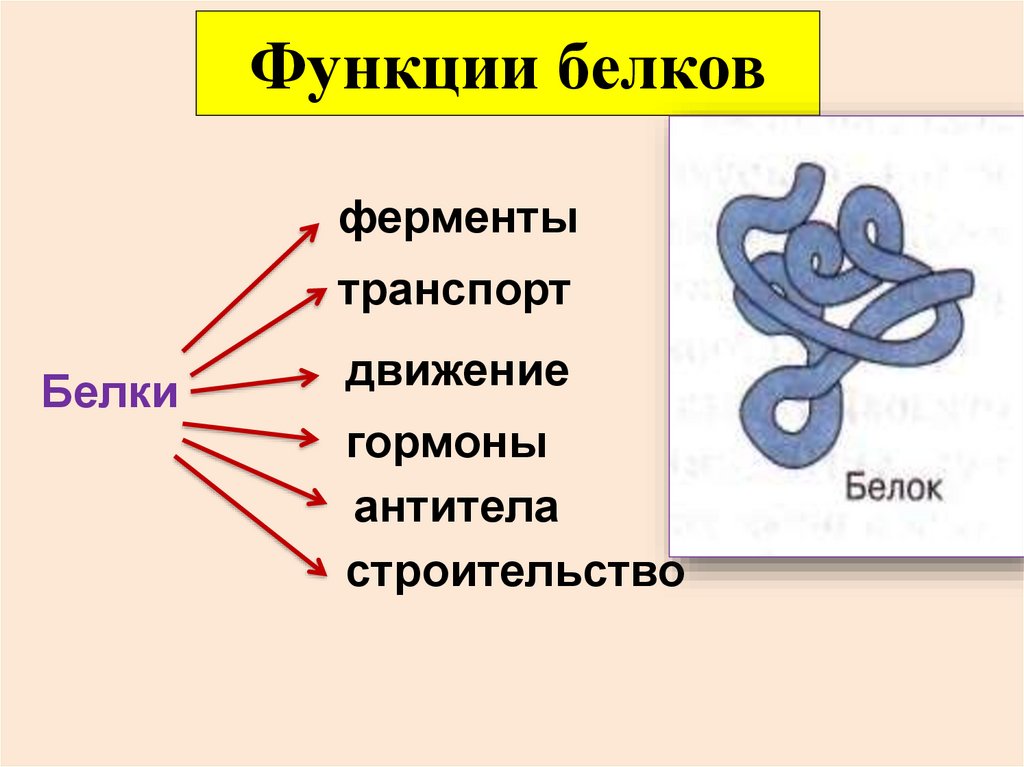 В соответствии с их функциональной важностью трехмерные структуры белков более консервативны во время эволюции, чем первичные аминокислотные последовательности.
В соответствии с их функциональной важностью трехмерные структуры белков более консервативны во время эволюции, чем первичные аминокислотные последовательности.
Для тех, кто хочет внести свой вклад в науку, играя в игры, я предлагаю вам попробовать FoldIt. Недавно участники этой игры смогли правильно предсказать структуру ретровирусной протеазы. Для тех, кто хочет, чтобы их свободные циклы ЦП использовались с пользой, я предлагаю вам проверить Folding@home.
Четвертичная структура в белках представляет собой наиболее сложную степень организации, которая до сих пор считается отдельной молекулой. Чтобы считаться имеющим четвертичную структуру, белок должен иметь две или более пептидных цепей, образующих субъединицы. Субъединицы могут быть разными или одинаковыми и в большинстве случаев расположены симметрично. Обычно белок с двумя субъединицами называется димером; один с тремя субъединицами в тримере; и один с четырьмя субъединицами тетрамера.
Изменения в четвертичной структуре могут происходить за счет конформационных изменений внутри отдельных субъединиц или за счет переориентации субъединиц относительно друг друга. Именно благодаря таким изменениям, лежащим в основе кооперативности и аллостерии в «мультимерных» ферментах, многие белки подвергаются регуляции и выполняют свою физиологическую функцию. Хорошим примером может служить ДНК-полимераза (см. изображение) и ионные каналы. Субъединицы удерживаются вместе теми же типами взаимодействий, которые стабилизируют третичную структуру белков.
Именно благодаря таким изменениям, лежащим в основе кооперативности и аллостерии в «мультимерных» ферментах, многие белки подвергаются регуляции и выполняют свою физиологическую функцию. Хорошим примером может служить ДНК-полимераза (см. изображение) и ионные каналы. Субъединицы удерживаются вместе теми же типами взаимодействий, которые стабилизируют третичную структуру белков.
Ведутся споры о том, следует ли определять четвертичную структуру как включающую пептиды, связанные ковалентными (дисульфидными) связями. В CMB мы будем использовать четвертичную структуру для обозначения только расположения субъединиц, которые не связаны ковалентно, хотя внутри отдельных субъединиц могут возникать ковалентные дисульфидные связи.
Глава 9 — Белки и ферменты — CHE 120 — Введение в органическую химию — Учебник
9.1 Белки
Цели обучения
- Описать четыре уровня структуры белка.
- Определите типы взаимодействий притяжения, которые удерживают белки в их наиболее стабильной трехмерной структуре.

- Объясните, что происходит при денатурации белков.
- Определите, как можно денатурировать белок.
Каждый из тысяч встречающихся в природе белков имеет свой характерный аминокислотный состав и последовательность, что приводит к уникальной трехмерной форме. С 19В 50-х годах ученые определили аминокислотные последовательности и трехмерную структуру множества белков и, таким образом, получили важные сведения о том, как каждый белок выполняет свою специфическую функцию в организме.
Белки представляют собой соединения с высокой молекулярной массой, состоящие в основном или полностью из цепочек аминокислот. Из-за их большой сложности белковые молекулы не могут быть классифицированы на основе определенного структурного сходства, как классифицируются углеводы и липиды. Две основные структурные классификации белков основаны на гораздо более общих характеристиках: является ли белок (1) нитевидным и нерастворимым или (2) глобулярным и растворимым. Некоторые белки, например те, из которых состоят волосы, кожа, мышцы и соединительная ткань, подобны волокнам.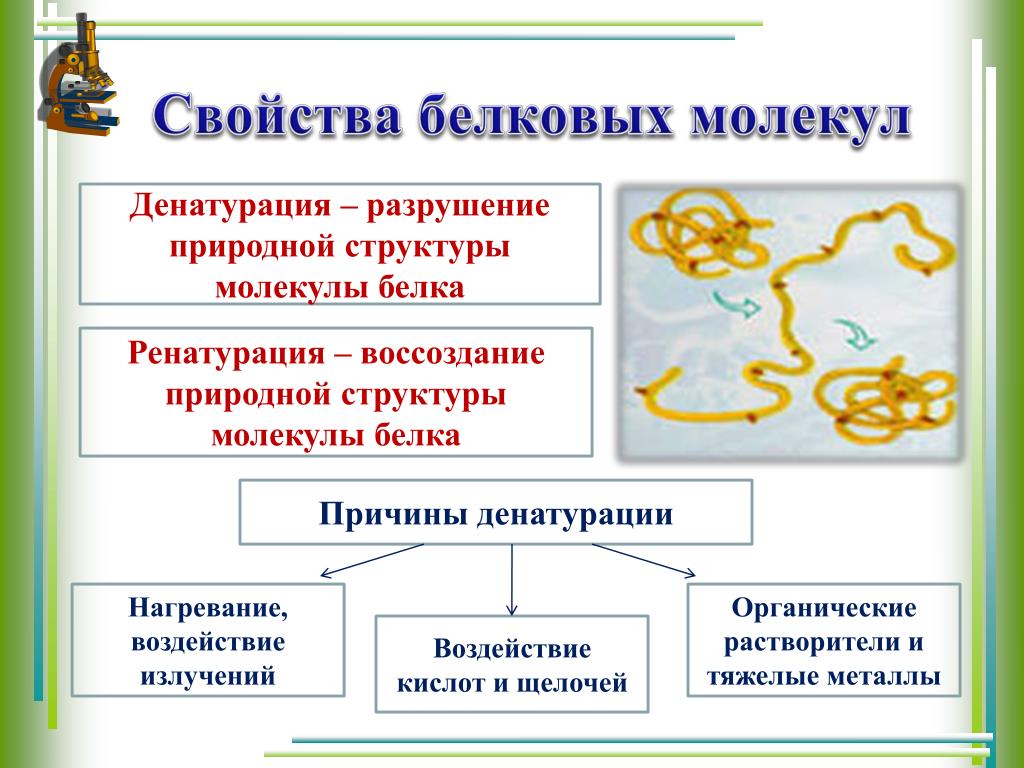 Эти волокнистые белки нерастворимы в воде и обычно выполняют структурную, соединительную и защитную функции. Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина. Соединительные ткани содержат коллаген. Миозины являются мышечными белками и способны сокращаться и растягиваться. Эластины находятся в связках и эластичной ткани стенок артерий.
Эти волокнистые белки нерастворимы в воде и обычно выполняют структурную, соединительную и защитную функции. Примерами волокнистых белков являются кератины, коллагены, миозины и эластины. Волосы и внешний слой кожи состоят из кератина. Соединительные ткани содержат коллаген. Миозины являются мышечными белками и способны сокращаться и растягиваться. Эластины находятся в связках и эластичной ткани стенок артерий.
Глобулярные белки , другой основной класс, растворимы в водной среде. В этих белках цепи свернуты так, что молекула в целом имеет примерно сферическую форму. Знакомые примеры включают яичный альбумин из яичных белков и сывороточный альбумин в крови. Сывороточный альбумин играет важную роль в транспортировке жирных кислот и поддержании надлежащего баланса осмотического давления в организме. Гемоглобин и миоглобин, важные для связывания кислорода, также являются глобулярными белками.
Уровни структуры белков
Структура белков обычно описывается как имеющая четыре организационных уровня. Первой из них является первичная структура , которая представляет собой количество и последовательность аминокислот в полипептидной цепи или цепях белка, начиная со свободной аминогруппы и поддерживаемой пептидными связями, соединяющими каждую аминокислоту с последующей. Первичная структура инсулина, состоящая из 51 аминокислоты, показана на рисунке 9.1 «Первичная структура человеческого инсулина».
Первой из них является первичная структура , которая представляет собой количество и последовательность аминокислот в полипептидной цепи или цепях белка, начиная со свободной аминогруппы и поддерживаемой пептидными связями, соединяющими каждую аминокислоту с последующей. Первичная структура инсулина, состоящая из 51 аминокислоты, показана на рисунке 9.1 «Первичная структура человеческого инсулина».
Рисунок 9.1 Первичная структура человеческого инсулина
Человеческий инсулин, аминокислотная последовательность которого показана здесь, представляет собой гормон, необходимый для правильного метаболизма глюкозы.
Белковая молекула – это не случайный клубок полипептидных цепей. Вместо этого цепи расположены в уникальных, но специфических конформациях. Термин вторичной структуры относится к фиксированному расположению полипептидного остова. На основе рентгеновских исследований Лайнус Полинг и Роберт Кори предположили, что определенные белки или их части закручиваются в спираль или спираль. Эта спираль стабилизирована внутрицепочечная водородная связь между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты выше по цепи (расположена на следующем витке спирали) и известна как правая α-спираль. Рентгеновские данные показывают, что эта спираль делает один виток на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из закрученного остова (рис. 9.2 «Шаро-стержневая модель α-спирали»). α-кератины, обнаруженные в волосах и шерсти, имеют исключительно α-спиральную конформацию. Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, практически не имеют спиральной структуры. Другие, такие как гемоглобин и миоглобин, имеют спиральную форму в одних областях, но не в других.
Эта спираль стабилизирована внутрицепочечная водородная связь между карбонильным атомом кислорода одной аминокислоты и амидным атомом водорода на четыре аминокислоты выше по цепи (расположена на следующем витке спирали) и известна как правая α-спираль. Рентгеновские данные показывают, что эта спираль делает один виток на каждые 3,6 аминокислоты, а боковые цепи этих аминокислот выступают наружу из закрученного остова (рис. 9.2 «Шаро-стержневая модель α-спирали»). α-кератины, обнаруженные в волосах и шерсти, имеют исключительно α-спиральную конформацию. Некоторые белки, такие как гамма-глобулин, химотрипсин и цитохром с, практически не имеют спиральной структуры. Другие, такие как гемоглобин и миоглобин, имеют спиральную форму в одних областях, но не в других.
Рис. 9.2 Шаростержневая модель α-спирали
Эта шаростержневая модель показывает внутрицепочечную водородную связь между карбонильными атомами кислорода и амидными атомами водорода. Каждый виток спирали охватывает 3,6 аминокислоты.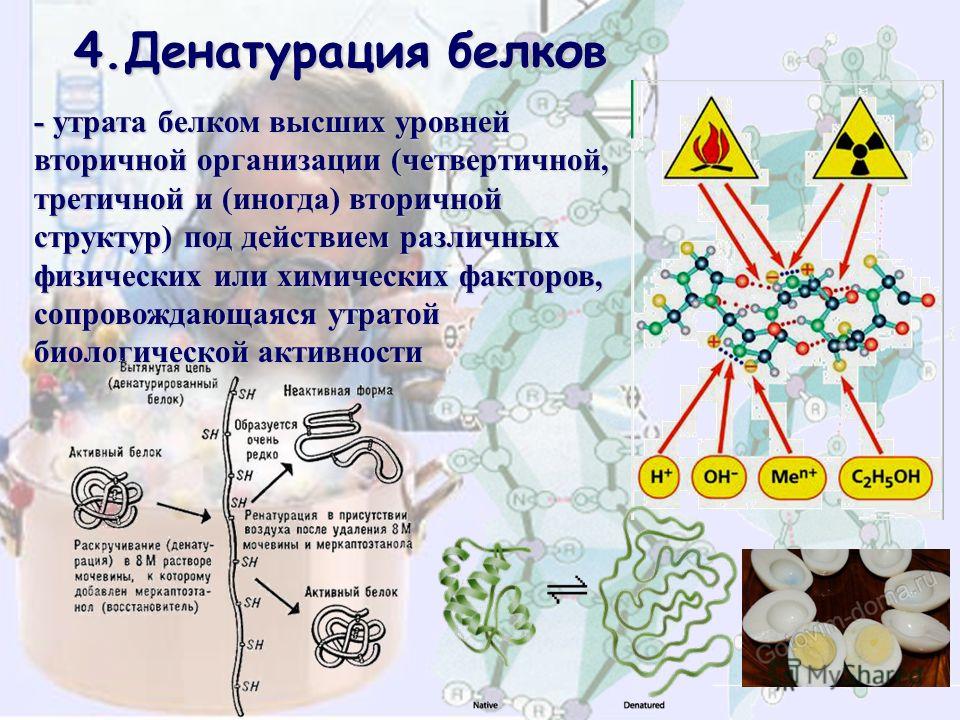 Обратите внимание, что боковые цепи (представленные зелеными сферами) направлены от спирали.
Обратите внимание, что боковые цепи (представленные зелеными сферами) направлены от спирали.
Другой распространенный тип вторичной структуры, называемый конформацией β-складчатого листа , представляет собой листообразную структуру, в которой две или более вытянутых полипептидных цепей (или отдельные участки одной цепи) выровнены бок о бок. Выровненные сегменты могут идти параллельно или антипараллельно, то есть N-концы могут быть обращены в одном и том же направлении на соседних цепях или в разных направлениях, и соединены межцепочечная водородная связь (рис. 9.3 «Шаровая модель β-складчатой листовой структуры в белках»). β-складчатый лист особенно важен для структурных белков, таких как фиброин шелка. Он также наблюдается в частях многих ферментов, таких как карбоксипептидаза А и лизоцим.
Рисунок 9.3 Шаровидная модель структуры β-складчатого листа в белках
Боковые цепи простираются выше или ниже листа и чередуются вдоль цепи. Белковые цепи удерживаются вместе за счет межцепочечных водородных связей.
Третичная структура относится к уникальной трехмерной форме белка в целом, которая является результатом складывания и изгиба остова белка. Третичная структура тесно связана с правильным биохимическим функционированием белка. На рис. 9.4 «Лента-модель трехмерной структуры инсулина» показано изображение трехмерной структуры инсулина.
Рис. 9.4 Ленточная модель трехмерной структуры инсулина
Спиральные участки представляют участки полипептидной цепи, имеющие α-спиральную структуру, а широкие стрелки представляют собой β-складчатые пластинчатые структуры.
Четыре основных типа взаимодействий притяжения определяют форму и стабильность третичной структуры белков.
1. Ионная связь . Ионные связи возникают в результате электростатического притяжения между положительно и отрицательно заряженными боковыми цепями аминокислот. Например, взаимное притяжение между ионом карбоксилата аспарагиновой кислоты и ионом аммония лизина помогает поддерживать определенную складчатую область белка (часть (а) на рис. 9)..5 «Взаимодействия третичной структуры белка»).
9)..5 «Взаимодействия третичной структуры белка»).
2. Водородное соединение . Водородная связь образуется между сильно электроотрицательным атомом кислорода или атомом азота и атомом водорода, присоединенным к другому атому кислорода или атому азота, например, в боковых цепях полярных аминокислот. Водородные связи (а также ионные притяжения) чрезвычайно важны как для внутримолекулярных, так и для межмолекулярных взаимодействий белков (часть (b) рис. 9.5 «Взаимодействия третичной структуры белка»).
3. Дисульфидные связи . Две аминокислотные единицы цистеина могут сближаться по мере того, как молекула белка складывается. Последующее окисление и соединение атомов серы в высокореакционноспособных сульфгидрильных (SH) группах приводит к образованию цистина (часть (c) рисунка 9.5 «Взаимодействия третичной структуры белка»). Внутрицепочечные дисульфидные связи обнаружены во многих белках, включая инсулин (желтые столбцы на рис. 9.1 «Первичная структура инсулина человека»), и оказывают сильное стабилизирующее действие на третичную структуру.
4. Силы рассеивания . Дисперсионные силы возникают, когда обычно неполярный атом становится на мгновение полярным из-за неравномерного распределения электронов, что приводит к мгновенному диполю, который вызывает сдвиг электронов в соседнем неполярном атоме. Дисперсионные силы слабы, но могут быть важны, когда другие типы взаимодействий либо отсутствуют, либо минимальны (часть (d) рис. 9.5 «Взаимодействия третичной структуры белка»). Так обстоит дело с фиброином, основным белком шелка, в котором значительная доля аминокислот в белке имеет неполярные боковые цепи. Срок гидрофобное взаимодействие часто ошибочно используют как синоним дисперсионных сил. Гидрофобные взаимодействия возникают из-за того, что молекулы воды вступают в водородные связи с другими молекулами воды (или группами белков, способными образовывать водородные связи). Поскольку неполярные группы не могут образовывать водородные связи, белок сворачивается таким образом, что эти группы погребены во внутренней части белковой структуры, сводя к минимуму их контакт с водой.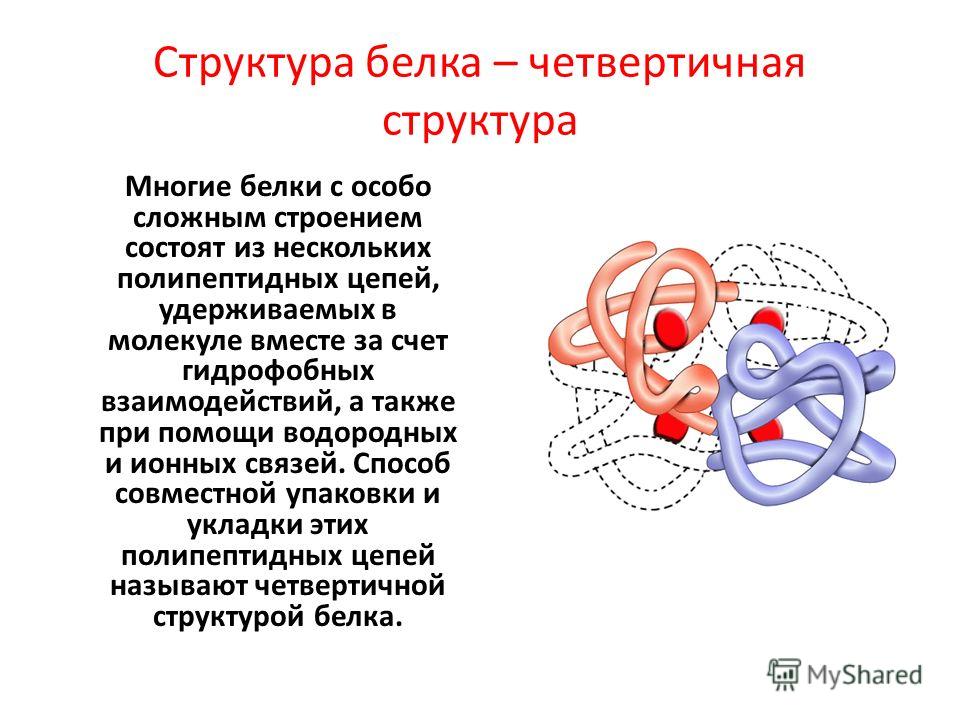
Рисунок 9.5 Взаимодействия третичной структуры белка
Четыре взаимодействия стабилизируют третичную структуру белка: (а) ионная связь, (б) водородная связь, (в) дисульфидные связи и (г) дисперсионные силы.
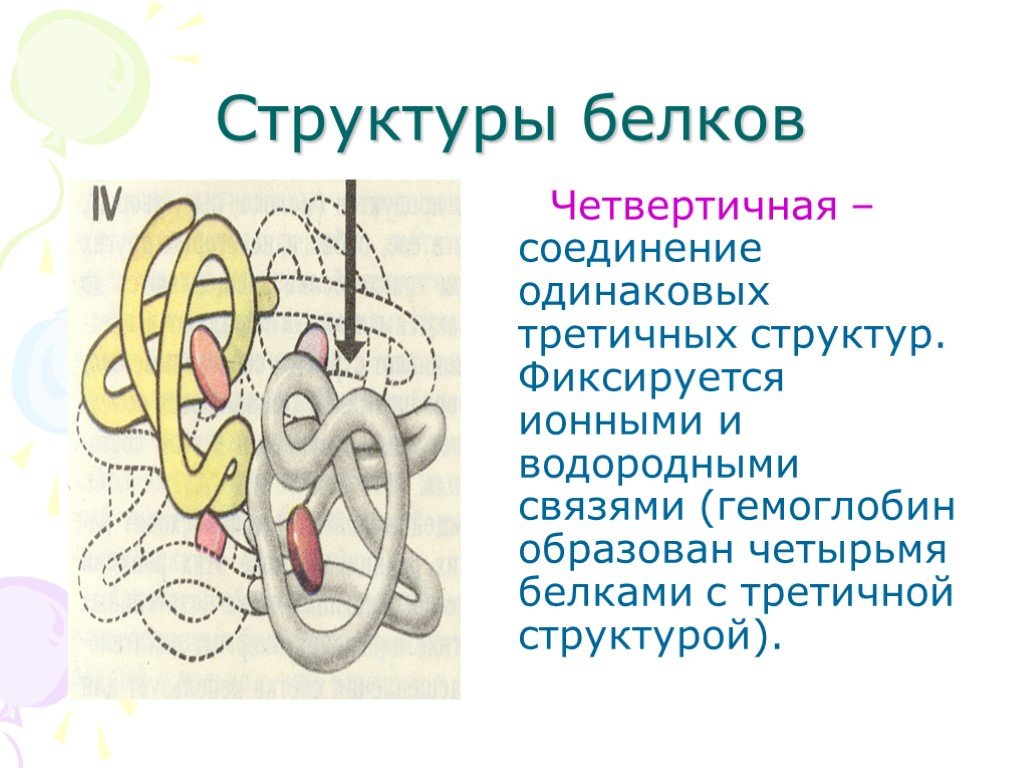
Когда белок содержит более одной полипептидной цепи, каждая цепь называется субъединицей . Расположение нескольких субъединиц представляет собой четвертый уровень структуры, четвертичную структуру белка. Гемоглобин с четырьмя полипептидными цепями или субъединицами является наиболее часто упоминаемым примером белка с четвертичной структурой (рис. 9)..6 «Четвертичная структура гемоглобина»). Четвертичная структура белка создается и стабилизируется посредством тех же взаимодействий, которые создают и поддерживают третичную структуру. Схематическое изображение четырех уровней структуры белка представлено на рис. 9.7 «Уровни структуры белков».
Рисунок 9.6 Четвертичная структура гемоглобина
Гемоглобин — это белок, который переносит кислород по всему телу.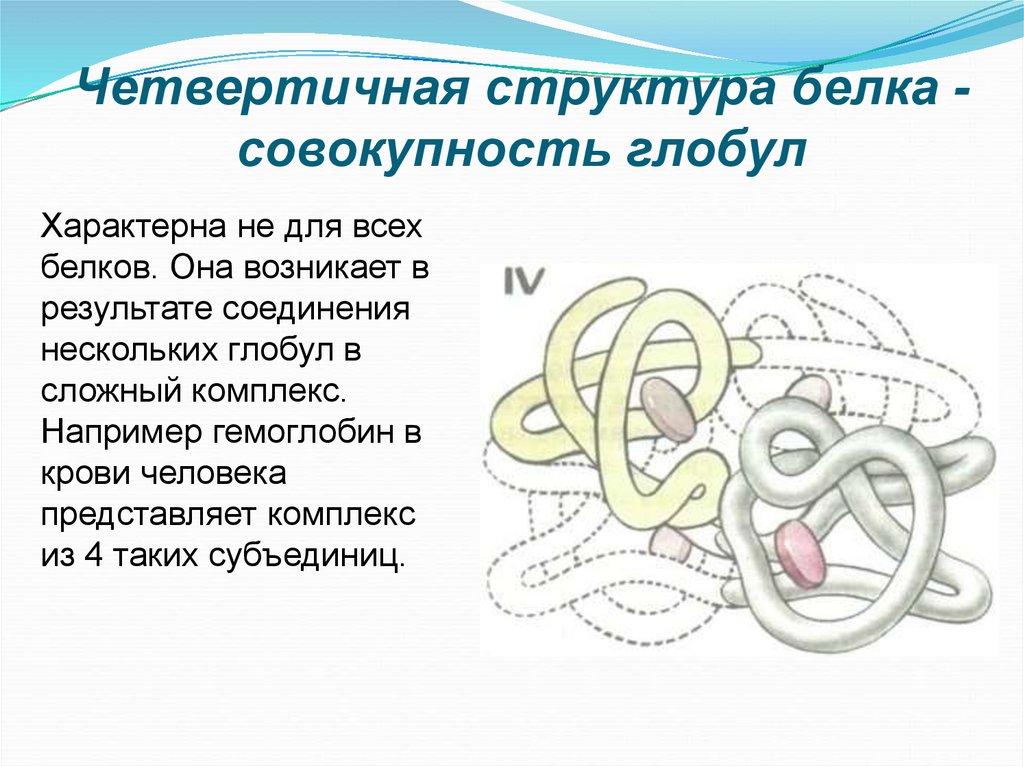
Источник: Изображение из PDB RCSB (www.pdb.org) PDB ID 1I3D (R.D. Kidd, H.M. Baker, A.J. Mathews, T. Brittain, E.N. Baker (2001) Олигомеризация и связывание лиганда в гомотетрамерном гемоглобине: два высоких кристаллические структуры гемоглобина Барта (гамма (4)), маркера альфа-талассемии с разрешением. Protein Sci. 1739.–1749).
Рисунок 9.7 Уровни структуры в белках
Первичная структура состоит из определенной аминокислотной последовательности. Полученная пептидная цепь может закручиваться в α-спираль, которая является одним из типов вторичной структуры . Этот спиральный сегмент включен в третичную структуру свернутой полипептидной цепи. Одиночная полипептидная цепь представляет собой субъединицу, которая составляет четвертичную структуру белка, такого как гемоглобин, который имеет четыре полипептидные цепи.
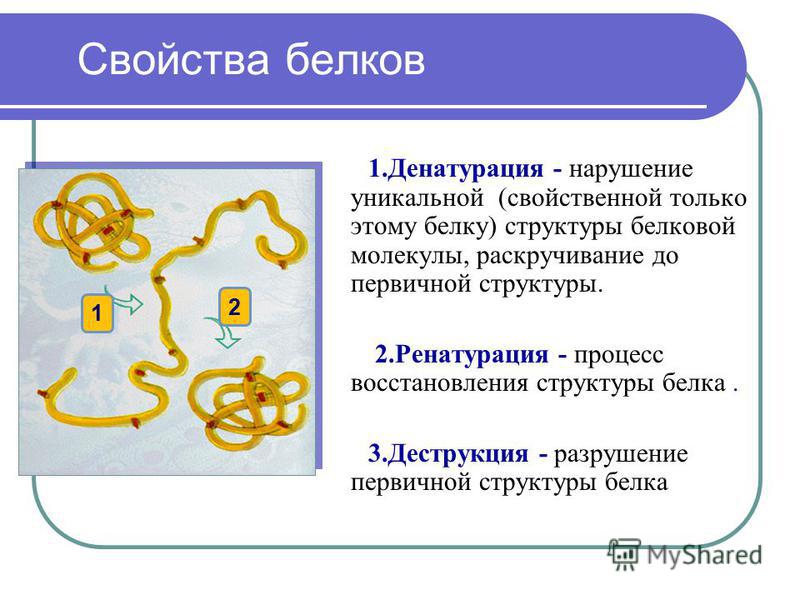
Денатурация белков
Высокоорганизованные структуры белков — это поистине шедевры химической архитектуры.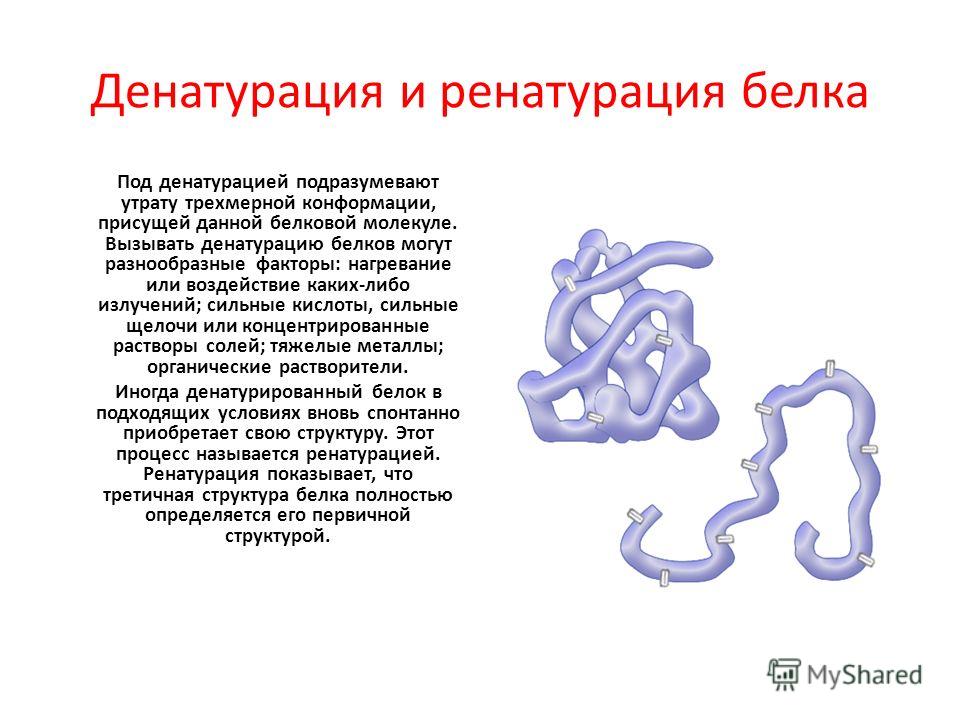 Но высокоорганизованные структуры, как правило, обладают определенной деликатностью, и это относится к белкам. Денатурация — это термин, используемый для обозначения любого изменения трехмерной структуры белка, которое делает его неспособным выполнять возложенную на него функцию. Денатурированный белок не может выполнять свою работу. (Иногда денатурацию приравнивают к осаждению или коагуляции белка; наше определение немного шире.) Денатурацию белка могут вызывать самые разнообразные реагенты и условия, такие как тепло, органические соединения, изменения рН и ионы тяжелых металлов (табл. 9.1 «Методы денатурации белков»).
Но высокоорганизованные структуры, как правило, обладают определенной деликатностью, и это относится к белкам. Денатурация — это термин, используемый для обозначения любого изменения трехмерной структуры белка, которое делает его неспособным выполнять возложенную на него функцию. Денатурированный белок не может выполнять свою работу. (Иногда денатурацию приравнивают к осаждению или коагуляции белка; наше определение немного шире.) Денатурацию белка могут вызывать самые разнообразные реагенты и условия, такие как тепло, органические соединения, изменения рН и ионы тяжелых металлов (табл. 9.1 «Методы денатурации белков»).
Таблица 9.1 Методы денатурации белков
| Метод | Влияние на структуру белка |
|---|---|
| Нагрев выше 50°C или ультрафиолетовое (УФ) излучение | Тепловое или УФ-излучение придает кинетическую энергию белковым молекулам, заставляя их атомы вибрировать быстрее и разрушая относительно слабые водородные связи и дисперсионные силы. |
| Использование органических соединений, таких как этиловый спирт | Эти соединения способны образовывать межмолекулярные водородные связи с белковыми молекулами, разрушая внутримолекулярные водородные связи внутри белка. |
| Соли ионов тяжелых металлов, таких как ртуть, серебро и свинец | Эти ионы образуют прочные связи с карбоксилатными анионами кислых аминокислот или SH-группами цистеина, нарушая ионные и дисульфидные связи. |
| Алкалоидные реагенты, такие как дубильная кислота (используемая при дублении кожи) | Эти реагенты объединяются с положительно заряженными аминогруппами в белках, разрушая ионные связи. |
Любой, кто жарил яйцо, наблюдал денатурацию. Прозрачный яичный белок становится непрозрачным по мере денатурации и коагуляции альбумина. Никто еще не обратил вспять этот процесс. Однако при соответствующих обстоятельствах и достаточном количестве времени белок, развернутый в достаточно щадящих условиях, может снова свернуться и снова проявить биологическую активность (рис. 9.8 «Денатурация и ренатурация белка»). Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Данная последовательность аминокислот, по-видимому, естественным образом принимает свое конкретное трехмерное расположение, если условия правильные.
9.8 «Денатурация и ренатурация белка»). Такие данные свидетельствуют о том, что, по крайней мере, для этих белков первичная структура определяет вторичную и третичную структуру. Данная последовательность аминокислот, по-видимому, естественным образом принимает свое конкретное трехмерное расположение, если условия правильные.
Рисунок 9.8 Денатурация и ренатурация белка
Изображены денатурация (развертывание) и ренатурация (ренатурация) белка. Красные прямоугольники представляют стабилизирующие взаимодействия, такие как дисульфидные связи, водородные связи и/или ионные связи.
Первичные структуры белков достаточно прочны. Как правило, для гидролиза пептидных связей необходимы довольно энергичные условия. Однако на вторичном и четвертичном уровнях белки весьма уязвимы для атаки, хотя их уязвимость к денатурации различается. Аккуратно свернутые глобулярные белки гораздо легче денатурировать, чем жесткие волокнистые белки волос и кожи.
Упражнения по обзору концепции
Какая преобладающая сила притяжения стабилизирует образование вторичной структуры в белках?
Различают третичный и четвертичный уровни структуры белка.

Кратко опишите четыре способа денатурации белка.
Ответы
водородная связь
Третичная структура относится к уникальной трехмерной форме одной полипептидной цепи, тогда как четвертичная структура описывает взаимодействие между несколькими полипептидными цепями для белков, которые имеют более одной полипептидной цепи.
(1) нагревать белок выше 50°C или подвергать его воздействию УФ-излучения; (2) добавить к раствору белка органические растворители, такие как этиловый спирт; (3) добавить соли ионов тяжелых металлов, таких как ртуть, серебро или свинец; и (4) добавить алкалоидные реагенты, такие как дубильная кислота
Ключевые выводы
- Белки можно разделить на две категории: волокнистые, которые, как правило, нерастворимы в воде, и глобулярные, которые лучше растворяются в воде.
- Белок может иметь до четырех уровней структуры. Первичная структура состоит из определенной аминокислотной последовательности.
 Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы.
Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы. - Четыре основных типа взаимодействий притяжения определяют форму и стабильность свернутого белка: ионная связь, водородная связь, дисульфидные связи и дисперсионные силы.
- Широкий спектр реагентов и условий может вызвать разворачивание или денатурацию белка.
Упражнения
1. Классифицируйте каждый белок как волокнистый или глобулярный.
а. альбумин
б. миозин
в. фиброин
2. Классифицируйте каждый белок как волокнистый или глобулярный.
а. гемоглобин
б. кератин
в. миоглобин
3. Как называется преобладающая вторичная структура шелка?
4. Как называется преобладающая вторичная структура белка шерсти?
Как называется преобладающая вторичная структура белка шерсти?
5. Белок имеет третичную структуру, образованную взаимодействиями между боковыми цепями следующих пар аминокислот. Для каждой пары определите самый сильный тип взаимодействия между этими аминокислотами.
а. аспарагиновая кислота и лизин
b. фенилаланин и аланин
c. серин и лизин
d. два цистеина
6. Белок имеет третичную структуру, образованную взаимодействиями между боковыми цепями следующих пар аминокислот. Для каждой пары определите самый сильный тип взаимодействия между этими аминокислотами.
а. валин и изолейцин
b. аспарагин и серин
c. глутаминовая кислота и аргинин
д. триптофан и метионин
7. Какие уровни белковой структуры обычно разрушаются при денатурации? Какой(ие) уровень(и) не является(и)?
8. Какой класс белков легче денатурировать — волокнистые или глобулярные?
Ответы
1.




 Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы.
Полученная пептидная цепь может образовывать α-спираль или β-складчатый лист (или локальные структуры, которые не так легко классифицировать), что известно как вторичная структура. Эти сегменты вторичной структуры включены в третичную структуру свернутой полипептидной цепи. Четвертичная структура описывает расположение субъединиц в белке, который содержит более одной субъединицы.