Презентация по химии 9 класс щелочные металлы и их соединения – Презентация к уроку по химии (9 класс) на тему: Презентация «Щелочные металлы. Химические свойства. Важнейшие соединения щелочных металлов» | скачать бесплатно
Презентация к уроку по химии (9 класс) по теме: Презентация «Щелочные металлы»
Слайд 1
Центр дистанционного образования детей-инвалидов при ОГАОУ «Белгородский инженерный юношеский лицей-интернат» ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнила: Быкова О.С., учитель химииСлайд 2
Цель: повторить свойства металлов, систематизировать и углубить знания о щелочных металлах на основании их сравнительной характеристики. Сформировать понятие о физических и химических свойствах щелочных металлов.
Слайд 3
Строение и свойства атомов
Слайд 4
Щелочные металлы — это элементы главной подгруппы I группы : литий Li, натрий Nа, калий К, рубидий Rb, цезий Сs , франций Fr.
Слайд 6
На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов. Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Слайд 7
Щелочные металлы — простые вещества
Слайд 8
Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности. Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.
Слайд 10
Химические свойства
Слайд 11
Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион. В качестве окислителей могут выступать простые вещества – неметаллы, оксиды, кислоты, соли, органические вещества.
Слайд 13
Взаимодействие с неметаллами
Слайд 14
Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность: оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует пероксид: 2Na + O2 = Na2O2, калий, рубидий и цезий – надпероксид: K + O2 = KO2.
Слайд 15
Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании: с водородом образуются гидриды: 2Na + h3 = 2NaH, с серой – сульфиды: 2K + S = K2S, с фосфором – фосфиды: 3K + P = K3P, с кремнием – силициды: 4Cs + Si = Cs4Si, с углеродом карбиды образуют литий и натрий: 2Li + 2C = Li2C2
Слайд 16
С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития: 6Li + N2 = 2Li3N. С галогенами все щелочные металлы образуют галогениды: 2Na + Cl2 = 2NaCl.
Слайд 17
Взаимодействие с водой
Слайд 18
Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Слайд 19
Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой. При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно. Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся. Взаимодействие с кислотами
Слайд 20
Соединения щелочных металлов В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях , природных водах.
Слайд 21
Гидроксид натрия NаОН в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали. Оба гидроксида — NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами. Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Слайд 22
Соли щелочных металлов — твердые кристаллические вещества ионного строения. . Nа2СO3 — карбонат натрия , образует кристаллогидрат Nа2СO3* 10Н2O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла. Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO3 , она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода). К2С03 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла. Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.
Слайд 24
NаСl — хлорид натрия , или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту.
Слайд 25
Спасибо за внимание!
nsportal.ru
Презентация к уроку химии по теме: «Щелочные металлы»


Дать общую характеристику щелочным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях металлов и их тривиальных названиях.
Определить области применения этих соединений.


Эти металлы получили название щелочных , потому что большинство их соединений растворимы в воде.

- В 1807 г. в Англии Г. Деви открыл натрий и калий.
«Натрун» — сода, «алкали» — щелочь.
- В 1817г. в Швеции А. Арфведсоном был открыт литий.
«Литос» — камень.
- В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой».
- В 1939г. во Франции М. Перей открыла радиоактивный элемент франций, который назвала в честь своей страны – Франции.

Нахождение в природе
Как очень активные металлы, они встречаются в природе только в виде соединений
Натрий и калий широко распространены в природе в виде солей
Соединения других щелочных металлов встречаются редко
Кристаллы хлорида натрия – минерал галит
Лепидолит — один из основных источников редких щелочных металлов, рубидия и цезия
Карбонат калия-поташ

Na + — внутриклеточный ион, содержится в крови и лимфе, создает в клетках осмотическое давление.
K + — внеклеточный ион, поддерживает работу сердца и мышц.
Большое количество калия содержится в кураге, сое, фасоли, зеленом горошке, черносливе, изюме.


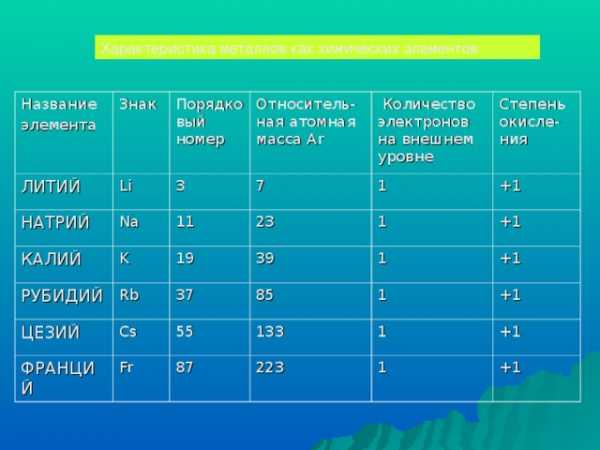
Характеристика металлов как химических элементов
Название
элемента
Знак
ЛИТИЙ
Порядковый номер
Li
НАТРИЙ
КАЛИЙ
Относитель-ная атомная масса Ar
3
Na
Количество электронов на внешнем уровне
7
K
11
РУБИДИЙ
19
23
1
Степень окисле-ния
Rb
ЦЕЗИЙ
1
+1
39
Cs
37
ФРАНЦИЙ
+1
1
Fr
85
55
+1
1
133
87
223
+1
1
+1
1
+1

Изменение свойств в группе
В ряду щелочных металлов:
- Радиус атома увеличивается
- Увеличиваются восстановительные свойства (способность отдавать электроны)
- Уменьшается прочность химической связи металл – металл
- Уменьшается температура плавления, температура кипения
Li
Na
K
Rb
Cs
Fr

Химические свойства
Щелочные металлы активно взаимодействуют почти со всеми неметаллами:
2Ме 0 + Н 2 0 = 2Ме +1 Н -1 (гидрид)
2Na + H 2 = 2NaH
2Ме 0 + Cl 2 0 = 2M е +1 Cl -1 ( хлорид )
2Ме 0 + S 0 = M е +1 2 S ( сульфид )
С кислородом натрий образует
пероксиды:
2Ме 0 + О 2 0 = Ме +1 2 О 2 -1 пероксид
2Na + O 2 = Na 2 O 2


Химические свойства
Все щелочные металлы активно реагируют с водой, образуя щелочи и восстанавливая воду до водорода:
2Ме 0 + 2Н 2 О = 2Ме +1 ОН + Н 2
2Na + 2Н 2 О = 2NaOH + H 2
Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию опыт
Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина


Окраска пламени ионами щелочных металлов
Na +
Li +
Cs +
K +


Самые распространенные соединения металлов и их применение
Используют для очистки нефтепродуктов, производства бумаги, мыла, волокон, стекла, удобрений. Применяют в медицине и фармакологии.
NaOH – едкий натр, каустическая сода.
KOH — едкое кали.
Na 2 CO 3 10H 2 O – кристаллическая сода.
NaHCO 3 – пищевая сода.
K 2 CO 3 — поташ.
Na 2 SO 4 10H 2 O – глауберова соль.
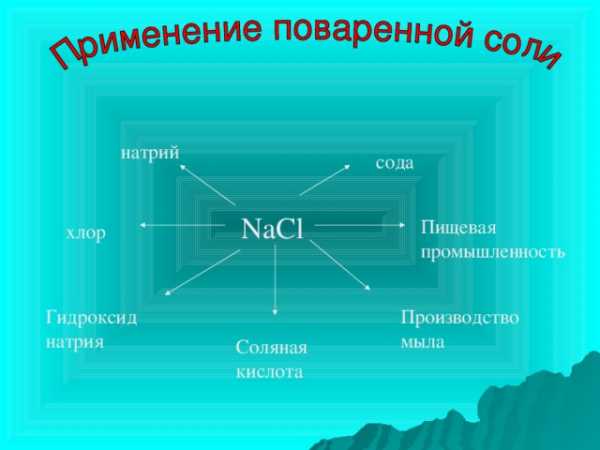
натрий
сода
NaCl
Пищевая промышленность
хлор
Гидроксид натрия
Производство мыла
Соляная кислота

1.К группе щелочных металлов относятся:
а) Li, Na, K, Cu, Pb, Ag б) Li,Na,K, Rb,Cs,Fr
в) Li, Be, B, C, N, O г) Li, Na, Be, Mg, K, Ca
2.Строение внешнего энергетического уровня щелочных металлов отражает электронная формула:
а ) ns 1 б) ns 2
в ) ns 1 np 6 г) np 1
3. Для щелочных металлов характерны свойства:
а) окислителей б) восстановителей и окислителей
в) окислителей и восстановителей г)восстановителей
4. Щелочные металлы взаимодействуют со всеми веществами группы
а) HCl, H 2 O, H 2 , SO 3 , O 2 б) O 2 , N 2 , S, H 2 O, Cu
в) O 2 , H 2 , S, H 2 O г) KOH, H 2 , O 2 , H 2 O
5. Активность атомов щелочных металлов увеличивается в ряду:
а ) Li, Na, K, Rb, Cs, Fr б) Fr, Cs, Rb, K, Na, Li
в) Na, Li, Rb, K, Fr, Cs г) K, Na, Li, Rb, Cs, Fr

КЛЮЧ к проверке тестов: 1б 2а 3г 4в 5а

Повторить § 3 9 , придумать загадки о металлах, упр. 1-5,11-на «5».
Презентация «Соединения щелочных металлов»



Напишите уравнения реакций между: а) калием и хлором,
б) натрием и йодом, в) литием и водой.
Рассмотрите реакции как окислительно-восстановительные
Na 0 + I 2 0 = Na + I ─
K 0 + Cl 2 0 = K + Cl ─
2
2
2
2
Na 0 ─ 1e → Na + 1 2
I 2 0 + 2e → 2I ─ 2 1
K 0 ─ 1e → K + 1 2
Cl 2 0 + 2e → 2CL ─ 2 1
Na – восстановитель, пр. окисления
K – восстановитель, пр. окисления
I 2 – окислитель, пр. восстановления
Cl 2 – окислитель, пр. восстановления
2
2
Li 0 + 2Н + 2 О = Li + ОН + Н 2 0
Li 0 ─ 1e → Li + 1 2
2Н + + 2e → Н 2 0 2 1
Li 0 – восстановитель, пр. окисления
2Н + – окислитель, пр. восстановления

Соединения щелочных металлов

Составьте формулу оксида натрия:
Na 2 O
основный
Определите характер оксида:
Оксид натрия представляет собой бесцветные кристаллы. Хранить Na 2 O лучше всего в безводном бензоле.
Температура плавления – 1132 °C
Плотность – 2,27г/см 3

Получение:
1. Взаимодействие металлического натрия с кислородом
Чистый оксид натрия получить непосредственным окислением натрия
нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия :
6Na + 2O 2 = 2Na 2 O + Na 2 O 2
2. Прокаливание пероксида натрия с избытком натрия:
2Na + Na 2 O 2 = 2Na 2 O

Химические свойства.
Перечислите свойства основных оксидов.
Основные оксиды взаимодействуют с водой (если данному оксиду
соответствует растворимое или малораствоимое основание), с кислотными
и амфотерными оксидами, с кислотами.
Составьте уравнения реакций оксида натрия с водой, оксидом фосфора(V),
Na 2 O + H 2 O = 2NaOH
3Na 2 O + P 2 O 5 = 2Na 3 PO 4
3Na 2 O + P 2 O 5 = 2Na 3 PO 4

Составьте формулу гидроксида натрия:
NaOH
Твердое белое кристаллическое вещество, хорошо растворимое в
воде. Процесс растворения сопровождается выделением достаточного
количества теплоты.
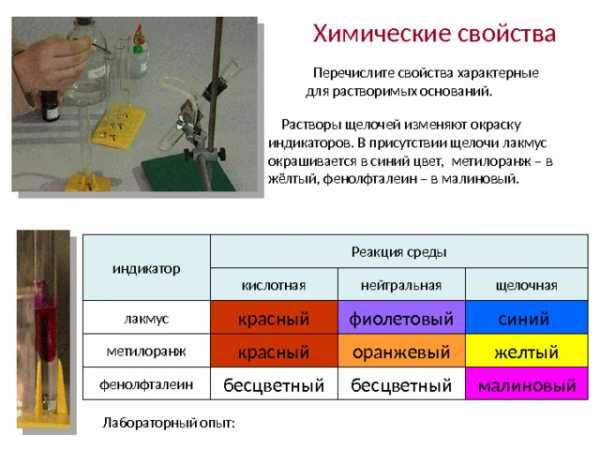
Химические свойства
Перечислите свойства характерные
для растворимых оснований.
Растворы щелочей изменяют окраску
индикаторов. В присутствии щелочи лакмус окрашивается в синий цвет, метилоранж – в жёлтый, фенолфталеин – в малиновый.
индикатор
Реакция среды
щелочная
нейтральная
кислотная
лакмус
синий
красный
фиолетовый
метилоранж
красный
оранжевый
желтый
фенолфталеин
бесцветный
бесцветный
малиновый
Лабораторный опыт:

Лабораторные опыты «Свойства гидроксида натрия»
С правилами ТБ ознакомлен __________
Инструкция
- Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете?
- Добавьте в эту же пробирку раствор серной кислоты. Что наблюдаете? Запишите уравнение реакции.
- Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции.
Сделайте вывод о химических свойствах гидроксидов щелочных металлов.
№ опыта
Наблюдения
№ 1
Уравнения реакций, вывод
№ 2
№ 3

Применение соединений
щелочных металлов
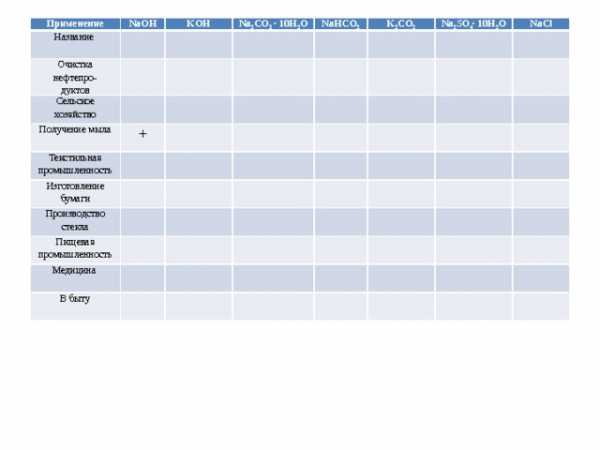
Применение
Название
NaOH
Очистка нефтепро-
KOH
Сельское хозяйство
дуктов
Na 2 CO 3 ∙ 10H 2 O
NaHCO 3
Получение мыла
K 2 CO 3
+
Текстильная промышленность
Na 2 SO 4 ∙ 10H 2 O
Изготовление бумаги
Производство стекла
NaCl
Пищевая промышленность
Медицина
В быту

Применение NaOH
Едкий натр применяется в огромном множестве отраслей промышленности
и для бытовых нужд:
Каустик применяется в целлюлозно-бумажной промышленности.
В производстве бумаги, картона, искусственных волокон, древесно-
волоконных плит

Для омыления жиров при производстве мыла, шампуня и других
моющих средств

В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется.
О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 г. н. э. Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад.

В химических отраслях промышленности — для нейтрализации
кислот и кислотных оксидов, как реагент или катализатор в
химических реакциях, в нефтепереработке —для производства масел, очистке нефти.

В качестве агента для растворения засоров канализационных
труб в виде сухих гранул или в составе гелей. Гидроксид натрия
дезагрегирует засор и способствует лёгкому продвижению его
далее по трубе.

КОН
Гидроксид калия (едкий кали)
Применяют при производстве жидкого мыла
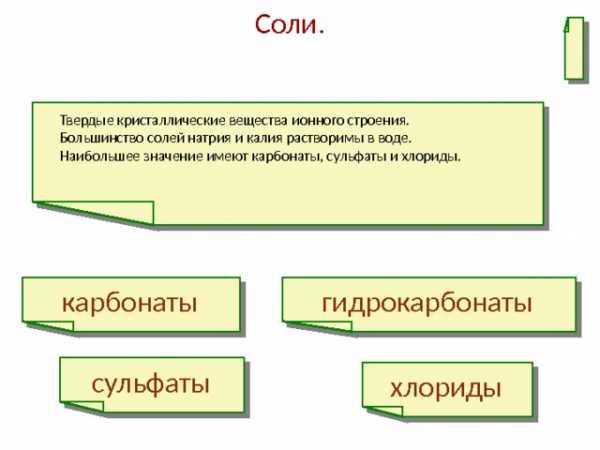
Соли.
Твердые кристаллические вещества ионного строения.
Большинство солей натрия и калия растворимы в воде.
Наибольшее значение имеют карбонаты, сульфаты и хлориды.
карбонаты
гидрокарбонаты
сульфаты
хлориды

Карбонат натрия.
Карбонаты
Na 2 CO 3
Na 2 CO 3 образует кристаллогидрат Na 2 CO 3 ·10Н 2 О , известный под
названием кристаллическая сода. Это вещество применяют в
производстве
для устранения жесткости воды
бумаги,
мыла,
стекла,

гидрокарбонаты
NaНCO 3
Пищевая сода
Применяется:
— в химической промышленности — для производства красителей, пенопластов и других органических продуктов; товаров бытовой химии; наполнителей в огнетушителях, при производстве стекла.
— в легкой промышленности — в производстве искусственных кож,
кожевенном производстве (дубление и нейтрализация кож), текстильной
промышленности (отделка шелковых и хлопчатобумажных тканей).
— в пищевой промышленности — хлебопечении, производстве кондитерских
изделий, приготовлении напитков. Зарегистрирован в качестве пищевой
добавки E500
- в медицине раствор питьевой соды используется в качестве слабого
антисептика для полосканий, а также как традиционное
кислотонейтрализующее средство от изжоги и болей в желудке.

сульфаты
Na 2 SO 4
Сульфат натрия образует кристаллогидрат
Na 2 SO 4 · 10Н 2 О , известный под названием
глауберова соль
Применяется для производства соды, стекла, как слабительное средство.


NaCl
хлориды
Хлорид натрия – поваренная соль
Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты»
Поваренную соль применяют при производство химических веществ: соляной кислоты, гидроксида натрия
хлора, соды, для консервирования,
приправа к пище, производство мыла, в медицине

Биологическая роль ионов натрия и калия
Катион
Биологическая роль
Na +
Продукты богатые катионами
K +
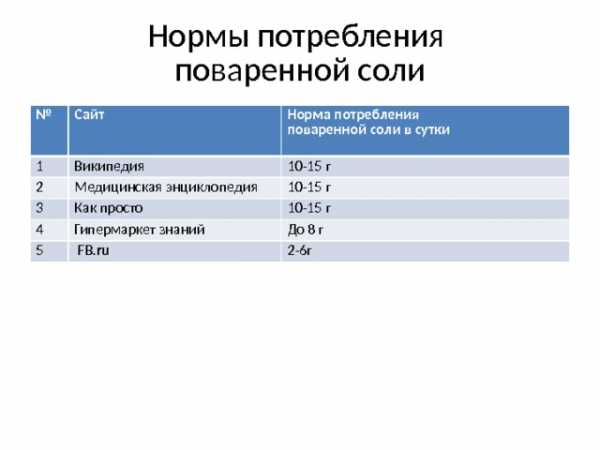
Нормы потребления поваренной соли
№
Сайт
1
Википедия
Норма потребления
2
Медицинская энциклопедия
поваренной соли в сутки
10-15 г
3
10-15 г
Как просто
4
Гипермаркет знаний
10-15 г
5
До 8 г
FB.ru
2-6г

Домашнее задание
Параграф 14 упр2,5
Составить презентацию о применении соединений кальция и магния
multiurok.ru
Щелочные металлы и их соединения
Текст этой презентации
Слайд 1
Периодическая система химических элементов Д.И. Менделеева
Слайд 2
А. Арфведсон 1792–1841 гг.
Литий был открыт в 1817 г. шведским химиком А. Арфведсоном. Металл назвали литием, что в переводе с греческого означает «камень».
Слайд 3
Г. Деви 1778–1829 гг.
Впервые литий был получен английским химиком Г. Дэви в 1818 г.
Слайд 4
Г. Деви 1778–1829 гг.
В 1807 г. английский химик и физик Г. Дэви впервые получил натрий в чистом виде при электролизе едкого натра. Он первым изучил его свойства.
Слайд 5
Натрий содержится в организме человека: в эритроцитах крови, сыворотке, пищеварительных соках, играет важную роль в водно-солевом обмене и поддержании кислотно-щелочного равновесия.
Слайд 6
Металлическим натрием восстанавливают из соединений такие ценные металлы, как цирконий, тантал.
Цирконий
Alchemist-hp
Тантал
Слайд 7
Калий
Dnn87
Слайд 8
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Слайд 9
Калий используют обычно в форме солей. Калийные удобрения — это природные или изменённые в процессе химической обработки соли калия.
Слайд 10
Рубидий
Слайд 11
Цезий
Magnus Manske
Слайд 12
Франций
Маргарита Пере 1909–1975 гг.
Франций был открыт в 1939 г. Маргаритой Пере. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Слайд 13
Строение атомов щелочных металлов и их свойства
Свойства Li Na K Rb Cs Fr
Порядковый номер 3 11 19 37 55 87
Валентные электроны 2s1 3s1 4s1 5s1 6s1 7s1
Энергия ионизации атома, эВ 5,39 5,14 4,34 4,18 3,89 3,83
Относительная электроотрицательность 0,97 1,01 0,91 0,89 0,86 0,86
Степень окисления в соединениях +1 +1 +1 +1 +1 +1
Радиус атома, нм 0,155 0,189 0,236 0,248 0,268 0,280
Слайд 14
Металлические свойства
Металлический блеск
Пластичность
Мягкость
Хорошая электропроводность
Хорошая теплопроводность
Слайд 15
Химические свойства металлов
Щелочные металлы активно взаимодействуют почти со всеми неметаллами.
2M + h3 = 2MH
0
0
+1
–1
гидрид
t
Слайд 16
Химические свойства металлов
При взаимодействии щелочных металлов с галогенами образуются соли (галогениды металлов).
2M + Cl2 = 2MCl
0
0
+1
–1
хлорид
t
Слайд 17
Химические свойства металлов
При взаимодействии щелочных металлов с серой образуются сульфиды металлов.
2M + S = M2S
0
0
+1
–2
сульфид
t
Слайд 18
Реакция взаимодействия щелочных металлов с кислородом
4Li + O2 = 2Li2O
0
0
+1
–2
t
Слайд 19
При взаимодействии с водой щелочные металлы образуют щёлочи, восстанавливая воду до водорода, и водород.
2Na + h3O = 2NaOH + h3↑
0
+1
+1
0
2K + h3O = 2KOH + h3↑
0
+1
+1
0
Слайд 20
Соединения щелочных металлов
Галит
Сильвинит
Слайд 21
Оксиды щелочных металлов
Оксиды щелочных металлов являются типичными основными оксидами, они обладают всеми свойствами основных оксидов.
R2O +h3O =2ROH
Слайд 22
Гидроксиды щелочных металлов
Гидроксиды щелочных металлов являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований.
Na2O + h3O = 2NaOH
K2O+HNO3 = 2KNO3 + h3O
нитрат калия
Слайд 23
Соли щелочных металлов
Хлорид натрия
Слайд 24
Самая значительная способность калия — поддерживать работу сердечной мышцы, поэтому нехватка калия в организме очень сказывается на здоровье человека. Взрослый человек должен в сутки потреблять с пищей 3,5 г ионов калия.
topslide.ru
Презентация к уроку по химии (9 класс) на тему: Щелочные металлы. Презентация, 9 класс
Слайд 1
Задача . Сколько килограммов меди получается из 120 т обогащенной горной породы, содержащей 20% медного блеска Cu 2 S , если выход меди составляет 90% от теоретически возможного? 1. Предложите технологическую цепочку производства свинца из минерала галенита PbS . Запишите уравнения реакций.Слайд 2
«Алхимию постигнуть каждый рад: Безумный идиот , старик и юный фат, Портной, старуха, юркий адвокат, Монах плешивый, пастырь и солдат». ( Г.Деви ) В ноябре 1807г в Лондоне на заседании Королевского общества Гемфри Деви объявил об открытии им новых химических элементов- натрия и калия. Выявить их удалось с помощью электрического тока. Никто тогда не предполагал, какую пользу они могут принести. Мы сегодня поведем разговор о металлах 1 группы главной подгруппы
Слайд 3
План урока 1. Записать химические символы щелочных металлов. 2. Изменение свойств в группе. 3. Физические свойства ( стр 45) 5. Соединения щелочных металлов: оксиды, гидроксиды , соли. 4. Химические свойства
Слайд 4
Строение атомов I группы главной подгруппы II Li +3 ) ) порядковый номер 2 1 заряд ядра III Na +11 ) ) ) радиус атома 2 8 1 металлические и IV K +19 ) ) ) ) восстановительные 2 8 8 1 свойства V Rb + 37 ) ) ) ) ) 2 8 18 8 1 VI Cs + 55 ) ) ) ) ) ) 2 8 18 18 8 1 VII Fr + 87 ) ) ) ) ) ) ) 2 8 18 32 18 8 1 > > > > >
Слайд 5
Физические свойства: «Первой группы элементы одинаково валентны, Легкоплавки и мягки, серебристы, как снежки, Только с ними не зевай – К ним воды не приливай. Не послушаешь совета, и поплатишься за это, Не услышишь мой призыв – Грянет в классе страшный взрыв. И тогда ты, наш дружок, Испытаешь жуткий шок, Потому что двойку сразу Ты получишь за урок. Догадался, наконец: «Калий, натрий». Молодец.
Слайд 6
Живет обычно в керосине И бегает он по воде, В природе, в комнате – отныне Свободным нет его нигде. В солях открыть его возможно: Желтеет пламя от него. И получить из соли можно, Как Дэви получил его
Слайд 7
Опять в таблицу посмотрите: На третьем месте литий встал. Второй период начал литий, Ведь это щелочной металл. По цвету серебристо – белый, Ножом разрежется металл. Он мягкий, легкий. Вывод сделай: «Такого раньше не встречал!»
Слайд 8
4. Химические свойства: а. с водородом б. с галогенами в. с серой г. с кислородом д. с водой
Слайд 9
Щелочные металлы и их соединения 1. Выберите щелочные металлы и запишите их в порядке увеличения восстановительных способностей: Ca, Al, Na, K, Mn , Cs, Cu, Au, Fr, Ag, Rb 2. Какой из щелочных металлов является радиоактивным? 3. Какую степень окисления они имеют и почему? 4. Как следуют хранить щелочные металлы и почему? 5. Перечислите физические свойства металлов? 6. Можно ли сказать, что щелочные металлы растворяются в воде? Почему?
Слайд 10
Соединения щелочных металлов Задания по теме «Щелочные металлы» Закончить уравнения возможных реакции А ) K 2 O + H 2 O= Б) K 2 O + MgO = В ) K 2 O+ H 2 SO 4 = Г ) K 2 O + SO 3 = Д) K 2 O + NaOH = Е) K 2 O + Са SO 4 = А ) NaOH + HNO 3 = Б) NaOH + Zn(OH) 2 = В ) NaOH + H 2 ZnO 2 = Г) NaOH +CO 2 = Д ) NaOH + ZnCl 2 = Е) NaOH + Zn(OH) 2 =
Слайд 11
А) Глауберова соль 1) K 2 SO 4 7) Na 2 CO 3 Б) Карбонат натрия 2) Na 2 CO 3 * 10 H 2 O 8) NaHCO 3 В) Пищевая сода 3) Na 2 SO 4 *10 H 2 O 9) NaCl Г) Кристаллическая сода 4) K 2 SO 4 10) K 2 CO 3 Д) Поваренная соль 5) Na 2 CO 3 * 10 H 2 O 11) NaHCO 3 Е) Поташ 6) Na 2 SO 4 * 10 H 2 O 12) NaOH А) Глауберова соль — Na 2 SO 4 * 10 H 2 O Б) Карбонат натрия — Na 2 CO 3 В) Пищевая сода — NaHCO 3 Г) Кристаллическая сода — Na 2 CO 3 *10 H 2 O Д) Поваренная соль — NaCl Е) Поташ — K 2 CO 3
Слайд 12
Задача . Сколько килограммов меди получается из 120 т обогащенной горной породы, содержащей 20% медного блеска Cu 2 S , если выход меди составляет 90% от теоретически возможного?
nsportal.ru
Презентация к уроку по химии (9 класс) по теме: щелочные металлы
Слайд 1
Отгадайте фамилию русского ученого, который сказал: «Металлом называется светлое тело, которое ковать можно». Самый тугоплавкий. Самый распространенный на земле. Самый легкий. Самый электропроводный. Самый твердый . Самый пластичный. Самый легкоплавкий. Самый тяжелый. Самый космический. Л О М О Н О С О В Au Os Cr Hg Li W Fe Al AgСлайд 2
Дать характеристику элементам IA группы по их положению в периодической системе химических элементов. На основе строения их атомов рассмотреть физические и химические свойства щелочных металлов. Указать области применения щелочных металлов
Слайд 5
Li Na K Rb Cs Fr 7 23 39 85 133 [223] 2s 1 3s 1 4s 1 5s 1 6s 1 7s 1 )) ))) )))) ))))) )))))) ))))))) Элемент А r Валентные электроны Число энергетических уровней Металлические свойства Восстановительные свойства R атома
Слайд 6
каменная Глауберова сильвинит карналлит NaCl – поваренная (каменная) соль Na 2 SO 4 ∙ 10H 2 O – глауберова соль KCl ∙ NaCl – сильвинит KCl ∙ MgCl 2 · 6H 2 O – карналлит Na + Na + Na + Na + Cl — Cl — Cl — Cl — NaCl → Na + + Cl — 2NaCl → 2Na + Cl 2
Слайд 7
Вещества серебристо-белого цвета Электропроводны и теплопроводны Легкоплавкие. пластичные Li Na K Rb Cs t пл = 98 t пл = 181 t пл = 64 t пл = 28 t пл = 39
Слайд 8
Реагируют с простыми веществами (с неметаллами) Реагируют со сложными веществами Почему щелочные металлы не используют для реакции с растворами кислот и солей? Li K Катионы щелочных металлов окрашивают пламя спиртовки Na РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Bi Cu Hg Ag Pt Au 4 2 6 2 2 2 2 2 2 Li + O 2 → Li 2 O Na + O 2 → Na 2 O 2 2 Li + N 2 → Li 3 N Li + H 2 → LiH Li + H 2 O → LiOH + H 2 Na + Na 2 O 2 → Na 2 O 2 2 Li + Cl 2 → LiCl 2 2
Слайд 9
Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора массой 0,5 кг? 4,5г соли 495,5 г воды Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси. 70% NaHCO 3 30% NaCl Хлорид калия — очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе. 52% Тривиальные названия солей: Поваренная соль ответ Раствор хлорида натрия (0,9%) применяется в медицине. Такой раствор называется физиологическим ответ Питьевая сода применяется в кулинарии, для выпечки кондитерских изделий. Хлорид натрия — как добавка к пище ответ Калийные удобрения играю важную роль в жизни растений. NaCl Кристалли-ческая сода Na 2 CO 3 *10H 2 O Питьевая сода NaHCO 3 поташ K 2 CO 3 Калийная селитра KNO 3 Глауберова соль Na 2 SO 4 *10H 2 O
Слайд 10
Проверь себя: ☺ Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне щелочных металлов равно 1. 2. В реакциях щелочные металлы являются окислителями и восстановителями. 3. При взаимодействии натрия с кислородом образуется пероксид натрия 4. Щелочные металлы – это металлы IA группы Периодической системы химических элементов. 5. Щелочные металлы получают электролизом расплавов их солей. 6. Щелочные металлы не взаимодействуют с водой. 7. Качественной реакцией на ионы щелочных металлов является их взаимодействие с кислородом. 8. При переходе от лития к калию уменьшается радиус атома
Слайд 11
§ 11 2. Выполнить цепочку химических превращений: Na → Na 2 O 2 → Na 2 O → Na 2 CO 3 NaOH → NaCl
Слайд 13
Интернет-ресурсы http://school-collection.edu.ru/ http://ru.wikipedia.org/ images.yandex.ru
nsportal.ru
Презентация к уроку по химии (9 класс) на тему: Щелочные металлы
Слайд 1
Щелочные металлы.Слайд 3
Строение и свойства атомов Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: литий, натрий, калий, рубидий, цезий, франций. На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1. Щелочные металлы – простые вещества.
Слайд 5
Физические свойства. Серебристо – белые мягкие вещества (кроме серебристо-жёлтого цезия), с характерным блеском на свежесрезанной поверхности. Все они лёгкие и легкоплавкие, причём, как правило, плотность их возрастает от лития к цезию. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Слайд 6
Калий Натрий
Слайд 7
Химические свойства . с простыми веществами: 2Li + Н2 = 2LiН – гидрид лития; 2К + Сl2 = 2КСl – хлорид калия; 2Nа + S = Nа2S – сульфид натрия; 4 Li + О2 = 2Li2О – оксид лития. со сложными веществами: 2Nа + 2НОН = 2NаОН + Н2 2Nа +2НСl = 2NаСl + Н2 2Nа +2СН3Сl=С2Н6+2NаСl
Слайд 9
Получение. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы: 2 LiCl = 2Li+Cl2 Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов: 4NaOH=4Na+2h3O+O2 Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C: 2MeCl+Ca=2Me+CaCl2
Слайд 10
Цезий Рубидий Литий
Слайд 11
Вопросы: 1)Приведите примеры щелочных металлов. Ответ: литий, натрий, калий, рубидий, цезий, франций; 2)Сколько электронов на внешнем энергетическом уровне содержат атомы этих элементов? Ответ: На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону; 3)Щелочные металлы являются окислителем или восстановителем? Ответ: щелочные металлы являются сильными восстановителями; 4)Какого цвета щелочные металлы? Ответ: серебристо – белые вещества ; 5)Какие из щелочных металлов легче воды? Ответ: литий, натрий и калий.
nsportal.ru

