Простые и сложные вещества урок 8 класс: Конспект урока Тема: « Простые и сложные вещества» Химия 8 класс | План-конспект урока по химии (8 класс) на тему:
Урок на тему «Простые и сложные вещества». 8-й класс, химия
Цель урока:
- Знать определение атома, молекулы, простого и сложного вещества.
- Уметь различать простые и сложные вещества; смеси и сложные вещества.
- Знать отличие смеси и сложного вещества.
Оборудование: Шаровые модели молекул воды, Штатив с пробирками, реактивы (железо, вода, сера, карбонат кальция).
демонстрация соединение железа с серой.
Лабораторные опыты: Ознакомление с образцами простых и сложных веществ.
Ход урока
1. Повторение и обобщение знаний.
1) Проверка домашнего задания:
Упражнение упр. 8, 9, 10, на стр. 22. (Взаимопроверка).
2) Выполните тестовое задание. Подберите соответствие: термин – определение понятия.
(Приложение №1). Самопроверка.
3) Приведите примеры смесей (не менее двух), которые можно разделить:
1 вариант:
А) фильтрованием————————————————————————————-
Б) отстаиванием—————————————————————————————-
2 вариант:
А) выпариванием—————————————————————————————
Б) дистилляцией——————————————————————————————
2. Изучение нового материала
Изучение нового материала
1. Фронтальный опрос:
Какие виды смесей вам известны?
Какие смеси называются однородными, неоднородными?
Какое вещество называется чистым? Что такое «вещество»? Из курса физики вам известно, что многие вещества состоят из молекул.
Дайте определения понятиям «молекула» и «атом». (Приложение №2).
Рассмотрите шаровые модели некоторых веществ, укажите состав данного вещества. Чем молекула озона отличается от молекулы оксида кальция? Чем водород отличается от соляной кислоты? Учащиеся могут ответить, что молекулы водорода, фосфора, азота образованы атомами одного вида. – Простые вещества.
Вещества соляная кислота, оксид кальция, метан, оксид натрия образованы атомами разного вида. Сложные вещества.
Выпишите в словарь новые понятия, со страниц 15,16.
Заполните схему:
2. Лабораторный опыт.
Инструкция к лабораторному опыту.
- Прослушайте инструктаж по охране труда.
- Выполните опыт: рассмотрите выданные вам образцы веществ: железо, вода, сера, карбонат кальция.
- Опишите их физические свойства.
- Оформите результаты в таблицу. (Приложение №3).
| Физические свойства | железо |
вода |
сера |
Карбонат кальция |
Агрегатное состояние (твердое, жидкое, газообразное) |
|
|
|
|
Цвет |
|
|
|
|
Блеск |
|
|
|
|
Растворимость в воде |
|
|
|
|
Хрупкость (пластичность) |
|
|
|
|
Теплоэлектропроводность |
|
|
|
|
Температура кипения, температура плавления. |
|
|
|
|
Простое (сложное) вещество |
|
|
|
|
Вывод к работе: о физических свойствах веществ, о составе простых и сложных веществах.
3. Чем смесь отличается от сложного вещества.
Напомнив, как готовиться смесь железа и серы, учитель отмечает, что сера — простое вещество, молекулы ее состоят из одинаковых атомов одного вида, железо тоже простое вещество, состоящее из одинаковых атомов другого вида. Можно ли назвать то, что получилось при перемешивании порошков, сложным веществом? Разделим смесь при помощи магнита. После обсуждения делаем вывод, что смесь можно разделить физическими способами и получить чистые вещества, из которых она состояла.
Таблица №1. Сравнение смесей и сложных веществ.
Смесь |
Сложное вещество |
1. Вещества сохраняют свои свойства. |
1. Свойства исходных веществ не сохраняются. |
2. Вещества можно разделить физическими методами. |
2. Сложное вещество нельзя разделить физическими методами. |
3. Количественный состав может быть произвольным. |
3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
3. Закрепление.
1. Выпишите простые вещества: сталь, чугун, железо, морская вода, дистиллированная вода, алюминий, лимонад, спиртовая настойка йода, нефть, глюкоза, поваренная соль, воздух, кислород, бронза.
2. Простые вещества состоят из атомов … химического элемента.
Сложные вещества состоят из атомов … Химических элементов. Сложные вещества иначе называют … .
Простое вещество, в отличие от сложного, нельзя … .
3. Чем морская вода отличается от дистиллированной воды?
4. Сравнить смесь со сложным веществом.
Вопросы и задания |
Вещества |
|
вода |
Водород и кислород (смесь) |
|
Можно ли разделить эти вещества на более простые компоненты. |
|
|
Сохраняется ли способность молекул кислорода поддерживать горение? Почему? |
|
|
Рефлексия и подведение итогов
Что нового узнали на уроке?
Какие вопросы вызвали затруднение?
Какие знания вы сегодня приобрели?
Домашнее задание: Читать стр. 15-17.
Выполнить упражнения 11-13 на стр.22.
Литература: Г.Е. Рудзитис, Ф.Г. Фельдман. «Химия 8 класс».
Конспект урока химии в 8 классе по теме «Простые и сложные вещества»
Простые и сложные вещества. | |
ТЕМА | |
ЦЕЛЬ | Сформировать представление о формах существования химических элементов. |
СОДЕРЖАНИЕ | Простые и сложные вещества. |
ПЛАН УРОКА.
I. Проверка знаний и умений.
· Какую информацию несет химическая формула вещества?
· Дайте определение понятия «молекулярная масса».
· Как вычислить молекулярную массу вещества?
· Рассчитайте молекулярную массу кислорода, водорода, воды, угарного газа по предложенным формулам (устно, с комментариями).
II. Изучение нового материала.
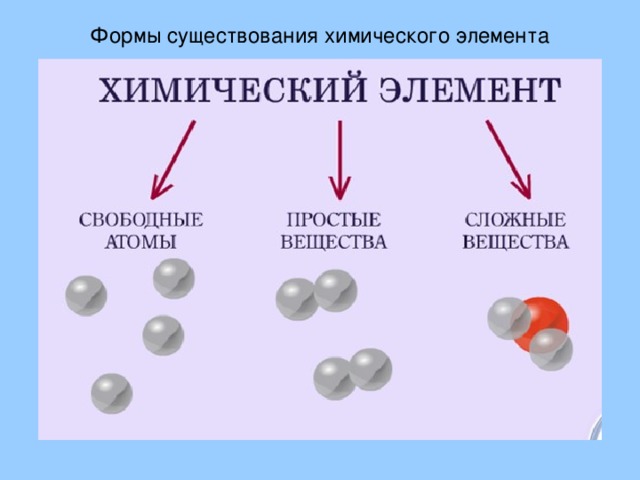
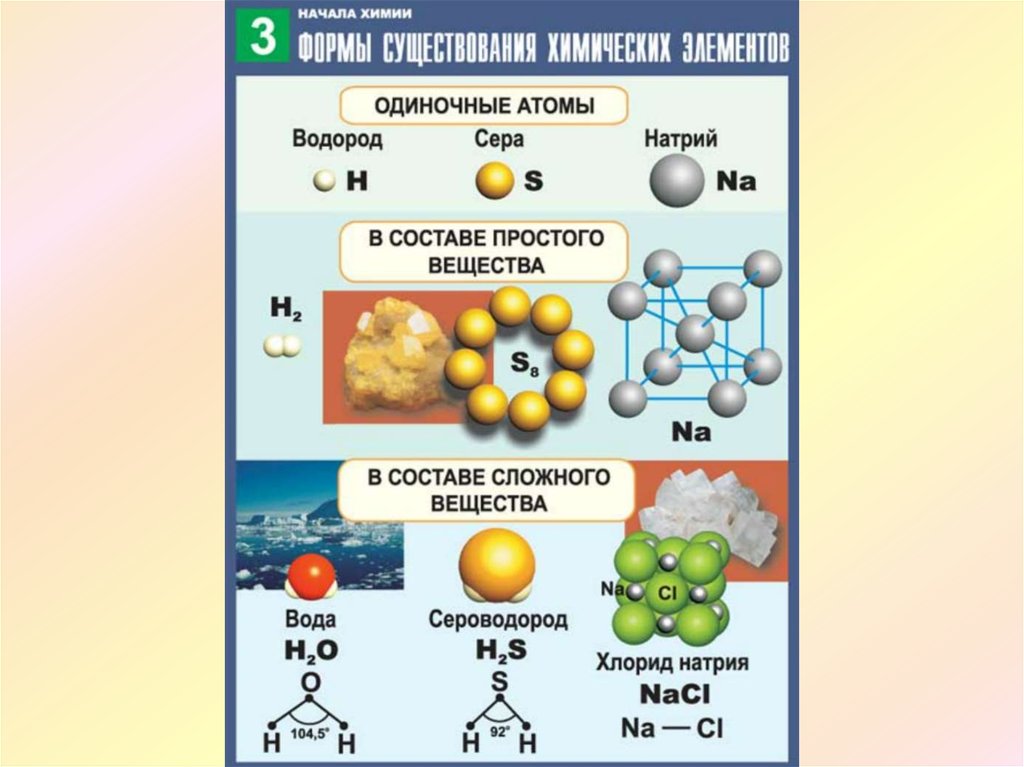
Известно три формы существования химического элемента: свободные атомы, в составе простых веществ, в составе сложных веществ.
Со свободными атомами как формой существования химического элемента мы знакомы. Основная характеристика ХЭ – заряд ядра атома. Дайте характеристику ХЭ лития и фтора по плану на с 36.
Состав простых и сложных веществ выражают при помощи химических формул.
Простые вещества – вещества, образованные атомами одного химического элемента.
Ne, Ar, O2, Br2, I2, O3, P4, S8 (Одноатомные простые вещества – молекулы инертных газов; двухатомные – молекулы водорода, кислорода, хлора, брома, иода; трехатомные – озона, четырехатомные – фосфора и т.д.)
Названия простых веществ часто совпадают с названием ХЭ, атомами которых они образованы.
Простые вещества характеризуются определенными физическими свойствами (агрегатным состоянием, цветом, плотностью).
Сложные вещества (химические соединения) – это вещества, образованные атомами разных химических элементов, связанных между собой.
H2O, C6H12O6, NaCl, KMnO4, CO2, CO (вода, сахароза, хлорид натрия — поваренная соль, перманганат калия – марганцовка, углекислый газ, угарный газ).
Сложные вещества характеризуются определенными физическими свойствами.
III. Закрепление изученного.
· Перечислите формы существования химического элемента.
· Разграничьте понятия свободные атомы и простые вещества.
· В чем различие простых и сложных веществ.
Лабораторный опыт
Распознавание простых и сложных веществ.
— инструктаж.
— выполнение опыта.
— обсуждение результата.
— оформление работы.
ВЫВОД.
Каковы формы существования химического элемента?
Возможно ли по названию вещества определить его принадлежность к простым или сложным?
Возможно ли по химической формуле определить принадлежность вещества к сложным или простым?
Y.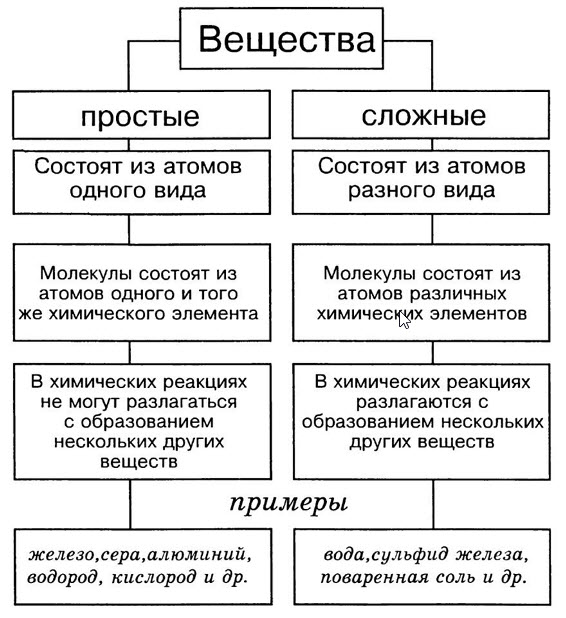 Домашнее задание (инструктаж).
Домашнее задание (инструктаж).
элементов и соединений | Техасский шлюз
Engage: Mystery MessageExplore: Знакомство с вамиОбъяснение 1: Руководство по предвидениюОбъяснение 2: Элементы и соединенияОбъяснение 3: Характеристики элементов и соединенийРазработка 1a: Расшифровка символов и формулРазработка 1b: Расшифровка символов и формул Разработка 2: Расшифровка таблицы и периодической таблицыОценка: Оцените свои знания !Заметки для учителя
Можете ли вы интерпретировать приведенное ниже сообщение?
Вам нужна помощь? Следующий инструмент должен помочь вам расшифровать загадочное сообщение.
Запишите расшифрованное сообщение в свой блокнот. Или распечатайте копию раздаточного материала «Загадочное сообщение», чтобы выполнить расшифровку. Раздаточный материал находится в Related Items. Познакомьтесь с элементами и узнайте о соединениях!
Щелкните поле видео ниже, чтобы посмотреть видео.
Пока вы смотрите видео, слушайте
- Описание/характеристики элементов
- Описание/характеристики соединений
- Примеры элементов
- Примеры соединений
Запишите свои выводы в свой научный журнал.
Источник
Пришло время узнать больше об элементах и соединениях. Но сначала давайте посмотрим на то, что вы, возможно, уже знаете.
Распечатайте копию «Руководства по предупреждению», найденного в
Когда элементы химически объединяются в соединения, их трудно отделить от соединения.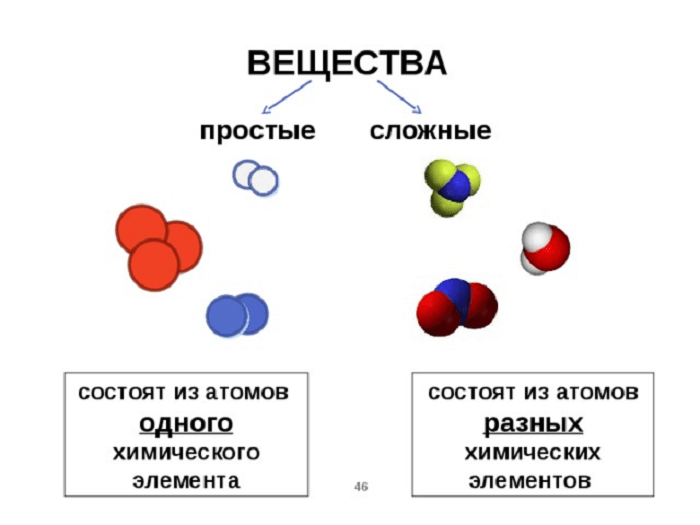 Напомним, что смеси — это вещества, физически соединенные вместе и обычно легко разделяемые физическими средствами.
Напомним, что смеси — это вещества, физически соединенные вместе и обычно легко разделяемые физическими средствами.
Щелкните между двумя темными линиями ниже, чтобы узнать больше о различиях между элементами и соединениями. Не забудьте добавить заметки в свой журнал!
После просмотра видео прокрутите вниз, чтобы получить инструкции по заполнению «Руководства по ожиданиям».
Источник
Видео любезно предоставлено Марком Дроллингером, Simple Science
Еще раз просмотрите «Руководство по прогнозированию», перечитав каждое утверждение и обведя A для согласия или D для несогласия в правой колонке с пометкой После обучения.
Ключ ответа можно найти в Related Items .
Можете ли вы определить характеристики элемента и соединения?
Выполните следующее задание, определяя каждую фразу как описывающую либо элемент, либо соединение. Чтобы повторно пройти тест, перезагрузите страницу и выберите Нет , когда появится диалоговое окно Возобновить тест .
Периодическая таблица — это инструмент, который помогает ученым определять элементы, содержащиеся в соединениях. Вы можете думать о Периодической таблице как о декодере, подобном тому, который использовался в Задействовать .
Нажмите на белую видеорамку ниже, чтобы узнать, как использовать периодическую таблицу в качестве декодера для элементов и соединений. Вам предлагается остановить видео, чтобы решить проблемы и воспроизвести информацию.
Таблица Менделеева необходима для обоих видео. Найдите в разделе Related Items периодическую таблицу, которую можно загрузить.
Нажмите ниже, чтобы начать задание «Расшифровка соединений». Чтобы повторно пройти тест, перезагрузите страницу и выберите 9.0013 Нет при появлении диалогового окна Возобновление теста . Для работы нужна периодическая таблица. Найдите в Related Item s загружаемую периодическую таблицу
Чем периодическая таблица похожа на инструмент декодирования, который вы использовали в Engage?
Пройдите тест, чтобы определить свое обучение.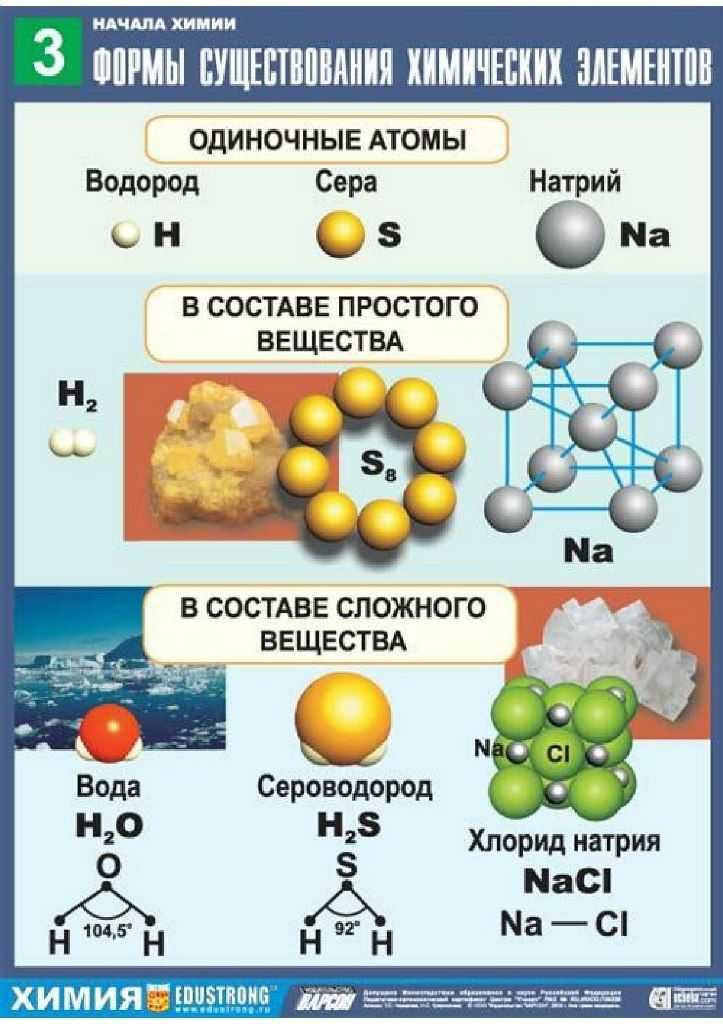
На этом уроке учащиеся различают элементы и соединения на самом базовом уровне. Студенты узнают основные характеристики элементов и соединений. Хотя учащиеся знакомятся с молекулами и атомами в видеороликах, эти термины не рассматриваются в этом уроке. Молекула вводится в ТЭКС (7)(6)(С) седьмого класса, а атомы и индексы вводятся в ТЭКС (8)(5)(D) восьмого класса. Избегайте ошибочного представления о том, что только соединения представлены химическими формулами. Элементарные молекулы, такие как O 2 , Cl 2 , O 3 и т. д. также представлены химическими формулами. Поскольку этот TEKS рассматривает элементы и соединения на самом базовом уровне, неуместно (и сбивает с толку учащихся) включение этого понятия в большинство учащихся шестого класса.
| Цикл уроков | Учебные задания и примечания |
|---|---|
Задействовать Загадочное сообщение | Учащиеся расшифровывают сообщение.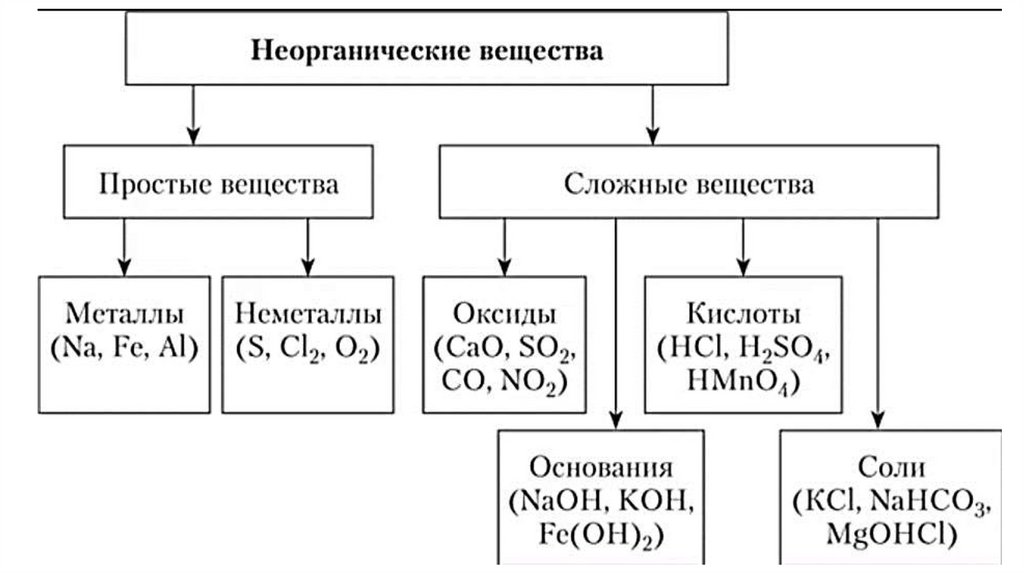 Позже на уроке учащиеся будут сравнивать инструмент декодера с периодической таблицей. Расшифрованное сообщение должно выглядеть так: «Буквы относятся к словам так же, как элементы относятся к соединениям». Учащимся будет предложено объяснить эту аналогию позже в ходе урока. На протяжении этого урока Периодическая таблица показана как инструмент, помогающий «расшифровывать» соединения и элементы. Позже на уроке учащиеся будут сравнивать инструмент декодера с периодической таблицей. Расшифрованное сообщение должно выглядеть так: «Буквы относятся к словам так же, как элементы относятся к соединениям». Учащимся будет предложено объяснить эту аналогию позже в ходе урока. На протяжении этого урока Периодическая таблица показана как инструмент, помогающий «расшифровывать» соединения и элементы. |
Исследовать Знакомство с вами | Студенты знакомятся с элементами и соединениями и получают примеры с помощью видеоролика «Они должны быть великанами — знакомьтесь с элементами». |
Объяснить 1 Руководство по прогнозированию | Учащиеся начинают Объяснение, заполнив раздел Перед изучением Руководства по прогнозированию. Руководство по прогнозированию помогает учащимся сосредоточиться на важных различиях между элементами и соединениями. |
Объяснить 2 Элементы и соединения | Учащиеся смотрят видеоролик, в котором объясняются различия между элементами и соединениями. Учителям предлагается помочь учащимся понять разницу между соединениями (химически объединенными) и смесями (физически объединенными). Смеси входят в ТЭКС 3, 4 и 5 класса. Учащимся вводятся термины атомы и молекулы. Студентов следует поощрять делать записи в своих дневниках. Учащиеся повторно посещают руководство по ожиданиям и выполняют После обучения столбец. Руководство по ожиданиям и ключ ответа доступны в Related Items. Учителям предлагается помочь учащимся понять разницу между соединениями (химически объединенными) и смесями (физически объединенными). Смеси входят в ТЭКС 3, 4 и 5 класса. Учащимся вводятся термины атомы и молекулы. Студентов следует поощрять делать записи в своих дневниках. Учащиеся повторно посещают руководство по ожиданиям и выполняют После обучения столбец. Руководство по ожиданиям и ключ ответа доступны в Related Items. |
Объяснить 3 Характеристики элементов и соединений | Учащиеся работают с интерактивной карточной сортировкой, элементами сортировки и составными дескрипторами. |
Разработка 1 Расшифровка символов и химических формул | Учащиеся смотрят видео, в котором моделируется расшифровка элементов, встречающихся в соединениях, и рассказывается об использовании моделей для представления элементов и соединений. Учащимся показывают, что нижние индексы представляют собой атомы каждого элемента, но это не является предметом урока, и при этом учащиеся не должны определять количество атомов в соединении в шестом классе.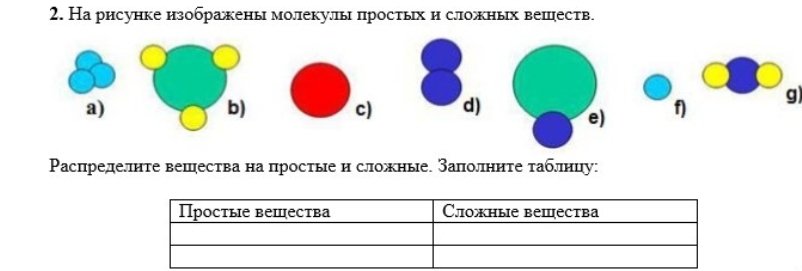 После просмотра видео учащиеся выполняют интерактивное задание, чтобы определить количество элементов в различных соединениях и идентифицировать элементы, содержащиеся в соединении. Студенты должны использовать свою периодическую таблицу как во время видео, так и во время занятий. После просмотра видео учащиеся выполняют интерактивное задание, чтобы определить количество элементов в различных соединениях и идентифицировать элементы, содержащиеся в соединении. Студенты должны использовать свою периодическую таблицу как во время видео, так и во время занятий. |
Разработка 2 Таблица декодирования и периодическая таблица | Учащихся просят вспомнить задание Engage и связать его с периодической таблицей. Студенты должны учитывать, что соединения состоят из множества элементов, точно так же, как слова состоят из букв. Есть простые и сложные слова, так же как есть простые и сложные соединения. Количество букв в словах меняется, как и количество элементов в сложных словах. Буквы, найденные в слове, можно переставить, чтобы образовать новое слово. То же самое верно для элементов и соединений. |
Оценить Оценка вашего обучения | Учащиеся оценивают свое обучение, используя несколько вопросов с несколькими вариантами ответов и диаграмму Венна. |
- Печать
- Поделиться
Примеры химических элементов и простых веществ. Простые и сложные вещества
Билет 1:
Химия — наука о веществах, их строении и свойствах, а также о превращении одного вещества в другое. Элемент — это атом определенного типа с одинаковым положительным зарядом ядра. Химический элемент существует в виде трех форм: 1) одиночного атома; 2) простые вещества; 3) сложные вещества или химические соединения. Вещества, образованные одним химическим элементом, называются простыми. Вещества, образованные несколькими химическими элементами, называются сложными
Билет 2:
Жизнь человека зависит от химии — процессы расщепления пищи в организме представляют собой непрерывные химические реакции. Ну а все, что мы носим, на чем ездим, на что так или иначе смотрим, проходит определенные этапы химической обработки – будь то покраска, изготовление различных сплавов и так далее. Химия играет большую роль в промышленности. И тяжелый, и легкий. Например: без химии человек не смог бы получить лекарства и некоторые продукты питания ненатурального происхождения (уксус). По большому счету – химия внутри и вокруг нас. Химическая промышленность – одна из самых динамично развивающихся отраслей. Она относится к отраслям, составляющим основу современного научно-технического прогресса (пластмассы, химические волокна, красители, фармацевтика, моющие и косметические средства). В результате хозяйственной деятельности человека изменяется газовый состав и запыленность нижних слоев атмосферы. В результате это может вызвать длительное воздействие на человека: хронические воспалительные заболевания различных органов, изменения нервной системы, влияние на внутриутробное развитие плода, приводящее к различным аномалиям у новорожденных. Экологические проблемы могут быть решены только при стабилизации экономической ситуации и создании такого экономического механизма природопользования, когда плата за загрязнение окружающей среды будет соответствовать стоимости ее полной очистки.
Химия играет большую роль в промышленности. И тяжелый, и легкий. Например: без химии человек не смог бы получить лекарства и некоторые продукты питания ненатурального происхождения (уксус). По большому счету – химия внутри и вокруг нас. Химическая промышленность – одна из самых динамично развивающихся отраслей. Она относится к отраслям, составляющим основу современного научно-технического прогресса (пластмассы, химические волокна, красители, фармацевтика, моющие и косметические средства). В результате хозяйственной деятельности человека изменяется газовый состав и запыленность нижних слоев атмосферы. В результате это может вызвать длительное воздействие на человека: хронические воспалительные заболевания различных органов, изменения нервной системы, влияние на внутриутробное развитие плода, приводящее к различным аномалиям у новорожденных. Экологические проблемы могут быть решены только при стабилизации экономической ситуации и создании такого экономического механизма природопользования, когда плата за загрязнение окружающей среды будет соответствовать стоимости ее полной очистки.
Билет 3:
Самый известный:
Дмитрий Иванович Менделеев, разумеется, со своей известной периодической системой химических элементов.
КУЧЕРОВ МИХАИЛ ГРИГОРЬЕВИЧ — русский химик-органик, открывший реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений, в частности превращение ацетилена в ацетальдегид в присутствии солей ртути.
КОНОВАЛОВ МИХАИЛ ИВАНОВИЧ — русский химик-органик, открыл нитрующее действие слабого раствора азотной кислоты на предельные углеводороды, разработал методы выделения и очистки нафтенов.
ЛЕБЕДЕВ СЕРГЕЙ ВАСИЛЬЕВИЧ — русский химик, впервые получивший образец синтетического бутадиенового каучука, получил синтетический каучук полимеризацией бутадиена под действием металлического натрия. Благодаря Лебедеву с 1932 года в нашей стране начала создаваться отечественная промышленность синтетического каучука.
Билет 4: Тип элемента, какой элемент, информация о нем (количество электронных слоев, количество электронов на внешнем уровне, степень окисления, количество протонов/нейтронов/электронов, относительная масса, группа элементов, конфигурация внешнего слоя) , реакция — взаимодействие элементов, веществ, формулы — вещества и классы веществ.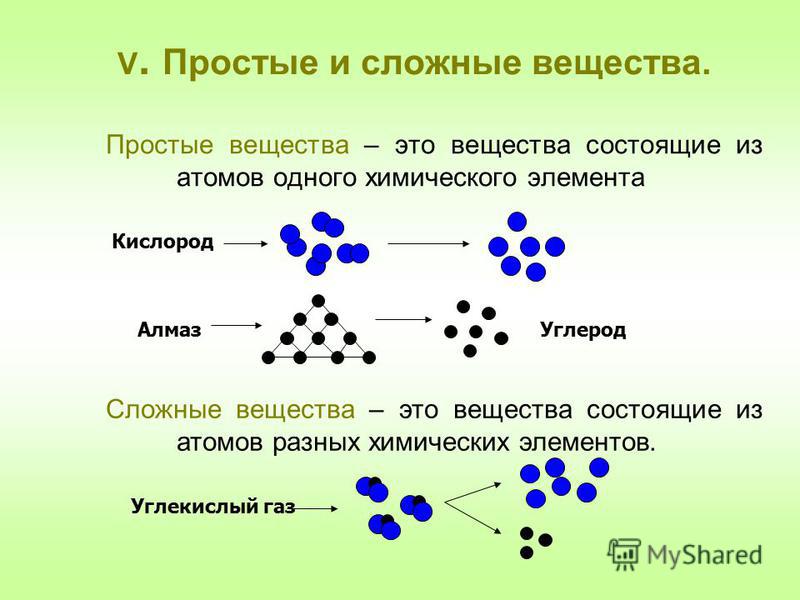
Билет 5: Атом состоит из атомного ядра и частиц (электронов, протонов, нейтронов), расположенных на периферии. Протоны и нейтроны составляют ядро атома, несущее почти всю массу атома. Электроны составляют электронную оболочку атома, которая делится на энергетические уровни (1,2,3 и т. д.), уровни делятся на подуровни (обозначаются буквами s, p, d, f). Подуровни состоят из атомных орбиталей, то есть областей пространства, где, вероятно, находятся электроны. Орбитали обозначаются как 1s (орбиталь первого уровня, s-подуровень) Заполнение атомных орбиталей происходит в соответствии с тремя условиями: 1) Принцип минимума энергии
2) Правило запрета, ну или принцип Паули
3) Принцип максимальной кратности, правило Хунда.
Изотопы — это атомы одного и того же элемента, различающиеся числом нейтронов в ядре.
Так например, самым ярким примером могут быть изотопы водорода:
1H — протий с одним протоном в ядре и 1 электроном в оболочке
2H — дейтерий с одним протоном и одним нейтроном в ядре и одним электроном в оболочке
3H — тритий с одним протоном и двумя нейтронами в ядре и одним электроном в оболочке
Билет 6:
1. H)1
H)1
2.He)2
3. Li)2)1
4. Be)2)2
5.B)2)3
6. C)2)2
7.N)2)5
8. O)2)6
9.F)2)7
10.Ne)2)8
11.Na)2)8)1
12.Mg)2)8) 2
13. Al)2)8)3
14.Si)2)8)4
15. P)2)8)5
16.S)2)8)6
17.Cl)2)8) 7
18. Ar)2)8)8
19. K)2)8)8)1
20. Ca)2)8)8)8
На внешнем уровне, если 2 или 8 электронов — завершено, а если другой номер — не заполняется.
Билет 8:
Ионная связь: типичный металл + типичный неметалл. Пример: NaCl, AlBr3. Ковалентная полярность: неметалл + неметалл (разные). Пример: h3O, HCl. Ковалентная неполярность это: неметалл + неметалл (идентично). Пример: h3, Cl2, O2, O3. Металлический, когда металл + металл Li, Na, K
Билет 11:
Соединения состоят из органических и неорганических веществ.
Неорганические вещества: оксиды, гидроксиды, соли
органические вещества: кислоты, основания.
Ну, дружище, чем мог — помог.)
Окружающая среда материальна. Материя бывает двух видов: вещество и поле. Предметом химии является вещество (в том числе влияние на вещество различных полей — звуковых, магнитных, электромагнитных и др.)
Предметом химии является вещество (в том числе влияние на вещество различных полей — звуковых, магнитных, электромагнитных и др.)
Вещество — все, что имеет массу покоя (т. е. характеризуется наличием массы при он не движется) . Итак, хотя масса покоя одного электрона (масса неподвижного электрона) очень мала — около 10 -27 г, но даже один электрон является веществом.
Вещество бывает в трех агрегатных состояниях: газообразном, жидком и твердом. Есть еще одно состояние вещества — плазма (например, плазма есть в грозе и шаровой молнии), но химия плазмы в школьном курсе почти не рассматривается.
Вещества могут быть чистыми, очень чистыми (необходимыми, например, для создания волоконной оптики), могут содержать заметные количества примесей, могут быть смесями.
Все вещества состоят из крошечных частиц, называемых атомами. Вещества, состоящие из однотипных атомов (из атомов одного элемента), называемых простыми (например, уголь, кислород, азот, серебро и др. ). Вещества, содержащие связанные между собой атомы различных элементов, называются сложными.
). Вещества, содержащие связанные между собой атомы различных элементов, называются сложными.
Если вещество (например, в воздухе) содержит два или более простых вещества, причем их атомы не связаны между собой, то оно называется не сложным, а смесью простых веществ. Количество простых веществ относительно невелико (около пятисот), а количество сложных веществ огромно. На сегодняшний день известны десятки миллионов различных сложных веществ.
Вещества способны взаимодействовать друг с другом, и возникают новые вещества. Такие превращения называются химическими . Например, простое вещество уголь взаимодействует (химики говорят — вступает в реакцию) с другим простым веществом — кислородом, в результате чего образуется сложное вещество — углекислый газ, в котором атомы углерода и кислорода соединены между собой. Такие превращения одного вещества в другое называются химическими. Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которой состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Химия изучает превращение одного вещества в другое. Задача химии состоит в том, чтобы выяснить, с какими веществами может взаимодействовать (реагировать) то или иное вещество в данных условиях, что при этом образуется. Кроме того, важно выяснить, при каких условиях может протекать то или иное превращение и можно получить нужное вещество.
Каждое вещество характеризуется набором физических и химических свойств. Физические свойства — это свойства, которые можно охарактеризовать с помощью физических инструментов. . Например, с помощью термометра можно определить температуры плавления и кипения воды. Физические методы могут характеризовать способность вещества проводить электричество, определять плотность вещества, его твердость и т. д. При физических процессах вещества остаются неизменными по своему составу.
Физические свойства веществ делятся на исчисляемые (те, которые можно охарактеризовать с помощью определенных физических приборов числом, например, указывающим плотность, температуры плавления и кипения, растворимость в воде и т. п.) и неисчислимые (те, которые нельзя охарактеризовать числом или очень сложными, такими как цвет, запах, вкус и т. д.).
п.) и неисчислимые (те, которые нельзя охарактеризовать числом или очень сложными, такими как цвет, запах, вкус и т. д.).
Химические свойства вещества представляют собой совокупность сведений о том, с какими другими веществами и при каких условиях данное вещество вступает в химические взаимодействия. . Важнейшей задачей химии является выявление химических свойств веществ.
В химических превращениях участвуют мельчайшие частицы веществ — атомы. При химических превращениях из одного вещества образуется другое вещество, а исходные вещества исчезают, а вместо них образуются новые вещества (продукты реакции). А атомов при сохраняются все химических превращений . Происходит их перестройка, при химических превращениях разрушаются старые связи между атомами и возникают новые связи.
Количество различных веществ огромно (и каждое из них имеет свой набор физических и химических свойств). В окружающем нас материальном мире относительно немного атомов, отличающихся друг от друга своими важнейшими характеристиками, — около сотни. Каждый тип атома имеет свой химический элемент. Химический элемент представляет собой совокупность атомов с одинаковыми или близкими характеристиками. . В природе встречается около 90 различных химических элементов. На сегодняшний день физики научились создавать новые типы атомов, отсутствующие на Земле. Такие атомы (и, соответственно, такие химические элементы) называются искусственными (по-английски — man-made elements). На сегодняшний день синтезировано более двух десятков искусственно полученных элементов.
Каждый тип атома имеет свой химический элемент. Химический элемент представляет собой совокупность атомов с одинаковыми или близкими характеристиками. . В природе встречается около 90 различных химических элементов. На сегодняшний день физики научились создавать новые типы атомов, отсутствующие на Земле. Такие атомы (и, соответственно, такие химические элементы) называются искусственными (по-английски — man-made elements). На сегодняшний день синтезировано более двух десятков искусственно полученных элементов.
Каждый элемент имеет латинское имя и одно- или двухбуквенный символ. Четких правил произношения символов химических элементов в русскоязычной химической литературе нет. Одни произносят его так: называют элемент по-русски (символы натрия, магния и др.), другие — латинскими буквами (символы углерода, фосфора, серы), третьи — как звучит название элемента на латыни (железо, серебро, золото, ртуть). Символ водородного элемента Н принято произносить так же, как эта буква произносится во французском языке.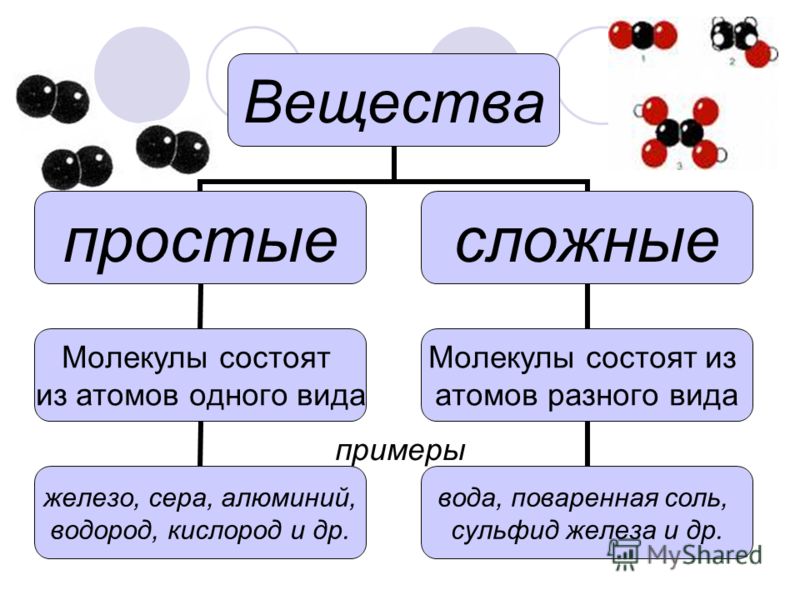
Сравнение наиболее важных характеристик химических элементов и простых веществ приведено в таблице ниже. Одному элементу может соответствовать несколько простых веществ (явление аллотропии: углерод, кислород и др.), а может и одному (аргон и другие инертные газы).
Основное различие между ними заключается в их составе. Итак, простые вещества включают в себя атомы одного элемента. Их (простых веществ) кристаллы можно синтезировать в лаборатории, а иногда и в домашних условиях. Однако часто необходимо создать определенные условия для хранения полученных кристаллов.
Существует пять классов, на которые делятся простые вещества: металлы, полуметаллы, неметаллы, интерметаллиды и галогены (в природе не встречаются). Они могут быть представлены атомарными (Ar, He) или молекулярными (O2, h3, O3) газами.
Примером является простое вещество кислород. В него входят молекулы, состоящие из двух атомов элемента Кислорода. Или, например, вещество железо состоит из кристаллов, включающих только атомы элемента Железо. Исторически принято называть простое вещество по имени элемента, атомы которого входят в его состав. Строение этих соединений может быть молекулярным и немолекулярным.
Исторически принято называть простое вещество по имени элемента, атомы которого входят в его состав. Строение этих соединений может быть молекулярным и немолекулярным.
Соединения включают атомы разного вида и при разложении могут образовать два (или более) соединения. Например, вода распадается на кислород и водород. Однако не каждое соединение можно разложить на простые вещества. Например, сульфид железа, образованный атомами серы и железа, не поддается расщеплению. В этом случае для доказательства того, что соединение является сложным и включает в себя разнородные атомы, применяется принцип обратной реакции. Другими словами, сульфид железа получают из исходных компонентов.
Простые вещества – это формы химических элементов, существующие в свободной форме. Сегодня науке известно более четырехсот видов этих элементов.
В отличие от сложных веществ, простые вещества нельзя получить из других простых веществ. Они также не могут быть разложены на другие соединения.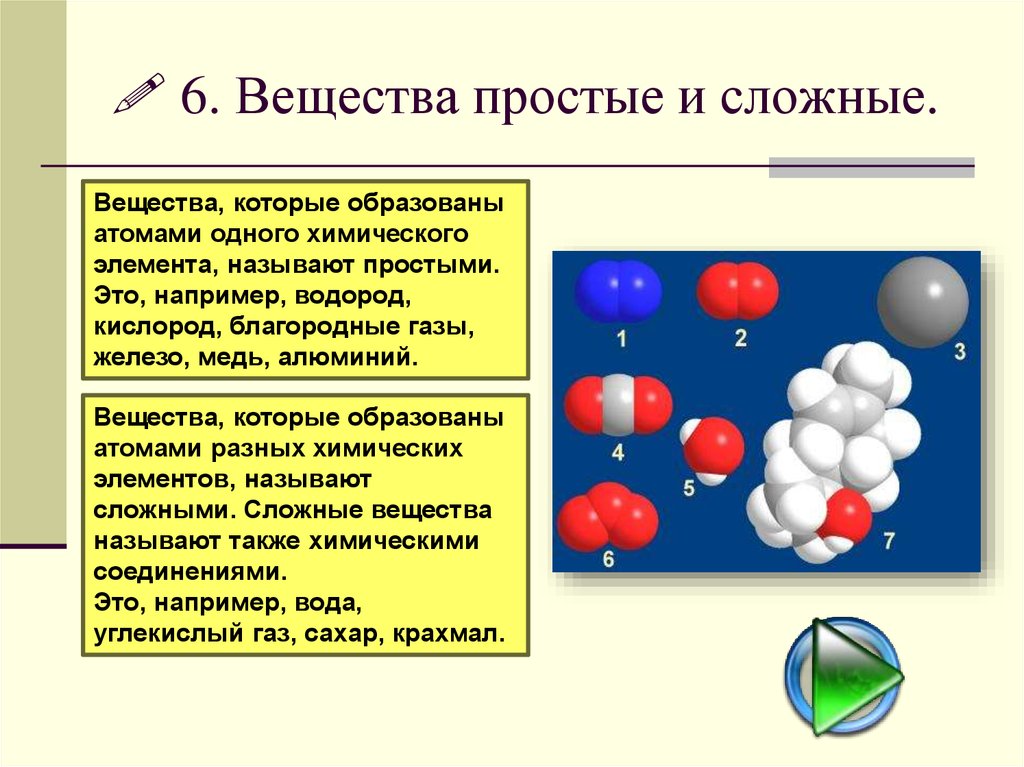
Все аллотропные модификации имеют свойство переходить друг в друга. разные виды простых веществ, образованных одним химическим элементом, могут иметь разную и разную степень химической активности. Так, например, кислород проявляет меньшую активность, чем озон, а температура плавления фуллерена, например, ниже, чем у алмаза.
При нормальных условиях для одиннадцати элементов простыми веществами будут газы (Ar, Xe, Rn, N, H, Ne, O, F, Kr, Cl, He,), для двух жидкостей (Br, Hg), а для остальных элементов — твердые тела.
При температурах, близких к комнатной, пять металлов переходят в жидкое или полужидкое состояние. Это связано с тем, что их температура плавления почти равна Т, ртуть и рубидий плавятся при 39 градусах, франций — при 27, цезий — при 28, а галлий при 30 градусах.
Следует отметить, что не следует смешивать понятия «химический элемент», «атом», «простое вещество». Так, например, атом имеет определенное, конкретное значение и реально существует.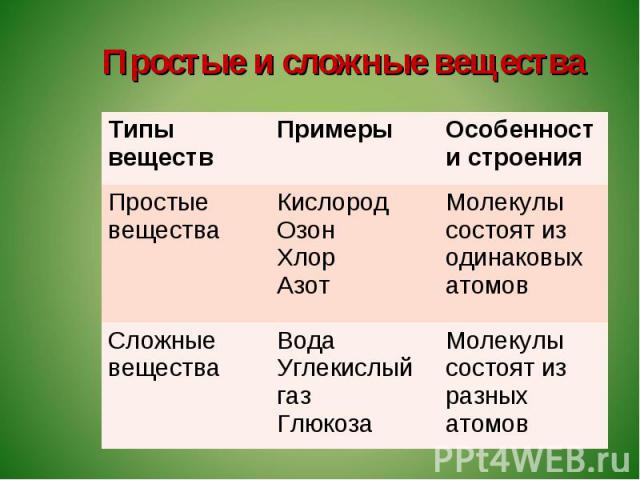 Определение «химический элемент» вообще абстрактно, собирательно. В природе элементы присутствуют в виде свободных или химически связанных атомов. В то же время характеристики простых веществ (наборов частиц) и химических элементов (обособленных атомов определенного вида) имеют свои особенности.
Определение «химический элемент» вообще абстрактно, собирательно. В природе элементы присутствуют в виде свободных или химически связанных атомов. В то же время характеристики простых веществ (наборов частиц) и химических элементов (обособленных атомов определенного вида) имеют свои особенности.
Все вещества, о которых мы говорим в школьном курсе химии, принято делить на простые и сложные. Простые вещества – это вещества, молекулы которых содержат атомы одного и того же элемента. Атомарный кислород (О), молекулярный кислород (О2) или просто кислород, озон (О3), графит, алмаз являются примерами простых веществ, образующих химические элементы кислород и углерод. Соединения делятся на органические и неорганические. Среди неорганических веществ в первую очередь выделяют следующие четыре класса: оксиды (или оксиды), кислоты (кислородные и бескислородные), основания (водорастворимые основания называются щелочами) и соли. Соединения неметаллов (исключая кислород и водород) в эти четыре класса не входят, будем называть их условно «и другие сложные вещества».
Простые вещества обычно делят на металлы, неметаллы и инертные газы. К металлам относятся все химические элементы, у которых заполняются d- и f-подуровни, это элементы в 4-м периоде: Sc — Zn, в 5-м периоде: Y — Cd, в 6-м периоде: La — Hg, Ce — Lu, в 7 периоде Ac — Th — Lr. Если теперь провести линию от Be к At среди остальных элементов, то слева и снизу от нее будут располагаться металлы, а справа и сверху — неметаллы. В группе 8 Периодической системы расположены инертные газы. Элементы, расположенные по диагонали: Al, Ge, Sb, Po (и некоторые др., например, Zn) в свободном состоянии обладают свойствами металлов, а гидроксиды обладают свойствами как оснований, так и кислот, т. е. являются амфотерными гидроксидами. Поэтому эти элементы можно считать металлами-неметаллами, занимающими промежуточное положение между металлами и неметаллами. Таким образом, классификация химических элементов зависит от того, какими свойствами будут обладать их гидроксиды: основные — значит металл, кислые — неметалл, и те и другие (в зависимости от условий) — металл-неметалл.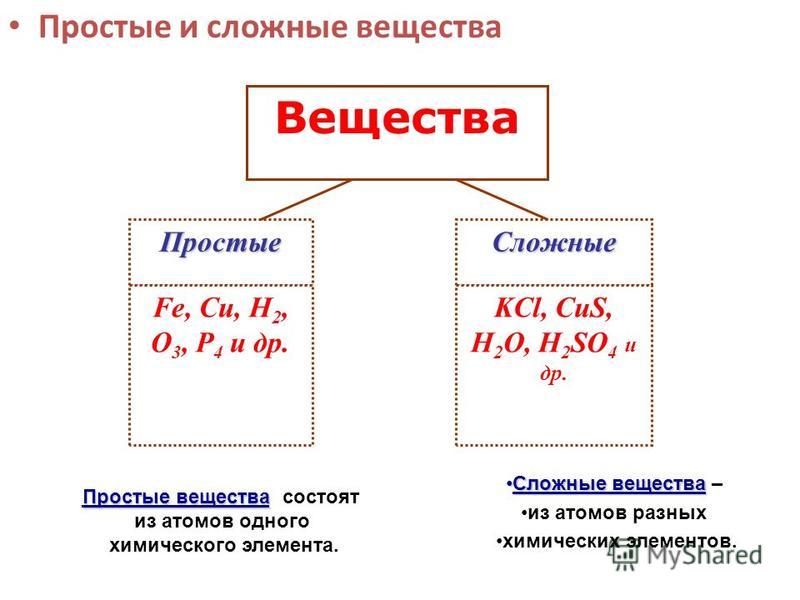



 Не разрушая молекул? Почему?
Не разрушая молекул? Почему?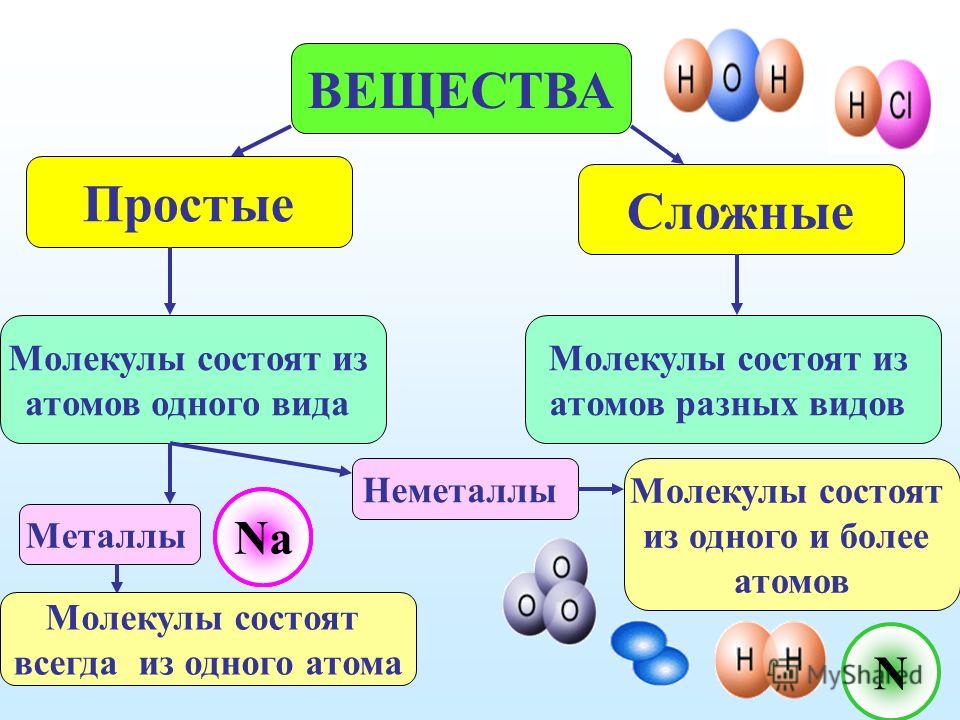 Вырабатывать умения отличать простые вещества от сложных, основываясь на их химических формулах. Совершенствовать практическкие умения обращения с химическими реактивами.
Вырабатывать умения отличать простые вещества от сложных, основываясь на их химических формулах. Совершенствовать практическкие умения обращения с химическими реактивами.