Формула по химии 8 класс – Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
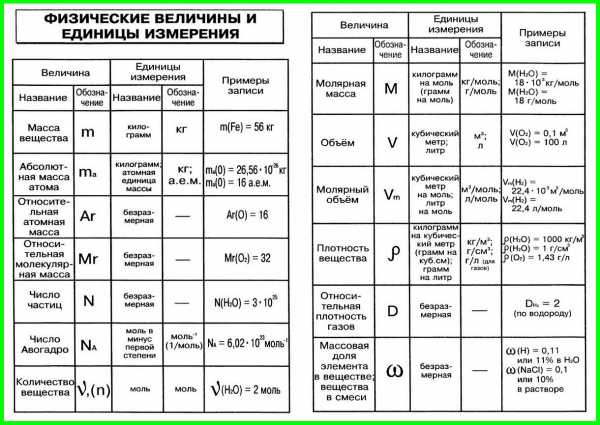
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | кг/моль, г/моль | |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля | Безразмерная | |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | Безразмерная |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|
2. Соотношения между единицами физических величин

3. Химические формулы в 8 классе
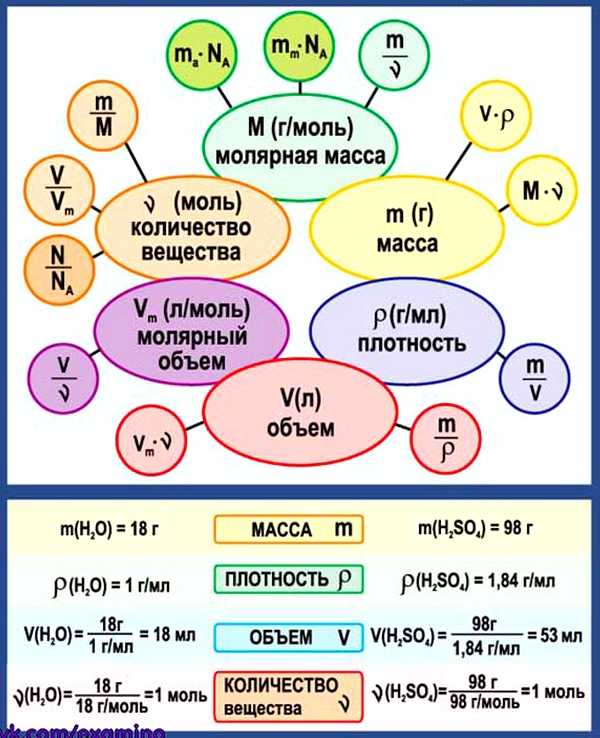
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
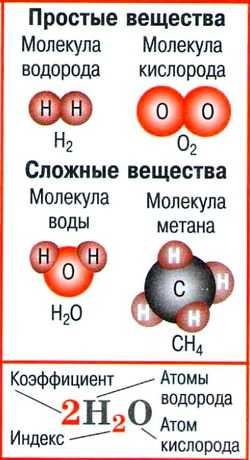
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na = 6*1023 моль-1) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.

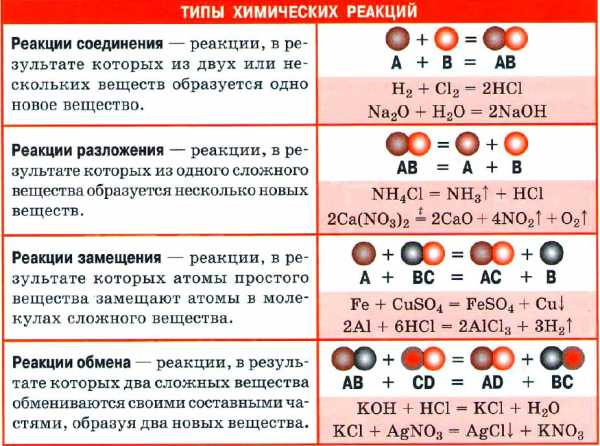
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
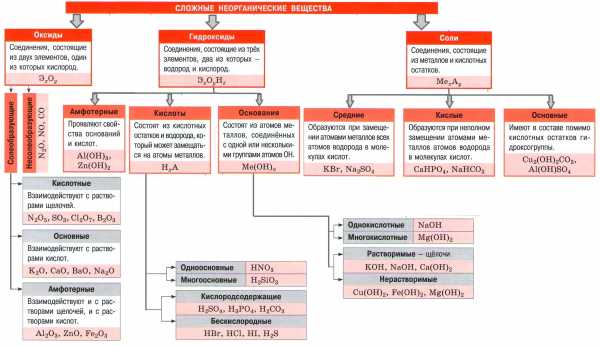
Важнейшие классы неорганических веществ
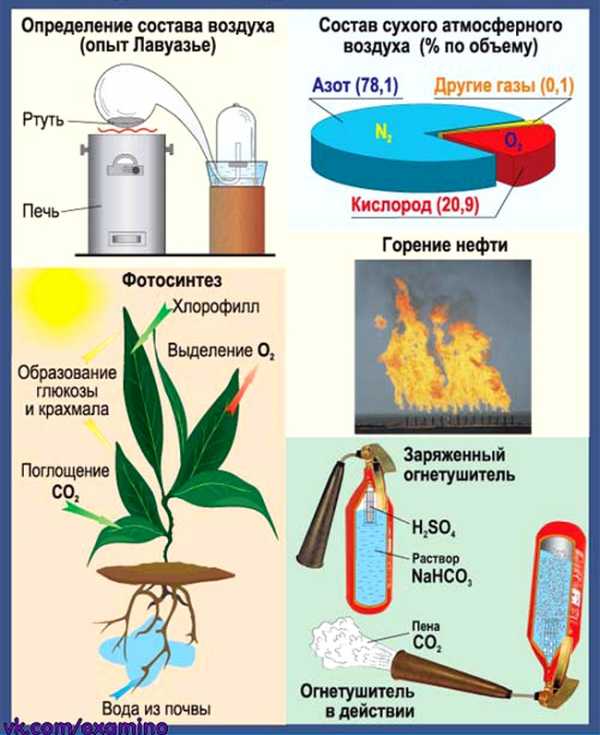
Воздух. Кислород. Горение
Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
Химия 8 класс. Все формулы и определения
4.5 (89.14%) 81 vote[s]uchitel.pro
Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 413 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\Mr
n=V\22.4 (л\моль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:

Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
_________________________________________________________________________________________________
Еще вам могут понадобиться:
- в ЕГЭ это вопрос А27
- А28
- задачи части С — 4 и 5
Категории: |
Обсуждение: «Основные формулы для решения задач по химии»
distant-lessons.ru
Памятка по химии «Формулы для решения задач» (8 класс)
Формулы для решения задач по химии.
1.Вычисление относительной молекулярной массы вещества:
Mr (H2SO4)=Ar(H)∙2+Ar(S)+Ar(O)∙4=98
2.Вычисление массовой доли элемента в веществе:
3.Выведение молекулярной формулы вещества:
4.Вычисление количества вещества:
а.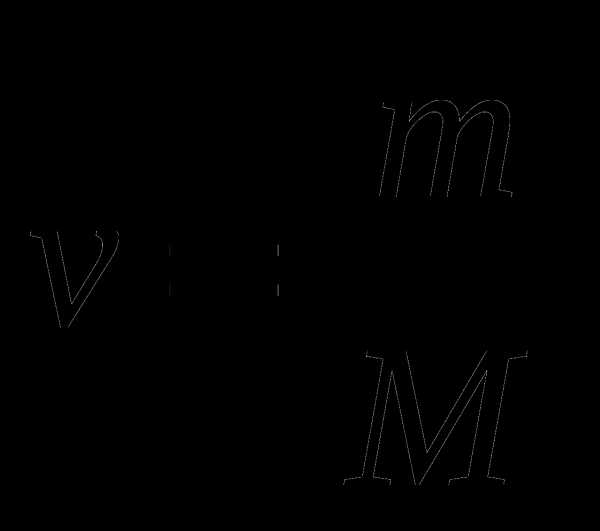
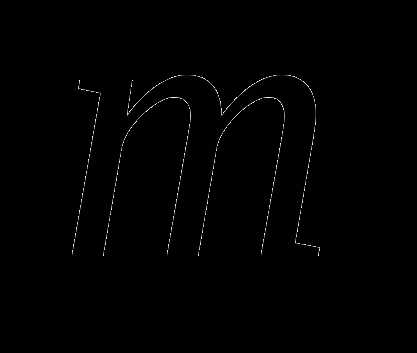 -масса (грамм)
-масса (грамм)
 -молярная масса (грамм/моль)
-молярная масса (грамм/моль)
б. только для газообразных веществ при нормальных условиях ( 00 С, 750 мм. рт. ст.)

 объем (литр)
объем (литр)
 -молярный объем (литр/моль)
-молярный объем (литр/моль)
в. 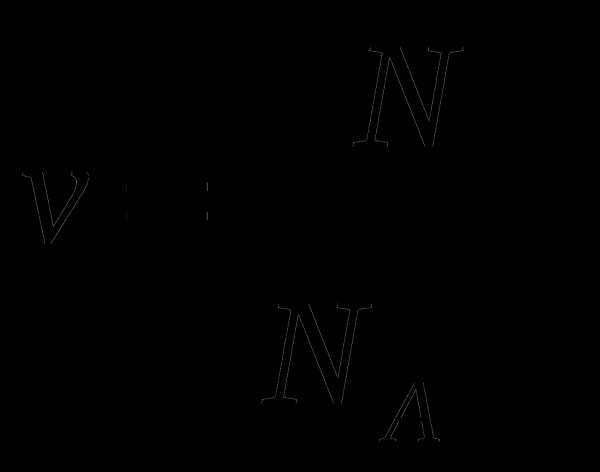
 -число частиц
-число частиц
 — постоянная Авогадро 6 ∙ 1023
— постоянная Авогадро 6 ∙ 1023
5.Массовая доля растворенного вещества:


6.Вычисление массы:

7.Вычисление относительной плотности газов:
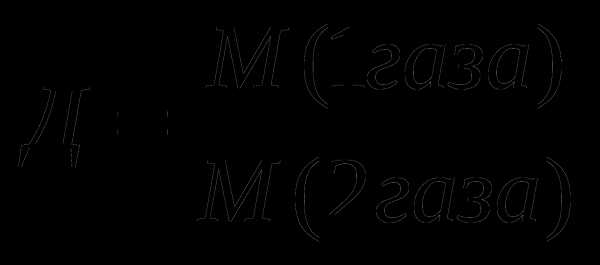
8.Вычисление выхода продукта (%) от теоретически возможного:
infourok.ru
Формулы по химии 8-9 класс
Соотношение некоторых физико-химических величин и их единиц
Величина, её обозначение
Единицы величины
Основная
В 1000 раз большая
В 1000 раз меньшая
Масса, m
г
кг
мг
Количество вещества, n
моль
кмоль
ммоль
Молярная масса, M
г/моль
кг/кмоль
мг/ммоль
M=Mr
Число частиц, N
Молекул, атомов, ионов
Число молекул в единице количества вещества – постоянная Авагадро, NA
6▪1023(в 1 моль) молекул/моль
6▪1026 (в 1 моль) молекул/кмоль
6▪1020 (в 1 моль) молекул/ммоль
Объём газа, V
л (дм3)
м3
мл (мм3)
Молярный объём газа, Vm
л/моль (22,4 л/моль при н.у.)
м3/кмоль (22,4 м3/кмоль при н.у.)
мл/ммоль (22,4 мл/ммоль при н.у.)
Массовая доля, ω
Объёмная доля, φ
Массовая доля Элемента, ω (Э)
Выражают в долях и %
ω (Э, в долях) = ; n – число атомов, Аr – атомная масса, Mr – молекулярная масса
Выход продукта реакции от теоретически возможного, W
W = Vпракт : Vтеор, Vпракт = W ▪ Vтеор
W = mпракт : mтеор, mпракт = W ▪ mтеор
infourok.ru
Составление формул веществ по валентности элементов. Видеоурок. Химия 8 Класс
В уроке рассматривается алгоритм составления химических формул веществ по известным валентностям химических элементов. Учитель объяснит два разных способа вывода химической формулы вещества.
Графические (структурные) формулы показывают порядок соединения атомов в молекуле и реализацию валентных возможностей атомов элементов. Зная валентности атомов элементов и используя графическую формулу, можно вывести химическую формулу вещества.
Пример. Сера может иметь валентность IV, а валентность кислорода всегда равна II. Составим формулу вещества, образованного этими элементами.
Обозначим валентные возможности атомов черточками: =S= и =O .
Атомы серы могут быть связаны только с атомами кислорода, таким образом, что бы все связи серы и кислорода были задействованы. Для насыщения всех валентных возможностей атома серы необходимо два атома кислорода. Число общих единиц валентностей равно четырем. Таким образом, графическая формула данного вещества: О=S=О.
Для насыщения всех валентных возможностей атома серы необходимо два атома кислорода. Число общих единиц валентностей равно четырем. Таким образом, графическая формула данного вещества: О=S=О. Химическая формула вещества – SO2. Название вещества — сернистый газ.
Рис. 1. Составление химической формулы сернистого газа
Можно выводить химические формулы вещества без использования графических формул.
Пример 1. Составим формулу вещества, образованного атомами серы (с валентностью IV) и атомами кислорода. Для этого:
1. запишем знаки элементов – серы и кислорода, а над ними укажем их валентности;
2. определим число общих единиц валентности, оно равно наименьшему общему кратному валентностей элементов: НОК (2,4)= 4;
3. определим число атомов каждого химического элемента в молекуле, разделив число общих единиц валентности на валентность элемента;
4. запишем формулу вещества: SO2.
Пример 2. Составим формулу вещества, образованного атомами фосфора (с валентностью V) и атомами кислорода.
1. Запишем знаки элементов и над ними укажем их валентности:.
2. Найдем число общих единиц валентности: НОК(2,5)=10
3. Найдем число атомов фосфора в молекуле: 10:5=2.
4. Найдем число атомов кислорода в молекуле: 10:2=5.
5. Запишем формулу вещества: .
Рис. 2. Составление химической формулы оксида фосфора
Список рекомендованной литературы
1. Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: Часть I. – М.: Школьная Пресса, 2002. (с.33)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с. 36-38)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§16)
4. Химия: неор
interneturok.ru
Урок химии в 8 классе на тему » Решение задач: расчеты по формулам»
Титульный лист
Автор материала (ФИО)
Золотарь Веста Петровна
Должность (с указанием преподаваемого предмета)
Учитель химии
Образовательное учреждение
Государственное бюджетное общеобразовательное
учреждение
средняя общеобразовательная школа № 511 Пушкинского района г. Санкт-Петербурга
Электронный адрес
Название материала
Урок закрепления и актуализации знаний по теме «Решение задач: расчеты по формулам с использованием понятий количество вещества, моль, молярная масса, молярный объем газов»
Класс (возраст)
8 класс
Учебный предмет
Химия
Название учебного пособия, образовательной программы (УМК) с указанием авторов, к которому относится ресурс
Кузнецова Н.Е., И.М. Титова, Гара Н.Н., Химия: 8 класс: учебник для учащихся общеобразовательных учреждений. — М.: Вентана-Граф, 2011.
Кузнецова Н.Е., Левкин А.Н. Задачник по химии: 8 класс: для учащихся общеобразовательных учреждений. — М.: Вентана-Граф, 2011.
3. Н.Н. Гара, М.А. Ахметов, Химия: 8 класс: рабочая тетрадь для учащихся общеобразовательных учреждений. — М.: Вентана-Граф, 2013
Вид ресурса (презентация, видео, текстовый документ и другие)
Текстовый документ, ЭУМ «Тест «Количество вещества»
Техническое оснащение (компьютер, интерактивная доска и другие.)
Компьютер, интерактивная доска, проектор
Цели,
Задачи материала
Цель: систематизация знаний учащихся о понятиях «количество вещества», «число Авогадро», «молярная масса», «молярный объем газов», выявление их взаимосвязи и использование при решении задач.
Задачи:
воспитывающие: воспитывать взаимовыручку и взаимодействие через групповую и парную форму работы;
развивающие: развивать познавательный интерес к предмету и навыки самооценки знаний, умение логически мыслить, выдвигать гипотезы, делать аргументированные выводы;
обучающие: формировать понятия о молярной массе и единицах ее измерения, показать взаимосвязь понятий: масса, количество вещества, молярная масса, молярный объем газа.
Краткое описание работы с ресурсом
(на каком этапе предполагается применение, форма использования: индивидуальная, групповая и другое, на усмотрение автора).
Урок комплексного применения знаний и умений.
В целях повышение качества образования, совершенствования научно-методического обеспечения образовательного процесса используются индивидуальная, парная, групповая форма работы, которые повышают мотивацию, позволяют выбирать индивидуальный темп, решать творческие задачи, формируют навыки самоорганизации и самообразования, обеспечивают деятельностный и личностно-ориентированный характер образования.
Использование ИКТ на уроках химии позволяет стимулировать познавательную активность детей и участвовать в освоении новых знаний через поиск необходимой информации, развитие умений находить несколько способов решения проблемной задачи
При проведении уроков используются:
интерактивная доска, что позволяет сделать занятия интересными и развивает мотивацию; предоставляет больше возможностей учащимся для участия в коллективной работе, легче воспринимать и усваивать сложные вопросы в результате более ясной, эффективной и динамичной подачи материала.
электронные модули из базы ФЦИОР http://www.fcior.edu.ru:
тест по теме «Количество вещества»,
тесты учебника-навигатора О.С. Габриеляна «Химия. 8 класс» — для проверки усвоения знаний.
Список использованной литературы.
Ссылки на Интернет — источники
Список используемой литературы.
1. 1. Кузнецова Н.Е., И.М. Титова, Гара Н.Н., Химия: 8 класс: учебник для учащихся общеобразовательных учреждений. — М.: Вентана-Граф, 2011.
2. Кузнецова Н.Е., Левкин А.Н. Задачник по химии: 8 класс: для учащихся общеобразовательных учреждений. — М.: Вентана-Граф, 2011.
3. Н.Н. Гара, М.А. Ахметов, Химия: 8 класс: рабочая тетрадь для учащихся общеобразовательных учреждений. — М.: Вентана-Граф, 2013
2. 1. Электронный модуль из базы ФЦИОР:
http://fcior.edu.ru/card/12788/testy-po-teme-kolichestvo-veshestva.html — тест по теме «Количество вещества»
2. http://school-collection.edu.ru
тесты учебника-навигатора О.С. Габриеляна «Химия. 8 класс» — для проверки усвоения знаний.
Урок закрепления и актуализации знаний по теме «Решение задач: расчеты по формулам:
«Количество вещества. Моль. Молярная масса. Молярный объем газов»
На изучение темы «Решение задач по теме «Количество вещества. Моль. Молярная масса. Молярный объем газов» согласно рабочей программе отводится 4 часа. Данный урок завершает тему.
Тип урока: комплексного применения знаний и умений.
Цель урока: систематизация знаний учащихся о понятиях «количество вещества», «число Авогадро», «молярная масса», «молярный объем газов», выявить их взаимосвязь и использование при решении расчетных задач.
Задачи урока:
воспитывающая: воспитывать взаимовыручку и взаимодействие через парную и групповую форму работы;
развивающие: развивать познавательный интерес к предмету и навыки самооценки знаний, умение логически мыслить, выдвигать гипотезы, делать аргументированные выводы;
обучающая: формировать понятия о молярной массе и единицах ее измерения, показать взаимосвязь понятий: масса, количество вещества, молярная масса, молярный объем газа.
Планируемые результаты:
личностные: формировать умения понимать значимость естественнонаучных и математических
знаний для решения практических задач;
устанавливать связь между целью деятельности и ее результатом, оценивать
собственный вклад в работу группы;
метапредметные: формировать умения планировать, контролировать и оценивать учебные действия
в соответствии с поставленной задачей,
самообразование, самоорганизация, саморазвитие и самоопределение,
предметные: установить взаимосвязь понятий: масса, количество вещества, молярная масса,
молярный объем газа.
Ожидаемые результаты.
Ученики знают понятия:
«количество вещества», «молярная масса», «молярный объем», «моль», «число Авогадро»;
Ученики умеют:
на базовом уровне: называть количество вещества и молярную массу по обозначениям, указывать единицы измерения, видоизменять расчетную формулу при решении прямых задач;
для повышенного уровня: видоизменять расчетную формулу при решении прямых и обратных задач, производить белее сложные расчёты (например, находить массу вещества, если известен объем или число структурных частиц).
Межпредметные связи: математика, информатика, физика.
Виды учебной деятельности: проводят соответствие между названием величин и их единиц измерения; внимательно прочитывают задачу, оформляют ее решение;
Характер деятельности: частично-поисковый
Методы и формы обучения: объяснительно-иллюстративный с элементами проблемно-поискового изложения; индивидуальная и групповая работа по решению задач.
Используемые педагогические технологии: игровые, групповые, ИКТ, проблемно-поисковый (дифференцированный, работа по схеме-алгоритму).
Оборудование: ИД, компьютер, проектор.
В целях повышение качества образования, совершенствования научно-методического обеспечения образовательного процесса используются индивидуальная , парная и групповая форма работы, которые повышают мотивацию, позволяют выбирать индивидуальный темп, решать творческие задачи, формируют навыки самоорганизации и самообразования, обеспечивают деятельностный и личностно-ориентированный характер образования, который является неотъемлемой частью Федеральных Государственных стандартов второго поколения.
Актуальность и оригинальность:
— возможность каждому школьнику проявить свои возможности, развитие его познавательной самостоятельности и творчества, умений анализировать информацию, выбирать главное и обрабатывать ее развитие коммуникативных УУД, чувства ответственности и причастности к созданию «своего» урока (при этом учитель выступает в роли координатора).
Приемы, методы, формы обучения соответствуют возрастным психологическим и педагогическим особенностям восьмиклассников.
В текущем учебном году урок был проведен для восьмиклассников. Уровень усвоения темы: общая успеваемость – 95%, качественная 60%.
Использование ИКТ на уроках химии позволяет стимулировать познавательную активность детей и участвовать в освоении новых знаний через поиск необходимой информации, развитие умений находить несколько способов решения проблемной задачи
При проведении уроков используются:
интерактивная доска, что позволяет сделать занятия интересными и развивают мотивацию; предоставляют больше возможностей учащимся для участия в коллективной работе, легче воспринимать и усваивать сложные вопросы в результате более ясной, эффективной и динамичной подачи материала. Школьники работают у доски с удовольствием, более творчески, с уверенностью в себе. Учитель может своевременно вносить коррективы, организовать коллективное обсуждение,
электронные модули из базы ФЦИОР:
тест по теме «Количество вещества» (задания 1-7),
Технологическая карта урока «Решение задач: расчеты по формулам с использованием понятий «Количество вещества. Моль. Молярная масса. Молярный объем газов»
Технологиче
ские этапы урока
Деятельность учащихся
Деятельность учителя
Задание для учащихся, выполнение которого приведет к достижению запланированных результатов.
Организационный момент.
1 мин.
Приветствуют
Приветствует
Актуализация знаний.
3 мин.
Отвечают на вопросы.
Один ученик выполняет задание на закрытой части доски (заполняет пустые графы таблицы)
Что означает эта запись?
Что является единицей измерения?
Моль
М
N
6*1023 1/моль
г
Vm
л
Используя данные обозначения, запиши формулы для вычисления:
А) массы вещества –
Б) числа молекул –
В) объема газообразного вещества
Какое отношение имеет моль к теме нашего урока?
С какими новыми величинами мы познакомились на предыдущих уроках?
Давайте их вспомним.
Расскажу сегодня, что ли
о зловредной роли моли.
Моль съедает шерсть и мех,
просто паника у всех…
Ну а в химии – изволь!
Есть другое слово «моль».
Прост, как небо и трава,
моль любого вещества.
Но трудна его дорога:
в моле так молекул много!
Задание 1 с.67 учебника, фронтальный опрос по понятиям
масса, количество вещества, молярная масса, молярный объем газа.
Постановка цели и задач урока.
1 мин.
Формулируют тему, цель урока.
Определяют, какие действия, в какой последовательности и с помощью чего надо осуществить.
Сформулируйте тему и цели урока.
Первичное закрепление:
решение типовых задач (в знакомой и измененной ситуации)
10 мин.
4 человека на первых партах получают индивидуальные задания в тестовой форме на 10 мин (приложение № 1)
2 человека у доски решают задачи, заданные на дом, и новые задачи на формулу, связывающую количество вещества и число частиц
1-й ученик- № 1(а), 3(а) с.65 учебника
2-й ученик- № 1(б), 3(б) с.65 учебника
Анализируют выполнение задания. Проводят самооценку.
Организует решение задачи на компьютере с демонстрацией этого процесса на экране всем учащимся
http://school-collection.edu.ru/catalog/res/0ab68076-4185-11db-b0de-0800200c9a66/view
Первичное закрепление:
решение типовых задач (в знакомой и измененной ситуации)
7 мин.
3 человека у доски решают задачи, заданные на дом, на формулу, связывающую количество вещества и массу вещества
1-й ученик- № 5(а) с.68 учебника
2-й ученик- № 5(б) с.68 учебника
3-й ученик- № 5(в) с.68 учебника
Анализируют выполнение задания. Проводят самооценку
Теперь проведём исследование по практическому применению этих величин.
1) С. 47 № 3 рабочей тетради
2) решение задачи на компьютере
http://school-collection.edu.ru/catalog/res/0ab68077-4185-11db-b0de-0800200c9a66/view/
Первичное закрепление:
решение типовых задач (в знакомой и измененной ситуации)
7 мин.
2 человека у доски решают задачи, заданные на дом, на формулу, связывающую количество вещества и объем вещества
1-й ученик- № 4-1(д) с.42 задачника
2-й ученик- № 4-3(г) с.42 задачника
Анализируют выполнение задания. Проводят самооценку
Организует решение задачи на компьютере с демонстрацией этого процесса на экране всем учащимся
http://school-collection.edu.ru/catalog/res/0ab6807e-4185-11db-b0de-0800200c9a66/view/
Творческое применение и добывание знаний в новой ситуации (проблемные задания).
10 мин.
Выполняют творческие задания (по уровням сложности). Знакомят товарищей с результатом работы.
С.72 рабочей тетради № 1
1-ая строка- 1 –ый ряд, 2-ая строка- 2-ой ряд, 3-я строка- 3-й ряд.
Проблемная ситуация. Все читали или смотрели фильм «Дети капитана Гранта». Записка со стертыми записями пришла и к нам. Попробуем восстановить.
Информация о домашнем задании, инструктаж по его выполнению. 1 мин.
Записывают домашнее задание. Задают вопросы.
Знакомит с домашним заданием.
Оно парное, т.е. ученики, сидящие за одной партой выполняют одинаковое задание (приложение № 2)
Восстановить запись.
Дополнительное задание — 4 строка упр. на стр. 72 рабочей тетради
Рефлексия.
5 мин.
Подводят итоги работы (анализируют, выполнили цель и задачи урока).
Чему мы научились на этом уроке?
Как вы понимаете слова Алигер?
Эти строки раскрывают
связь химии с другими естественными науками,
причем об этом говорил ещё
М.В. Ломоносов более двух
веков назад, актуальной является эта мысль и сейчас. Из уроков физики, химии и математики вы узнали, что для изучения окружающего мира недостаточно только наблюдать и описывать явления и предметы, необходимо их характеризовать также количественно.
Тест по теме «Количество вещества» (задания 1-7)
О, физика – наука из наук!
Все впереди!
Как мало за плечами!
Пусть химия нам будет вместо рук.
Пусть станет математика очами.
Не разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире.
(отрывок из поэмы М. Алигер “Ленинские горы”)
infourok.ru
Назовите пожалуйста все формулы по химии за курс 8 класс
Моль (количество моль)
Основные формулы для решения задач по химии
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — h3SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(h3SO4)=1•2+32+16•4=98 г/моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Основные формулы для решения задач по химии
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Основные формулы для решения задач по химии
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m/Mr
n=V/22.4 (л/моль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л/моль)
dvoechka.com

