Задачи по химии 10 класс с решением: Химия 10-11 класс — задачи, уроки
Химия 10-11 класс — задачи, уроки
Все уроки химии: 8 класс, 9 класс, 10 – 11 класс
1) Уроки химии 10 -11 класс — ютуб канал «Инфоурок»
2) Органическая химия 10 класс — ютуб канал «Вурдихан Вурдиханов»
3) Подготовка к олимпиаде по химии 10 — 11 класс — ютуб канал «Онлайн-школа с 3 по 11 класс»
4) Химия для поступающих — ютуб канал «Дистанционные курсы для абитуриентов Химфака МГУ»
- Задачи по химии с решениями. 11 класс
- Задачи на понятие «количество вещества»
- Задачи на относительную плотность газов
- Задачи на массовую долю растворённого вещества в растворе
- Задачи на расчёт по формулам и вывод формул
- Задачи на расчёты по уравнению реакций
- Задачи на расчёт по уравнению реакции, если реагент дан в виде раствора или содержит примеси
- Задачи на расчёт по уравнению реакции, протекающей с определённым выходом продукта
- Задачи на расчет по уравнению реакции, если одно из реагирующих веществ дано в избытке
- Задачи на расчет по уравнению реакции с участием газообразных веществ
- Задачи на расчет по термохимическим уравнениям реакции и по уравнениям, связанным с изменением того или иного параметра
- Задача на «параллельное» протекание реакций
Уроки химии 10 — 11 класс
Уроки по химии 10 класс. Ютуб канал «Инфоурок» Ютуб канал «Инфоурок» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Теория строения органических соединений А.М. Бутлерова. | >>>>>>>>>> |
| Современное представление о строении атома, S и P орбитали. | >>>>>>>>>> |
| Номенклатура и изомерия алканов. | >>>>>>>>>> |
| Упражнения на составление формул и названий гомологов и изомеров. | >>>>>>>>>> |
| Химические и физические свойства алканов. | >>>>>>>>>> |
| Методы получения и применения алканов. | >>>>>>>>>> |
| Решение задач на вывод формул органических соединений. | >>>>>>>>>> |
| Понятие о циклоалканах. | >>>>>>>>>> |
Алкены. Гомологический ряд алкенов. Гомологический ряд алкенов. | >>>>>>>>>> |
| Номенклатура и изомерия алкенов. | >>>>>>>>>> |
| Физические и химические свойства алкенов. | >>>>>>>>>> |
| Получение алкенов и их применение. | >>>>>>>>>> |
| Расчеты по уравнениям когда одно из веществ дано в избытке. | >>>>>>>>>> |
| Алкадиены. Типы алкадиенов. | >>>>>>>>>> |
| Алкины, гомологический ряд алкинов. | >>>>>>>>>> |
| Физические и химические свойства алкинов. | >>>>>>>>>> |
| Получение и применение алкинов. | >>>>>>>>>> |
Бензол — представитель ароматических углеводородов. | >>>>>>>>>> |
| Гомологи бензола. | >>>>>>>>>> |
| Нефть и способы её переработки. | >>>>>>>>>> |
| Многообразие углеводородов. Взаимосвязь гомологических рядов. | >>>>>>>>>> |
| Предельные одноатомные спирты строение, номенклатура. | >>>>>>>>>> |
| Химические свойства предельных одноатомных спиртов. | >>>>>>>>>> |
| Получение и применение спиртов. Спирты и здоровье человека. | >>>>>>>>>> |
| Многоатомные спирты. | >>>>>>>>>> |
| Каменный уголь. Фенол. | >>>>>>>>>> |
| Альдегиды строение, свойства. | >>>>>>>>>> |
Получение и применение альдегидов. | >>>>>>>>>> |
| Одноосновные карбоновые кислоты. | >>>>>>>>>> |
| Химические свойства одноосновных карбоновых кислот. | >>>>>>>>>> |
| Получение карбоновых кислот. | >>>>>>>>>> |
| Генетическая связь углеводородов, спиртов, альдегидов и карб. кислот. | >>>>>>>>>> |
| Сложные эфиры. | >>>>>>>>>> |
| Жиры. | >>>>>>>>>> |
| Углеводы. Классификация и состав углеводов. | >>>>>>>>>> |
| Глюкоза строение, свойства, применение. | >>>>>>>>>> |
| Моносахариды. | >>>>>>>>>> |
Дисахариды. | >>>>>>>>>> |
| Полисахариды. | >>>>>>>>>> |
| Амины — органические основания. | >>>>>>>>>> |
| Анилин. Его свойства и применение. | >>>>>>>>>> |
| Аминокислоты. Названия и свойства аминокислот. | >>>>>>>>>> |
| Белки. | >>>>>>>>>> |
| Ферменты. Гормоны. | >>>>>>>>>> |
| Витамины. | >>>>>>>>>> |
| Лекарства. | >>>>>>>>>> |
| Искусственные полимеры. | >>>>>>>>>> |
| Синтетические органические соединения. | >>>>>>>>>> |
Значение органической химии. | >>>>>>>>>> | Уроки химии 11 класс. Ютуб канал «Инфоурок» |
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Атом – сложная частица. | >>>>>>>>>> |
| Периодический закон и строение атома. | >>>>>>>>>> |
| Ионная химическая связь. | >>>>>>>>>> |
| Ковалентная химическая связь. | >>>>>>>>>> |
| Металлическая химическая связь. | >>>>>>>>>> |
| Водородная химическая связь. | >>>>>>>>>> |
| Полимеры. | >>>>>>>>>> |
| Газообразные вещества. | >>>>>>>>>> |
Жидкие вещества.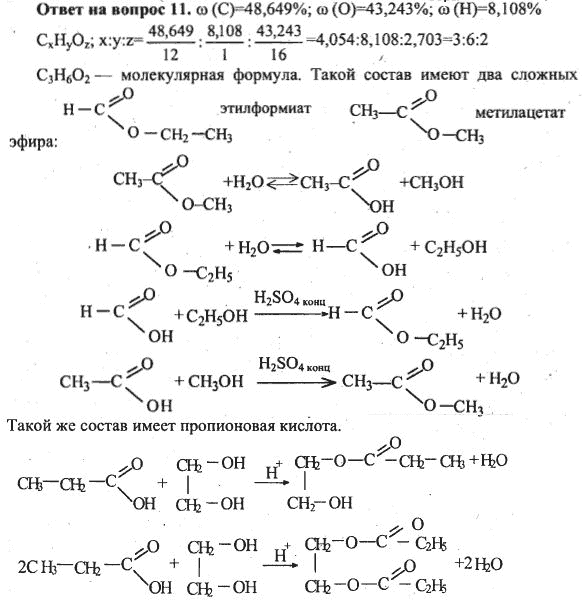 | >>>>>>>>>> |
| Твердые вещества. | >>>>>>>>>> |
| Дисперсные системы. | >>>>>>>>>> |
| Состав вещества. Смеси. | >>>>>>>>>> |
| Понятие о химической реакции. | >>>>>>>>>> |
| Классификация химических реакций. | >>>>>>>>>> |
| Скорость химической реакции. | >>>>>>>>>> |
| Обратимость химических реакций. Химическое равновесие. | >>>>>>>>>> |
| >>>>>>>>>> | |
| Гидролиз. | >>>>>>>>>> |
Окислительно восстановительные реакции. Электролиз. | >>>>>>>>>> |
| Классификация веществ. Металлы. | >>>>>>>>>> |
| Неметаллы. | >>>>>>>>>> |
| Кислоты. | >>>>>>>>>> |
| Основания. | >>>>>>>>>> |
| Амфотерные органические и неорганические соединения. | >>>>>>>>>> |
| Соли. | >>>>>>>>>> |
| Генетическая связь между классами органических и неорганических веществ. | >>>>>>>>>> |
| Органическая химия 10 класс. Ютуб канал «Вурдихан Вурдиханов» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Алканы. Структурные формулы, названия, гомологи, радикалы. | >>>>>>>>>> |
Алканы. Строение, гибридизация, углы, геометрическая форма молекул. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Пи и сигма связи, как определить? | >>>>>>>>>> |
| sp sp2 sp3 гибридизация, как определить? | >>>>>>>>>> |
| Первичный, вторичный, третичный, четвертичный атом углерода. | >>>>>>>>>> |
| Номенклатура, названия алканов. Учимся называть алканы. | >>>>>>>>>> |
| Все виды изомерии. | >>>>>>>>>> |
| Цис- Транс- Изомерия. Все виды. | >>>>>>>>>> |
| Межклассовая изомерия. Все виды. | >>>>>>>>>> |
| Алкены. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
Алкины.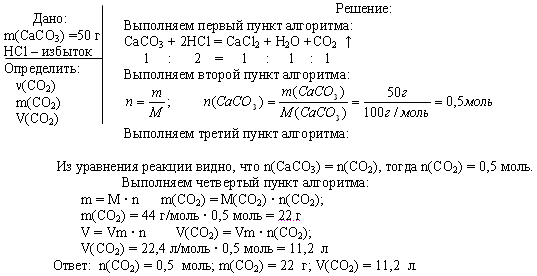 Строение, гибридизация, углы, геометрическая форма молекул. Строение, гибридизация, углы, геометрическая форма молекул. | >>>>>>>>>> |
| Строение атома углерода. | >>>>>>>>>> |
| Теория строения органических соединений Бутлерова. | >>>>>>>>>> |
| Предмет органической химии. Органические вещества. | >>>>>>>>>> |
| Алканы. Получение. Все реакции получения. | >>>>>>>>>> |
| Алканы. Химические свойства. Все реакции для ЕГЭ. | >>>>>>>>>> |
| Циклоалканы. Получение. | >>>>>>>>>> |
| Циклоалканы. Химические свойства. | >>>>>>>>>> |
| Галогеналканы. Получение. | >>>>>>>>>> |
Галогеналканы. Химические свойства. Химические свойства. | >>>>>>>>>> |
| Функциональные группы и номенклатура органических веществ. | >>>>>>>>>> |
| Общие и молекулярные формулы органических веществ. | >>>>>>>>>> |
| Алкены. Получение. Все реакции для ЕГЭ. | >>>>>>>>>> |
Подготовка к олимпиаде по химии
Химия для поступающих
| Химия для поступающих. Ютуб канал «Дистанционные курсы для абитуриентов Химфака МГУ» | |
|---|---|
| ТЕМА УРОКА | ССЫЛКА НА УРОК |
| Разбор задач дополнительного вступительного испытания МГУ по химии 2016 г. | >>>>>>>>>> |
| Расчет средней скорости химической реакции. Химия для поступающих. Разбор задач. | >>>>>>>>>> |
Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих. Химия для поступающих. | >>>>>>>>>> |
| Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих. | >>>>>>>>>> |
| Использование уравнения Аррениуса для решения задач (2/2). Химия для поступающих. | >>>>>>>>>> |
| Использование правила Вант-Гоффа для решения задач. Химия для поступающих. | >>>>>>>>>> |
| Использование правила Вант-Гоффа для решения задач (2/2). Химия для поступающих. | >>>>>>>>>> |
| Диссоциация воды. Водородный показатель. | >>>>>>>>>> |
| Кислотно-основные равновесия в водном растворе. Гидролиз солей. | >>>>>>>>>> |
Расчет рН растворов сильных и слабых кислот. Химия для поступающих. | >>>>>>>>>> |
| Расчет рН растворов сильных и слабых оснований. Химия для поступающих. | >>>>>>>>>> |
| Окислительно восстановительные реакции, часть 1 из 4. Определение степеней окисления. | >>>>>>>>>> |
| Окислительно восстановительные реакции, часть 2 из 4. Уравнивание ОВР методом электронного баланса. | >>>>>>>>>> |
| Уравнивание неорганических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 3 из 4. | >>>>>>>>>> |
| Уравнивание органических реакций (ОВР) методом электронно-ионного баланса. ОВР, часть 4 из 4. | >>>>>>>>>> |
Поделитесь с друзьями:
Решение качественных задач по органической химии 10 класс онлайн-подготовка на Ростелеком Лицей
Задачи на объяснение фактов или тенденций
Качественные, т.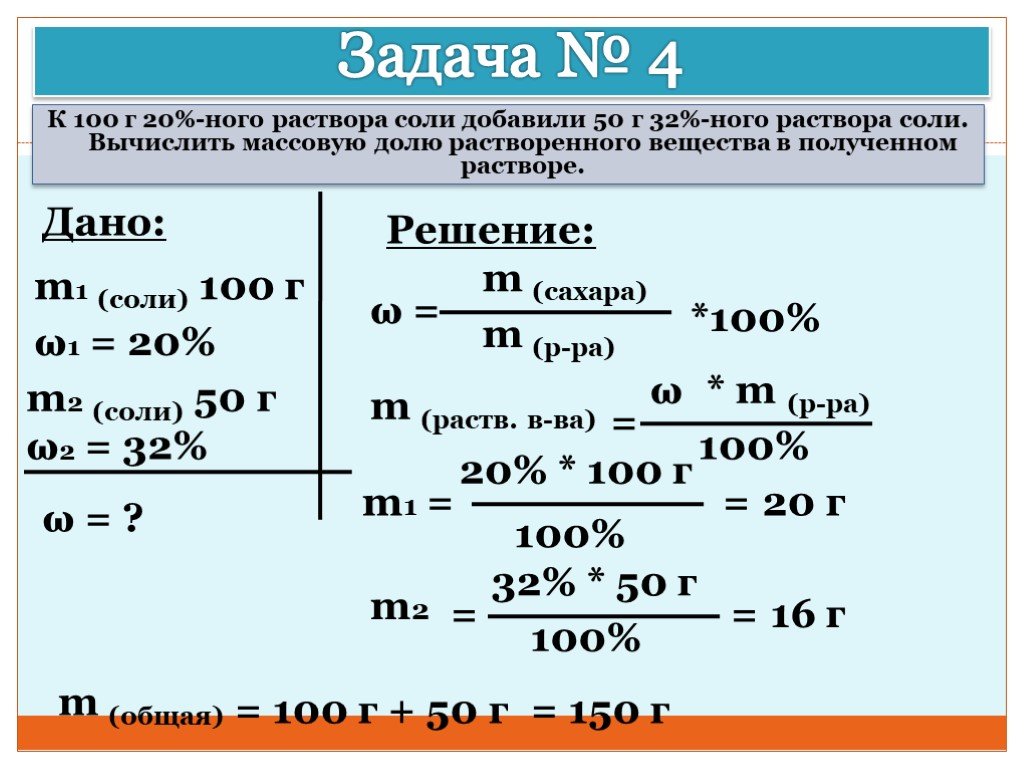 е. нерасчетные задачи можно условно разделить на несколько типов.
е. нерасчетные задачи можно условно разделить на несколько типов.
I. Задачи на объяснение фактов или тенденций.
Задача 1
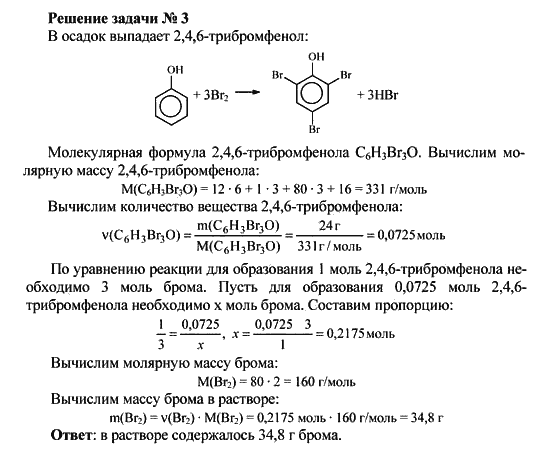
Условие задачи. Согласно справочным данным, фенол представляет собой бесцветные прозрачные кристаллы. Тем не менее химический реактив фенол, стоящий в банке на полке (рис. 1), всегда окрашен в розовый цвет. Почему?
Рис. 1. Фенол
Решение.
Вспомним особенности строения фенола (рис. 2).
Рис. 2. Строение фенола
Поскольку это бензольное кольцо, к которому присоединен атом заместителя кислорода, содержащего неподеленную электронную пару, то происходит взаимодействие электронов кислорода и бензольного кольца.
В результате происходит сопряжение π-электронов бензольного кольца и электронной пары атома кислорода. Активность всего бензольного кольца существенно возрастает. Получается вещество, гораздо менее устойчивое к окислению по сравнению с исходным бензолом.
Поэтому фенол всегда загрязнен продуктами окисления, имеющими яркую окраску. В результате он имеет характерный розовый цвет.
Задачи на сравнение свойств веществ
II. Задачи на сравнение свойств веществ
Задача 1
Условие задачи. Как изменятся свойства уксусной кислоты при замене водородов в метильном радикале на атомы хлора: СН3-СООН → СН2Cl-СООН → СНCl2-СООН → СCl3-СООН?
Решение.
При замещении водорода хлором хлор как более электроотрицательный атом стягивает на себя электронную плотность.
Эта электронная плотность смещается от карбоксильной группы и, соответственно, от карбоксильного атома водорода.
СН3-СООН < СН2Cl-СООН < СНCl2-СООН < СCl3-СООН
Атом водорода приобретает более положительный заряд. Уксусная кислота с заменой водорода на хлор в своем углеводородном радикале становится более легко диссоциирующей.
Уксусная кислота с заменой водорода на хлор в своем углеводородном радикале становится более легко диссоциирующей.
У нее становится более высокая константа диссоциации по сравнению с исходной уксусной кислотой.
Трихлоруксусная кислота СCl3-СООН уже относится не к слабым кислотам, как сама уксусная кислота, а к сильным. Именно из-за этого эффекта.
Задачи на качественный анализ органических соединений
III. Задачи на качественный анализ органических соединений
Задача 1
Условие задачи. Соединение А – легкокипящая жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений – В – лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди (II) в вещество С, которое используется для сохранения биологических препаратов.
Приведите возможные формулы веществ А, В, С.
Решение.
То, что могло быть окислено оксидом меди (II), является альдегидом.
R-CH2-OH + CuO R-CH=O + Cu + H2O
Делаем предположение: вещество С – альдегид. При этом данный альдегид используется для хранения биологических препаратов. Биологические препараты хранят в растворе формалина. Вещество – С – формальдегид (метаналь) Н-CH=O.
Формальдегид получился из метанола. Значит, вещество В – это метанол.
CH3-OH + CuO НCH=O + Cu + H2O
Метанол CH3-OH немного тяжелее воздуха.
М(CH3-OH) = 32 г/моль, М(воздуха) = 29 г/моль.
Поскольку при гидролизе исходного вещества получились два вещества с одинаковым числом атомов углерода RCOOCH3 RCOOH + CH3-OH, то кислота с одним атомом углерода – это НCOOH – муравьиная кислота.
Исходное вещество А – с приятным запахом – это НCOOCH3 – метиловый эфир муравьиной кислоты.
Ответ: А – НCOOCH3; В – CH3-OH; С – формальдегид Н-CH=O.
Задачи на различение веществ
IV. Задачи на различение веществ
Задача 1
Условие задачи. В трех пробирках находятся три водных раствора: муравьиной кислоты НCOOH, соляной кислоты HCl и этанола C2H5—OH. Как, используя минимальное количество реактивов, различить вещества в пробирках?
Решение
1. Во все три пробирки добавляем индикатор, например, метилоранж. В растворах кислот он изменит свой цвет на красный.
В оставшейся пробирке – этанол C2H5—OH.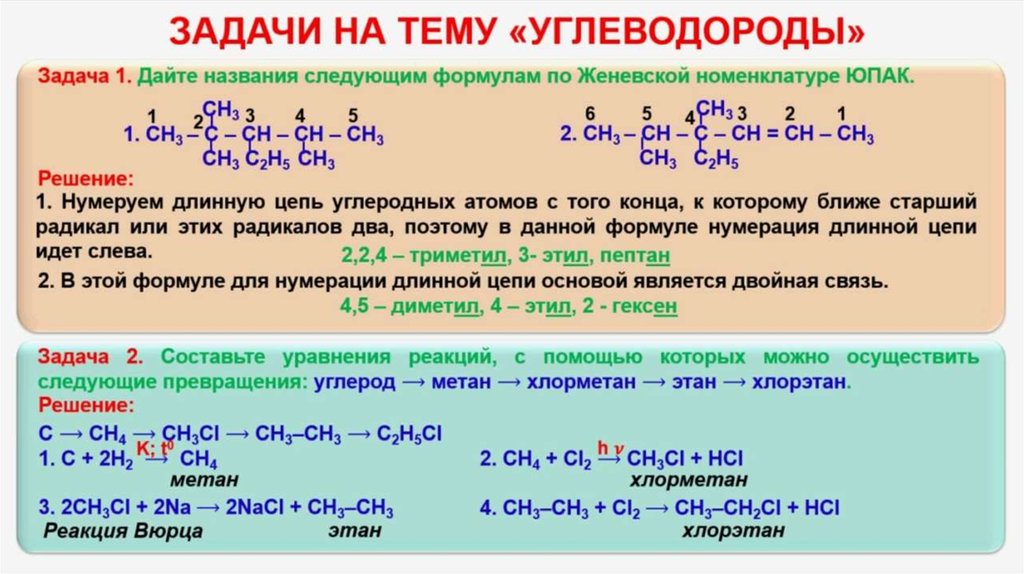
2. Муравьиная кислота НCOOH является еще и альдегидом. Действуем на обе кислоты щелочным раствором Сu(ОН)2.
2Сu(ОН)2↓+ НCOOH Сu2О↓ + СО2↑ + 3Н2О
Сu2О↓ – осадок красного цвета.
3. В пробирке с соляной кислотой HCl синий осадок Сu(ОН)2↓ просто растворится.
Сu(ОН)2↓ + 2НCl → СuCl2↓+ 2Н2O
Подведение итога урока
На этом уроке вы познакомились с решением качественных задач по органической химии. На нём вы рассмотрели примеры качественных (нерасчётных) задач, которые условно можно разделить на несколько типов. Например: на объяснения фактов или тенденций, на сравнения свойств веществ, на качественный анализ органических соединений. Научились правильно решать такие задачи из курса органической химии.
Список литературы
- Рудзитис Г.
 Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012. - Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин, А. А. Дроздов, В. И. Теренин. – М.: Дрофа, 2008. – 463 с.
- Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин, А. А. Дроздов, В. И. Теренин. – М.: Дрофа, 2010. – 462 с.
- Хомченко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «Органическая химия» (Источник)
- Интернет-портал «xumuk.ru» (Источник)
- Интернет-портал «promobud.ua» (Источник)
Домашнее задание
- №№ 2 (с.
 124) Рудзитис Г. Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
124) Рудзитис Г. Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012. - Как доказать непредельный характер жидких жиров?
- Почему сульфат меди (II) при хранении на воздухе из белого превращается в голубой?
- Как различить, в какой пробирке находится раствор фенола, а в какой — этанола? Приведите уравнения реакций.
CBSE Класс 10 Научные текстовые задания решены
Главная » Руководство CBSE » Класс 10 » Наука » Глава 1 Решенные текстовые действия
Глава 1 — Химические реакции и уравнения
1.1) Когда магниевая лента горит, что вы наблюдаете?
Ответ) Магниевая лента горит ослепительным пламенем и часовой порошок собирается на подложенном под нее часовом стекле. Белый порошок представляет собой оксид магния, образованный реакцией магния и кислорода, присутствующих в воздухе.
2Mg(s) + O 2 (g) → 2MgO
1.2) что вы наблюдаете, когда к раствору нитрата свинца в пробирке добавляют раствор йодида калия?
Ans) Белый нитрат свинца реагирует с белым йодидом калия с образованием желтого йодида свинца, который не растворяется в воде.
Pb(NO 3 ) 2 (водн.) + 2KI (водн.) → 2KNO 3 (водн.) + PbI 2 (т)
1.3) Что происходит с дихлористоводородной кислотой в гранулах или в него добавляют серную кислоту? Есть ли изменение его температуры?
Цинк, будучи активным металлом, легко реагирует с разб. соляной кислоты при комнатной температуре с образованием растворимого хлорида цинка и водорода. Мы можем наблюдать пузырьки газообразного водорода, образующиеся вокруг гранул цинка. Если мы прикоснемся к конической колбе, мы можем почувствовать ощущение жара, так как происходит повышение температуры. Итак, это экзотермическая реакция.
Zn + 2HCl → ZnCl 2 + H 2
Поскольку цинк вытесняет водород из HCl, это реакция замещения. Газообразный водород обычно получают в лаборатории по этой реакции.
Газообразный водород обычно получают в лаборатории по этой реакции.
Когда гранулы цинка добавляют к разбавленной серной кислоте, происходит изменение состояния гранул цинка, они превращаются в сульфат цинка (ZnSO 4 ) и выделяется газообразный водород.
Zn + H 2 SO 4 → ZnSO 4 + H 2
Эта реакция является экзотермической, т.
1.4) Изменяется ли температура при добавлении воды к оксиду кальция или негашеной извести в химическом стакане?
Ans) Оксид кальция энергично реагирует с водой с образованием гашеной извести (гидроксид кальция) с выделением большого количества тепла.
В этой реакции оксид кальция и вода объединяются, образуя единый продукт — гидроксид кальция. Такая реакция, в которой один продукт образуется из двух или более реагентов, известна как реакция сочетания.
1.5) Наблюдаете ли Вы изменение окраски кристаллов железного купороса при нагревании их в кипящей трубке над пламенем горелки или спиртовки?
Ответ) Зеленый цвет кристаллов сульфата железа меняется на коричневато-черный оксид и появляется запах горящей серы. Сульфат железа разлагается с образованием оксида железа (Fe 2 O 3 ), диоксида серы (SO 2 ) и триоксида серы (SO 3 ). Итак, выбрасываемый газ пахнет горящей серой. В этой реакции единственный реагент FeSO 4 разлагается с образованием трех различных продуктов. Таким образом, реакция является реакцией разложения.
Сульфат железа разлагается с образованием оксида железа (Fe 2 O 3 ), диоксида серы (SO 2 ) и триоксида серы (SO 3 ). Итак, выбрасываемый газ пахнет горящей серой. В этой реакции единственный реагент FeSO 4 разлагается с образованием трех различных продуктов. Таким образом, реакция является реакцией разложения.
1.6) Что вы наблюдаете, когда кипящую пробирку с порошком нитрата свинца нагревают над пламенем?
Ответ) При нагревании нитрат свинца разлагается с потрескивающим звуком с выделением коричневых паров диоксида азота (NO 2 ), имеющего раздражающий запах. Газ синеет, лакмус краснеет; следовательно, он кислый по своей природе. В пробирке остается желтый твердый остаток оксида свинца (PbO).
« Назад в меню | Страница 1 | Страница 2
4.5: Концентрация растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21718
Цели обучения
- Количественно описать концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: of\: растворенное вещество}{литры\: of\: раствора} = \dfrac{mmoles \: of\: раствор} {миллилитров\: of\: раствор} \label{4. 5.1} \]
5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, который содержит 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер \]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right) = ммоль \label{4.5.3} \]
На рисунке \(\PageIndex{1}\) показано использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3}\).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей гидроксида натрия (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4.5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано число молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L} ) \влево( \dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланин.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube(opens in new window) [youtu. be]
be]
Концентрации также часто указываются в пересчете на массу (m/m) или на основе массы на объем (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллион ), что составляет граммов растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллион | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя почти всегда на 90 128 меньше, чем на 90 129 желаемого объема раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя почти всегда на 90 128 меньше, чем на 90 129 желаемого объема раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 •2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора.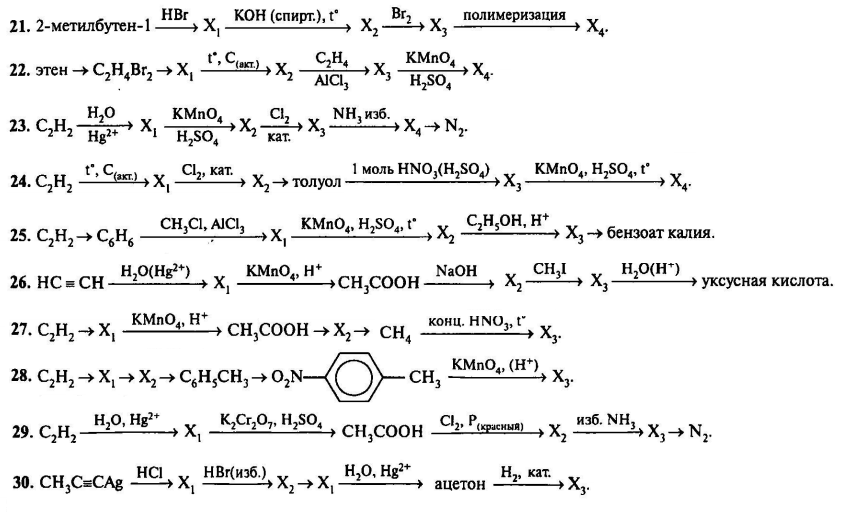 Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит определенную концентрацию растворенного вещества, сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в указанном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\(V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0003
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0003
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки [( V s )(M s ) = ( V d )(M d ) ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М исходного раствора, содержащего такое количество глюкозы:
\[ объем\: из\: сток\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \нечисло \]
При определении необходимого объема маточного раствора мы должны были разделить желаемое число молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г дихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае при растворении 1 моля (NH 4 ) 2 Cr 2 O 7 получается раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды опущены из молекулярного изображения раствора для ясности.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 — также должен быть 1,43 м, потому что есть один CR 2 — 7.43 м, потому что есть один CR 2 7013 7 70203 7.43 М, потому что есть один Cr 2 7. 70203. 2 − ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 Производит Три ионов при растворении в воде (2NH 4 + + 1CR 2 O 7 2 02. 8, 8, 8, 8, 8, 8, 8). в растворе 3 × 1,43 M = 4,29 M. Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be] Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах? Дано: молярность Запрошено: концентрации A Классифицируйте каждое соединение как сильный электролит или неэлектролит. B Если соединение является неэлектролитом, его концентрация равна молярности раствора. B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М. , , 9012, 9012, 9012, 9012, 9012, 9012, , , , , , , , , , ,
, , 9012, 9012, 9012, 9012, 9012, 9012, , , , , , , , , , , Пример \(\PageIndex{5}\)
Стратегия:
 — (водн.) \)
— (водн.) \)
B Одна формула единицы в IN (№ 3 ) 3 производит один в 3 + Ион и три № 3 — , так что 0,032 м в (№ 3 )). 3 solution contains 0.032 M In 3 + and 3 × 0.032 M = 0. 096 M NO 3 – —that is, [In 3 + ] = 0.032 M and [NO 3 − ] = 0,096 М.
096 M NO 3 – —that is, [In 3 + ] = 0.032 M and [NO 3 − ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, обычно известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моль\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитров\: из \: решение} \номер\]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают в терминах молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).0008 ) до желаемого конечного объема.
Концентрации обычно выражают в терминах молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).0008 ) до желаемого конечного объема.
Авторы и авторство
4.5: Concentration of Solutions распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.



 Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012. 124) Рудзитис Г. Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
124) Рудзитис Г. Е., Фельдман Ф. Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.