Задачи по химии 10 класс на нахождение молекулярной формулы: Нахождение молекулярной формулы по массовым долям элементов и относительной плотности — урок. Химия, 10 класс.
«Решение задач на нахождение формулы органического вещества»
Цель: применение алгоритма при решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения задач;
- закрепить навыки работы с алгоритмами;
- показать взаимосвязь химии и математики.
ХОД УРОКА
1. Оргмомент
Учитель знакомит класс с темой урока, целью и задачами урока.
2. Повторение общих формул органических веществ.
Учитель предлагает учащимся назвать общие формулы алканов, алкенов, алкинов, циклоалканов, алкадиенов, типы гибридицациии атомов углерода, характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач на нахождение формулы вещества по продуктам сгорания вещества, если дана относительная плотность.
АЛГОРИТМ №1.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) = (2)
б) если СО2 дано в объеме:
n(C) = (3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда формулу умножаем на 2 (это применимо и к N)
n(Н) = 2 (4)
4. Вычисляем молярную массу полученного вещества.
5. Если молярная масса полученного вещества
равна молярной массе вещества (1), тогда задача
решена правильно; если молярная масса
полученного вещества отличается от молярной
массы вещества (1), вычисляем разность и
определяем количество атомов кислорода, если
вещество кислородосодержащие, или азота, если
вещество азотосодержащее.
Пример:
При сгорании органического вещества массой 2, 37 г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35 г воды и азот. Относительная плотность этого вещества по воздуху равна 2,724. Выведите молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = = 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 = 5
3. Вычисляем молярную массу С
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14.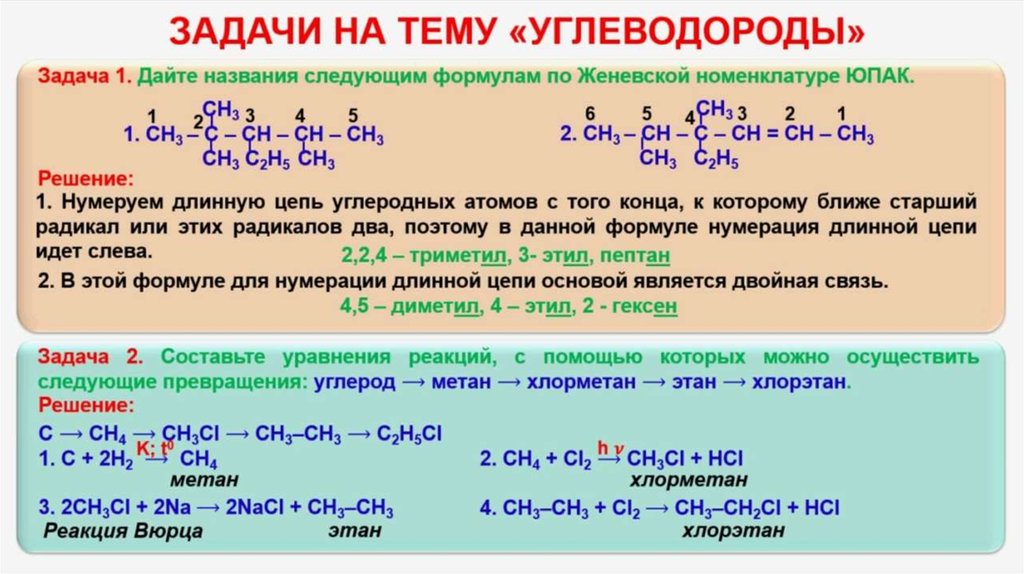 т.к. атомная масса азота – 14, значит в
данной формулу один атом N.
т.к. атомная масса азота – 14, значит в
данной формулу один атом N.
Ответ: С5Н5N
4. Составление алгоритма нахождение молекулярной формулы вещества по его относительной плотности и массовой доле элементов в соединении.
АЛГОРИТМ № 2
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = (2)
б) если w дана в долях:
n(Э) = (3)
3. Вычисляем молярную массу полученного вещества.
4. Если молярная масса полученного вещества
равна молярной массе вещества (1), тогда задача
решена правильно; если молярная масса
полученного вещества отличается от молярной
массы вещества (1), вычисляем разность и
определяем количество атомов кислорода, если
вещество кислородосодержащие, или азота, если
вещество азотосодержащее.
Пример:
Выведите формулу вещества, содержащего 82,75% углерода и 17,25 % водорода. Относительная плотность паров этого вещества по воздуху равна 2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1), задача решена.
Ответ: С4Н10
5. Закрепление материала
Учащиеся решают задачи самостоятельно, по
необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г. Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества получили 4,4 г оксида углерода и 1,8 г. воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 3. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
6. Домашнее задание
Гара Н.Н., Горбусева Н. И. Сборник задач. –
М.:Дрофа, 2010.
Задачи: 1.5; 1. 17; 2.10; 2.27.
17; 2.10; 2.27.
Решение задач по теме: «Вывод формул органических соединений» | Методическая разработка по химии (10 класс) по теме:
Опубликовано 08.12.2012 — 17:32 — Утякаева Фарида Абдрахмановна
Рассматривается наиболее типичные варианты задач по органической химии
Скачать:
Предварительный просмотр:
Задачи на вывод молекулярной формулы органического вещества Вариант №1
( Ответ С4Н10)
m(вещества) = 4,2г m(СО2) = 13,2г m(Н2О) = 5,4г Д возд. (вещества) = 2,9 МФ -? ( Ответ С6Н12) | Задачи на вывод молекулярной формулы органического вещества Вариант №2
( Ответ С3Н8)
m(вещества) = 4,3г m(СО2) = 13,2г m(Н2О) = 0,7г Д Н2 (вещества) = 43 МФ -? ( Ответ С6Н14) |
Задачи на вывод молекулярной формулы органического вещества Вариант №3
( Ответ С3Н6)
m(вещества) = 4,4г m(СО2) = 13,2г m(Н2О) = 0,8г Д возд. МФ -? ( Ответ С3Н8) | Задачи на вывод молекулярной формулы органического вещества Вариант №4
( Ответ С2Н4)
m(вещества) = 3,6г m(СО2) = 11г m(Н2О) = 5,4г Д Н2. (вещества) = 2,9 МФ -? ( Ответ С5Н12) |
Задачи на вывод молекулярной формулы органического вещества Вариант №5
( Ответ С2Н2)
m(вещества) = 36г m(СО2) = 52,8г m(Н2О) = 21,6г Мr (вещества) = 180 МФ -? ( Ответ С6Н12О6) | Задачи на вывод молекулярной формулы органического вещества Вариант №6
( Ответ С2Н6)
m(вещества) = 6,2г V(СО2) = 4.48л m(Н2О) = 9г V(N2) = 2,24л Д Н2 (вещества) = 15,5 МФ -? ( Ответ СН5N)) |
Задачи на вывод молекулярной формулы органического вещества Вариант №7
( Ответ СН4О)
m(вещества) = 0,9г m(СО2) = 1,76г m(Н2О) = 1,26г, содержится азот Д Н2 (вещества) = 2,9 МФ -? ( Ответ С2Н7N) | Задачи на вывод молекулярной формулы органического вещества Вариант №8
( Ответ СН2F2)
m(вещества) = 25,2г V(СО2) = 40,32г m(Н2О) = 32,4г Д Н2 (вещества) = 21 МФ -? ( Ответ С3Н6) |
Задачи на вывод молекулярной формулы органического вещества Вариант №9
( Ответ С4Н10)
m(вещества) = 1,2г m(СО2) = 3,52г m(Н2О) = 2,16г Д Н2 (вещества) = 15 МФ -? ( Ответ С2Н6) | Задачи на вывод молекулярной формулы органического вещества Вариант №10
( Ответ С4Н8)
m(вещества) = 2,34г V(СО2) = 4.032л ДН2(вещества) = 39 МФ -? ( Ответ С6Н6) |
Задачи на вывод молекулярной формулы органического вещества Вариант №11
( Ответ С2Н4О)
m(вещества) = 1,8г m(СО2) = 3,96г m(Н2О) = 2,16г ДН2 (вещества) = 30 МФ -? ( Ответ С3Н8О) | Задачи на вывод молекулярной формулы органического вещества Вариант №12
( Ответ С2Н6О)
m(вещества) = 2,52г m(СО2) = 7,92г m(Н2О) = 3,24г Д возд.(вещества) = 2,9 МФ -? ( Ответ С6Н12) |
Задачи на вывод молекулярной формулы органического вещества Вариант №13
( Ответ СН2Сl2)
m(вещества) = 12г VСО2) = 8,96л m(Н2О) = 7,2г ДН2 (вещества) = 15 МФ -? ( Ответ СН2О) | Задачи на вывод молекулярной формулы органического вещества Вариант №14
( Ответ С2Н4О2)
m(вещества) = 2,24г m(СО2) = 7,04г ДН2 (вещества) = 56 МФ -? ( Ответ С8Н16) |
Задачи на вывод молекулярной формулы органического вещества Вариант №15
( Ответ С4Н8)
m(вещества) = 3,9г m(СО2) = 13,2г m(Н2О) = 2,7г ДН2 (вещества) = 39 МФ -? ( Ответ С6Н6) | Задачи на вывод молекулярной формулы органического вещества Вариант №16
( Ответ СН4О)
m(вещества) = 0,7г V(СО2) = 1,12л m(Н2О) = 0,9г ДН2 (вещества) = 42 МФ -? ( Ответ С6Н12) |
По теме: методические разработки, презентации и конспекты
Блок-схема «Решение задач по теме: Вывод формул органических веществ»
Демонстрация двух основных вариантов решения задач по органической химии, связанных с выводом химических формул соединений. …
…
МЕТОДИЧЕСКАЯ РАЗРАБОТКА лекция «Решение задач по теме «Вывод молекулярной формулы органического вещества по продуктам сгорания»»
Проблемная лекция по теме «Вывод молекулярной формулы органического вещества по продуктам сгорания» для обучающихся 10 класса с использованием ИКТ….
Решение задач на вывод формул органических соединений
В данном методическом материале находятся задачи, которые можно использовать на уроке» Решение задач на вывод молекулярной формулы органических веществ»…
Задачи на вывод молекулярной формулы органических и неорганических веществ.
Вашему вниманию предлагается подборка задач к урокам химии в 10 классе, которые можно использовать при изучении темы «Алканы», и при решении задач на вывод молекулярной формулы органических и не…
Решение задач на нахождение молекулярной формулы органических веществ
Презентацию можно использовать учителю и учащимся при обучении решению задач на вывод формул органических веществ. …
…
Дидактический материал по органической химии » Все типы задач на нахождение формул органических соединений»
Предложено нескольео вариантов , в которых типовые задачи помещены по типу решения эадач на нахождения формул органических соединений….
структурные формулы органических соединений
Собраны все основные структурные формулы органических соединений, встречающиеся в школьных учебниках по органической химии…
Поделиться:
Список химических формул для класса 10 Скачать PDF
Если вы учащийся 10 класса и читаете научную книгу NCERT, то вы должны искать для

Химическая формула Список для 10 класса PDF
Вы 10 класс студент, и вы должны сдать экзамен в этом году. Вы должны много работать для подготовки к экзамену. Вы также можете прочитать список химических соединений их названия и формулы
Таблица Содержимое |
Список химических формул для класса 10 |
Формула химических соединений Класс 10 Вопрос |
Вопросы по всем химическим формулам |
Похожие темы для вас |
👉 Как сбалансировать химическое уравнение
Химия является частью
научная книга. Если вы хотите хорошо разбираться в химии,
тогда вы должны понять и запомнить класс 10
химическая формула . Наряду с этой темой вы должны пройти Решения 10 класса Науки.
Наряду с этой темой вы должны пройти Решения 10 класса Науки.
Перечень химических формул для класса 10
С.Н. | Название химического соединения | Химическая формула |
формула серной кислоты | H 2 SO 4 | |
2 | сульфат цинка формула | ZnSO 4 |
3 | формула оксида магния | МдО |
4 | формула оксида железа | Fe 3 О 4 |
5 | спирт этиловый формула | С 2 Н 5 ОХ |
6 | формула глюкозы | С 6 Н 12 О 6 |
7 | Формула гидроксида кальция | Са(ОН) 2 |
8 | формула оксида кальция | СаО |
9 | формула двуокиси углерода | СО 2 |
10 | формула сульфата железа | FeSO 4 |
11 | формула диоксида серы | SO 2 |
12 | формула трехокиси серы | СО 3 |
13 | формула нитрата свинца | Pb (№ 3 ) 2 |
14 | формула оксида свинца | ПбО |
15 | формула диоксида азота | № 2 |
16 | формула хлорида серебра | AgCl |
17 | Формула бромида серебра | AgBr |
18 | формула гидроксида бария | Ва(ОН) 2 |
19 | формула хлорида аммония | NH 4 Класс |
20 | хлорид бария формула | BaCl 2 |
21 | формула гидроксида аммония | НХ 4 ОХ |
22 | формула сульфата меди(II) | CuSO 4 |
23 | формула хлорида меди | CuCl 2 |
24 | формула хлорида свинца | PbCl 2 |
25 | формула сульфата натрия | Na 2 SO 4 |
26 | Формула хлорида натрия | NaCl |
27 | Формула йодида калия | КИ |
28 | Формула хлорида калия | KCl |
29 | формула хлорида марганца | MnCl 2 |
30 | формула соляной кислоты | HCl |
31 | формула оксида марганца | MnO 2 |
32 | оксид натрия формула | На 2 О |
33 | Формула оксида железа | Fe 2 О 3 |
34 | формула оксида алюминия | Ал 2 О 3 |
35 | формула хлорного железа | FeCl 2 |
36 | формула хлорного железа | FeCl 3 |
37 | формула гидроксида железа(II) | Fe(ОН) 2 |
38 | формула аммиака | НХ 3 |
39 | Формула сероводорода | Н 2 С |
40 | формула сульфата алюминия | Ал 2 (СО 4 ) 3 |
41 | формула хлорида алюминия | AlCl 3 |
42 | формула сульфата бария | БаСО 4 |
43 | формула гидроксида калия | КОН |
44 | Формула азотной кислоты | HNO 3 |
45 | Формула нитрата кальция | Ca(№ 3 ) 2 |
46 | формула гидроксида натрия | NaOH |
47 | нитрат серебра формула | AgNO 3 |
48 | формула нитрата натрия | NaNO 3 |
49 | формула карбоната кальция | СаСО 3 |
50 | формула карбоната цинка | ZnCO 3 |
51 | оксид цинка формула | ZnO |
52 | формула хлорида магния | MgCl 2 |
53 | формула угарного газа | СО |
54 | формула соляной кислоты | HCl |
55 | формула уксусной кислоты | СН 3 СООН |
56 | формула гидроксида магния | Мг(ОН) 2 |
57 | формула цинката натрия | Na 2 ZnO 2 |
58 | формула карбоната натрия | Na 2 CO 3 |
59 | формула гидрокарбоната натрия | NaHCO 3 |
60 | формула гидрокарбоната кальция | Ca(HCO 3 ) 2 |
61 | формула отбеливающего порошка | CaOCl 2 |
62 | гипсовая формула | CaSO 4 . |
63 | формула гипса | CaSO 2 .1/2H 2 O |
64 | формула хлорида лития | LiCl |
65 | формула алюмината натрия | NaAlO 3 |
66 | формула оксида калия | К 2 О |
67 | формула гидроксида калия | КОН |
68 | Сульфид цинка формула | ЗНС |
69 | формула сульфида ртути | HgS |
70 | формула оксида ртути | HgO |
71 | формула сульфида меди | Медь 2 С |
72 | формула закиси меди | Медь 2 О |
73 | формула бромида натрия | NaBr |
74 | формула хлороформа | CHCl 3 |
75 | формула метана | СН 4 |
76 | Формула этана | С 2 Н 6 |
77 | Формула бензола | С 6 Н 6 |
78 | Формула циклогексана | С 6 Н 12 |
79 | формула метанола | CH 3 ОН |
80 | формула угольной кислоты | H 2 CO 3 |
81 | формула четыреххлористого углерода | ККл 4 |
82 | формула ацетата натрия | CH 3 COONa |
83 | формула этоксида натрия | CH 3 CH 2 ONa |
84 | формула йодида натрия | НаИ |
85 | формула фосфата кальция | Са 3 (ПО 4 ) 2 |
86 | формула карбоната калия | К 2 СО 3 |
87 | Формула гидрида кальция | CaH 2 |
88 | формула гидрида магния | МгН 2 |
89 | формула гидрида натрия | NaH |
90 | формула сульфида натрия | Нет 2 С |
91 | формула сернистого калия | К 2 С |
92 | формула сульфида кальция | КАС |
93 | формула фосфата натрия | Нет данных 3 Заказ на поставку 4 |
94 | формула фосфата калия | К 3 Заказ на покупку 4 |
95 | формула сульфита натрия | Нет 2 SO 3 |
96 | формула сульфита калия | К 2 SO 3 |
97 | Формула бромида калия | КБр |
98 | формула йодида калия | КИ |
99 | формула бромида кальция | CaBr 2 |
100 | нитрат железа формула | Fe(№ 3 ) 3 |
101 | формула гидрокарбоната аммония | NH 4 HCO 3 |
102 | формула сулемы | HgCl 2 |
103 | формула гидроксида алюминия | Ал(ОН) 3 |
104 | формула силиката натрия | Na 2 SiO 3 |
105 | Цинк сульфат гептагидрат формула | ZnSO 4 . |
106 | формула сульфата аммония | (NH 4 ) 2 SO 4 |
107 | Формула аммиачной селитры | NH 4 НЕТ 3 |
108 | формула хлорида аммония | NH 4 Класс |
109 | формула карбоната аммония | (NH 4 ) 2 CO 3 |
110 | формула фосфата аммония | (НХ 4 ) 3 Заказ на поставку 4 |
111 | формула нитрата магния | Мг(НО 3 ) 2 |
112 | формула оксида лития | Ли 2 О |
113 | фосфат магния формула | Мг 3 (ПО 4 ) 2 |
114 | формула азотистой кислоты формула | HNO 2 |
115 | бихромат калия формула | К 2 Cr 2 О 7 |
116 | формула фторида кальция | КаФ 2 |
117 | оксид бария формула | БаО |
11 | формула бромида кальция | CaBr 2 |
119 | бромид магния формула | MgBr 2 |
120 | диоксид кремния формула | SiO 2 |
121 | нитрат меди формула | Cu(№ 3 ) 2 |
122 | формула фторида калия | КФ |
123 | нитрат бария формула | Ба(№ 3 ) 2 |
124 | тиосульфат натрия формула | Нет 2 С 2 О 3 |
125 | сульфат кальция, формула | CaSO 4 |
👉Прочитайте- 125Потрясающие факты о человеческом теле
вы, должно быть, хорошо запомнили химические формулы. Вы должны предоставить MCQ
викторина ниже, чтобы проверить свои знания. Вы можете занять все свое время. Окончательно,
Вы сможете получить свою оценочную карту.
Вы должны предоставить MCQ
викторина ниже, чтобы проверить свои знания. Вы можете занять все свое время. Окончательно,
Вы сможете получить свою оценочную карту.
Идет загрузка…
Важная химическая формула для класса 10 было дано в приведенную выше таблицу. Вы должны хорошо запомнить все эти химические формулы. В 9 классе научили составлять эти химические формулы, так что вы Таким образом, вы можете создать эти химические формулы самостоятельно.
Если вы помните химические формулы 10 класса, то сможете решить вопросы, связанные с им.
Теперь решите несколько вопросов на основе класс 10 химическая формула самостоятельно.
Вопросы по формуле химических соединений, класс 10
1. Что такое формула уксусной кислоты?
а. CH 3 COCH 3
б. CH 3 COOH
c. CH 3 CH 2 COOH
d. СООН
2. Напишите формулу
органическая кислота
Напишите формулу
органическая кислота
а. ОХС 3
б. H 2 CO 3
c. Н 3 СО 3
д. H 3 CO 2
3. Что такое химическое название H 2 SO 4 ?
а. серная кислота
б. Азотистая кислота
c. азотная кислота
d. соляная кислота
4. Укажите химическое название HCl
а. Серная кислота
b. Соляная кислота
c. Кислота хлора
d. Кислота серы
👉Читать- 125Сногсшибательные факты о человеческом теле
5. Что такое химическое название ZnSO4?
а. Сульфит цинка
b. Сульфид цинка
c. Сульфат цинка
d. Цинк серный
6. Что такое гипс? Парижская формула?
а. CuSO 4 .H 2 O
б. CaSO 4 .1/2H 2 O
c. CaSO 4 .2H 2 O
d. CuSO 4
7. Что такое химическое
формула сульфата аммония?
Что такое химическое
формула сульфата аммония?
а. NH 4 SO 4
б. NH 4 (SO 4 )
c. (NH 4 ) 2 SO 4
d. NH 4 SO2
8. Укажите химическое формула хлороформа
а. CH 2 Cl 2
б. CH 3 Cl
c. CHCl 3
d. ККл 4
9. FeCl 2 это химическая формула какого из следующий?
а. Хлорид железа
b. Хлорид железа
c. Дихлорид железа
d. Дихлорид железа
10 . CuO является химической формулой какого из следующих веществ?
а. Сверкающий хлорид
b. Хлорид меди
c. Дихлорид меди
d. Оксид меди
11. Напишите химическое вещество формула гидроксида алюминия?
а. AlOH 3
б. Ал (ОН) 3
в. Al 2 OH
d. AlOH
AlOH
12. Дайте химическое формула фосфата цинка —
а. Zn 2 (ПО 4 ) 3
б. ЗнПО 4
в. Zn 2 (ПО) 2
д. Zn 2 PO 4
13. Fe(NO3)3 химическая формула-
а. Нитрат железа
b. Нитрат железа
c. Нитрит железа
д. Нитрит железа
14. HNO 2 is химическая формула-
а. Азотная кислота
б. Азотистая кислота
c. Азотная кислота
d. Азотистоводородная кислота
15. MnO2 — это химическое формула-
а. Диоксид марганца
b. Оксид марганца
c. Оксид магния
d. Диоксид магния
👉Читать- 125 Невероятные факты о человеческом теле
Вопросы по всем химическим формулам1. Напишите молекулярную формулу аммиака.
2. Приведите формулу сульфата хрома.
3. Какова химическая формула гидроксида аммония?
4. Приведите формулу азотнокислого хрома.
Приведите формулу азотнокислого хрома.
5. Напишите формулу хлорида цинка.
Похожие темы для вас
1. Решения NCERT для науки 10 класса
2. Дополнительные вопросы науки 10 класса
3. Умопомрачительные удивительные факты о человеческом теле
4. Список химических соединений
5. Как сбалансировать химическую реакцию
19.1 Атомная масса и моль | Количественные аспекты химических изменений
19.1 Атомная масса и моль (ESAFW)
Уравнение химической реакции может дать нам много полезной информации. Оно говорит нам, что такое реагенты и продукты находятся в реакции, и это также говорит нам о соотношении, в котором реагенты объединяются в формировать изделия. Посмотрите на уравнение ниже:
\[\text{Fe} + \text{S} \rightarrow \text{FeS}\] В этой реакции каждый атом железа (\(\text{Fe}\)) будет реагировать с одним атомом серы (\(\text{S}\)) до
образуют сульфид железа (\(\text{FeS}\)). Однако то, что уравнение не говорит нам, это количество или количество каждого вещества, которое участвует. Вы можете например
дать небольшой образец железа для реакции. Как узнать, сколько атомов железа содержится в этом образце? И
сколько атомов серы потребуется для реакции, чтобы израсходовать все имеющееся у вас железо? Есть ли способ
зная, какая масса сульфида железа получится в конце реакции? Все это очень важно
вопросы, особенно когда реакция промышленная, где важно знать количества
необходимые реагенты и количество образующегося продукта. В этой главе будет рассмотрено, как
количественно оценить изменения, происходящие в
химические реакции.
Однако то, что уравнение не говорит нам, это количество или количество каждого вещества, которое участвует. Вы можете например
дать небольшой образец железа для реакции. Как узнать, сколько атомов железа содержится в этом образце? И
сколько атомов серы потребуется для реакции, чтобы израсходовать все имеющееся у вас железо? Есть ли способ
зная, какая масса сульфида железа получится в конце реакции? Все это очень важно
вопросы, особенно когда реакция промышленная, где важно знать количества
необходимые реагенты и количество образующегося продукта. В этой главе будет рассмотрено, как
количественно оценить изменения, происходящие в
химические реакции.
Крот (ESAFX)
Иногда важно точно знать, сколько частиц (например, атомов или молекул) содержится в образце вещества или какое количество вещества необходимо для протекания химической реакции.
Количество вещества настолько важно в химии, что ему дали собственное название — моль.
- Крот (\(n\))
Моль (аббревиатура «моль») — это единица СИ (Международный стандарт), обозначающая «количество вещество». 9{-1}\).
Если бы у нас было столько банок из-под прохладительных напитков, то мы могли бы покрыть поверхность земли на глубину более \(\text{300}\) \(\text{км}\)! Если бы вы могли считать атомы со скоростью 10 миллионов в секунду, то это заняло бы вам 2 миллиарда лет считать атомы в одном моле!
Первоначальная гипотеза, предложенная Амадео Авогадро, заключалась в том, что «равные объемы газов при
одинаковые температура и давление, содержат одинаковое число молекул». Его идеи не были приняты
научное сообщество, и только через четыре года после его смерти его первоначальная гипотеза была принята и
что он стал известен как «Закон Авогадро». В честь его вклада в науку число
частиц в одном моле было названо 9{\text{23}}\) атомов меди. В самом деле, если мы измерим относительную
атомная масса любого элемента периодической таблицы, у нас есть один моль этого элемента.
В самом деле, если мы измерим относительную
атомная масса любого элемента периодической таблицы, у нас есть один моль этого элемента.
Моль и масса
Учебник Упражнение 19.1
Сколько атомов в:
1 моль вещества
2 моля кальция
5 моль фосфора
\(\text{24,3}\) \(\text{g}\) из магния
\(\text{24,0}\) \(\text{g}\) углерода
Решение пока недоступно
Заполните следующую таблицу:
Элемент | Относительная атомная масса (ед. | Масса образца (г) | Количество молей в образце |
Водород | \(\текст{1,01}\) | \(\текст{1,01}\) | |
Магний | \(\текст{24,3}\) | \(\текст{24,3}\) | |
Углерод | \(\текст{12,0}\) | \(\текст{24,0}\) | |
Хлор | \(\текст{35,45}\) | \(\текст{70,9}\) | |
Азот | \(\текст{14,0}\) | \(\текст{42,0}\) |
Решение пока недоступно
Молярная масса (ESAFY)
- Молярная масса
Молярная масса (\(M\)) – это масса 1 моля химического вещества.
 {-1}$}\).
{-1}$}\).
Вы помните, что когда масса элемента в граммах равна его относительной атомной массе, образец содержит один моль этого элемента. Эта масса называется молярной массой этого элемента.
Иногда молярную массу можно увидеть в виде \(M_{m}\). Мы будем использовать \(M\) в этой книге, но вы должны быть известно об альтернативной записи.
Следует помнить следующее: в периодической таблице показанная относительная атомная масса может быть интерпретируется двояко.
Масса (в граммах) одного среднего атома этого элемента по отношению к массе атома углерод.
Средняя атомная масса всех изотопов этого элемента. Это использование относительной атомной массы .
Масса одного моля элемента . Это третье использование — молярная масса элемента.
 9{-1}$}\))
9{-1}$}\)) Масса одного моля элемента (г)
Магний
\(\текст{24,3}\)
\(\текст{24,3}\)
\(\текст{24,3}\)
Литий
\(\текст{6,94}\)
\(\текст{6,94}\)
\(\текст{6,94}\)
Кислород
\(\текст{16,0}\)
\(\текст{16,0}\)
\(\текст{16,0}\)
Азот
\(\текст{14,0}\)
\(\текст{14,0}\)
\(\текст{14,0}\)
Железо
\(\текст{55,8}\)
\(\текст{55,8}\)
\(\текст{55,8}\)
Таблица 19.
временный текст 9{-1}$}} \\ & = \frac{\text{111,7}\text{г·моль}}{\text{55,8}\text{г}} \\ & = \text{2,0017…}\text{моль} \\ & \ приблизительно \ текст {2} \ текст { моль} \конец{выравнивание*} 1: Соотношение между относительной атомной массой, молярной массой и массой одного моля для числа
элементов.
1: Соотношение между относительной атомной массой, молярной массой и массой одного моля для числа
элементов.В образце содержится 2 моля железа.
Рабочий пример 2: Расчет массы по молям
У вас есть образец, содержащий 5 молей цинка.
Какова масса цинка в образце?
9{\text{24}}\text{атомы}\) (ответ на вопрос б)Моль и молярная масса
Учебник Упражнение 19.2
Укажите молярную массу каждого из следующих элементов:
газообразный водород
азот газообразный
газообразный бром
Решение пока недоступно
Подсчитайте количество молей в каждом из следующих образцов:
\(\text{21,6}\) \(\text{g}\) бора (\(\text{B}\))
\(\text{54,9}\) \(\text{g}\) марганца (\(\text{Mn}\))
\(\text{100,3}\) \(\text{g}\) ртути (\(\text{Hg}\))
\(\text{50}\) \(\text{g}\) бария (\(\text{Ba}\))
\(\text{40}\) \(\text{g}\) из свинца (\(\text{Pb}\))
Решение пока недоступно
Уравнение для расчета молей и массы (ESAFZ)
Мы можем рассчитать молярную массу следующим образом:
Это можно изменить, чтобы получить количество молей:
\[n = \frac{m}{M}\]Следующая диаграмма может помочь запомнить взаимосвязь между этими тремя переменными.
 {-1}$}} \\
& = \text{2}\text{моль}
\конец{выравнивание*}
9{\text{24}}\) атомов алюминия в образце \(\text{81}\)
\(\текст{г}\).
{-1}$}} \\
& = \text{2}\text{моль}
\конец{выравнивание*}
9{\text{24}}\) атомов алюминия в образце \(\text{81}\)
\(\текст{г}\).Некоторые простые расчеты
Учебник Упражнение 19.3
Подсчитайте количество молей в каждом из следующих образцов:
\(\text{5,6}\) \(\text{g}\) кальция
\(\text{0,02}\) \(\text{g}\) марганца
\(\text{40}\) \(\text{g}\) из алюминия
Решение пока недоступно
Свинцовое грузило имеет массу \(\text{5}\) \(\text{g}\).
Рассчитайте количество молей свинца, содержащихся в грузиле.
Сколько атомов свинца в грузиле?
Решение пока недоступно
Соединения (ЭСАГА)
До сих пор мы обсуждали только моли, массу и молярную массу по отношению к элементам .
 Но что произойдет, если
мы имеем дело с соединением? Применяются ли те же концепции и правила? Ответ да . Однако вы
нужно помнить, что все ваши расчеты будут относиться к целому соединению 9{\text{23}}\) молекул хлорида натрия в одной формульной единице.
Но что произойдет, если
мы имеем дело с соединением? Применяются ли те же концепции и правила? Ответ да . Однако вы
нужно помнить, что все ваши расчеты будут относиться к целому соединению 9{\text{23}}\) молекул хлорида натрия в одной формульной единице.В сбалансированном химическом уравнении число, написанное перед элементом или соединением, показывает молярное отношение , при котором реагенты объединяются с образованием продукта. Если впереди нет цифр символа элемента, это означает, что число равно «1».
Видео: VPezc
напр. \(\text{N}_{2} + 3\text{H}_{2} \rightarrow 2\text{NH}_{3}\)
9{-1}$} \конец{выравнивание*}Рабочий пример 6: Расчет молей по массе
Рассчитайте количество молей в \(\text{1}\) \(\text{kg}\) из \(\text{MgCl}_{2}\).
Перевести массу в граммы
\[m = \text{1}\text{кг} \times \frac{\text{1 000}\text{г}}{\text{1}\text{кг}} = \текст{1 000}\текст{г}\]Рассчитать молярную массу
\[M_{\text{MgCl}_{2}} = \text{24,3}\text{ г·моль$^{-1}$} + 2(\text{35,45}\text{ г ·моль$^{-1}$}) = \текст{9{-1}$}} \\ & = \text{10,5042. ..}\text{моль} \\
& \приблизительно \text{10,5}\text{ моль}
\конец{выравнивание*}
..}\text{моль} \\
& \приблизительно \text{10,5}\text{ моль}
\конец{выравнивание*}В образце \(\text{1}\) \(\text{кг}\) содержится \(\text{10,5}\) \(\text{молей}\) хлорида магния.
Понимание родинок, молекул и числа Авогадро
Разделитесь на группы по три человека и в течение 20 минут вместе отвечайте на следующие вопросы:
Каковы единицы измерения моля? Подсказка: проверьте определение родинки.
У вас есть \(\text{46}\) \(\text{g}\) образец диоксида азота (\(\text{NO}_{2}\))
Сколько молей \(\text{NO}_{2}\) содержится в образце?
Сколько молей атомов азота содержится в образце?
Сколько молей атомов кислорода содержится в образце?
Сколько молекул \(\text{NO}_{2}\) содержится в образце?
В чем разница между родинкой и молекулой?
Точный размер Число Авогадро иногда трудно представить.

Запишите число Авогадро без экспоненциального представления.
Сколько времени потребуется, чтобы сосчитать число Авогадро? Вы можете предположить, что можете считать два числа в каждую секунду.
Более сложные расчеты
Учебник Упражнение 19.4
Рассчитайте молярную массу следующих химических соединений:
\(\текст{КОН}\)
\(\text{FeCl}_{3}\)
\(\text{Mg}(\text{OH})_{2}\)
Решение еще не доступно
Сколько родинок присутствует в: 9{-}\) ионы
Решение пока недоступно
У вас есть образец, содержащий \(\text{3}\) \(\text{моль}\) хлорида кальция.


 Относительная плотность паров этого вещества по водороду равна 22.
Относительная плотность паров этого вещества по водороду равна 22. (вещества) = 1,52
(вещества) = 1,52 Относительная плотность паров этого вещества по водороду равна 13.
Относительная плотность паров этого вещества по водороду равна 13. Относительная плотность паров этого вещества по водороду равна 16.
Относительная плотность паров этого вещества по водороду равна 16. Относительная плотность паров этого вещества по воздуху равна 2.
Относительная плотность паров этого вещества по воздуху равна 2. 09% водорода и 36.36% кислорода. Относительная плотность паров этого вещества по водороду равна 22.
09% водорода и 36.36% кислорода. Относительная плотность паров этого вещества по водороду равна 22. Относительная молекулярная масса этого вещества равна 85.
Относительная молекулярная масса этого вещества равна 85. Относительная плотность паров этого вещества по азоту равна 2.
Относительная плотность паров этого вещества по азоту равна 2. 2H 2 O
2H 2 O 7H 2 O
7H 2 O )
)  {-1}$}\).
{-1}$}\). 9{-1}$}\))
9{-1}$}\))  1: Соотношение между относительной атомной массой, молярной массой и массой одного моля для числа
элементов.
1: Соотношение между относительной атомной массой, молярной массой и массой одного моля для числа
элементов. {-1}$}} \\
& = \text{2}\text{моль}
\конец{выравнивание*}
9{\text{24}}\) атомов алюминия в образце \(\text{81}\)
\(\текст{г}\).
{-1}$}} \\
& = \text{2}\text{моль}
\конец{выравнивание*}
9{\text{24}}\) атомов алюминия в образце \(\text{81}\)
\(\текст{г}\). Но что произойдет, если
мы имеем дело с соединением? Применяются ли те же концепции и правила? Ответ да . Однако вы
нужно помнить, что все ваши расчеты будут относиться к целому соединению 9{\text{23}}\) молекул хлорида натрия в одной формульной единице.
Но что произойдет, если
мы имеем дело с соединением? Применяются ли те же концепции и правила? Ответ да . Однако вы
нужно помнить, что все ваши расчеты будут относиться к целому соединению 9{\text{23}}\) молекул хлорида натрия в одной формульной единице. ..}\text{моль} \\
& \приблизительно \text{10,5}\text{ моль}
\конец{выравнивание*}
..}\text{моль} \\
& \приблизительно \text{10,5}\text{ моль}
\конец{выравнивание*}