Презентация изопроцессы 10 класс – Презентация по физике на тему «Изопроцессы в газах» (10 класс)
Презентация к уроку по физике (10 класс) по теме: Изопроцессы
Слайд 1
Газовые законыСлайд 2
Назовите макропараметры Давление [p]=[ Па ] Объем [V]=[ м³ ] Температура [ Т ]=[ К ]
Слайд 3
p V = m R T M Какое уравнение связывает макропараметры? Уравнение Менделеева — Клайперона
Слайд 4
Изопроцессы Процесс, протекающий при постоянном макропараметре, называется изопроцессом Изотермический Изобарический Изохорический
Слайд 5
Закон Бойля-Мариотта (изотермический процесс) Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется pV=const при T=const
Слайд 6
V /Т =const при р =const Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется Закон Гей-Люссака (изобарный процесс)
Слайд 7
p /Т =const при V=const Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется Закон Шарля (изохорный процесс)
Слайд 8
Изотермы V 0 P V 0 T P 0 T
Слайд 9
Изобары V 0 T V 0 P P 0 T
Слайд 10
Изохоры
Слайд 11
Изобары Изотермы Изохоры
Слайд 12
Проверь свои знания 1) изотермическое сжатие 2) изохорное нагревание 3) изобарное нагревание 4) изотермическое расширение 5) изобарное сжатие 6) изохорное охлаждение 4 2 6 5 1 3 Назовите процесс:
Слайд 13
Проверь свои знания 1) изотермическое сжатие 2) изохорное нагревание 3) изобарное нагревание 4) изотермическое расширение 5) изобарное сжатие 6) изохорное охлаждение 4 2 6 5 1 3 Назовите процесс:
Слайд 14
Проверь свои знания 1) изотермическое сжатие 2) изохорное нагревание 3) изобарное нагревание 4) изотермическое расширение 5) изобарное сжатие 6) изохорное охлаждение 4 2 6 5 1 3 Назовите процесс:
Слайд 15
Выбери правильный ответ 1) p =const V T 2) T =const p V 3) V =const T p 4) p =const T V 5) T =const p V 6) V =const p T 1 2 3 4 5 6
Слайд 16
Выбери правильный ответ 1) p =const V T 2) T =const p V 3) V =const T p 4) p =const T V 5) T =const p V 6) V =const p T 1 2 3 4 5 6
Слайд 17
Выбери правильный ответ 1) p =const V T 2) T =const p V 3) V =const T p 4) p =const T V 5) T =const p V 6) V =const p T 1 2 3 4 5 6
Слайд 18
Задание на построение На рисунке дан график изменения состояния идеально-го газа в координат-ных осях V, T . Представьте этот процесс на графиках в координатных осях (p, V) и (p, T)
Слайд 19
Задание на построение 1-2 изобара V T 2-3-изотерма V p 3-1-изохора T p
Слайд 20
Задание на построение 1-2 изобара V T 2-3-изотерма V p 3-1-изохора T p
Слайд 21
Задание на построение 1-2 изобара V T 2-3-изотерма V p 3-1-изохора T p
Слайд 22
P 0 T 1 2 3 T V 1 2 3 P 0 V 1 2 3 Сколько циклов представлено ОДИН
Слайд 23
Из истории физики Одна из его заслуг – полет на воздушном шаре. Он получил церковное образование, был игуменом монастыря. Он писал, как можно при помощи барометра определить высоту местности. Одним из его ассистентов был Гук, впоследствии ставший знаменитым ученым. Ему принадлежат термины «пипетка» и «бюретка», вошедшие в обиход. Шарль Мариотт Мариотт Бойль Гей-Люссак
Слайд 24
Какое состояние больше
Слайд 25
Какое состояние больше
Слайд 26
Какое состояние больше
Слайд 27
Решите задачу Объем и температура заданной массы разряженного газа уменьшились в 2 раза. Химический состав не изменился. Давление газа при этом увеличилось в 2 раза увеличилось в 4 раза уменьшилось в 2 раза уменьшилось в 4 раза не изменилось
Слайд 28
Решите задачу Объем и давление заданной массы разряженного газа уменьшились в 2 раза. Температура газа при этом увеличилась в 2 раза увеличилась в 4 раза уменьшилась в 2 раза уменьшилась в 4 раза не изменилась
Слайд 29
Желаю Вам успеха Учитель физики Кобзарева Е.А. МОУ Лизиновская СОШ Россошанского района Воронежской области
nsportal.ru
Презентация по физике на тему: «Изопроцессы»
Презентация
Тема: «Изопроцессы»
Выполнил:
Учитель МОУ СОШ №5.
Поминов Максим Васильевич

решение задач
теория
Тестирование
Список литературы
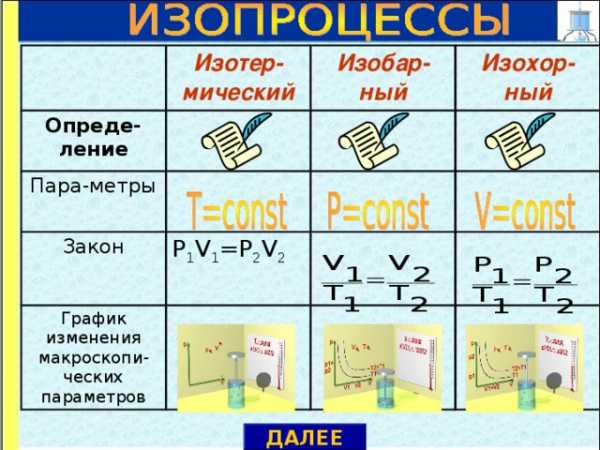
Изотер-мический
Опреде-ление
Изобар-ный
Пара-метры
Изохор-ный
Закон
P 1 V 1 =P 2 V 2
График изменения макроскопи-ческих параметров
ДАЛЕЕ

Изопроцесс – процесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным
Макроскопические параметры – параметры характеризующие макросистему: давление, температура, объем ( P,V,T )

Изотермически й процесс (закон Бойля-Мариотта) – процесс изменения состояния определенной массы газа при постоянной температуре.
При изотермическом процессе Т= const , m= const .

Изобарный процесс(закон Гей-Люссака) – процесс изменения состояния определенной массы газа при постоянном давлении.
При изобарном процессе p = const , m= const .

Изохорный процесс(закон Шарля) – процесс изменения состояния определенной массы газа при постоянном объеме.
При изохорном процессе V = const , m= const .
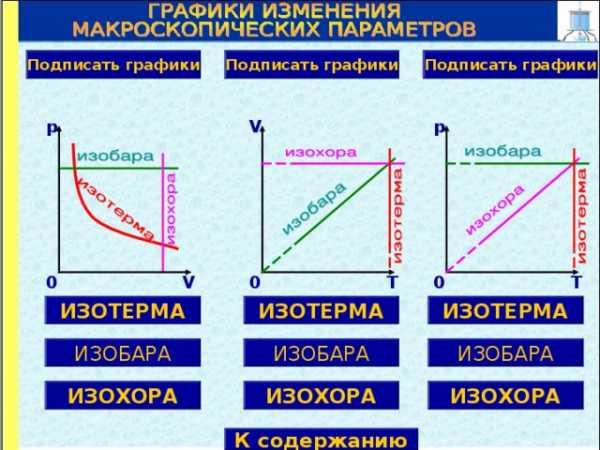
Подписать графики
Подписать графики
Подписать графики
p
V
p
0
T
0
T
0
V
ИЗОТЕРМА
ИЗОТЕРМА
ИЗОТЕРМА
ИЗОБАРА
ИЗОБАРА
ИЗОБАРА
ИЗОХОРА
ИЗОХОРА
ИЗОХОРА
К содержанию
8

Необходимо знать из курса математики
- Решение уравнений и систем уравнений
- Линейная функция и ее график
- График обратно пропорциональной зависимости
ДАЛЕЕ
К содержанию
8

- Уравнение – равенство с одной или несколькими неизвестными. Значение неизвестной, при которой получается верное неравенство, называется корнем уравнения.
- Решить систему уравнений – значит найти множество всех пар значений переменных, при подстановке которых оба уравнения системы обращаются в верные равенства. Это множество называется решением системы.
8

Линейное уравнение
Уравнение вида ax=b , где a и b – некоторые числа, а x — переменная, называется линейным уравнением (при а 0; х= b/a ).
Квадратное уравнение
Уравнение вида ax 2 +bx+c=0 , х-переменная, a,b,c – любые числа, причем a 0 , называется квадратным уравнением.
Корни квадратного уравнения находятся по формуле
при условии, что
8

Функция у= kx+b , где х и у – переменные, а k и b – любые действительные числа, называется линейной . График линейной функции – прямая . Для его построения достаточно знать координаты двух точек, принадлежащих графику.
Если k =0, то у= b . График этой функции – прямая, параллельная оси х, проходящая через точку А(0, b )
У
У= b
A
0
х
12
у
А
B
b
l
0
х
12
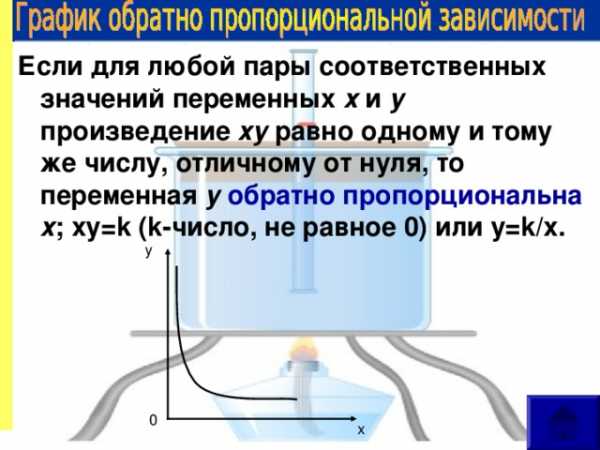
Если для любой пары соответственных значений переменных х и у произведение ху равно одному и тому же числу, отличному от нуля, то переменная у обратно пропорциональна х ; ху= k (k- число, не равное 0 ) или у= k/x .
у
0
х
12

Обратите внимание
- Если по условию параметры состояния газа не изменяются, запишите уравнение Менделеева-Клапейрона и выразите неизвестную величину
- Если по условию даны два или несколько состояний газа, то при решении задач рекомендуется соблюдать последовательность:
- Параметры состояния газа (как данные, так и искомые) запишите по форме:
- Запишите уравнение Менделеева-Клапейрона для каждого состояния, дополнительные условия, решите систему уравнений относительно искомой величины.
1 состояние газа
2 состояние газа
m 1 =…
m 2 =…
p 1 =…
p 2 =…
V 1 =…
T 1 =…
V 2 =…
T 2 =…

Пр.1
P 0
В цилиндре под поршнем находится воздух. Вес поршня Р=60 Н, площадь цилиндра S 0 =20см2, атмосферное давление р
?
Р
?
S 0
ПУСК
16

Пр.1
В цилиндре под поршнем находится воздух. Вес поршня Р=60 Н, площадь цилиндра S 0 =20см 2 , атмосферное давление р 0 =10 5 Па. Груз какого веса надо положить на поршень, чтобы объем воздуха в цилиндре уменьшился в два раза? Трение не учитывайте, температура постоянна?
1 состо-яние газа
2 состо-яние газа
m 1 =m
p 1 =p 0 +(P/S 0 )
m 2 =m
V 1
p 2 =p 0 +(P/S 0 )+(P 1 /S 0 )
T 1 =T
V 2 =V 1 /2
T 2 =T
P 1 — ?

Пр.1
1 состо-яние газа
m 1 =m
2 состо-яние газа
p 1 =p 0 +(P/S 0 )
m 2 =m
V 1
p 2 =p 0 +(P/S 0 )+(P 1 /S 0 )
T 1 =T
V 2 =V 1 /2
T 2 =T
P 1 — ?
Решение:
P/S 0 — давление поршня; P 1 /S 0 — давление груза.
Согласно закону Бойля-Мариотта p 1 V 1 =p 2 V 2 ;
( p 0 +P/S 0 )V 1 =(p 0 +P/S 0
Отсюда
P 1 =p 0 S 0 +P=260 (Н).
Ответ: P 1 =260 Н.
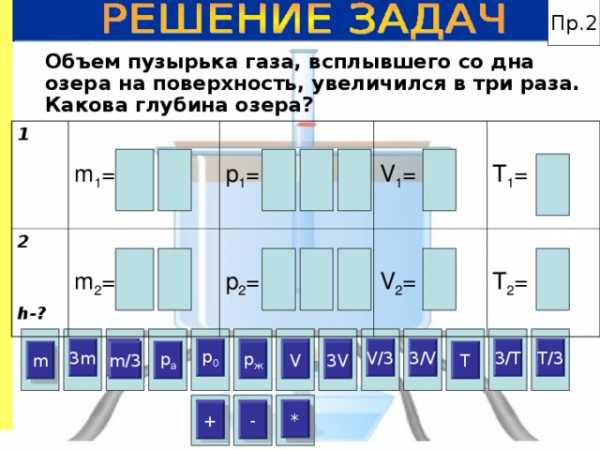
Пр.2
Объем пузырька газа, всплывшего со дна озера на поверхность, увеличился в три раза. Какова глубина озера?
1
m 1 =
2
h- ?
m 2 =
p 1 =
V 1 =
p 2 =
V 2 =
T 1 =
T 2 =
p 0
3m
3/T
V/3
3/V
3/T
T/3
T/3
p ж
3/V
V/3
3V
V
p 0
m/3
3m
p a
p ж
V
3V
m/3
T
T
m
p a
m
*
—
*
+
+
—
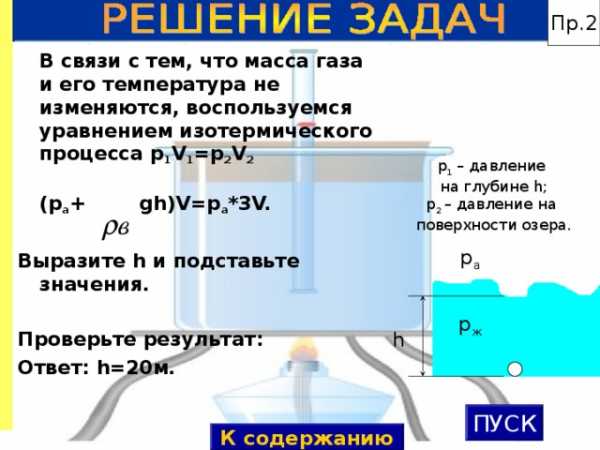
Пр.2
В связи с тем, что масса газа и его температура не изменяются, воспользуемся уравнением изотермического процесса p 1 V 1 =p 2 V 2
(p а + gh)V=p а *3 V.
Выразите h и подставьте значения.
Проверьте результат:
Ответ: h=20 м.
p 1 – давление
на глубине h ;
p 2 – давление на
поверхности озера.
p а
p ж
h
ПУСК
К содержанию

№ 1
Как изменится давление идеального газа при увеличении температуры и объема газа в 4 раза?
ПУСК
21

№ 2
В одинаковых сосудах при одинаковой температуре находятся водород (Н 2 ) и углекислый газ (СО 2 ). Массы газов одинаковы. Какой из газов и во сколько раз оказывает большее давление на стенки сосуда?
21
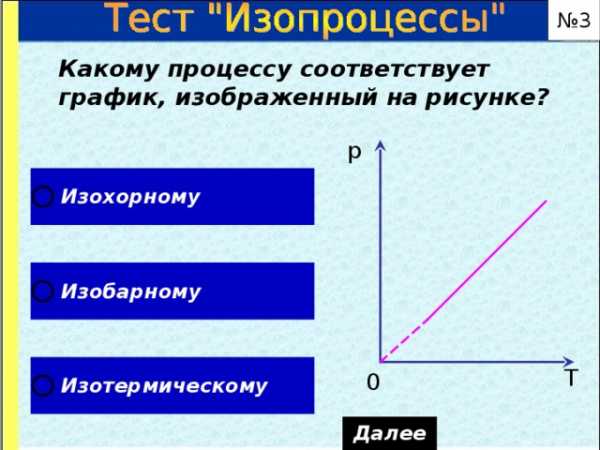
№ 3
Какому процессу соответствует график, изображенный на рисунке?
p
Т
0
23
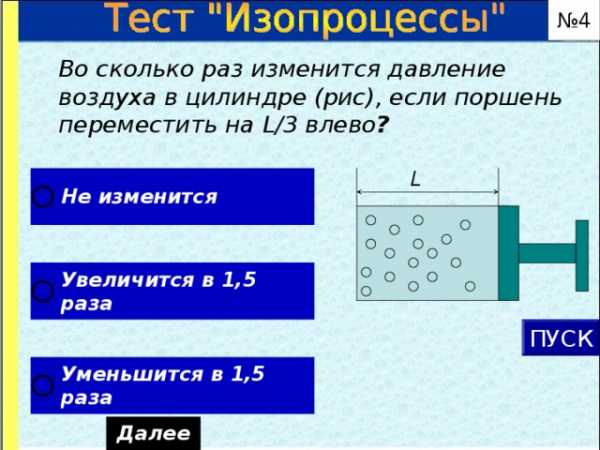
№ 4
Во сколько раз изменится давление воздуха в цилиндре (рис), если поршень переместить на L /3 влево ?
L
ПУСК
24

№ 5
Во сколько раз отличается плотность метана (СР4) от плотности кислорода (О2) при одинаковых условиях ?
24

К содержанию
24

- Марон, А.Е. Физика. Законы, формулы, алгоритмы решения задач: материалы для подготовки к единому государственному экзамену и вступительным экзаменам в аузы/ А.Е.Марон, Д.Н.Городецкий, В.Е.Марон, Е.А.Марон; под ред.А.Е.Марона.-М.:Дрофа, 2008.
- Касьянов, В.А. Физика.10кл.:Учебн.для общеобразоват.учеб.заведений.-3-е изд. – М.:Дрофа, 2002.
- Марон, А.Е. Физика. 10класс: дидактические материалы/А.Е.Марон, Е.А.Марон.-6-е изд.-М.:Дрофа, 2009.
videouroki.net
Изопроцессы. 10-й класс
Разделы: Физика, Конкурс «Презентация к уроку»
Презентация к уроку
Загрузить презентацию (1,9 МБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Тип урока: урок изучения и первичного закрепления новых знаний.
Цель:
- Формирование представления об изопроцессах, изучение законов Бойля-Мариотта, Гей-Люссака, Шарля, их графическое представление.
- Расширить кругозор учащихся осуществлением межпредметных связей с курсом математики
- Создать условия для выявления качества и уровня овладения знаниями и умениями с использованием компьютерных технологий.
Задачи:
- Образовательные: изучить газовые законы; формировать умение объяснять законы с молекулярной точки зрения; изображать графики процессов; начать обучение учащихся решать графические и аналитические задачи, используя уравнение состояния и газовые законы; установление межпредметных связей (физика, математика, биология).
- Воспитательные: продолжить формирование познавательного интереса учащихся; в целях интернационального воспитания обратить внимание учащихся, что физика развивается благодаря работам ученых различных стран и исторических времен; продолжить формирование стремления к глубокому усвоения теоретических знаний через решение задач.
- Развивающие: активизация мыслительной деятельности (способом сопоставления), формирование алгоритмического мышления; развитие умений сравнивать, выявлять закономерности, обобщать, логически мыслить; научить применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач.
План урока:
- Организационный момент.
- Актуализация знаний.
- Объяснение нового материала.
- Закрепление нового материала.
- Домашнее задание.
Ход урока
I. Организационный момент.
Слайды 1-3
Перед учащимися определяются цели урока, освещается ход урока и конечные результаты его проведения.
II. Актуализация знаний.
Фронтальный опрос
- Что является объектом изучения МКТ? (Идеальный газ.)
- Что в МКТ называется идеальным газом? (Идеальный газ – это газ, в котором взаимодействием между молекулами можно пренебречь.)
- Для того чтобы описать состояние идеального газа, используют три термодинамических параметра. Какие? (Давление, объем и температура.)
- Какое уравнение связывает между собой все три термодинамических параметра? (Уравнение состояния идеального газа).
III. Объяснение нового материала.
Слайды 4-6
Учитель. Итак, мы отметили, что уравнение состояния идеального газа связывает между собой три макроскопических параметра: р, Т и V. Но при любых ли процессах все эти параметры изменяются? Давайте рассмотрим несколько примеров. Возьмем надувной круг. Какой параметр здесь постоянен? (учащиеся отвечают: объем не изменяется). А если мы деформируем его и объем изменим, но внешних условий менять не будем? (учащиеся отвечают: при деформации объем уменьшится, давление внутри возрастет, а температура останется постоянной). А что произойдет с кругом при повышении температуры? (учащиеся отвечают: объем растет с повышением температуры, а давление внутри круга равно внешнему давлению и постоянно). Теперь мы знаем, что существуют процессы, при которых отдельные макроскопические параметры сохраняются.
Теперь рассмотрим каждый из представленных процессов подробнее и установим для каждого из них связь между Т, р и V.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Изопроцесс – процесс, при котором масса газа и один из его термодинамических параметров остаются неизменными.
Газовых законов, как и изопроцессов – три. Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут. Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И. Менделеевым.
Слайды 7-10 Изотермический процесс. Закон Бойля-Мариотта.
Первый газовый закон был открыт английским ученым Бойлем в 1662 году. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал давление газа в зависимости от объёма при постоянной температуре. Данный процесс называется изотермическим.
Имя французского аббата Эдма Мариотта в названии закона появилось в 1676 году благодаря его работе “Речь о природе воздуха”, в которой были описаны опыты, аналогичные экспериментам Бойля. Поэтому закон получил название закона Бойля-Мариотта.
Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно.
Затем рисуется график, даётся его название — изотерма. При построении графиков проводится аналогия с соответствующим разделом из математики.
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине.
Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и вследствие образовавшегося перепада давлений происходит вдох. Другими словами воздух идет из окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выравниваются.
Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
Слайды 11-14
Закрепление нового материала. Решение задач.
Слайды 15-18 Изобарный процесс. Закон Гей-Люссака.
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным. Первооткрыватель — Жозеф Луи Гей-Люссак (1802 год).
Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.
Рисуется график, даётся его название и отмечается, что зависимость (V/T) представляет собой tg угла наклона прямой к оси T.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Слайды 19, 12-14
Закрепление нового материала. Решение задач.
Слайды 20-23 Изохорный процесс. Закон Гей-Люссака.
В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Рисуется график, даётся его название.
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
Слайды 24, 12-14
Закрепление нового материала. Решение задач.
IV. Закрепление нового материала.
Слайды 25-31
Мы познакомились с тремя изопроцессами: изотермическим, изобарным и изохорным. Все они вытекают из уравнения состояния идеального газа.
Далее предлагаю обучающимся мини тест, чтобы они определились в своих знаниях полученных за урок, а также проверили свои умения.
V. Домашнее задание.
Слайды 32
§69, № 522, № 524
Литература:
- Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский Физика, 10 класс. – М.: «Просвещение», 2011.
- А.П. Рымкевич Физика. Задачник 10-11 класс. – М.: Дрофа, 2005.
18.01.2014
xn--i1abbnckbmcl9fb.xn--p1ai
Конспект урока в 10 классе на тему «Изопроцессы»
Конспект урока физики в 10 классе
Тема: «Изопроцессы».
Цель занятия: изучение и первичное закрепление полученных знаний о газовых законах (их значение в природе и технике, закономерности).
Задачи занятия:
Познавательные: ввести понятие «изопроцесс» и «газовый закон», получить формулы газовых законов и уравнение состояния идеального газа, определить зависимости между параметрами в них, научить строить графики процессов в разных системах координат, решать графические и аналитические задачи, используя уравнения газовых законов.
Развивающие: закрепить знание уравнений состояния идеального газа и их применение при решении задач, развивать умение сравнивать, выявлять закономерности, обобщать, логически мыслить; научить применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач, раскрыть взаимосвязь между изученным теоретическим материалом и явлениями в жизни;
Воспитательные: воспитывать самостоятельность, трудолюбие, точность и четкость при ответе, сознательное отношение к процессу обучения, формировать практические навыки в применении и закреплении полученных знаний, познавательный интерес к предмету, развивать умение видеть физику вокруг себя, творческий подход к решению задач
Сегодня, ребята, мы попытаемся, используя уже накопленные нами знания, пройти сложный путь первооткрывателей и сформулировать пусть уже открытые законы. Но мы пока учимся, а дальше, может быть, вам откроется то, о чем сегодня ученые даже не думают. Повторим то, что изучали ранее.
Фронтальный опрос
(слайд 2)
Что является объектом изучения молекулярно-кинетической теории? (Идеальный газ)
Что в молекулярно-кинетической теории называется идеальным газом? (Идеальный газ – это модель, в которой взаимодействием между молекулами и размерами молекул можно пренебречь)
Каковы нормальные условия для идеального газа? (давление 101 325 Па, температура 273,13 К, объем 1 моля газа – 22,4 дм3 )
Для того чтобы описать состояние идеального газа, используют три термодинамических параметра. Какие? (Давление, объем и температура)
Какие макроскопические параметры связываются уравнением Клапейрона – Менделеева? (Давление, объем, температура)
Письменная проверка домашнего задания
А) Тест (слайд 3)
1. Как изменится давление идеального одноатомного газа при изменении его объема в 4 раза и увеличении температуры в 2 раза?
А. Увеличится в 8 раз
Б. Уменьшится в 4 раза
В. Увеличится в 2 раза
Г. Не изменится
(слайд 4)
2. Вычислите давление кислорода массой 0,032 кг в сосуде объемом
8,3 м 3 при температуре 100 0 С.
А. 10 Па
Б. 830 Па
В. 100 Па
Г. 373 Па
(слайд 5)
3. Как изменится масса воздуха в помещении, если температура увеличится?
А. Увеличится
Б. Уменьшится
В. Не изменится
(слайд 6)
4. Чему равен объем одного моля идеального газа при нормальных условиях?
А. 1 м3
Б. 24 м3
В. 0,024 м3
(слайд 7)
Б) Задачи:
Вариант 1: Какова температура 1,6·10-2 кг кислорода, находящегося под давлением 106 Па и занимающего объем 1,6·10-3 м3 ? Молярная масса кислорода 32·10-3 кг/моль.
Вариант 2: Определите давление воздуха в сосуде объемом 2·10-3 м3, если его масса 1,2 ·10-2 кг, температура 270С, а молярная масса 29·10-3 кг/моль.
Изучение нового материала
Мы знаем, что состояние данной массы газа полностью определено, если известны его давление, температура и объем — параметры состояния газа.
Изопроцесс. Газовый закон
Особый интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами. Запишите определение
Изопроцесс – это переход газа из одного состояния в другое, при котором масса газа и один из его термодинамических параметров остаются неизменными. ( слайд 8)
Газовый закон – количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего. (слайд 9)
Газовых закона, как и изопроцесса – три. Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут. Но в истории физики сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И. Менделеевым.
4.1 Изотермический процесс
Изотермический процесс – процесс изменения состояния определенной массы газа при постоянной температуре (Т=const) (слайд 10)
Для идеального газа изотермический процесс описывается законом Бойля-Мариотта. Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским аббатом Эдмоном Мариоттом, который описал независимо от Бойля аналогичные опыты в 1676 году
Формулировка: Для газа данной массы при постоянной температуре произведение давления на объем постоянно:
или (слайд 11)
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными. Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда, температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине. Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и вследствие образовавшегося перепада давлений происходит вдох. Другими словами, воздух идет из окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выровняются. Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
При изотермическом расширении происходит уменьшение средней кинетической энергии молекул газа, т. е газ охлаждается. Поэтому для поддержания постоянной температуры газа к нему нужно подводить тепло.
Графически этот закон можно изобразить в виде изотермы, которую вы видите в осях (p, V) (V, T) (p,T) (слайд 12)
Решим задачу: (слайд 13) Сосуд объемом 12 л, содержащий газ при давлении 4·105 Па, соединяют с другим сосудом объемом 3 л, из которого полностью откачан воздух. Найти конечное значение давления. Процесс изотермический.
4.2 Изобарный процесс
Изобарный процесс – процесс изменения состояния определенной массы газа, протекающий при постоянном давлении (Р=const) (слайд 14).
Для идеального газа изобарный процесс описывается законом Гей-Люссака. Закон установлен в 1802 году французским физиком Жозефом Луи Гей-Люссаком, который определял объем газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально
Формулировка: для газа данной массы при постоянном давлении отношение объема газа к его термодинамической температуре постоянно:
или (слайд 15).
Графически этот закон изображается с помощью изобары. Вы видите изобары в осях ( p, V ) (p, T) (V, T) (слайд 16)
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
При изобарном расширении температура газа и соответственно средняя квадратичная скорость молекул возрастают за счет тепла, подводимого к газу.
Решим задачу: (слайд 17) Газ при температуре 300 К занимает объем 250 см3. Какой объем займет та же масса газа, если температура повысится до 324 К? Давление считать постоянным.
4.3 Изохорный процесс
Изохорный процесс – процесс изменения состояния определенной массы газа, протекающий при постоянном объеме (V=const). (слайд 18)
Для идеального газа изохорный процесс описывается законом Шарля. В 1787 году французский ученый Жак Александр Цезар Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля (слайд 19)
Формулировка: Для газа данной массы при постоянном объеме отношение давления к температуре постоянно:
или
Что происходит с давлением при нагревании? При охлаждении? Почему? Графически этот закон изображается с помощью изохоры: (слайд 20) эта зависимость показана в координатах (V, T ) (p,T) и (р,V)
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
При изохорном нагревании газа за счет подводимого к нему тепла средняя квадратичная скорость молекул и соответственно температура и давление газа возрастают.
Решим задачу. (слайд 21) Газ находится в баллоне при температуре 288 К и давлении 18 атм. При какой температуре давление газа станет равным 15,6 атм? Объем газа считать неизменным.
Закрепление и систематизация полученных знаний
А теперь проверим, насколько хорошо вы разобрались в газовых законах. Необходимо самостоятельно выполнить задания (слайд 22)
Задание 6. Даны графики процессов в различных системах координат:
Найти во всех трех системах координат:
Изотермы;
Изохоры;
Изобары.
Подведение итогов и рефлексия
Сегодня мы с вами хорошо поработали. Результаты следующие (выставить и прокомментировать оценки). А еще ответьте на вопросы:
1. Сегодняшний урок мне (понравился или не понравился)
2. Мне понравилось …(назвать, что именно)
3. Что нового узнали? Чему научились?
Домашнее задание :
§ 54 ( учебник Физика – 10, Касьянов В.А)
№ 500, 509, 511, 515 (Сборник задач по физике – А.П. Рымкевич, П.А. Рымкевич)
Решить задачу: При температуре 27оС давление газа в закрытом сосуде было 75кПа. Каким будет давление этого газа при температуре – 13оС?
Хочу закончить это занятие следующим высказыванием: «Сколько бы ты не жил, всю жизнь следует учиться» (Сенека). Всем спасибо. До свидания.
infourok.ru
Конспект урока по физике на тему «Изопроцессы» с презентацией, 10 класс.
Муниципальное бюджетное общеобразовательное учреждение
«Лицей»
Методическая разработка для проведения урока по теме:
«Изопроцессы»
Разработала:
Учитель физики
Газетова Татьяна Леонидовна
г. Арзамас
2017 г.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Представлен план урока в 10 классе.
Образовательное учреждение: Муниципальное бюджетное общеобразовательное учреждение «Лицей»
Учитель : Газетова Татьяна Леонидовна
Учебная дисциплина: Физика.
Тема занятия: «Изопроцессы».
Цель занятия: изучить, систематизировать и закрепить полученные знания о газовых законах (их значение в природе, исследовать закономерности).
Задачи занятия:
познавательные: ввести понятие «изопроцесс» и «газовый закон», получить формулы газовых законов и уравнение состояния идеального газа для изопроцессов, определить зависимости между параметрами в них, научить строить графики процессов в разных системах координат.
развивающие: закрепить знание уравнений состояния идеального газа и их применение при решении задач, развивать умение сравнивать, выявлять закономерности, обобщать, логически мыслить; научить применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач, раскрыть взаимосвязь между изученным теоретическим материалом и явлениями в жизни;
воспитательные: воспитывать самостоятельность, трудолюбие, точность и четкость при ответе, сознательное отношение к процессу обучения, формировать практические навыки в применении и закреплении полученных знаний, познавательный интерес к дисциплине, развивать умение видеть физику вокруг себя, творческий подход к решению задач.
Планируемые образовательные результаты:
Личностные:
физически грамотное поведение в профессиональной деятельности и быту при обращении с газовыми приборами и устройствами;
умение использовать полученные знания о взаимозависимости параметров состояния газа в выбранной профессиональной деятельности;
умение работать с конспектом и учебником;
умение управлять своей познавательной деятельностью, проводить самооценку уровня собственного интеллектуального развития.
Метапредметные:
применение методов наблюдения, описания и эксперимента для изучения параметров состояния газа;
умение определять средства, необходимые для решения аналитических и графических задач;
умение составлять уравнения и решать задачи, анализировать полученный результат и изображать зависимости на координатной плоскости;
умение публично представлять полученные результаты, вести дискуссии;
Предметные:
понимание физической сущности зависимости агрегатного состояния вещества от его структуры и характера взаимодействия молекул, роли полученных закономерностей состояния газа для решения практических задач;
владение основами молекулярно-кинетической теории;
умение обрабатывать результаты измерений, обнаруживать зависимость между параметрами состояния газа, объяснять полученные результаты и делать выводы;
сформированность умения решать аналитические и графические физические задачи;
сформированность умения объяснять зависимость свойств веществ от их состава и строения, применять полученные знания для объяснения физических явлений в природе, профессиональной сфере и для принятия практических решений в повседневной жизни.
Оснащение занятия: электронная презентация.
Технические средства обучения: мультимедийный проектор, компьютер с лицензионным программным обеспечением, экран
Литература:
1. Касьянов В.А. Физика. 10 кл. Углубленный уровень: учебник. – М. : Дрофа, 2016.
2. Волков В.А. Универсальные поурочные разработки по физике: 10 класс. – М.: ВАКО, 2007
3. Кабардин О.Φ., Орлов В.А. Экспериментальные задания по физике. 9–11 классы: учебное пособие для учащихся общеобразовательных учреждений. – М., 2001.
Интернет-ресурсы:
edu.ru — «Российское образование» Федеральный портал
school.edu — «Российский общеобразовательный портал»
Хронометраж урока :
Организационный момент 2 минуты
Фронтальные опрос по предыдущему занятию 5 минут.
Письменная проверка домашнего задания 7 минут.
Изучение нового материала. 20 минут
4.1. Изотермический процесс
4.2. Изобарный процесс
4.3. Изохорный процесс
5. Закрепление и систематизация полученных знаний 8 минут
6. Подведение итогов и рефлексия, домашнее задание 3 минуты
Ход учебного занятия:
1. Организационный момент
Здравствуйте, садитесь! Давайте проверим присутствующих.
Тема сегодняшнего нашего занятия: «Изопроцессы». Запишите в тетрадях число и тему занятия.
Сегодня нам необходимо одно из важных понятий в физике – газовые законы и изопроцессы.
Цель занятия: изучение и первичное закрепление полученных знаний о газовых законах (их значение в природе и технике, закономерности).
Задачи занятия:
Познавательные: ввести понятие «изопроцесс» и «газовый закон», получить формулы газовых законов и уравнение состояния идеального газа, определить зависимости между параметрами в них, научить строить графики процессов в разных системах координат, решать графические и аналитические задачи, используя уравнения газовых законов.
Развивающие: закрепить знание уравнений состояния идеального газа и их применение при решении задач, развивать умение сравнивать, выявлять закономерности, обобщать, логически мыслить; научить применять полученные знания в нестандартных ситуациях для решения графических и аналитических задач, раскрыть взаимосвязь между изученным теоретическим материалом и явлениями в жизни;
Воспитательные: воспитывать самостоятельность, трудолюбие, точность и четкость при ответе, сознательное отношение к процессу обучения, формировать практические навыки в применении и закреплении полученных знаний, познавательный интерес к предмету, развивать умение видеть физику вокруг себя, творческий подход к решению задач
Сегодня, ребята, мы попытаемся, используя уже накопленные нами знания, пройти сложный путь первооткрывателей и сформулировать пусть уже открытые законы. Но мы пока учимся, а дальше, может быть, вам откроется то, о чем сегодня ученые даже не думают. Повторим то, что изучали ранее.
2. Фронтальный опрос
(слайд 2)
Что является объектом изучения молекулярно-кинетической теории? (Идеальный газ)
Что в молекулярно-кинетической теории называется идеальным газом? (Идеальный газ – это модель, в которой взаимодействием между молекулами и размерами молекул можно пренебречь)
Каковы нормальные условия для идеального газа? (давление 101 325 Па, температура 273,13 К, объем 1 моля газа – 22,4 дм3 )
Для того чтобы описать состояние идеального газа, используют три термодинамических параметра. Какие? (Давление, объем и температура)
Какие макроскопические параметры связываются уравнением Клапейрона – Менделеева? (Давление, объем, температура)
3. Письменная проверка домашнего задания
А) Тест (слайд 3)
1. Как изменится давление идеального одноатомного газа при изменении его объема в 4 раза и увеличении температуры в 2 раза?
А. Увеличится в 8 раз
Б. Уменьшится в 4 раза
В. Увеличится в 2 раза
Г. Не изменится
(слайд 4)
2. Вычислите давление кислорода массой 0,032 кг в сосуде объемом
8,3 м 3 при температуре 100 0 С.
А. 10 Па
Б. 830 Па
В. 100 Па
Г. 373 Па
(слайд 5)
3. Как изменится масса воздуха в помещении, если температура увеличится?
А. Увеличится
Б. Уменьшится
В. Не изменится
(слайд 6)
4. Чему равен объем одного моля идеального газа при нормальных условиях?
А. 1 м3
Б. 24 м3
В. 0,024 м3
(слайд 7)
Б) Задачи:
Вариант 1: Какова температура 1,6·10-2 кг кислорода, находящегося под давлением 106 Па и занимающего объем 1,6·10-3 м3 ? Молярная масса кислорода 32·10-3 кг/моль.
Вариант 2: Определите давление воздуха в сосуде объемом 2·10-3 м3, если его масса 1,2 ·10-2 кг, температура 270С, а молярная масса 29·10-3 кг/моль.
4. Изучение нового материала
Мы знаем, что состояние данной массы газа полностью определено, если известны его давление, температура и объем — параметры состояния газа.
Изопроцесс. Газовый закон
Особый интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами. Запишите определение
Изопроцесс – это переход газа из одного состояния в другое, при котором масса газа и один из его термодинамических параметров остаются неизменными. ( слайд 8)
Газовый закон – количественная зависимость между двумя термодинамическими параметрами газа при фиксированном значении третьего. (слайд 9)
Газовых закона, как и изопроцесса – три. Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут. Но в истории физики сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И. Менделеевым.
4.1 Изотермический процесс
Изотермический процесс – процесс изменения состояния определенной массы газа при постоянной температуре (Т=const) (слайд 10)
Для идеального газа изотермический процесс описывается законом Бойля-Мариотта. Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским аббатом Эдмоном Мариоттом, который описал независимо от Бойля аналогичные опыты в 1676 году
Формулировка: Для газа данной массы при постоянной температуре произведение давления на объем постоянно:
или 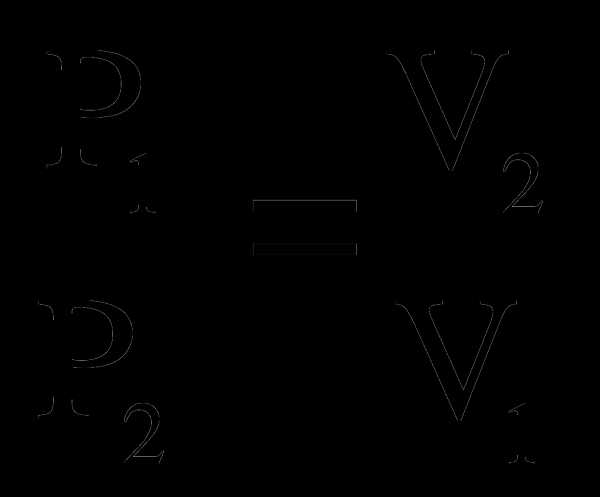 (слайд 11)
(слайд 11)
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными. Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда, температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине. Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и вследствие образовавшегося перепада давлений происходит вдох. Другими словами, воздух идет из окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выровняются. Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
При изотермическом расширении происходит уменьшение средней кинетической энергии молекул газа, т. е газ охлаждается. Поэтому для поддержания постоянной температуры газа к нему нужно подводить тепло.
Графически этот закон можно изобразить в виде изотермы, которую вы видите в осях (p, V) (V, T) (p,T) (слайд 12)
Решим задачу: (слайд 13) Сосуд объемом 12 л, содержащий газ при давлении 4·105 Па, соединяют с другим сосудом объемом 3 л, из которого полностью откачан воздух. Найти конечное значение давления. Процесс изотермический.
4.2 Изобарный процесс
Изобарный процесс – процесс изменения состояния определенной массы газа, протекающий при постоянном давлении (Р=const) (слайд 14).
Для идеального газа изобарный процесс описывается законом Гей-Люссака. Закон установлен в 1802 году французским физиком Жозефом Луи Гей-Люссаком, который определял объем газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально
Формулировка: для газа данной массы при постоянном давлении отношение объема газа к его термодинамической температуре постоянно:
 или
или (слайд 15).
(слайд 15).
Графически этот закон изображается с помощью изобары. Вы видите изобары в осях ( p, V ) (p, T) (V, T) (слайд 16)
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
При изобарном расширении температура газа и соответственно средняя квадратичная скорость молекул возрастают за счет тепла, подводимого к газу.
Решим задачу: (слайд 17) Газ при температуре 300 К занимает объем 250 см3. Какой объем займет та же масса газа, если температура повысится до 324 К? Давление считать постоянным.
4.3 Изохорный процесс
Изохорный процесс – процесс изменения состояния определенной массы газа, протекающий при постоянном объеме (V=const). (слайд 18)
Для идеального газа изохорный процесс описывается законом Шарля. В 1787 году французский ученый Жак Александр Цезар Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля (слайд 19)
Формулировка: Для газа данной массы при постоянном объеме отношение давления к температуре постоянно:
 или
или
Что происходит с давлением при нагревании? При охлаждении? Почему? Графически этот закон изображается с помощью изохоры: (слайд 20) эта зависимость показана в координатах (V, T ) (p,T) и (р,V)
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
При изохорном нагревании газа за счет подводимого к нему тепла средняя квадратичная скорость молекул и соответственно температура и давление газа возрастают.
Решим задачу. (слайд 21) Газ находится в баллоне при температуре 288 К и давлении 18 атм. При какой температуре давление газа станет равным 15,6 атм? Объем газа считать неизменным.
5. Закрепление и систематизация полученных знаний
А теперь проверим, насколько хорошо вы разобрались в газовых законах. Необходимо самостоятельно выполнить задания (слайд 22)
Задание 6. Даны графики процессов в различных системах координат:
Найти во всех трех системах координат:
Изотермы;
Изохоры;
Изобары.
6. Подведение итогов и рефлексия
Сегодня мы с вами хорошо поработали. Результаты следующие (выставить и прокомментировать оценки). А еще ответьте на вопросы:
1. Сегодняшний урок мне (понравился или не понравился)
2. Мне понравилось …(назвать, что именно)
3. Что нового узнали? Чему научились?
Домашнее задание :
§ 54 ( учебник Физика – 10, Касьянов В.А)
№ 500, 509, 511, 515 (Сборник задач по физике – А.П. Рымкевич, П.А. Рымкевич)
Решить задачу: При температуре 27оС давление газа в закрытом сосуде было 75кПа. Каким будет давление этого газа при температуре – 13оС?
Хочу закончить это занятие следующим высказыванием: «Сколько бы ты не жил, всю жизнь следует учиться» (Сенека). Всем спасибо. До свидания.
infourok.ru
Урок физики в 10 классе по теме «Изопроцессы. Газовые законы»

Изопроцессы.
Газовые законы

Цели урока : познакомиться
- с понятием «изопроцесс»
- с видами изопроцессов
- с законами протекания различных изопроцессов

Задачи урока:
- с помощью демонстрационного, лабораторного и виртуального экспериментов установить закономерности изопроцессов;
- доказать, что данные законы являются следствием уравнения Менделеева-Клапейрона;
- познакомиться с графиками изопроцессов.

Вопросы для повторения:
- Что называют уравнением состояния?
- Запишите уравнение Менделеева — Клапейрона.
- Почему газовая постоянная R называется универсальной?
- Для чего нужно уравнение состояния?

Итак, зная уравнение состояния, можно сказать, как протекают в системе различные процессы при определенных внешних условиях : например, как будет меняться давление газа, если увеличивать его объем при неизменной температуре, и т. д. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами .
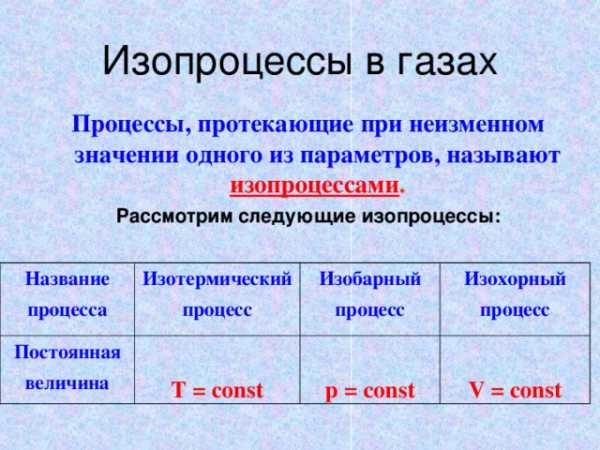
Изопроцессы в газах
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами .
Рассмотрим следующие изопроцессы:
Название
процесса
Изотермический
процесс
Постоянная
величина
Изобарный
процесс
T = const
Изохорный
процесс
p = const
V = const

Газовый закон –
количественная зависимость между
двумя параметрами газа
одной и той же массы при фиксированном значении третьего.
Газовые законы количественно
описывают изопроцессы, происходящие в газах .

Изопроцесс
Постоянная
величина
Закон
изопроцесса
Изотермический
Графики изопроцессов
Изохорный
В координатах
PV
Изобарный
В координатах
PT
В координатах
VT

Установка для демонстрации закономерностей изотермического процесса
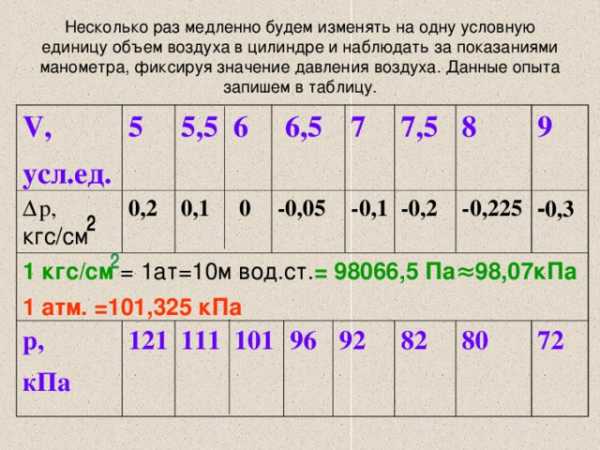
Несколько раз медленно будем изменять на одну условную единицу объем воздуха в цилиндре и наблюдать за показаниями манометра, фиксируя значение давления воздуха. Данные опыта запишем в таблицу.
V ,
усл.ед.
5
Δ р, кгс/см
0,2
5,5 6
1 кгс/см = 1ат=10м вод.ст. = 98066,5 Па ≈98,07кПа
6,5
0,1 0
1 атм. =101,325 кПа
р,
кПа
121
-0,05
111 101
7
-0,1
7,5
96
92
-0,2
8
9
-0,225
82
— 0,3
80
72
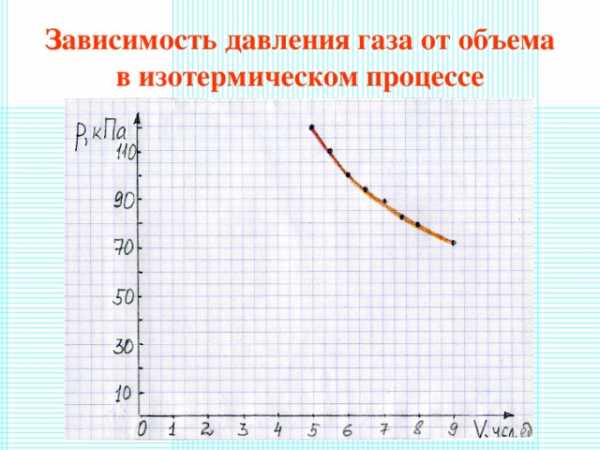
Зависимость давления газа от объема в изотермическом процессе

Вывод:
- При уменьшении объема давление газа увеличивается , а при увеличении объема газа давление уменьшается .
- Произведение PV для любого состояния остается постоянным при неизменной массе газа и постоянной температуре.
- При изотермическом процессе давление газа обратно пропорционально его объему.

Этот закон экспериментально был открыт английским ученым Р.Бойлем и несколько позже французским ученым Э.Мариоттом. Поэтому он носит название Бойля-Мариотта.
Английский ученый Р.Бойль
Французский ученый Э. Мариотт

Закон Бойля- Мариотта
Т = const , процесс изотермический
1 состояние газа:
2 состояние газа:
m = const
PV = PV = const при Т = const
PV = const при Т = const
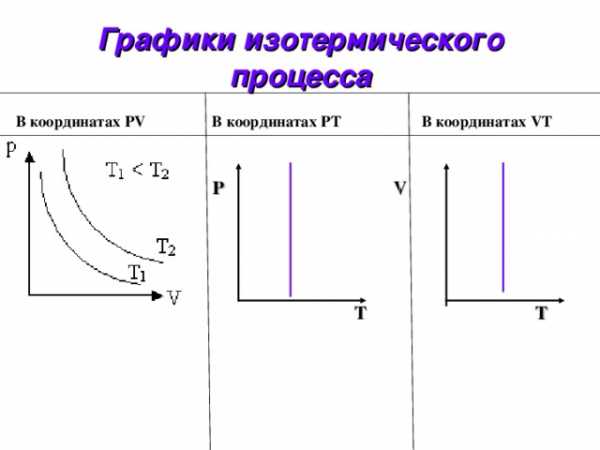
Графики изотермического процесса
В координатах PV В координатах PТ В координатах VТ
P V
T T
- Какие параметры газа остаются постоянными при изотермическом процессе?
- Как эти условия обеспечиваются в опыте ?
- Почему с точки зрения МКТ при уменьшении объема растет давление газа?
Лабораторная работа
«Изучение
закономерностей
изохорного процесса»
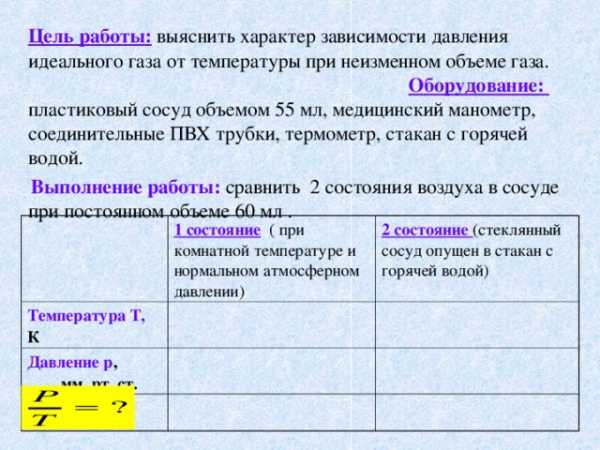
Цель работы: выяснить характер зависимости давления идеального газа от температуры при неизменном объеме газа. Оборудование: пластиковый сосуд объемом 55 мл, медицинский манометр, соединительные ПВХ трубки, термометр, стакан с горячей водой.
Выполнение работы: сравнить 2 состояния воздуха в сосуде при постоянном объеме 60 мл .
Температура Т, К
1 состояние ( при комнатной температуре и нормальном атмосферном давлении)
2 состояние (стеклянный сосуд опущен в стакан с горячей водой)
Давление р , мм. рт. ст.

Вывод :
- При уменьшении температуры давление газа уменьшается , при увеличении температуры давление газа увеличивается .
- Отношение для любого состояния остается постоянным при неизменной массе газа и постоянном объеме.
- При изохорном процессе давление газа прямо пропорционально температуре.

- Этот закон экспериментально был открыт французским ученым Шарлем. Поэтому он носит название закона Шарля.

Закон Шарля
V=const , процесс изохорный.
1 состояние газа:
2 состояние газа:
m = const
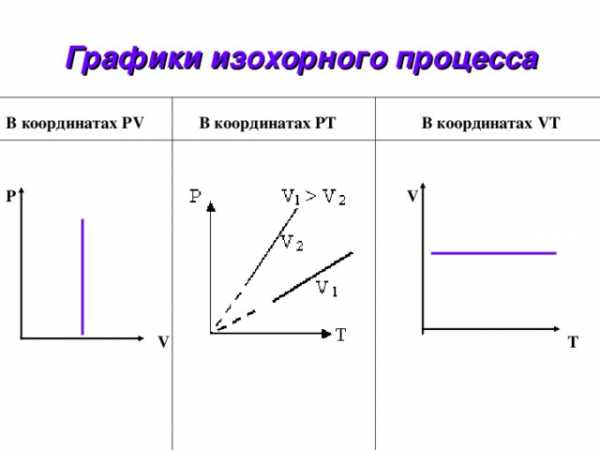
Графики изохорного процесса
В координатах PV В координатах PТ В координатах VТ
Р V
V T

- Какие параметры газа остаются постоянными при изохорном процессе?
- Можно ли график изохоры проводить из начала координат? Почему?
- Почему с точки зрения
МКТ при увеличении
температуры растет
и давление газа?

Изобарный процесс
р =const , процесс изобарный .
1 состояние газа:
2 состояние газа:
m = const
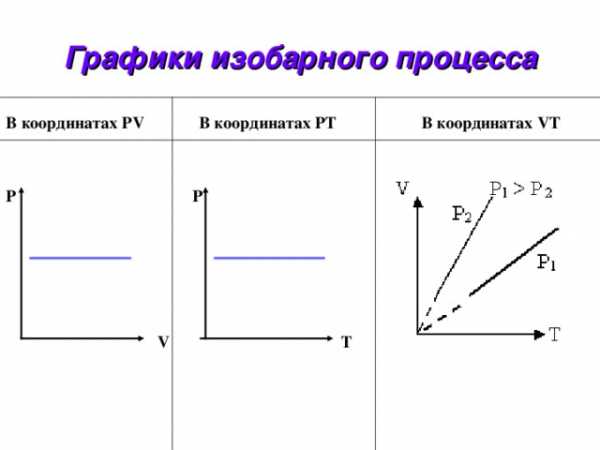
Графики изобарного процесса
В координатах PV В координатах PТ В координатах VТ
Р P
V T

- Какие параметры газа остаются постоянными при изобарном процессе?
- Можно ли график изобары проводить из начала координат? Почему?
- Почему с точки зрения МКТ
при увеличении температуры
растет и объем газа?

Изопроцессы в природе и технике
- Увеличение давления газа в любой емкости или в электрической лампочке при нагревании является изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объема.
- Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.

Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой – термостатом. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.

Обобщение
PV = m/M ·RT
ט = m/M
ט = const
P 1 V 1 = P 2 V 2
T 1 T 2
V = const
T = const
P = const
V 1 = V 2
T 1 T 2
P 1 V 1 = P 2 V 2
P 1 = P 2
T 1 T 2
29

Домашнее задание:
§ 71, ответить на вопросы
на стр.194
kopilkaurokov.ru
Презентация к уроку по физике (10 класс) по теме: Изопроцессы в физике
Слайд 1
ТЕСТ на знание понятий по теме: «ИЗОПРОЦЕССЫ» начало Учитель: Чернодыр Т.П. ГБОУ СОШ №285 им. В.А. МолодцоваСлайд 2
Вопрос № 1 Какое состояние газа, является стационарным равновесным состоянием? состояние, в котором число молекул в заданном интервале скоростей периодически изменяется. состояние, в котором число молекул в заданном интервале скоростей остаётся постоянным. состояние, в котором число молекул в заданном интервале скоростей изменяется хаотически.
Слайд 3
Вопрос № 2 pV= m M RT mV= M p RT pV= RT M m Какая формула является уравнением идеального газа?
Слайд 4
Вопрос № 3 Какие процессы изменения состояния идеального газа называют изопроцессами? процесс, при котором все макроскопические параметры состояния данной массы газа изменяются. процесс, при котором любой макроскопический параметр состояния данной массы газа изменяется. процесс, при котором один из макроскопических параметров состояния данной массы газа остаётся постоянным.
Слайд 5
Вопрос № 4 Какой процесс называется изотермическим? процесс изменения состояния определённой массы газа при постоянной температуре. процесс изменения состояния определённой массы газа при постоянном давлении. процесс изменения состояния определённой массы газа при постоянном объёме.
Слайд 6
Вопрос № 5 Какой процесс называется изохорным? процесс изменения состояния определённой массы газа при постоянной температуре. процесс изменения состояния определённой массы газа при постоянном давлении. процесс изменения состояния определённой массы газа при постоянном объёме.
Слайд 7
Вопрос № 6 Какой процесс называется изобарным? процесс изменения состояния определённой массы газа при постоянной температуре. процесс изменения состояния определённой массы газа при постоянном давлении. процесс изменения состояния определённой массы газа при постоянном объёме.
Слайд 8
Вопрос № 7 Что называется температурой тела? мера средней потенциальной энергии хаотического поступательного движения его молекул. мера средней кинетической энергии хаотического поступательного движения его молекул. мера средней внутренней энергии хаотического поступательного движения молекул.
Слайд 9
Вопрос № 8 Абсолютный нуль температуры (0 К)? температура, при которой должно прекратиться движение молекул . температура, при которой начинает замерзать вода. температура, при которой вода закипает.
Слайд 10
Вопрос № 9 Как изменится давление идеального газа при увеличении температуры и объёма газа в 4 раза? увеличится в 4 раза. уменьшится в 4 раза. не изменится.
Слайд 11
МОЛОДЕЦ ! Ты ответил на все 9 вопросов правильно и значит набрал — 9 баллов. конец
Слайд 12
ХОРОШО ! Ты ответил на 8 вопросов правильно и значит набрал — 8 баллов. конец
Слайд 13
ХОРОШО ! Ты ответил на 7 вопросов правильно и значит набрал — 7 баллов. конец
Слайд 14
но подучи ещё ! Ты ответил на 6 вопроса правильно и значит набрал — 6 балла. ХОРОШО, конец
Слайд 15
ПРИДЁТСЯ ПОДУЧИТЬ ! Ты ответил всего на 5 вопросов правильно и значит набрал — 5 баллов. конец
Слайд 16
ПРИДЁТСЯ ПОДУЧИТЬ ! Ты ответил всего на 4 вопроса правильно и значит набрал — 4 балла. конец
Слайд 17
ПЛОХО ! Ты ответил всего на 3 вопроса правильно и значит набрал — всего 3 балла. конец
Слайд 18
ПЛОХО ! Ты ответил всего на 2 вопроса правильно и значит набрал — всего 2 балла. конец
Слайд 19
ПЛОХО ! Ты ответили всего на 1 вопрос правильно и значит набрал — всего 1 балл. конец
Слайд 20
ТЫ НЕ ГОТОВ К УРОКУ СОВСЕМ ! Ты ответил на все 9 вопросов неправильно и значит не набрал баллов вообще. конец
nsportal.ru

