Олимпиада по химии школьный этап с ответами 10 класс: Всероссийская олимпиада по химии, задания
Школьная олимпиада по химии 10 класс | Олимпиадные задания по химии (10 класс) на тему:
Школьный этап всероссийской олимпиады школьников по химии
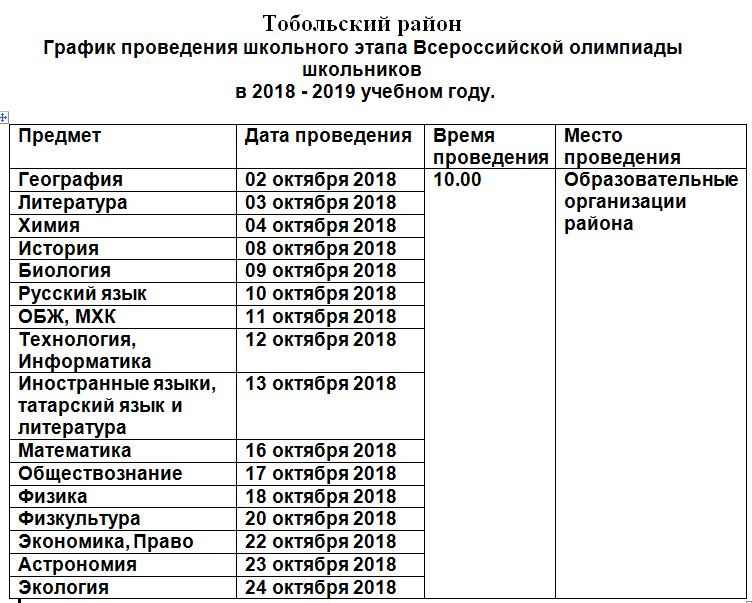
2018-2019 учебный год 10 класс
Задание 1. Вам предлагаются тестовые задания, требующие выбора только одного ответа из четырех возможных. Максимальное количество баллов, которое можно набрать – 14 (по 1 баллу за каждое тестовое задание).
Часть 1.
- В атоме железа распределение электронов по электронным слоям соответствует ряду чисел
1) 2; 14; 8; 2
2) 2; 4; 8; 6; 6
3) 2; 8; 14; 2
4) 2; 8; 8; 8
2. У какого элемента наиболее выражены неметаллические свойства?
1) Be
2) B
3) Ca
4) Sr
- Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) хлороводород и силан
2) фосфат натрия и нитрид калия
3) фосфин и водород
4) аммиак и сероуглерод
- В каких соединениях атомы хлора и алюминия имеют одинаковое значение степени окисления?
1) Сl2O и Al(NO3)3
2) НСlO2 и Na[Al(OH)4]
3) НСlO3 и АlСl3
4) Nh5CIO4 и AI2(SO4)3
5. Основанием и кислотой соответственно являются
Основанием и кислотой соответственно являются
1) HNO3 и Nh5Al(SO4)2
2) h3S и NaNO3
3) h3SO3 и Са(ОН)2
4) KOH и h5P2O7
6. Окислительно-восстановительной является реакция
1) СаСO3 + SiO2 = CaSiO3 + СO2
2) BaSO3 = BaO + SO2
3) CuSO4 + 2KOH = Cu(OH)2 + K2SO4
4) CuCl2 + Fe = FeCl2 + Cu
7. Электролитической диссоциации фосфата натрия в водном растворе соответствует уравнение
1) Na3PO4 = Na+ + PO4-
2) Na3PO4 = Na+ + PO43-
3) Na3PO4 = 3Na+ + PO43-
4) Na3PO4 = 3Na+ + PO4-
8. При добавлении раствора нитрата калия к раствору хлорида цинка
1) выпадает осадок
2) выделяется газ
3) выпадает осадок и выделяется газ
4) видимых изменений не происходит
9. Кальций при обычных условиях вступает в реакцию с каждым из двух веществ:
1) кислородом и хлором
2) аргоном и углеродом
3) оксидом углерода(II) и оксидом железа(II)
4) хлоридом калия и нитратом меди(II)
10. Углекислый газ реагирует с каждым из двух веществ:
Углекислый газ реагирует с каждым из двух веществ:
1) HNO3 и h3O
2) Са(ОН)2 и К2O
3) КОН и ВаСl2
4) h3SO4 и SiO2
11. С раствором гидроксида натрия реагирует вещество, формула которого
1) CuS
2) NO
3) Н3РO4
4) KNO3
12. Фосфат кальция можно получить при взаимодействии двух веществ:
1) гидроксида кальция и фосфата меди(II)
2) фосфата бария и кальция
3) хлорида кальция и фосфата натрия
4) фосфата натрия и карбоната кальция
13. Верны ли следующие суждения о чистых веществах и смесях?
А. Серная кислота является смесью веществ.
Б. Угарный газ является чистым веществом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14. Оксид cepы(IV) проявляет окислительные свойства при взаимодействии с
1) оксидом натрия
2) водой
3) гидроксидом бария
4) йодоводородом
Задание 2. При выполнении заданий 1 и 2 из предложенного перечня ответов выберите два правильных. Максимальное количество баллов, которое можно набрать – 4 (по 2 балла за каждое тестовое задание).
Максимальное количество баллов, которое можно набрать – 4 (по 2 балла за каждое тестовое задание).
1. В порядке усиления неметаллических свойств расположены химические элементы следующих рядов:
1) N → С → О
2) Те → Se → S
3) Mg → Al → S
4) N → P → As
5) Si → В → Be
2. Атомы кислорода содержат молекулы
1) метана
2) ацетилена
3) этилового спирта
4) этана
5) уксусной кислоты
Задание 3. При выполнении заданий 1 и 2 к каждому элементу первого первого столбца подберите соответствующий элемент из второго столбца. Запишите выбранные цифры под соответствующими буквами. Цифры в ответе могут повторяться. Максимальное количество баллов, которое можно набрать – 6 (по 1 баллу за каждый правильный ответ: 1 задание – 3 балла, 2 задание – 3 балла).
1. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
ВЕЩЕСТВА
А) Zn(OH)2(TB.) и NaOH(TB.)
Б) Zn(OH)2(TB. ) и BaSO4(TB.)
) и BaSO4(TB.)
В) Вг2(р-р) и FeCl3(p-p)
РЕАКТИВ
1) Н2O
2) NaOH(p-p)
3) Na2SO4(p-p)
4) CO2(р-р)
2. Установите соответствие между простым веществом и реагентами, с каждым из которых оно может взаимодействовать.
НАЗВАНИЕ ВЕЩЕСТВА
А) кислород
Б) алюминий
В) сера
РЕАГЕНТЫ
1) Fe2O3, NaOH(р-р)
2) Fe, HNO3
3) HI, SO2
4) C2H5OH, Cl2
5) СаСl2, HCl
Задание 4. При выполнении заданий 1 – 3 запишите развернутый ответ к нему. Ответы записывайте четко и разборчиво. Максимальное количество баллов, которое можно набрать – 12 (1 задание – 4 балла, 2 задание – 3 балла, 3 задание – 5 баллов).
1. Используя метод электронного баланса, составьте уравнение реакции
Сu + NaNO3 + h3SO4 → CuSO4 + NO2 + Na2SO4 + h3O.
Определите окислитель и восстановитель.
2. Железную пластинку массой 50 г, содержащую 25 % нерастворимых в кислотах примесей, обработали избытком раствора концентрированной соляной кислоты. Какой объём водорода (н.у.) при этом выделится?
Какой объём водорода (н.у.) при этом выделится?
3. Даны вещества: растворы Cu(NO3)2, h3SO4, ZnCl2, KNO3, MgSO4, КОН. Используя воду и необходимые вещества только из этого списка, получите в две стадии оксид магния. Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Максимальное количество баллов за олимпиаду 36.
Ответы: Максимальное количество баллов за олимпиаду 36.
Задание 1. 14 баллов – 1 балл за каждый ответ.
№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
Ответ | 3 | 2 | 3 | 2 | 4 | 4 | 3 | 8 | 1 | 2 | 3 | 3 | 2 | 4 |
Задание 2.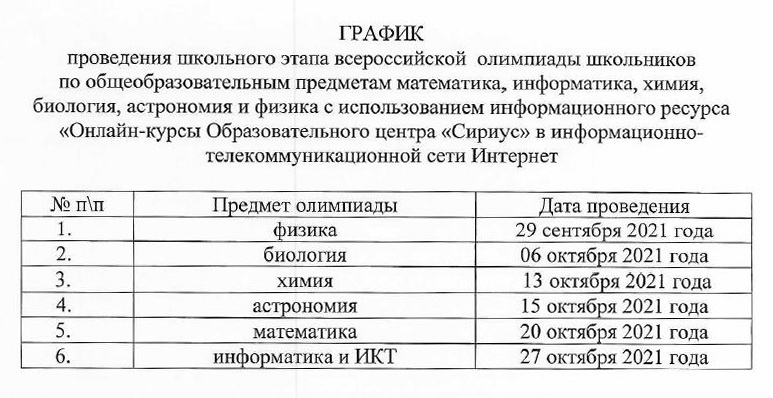 4 балла – по 2 балла за ответ.
4 балла – по 2 балла за ответ.
1. 23
2. 35
Задание 3. 6 баллов – по 3 балла за ответ.
1. 122
2. 312
Задание 4. Максимальное количество баллов, которое можно набрать – 12 (1 задание – 4 балла, 2 задание – 3 балла, 3 задание – 5 баллов).
- Cu0 + NaN+5O3 + h3SO4 → Cu+2SO4 + N+4O2 + Na2SO4 + h3O (1)
Cu0 – 2е = Cu+2 1 (1)
N+5 + 1е = N+4 2
N+5(HN+5O3) — окислитель (1)
Cu0 — восстановитель
Молекулярное уравнение
Сu + 2NaNO3 + 2h3SO4 = CuSO4 + 2NO2 + Na2SO4 + 2h3O (1)
- 1) Уравнение реакции:
Fe + 2HCl = FeCl2 + h3↑. (1)
2) Рассчитываем количество вещества железа:
m(Fe)чист. = 50 • 75/100 = 37,5 г (1)
M(Fe) = 56 г/моль, n(Fe) = 37,5/56 ≈ 0,67 моль.
3) Рассчитываем объём Н2:
по уравнению реакции
n(h3) = n(Fe) = 0,67(моль)
V(h3) = 0,67 • 22,4 = 15,008 ≈ 15(л). (1)
3. Схема эксперимента MgSO4 → Mg(OH)2 → MgO (1)
1) MgSO4 + 2NaOH = Mg(OH)2↓ + Na2SO4 (1)
Mg2+ + 2OH-=Mg(OH)2 (1)
Образуется осадок белого цвета. Реакция ионного обмена.
2) Mg(OH)2 = MgO + Н2O (1)
При нагревании Mg(OH)2 разлагается и изменяется внешний вид осадка — он
уменьшается в объёме.
Указаны признаки (1)
Олимпиада химия задания ответы Олимпиадные задания по химию
Олимпиада химия задания ответы Олимпиадные задания по химию с ответами Всероссийская олимпиада с решениями
Олимп ХимияКомментарии: 0Олимпиада по химии 2021-2022 региональный этап. Всероссийская олимпиада по химии задания и ответы для Регионального этапа 2021-2022. 1 тур задания 2 тур задания Решения 9 кл. теор. + прак. 10 кл. теор. + прак. 11 кл. теор. + прак. Смотрите также: Олимпиада по химии 2020-2021 региональный этап
Всероссийская олимпиада по химии задания и ответы для Регионального этапа 2021-2022. 1 тур задания 2 тур задания Решения 9 кл. теор. + прак. 10 кл. теор. + прак. 11 кл. теор. + прак. Смотрите также: Олимпиада по химии 2020-2021 региональный этап
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2021-2022 муниципальный этап г. Москва. Всероссийская олимпиада по химии задания и ответы для муниципального этапа 2020-2021 7-8 классы скачать Ответы 9 класс скачать Ответы 10 класс скачать Ответы 11 класс скачать Ответы Смотрите также: Олимпиада по химии 2020-2021 муниципальный этап г. Москва
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2021-2022 школьный этап для г.Москвы. Всероссийская олимпиада по химии задания и ответы для школьного этапа 2021-2022. 7-8 КЛАССЫ скачать Решения Видео разбор 9 КЛАСС скачать Решения Видео разбор 10 КЛАСС скачать Решения Видео разбор 11 КЛАСС скачать Решения Смотрите также: Олимпиада по химии 2020-2021 школьный этап для г.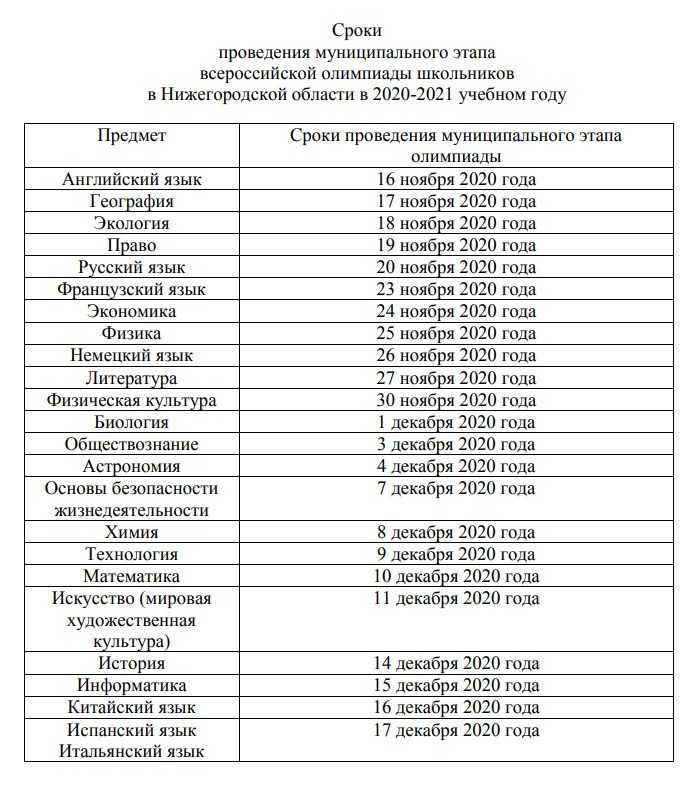
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2021-2022 школьный этап для Омска. Всероссийская олимпиада по химии задания и ответы для школьного этапа 2021-2022. 5-8 классы Задания скачать Решения 9 класс Задания скачать Решения 10 класс Задания скачать Решения 11 класс Задания скачать Решения Смотрите также: Олимпиада по химии 2020-2021 школьный этап для г.Москвы
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2020-2021 региональный этап. Всероссийская олимпиада по химии задания и ответы для Регионального этапа 2020-2021. 9 класс 1 тур задания — решения 2 тур задания — решения 10 класс 1 тур задания — решения 2 тур задания — решения 11 класс 1 тур задания — решения 2 тур задания — решения Смотрите также: …
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2019-2020 региональный этап. Всероссийская олимпиада по химии задания и ответы для Регионального этапа 2019-2020. 9 класс 1 тур задания — решения 2 тур задания — решения 10 класс 1 тур задания — решения 2 тур задания — решения 11 класс 1 тур задания — решения 2 тур задания — решения Смотрите также: …
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2020-2021 муниципальный этап г.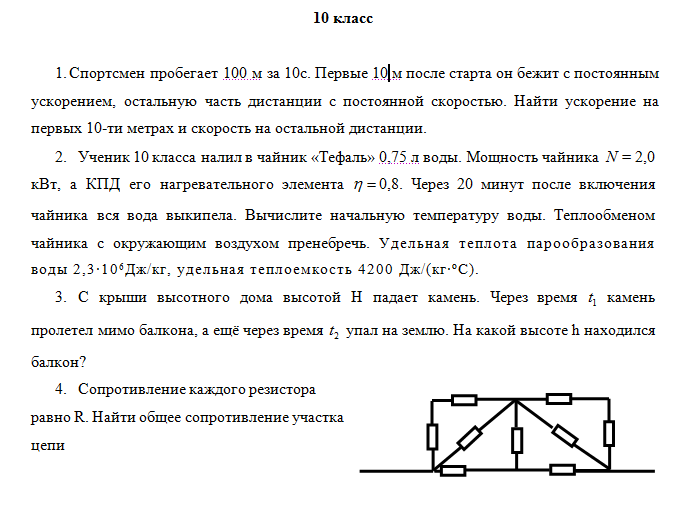 Москва. Всероссийская олимпиада по химии задания и ответы для муниципального этапа 2020-2021 7-8 классы Ответы Критерии Справочные данные 7-11 9 класс Ответы Критерии Справочные данные 7-11 10 класс Ответы Критерии Справочные данные 7-11 11 класс Ответы Критерии Справочные данные 7-11 Смотрите также: Олимпиада по химии 2019-2020 муниципальный …
Москва. Всероссийская олимпиада по химии задания и ответы для муниципального этапа 2020-2021 7-8 классы Ответы Критерии Справочные данные 7-11 9 класс Ответы Критерии Справочные данные 7-11 10 класс Ответы Критерии Справочные данные 7-11 11 класс Ответы Критерии Справочные данные 7-11 Смотрите также: Олимпиада по химии 2019-2020 муниципальный …
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2019-2020 муниципальный этап г. Москва. Всероссийская олимпиада по химии задания и ответы для муниципального этапа 2019-2020 Все классы Решения Смотрите также: Олимпиада по химии 2018-2019 муниципальный этап Московской
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2020-2021 школьный этап для г.Москвы. Всероссийская олимпиада по химии задания и ответы для школьного этапа 2020-2021. Все классы Решения Смотрите также: Олимпиада по химии 2019-2020 школьный этап для г.Москвы
Читать далее
Олимп ХимияКомментарии: 0Олимпиада по химии 2019-2020 школьный этап для г.
Читать далее
Прошлые работы олимпиады по химии | Ресурс
Потренируйтесь отвечать на вопросы в стиле олимпиады с помощью этих прошлых работ и отметьте схемы ответами
Для учащихся, планирующих принять участие в олимпиаде по химии, тестирование прошлых работ дает им возможность отточить ключевые навыки и повысить уверенность перед экзаменом. соревнование. В этом сборнике собраны прошлые статьи, начиная с 2003 г., каждая из которых сопровождается кратким изложением затронутых тем, а также схемой оценок с ответами.
Некоторые документы также включают оригинальную брошюру с ответами учащихся и отчеты экзаменаторов.
Как использовать прошлые работы по химии
Прошлые работы могут гибко использоваться учителями и учащимися с разной степенью независимости. Просмотрите сводку докладов и тем ниже, чтобы найти конкретный вопрос, или выберите документ, который нужно проработать от начала до конца.
Просмотрите сводку докладов и тем ниже, чтобы найти конкретный вопрос, или выберите документ, который нужно проработать от начала до конца.
Химические олимпиады сосредоточены на решении задач и вознаграждают за стойкость, поэтому учащиеся должны пробовать как можно больше частей каждого вопроса и стараться не откладывать, если есть части, на которые они не могут ответить. Даже кажущаяся «низкой» оценка может принести медаль на соревнованиях.
Вопросы часто усложняются по мере продвижения работы, но учащиеся, изучающие A-level или эквивалентные квалификации, должны быть в состоянии выполнить большинство частей.
Дополнительная поддержка и ресурсы
- Ознакомьтесь с нашим буклетом поддержки олимпиады по химии, чтобы получить дополнительные указания по типам вопросов, используемых в конкурсе, а также примеры вопросов с комментариями и анализом.
- Подготовьтесь к решению всего предыдущего задания, используя нашу серию отработанных ответов, разработанных, чтобы помочь учащимся, менее знакомым с вопросами в олимпиадном стиле, развить необходимые навыки и уверенность, шаг за шагом.

Поиск и загрузка ресурсов по годам
2022
Темы включают бензин E10; химия закиси азота; синтез платонового твердого кубана; расчеты равновесий при испытаниях на боковой поток; синтез и структура самого маленького в мире китайского узла; и расчеты, основанные на силицировании компонентов вакцины для повышения их стабильности.
Прошлая статья | Буклет с ответами | Отметить схему | Отчет экспертов
2021
Темы включают реакции, в результате которых образуется фосфин; захват углерода кальциевой петлей; синтез и реакции левулиновой кислоты; проекции Ньюмена; синтез гидроксихлорохина; кинетика образования дифторида ксенона.
Бумага прошлого | Буклет ответов | Маркировочная схема
2020
Темы включают реакции и строение карбида кальция; термодинамика водорода как топлива; структура химических веществ, поглощающих УФ-излучение; структуры оксидов кремния; кинетика красочных соединений; и синтез [5]-ладдерановой кислоты.
Прошлая бумага | Буклет ответов | Схема маркировки
2019
Темы включают двуокись углерода в газированных напитках; электролиз драгоценных металлов и спектры ЯМР комплексов платины; кинетика лечения отравляющими веществами нервно-паралитического действия; синтез пестицидов; расчеты по биоразлагаемым полимерам.
Бумага прошлого | Буклет ответов | Схема маркировки
2018
Темы включают реакции в литий-ионных батареях; устойчивые методы производства аммиака; изотопы и реакции урана; синтез декстрометорфана; соединения гелия и натрия.
Прошлая бумага | Марк схема | Отчет экспертов
2017
Темы включают свойства гипохлорита натрия; реакции и кинетика атмосферных газов; сплавы титана; строение и синтез твистана; и реакции супероснований.
Бумага прошлого | Марк схема | Отчет экспертов
2016
Темы включают термодинамику цикла сера-йод; реакции вольфрама; ЯМР ненасыщенных молекул; синтез флибансерина; и анализируя древние кости.
Прошлая бумага | Марк схема | Отчет экспертов
2015
Темы включают расчеты на основе оксида индия-олова; свойства 2-метилпропаннитрила; синтез риталина; скорости метаболизма этанола; реакции и термодинамика «зеленого» реактивного топлива.
Бумага прошлого | Марк схема | Отчет экспертов
2014
Темы включают реакции карбоната лантана; энергии ионизации натрия; синтез тазаротена; анализ химических веществ, которые жуки-бомбардиры используют для защиты; строение и реакции гидратов метана.
Прошлая бумага | Марк схема | Отчет экспертов
2013
Темы включают реакции и термодинамику гидразина; медь в олимпийских медалях; цвета соединений; синтез бензодиазепинов; и структура креатина.
Бумага прошлого | Марк схема | Отчет экспертов
2012
Темы включают циклические аллотропы серы; реакции аминокислот в кератине; общие знания по химии; синтез липтора; и структура самого маленького автомобиля в мире.
Прошлая бумага | Схема маркировки
2011
Темы включают анализ ингредиентов закусок; карбид кальция; использование взрывчатых веществ в гражданском строительстве; ЯМР органических соединений; и синтез фенобарбитала.
Бумага прошлого | Схема маркировки
2010
Темы включают синтез амброкса; анализ комплекса меди с помощью титрования; термодинамика фторидов галогенов; расчеты на солевых растворах; использование соединений осмия в органических реакциях; и строение золота.
Прошлая бумага | Схема маркировки
2009
Темы включают азотсодержащие топлива; сжигание метана; реакции и строение сульфидов фосфора; синтез лоперамида; и обнаружение мышьяка.
Бумага прошлого | Маркировка схема
2008
Темы включают методы получения чистого кремния; кинетика образования витамина D в грибах; термодинамика и строение гремучей ртути; реакции и анализ соединений алюминия; масс-спектрометрия полипептидов; и синтез фексофенадина.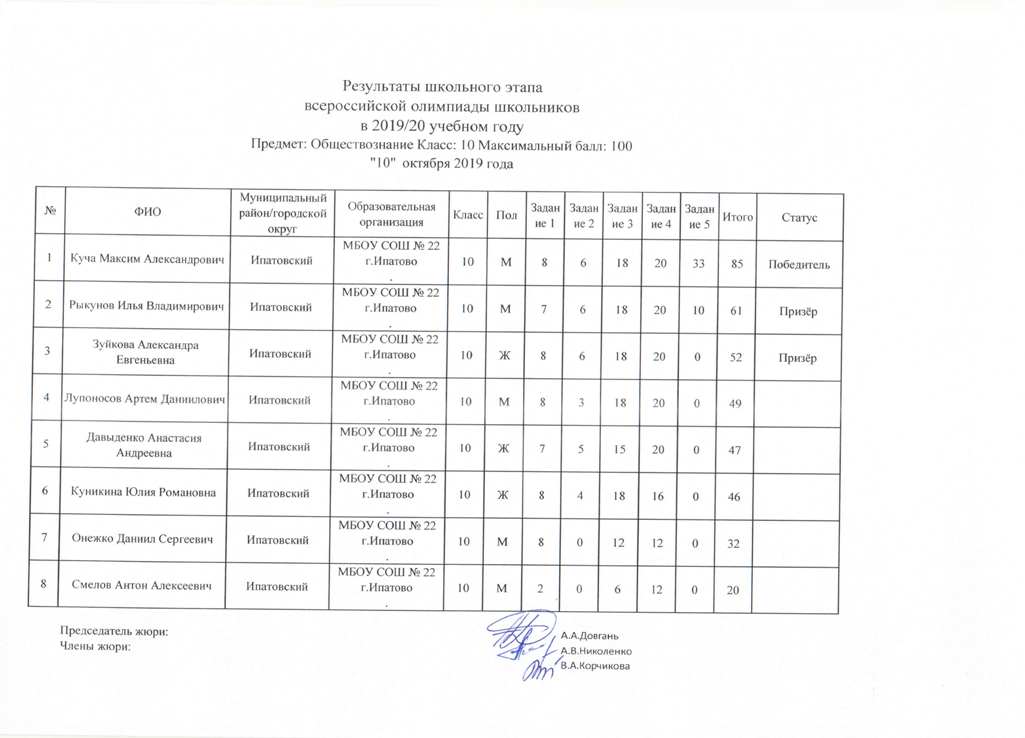
Прошлая бумага | Маркировочная схема
2007
Темы включают реакции и термодинамику ракетных топлив; структуры аллотропов фосфора; анализ уровня фосфатов в крови; спектроскопический анализ антипиренов; синтез Тамифлю; и реакции диоксида хлора.
Бумага прошлого | Схема маркировки
2006
Темы включают реакции ингредиентов лимонного щербета; реакции в выхлопах автомобилей; структуры ацилхлоридных соединений; термическое разложение сульфата меди(II); производство кислорода в чрезвычайных ситуациях; синтез силденафила; и масс-спектрометрия и ЯМР галогеналканов.
Прошлая бумага | Схема маркировки
2005
Темы включают свойства оксидов углерода; реакции пятиокиси дийода; расчеты с метановой кислотой; спектры ЯМР нанопутиан; оценка уровня алкоголя в крови; и синтез римонабанта.
Бумага прошлого | Схема маркировки
2004
Темы включают окислительно-восстановительные реакции; реакции поллютантов, разрушающих памятники; расчет растворенного кислорода в воде; структура оранжевого агента; термодинамика белого и серого олова; электронные переходы в водороде; и структуры серосодержащих соединений.
Прошлая бумага | Схема марки
2003
Темы включают подогрев банки кофе; структура соли Рейнеке; расчет атомной экономики; написание окислительно-восстановительных уравнений; расчеты на основе исторических экспериментов; гидроксиламин и его взаимодействие с ионами железа(III); синтез флунитразепама; и свойства полония.
Бумага прошлого | Схема оценки
Добро пожаловать в мир научной Олимпиады
Национальные олимпиады по науке предоставляют молодым людям возможность получить образование в течение последних 29 лет.
Общая информация
Программа научных олимпиад 2202 проводится Командой соревнований в рамках Управления программ помощи ученым TÜBİTAK (BİDEB).
TÜBİTAK проводит научные олимпиады по трем категориям: национальные, международные и региональные научные олимпиады, в соответствии друг с другом.
Программа TÜBİTAK 2202 – Научные олимпиады направлена на развитие у учащихся средних и старших классов интереса к фундаментальным наукам и компьютерным наукам, а также на обучение учащихся в этом направлении. С этой целью он ежегодно организует научные олимпиады по математике, физике, химии, биологии, информатике, математике в средней школе и информатике в средней школе. Студенты, успешно сдавшие Научные олимпиады отбираются и обучаются по информатике, биологии, физике, химии, математике, математике в средней школе и информатике в средней школе, чтобы представлять нашу страну на региональных и международных олимпиадах , проводимых каждый год.
Мы начали участвовать в международных олимпиадах в 1973 году, а с 1993 года эта программа стала национальной. В течение последних 29 лет организована двухэтапная система экзаменов по информатике, биологии, физике, химии и математике.годы. В 1996 году к процессу была добавлена математика для средней школы, а в 2017 году — информатика для средней школы. Общее количество категорий экзаменов увеличилось до семи. По состоянию на 2021 год научным олимпиадам исполняется 29 лет.
Общее количество категорий экзаменов увеличилось до семи. По состоянию на 2021 год научным олимпиадам исполняется 29 лет.
Схема процесса
01
Заявление
Студенты должны подать заявку на сдачу экзамена, зайдя на сайт ebideb.tubitak.gov.tr в объявленную дату каждый год.
02
1. Этапный экзамен
Студенты будут сдавать экзамен в местах, указанных TÜBITAK.
03
Летний лагерь
Учащиеся, успешно сдавшие экзамен 1-го этапа, будут приглашены в летний лагерь для подготовки к экзамену 2-го этапа.
04
2-й этап экзамена
Учащиеся, успешно сдавшие 1-й этап экзамена и приглашенные в летний лагерь, проходят 2-й этап экзамена, чтобы определить призеров на национальном уровне.
05
Зимний лагерь
Учащиеся, завоевавшие медали на национальном уровне и отобранные олимпиадным комитетом в соответствии с текстом вызова, приглашаются в Зимний лагерь для подготовки к командным отборочным экзаменам.
06
Экзамены по отбору команд
Учащиеся, приглашенные в Зимний лагерь, сдают экзамены по отбору команд для участия в региональных и международных олимпиадах.
07
Командные лагеря
Все мероприятия по подготовке учащихся к программе осуществляются олимпиадными комитетами по согласованию с BİDEB.
08
Участие в региональных и международных олимпиадах
Ежегодно проводятся региональные и международные олимпиады по науке.
Экзамен первого этапа
С 2020 года экзамены первого этапа проводятся по всей стране в 81 провинциальном центре и в ТРСК в заранее определенные и объявленные даты. Экзаменационные вопросы первого этапа представляют собой вопросы с несколькими вариантами ответов, подготовленные олимпиадным комитетом, уполномоченным TUBITAK. Информация об экзамене первого этапа научной олимпиады:
| Класс | Категория | Количество вопросов | Продолжительность экзаменов |
|---|---|---|---|
. | 180 дк. | ||
| Информатика | 50 | 150 дк. | |
8, Подготовительный класс, 9, 10 и 11 (старшеклассники не могут посещать) | Физика | 25 | 210 дк. |
| Химия | 50 | 150 дк. | |
| Биология | 100 | 120 дк. | |
| 5,6,7,8. класс | Математика средней школы | 32 | 180 dk. |
| Информатика в средней школе | 30 | 90 dk. |
Национальные олимпиады по естествознанию организуются для того, чтобы побудить учащихся средних и старших классов заниматься естественными науками, направлять их обучение и способствовать их развитию в этих областях. Он также предназначен для отбора и подготовки команд, которые будут представлять нашу страну на международных и региональных олимпиадах.
Экзаменационные вопросы олимпиады отличаются от других экзаменов по содержанию и уровню сложности, поскольку они направлены на выявление конкретных талантов.
Щелкните здесь, чтобы ознакомиться с программой и библиографической информацией об экзамене первого этапа.
Оценка экзаменов первого этапа Соответствующий олимпиадный комитет оценивает результаты экзамена первого этапа и принимает во внимание оптические результаты экзаменационного учреждения.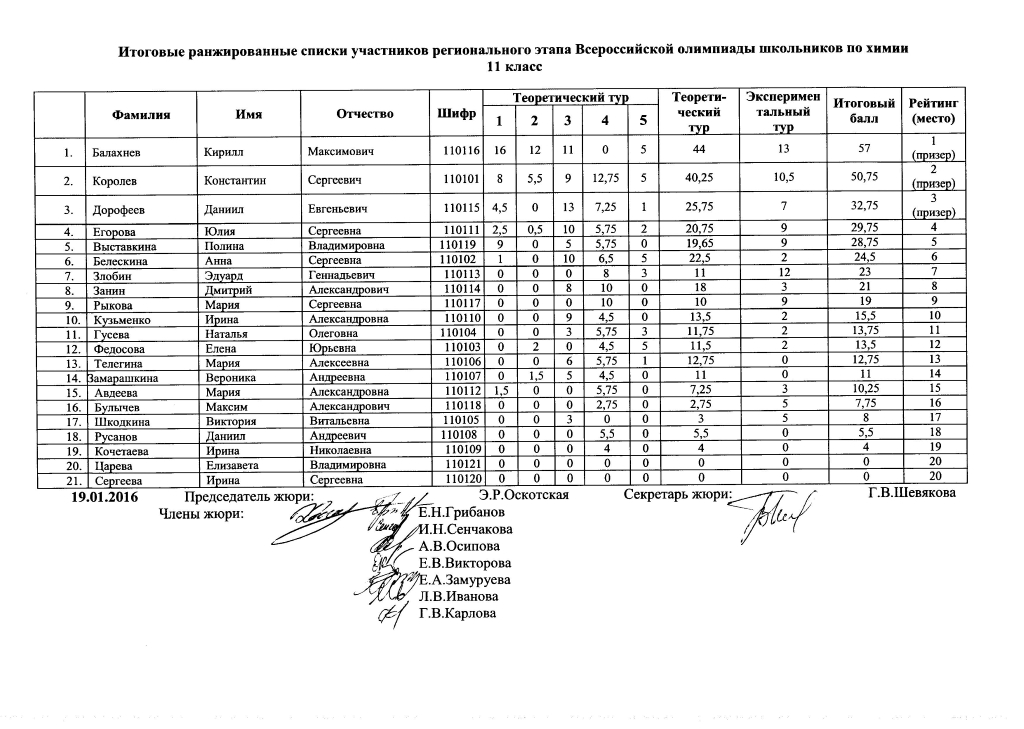
Учащиеся, успешно сдавшие первый этап экзамена, имеют право сдать второй этап экзамена и приглашены на Летнюю школу, организованную BİDEB.
Наша таблица почета
Летний лагерь
Учащиеся, успешно сдавшие экзамен первого этапа, будут посещать летнюю школу для подготовки к экзамену второго этапа. Их будут обучать ученые, пользующиеся авторитетом в своих областях.
Летняя школа (с августа по сентябрь) длится две недели, и сразу после этого, по запросу председателей комитетов, студенты будут приглашены на недельный ноябрьский лагерь, который проводится в ноябре.
Второй этап экзамена
Прямых заявок на второй этап научной олимпиады нет. Студенты, успешно сдавшие экзамен первого этапа, вызываются на экзамен второго этапа. Экзамен второго этапа может быть письменным и/или практическим. Экзаменационные вопросы второго этапа готовятся олимпиадным комитетом, уполномоченным TÜBİTAK.
Экзаменационные вопросы второго этапа готовятся олимпиадным комитетом, уполномоченным TÜBİTAK.
Оценки проводятся с учетом базовых оценок, определяемых общим рейтингом. Учащиеся, добившиеся успеха по мнению олимпиадного комитета, имеют право на получение медалей на национальном уровне и приглашаются на Зимнюю школу.
Оценка экзаменов второго этапа Оценка проводится с учетом общего рейтинга и/или пороговых баллов. Пороговый балл может быть определен соответствующим олимпийским комитетом с учетом устного/письменного мнения директора BİDEB для каждого типа медали. Медали и сертификаты достижений вручаются учащимся, достигшим рейтинга на экзамене второго этапа, а их учителям могут быть вручены сертификаты признательности. Медали распределяются по 4 золотым, 8 серебряным и 12 бронзовым медалям в соответствии с распределением очков в общем зачете. В случае равенства баллов количество медалей может быть увеличено или уменьшено с одобрения Дирекции BİDEB с учетом предыдущего или последующего балла.
Учащиеся, получившие медали на втором этапе экзамена и отобранные соответствующим комитетом олимпиады и приглашенные на Зимнюю школу после получения устного/письменного мнения директора BİDEB.
Зимний лагерь
Зимний лагерь научной олимпиады — это двухнедельная научно-исследовательская программа для студентов, приглашенных для участия на основании их результатов на экзамене второго этапа научной олимпиады. Студенты получают интенсивную и углубленную теоретическую и практическую подготовку по выбранной ими дисциплине, работая с другими студентами и учеными-экспертами со всей Турции.
Зимняя школа является отличной отправной точкой для дальнейшего обучения и карьеры в науке и служит подготовкой к командным отборочным экзаменам.
Получение результатов экзаменов Вы можете получить доступ к результатам экзаменов по естествознанию в BİDEB+ на вкладке «Результаты олимпиадных экзаменов».
Здесь вы можете найти вопросы и решения предыдущих олимпиад. Это отличная возможность проверить свои навыки перед экзаменом!
Экзамены по отбору команд и сборы команд
После сдачи экзаменов по отбору команд, проведенных после Зимней школы, и, при необходимости, результатов экзаменов Летней школы, Второго этапа и Зимней школы, команды, которые будут представлять нашу страну в Региональные или международные научные олимпиады определяются по решению соответствующих олимпиадных комитетов. Это оценивается GYK и завершается после утверждения Департаментом.
Команды, выбранные в конце Экзаменов по отбору команд, отправляются в краткосрочные командные лагеря в сроки, установленные олимпийскими комитетами, до проведения Олимпиады. В этих лагерях студенты берут теоретические и/или практические уроки у ученых, являющихся экспертами в своих областях. Эти лагеря более проработаны, чем Зимняя школа.