Конспект урока валентные возможности атомов химических элементов 11 класс – План-конспект урока по химии (11 класс) по теме: Конспект урока ««Валентные возможности атомов химических элементов»» | скачать бесплатно
Валентные возможности атомов химических элементов. Видеоурок. Химия 11 Класс
Данный урок посвящен повторению понятия «валентность» и изучению принципов определения валентных возможностей атомов химических элементов. В ходе изучения материала вы узнаете, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Свойства атома во многом определяется строением его внешнего электронного слоя. Электроны, находящиеся на внешнем, а иногда и на предпоследнем, электронном слое атома могут принимать участие в образовании химических связей. Такие электроны называют валентными. Например, в атоме фосфора 5 валентных электронов: (рис. 1).
Рис. 1. Электронная формула атома фосфора
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предпоследнего слоев.
Валентность – это способность атома образовывать химические связи. Данное определение и само понятие валентность корректны только по отношению к веществам с ковалентным типом связи. Для ионных соединений это понятие неприменимо, вместо него используют формальное понятие «степень окисления».
Валентность характеризуется числом электронных пар, образующихся при взаимодействии атома с другими атомами. Например, валентность азота в аммиаке NH3 равна трем (Рис. 2).
Рис. 2. Электронная и графическая формулы молекулы аммиака
Количество электронных пар, которое может образовать атом с другими атомами, зависит, в первую очередь, от числа его неспаренных электронов. Например, в атоме углерода два неспаренных электрона – на 2р-орбиталях (Рис. 3). По числу неспаренных электронов мы можем сказать, что такой атом углерода может проявлять валентность, равную II.
Рис. 3. Электронное строение атома углерода в основном состоянии
Во всех органических веществах и некоторых неорганических соединениях углерод четырехвалентен. Такая валентность возможна только в возбужденном состоянии атома углерода, в которое он переходит при получении дополнительной энергии.
В возбужденном состоянии в атоме углерода распариваются 2s-электроны, один из которых переходит на свободную 2р-орбиталь. Четыре неспаренных электрона могут участвовать в образовании четырех ковалентных связей. Возбужденное состояние атома принято обозначать «звездочкой» (Рис. 4).
Рис. 4. Электронное строение атома углерода в возбужденном состоянии
Может ли азот иметь валентность, равную пяти – по числу его валентных электронов? Рассмотрим валентные возможности атома азота.
В атоме азота два электронных слоя, на которых расположено всего 7 электронов (Рис. 5).
7N
Рис. 5. Электронная схема строения внешнего слоя атома азота
Азот может образовать три общие электронные пары с тремя другими электронами. Пара электронов на 2s-орбитали тоже может участвовать в образовании связи, но по другому механизму – донорно-акцепторному, образуя четвертую связь.
Распаривание 2s-электронов в атоме азота невозможно, т. к. на втором электронном слое нет d-подуровня. Поэтому высшая валентность азота равна IV.
Подведение итога урока
На уроке вы научились определять валентные возможности атомов химических элементов. В ходе изучения материала вы узнали, сколько атомов других химических элементов может присоединить к себе конкретный атом, а также почему элементы проявляют разные значения валентности.
Список литературы
- Новошинский И.И., Новошинская Н.С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§ 9)
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учеб. для общеобраз. учрежд.: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010. (§ 5)
- Радецкий А.М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011.
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 8)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
- Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
- с. 30 №№ 2.41, 2.43 из Сборника задач и упражнений по химии для средней школы (Хомченко И.Д.), 2008.
- Запишите электронные схемы строения атома хлора в основном и возбужденном состояниях.
- Сколько валентных электронов в атоме: а) бериллия; б) кислорода; в) серы?
interneturok.ru
Валентность, валентные возможности и размеры атомов химических элементов
Урок № 8 дата класс11 предмет химия
Тема урока : Валентность, валентные возможности и размеры атомов химических элементов
Цели и задачи урока: О- повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов, пробуждение интереса к изучаемой теме, актуализация знаний по теме и определение направления дальнейшего изучения или целеполагание. Р-развивать познавательный интерес, навыки определения валентности элементов. В- воспитать способность к взаимопониманию и бережное отношение к природе и собственному здоровью
Оборудование: Таблица «ПСХЭ», учебник, тетради, карточки разноуровневые.
Тип урока: урок обобщения и систематизации знаний
Ход урока
1. Оргмомент
2. Актуализация опорных знаний
— проверка домашнего задания
— работа по таблице
Таблица №1. Тонкие и толстые вопросы.
1. Что такое валентность? 2. Что такое степень окисления?3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Ответы учащиеся записывают в тетради:
1. валентность — способность атомов к присоединению определенного числа других атомов.
2. степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов (электрический заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам).
3. Высшая валентность х.э. – это число электронов на внешнем энергетическом уровне.
4. Низшая валентность – это число свободных мест на атомной орбитали внешнего уровня.
Ответ на толстый вопрос учитель предлагает найти вместе.
3. Мотивация
Учитель на доске изображает «рыбный скелет», учащиеся переносят его себе в тетради (схема 1). В «голове» рыбы записывается вопрос. На первых «косточках», ближайших к голове, записываются понятия, которые нужно сравнить, на вторых – определения этих понятий. Однако понятие валентности рассматривается уже на более высоком уровне, с точки зрения образования ковалентных связей. На следующих «косточках» учитель записывает примеры веществ N
4. Целеполагание
5. Изучение нового материала
1)учитель формулирует следующее положение: «Мы обсудили, что валентность атома определяется числом неспаренных электронов. Но тогда, мне бы хотелось знать, чему равна валентность азота в катионе аммония NH4+».
Учащиеся с помощью учителя, путем последовательных рассуждений, выводят решение этой проблемы:
Атом N образует три ковалентные связи с атомами водорода:2p
2s
H 1s H 1s H 1s
Образуется молекула аммиака.
Для образования катиона аммония необходимо присоединить к данной молекуле катион водорода (протон).
N 2p
2s
H 1s H 1s H 1s
H+ 1s
Такой механизм образования связи называется донорно-акцепторным.
Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
2) ФИЗМИНУТКА!
3)Исходя из решения данной проблемы, учащиеся вместе с учителем делают вывод, что Валентные возможности атомов определяются не только числом неспаренных электронов, но и числом неподеленных электронных пар, способных переходить на свободные орбитали атомов другого элемента. Вывод записывается в хвосте рыбы
Высшим пределом валентности является такое значение, которое равно числу возможных орбиталей (квантовых ячеек) на внешнем уровне атома.
Учащимся предлагается на основании электронной конфигурации атома (и ее графического отображения) определить валентные возможности атома.
Электронная конфигурация S – 3s23p43p
3s
2 свободных элеткрона дают возможность сере образовывать 2 ковалентные связи по обменному механизму. Сера в данном случае проявляет валентность 2.
Химический элемент S расположен в третьем периоде, значит на внешнем энергетическом уровне его имеется 3 энергетических подуровня – s, p и d. Серу можно перевести в возбужденное состояние распарив электроны на 3p-подуровне.
*
3p 3d
3s 3p
3s
Теперь на внешнем энергетическом уровне находится 4 неспаренных электрона. Которые могут участвовать в образовании 4 ковалентных связей по обменному механизму. Валентность серы равна 4.
Аналогично можно распарить электроны, расположенные на 3s-подуровне.
* 3d ** 3d
3p 3p
3s 3s
6 неспаренных электронов на внешнем энергетическом уровне способны образовывать 6 ковалентных связей. Сера в таких соединениях проявляет валентность равную 6.
Таким образом, валентность серы в соединениях может быть равной 2, 4 и 6. В простых веществах валентность серы равно 0.
7. Рефлексия
Я повторил… Я узнал… Я умею…
8. Домашнее задание П- повторить подготовиться к контрольной работе
Задания № стр письменно в тетради
9. Подведение итога урока. Выставление оценок
Карточка вопросов
1. Что такое валентность?2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Карточка вопросов
1. Что такое валентность?2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Карточка вопросов
1. Что такое валентность?2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Карточка вопросов
1. Что такое валентность?2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Карточка вопросов
1. Что такое валентность?2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Карточка вопросов
1. Что такое валентность?2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Схема 1. Схема для приема «Фишбоун»
infourok.ru
Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Химия, 11 класс
Урок № 2. Валентность и валентные возможности атомов
Перечень вопросов, рассматриваемых в теме: всё в нашем мире состоит из атомов. Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.
Ключевые слова: валентность; валентные возможности; электроотрицательность; степень окисления; графическая электронная формула; периодическая таблица.
Глоссарий
Валентность – это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
Ковалентная связь — химическая связь, в которой у двух атомов имеется общая пара электронов.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Периодический закон: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Степень окисления – это условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, то есть все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Электрон — стабильная отрицательно заряженная элементарная частица.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Электроотрицательность – это суммарная характеристика способности атома данного элемента отдавать или присоединять электроны атомов других элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Формулировка периодического закона: «свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Четыре основные периодические закономерности:
- Правило октета: все элементы стремятся потерять, либо приобрести электрон, для того, чтобы иметь конфигурацию ближайшего по периодической таблице благородного газа, то есть восьмиэлектронную конфигурацию. Благородные газы являются самыми стабильными элементами, в следствие заполненности их внешних s- и p-орбиталей.
- Энергия ионизации – количество энергии, которое необходимо затратить для отрыва электрона атома. Элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. По правилу октета чем правее элемент расположен в таблице Менделеева, тем больше нужно затратить энергии на отрыв его электрона, это же справедливо и для энергии ионизации: она увеличивается слева направо. Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
- Сродство к электрону – если вещество находится в газообразном состоянии, то при приобретении его атомом дополнительного электрона, его энергия изменяется. При движении по группе вниз сродство к электрону становится менее отрицательным.
- Электроотрицательность — мера того, как сильно атом притягивает к себе электроны другого атома, который связан с ним. Электроотрицательность увеличивается при движении в таблице снизу вверх и слева направо. Благородные газы не имеют электроотрицательности.
Водородная связь – специфическая химическая связь между электроотрицательным атомом (например, кислородом, азотом или фтором) и атомом водорода. Данный вид связи может быть как межмолекулярным, так и внутримолекулярным. Возникновение водородной связи связано с тем, что у атома водорода очень маленький радиус. Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Особенностью данного вида связи является ее высокая прочность, а также широкая распространённость, главным образом в органических соединениях, например в спиртах, фенолах, альдегидах и карбоновых кислотах. Именно за счет нее образуется вторичная структура белков. В качестве неорганических веществ, молекулы которых образуют водородную связь, можно отметить следующие: вода, фтороводород, синильная кислота. В настоящее время водородную связь рассматривают как частный случай ковалентной.
Металлическая связь — связь между положительными ионами металлов в металлической решетке, осуществляемая за счет притяжения электронов, которые расположены относительно свободно в кристалле металла. Атомы металлов имеют небольшое число валентных электронов, что объясняется их положением в таблице Менделеева. Из-за слабой связи электронов с ядрами, они могут легко отрываться от них. В результате в кристаллической решетке металла появляются свободные электроны и положительно заряженные ионы, поэтому электроны обладают большой свободой перемещения внутри кристалла металла. Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Ван-дер-Ваальсова связь — силы межмолекулярного и межатомного взаимодействий, энергия которых составляет 10—20 кДж/моль. Такие связи названы в честь голландского физика Яна Дидерика Ван-дер-Ваальса. Экспериментально было определено, что молекулы, в которых внешние оболочки всех атомов заполнены (молекулы азота N2, хлора Cl2, аммиака NH3 , атомы инертных газов — He, Ne и т.д) также связываются друг с другом и образуют слабые межмолекулярные связи. Вандерваальсово взаимодействие состоит из трёх слабых электромагнитных взаимодействий:
- Ориентационные силы, диполь-дипольное притяжение – связь между молекулами, которые являются постоянными диполями.
- Дисперсионное притяжение, обусловлено взаимодействием между мгновенным и наведённым диполем.
- Индукционное притяжение (поляризационное притяжение). Взаимодействие между постоянным диполем и наведённым (индуцированным).
В основе данного типа связи также лежат кулоновские силы, которые заключаются во взаимодействии между электронами и ядрами двух молекул: на определенном расстоянии между молекулами силы отталкивания/притяжения уравновешивают друг друга, в результате чего образуется устойчивая система.
Возбужденное состояние атома — энергетически нестабильное состояние, в которое атом переходит при получении энергии. Возбужденные состояния атомов образуются при переходе электронов (одного или нескольких) с занятых орбиталей на свободные. Меньше энергии затрачивается при переходе электрона между внешними оболочками, а больше – при переходе с внутренней оболочки на внешнюю.
Возбужденным атом пребывает недолго: при отдаче полученной энергии атом возвращается в основное состояние. Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Эффективный заряд атома, характеризуется разностью между числом электронов свободного атома и числом электронов принадлежащих данному атому в химическом соединении. Для оценки эффективного заряда атома применяют модель, где величины представляют как функции точечных неполяризуемых зарядов, которые локализованы на атомах. У двухатомной молекулы рассматривают дипольный момент как произведение эффективного заряда атома на межатомное расстояние.
Диполь — совокупность двух равных по величине разноименных точечных зарядов q, расположенных на некотором расстоянии друг от друга, которое мало по сравнению с расстоянием до рассматриваемой точки поля.
Постоянный диполь – совокупность периодически быстро меняющихся по направлению и величине мгновенных микродиполей.
Наведенный диполь – диполь, который возникает под действием внешнего электрического поля.
Примеры и разбор решения задач тренировочного модуля
- Пример задачи. Определите валентность S в соединении H2SO4; определите валентность N в соединении HNO2; определите валентность F в соединении C2H2F2.
Решение. Валентность кислорода всегда равна 2. Валентность водорода равна 1. Для нахождения валентности серы, необходимо валентность кислорода умножить на ее индекс: 2*4=8, затем валентность водорода умножить на его индекс: 1*2 = 2. Теперь нужно вычесть полученные значения: 8-2 = 6 и разделить его на индекс серы: 6/1 = 6. Валентность серы в соединении 6.
Аналогично в варианте: валентность N в соединении HNO2 : (2*2-1*1)/1=3.
Валентность F в C2H2F2: валентность фтора всегда = 1, поэтому ответ 1.
- Пример задачи. Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Соединения: BeF2, O2, PCl5.
Типы химической связи: ионная, ковалентная неполярная, ковалентная полярная.
Решение. С помощью шкалы электроотрицательности найдем разность значений (∆х) для элементов:
BeF2 : 4,0 – 1,5 = 2,5
O2 : 3,5 – 3,5 = 0
PCl5 : 3,0 – 2,1 = 0,9
По правилам если ∆х < 2,0, то связь ковалентная полярная, если ∆х > 2,0, то связь ионная, если
∆х = 0, то связь ковалентная неполярная, таким образом, верный ответ:
BeF2 – ионная связь, O2 – ковалентная неполярная связь, PCl5 – ковалентная полярная связь.
resh.edu.ru
Урок по химии (11 класс) профильный уровень «Валентность»
«Валентность, валентные возможности атомов» (11 класс)
Мазов Сергей Борисович, учитель химии высшей категории МОУ «Средняя школа №13» г. Кимры Тверской области
Цель урока: Повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Технологическая схема урока в по технологии ТРКМ (развития критического мышления):
Вызов: пробуждение интереса к изучаемой теме, актуализация знаний по теме и определение направления дальнейшего изучения или целеполагание) – «тонкие» и «толстые» вопросы.
Осмысление: знакомство с новой информацией – фишбоун, вопрос Коломбо.
Рефлексия: введение новых знания в систему имеющихся сведений по теме, выработка отношение к ней – вопрос, направляющий ход мышления, рефлексивные вопросы.
Стадия вызова.
Учитель задает учащимся вопросы: тонкие вопросы, требующие ответа на уровне воспроизведения, и толстый вопрос, ответ на который требует размышления (смотри таблицу 1).
Таблица №1. Тонкие и толстые вопросы.
Тонкие вопросыТолстые вопросы
1. Что такое валентность?
2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Ответы учащиеся записывают в тетради:
1. Валентность — способность атомов к присоединению определенного числа других атомов.
2. Степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов (электрический заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам).
3. Высшая валентность х.э. – это число электронов на внешнем энергетическом уровне.
4. Низшая валентность – это число свободных мест на атомной орбитали внешнего уровня.
Ответ на толстый вопрос учитель предлагает найти вместе.
Учащиеся выдвигают свои версии ответа на этот вопрос.
Стадия осмысления
Учитель на доске изображает «рыбный скелет», учащиеся переносят его себе в тетради (схема 1). В «голове» рыбы записывается проблема (вопрос). На первых «косточках», ближайших к голове, записываются понятия, которые нужно сравнить, на вторых – определения этих понятий. Однако понятие валентности рассматривается уже на более высоком уровне, с точки зрения образования ковалентных связей. На следующих «косточках» учитель записывает примеры веществ N2 и NaCl, С2Н2 учащимся предлагается определить валентности и степень окисления элементов данных соединениях. Затем учащиеся делают вывод о том, в чем состоит отличие рассмотренных понятий. Этот вывод записывается в «хвосте» рыбы.
Затем учитель формулирует следующее положение: «Мы обсудили, что валентность атома определяется числом неспаренных электронов. Но тогда, мне бы хотелось знать (вопрос Коломбо), чему равна валентность азота в катионе аммония NH4+».
Учащиеся с помощью учителя, путем последовательных рассуждений, выводят решение этой проблемы:
Атом N образует три ковалентные связи с атомами водорода:2p
2s
H 1s H 1s H 1s
Образуется молекула аммиака.
Для образования катиона аммония необходимо присоединить к данной молекуле катион водорода (протон).
N 2p
2s
H 1s H 1s H 1s
H+ 1s
Такой механизм образования связи называется донорно-акцепторным.
Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
Исходя из решения данной проблемы, учащиеся вместе с учителем делают вывод, что валентные возможности атомов определяются не только числом неспаренных электронов, но и числом неподеленных электронных пар, способных переходить на свободные орбитали атомов другого элемента.
Высшим пределом валентности является такое значение, которое равно числу возможных орбиталей (квантовых ячеек) на внешнем уровне атома.
Стадия рефлексии
Учащимся предлагается на основании электронной конфигурации атома (и ее графического отображения) определить валентные возможности атома.
Электронная конфигурация S – 3s23p43p
3s
2 свободных элеткрона дают возможность сере образовывать 2 ковалентные связи по обменному механизму. Сера в данном случае проявляет валентность II.
Химический элемент S расположен в третьем периоде, значит на внешнем энергетическом уровне его имеется 3 энергетических подуровня – s, p и d. Серу можно перевести в возбужденное состояние распарив электроны на 3p-подуровне.
*
3p 3d
3s 3p
3s
Теперь на внешнем энергетическом уровне находится 4 неспаренных электрона, которые могут участвовать в образовании 4 ковалентных связей по обменному механизму. Валентность серы равна IV.
Аналогично можно распарить электроны, расположенные на 3s-подуровне.
* 3d ** 3d
3p 3p
3s 3s
6 неспаренных электронов на внешнем энергетическом уровне способны образовывать 6 ковалентных связей. Сера в таких соединениях проявляет валентность равную VI.
Таким образом, валентность серы в соединениях может быть равной II, IV и VI.
После этого учитель задает учащимся следующие вопросы:
Что показалась трудным на уроке? что осталось непонятым? что бы вы хотели обсудить подробнее? какое впечатление осталось от урока?
Использование приемов ТРКМ на данном уроке позволило заинтересовать учащихся, пробудить их творческую активность
СХЕМА 1. Фишбоун к уроку «Валентность. Валентные возможности атомов.»
Проблема
Чем отличается валентность от степени
окисления?
ВАЛЕНТНОСТЬ СТЕПЕНЬ ОКИСЛЕНИЯ
ОПРЕДЕЛЕНИЕ
Валентность – способность атомов образовывать Степень окисления – условный заряд атома,
ковалентные связи с другими атомами. вычисленный из предположения, что он
принял или отдал определенное число
электронов.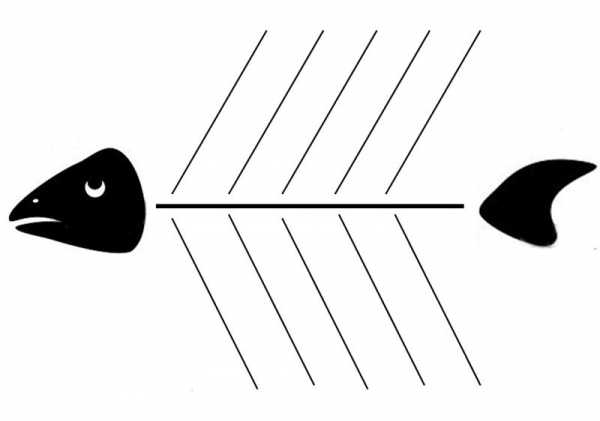
N2
0
Валентность равна III N≡ N NaCl Степень окисления равна нулю N2
В ионном соединении понятие Степень окисления натрия +1, а
валентности не применяют С2Н2 степень окисления хлора ─1
Валентность углерода равна IV, а Степень окисления
водорода I H─C≡C─H углерода ─ 1 и применяют для
расстановки коэффициентов
методом электронного
баланса.
+1 ─ 1 ─1 +1
H─ C ≡ C─H
Вывод: степень окисления во многих
случаях не совпадает с числом образуемых
им связей, то есть не равна валентности
данного элемента. Нельзя говорить о
валентности атомов в соединениях, если
в нем отсутствуют ковалентные связи.
infourok.ru
Урок «Валентность. Валентные возможности атома. Размер атомов.»
Тема: Валентность. Валентные возможности и размеры атомов химических элементов.
Цели урока:
Личностные: содействовать осознанию ценности совместной деятельности.
Метапредметные:
Создать условия для развития умений сравнивать, выделять главное в тексте, структурировать, общаться, слушать и вступать в диалог, планировать свою деятельность, осуществлять самоконтроль, самооценку.
Оборудование урока: маршрутные листы, текст, учебники.
Структура урока:
Организационный момент (наведение на тему урока, постановка цели урока, сообщение правил работы в группе – запись на доске). Обратить внимание на регламент времени.
Запомни и соблюдай простые правила:
Уважай своего товарища.
Умей каждого выслушать.
Не согласен – предлагай!
План действий:
Выберите лидера группы.
Обсудите пути достижения целей, распределите задания для каждого из членов группы.
Убедитесь, что члены группы понимают цели и задачи, стоящие перед ними.
Учитесь находить контакты в группе.
2.Проверка домашнего задания (работа в группе с маршрутным листом – 5 минут)
3.Изучение нового материала :
Теория –7 минут на подготовку, выполнение по маршрутному листу в группах.
По 5 минут – выступление 3 групп.
Практика – выполнение в группах 5 минут.
4.Самооценка и рефлексия. Индивидуально.
Обсуждение достижения/не достижения цели урока.
5. Домашнее задание.
Тема: _____________________________________________________________________________________________________________________
Цель: ______________________________________________________________________________________________________________________
Проверка домашнего задания | Теория | Практика | Оценивание |
Запишите молекулярные уравнения реакций: H2 + Cl2 = CuO + H2 = CuCl2+H2= Ca+H2= Подчеркните ошибки в тексте: Лантаноиды и актиноиды в короткой форме Периодической системы Д.И. Менделеева вынесены в три последних ряда. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4s- и 5s-подуровней. Лантаноиды не сходны по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия. Электроны заполняют 5d-, а не 4f- подуровень потому, что в этом случае они обладают меньшей энергией. Благодаря этому один из 4f -электронов (а в некоторых случаях, например, у церия, два 4f—электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. | Напишите определение : валентность – это Дополните схему примерами: Валентность Постоянная Переменная ______________ _____________ Определите валентность всех элементов в соединениях, подпишите валентность: HCl, HNO3, H3РО4, H2SO4 Объясните, составьте алгоритм определения валентности и представьте его одноклассникам 1) 2) 3) 4) | Выполните задания: Укажите 5 химических элементов, имеющих постоянную валентность _______________________ Укажите 5 химических элементов, имеющих переменную валентность Определите валентность хим.элементов в следующих хим. соединениях: NaCl, СаSO4, СаCl2 Постройте графическую формулу серы, укажите валентные возможности атома. Количество валентностей, образуемых атомом серы. | Оцените свою работу по разделу «Теория»: Разобрался в материал полностью, все было понятно (2б) Во время работы возникали затруднения, но к концу урока они были преодолены (1,5б) Активно принимал участие на всех этапах урока (2 б) Принимал участие не на всех этапах урока (1б) Выступал у доски (2 б) Создавал продукт (плакат, алгоритм, схему на доске, рисунок, модель) (2б) Наибольшее затруднение вызвал раздел «Проверка домашнего задания» Д.з. Наибольшее затруднение вызвал раздел «Теория» Т. Наибольшее затруднение вызвал раздел «Практика» П. Достиг ли цели урока? Фамилия, имя – количество баллов ___________________________ |
Тема: _____________________________________________________________________________________________________________________
Цель: ______________________________________________________________________________________________________________________
Проверка домашнего задания | Теория | Практика | Оценивание |
Запишите молекулярные уравнения реакций: H2 + Cl2 = CuO + H2 = CuCl2+H2= Ca+H2= Подчеркните ошибки в тексте: Лантаноиды и актиноиды в короткой форме Периодической системы Д.И. Менделеева вынесены в три последних ряда. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4s- и 5s-подуровней. Лантаноиды не сходны по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия. Электроны заполняют 5d-, а не 4f- подуровень потому, что в этом случае они обладают меньшей энергией. Благодаря этому один из 4f -электронов (а в некоторых случаях, например, у церия, два 4f—электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. | Внимательно прочтите текст «Валентные возможности атома» Ознакомьтесь с графическими формулами азота и фосфора, почему фосфор может быть в нескольких валентных состояниях Объясните на примере фосфора возможность образовывать разные валентности. (выступление у доски) Напишите графическую формулу распределения электронов в атоме кремния, укажите варианты возможной валентности. | Выполните задания: Укажите 5 химических элементов, имеющих постоянную валентность _______________________ Укажите 5 химических элементов, имеющих переменную валентность Определите валентность хим.элементов в следующих хим. соединениях: NaCl, СаSO4, СаCl2 Постройте графическую формулу серы, укажите валентные возможности атома. Количество валентностей, образуемых атомом серы. | Оцените свою работу по разделу «Теория»: Разобрался в материал полностью, все было понятно (2б) Во время работы возникали затруднения, но к концу урока они были преодолены (1,5б) Активно принимал участие на всех этапах урока (2 б) Принимал участие не на всех этапах урока (1б) Выступал у доски (2 б) Создавал продукт (плакат, алгоритм, схему на доске, рисунок, модель) (2б) Наибольшее затруднение вызвал раздел «Проверка домашнего задания» Д.з. Наибольшее затруднение вызвал раздел «Теория» Т. Наибольшее затруднение вызвал раздел «Практика» П. Достиг ли цели урока? Фамилия, имя – количество баллов ___________________________ |
Тема: _____________________________________________________________________________________________________________________
Цель: ______________________________________________________________________________________________________________________
Проверка домашнего задания | Теория | Практика | Оценивание |
Запишите молекулярные уравнения реакций: H2 + Cl2 = CuO + H2 = CuCl2+H2= Ca+H2= Подчеркните ошибки в тексте: Лантаноиды и актиноиды в короткой форме Периодической системы Д.И. Менделеева вынесены в три последних ряда. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4s- и 5s-подуровней. Лантаноиды не сходны по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия. Электроны заполняют 5d-, а не 4f- подуровень потому, что в этом случае они обладают меньшей энергией. Благодаря этому один из 4f -электронов (а в некоторых случаях, например, у церия, два 4f—электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. | Внимательно прочтите часть параграфа «Периодические изменения валентности и размеров атомов» Составьте краткий содержательный конспект или схему (не более 6 предложений) Объясните одноклассникам, в чем заключается ваша часть темы (выступление у доски). Используя таблицу Менделеева, напишите как изменяется (увеличивается или уменьшается ) размер атомов во А) 2 группе ПСХЭМ Б) 3 периоде ПСХЭМ | Выполните задания: Укажите 5 химических элементов, имеющих постоянную валентность _______________________ Укажите 5 химических элементов, имеющих переменную валентность Определите валентность хим.элементов в следующих хим. соединениях: NaCl, СаSO4, СаCl2 Постройте графическую формулу серы, укажите валентные возможности атома. Количество валентностей, образуемых атомом серы. | Оцените свою работу по разделу «Теория»: Разобрался в материал полностью, все было понятно (2б) Во время работы возникали затруднения, но к концу урока они были преодолены (1,5б) Активно принимал участие на всех этапах урока (2 б) Принимал участие не на всех этапах урока (1б) Выступал у доски (2 б) Создавал продукт (плакат, алгоритм, схему на доске, рисунок, модель) (2б) Наибольшее затруднение вызвал раздел «Проверка домашнего задания» Д.з. Наибольшее затруднение вызвал раздел «Теория» Т. Наибольшее затруднение вызвал раздел «Практика» П. Достиг ли цели урока? Фамилия, имя – количество баллов ___________________________ |
Текст 2 группа.
Валентные возможности атомов определяются числом не спаренных электроном, а так же числом не поделённых электронных пар способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму).
Азот | 7 N 1s22s22p3 | У атома азота на внешнем втором уровне 1s и 3pорбитали, всего 4 орбитали, следовательно, максимально возможная валентность равна IV |
Фосфор | У атома фосфора в основном (стационарном) состояниивалентность как и у азота равнаIV | |
| У атома фосфора, в отличие от азота есть свободные d– орбитали, поэтому для фосфора характерновозбуждённое состояние, когда 3s2 электроны распариваются и валентность принимает значение V |
videouroki.net
конспект урока — конкурса в 11 классе на тему «Химическая связь и строение веществ»
Урок – конкурс «СВОЯ ОПОРА» или чья шпаргалка лучше
Активизация познавательной деятельности – важнейшее условие развития учащихся и поддержания их интереса к химии. Продуманный и хорошо организованный процесс самостоятельного освоения материала и его обобщения способен увлечь даже тех школьников, которые не проявляют особого интереса к изучению данного предмета. Уроки обобщения знаний можно спланировать так, чтобы они не только давали учащимся возможность повторить и систематизировать учебный материал, но и развивали умение выступать перед аудиторией, уверенно применять знания, анализировать ответы одноклассников, формулировать вопросы различных типов по изученным темам, проявлять смекалку, осмысленно и творчески подходить к решению поставленной задачи.
Урок – конкурс, по сути, являющийся дидактической игрой, помогает учащимся глубже усвоить изученный материал и, кроме того, стимулирует развитие их познавательного интереса, творческих способностей. Немаловажное значение для этого имеет эмоциональный настрой школьников и психолого-педагогический климат урока.
Как показывает практика, применение дидактических игр целесообразно, прежде всего при изучении тем, которые недостаточно обеспечены химическим экспериментом.
За 2 – 3 недели до урока класс делится на четыре команды, состав команд и задания вывешиваются в кабинете химии на стенде. Учитель объясняет школьникам, что каждой команде необходимо подготовить опорный конспект или идеальную шпаргалку по теме «Химическая связь и строение вещества» и защитить его. Учитель объясняет ученикам практическую значимость такой работы: нынешним школьникам – будущим студентам и молодым специалистам – придется проходить собеседование при приеме на работу, поэтому им необходимо обладать логическим мышлением и коммуникативными способностями, хорошо говорить, уметь грамотно обосновывать и корректно отстаивать свою точку зрения, решать творческие задачи, ставить цели и мотивировать свои решения.
Кроме того, в школе дети в основном учатся решать задачи так называемого закрытого типа, где есть конкретные условия и один конкретный ответ. Решаются такие задачи, как правило, по заданному алгоритму. Однако жизнь чаще всего ставит перед человеком, так называемые задачи открытого типа, для которых не всегда есть четкий алгоритм решения и ответ может быть не один, а несколько. Навыки в решении подобных задач учащиеся могут получить, работая в группах на уроке или при подготовке к нему.
Каждая команда получает задание подготовить конспект по всей теме «Химическая связь и строение вещества». Учитель делит тему на 4 блока и на уроке вызывает команды в произвольном порядке. (Если поручить командам готовить один из блоков, то на уроке школьники не очень внимательно слушают ответы товарищей, готовясь каждый к своему выступлению). Члены команды должны продемонстрировать свой конспект, дать его краткую характеристику, а затем письменно (на доске) и устно ответить на вопросы по одному из блоков. Если ответ учащегося требует уточнения или дополнения, учитель обращается к классу.
Работая таким образом, учащиеся класса не являются пассивными слушателями. Они отвечают на вопросы учителя, выполняют письменно в тетрадях те же задания, что и их товарищи, работающие у доски. Результаты работы каждого ученика (устный ответ, письменный ответ при работе в группе, устный ответ с места) учитель фиксирует на листе опроса и в конце урока выставляет всем отметки.
Такая форма проведения урока мотивирует учащихся к проявлению активности, поскольку им известно, что по данной теме их спросят непременно, а итог их совместной работы будут анализировать одноклассники. Хорошие результаты позволяют школьникам испытать гордость за качественно выполненную работу.
Для проведения урока – конкурса необходимо 2 часа (спаренные уроки).
ОБОБЩАЮЩИЙ УРОК В 11 КЛАССЕ ПО ТЕМЕ
«ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА»
Цели урока: обобщить, систематизировать и закрепить знания основных теоретических положений и понятий, характеризующих химическую связь.
Задачи урока: обобщить знания по теме «Химическая связь и строение вещества», создать условия для развития коммуникативных способностей, логического мышления учащихся (таких мыслительных операций, как анализ, синтез, сравнение, обобщение), их творческой самореализации, способствовать формированию культуры дискуссии, воспитывать чувства взаимопомощи и ответственности за общее дело.
Девиз урока: «Зная типы связей в молекулах любого вещества, можно объяснить его структуру и важнейшие свойства» (Л.Полинг).
Ход урока.
После вступительного слова учителя, в котором он подчеркивает роль учения о химической связи в развитии современной химии, учащиеся с помощью учителя формулируют цели урока, учитель записывает их на доске, где заранее уже записаны дата, тема и девиз урока.
Педагог кратко рассказывает о плане проведения урока, затем вызывает каждую из команд к доске в произвольной очередности. Учащиеся кратко характеризуют свой опорный конспект, а затем излагают теоретический материал по одному из блоков, отвечают на вопросы по данному блоку, выполняют письменные задания.
Остальные учащиеся слушают ответы товарищей и, если возникает такая необходимость, дополняют их, исправляют, задают вопросы по данному блоку, письменно выполняют в тетрадях задания.
Блок 1. Ковалентная связь и ее свойства
Задание для устного ответа
Дайте определения ковалентной полярной и неполярной связи, связывающих и несвязывающих (неподелённых) электронных пар, σ- и π-связи, одинарной и кратной связи, обменного и донорно-акцепторного механизмов образования связи. Расскажите о свойствах ковалентной связи: длине, энергии, направленности.
Письменные задания
1. Покажите с помощью электронно-графических схем образование ковалентных связей в молекулах F2, Cl2, HCl, h3O. Напишите электронные и структурные формулы этих молекул.
2. Опишите пространственную структуру молекул F2, Cl2, HCl, h3O.
Вопросы по данному блоку
1. Какая из систем и почему наиболее устойчива: два отдельных атома водорода или молекула водорода?
2. Какую природу имеют силы, удерживающие атомы в составе молекулы?
3. Каким должен быть спин электронов, которые образуют общую электронную пару при возникновении ковалентной связи?
4. Сколько связывающих и неподелённых электронных пар имеется в молекуле фтора?
5. Как зависит геометрическая структура молекул от числа электронных пар?
6. Атомы каких элементов могут выступать акцепторами электронных пар: водорода, калия, фтора, серы?
Блок 2. Виды химической связи.
Задание для устного ответа
Дайте определения понятий электроотрицательности, иона, ионной связи, ионного соединения. Расскажите о возникновении ионной связи между простым катионом и сложными анионами, металлической связи, внутримолекулярной и межмолекулярной водородной связи и межмолекулярного взаимодействия.
Письменные задания
1. Напишите электронные формулы атомов и ионов: Li, Li+, S, S2-, F, F- .
2. Составьте схемы образования димеров уксусной и пропановой кислот за счет образования водородной связи.
Вопросы по данному блоку
1. Размер какой частицы больше: атома металла или его катиона? Атома неметалла или его аниона?
2. Между молекулами каких веществ могут образовываться водородные связи?
3. Какие связи присутствуют в веществах, формулы которых F2, Cl2, HBr, h3S, Mg, Ch4OH, CuSO4, KOH?
4. Между какими молекулами существует межмолекулярное взаимодействие: полярными или неполярными?
5. Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов?
6. Как называют соединения металлов друг с другом? Приведите примеры таких соединений.
Блок 3. Валентность и степень окисления.
Задание для устного ответа
Дайте определения понятий валентности и степени окисления. Расскажите о валентных возможностях атомов первых трех периодов, основных положениях, которыми следует руководствоваться при определении степеней окисления атомов элементов.
Письменные задания
1. Составьте электронно-графические схемы атомов кислорода и серы, сделайте выводы об их валентных возможностях.
2. Определите степени окисления всех атомов в соединениях по их формулам: h3O2, OF2, Ch4OH, KMnO4, KClO3, K2MnO4, HClO4, Ca(NO3)2, Nh5NO3, Fe3(PO4)2, Al2(SO4)3, PCl5, NOF.
Вопросы по данному блоку
1. Какой характеристикой атома – качественной или количественной – является валентность?
2. Почему валентность атомов элементов второго периода не может быть больше четырех?
3. К соединениям с каким видом связи применимо понятие валентности?
4. Какие степени окисления характерны для атомов металлов?
5. Как определить максимальную положительную и минимальную отрицательную степени окисления атома неметалла?
6. Приведите примеры соединений, в которых степень окисления и валентность атомов данного элемента не совпадают.
Блок 4. Типы кристаллических решеток.
Задание для устного ответа
Расскажите об атомных, молекулярных, ионных и металлических кристаллических решетках и свойствах веществ с данными типами кристаллических решеток.
Письменные задания
1. Изобразите схемы атомной, молекулярной, ионной и металлической кристаллических решеток и приведите примеры веществ с данными типами кристаллических решеток.
2. Выпишите из данного перечня формулы веществ: а) молекулярного строения; б) немолекулярного строения: Na2S, SiC, SiO2, HBr, CO2, Nh4, N2, C (алмаз).
Вопросы по данному блоку
1. Почему вещества с атомной кристаллической решеткой имеют высокие температуры кипения и плавления?
2. Почему вещества с ионной кристаллической решеткой обычно не имеют запаха?
3. Какой тип кристаллической решетки у инертных газов?
4. Вещество обладает высокими температурами плавления и кипения и большой плотностью. Какой тип кристаллической решетки у данного вещества?
5. Почему органические вещества, молекулы которых содержат десятки тысяч атомов, вообще не плавятся?
6. От чего зависит реакционная способность веществ молекулярного строения?
По окончании выступления команд учащиеся в группах обсуждают предложенные опорные конспекты и определяют лучший. Учитель выставляет отметки, задает домашнее задание и организует процесс рефлексии, предлагая детям вопросы: достигнута ли цель урока? Отметьте положительные и отрицательные стороны проведения урока в форме деловой игры.
infourok.ru
План урока по химии на тему «Валентность, валентные возможности атомов»
11 класс.
Тема: «Валентность, валентные возможности атомов».
Цель урока: Повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Технологическая схема урока в логике ТРКМ:
Вызов (пробуждение интереса к изучаемой теме, актуализация знаний по теме и определение направления дальнейшего изучения или целеполагание) – Тонкие и толстые вопросы;
Осмысление (знакомство с новой информацией) – Фишбоун, вопрос Коломбо;
Рефлексия (введение новых знания в систему имеющихся сведений по теме, выработка отношение к ней) – Вопрос, направляющий ход мышления, рефлексивные вопросы.
I Стадия вызова.
Учитель задает учащимся вопросы: тонкие вопросы, требующие ответа на уровне воспроизведения, и толстый вопрос, ответ на который требует размышления (смотри таблицу 1).
Таблица №1. Тонкие и толстые вопросы.
Тонкие вопросы
Толстые вопросы
1. Что такое валентность?
2. Что такое степень окисления?
3. Чем определяется высшая валентность атомов?
4. Чем определяется низшая валентность атома?
5. Чем отличается валентность от степени окисления?
Ответы учащиеся записывают в тетради:
1. валентность — способность атомов к присоединению определенного числа других атомов.
2. степень окисления – условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов (электрический заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам).
3. Высшая валентность х.э. – это число электронов на внешнем энергетическом уровне.
4. Низшая валентность – это число свободных мест на атомной орбитали внешнего уровня.
Ответ на толстый вопрос учитель предлагает найти вместе.
Учащиеся выдвигают свои версии ответа на этот вопрос.
II Стадия осмысления
Учитель на доске изображает «рыбный скелет», учащиеся переносят его себе в тетради (схема 1). В «голове» рыбы записывается вопрос. На первых «косточках», ближайших к голове, записываются понятия, которые нужно сравнить, на вторых – определения этих понятий. Однако понятие валентности рассматривается уже на более высоком уровне, с точки зрения образования ковалентных связей. На следующих «косточках» учитель записывает примеры веществ N2 и NaCl, учащимся предлагается определить валентности и степень окисления элементов данных соединениях. Затем учащиеся делают вывод о том, в чем состоит отличие рассмотренных понятий. Этот вывод записывается в «хвосте» рыбы.
Затем учитель формулирует следующее положение: «Мы обсудили, что валентность атома определяется числом неспаренных электронов. Но тогда, мне бы хотелось знать, чему равна валентность азота в катионе аммония NH4+».
Учащиеся с помощью учителя, путем последовательных рассуждений, выводят решение этой проблемы:
Атом N образует три ковалентные связи с атомами водорода:
2p
2s
H 1s H 1s H 1s
Образуется молекула аммиака.
Для образования катиона аммония необходимо присоединить к данной молекуле катион водорода (протон).
N 2p
2s
H 1s H 1s H 1s
H+ 1s
Такой механизм образования связи называется донорно-акцепторным.
Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
Исходя из решения данной проблемы, учащиеся вместе с учителем делают вывод, что Валентные возможности атомов определяются не только числом неспаренных электронов, но и числом неподеленных электронных пар, способных переходить на свободные орбитали атомов другого элемента.
Высшим пределом валентности является такое значение, которое равно числу возможных орбиталей (квантовых ячеек) на внешнем уровне атома.
III Стадия Рефлексии
Учащимся предлагается на основании электронной конфигурации атома (и ее графического отображения) определить валентные возможности атома.
Электронная конфигурация S – 3s23p4
3p
3s
2 свободных электрона дают возможность сере образовывать 2 ковалентные связи по обменному механизму. Сера в данном случае проявляет валентность 2.
Химический элемент S расположен в третьем периоде, значит на внешнем энергетическом уровне его имеется 3 энергетических подуровня – s, p и d. Серу можно перевести в возбужденное состояние распарив электроны на 3p-подуровне.
*
3p 3d
3s 3p
3s
Теперь на внешнем энергетическом уровне находится 4 неспаренных электрона. Которые могут участвовать в образовании 4 ковалентных связей по обменному механизму. Валентность серы равна 4.
Аналогично можно распарить электроны, расположенные на 3s-подуровне.
* 3d ** 3d
3p 3p
3s 3s
6 неспаренных электронов на внешнем энергетическом уровне способны образовывать 6 ковалентных связей. Сера в таких соединениях проявляет валентность равную 6.
Таким образом, валентность серы в соединениях может быть равной 2, 4 и 6. В простых веществах валентность серы равно 0.
После этого учитель задает учащимся следующие вопросы:
Что показалась трудным на уроке? что осталось непонятым? что бы вы хотели обсудить подробнее? какое впечатление осталось от урока?
Использование приемов ТРКМ на данном уроке позволило заинтересовать учащихся, пробудить их творческую активность
Схема 1. Схема для приема «Фишбоун»

infourok.ru

