Задачи на проценты химия: Проценты. Задачи на проценты. Как найти процент от числа
Текстовые задачи: проценты, сплавы, растворы
- Белозерова Татьяна Анатольевна, учитель химии
Разделы: Математика, Химия
Цели: Оказать методическую помощь при подготовке выпускников к ЕГЭ по математике; проработать алгоритм решения химических задач.
Задачи.
Обучающие:
- активизировать знания учащихся по теме «Массовая доля вещества в растворе»;
- познакомить учащихся с алгоритмом решения задач на растворы и сплавы «методом стаканчиков»;
- закрепить умение решать задачи на растворы и сплавы;
- продолжить подготовку учащихся к сдаче ЕГЭ.
Развивающие:
- развивать познавательный интерес, реализуя межпредметные связи курсов химии и математики;
- развивать алгоритмический стиль мышления.

Воспитательные:
- продолжать формирование мотивации учебной деятельности, положительного отношения к знаниям;
- формировать информационную и коммуникативную культуру.
Оборудование. Компьютер, экран, мультимедийный проектор, презентация с алгоритмами решения задач на массовую долю вещества в растворе «методом стаканчиков», многовариантная проверочная работа с задачами трёх уровней сложности (10 вариантов), ключ к ответам.
Методы. Объяснительно-иллюстративный, репродуктивный.
План урока
1. Вводная часть:
– организационный момент;
– мотивация познавательной деятельности;
– сообщение темы и постановка целей урока.
2. Активизация знаний по теме «Массовая доля вещества в растворе».
3. Знакомство учащихся с алгоритмом решения задач на растворы и сплавы
«методом стаканчиков».
4. Закрепление умения решать задачи на растворы и сплавы при помощи многовариантной проверочной работы с задачами трёх уровней сложности.
5. Самопроверка. Самооценка. Рефлексия.
6. Домашнее задание.
7. Подведение итогов.
Приложение 4
Ход урока
1. Вводная часть.
Проверка готовности класса к уроку, приветствие.
Учитель. У нас на уроке химии сегодня гости – это учителя математики. Как вы считаете, какая связь существует между учениками 11 класса, учителями математики и уроком химии?…. Да, это ЕГЭ по математике, в котором имеют место и химические задачи. С этими задачами вы уже встречались в 9 классе при сдаче экзаменов по химии и математике. А также умение решать эти задачи вам понадобится при подготовке к ЕГЭ по химии ( это задание В 9) и к ЕГЭ по математике (задание В 13). Поэтому закономерна тема нашего урока.
«Текстовые задачи: проценты, сплавы, растворы».
Далее учитель подводит учащихся к постановке целей урока.
- Повторить понятие массовой доли.
- Познакомиться с алгоритмом решения задач на растворы и сплавы методом стаканчиков».
- Отработать умение решать задачи на растворы и сплавы.
2. Активизация знаний по теме «Массовая доля вещества в растворе».
Как найти массу раствора?
– Надо сложить массу вещества и массу растворителя.
т
р-ра = т в-ва + т р-ля
(запись на доске)
Демонстрация приготовления раствора медного купороса (Приложение 1).
Что является основной характеристикой растворов?
– Массовая доля растворенного вещества.
Как вычислить массовую долю?
– Надо найти отношение массы растворенного вещества к массе раствора.
ω = т в-ва : т р-ра ۰ 100% (запись на доске)
В каких единицах измерения выражается массовая доля вещества?
– В процентах или долях единицы.
Это основные теоретические сведения, необходимые для успешного решения задач на растворы и сплавы.
3. Знакомство учащихся с алгоритмом решения задач на растворы и сплавы «методом стаканчиков»
Схема и уравнение для решения задач с процентами.
Главное правило в задачах с растворами.
Решение задачи №1.
Составляется схема приготовления раствора. Затем составляется уравнение решается относительно х.
Решение задачи № 2.
Решение задачи №3.
Решение задачи №4.
4. Закрепление умения решать задачи на растворы и сплавы при помощи многовариант-ной проверочной работы с задачами трёх уровней сложности (Приложение 2).
5. Двое учащихся с заданием 3-го уровня работают у доски. Остальные выполняют решение задач на листочках самостоятельно. Ученики оценивают свою работу, сверив ответы с матрицей.
- За правильное решение задачи первого уровня – «3» .
- За правильное решение задачи второго уровня – «4».
- За правильное решение задач первого и второго уровня -«5».
- За правильное решение задачи третьего уровня –«5».
Матрица ответов для самопроверки.
Рефлексия.
6. Домашнее задание.
Поменяться с соседом вариантом и решить его дома.
7. Подведение итогов урока (Приложение 3).
Расчётные задачи по химии. Химия, 8 класс: уроки, тесты, задания.
- Химия
- 8 класс
-
Физические величины
-
Относительная атомная и молекулярная массы.
 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества
-
Количество вещества
-
Вычисление молярной массы вещества
-
-
Вычисление массовой доли элемента в химическом соединении
-
Установление простейшей формулы вещества по массовым долям элементов
-
Простейшие вычисления по уравнениям химических реакций
-
Вычисления по уравнениям реакций, если исходное вещество содержит определённую долю примесей
Отправить отзыв
13.
 5: Концентрация раствора – массовые проценты
5: Концентрация раствора – массовые проценты- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98091
Цели обучения
- Выразите количество растворенного вещества в растворе в различных единицах концентрации.
Чтобы точно определить раствор, нам нужно указать его концентрацию: сколько растворенного вещества растворено в определенном количестве растворителя. Такие слова, как разбавленный или концентрированный , используются для описания растворов, содержащих мало или много растворенного вещества, соответственно, но это относительные термины, значения которых зависят от различных факторов.
Введение
Концентрация — это мера того, сколько данного вещества смешано с другим веществом. Растворы бывают разбавленными или концентрированными. Когда мы говорим, что уксус — это \(5\%\) уксусной кислоты в воде, мы даем концентрацию. Если бы мы сказали, что смесь представляет собой \(10%\) уксусную кислоту, она была бы более концентрированной, чем раствор уксуса.
Растворы бывают разбавленными или концентрированными. Когда мы говорим, что уксус — это \(5\%\) уксусной кислоты в воде, мы даем концентрацию. Если бы мы сказали, что смесь представляет собой \(10%\) уксусную кислоту, она была бы более концентрированной, чем раствор уксуса.
Концентрированный раствор — это раствор, в котором содержится большое количество растворенного вещества в данном количестве растворителя. Разбавленный раствор — это раствор, в котором содержится небольшое количество растворенного вещества в заданном количестве растворителя. Разбавленный раствор — это концентрированный раствор, который, по сути, был разбавлен водой. Подумайте о контейнерах для замороженного сока, которые вы покупаете в продуктовом магазине. Чтобы сделать сок, вы должны смешать замороженный концентрат сока внутри этих контейнеров с водой, в три или четыре раза превышающей размер контейнера. Таким образом, вы разбавляете концентрированный сок. Что касается растворенного вещества и растворителя, концентрированный раствор содержит много растворенного вещества по сравнению с разбавленным раствором, который содержит меньшее количество растворенного вещества.
Подумайте о контейнерах для замороженного сока, которые вы покупаете в продуктовом магазине. Чтобы сделать сок, вы должны смешать замороженный концентрат сока внутри этих контейнеров с водой, в три или четыре раза превышающей размер контейнера. Таким образом, вы разбавляете концентрированный сок. Что касается растворенного вещества и растворителя, концентрированный раствор содержит много растворенного вещества по сравнению с разбавленным раствором, который содержит меньшее количество растворенного вещества.
Термины «концентрированный» и «разбавленный» обеспечивают качественные методы описания концентрации. Хотя качественные наблюдения необходимы и имеют место в каждой области науки, включая химию, в ходе нашего изучения науки мы видели, что в науке существует определенная потребность в количественных измерениях. Особенно это касается химии растворов. В этом разделе мы рассмотрим некоторые количественные методы выражения концентрации раствора.
Массовый процент
Существует несколько способов выражения концентрации раствора в процентах.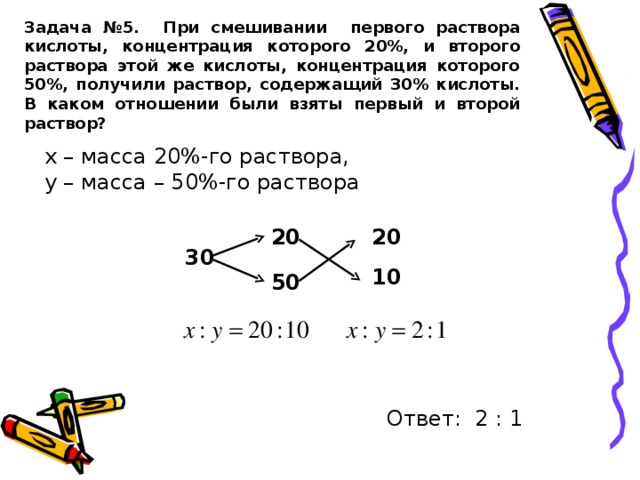 Массовый/массовый процент (% m/m) определяется как масса растворенного вещества, деленная на массу раствора, умноженная на 100:
Массовый/массовый процент (% m/m) определяется как масса растворенного вещества, деленная на массу раствора, умноженная на 100:
\[\mathrm{\% \:m/m = \dfrac{mass\:
масса раствора = масса растворенного вещества + масса растворителя
Если вы можете измерить массу растворенного вещества и решение, определяющее массу/массовый процент, легко. Каждая масса должна быть выражена в одних и тех же единицах, чтобы определить правильную концентрацию.
Предположим, что раствор был приготовлен путем растворения \(25,0 \: \text{г}\) сахара в \(100,0 \: \text{г}\) воды.
Масса раствора равна
Масса раствора = 25,0 г сахара + 100,0 г воды = 125,0 г
Процент по массе рассчитывается по формуле:
25,0 \: \text{г сахара}}{125,0 \: \text{г раствора}} \times 100\% = 20,0\% \: \text{сахар} \nonumber \]
Пример \(\PageIndex{1 }\)
В солевом растворе массой 355 г растворено 36,5 г NaCl. Какова массовая/массовая процентная концентрация раствора?
Решение
Мы можем заменить величины, данные в уравнении, массой/массовым процентом: раз100\%=10,3\%}\)
Упражнение \(\PageIndex{1}\)
Раствор декстрозы (также называемой D-глюкозой, C 6 H 12 O 6 ) с массой В массе 2,00 × 10 2 г растворено 15,8 г декстрозы. Какова массовая/массовая процентная концентрация раствора?
Какова массовая/массовая процентная концентрация раствора?
- Ответить
7,90 %
Использование массовых процентов в расчетах
Иногда вам может понадобиться составить определенную массу раствора с заданным процентным содержанием по массе и рассчитать, какую массу растворенного вещества использовать. Использование массовых процентов в качестве преобразования может быть полезным в этом типе задач. Массовый процент может быть выражен как коэффициент преобразования в виде \(\dfrac{г \; \rm{раствор}}{100 \; \rm{г раствор}}\) или \(\dfrac{100 \; \ rm g решение}{g\;\rm{раствор}}\)
Например, если вам нужно приготовить \(3000,0 \: \text{g}\) из \(5,00\%\) раствора хлорида натрия, необходимо определить массу растворенного вещества.
Раствор
Дано: 3000,0 г раствора NaCl
5,00% раствор NaCl
Найти: масса растворенного вещества = ? г NaCl
Другие известные количества: 5,00 г NaCl на 100 г раствора
Можно использовать следующий соответствующий коэффициент пересчета (на основе данного массового процента):
Чтобы определить массу NaCl, данную массу раствора умножают на коэффициент преобразования.
\[г NaCl = 3000,0 \отменить{г \: NaCl \:раствор} \times \dfrac{5,00 \:г \: NaCl}{100\отменить{г \: NaCl \: раствор}} = 150,0 г \: NaCl \nonumber \]
Вам нужно будет взвесить \(150 \: \text{g}\) \(\ce{NaCl}\) и добавить его к \(2850 \: \text{g }\) воды. Обратите внимание, что необходимо вычесть массу \(\ce{NaCl}\) \(\left( 150 \: \text{g} \right)\) из массы раствора \(\left( 3000 \ : \text{g} \right)\), чтобы вычислить массу воды, которую необходимо добавить.
Упражнение \(\PageIndex{1}\)
Какое количество (в г) перекиси водорода (H 2 O 2 ) необходимо для получения 6,00 кг, 3,00 % (по массе) H 2 O 2 раствор?
Ответ180 г H 2 O 2
Авторы и ссылки
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Проценты по массе и массовым долям Химия Учебное пособие
Учебное пособие по химии в процентах по массе и массовым долямКлючевые понятия
- Массовая доля также известна как массовая доля.
массовая доля обозначается символом m/m 1
массовая доля обозначается символом w/w - Процент по массе также известен как процент по массе. 90 210 процентов по массе обозначаются символом м/м % (или массовыми %). 90 213 процентов по массе обозначают символом масс.% (или масс.%).
- Массовая доля (массовая доля) и процент по массе (процент по массе) являются мерами концентрации растворенного вещества.
- Массовая доля (массовая доля) — отношение массы одного компонента раствора к общей массе раствора.
 2
2 - Массовая доля (а) = масса (а) ÷ (масса (а) + масса (б) + масса (в) + …)
масса (а) = масса компонента а
масса (b) = масса компонента b
масса (c) = масса компонента cДля двухкомпонентного раствора, состоящего из растворенного вещества в растворителе:
массовая доля (растворенного вещества) = масса (растворенного вещества) ÷ (масса (растворенного вещества) + масса (растворителя) )
- При суммировании массовая доля (массовая доля) каждого компонента в растворе должна равняться единице:
массовая доля (а) + массовая доля (б) + массовая доля (в) + …. = 1
Для двухкомпонентного раствора, состоящего из растворенного вещества в растворителе:
массовая доля (растворенное вещество) + массовая доля (растворитель) = 1
- Массы (веса) могут быть выражены в любых единицах, если они одинаковы для всех компонентов.

- Процент по массе (процент по массе) – это процент от общей массы раствора, который является одним компонентом.
Массовые проценты = массовая доля × 100
ИЛИ
Массовые проценты = массовая доля × 100Это также может быть выражено как:
% по массе a = масса (a) ÷ (масса (a) + масса (b) + масса (c) + …) × 100
вес. % а = масса (а) ÷ (вес (а) + вес (б) + вес (в) + …) × 100 - При сложении процент по массе (или весу) всех компонентов в растворе равен 100:
масс. % а + масс. % b + масс. % с + …. = 100
ИЛИ
вес. % a + вес. % b + вес. % c + …. = 100Для двухкомпонентного раствора, состоящего из растворенного вещества в растворителе:
% по массе (растворенное вещество) + % по массе (растворитель) = 100
ИЛИ
мас. % (растворенное вещество) + мас.% (растворитель) = 100
% (растворенное вещество) + мас.% (растворитель) = 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Массовая доля (массовая доля) Расчеты концентрации
Вопрос 1. Чему равна массовая доля (массовая доля) хлорида натрия в водном растворе, содержащем 560 мг хлорида натрия и 10,4 г воды?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaCl) и растворителя (H 2 O)
масса (NaCl) = 560 мг
масса (H 2 O) = 10,4 г - Преобразование всех единиц массы в одни и те же единицы (например, все массы в граммах):
масса (NaCl) = 560 мг = 560 × 10 -3 г = 0,560 г
масса (H 2 O) = 10,4 г - Напишите уравнение для расчета массовой доли (массовой доли) хлорида натрия:
массовая доля (NaCl) = масса (NaCl) ÷ (масса (NaCl) + масса (H 2 O) )
- Подставьте значения в уравнение и решите:
массовая доля (NaCl) = 0,560 ÷ (0,560 + 10,4) = 0,051
Вопрос 2. Если в 500 г водного раствора сахарозы содержится массовая доля воды 0,65, какая масса сахарозы присутствует?
Если в 500 г водного раствора сахарозы содержится массовая доля воды 0,65, какая масса сахарозы присутствует?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (сахароза) и растворителя (вода).
масса (водный раствор) = 500 г
массовая доля (вода) = 0,65
масса (сахароза) = ? грамм - Рассчитайте массовую долю сахарозы:
массовая доля (сахароза) + массовая доля (вода) = 1
массовая доля (сахароза) = 1 — массовая доля (вода) = 1 — 0,65 = 0,35
- Рассчитайте массу присутствующей сахарозы:
массовая доля (сахароза) = масса (сахароза) ÷ общая масса (раствор)
масса (сахароза) = массовая доля (сахароза) × масса (раствор)
масса (сахароза) 5 7 х 5085 0,3
Проценты по массе (проценты по массе) Расчет концентрации
Вопрос 1. Водный раствор хлорида калия имеет массовую долю воды 78%.
Водный раствор хлорида калия имеет массовую долю воды 78%.
Какова массовая доля хлорида калия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества, хлорида калия (KCl), и растворителя, воды (H 2 O)
мас.% (вода) = 78 %
мас.% (KCl) = ? % - Напишите уравнение для расчета массовых % (KCl):
масс.% (KCl) + масс.% (H 2 O) = 100
Измените уравнение, чтобы найти массовый % KCl:
масс.% (KCl) = 100 — масс.% (H 2 O) - Подставьте значения в уравнение и решите:
мас.% (KCl) = 100 — 78 = 22%
Вопрос 2. Водный раствор содержит 700 г воды и 45 г гидроксида натрия.
Какова массовая доля гидроксида натрия?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (NaOH) и растворителя (H 2 O)
масса (H 2 O) = 700 г
масса (NaOH) = 45 г
мас. % (NaOH) = ? %
% (NaOH) = ? % - Напишите уравнение для нахождения % по массе:
% масс. NaOH = масса (NaOH) ÷ (масса (NaOH) + масса (H 2 O) ) × 100
- Подставьте значения (все массы должны иметь одинаковые единицы измерения) в уравнение и решите:
мас.% NaOH = 45 ÷ (45 + 700) × 100 = 6,04%
Вопрос 3. Водный раствор содержит 42% этанола по массе.
Какая масса этанола содержится в 250 г раствора?
- Извлеките данные из вопроса:
Водный раствор состоит из двух компонентов: растворенного вещества (этанол) и растворителя (вода).
% масс. этанол = 42 %
масса (раствор) = масса (этанол) + масса (вода) = 250 г
масса (этанол) = ? грамм - Напишите уравнение для определения массовой доли этанола:
масс.% этанола = масс.




 Вычисление относительной молекулярной массы вещества
Вычисление относительной молекулярной массы вещества

 2
2 
 % (растворенное вещество) + мас.% (растворитель) = 100
% (растворенное вещество) + мас.% (растворитель) = 100 % (NaOH) = ? %
% (NaOH) = ? %