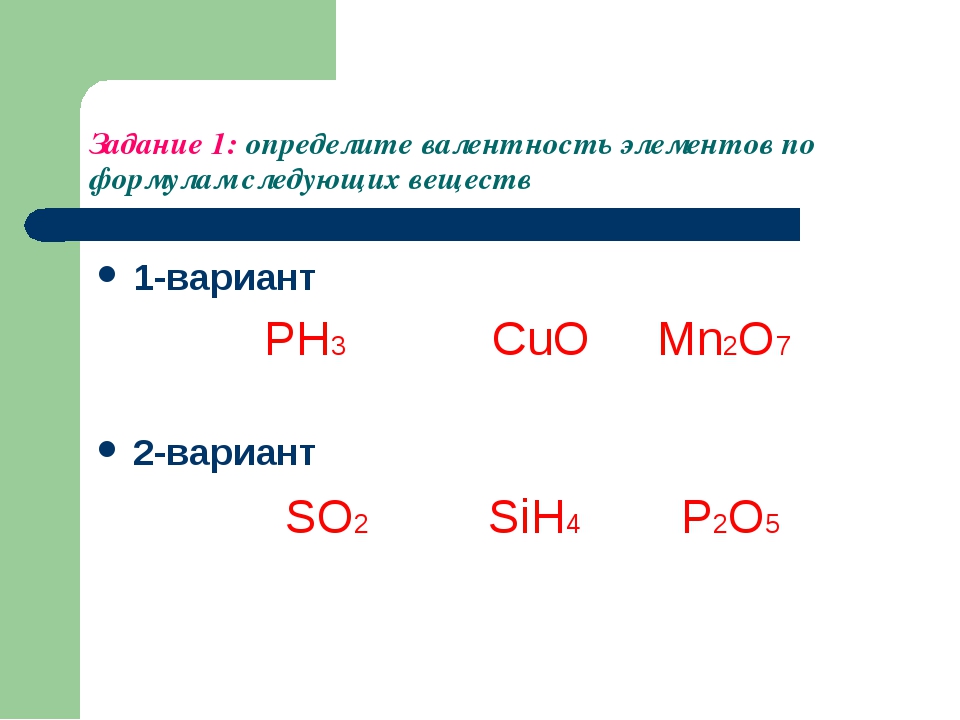
Разработка урока по химии валентность: Конспект урока «Валентность» 8 класс
знаний 9 мин |
Ребята, у вас у каждого на партах находится кроссворд, обратите внимание, что он без названия, но есть зашифрованное слово. Ваша задача отгадать кроссворд и узнать его название. Название кроссворда будет определять тему урока на сегодня.
Учитель раздает классу зеленые карточки, содержащие перечень вопросов, на которые ученики должны ответить односложно.
— На какие вопросы вы не знаете ответ? -Исходя из этого, какую цель урока можно поставить? |
Учащиеся отгадывают кроссворд. Отвечают, что кроссворд называется «Валентность» Тема урока – «Валентность».
Ученики отвечают односложно на вопросы по зеленой карточке.
Отвечают, на какие вопросы не знают ответ. Ставят цель урока:
|
20 мин |
Открываем тетрадь, записываем тему, число:
тема урока: число: 6 октября 2015 год (слайд 1)
На каждой парте находятся шарики и палочки для сборки молекул. Обратите внимание, что атом кислорода соединяется с двумя атомами водорода. Свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента называется валентностью. (слайд 2) Учитель еще раз дает определение понятию «валентность».
Сколько атомов, в молекуле воды, может присоединять атом кислорода? Следовательно, валентность кислорода равна двум, а валентность водорода равна одному. Учитель просит собрать молекулу Nh4 с помощью шаровых моделей. Валентность атома элемента ставится над соответствующим символом химического элемента и записывается римской цифрой.
Учитель на доске показывает запись расстановки валентности. Валентность водорода всегда равна I, а валентность кислорода – II. Учитель вводит понятие бинарные соединения. (слайд 3) Для бинарных соединений существует правило: «Общее число валентностей атомов одного химического элемента равно общему числу валентностей атомов другого химического элемента» (слайд 4) Учитель показывает, как использовать правило для определения валентностей элементов в бинарных соединениях, с использованием наводящих вопросов ученикам. Рассмотрим пример: Определите валентность элементов в бинарных соединениях: СаН2
Чтобы определять валентности элементов, мы должны следовать поэтапно, сейчас вы должны выделить этапы определения валентности. Для этого вам предстоит поработать с желтыми карточками, после прочтения которых, вы должны проговорить все этапы самостоятельно. Учитель раздает карточки с текстом:
«Вова Сидоров учится в 8 классе. Учитель по химии дал домашнее задание: «Определить валентность элементов в соединении СН4». Вова аккуратно переписал химическую формулу в тетрадь, вспомнив, что валентность водорода всегда равна I, поставил это значение над водородом. Далее нашел общее число единиц валентности водорода, для этого он умножил число единиц валентности водорода на его индекс, получилось, что общая валентность водорода равна 4. (Слайд 5)
А теперь мы с вами проведем игру «верное и неверное утверждение». Я проверю, насколько вы, усвоили материал на данном этапе урока, и заодно вы немного отдохнете. Я буду читать утверждения, а вы, если оно верное – хлопайте в ладоши, если неверное – топайте ногами. Утверждения:
|
Учащиеся записывают число и тему к себе в тетради.
Учащиеся в парах собирают молекулу воды.
Учащиеся записывают определение в тетрадь.
Отвечают: два атома.
Учащиеся в парах собирают молекулу аммиака.
Слушают учителя
Записывают пример записи к себе в тетрадь.
Учащиеся записывают в тетради правило
Учащиеся слушают учителя, отвечают на наводящие вопросы учителя.
Учащиеся слушают учителя.
Учащиеся работают по карточкам и выделяют устно этапы определения валентности химических элементов.
Учащиеся списывают этапы определения валентности химических элементов со слайда:
Слушают правила.
Хлопают в ладоши Топают ногами Топают ногами
Хлопают в ладоши
Хлопают в ладоши
Топают ногами |
Закрепление 10 мин |
Продолжаем дальше. Учитель приводит формулы некоторых бинарных веществ (слайд 5): SO2 Ph4 Fe2O3 MgO Ag2O Alh4 HBr N2O N2O5 Sih5 Расставьте валентность элементов и составьте модели молекул с помощью шаровых моделей. Выставление оценок. Учитель снова просит заполнить зеленую карточку, но уже столбик «Ответы в конце урока». Какие выводы можно сделать? |
Двое учащихся выходят к доске, остальные высчитывают валентности элементов в тетради.
В парах составляют модели предложенных молекул.
Учащиеся заполняют зеленую карточку.
Отвечают, что такое валентность и как ее определять. |
Урок по теме «Валентность. Составление формул по валентности». | План-конспект урока по химии (8 класс):
Приложение №2
Тема: «Валентность. Составление формул по валентности, определение валентности по формуле».
Цель: дать понятие валентности, уметь определить валентность и составлять химические формулы по валентности.
Ход урока:
- Повторение пройденного материала, самостоятельная работа- решение 3 типовых задач.
- Объяснение нового материала
Химия-это наука, которая изучает самые различные вещества. Здесь записаны формулы некоторых из них. Давайте их прочитаем вместе.
Запись на доске: Al2O3, FeO, Cr2O3, h3SO4, CuCl2
Возникает вопрос: как составляются эти формулы? Рассматривая закон постоянства состава вещества, мы отмечали, что атомы соединяются в строго определенных количественных соотношениях. Давайте вспомним, как был найден состав воды. В воде химические элементы H и O связаны в массовых отношениях 1:8.
Давайте вспомним, как был найден состав воды. В воде химические элементы H и O связаны в массовых отношениях 1:8.
слайд: 8 мас.ч. кислорода соединяются с 1 мас.ч. водорода
16 мас.ч кислорода соединяются с Х мас.ч. водорода
т.к Ar(н)=1, то следует, что в молекуле h3O один атом кислорода связан с двумя атомами водорода. Поэтому, состав воды можно выразить формулой h3O.
Но можно еще проще составить формулу вещества. Для этого мы должны познакомиться с понятием валентность.
Запись на доске: тема урока: «Валентность, ее определение, составление формул по валентности»
Рассмотрим химические формулы соединения некоторых элементов с водородом.
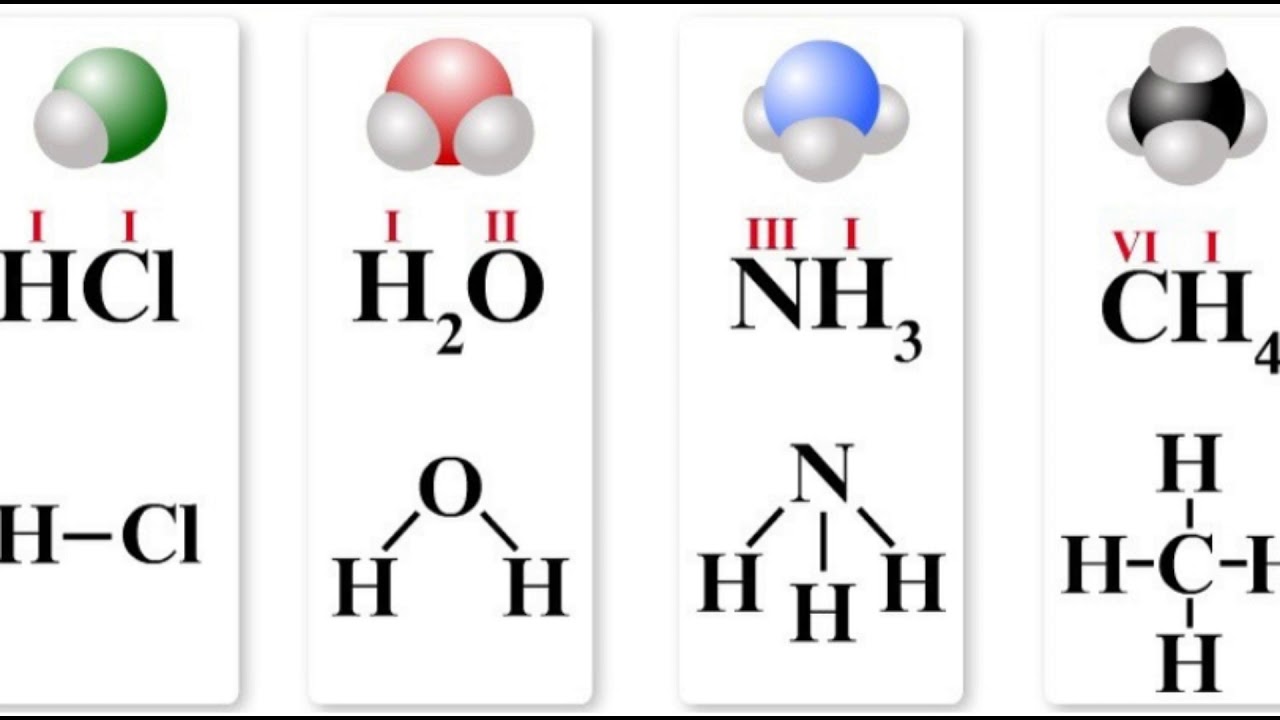
HCl h3O Nh4 Ch5
хлороводород вода аммиак метан
Из данных примеров видно, что атомы элементов хлора, кислорода, азота и углерода обладают свойством присоединять определенное число атомов водорода.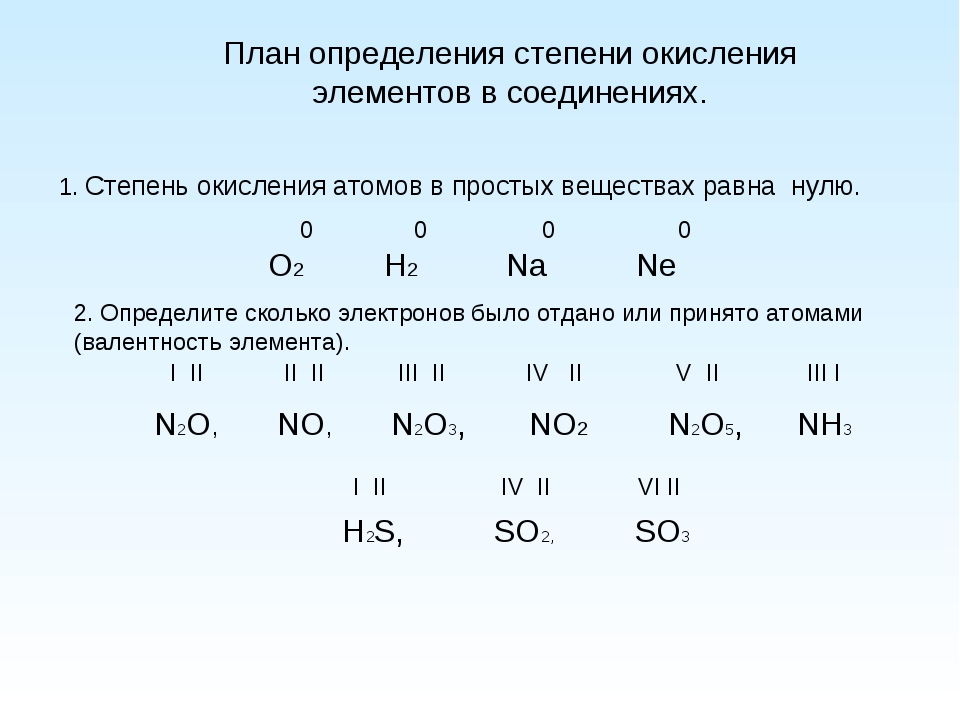 Таким свойством обладают и другие элементы.
Таким свойством обладают и другие элементы.
Запись: Валентность- это свойство атомов химического элемента присоединять определенное число атомов других элементов.
Элементы можно разделить на 2 группы: элементы с постоянной валентностью и элементы с переменной валентностью. Рассмотрим вначале элементы с постоянной валентностью, например, водород.
Водород всегда одновалентен.
Валентность других элементов можно выразить числом, показывающим, сколько атомов водорода может присоединить к себе атом данного элемента. Например, в молекуле HCl атом хлора присоединяет один атом водорода, следовательно, хлор одновалентен.
HIClI, HI2OII, NIIIHI3, CIVHI4
Следовательно, кислород-II, азот-III, углерод-IV
Кислород всегда двухвалентен.
Например, Mg и Ba образуют оксиды BaO и MgO, т.к. кислород двухвалентен и в этих оксидах на один атом элемента приходится по одному атому кислорода, то валентность Mg и Ba в этих соединениях II.
1.Определение валентности элементов по формулам их соединений.
Зная формулы веществ, мы можем определить валентность. Например, CaO- кислород двухвалентен, на один атом кислорода приходится один атом Ca, следовательно, валентность Ca=II.
Число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
- Определение валентности элементов по формуле
Чтобы валентность элемента в данной формуле узнать,
надо рядом с элементов водород пересчитать,
римской цифрою представить и над символом поставить.
Задание №1
Определить валентность элементов в следующих формулах:
Ch5,Nh4,h3O,HF,HCl,h3S,Ph4,Sih5,HBr,Ash4,h3Te,HI,Sbh4.
Если рядом с элементом кислород (двухвалентен он, не то, что водород)
сумму всех его валентностей найди и на индекс элемента раздели.
Задание №2
Определить валентность элементов в следующих формулах:
Cl2O7, Na2O,CuO,Cu2O,P2O5,Mn2O7,MnO2,F2O,MgO,Fe2O3,CrO,K2O.
Действуй также в каждом случае ином, только помни непременно об одном:
чтоб успешно все заданья выполнять, постоянную валентность нужно знать.
Запишем в тетради следующую таблицу по валентности.
Постоянные значения валентности
Значения валентности | Элементы с постоянной валентностью | ||
металлы | всегда | неметаллы (в соединениях с водородом и с металлами) | |
I | Na ,K ,Ag | H,F | Cl ,Br ,I |
II | Mg ,Ba ,Ca ,Hg , Be Cu ,Zn , Sr | O | S |
III | Al (Cr ,Fe) | N,P | |
IV | C,Si | ||
Задание №3
Определить валентность в следующих формулах:
BaCl2, ZnS, NaCl, CaBr2, K2S, Na3N, Mg3P2, HgS, CaS, Mg2C, Na4Si, Mg2Si, Cu3N2, Ca3P2, CuBr2, Ba3P2, Mg3N2, Al2S3, AlCl3.
Задание №4
Задание на внимательность. В каких соединениях валентность определена неправильно:
Всем необходимо знать следующие соединения:
Задание №5
Определить валентность в следующих соединениях:
Na2S, Cr2O3, Cl2O7, AlCl3, Ca3N2, CaCl2, CaO, CaS, So3, Na3P, Ba3N2, Ca2C, Na2Si, Sih5.
- Составление химических формул по валентности.
Чтобы составить химическую формулу, надо знать валентность элементов, образующих данное химическое соединение.
Что для этого надо знать:
- объяснить, как пользоваться таблицей растворимости
- объяснить, как пользоваться таблицей Д.И.Менделеева
Памятка по валентности:
- Водород всегда имеет валентность – I
- Кислород всегда имеет валентность – II
- Фтор всегда имеет валентность –I
- Элементы первой группы главной подгруппы имеют валентность-I
- Элементы второй группы главной подгруппы имеют валентность-II
- Элементы третьей группы главной полгруппы имеют валентность-III
- Элементы четвертой-седьмой групп имеют переменную валентность, но высшая валентность соответствует номеру группы
- Сера с водородом и с металлами проявляет валентность II, с кислородом- валентность IV и VI
- Хлор, бром, йод с водородом и металлами проявляет валентность-I
Задание №6
Составить формулу по валентности:
ClO, KCl, BaS, BaO, BaN, PO, SO, MnIVO, MnIIO, MnVIIO.
Задание №7
Какие формулы соединений составлены неправильно:
Если элементы могут друг с другом образовывать соединения разного состава, то валентность элементов в соединении обозначают в названии римской цифрой в скобках, например:
Cu2O-оксид меди (I) CuO-оксид меди (II)
Задание №8
Работа с карточками (на карточках даны формулы различных веществ)
Зная валентность химических элементов, умея определить её по формулам или составлять формулы по валентности, вы можете выполнять различные задания.
Задание на дом: параграф 11,12, записи в тетради, работа по сборнику упражнение 1-70,1-71-1-74.
Урок по теме: Валентность 8 класс | План-конспект урока по химии (8 класс) на тему:
Открытый урок по теме: «Валентность химических элементов».
Тип урока: комбинированный, изучение нового материала
Цель урока: сформировать понятие валентность и умение определять валентность по химическим формулам и составлять химические формулы по валентности.
Задачи урока
I. Образовательные.
1. Познакомить учащихся с понятием валентность;
2. Сформировать и закрепить умение определять валентность по химическим формулам;
3. Сформировать и закрепить умение составлять формулы, зная валентность химических элементов.
II. Воспитательные.
Показать единство материального мира
III. Развивающие.
Умение записывать химические формулы веществ, зная валентность элементов, входящих в состав данного вещества. Приобретение навыков самостоятельной работы.
Основные понятия: валентность,
Оборудование: таблицы и схемы
Используемая литература:
Учебник «Химия 8 класс» под редакцией Е.Е. Минченкова
Учебник «Химия 8 класс» Н.Е. Кузнецова
План урока:
- Организационный момент (3 мин)
приветствие; отметить отсутствующих.
- Постановка проблемного вопроса (3 мин)
- Актуализация знаний, (беседа 10 мин)
- Объяснение нового материала по теме «Валентность химических элементов» (15 мин)
- Закрепление материала, повторение ключевых моментов.
 Подведение итогов: ответ на проблемный вопрос (5 мин)
Подведение итогов: ответ на проблемный вопрос (5 мин) - Домашнее задание (1 мин)
Сегодня мы с вами повторим материал, который изучали на прошлом уроке «Химическая формула». Относительная молекулярная масса». Потренируемся в вычислении относительной молекулярной массы. А затем перейдем к изучению новой темы.
Итак, первый вопрос: что такое химическая формула? (предполагаемый ответ – химическая формула – это запись, выражающая качественный и количественный состав данного вещества).
А что такое, качественный и количественный состав вещества? (предполагаемый ответ – качественный состав – это какие элементы входят в состав данного вещества, а количественный – в каком соотношении).
Что такое, индекс и коэффициент в химической формуле? (предполагаемый ответ – индекс обозначает число атомов каждого химического элемента, входящего в состав молекулы, пишется справа внизу от символа элемента. Коэффициент – обозначает количество атомов или молекул, пишется перед символом элемента).
Что означает следующая запись:
2Сl, 2Сl2, 3Сl2, 5НСl
Предполагаемый ответ:
2Сl – два атома хлора;
2Сl2 – две молекулы хлора;
3Сl2 – три молекулы хлора;
5НСl – пять молекул хлороводорода.
Следующий вопрос: Что такое относительная молекулярная масса, как она обозначается и как рассчитывается?
Предполагаемый ответ – относительная молекулярная масса – показывает во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода; обозначается Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в состав молекулы вещества, с учетом индексов.
Давайте рассчитаем Мr молекулы следующего вещества:
Мr(Al2(SO4)3) = Ar(Al)2 + Ar(S)3 + Ar(O)12 = 54 + 96 + 192 = 342
Значит относительная молекулярная масса Al2(SO4)3 равна 342.
Итак, а теперь переходим к изучению новой темы. В конце урока мы напишем небольшую самостоятельную работу по новой теме, поэтому слушайте внимательно и переписывайте записи с доски. Запишите тему урока: «Валентность химических элементов».
Запишите тему урока: «Валентность химических элементов».
Только что мы с вами вспомнили, что такое химическая формула. Каждое вещество имеет свою химическую формулу, которая выражает его качественный и количественный состав, т.е. какие элементы и в каком количестве входят в состав одной молекулы данного вещества.
А как же узнают состав каждого вещества. С помощью сложных экспериментов. Однако, зная валентность можно составить формулу любого вещества. Итак, запишем, что же такое валентность:
Валентность – это способность атомов удерживать при себе определенное число атомов других элементов.
Валентность атома водорода принята за единицу.
I I I I
НСl h3O Nh4 Ch5
Cледовательно, атом водорода не может присоединять больше одного атома другого элемента, но другие элементы могут присоединять один (НСl), два (h3O), три (Nh4), четыре (Ch5) и более атомов водорода (показать шаростержневые модели этих молекул).
Валентность обозначается римской цифрой, которая ставится над знаком химического элемента в формуле вещества.
А кислород? Атом кислорода всегда двухвалентен.
II II II
h3O SO3 CO2
Атомы одних химических элементов имеют постоянную валентность, а других переменную (т.е. в разных соединениях один и тот же элемент может проявлять разную валентность):
VI IV II
SO3 SO2 h3S
В учебнике на странице 25 в таблице приведены валентности химических элементов в соединениях. Жирным шрифтом обозначены те элементы, которые имеют постоянную валентность (Na, К, Н, О и др.).
Зная формулы веществ, состоящих из двух элементов, и валентность одного из них, можно определить валентность другого элемента. Например, СuO – оксид меди (II). Мы знаем, что валентность кислорода равна двум. Если на один атом кислорода приходится один атом меди, значит, валентность меди тоже равна двум.
Если на один атом кислорода приходится один атом меди, значит, валентность меди тоже равна двум.
Запишем правила определения валентности по формулам их соединений.
Правила определения валентности элементов в соединениях:
1. Записать химическую формулу вещества и указать валентность известного элемента.
Например, оксид углерода (IV) имеет формулу – СО2, валентность кислорода постоянна и равна двум, записываем над символом кислорода II
II
СО2
2. Найти наименьшее общее кратное (НОК) между известным значением валентности и индексом этого элемента.
Для этого умножаем валентность известного элемента на индекс при этом элементе:
2 × II = 4 – это и есть НОК
3. Наименьшее общее кратное разделить на индекс другого элемента, полученное число и есть значение валентности.
Индекс при атоме углерода равен 1, значит:
4 : 1 = IV – это и есть валентность атома углерода
IV II
СО2
Разберем еще один пример:
II
Fe2O3
1. Валентность кислорода постоянна и равна II.
Валентность кислорода постоянна и равна II.
2. НОК: 3 × II = 6
3. 6 : 2 = III – это и есть валентность атома железа
III II
Fe2O3
Определим валентность химических элементов в следующих соединениях:
СаО ZnCl2
N2O3 Li2S
Nh4 Mg3P2
Валентность атомов кислорода вы уже знаете, а валентность других элементов, имеющих постоянную валентность, находим по таблице.
Вы уже умеете определять валентность химических элементов в соединениях, формулы которых известны. А теперь рассмотрим как, зная валентность составить химические формулы.
Для составления химической формулы, нужно знать валентность элементов в данном соединении. Валентности некоторых элементов представлены в таблице учебника.
Правила составления химических формул по валентности:
1. Записать химические знаки элементов, входящих в состав соединения, и указать их валентности.
Записать химические знаки элементов, входящих в состав соединения, и указать их валентности.
Например, составим формулу оксида алюминия – соединения алюминия с кислородом. Запишем знаки химических элементов:
Аl..O..
Валентность кислорода равна двум, валентность алюминия постоянна, находим значение валентности по таблице учебника, она равна трем. Записываем валентности:
III II
Аl..O..
2. Определить НОК чисел, обозначающих валентность обоих элементов.
НОК – наименьшее из целых положительных чисел, делящееся без остатка на каждое из данных целых чисел.
НОК II и III – 6
3. Разделить НОК на валентность каждого элемента, полученные числа обозначают индексы соответствующих элементов.
6 : II = 3, т.е. индекс при атоме кислорода равен 2
6 : III = 2, т.е. индекс при атоме алюминия равен 3.
4. Записать полученные индексы справа внизу у знаков химических элементов.
Записать полученные индексы справа внизу у знаков химических элементов.
III II
Аl2O3
Разберем еще один пример: соединение серы с водородом, при чем валентность серы указана, так как сера имеет переменную валентность.
II
Н..S..
1.Записываем валентность атома водорода:
I II
Н..S..
2. Находим НОК, оно равно двум
3. Находим индексы элементов:
2 : II = 1, т.е. индекс при атоме серы равен 1
2 : I = 2, т.е. индекс при атоме водорода равен 2
4. Записываем формулу с учетом индексов:
I II
Н2S
В названии веществ, имеющих переменную валентность, в скобках пишут валентность данного элемента в этом соединении:
СuO – оксид меди (II)
Cu2O – оксид меди (I)
Расставим индексы в формулах следующих соединений:
II III
К. .S.. Мg..N..
.S.. Мg..N..
IV I
Мg..Si.. С..Сl..
II I I
Fe..Сl.. Са..F..
Итак, сегодня на уроке мы узнали, что такое валентность, как определить валентность элементов, формула которого известна, и наоборот, зная валентность составить химическую формулу. Сейчас мы проверим, как вы усвоили данную тему, для этого напишем самостоятельную работу.
На работу вам остается 10 минут.
Домашнее задание §4, 5 задания №№ 3, 4 стр. 28; задачник: 1-99, 1-100
I вариант
1. Определите валентность химических элементов в следующих соединениях:
СО, ZnS, SiН4
2. Расставьте индексы в химических формулах следующих соединений:
а) K..O..
I
б) Аl..I..
V I
в) Р..Cl..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) железа (II)
б) азота (IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) бария
б) железа (III)
II вариант
1. Определите валентность химических элементов в следующих соединениях:
HBr, Ca3P2, MgCl2
2. Расставьте индексы в химических формулах следующих соединений:
VI
а) S..O..
III I
б) Fe..Cl..
I II
в) Cu..S..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) калия
б) кремния(IV)
4. Составьте химические формулы соединений с хлором (I) следующих элементов (символ хлора в данных формулах ставится на второе место):
а) алюминия
б) кальция
III вариант
1. Определите валентность химических элементов в следующих соединениях:
NO, Na2S, СaCl2
2. Расставьте индексы в химических формулах следующих соединений:
I II
а) Ag. .S..
.S..
II
б) Аl..S..
IV
в) Si..H..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) хлора (VII)
б) бария
4. Составьте химические формулы соединений с серой (II) следующих элементов (символ серы в данных формулах ставится на второе место):
а) железа (III)
б) меди (II)
IV вариант
1. Определите валентность химических элементов в следующих соединениях:
NaI, SiCl4, MgS
2. Расставьте индексы в химических формулах следующих соединений:
I
а) N..O..
I
б) Ba..Cl..
IV
в) Si..O..
3. Составьте химические формулы соединений с кислородом следующих элементов (символ кислорода в формулах ставится на второе место):
а) cеры(VI)
б) углерода(II)
4. Составьте химические формулы соединений с бромом (I) следующих элементов (символ брома в данных формулах ставится на второе место):
а) cеребра (I)
б) алюминия
Конспект урока Химические формулы.
Число _______________ Химические формулы веществ. Валентность.
Цель: дать понятие о химической формуле как способе выражения количественного и качественного состава веществ. Ввести понятие о валентности как о мере способности атомов соединяться с другими атомами; валентности переменной и постоянной. Формировать первоначальные умения составлять формулы по валентности и определять валентность по формуле.
План урока: 1. Организационный момент
2. Решение и обсуждение заданий по данной теме
Оборудование: доска, учебник «Химия 7 класс», В.Н. Хвалюк, В.И. Резяпкин, «Сборник задач по химии 7 класс».
Ход урока:
Химическая формула – условная запись состава вещества с помощью химически знаков и символов.
Индекс – число атомов данного химического элемента в формуле.
ФормулаН2 – индекс.
Валентность – численная характеристика способности атомов данного элемента соединяться с другими атомами.
Валентность | Элементы |
I | H, Li, Na, K, F, Cl, Br, I, N, Cu |
II | O, Mg, Ca, Ba, Zn, S, N, Fe, Cu, C, |
III | Al, B, N, P, Fe, Cl, Br, I |
IV | S, N, C, Si, |
V | N, P, |
VI | S |
VII | Cl, Br, I |
Составление химической формулы по валентности.
Записать рядом символы элементов
Сверху расставить их валентности
Найти наименьшее общее кратное валентности обоих элементов.
Разделить НОК на валентность каждого элемента. (Получим индексы)
Записать индексы возле химических элементов
Задание 188.
В каких соединениях железо проявляет валентность равную III, а в каких — II:FeO,FeCl3,Fe2O3,FeCl2,FeS.
Ответ:
II: FeO, FeCl2, FeS.
III: FeCl3, Fe2O3
Задание 189.
Определите валентность меди в следующих соединениях: CuO, CuS,Cu2O,CuCl,CuCl2.
Ответ:
I: Cu2O, CuCl
II: CuO, CuS, CuCl2.
Задание
Составьте формулы соединений с водородом следующих элементов:
1) кислорода
2) кальция
3) бора
4) калия
Ответ:H2O,CaH2,BH3,KH
Задание
Составьте формулы соединений с кислородом следующих элементов:
Алюминия (Al2O3)
Калия (K2O)
Цинка (ZnO)
Магния (MgO)
Кальция (CaO)
Натрия (Na2O)
Задание
Составьте формулы соединений с кислородом следующих элементов:
Углерода (IV): Ответ: CO2
Хлора (VII): ответ: Cl2O7
Фосфора (III): Ответ: P2O3
Азота(II): ответ: NO
Углерода (II): ответ: CO
Хлора (I): ответ: Cl2O
Фосфора(V): Ответ: P2O5
Азота(IV): ответ: NO2
Адрес публикации: https://www. prodlenka.org/metodicheskie-razrabotki/200328-konspekt-uroka-himicheskie-formuly-valentnost
prodlenka.org/metodicheskie-razrabotki/200328-konspekt-uroka-himicheskie-formuly-valentnost
Урок 2. валентность и валентные возможности атомов — Химия — 11 класс
Химия, 11 класс
Урок № 2. Валентность и валентные возможности атомов
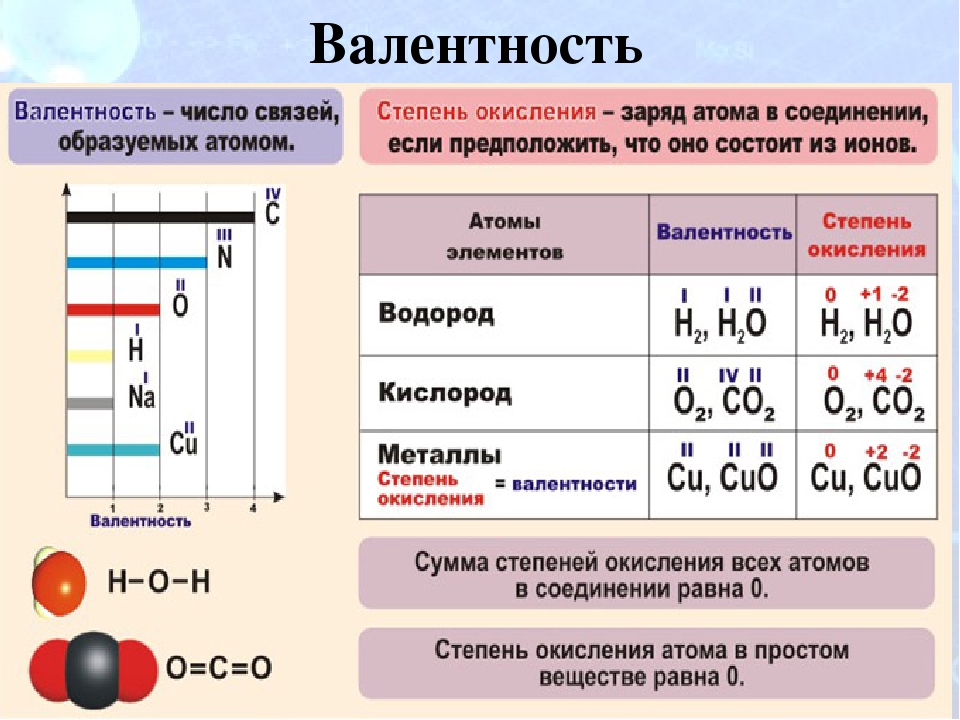
Перечень вопросов, рассматриваемых в теме: всё в нашем мире состоит из атомов. Каждый атом — это очень упорядоченная система, имеющая определенную электронную конфигурацию, свои значения валентностей и степеней окисления. Валентность определяется числом химических связей, которые образует атом химического элемента в соединении. Степень окисления, в отличие от валентности, может быть нулевой и характеризуется знаком. Валентные возможности зависят от количества неспаренных электронов, неподелённых электронных пар и вакантных орбиталей внешнего электронного уровня. Благодаря такому понятию как «электроотрицательность» можно определять тип химической связи в соединениях, которая может быть ионной, а также ковалентной полярной и неполярной.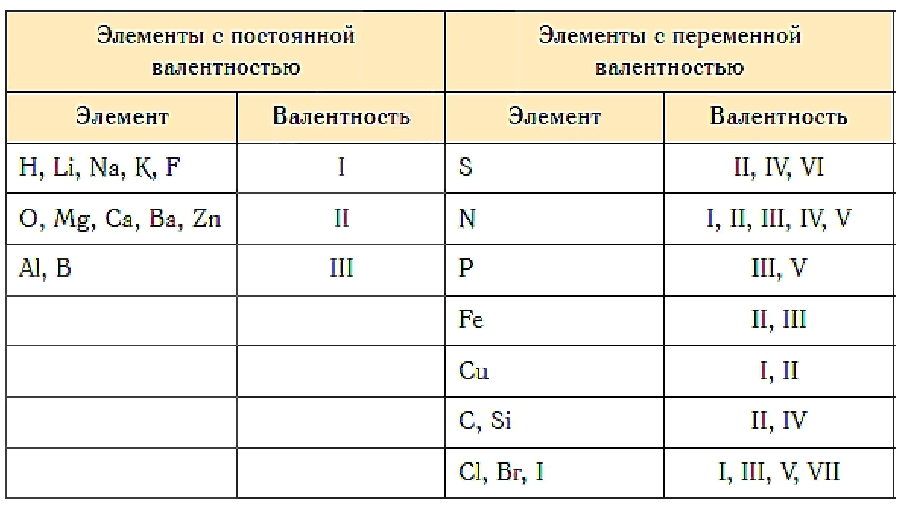
Ключевые слова: валентность; валентные возможности; электроотрицательность; степень окисления; графическая электронная формула; периодическая таблица.
Глоссарий
Валентность – это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
Ковалентная связь — химическая связь, в которой у двух атомов имеется общая пара электронов.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Периодический закон: Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Степень окисления – это условный заряд атома химического элемента в соединении, рассчитанный исходя из предположения, что все связи в его молекуле ионные, то есть все связывающие электронные пары смещены к атомам с большей электроотрицательностью.
Электрон — стабильная отрицательно заряженная элементарная частица.
Электронно-графическая формула для отдельных атомов химических элементов – это расположение всех его электронов на орбиталях.
Электроотрицательность – это суммарная характеристика способности атома данного элемента отдавать или присоединять электроны атомов других элементов.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс].
 М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
Теоретический материал для самостоятельного изучения
Формулировка периодического закона: «свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Четыре основные периодические закономерности:
- Правило октета: все элементы стремятся потерять, либо приобрести электрон, для того, чтобы иметь конфигурацию ближайшего по периодической таблице благородного газа, то есть восьмиэлектронную конфигурацию. Благородные газы являются самыми стабильными элементами, в следствие заполненности их внешних s- и p-орбиталей.
- Энергия ионизации – количество энергии, которое необходимо затратить для отрыва электрона атома. Элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. По правилу октета чем правее элемент расположен в таблице Менделеева, тем больше нужно затратить энергии на отрыв его электрона, это же справедливо и для энергии ионизации: она увеличивается слева направо.
 Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования.
Энергия ионизации уменьшается в группе при движении вниз, потому что на низких энергетических уровнях электроны способны отталкивать электроны высоких энергетических уровней. Это явление названо эффектом экранирования. - Сродство к электрону – если вещество находится в газообразном состоянии, то при приобретении его атомом дополнительного электрона, его энергия изменяется. При движении по группе вниз сродство к электрону становится менее отрицательным.
- Электроотрицательность — мера того, как сильно атом притягивает к себе электроны другого атома, который связан с ним. Электроотрицательность увеличивается при движении в таблице снизу вверх и слева направо. Благородные газы не имеют электроотрицательности.
Водородная связь – специфическая химическая связь между электроотрицательным атомом (например, кислородом, азотом или фтором) и атомом водорода. Данный вид связи может быть как межмолекулярным, так и внутримолекулярным. Возникновение водородной связи связано с тем, что у атома водорода очень маленький радиус. Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Благодаря этому при смещении или отдаче единственного электрона водород приобретает положительный заряд, который в свою очередь, действует на те атомы в молекуле, которые обладают высокой электроотрицательностью.
Особенностью данного вида связи является ее высокая прочность, а также широкая распространённость, главным образом в органических соединениях, например в спиртах, фенолах, альдегидах и карбоновых кислотах. Именно за счет нее образуется вторичная структура белков. В качестве неорганических веществ, молекулы которых образуют водородную связь, можно отметить следующие: вода, фтороводород, синильная кислота. В настоящее время водородную связь рассматривают как частный случай ковалентной.
Металлическая связь — связь между положительными ионами металлов в металлической решетке, осуществляемая за счет притяжения электронов, которые расположены относительно свободно в кристалле металла. Атомы металлов имеют небольшое число валентных электронов, что объясняется их положением в таблице Менделеева.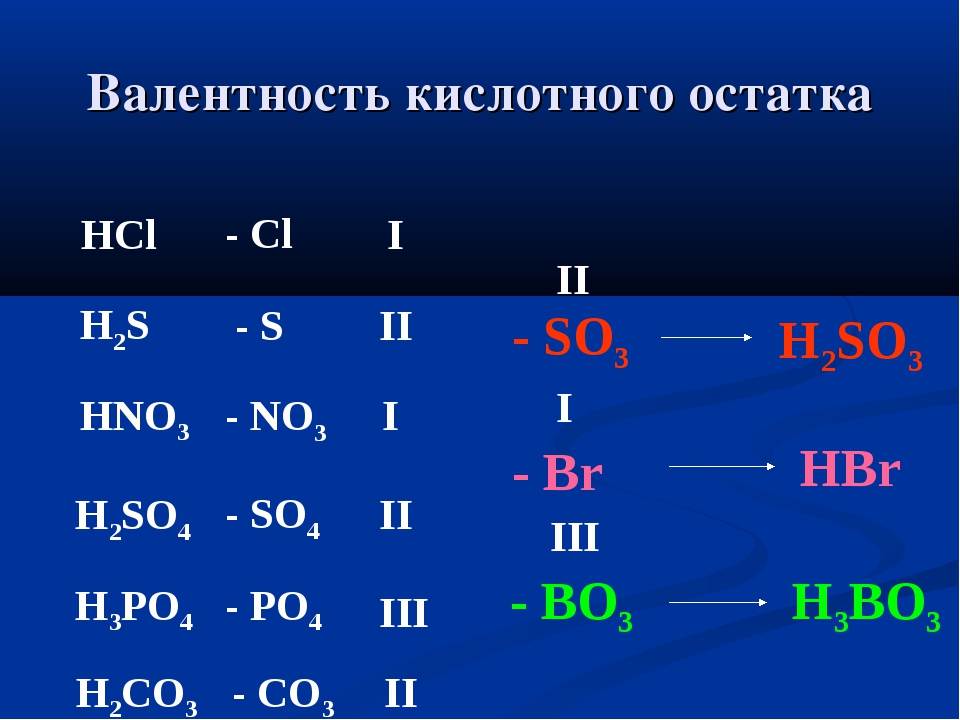 Из-за слабой связи электронов с ядрами, они могут легко отрываться от них. В результате в кристаллической решетке металла появляются свободные электроны и положительно заряженные ионы, поэтому электроны обладают большой свободой перемещения внутри кристалла металла. Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Из-за слабой связи электронов с ядрами, они могут легко отрываться от них. В результате в кристаллической решетке металла появляются свободные электроны и положительно заряженные ионы, поэтому электроны обладают большой свободой перемещения внутри кристалла металла. Энергия металлической связи в 3-4 раза меньше, чем энергия ковалентной связи. Данным видом связи обладают все твердые вещества, кроме ртути, например: натрий, железо, медь и различные сплавы.
Ван-дер-Ваальсова связь — силы межмолекулярного и межатомного взаимодействий, энергия которых составляет 10—20 кДж/моль. Такие связи названы в честь голландского физика Яна Дидерика Ван-дер-Ваальса. Экспериментально было определено, что молекулы, в которых внешние оболочки всех атомов заполнены (молекулы азота N2, хлора Cl2, аммиака NH3 , атомы инертных газов — He, Ne и т.д) также связываются друг с другом и образуют слабые межмолекулярные связи. Вандерваальсово взаимодействие состоит из трёх слабых электромагнитных взаимодействий:
- Ориентационные силы, диполь-дипольное притяжение – связь между молекулами, которые являются постоянными диполями.

- Дисперсионное притяжение, обусловлено взаимодействием между мгновенным и наведённым диполем.
- Индукционное притяжение (поляризационное притяжение). Взаимодействие между постоянным диполем и наведённым (индуцированным).
В основе данного типа связи также лежат кулоновские силы, которые заключаются во взаимодействии между электронами и ядрами двух молекул: на определенном расстоянии между молекулами силы отталкивания/притяжения уравновешивают друг друга, в результате чего образуется устойчивая система.
Возбужденное состояние атома — энергетически нестабильное состояние, в которое атом переходит при получении энергии. Возбужденные состояния атомов образуются при переходе электронов (одного или нескольких) с занятых орбиталей на свободные. Меньше энергии затрачивается при переходе электрона между внешними оболочками, а больше – при переходе с внутренней оболочки на внешнюю.
Возбужденным атом пребывает недолго: при отдаче полученной энергии атом возвращается в основное состояние.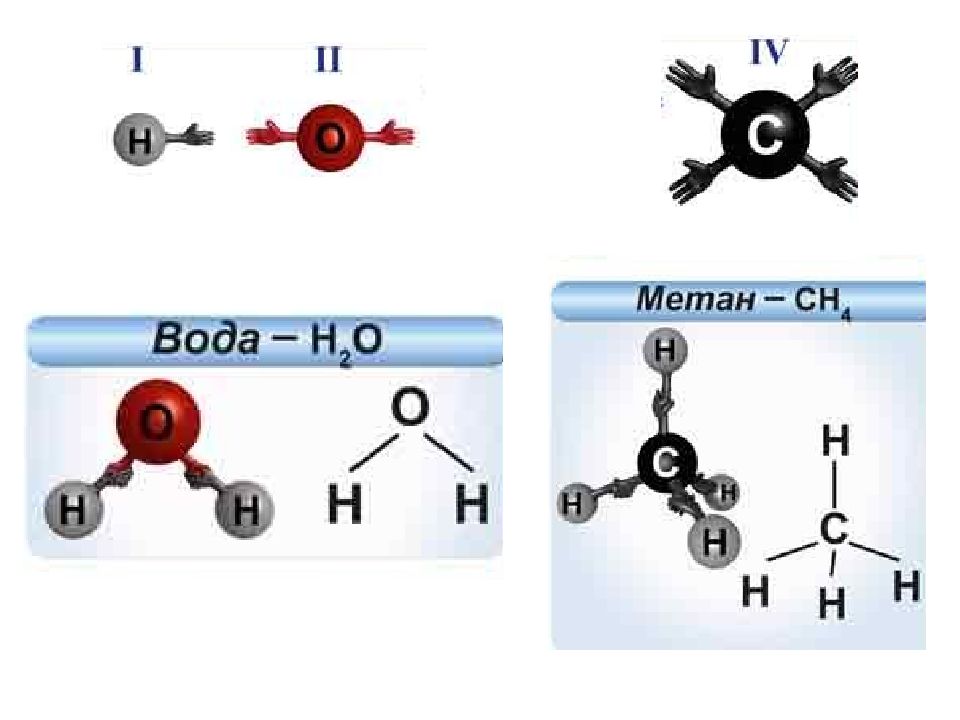 Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Переходы между различными состояниями атомов и молекул могут происходить с испусканием электромагнитного излучения, либо с обменом энергией между молекулами и атомами. Вероятности переходов атомов между возбужденным/основным состоянием и расчет энергии при этом изучает спектроскопия.
Эффективный заряд атома, характеризуется разностью между числом электронов свободного атома и числом электронов принадлежащих данному атому в химическом соединении. Для оценки эффективного заряда атома применяют модель, где величины представляют как функции точечных неполяризуемых зарядов, которые локализованы на атомах. У двухатомной молекулы рассматривают дипольный момент как произведение эффективного заряда атома на межатомное расстояние.
Диполь — совокупность двух равных по величине разноименных точечных зарядов q, расположенных на некотором расстоянии друг от друга, которое мало по сравнению с расстоянием до рассматриваемой точки поля.
Постоянный диполь – совокупность периодически быстро меняющихся по направлению и величине мгновенных микродиполей.
Наведенный диполь – диполь, который возникает под действием внешнего электрического поля.
Примеры и разбор решения задач тренировочного модуля
- Пример задачи. Определите валентность S в соединении H2SO4; определите валентность N в соединении HNO2; определите валентность F в соединении C2H2F2.
Решение. Валентность кислорода всегда равна 2. Валентность водорода равна 1. Для нахождения валентности серы, необходимо валентность кислорода умножить на ее индекс: 2*4=8, затем валентность водорода умножить на его индекс: 1*2 = 2. Теперь нужно вычесть полученные значения: 8-2 = 6 и разделить его на индекс серы: 6/1 = 6. Валентность серы в соединении 6.
Аналогично в варианте: валентность N в соединении HNO2 : (2*2-1*1)/1=3.
Валентность F в C2H2F2: валентность фтора всегда = 1, поэтому ответ 1.
- Пример задачи. Используя шкалу ЭО, соотнесите соединение и тип его химической связи.
Соединения: BeF2, O2, PCl5.
Типы химической связи: ионная, ковалентная неполярная, ковалентная полярная.
Решение. С помощью шкалы электроотрицательности найдем разность значений (∆х) для элементов:
BeF2 : 4,0 – 1,5 = 2,5
O2 : 3,5 – 3,5 = 0
PCl5 : 3,0 – 2,1 = 0,9
По правилам если ∆х < 2,0, то связь ковалентная полярная, если ∆х > 2,0, то связь ионная, если
∆х = 0, то связь ковалентная неполярная, таким образом, верный ответ:
BeF2 – ионная связь, O2 – ковалентная неполярная связь, PCl5 – ковалентная полярная связь.
Разработка урока по теме: Составление химических формул по валентности.
Бешенцева О.А., Кулик А.П.
ХАРЬКОВСКИЙ НАЦИОНАЛЬНЫЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ УНИВЕРСИТЕТ Бешенцева О.А., Кулик А.П. Методические рекомендации к занятиям по химии для иностранных студентов подготовительных факультетов АТОМЫ. МОЛЕКУЛЫ
ПодробнееОсновные понятия химии. Общая химия
Основные понятия химии Общая химия Цель: Повторим строение атомов и построение планетарных моделей атомов. Научимся определять валентность элементов и степени окисления атомов. Выучим термины: атом, аллотропия,
ПодробнееА. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ…
Оксиды А. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ… Определение валентности… Определение типа оксида… Взаимодействие оксидов… 3 Б. КОНТРОЛЬНЫЕ ЗАДАНИЯ… 5 ЧАСТЬ A… 5 ЧАСТЬ B… 6 ЧАСТЬ C… 11 ЧАСТЬ D… 1
ПодробнееВХОДНЫЕ ТЕСТЫ ПО ХИМИИ
Вариант 1 1. Укажите символ элемента Водород (поставьте знак ): О Н N 2. Вещество это (поставьте знак ): железо стакан стекло 3. Заполните таблицу, используйте такие слова: вода, кислород, соль, железо.
ПодробнееОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ ВЕЩЕСТВА. СВОЙСТВА ВЕЩЕСТВ Агрегатные состояния вещества Состояние Характеристика Пример Газообразное Жидкое Твердое (кристаллическое или аморфное) Расстояние между частицами
ПодробнееИнструкция по выполнению работы
Тренировочная работа 1 по ХИМИИ Химия. 11 класс. Вариант 1 m00090 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс Фамилия. Имя. Отчество 24 октября 2012 года 11 класс Вариант
ПодробнееУЧИСЬ САМОСТОЯТЕЛЬНОСТИ
1 Ю.И. Юнг, В.Ю. Юнг УЧИСЬ САМОСТОЯТЕЛЬНОСТИ ХИМИЯ ПОСОБИЕ ПО ХИМИИ ДЛЯ УЧАЩИХСЯ ОСНОВНОЙ ШКОЛЫ (7-8 классы) Часть 1 Ангарск 2 ХИМИЧЕСКИЕ УРАВНЕНИЯ. Необходимо знать: — химические уравнения; Вам необходимо
ПодробнееТехнологическая карта урока
Технологическая карта урока Учитель: Класс Предмет: Авторы учебника: Тарасова Екатерина Антоновна 1Г Математика В.Н. Рудницкая, Т.В.Юдачёва (Начальная школа XXI века) Тема урока. Прибавление числа 5. Тип
ПодробнееУДК :54 ББК 24.1я72 Г12
УДК 373.167.1:54 ББК 24.1я72 Г12 Г12 Габриелян, О. С. Химия. 8 кл. Контрольные работы к учебнику О. С. Габриеляна «Химия. 8 класс» : учебное пособие / О. С. Габриелян, В. Г. Краснова. 2-е изд., стереотип.
ПодробнееПредмет математика класс 2 г
Предмет математика класс 2 г Тема урока Место урока по теме (в разделе/главе) Закрепление изученного по теме «Умножение и деление» «Умножение и деление» 18 из 20 Тип урока Форма урока, форма учебной деятельности,
ПодробнееТема урока: «Длина окружности».
Муниципальное общеобразовательное учреждение «Заречная средняя общеобразовательная школа» Открытый урок по математике в 6 классе Тема урока: «Длина окружности». Урок подготовила и провела учитель математики
ПодробнееОборудование: проектор, ноутбуки, рабочие листы, тетради, учебники, раздаточный материал
Достаточно часто в школах мы встречаем ситуацию, когда учитель прекрасно объясняет материал, учащиеся его внимательно слушают, но через несколько минут, выходя из кабинета, забывают, о чем шла речь на
ПодробнееТехнологическая карта урока
Тема урока: Признаки химических явлений Предмет: природоведение Класс: 5А Технологическая карта урока УМК: 1. Учебник «Природоведение» 5 класс, авторы Т.С. Сухова и В.И.Строганов, Москва Издательство «Вентана-Граф»
ПодробнееТехнологическая карта урока
Мухтарова Лютфия Тухтамурадовна учитель начальных классов Муниципальное бюджетное образовательное учреждение средняя общеобразовательная школа 69 с углубленным изучением отдельных предметов Республика
ПодробнееУрок математики в 1Б классе по программе «Школа России» по теме: «Задачи в два действия». Первый урок в теме, когда дети переходят от решения задач-цепочек к решению задач в два действия. Цели деятельности
ПодробнееТехнологическая карта урока
Технологическая карта урока Приложение 2. Тема: Конкретный смысл действия умножения. Тип урока: урок первичного предъявления знаний Цель: создать условия для организации совместной деятельности учащихся
ПодробнееИнструкция по выполнению работы
Диагностическая работа 1 по ХИМИИ Химия. 11 класс. Вариант 1 2 Инструкция по выполнению работы Район. Город (населенный пункт). Школа. Класс. Фамилия Имя Отчество 6 декабря 2012 года 11 класс Вариант 1
ПодробнееЦели. Планируемый результат
Тема Цели Предмет: математика Класс: 2-а класс Тип урока: Изучение нового материала. Учитель: Турайханова Г.Ф. Технологическая карта изучения темы Прямой угол. Острые и тупые углы. Угольник. Образовательные:
ПодробнееХод учебного занятия.
Конспект урока по математике. Класс: 4 А класс. Тема учебного занятия: Задачи на движение Продолжительность учебного занятия: 40 мин Тип учебного занятия: урок закрепления и развития знаний, умений и навыков.
ПодробнееСТРАНЕ ЧУДЕСНОЙ ХИМИИ» С. П.
Разработка интерактивного факультативного занятия в рамках программы факультативных занятий по химии для учащихся VII класса «В СТРАНЕ ЧУДЕСНОЙ ХИМИИ» С. П. Швайбович, учитель химии СШ 32 г. Могилева Родословная
ПодробнееКонспект урока по Химии «Валентность и степень окисления атомов» 10 класс
Тема урока: «Валентность и степень окисления атомов»
Цель урока: Определить понятие валентности и степени окисления атомов.
Задачи:
обучающие: Научить учащихся работать с основным понятийным аппаратом, схемами, карточками, решать расчетные задачи.
развивающие: Способствовать развитию речи, овладеть основными способами мыслительной деятельности, умением работать в команде, развить познавательный интерес к предмету, формированию самостоятельной деятельности учащихся.
воспитательные: Воспитать нравственные и эстетические качества учащихся, правильное отношение к мнению одноклассников.
Основные понятия. Валентность, степень окисления атомов.
План урока:
Организационный момент.
Подготовка к объяснению нового материала.
Изложение нового материала.
Закрепление темы.
Домашнее задание.
Ход урока:
1. Здравствуйте, ребята! Кто сегодня на уроке отсутствует?
2. Тема нашего урока для вас уже знакома. В курсе химии 8 класса мы уже говорили о валентности и о степенях окисления. Сегодня мы будем вспоминать то, что знаем и узнавать то, что раньше не изучали.
3. Итак, что же такое валентность?
Валентность – одно из основных понятий химии, которое было введено в науку в середине 19в.
Валентность – это свойство атомов химического элемента присоединять определенное число атомов других химических элементов, или валентность – это способность атомов образовывать соединения.
Это определение ввел английский химик Э. Франкленд в 1852 г. как понятие о соединительной силе. Оно использовалось Д.И.Менделеевым как одно из главных свойств атома при установлении периодического закона. Валентность характеризует способность атомов элементов соединяться с другими атомами.
За единицу валентности принята валентность атома водорода. Атом водорода не присоединяет больше одного атома другого элемента. Это видно из химических формул следующих соединений HCl, HBr, H2S, PH3, CH4. Можно графически представить эти формулы так:
H
|
H–Cl, H–Br, H–S–Н, H–Р–Н, Н–C–H.
| |
Н H
Черточки в формулах условно обозначают связи между атомами. Сколько связей может образовать атом, такова его валентность.
Физический смысл термина валентность стал понятен с развитием учения о строении атомов и химической связи. Атомы элементов могут вести себя по–разному: отдавать или присоединять электроны, образовывать общие электронные пары. Электроны, которые участвуют в образовании химической связи между атомами, называются валентными.
у химических элементов общее число валентных электронов в атоме равно номеру группы ПС, в которой находится элемент.
К валентным относятся, прежде всего, электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня. Значения высших валентностей элементов имеют четкую периодическую зависимость от величины заряда ядра. В связи с этими данными определение валентности изменилось.
Валентность определяется как число химических связей, которыми данный атом соединен с другими атомами.
Для характеристики состояния атомов в соединениях введено понятие степени окисления.
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов.
Степень окисления может иметь отрицательное, положительное и нулевое значения, которые обычно выражаются арабскими буквами со знаками и ставят над символом элемента, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, то есть атомы более электроотрицательных атомов.
Отрицательная, или низшая, степень окисления определяется числом электронов, которые атом может принять для завершения внешнего энергетического уровня до устойчивого состояния(8 электронов). Ее можно вычислить по формуле 8 — №гр. Отрицательные степени окисления имеют элементы – неметаллы.
Положительную степень окисления имеют атомы, которые отдают свои электроны другим атомам. Высшая положительная степень окисления проявляется, когда в образовании связи принимают участие все валентные электроны атома. Численно она равна, номеру группы ПС и является важной количественной характеристикой элемента в его соединениях. Исключение составляют фтор, кислород, гелий, аргон, железо и элементы подгруппы кобальта и никеля, высшая валентность которых ниже, чем номер группы. Металлы в соединениях всегда имеют положительную степень окисления.
Нулевое значение степени окисления может быть у атомов в молекулах простых веществ, например в молекулах кислорода, фтора, водорода, хлора, так как в этом случае электроны в равной мере принадлежат обоим атомам. Степень окисления атомов в простом веществе равно нулю.
Степень окисления может представлять собой и дробное число. Такие значения степеней окисления могут быть использованы для составления ОВР.
Атомы в соединениях могут иметь и промежуточные степени окисления.
Изменения степеней окисления элементов по группам периодической счистемы соответствует периодичности изменения химических свойств элементов с ростом заряда ядра.
Зная степень окисления элемента в соединениях, можно предсказать, окислительные и восстановительные свойства проявит этот элемент и его соединение.
Степень окисления часто не совпадает с валентностью, т.к. во многих соединениях степень окисления атома элемента не совпадает с числом образуемых им связей
По формулам большинства неорганических соединений можно судить о степени окисления, а не о валентности.
4.
Определите степень окисления в следующих соединениях:
5. Домашнее задание: § 2.9, стр. 79 № 6, 7, 8.
План урокаValence Electron | Study.com
Продолжительность
1,5 — 2 часа
Стандарты учебных программ
- CCSS.ELA-LITERACY.RST.9-10.1
Приводите конкретные текстовые свидетельства для поддержки анализа научных и технических текстов, уделяя внимание точным деталям объяснений или описаний.
- CCSS.ELA-LITERACY.RST.9-10.4
Определите значение символов, ключевых терминов и других слов и фраз, относящихся к предметной области, когда они используются в конкретном научном или техническом контексте, относящемся к текстам и темам для 9–10 классов.
CCSS.ELA-LITERACY.RST.9-10.7
Переводить количественную или техническую информацию, выраженную словами в тексте, в визуальную форму (например, таблицу или диаграмму) и переводить информацию, выраженную визуально или математически (например, в уравнении ) словами.
Материалы
- Копии таблицы Менделеева
- Экземпляры теста на урок
- Бумага для принтера
- Карандаши цветные
- Компьютер с проектором
- Ножницы
Инструкции
- Начните урок с того, что скажите своим ученикам, что они собираются больше узнать об электронах в атомах, особенно о валентных электронах, во время просмотра валентных электронов: определение, конфигурация и пример.
- Включите видео для учащихся и периодически приостанавливайте его для обсуждения.
- Поставьте видео на паузу в первый раз в 2:46, затем спросите и обсудите следующее:
- Что такое валентные электроны?
- Сколько электронов может удерживать оболочка 1?
- Какие орбитали существуют в оболочке 1?
- Сколько электронов может удерживать оболочка 2?
- Какие орбитали существуют в оболочке 2?
- Сколько электронов может удерживать оболочка 3?
- Какие орбитали существуют в оболочке 3?
- Продолжайте воспроизведение видео, снова поставив его на паузу в 5:36, чтобы задать вопрос и обсудить следующее:
- Что такое электронная конфигурация?
- Что такое нотация spdf?
- Что говорит вам количество электронов в атоме?
- Продолжайте воспроизведение видео до 8:01, затем приостановите его, чтобы спросить и обсудить:
- Что такое конфигурация благородного газа?
- Что такое благородный газ?
- Как определить, сколько электронов нужно записать в конфигурацию при использовании конфигурации с благородным газом?
- Просмотрите оставшуюся часть видео для своих учеников и ответьте на любые вопросы.
Упражнение по электронной конфигурации
- Разделите учащихся на группы по 3-4
- Объясните своим ученикам, что они собираются создать книги электронной конфигурации.
- Раздайте каждой группе по одному экземпляру таблицы Менделеева, пачке цветных карандашей, ножницам и нескольким листам бумаги для принтера.
- Это правила для книг:
- Разрезать бумагу для принтера пополам
- Креатив крышка про электроны
- Нарисуйте электронные конфигурации для 10 различных элементов, поместив по одной электронной конфигурации на каждой странице
- Напишите количество валентных электронов для каждого химического вещества
- Напишите обозначение химического вещества в формате spdf внизу страницы.
- Напишите конфигурацию благородных газов внизу под обозначением spdf
- Разместите книги на отдельных участках в комнате и попросите группы пройтись по каждой книге.
Оценка
- Предложите учащимся пройти тест на уроке индивидуально.
- Просмотрите ответы на викторину вместе всем классом.
Действия с валентными электронами: простые способы обучения
Активность валентных электронов обычно состоит из рисования электронных точечных диаграмм или обсуждения количества электронов в каждой оболочке атома. Хотя эти концепции важны, вы можете вместо этого включить их в увлекательные занятия.
Схема кнопок
Вместо того, чтобы просто рисовать электронную точечную диаграмму, позвольте учащимся использовать кнопки для их представления. Раздайте учащимся пустую диаграмму, содержащую только ядро и несколько пустых оболочек, и позвольте им приступить к работе. Сначала они могут просто разместить правильное количество кнопок в каждой оболочке для представления определенного элемента. После некоторой практики они могут использовать кнопки разного цвета для обозначения кнопок на s-орбитали, p-орбитали, d-орбитали и f-орбитали.
Электронные музыкальные стулья
Этот простой способ научить валентным электронам настолько практичен, насколько это возможно! Поставьте коробку в центре комнаты и поставьте по два стула по обе стороны от коробки. Коробка будет представлять ядро, а стулья — самую внутреннюю оболочку электронов. Положите лист бумаги или учетную карточку на каждый стул, на одной из которых будет написано «1s1», а на одной — «1s2». Затем попросите учащихся поработать всем классом, чтобы выяснить, сколько стульев должно быть в следующих двух оболочках из электронов, и как следует обозначить каждый стул.
Когда они закончат, попросите учащихся притвориться электронами и «заполнить» количество стульев, необходимое для создания элемента с небольшим количеством электронов, такого как кислород. Дайте им сумку, полную теннисных мячей или других мелких предметов, изображающих протоны, и скажите ученикам, чтобы они поместили в ядро правильное количество протонов для этого элемента. Затем попросите их повторить процесс с элементом, который содержит больше электронов, например, с железом.
Периодическая таблица Shout Out
С периодической таблицей можно сделать очень многое — если бы только вы могли заставить своих учеников обратить на нее внимание.Но ты можешь! Просто нарисуйте Периодическую таблицу в натуральную величину тротуарным мелом на большой мощеной площадке. Пусть каждый ученик выберет квадрат Периодической таблицы, на котором он будет стоять (если возможно, сначала заполнив те, у которых меньше электронов). Затем задайте им вопросы о количестве электронов, которые у них есть, и позвольте подходящим ученикам называть свои ответы. Например, вы можете сказать: «У кого на внешней оболочке ровно один электрон?» и обсудите, какие студенты ответили и почему, или «Благородные газы — сколько электронов вам нужно, чтобы заполнить вашу внешнюю оболочку?» Этот простой способ рассказать о валентных электронах поможет студентам связать понятие электронов с периодической таблицей.
Как и другие занятия по химии, эта активность валентных электронов — идеальный способ сделать абстрактную концепцию более интересной, особенно для кинестетических учеников. Фактически, вы можете обнаружить, что ваши самые увлеченные участники — это те, кто не терпит типичных электронных диаграмм.
Список литературы
Эта публикация из серии: Уроки и упражнения по химии
Вы преподаете класс о валентных электронах? Химические связи? Таблица Менделеева? Эти уроки химии оживят ваш класс по химии.
- Простой способ рассказать о валентных электронах: упражнения для кинестетиков
- Веселые игры для уроков химии
Урок девятого класса по определению валентных электронов
Я прошу учеников держать свои периодические таблицы под рукой и открывать чистую страницу в своих тетрадях, чтобы делать заметки. Пока студенты готовятся, я включаю проектор и загружаю PowerPoint с электронами валентности.
Я предпочитаю более простые баллы PowerPoints, чтобы не отвлекать студентов.Когда мы делаем заметки, я предпочитаю, чтобы они были конкретными и по делу, чтобы студенты были сосредоточены. Я не диктую стиль заметок, одни студенты дословно копируют слайды, другие почти ничего не пишут, кроме примеров. Я действительно требую, чтобы все студенты что-то написали и проверили это в моих переплетных чеках. Подробнее о моей философии ведения заметок — см. Отражение заметок.
Мы начнем с того, как вычислить количество валентных электронов с помощью таблицы Менделеева. Студенты спрашивают, почему мы не учитываем группы 3–12, и я объясняю, что переходные металлы имеют некоторые сложности, выходящие за рамки того, что нам нужно понять на данный момент.Если они настаивают на этом вопросе, я объясню, что, поскольку у них есть место для дополнительных 10 электронов на внешнем уровне, они нарушают многие правила, которые мы собираемся изучить, и что я не хочу запутывать своих учеников. первые проходят.
Затем я покажу, как создавать точечные диаграммы Льюиса, поднимая экран и рисуя точки на доске вокруг символов элементов. Как я упоминал во введении, это уже третий раз, когда студенты видят точечные диаграммы и, возможно, помнят, как делали их раньше.
Остальные заметки посвящены персонализации атомов — тому, чего они хотят и как они этого добиваются. Мы вводим правило октетов, но еще не по имени. Студентам сложно понять, как теряющие электроны попадают в полную оболочку. Я использую аналогию с луком с плохим пятном: когда вы снимаете неполный слой с плохим пятном, под ним оказывается совершенно хороший лук. Это поможет студентам в настоящем, и они получат лучшее понимание на нашем уроке по атомам и ионам.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА И ПЛАН УРОКА ПО РЕАКТИВНОСТИ — ПОЛНЫЙ УРОК НАУКИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА 5E ИНСТРУКЦИИ
В конце этой периодической таблицы и плана урока по реактивности учащиеся смогут определить, что валентные электроны определяют химические свойства атома, включая реакционную способность и интерпретировать расположение периодической таблицы, чтобы объяснить, как свойства используются для классификации элементов (включая группы и периоды). Каждый урок разработан с использованием метода обучения 5E для обеспечения максимального понимания учащимися.
Следующий пост проведет вас через каждый из шагов и действий из периодической таблицы и плана урока реактивности.
В начале урока класс проведет Think-Pair-Share, чтобы обсудить цель.
Преподаватель поможет развеять неправильные представления о таблице Менделеева и реакционной способности. Некоторые серьезные заблуждения связаны с тем, что студенты не понимают, что все вещи состоят из комбинаций этих элементов, и студенты не понимают, что валентные электроны — это то, что определяет реактивность элементов.
Расчетное время занятий для помолвки: 20-30 минут
РАЗВЕДКА
Эта лаборатория станции, ориентированная на студентов, создана для того, чтобы студенты могли начать изучать периодическую таблицу и реактивность. Четыре из станций считаются входными станциями, где студенты изучают новую информацию о периодической таблице и реактивности, а четыре из станций являются выходными станциями, где студенты будут демонстрировать свое мастерство входных станций.Каждая из станций отличается, чтобы бросить вызов студентам, использующим разный стиль обучения. Вы можете узнать больше о том, как я организовал лаборатории станции здесь.
УЗНАЙТЕ ЭТО!
Студенты будут работать в парах, чтобы лучше понять, как расположены элементы в периодической таблице. У учащихся будут карточки, которые они разложат, чтобы лучше понять, что значит быть в группе или периоде. Студенты интерпретируют эту идею как способ показать реактивность и то, как элементы обладают одинаковыми свойствами.Студенты, наконец, возьмут эту информацию и применит ее к реальной таблице Менделеева.
ПОСМОТРИТЕ!
На этой станции студенты будут смотреть семиминутный видеоролик, объясняющий устройство таблицы Менделеева. Затем студенты ответят на вопросы, связанные с видео, и запишут свои ответы в листах лабораторных станций. Например: Что означает атомный номер в периодической таблице? Какая часть атома позволяет одному атому реагировать с другим? Что верно для элементов, находящихся в одном столбце (группе / семействе)?
ИССЛЕДУЙТЕ ЭТО!
Исследовательская станция позволит студентам проводить исследования по построению и организации периодической таблицы.Студенты узнают о периодах, группах и фактах об элементах. Затем студентам будет предложено ответить на несколько вопросов, основанных на проведенном ими исследовании.
ПРОЧИТАЙТЕ!
Эта станция предоставит студентам одну страницу для чтения о таблице Менделеева. В ходе чтения студенты узнают, как устроена таблица Менделеева. Студенты будут знать, как называются вертикальные столбцы, а также горизонтальные строки. Учащиеся ответят на 4 дополнительных вопроса, чтобы продемонстрировать понимание предмета при чтении.
ОЦЕНИТЬ!
Станция для оценки — это место, куда студенты отправляются, чтобы доказать свое мастерство в концепциях, которые они изучили в лаборатории. Вопросы составлены в стандартизированном формате с несколькими вариантами ответов. Некоторые вопросы включают: Что не верно в отношении всех этих элементов? Какой элемент имеет 2 валентных электрона и находится в периоде 4? Какие два элемента обладают схожими свойствами? Какой элемент самый реактивный?
НАПИШИТЕ!
Студенты, которые могут ответить на открытые вопросы о лаборатории, действительно понимают изучаемые концепции.На этой станции студенты будут отвечать на три карточки с заданиями: Объяснить, что такое валентный электрон. Чем периоды и группы отличаются друг от друга? Как определить, имеют ли элементы одинаковые химические свойства?
ИЛЛЮСТРИРУЙТЕ ЭТО!
Вашим ученикам-наставникам понравится эта станция. Студенты раскрашивают разделы периодической таблицы. Студенты будут раскрашивать определенные периоды и группы, чтобы показать, что они понимают, как устроена таблица Менделеева. Студенты также пометят определенные группы, периоды и места, где можно найти элементы с одинаковым количеством валентных электронов.
ОРГАНИЗУЙТЕ ЭТО!
Станция «организовать it» позволяет вашим ученикам размещать карточки под другими карточками с названиями двух определенных элементов. Эти карты будут описывать информацию, относящуюся к элементам, которые можно интерпретировать по их расположению в периодической таблице.
Расчетное время занятий для исследования: 1-2, 45-минутные занятия
ПОЯСНЕНИЕ
Действия по объяснению станут намного более интересными для класса после того, как они завершат лабораторию исследовательской станции.Во время объяснения учитель проясняет любые неправильные представления о периодической таблице и реактивности с помощью интерактивной PowerPoint, якорных диаграмм и интерактивных занятий с записной книжкой. Таблица Менделеева и план урока реактивности включает PowerPoint с упражнениями, разбросанными повсюду, чтобы учащиеся были вовлечены. Учащиеся также будут взаимодействовать со своими журналами, используя шаблоны INB для периодической таблицы и реактивности. Каждое занятие INB призвано помочь студентам разделить информацию на части для лучшего понимания концепции.Периодическая таблица и шаблоны INB реактивности позволяют студентам сосредоточить свои заметки на изучении разницы между группами и периодами, а также на заметках о периодической таблице и реактивности. Расчетное время занятий для исследования: 2-3 часа, 45 минут занятий
РАЗРАБОТКА
Раздел, посвященный описанию метода обучения 5E, предназначен для того, чтобы дать учащимся возможность выбрать способ подтверждения владения концепцией. Когда ученикам предоставляется выбор, их «участие» намного больше, чем когда учитель говорит им о проекте, который им предстоит создать.Проект разработки позволит студентам создать презентацию, чтобы рассказать о периодической таблице и реактивности. Расчетное время занятий на проработку: 2–3 урока по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E — оценка понимания учащимися. В каждый урок 5E входит домашнее задание, оценка и модифицированная оценка. Исследования показали, что домашнее задание должно быть значимым и применимым к реальной деятельности, чтобы быть эффективным.Когда это возможно, мне нравится давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Расчетное время занятий на проработку: 1, 45 минут урока
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полную версию урока можно загрузить в моем магазине TpT. Сэкономьте кучу времени и возьмите его сейчас.
Valence Electron — PHYSICS8ATLAUREL
Вы когда-нибудь играли в карточную игру под названием «Go Fish»? Игроки пытаются сформировать группы карт одного достоинства, например четыре семерки, из карт, которые им раздаются, или путем получения карт от других игроков или из колоды.Эти взаимные уступки — простая аналогия того, как атомы отдают и принимают валентные электроны в химических реакциях.
Что такое валентные электроны?
Валентные электроны — это электроны на внешнем энергетическом уровне атома, которые могут участвовать во взаимодействиях с другими атомами. Валентные электроны — это обычно самые дальние от ядра электроны. В результате они могут быть привлечены ядром другого атома в такой же или большей степени, чем их собственное ядро.
Электронные точечные диаграммы
Поскольку валентные электроны очень важны, атомы часто представляются простыми диаграммами, на которых показаны только их валентные электроны. Они называются электронно-точечными диаграммами, и три показаны ниже. На диаграммах этого типа химический символ элемента окружен точками, которые представляют валентные электроны. Обычно точки рисуются так, как если бы символ элемента окружал квадрат с двумя точками на каждой стороне. В элементе никогда не бывает более восьми валентных электронов, поэтому на атом не может быть более восьми точек.
Q: Углерод (C) имеет четыре валентных электрона. Как выглядит электронно-точечная диаграмма этого элемента?
A: Электронная точечная диаграмма углерода выглядит так:
Валентные электроны и периодическая таблица
Число валентных электронов в атоме отражается его положением в периодической таблице элементы (см. периодическую таблицу на рисунке ниже).В каждой строке или периоде периодической таблицы количество валентных электронов в группах 1-2 и 13-18 увеличивается на один от одного элемента к другому. В каждом столбце или группе таблицы все элементы имеют одинаковое количество валентных электронов. Это объясняет, почему все элементы в одной группе имеют очень похожие химические свойства.
Для элементов в группах 1-2 и 13-18 количество валентных электронов легко определить непосредственно из периодической таблицы.Это проиллюстрировано в упрощенной периодической таблице на рисунке ниже. Он показывает только количество валентных электронов в каждой из этих групп. Для элементов 3–12 групп определить количество валентных электронов сложнее. Вы можете узнать больше о валентных электронах элементов в этих группах по этому URL-адресу: http: //www.colorado.edu/physics/2000/periodic_table/transition_elements.html.
Q: На основании обеих периодических таблиц выше (рисунки выше и выше), каковы примеры элементов, у которых есть только один валентный электрон? Каковы примеры элементов с восемью валентными электронами? Сколько валентных электронов у кислорода (O)?
A: Любой элемент в группе 1 имеет только один валентный электрон.Примеры включают водород (H), литий (Li) и натрий (Na). Любой элемент в группе 18 имеет восемь валентных электронов (за исключением гелия, у которого всего два электрона). Примеры включают неон (Ne), аргон (Ar) и криптон (Kr). Кислород, как и все остальные элементы в группе 16, имеет шесть валентных электронов.
Валентные электроны и реакционная способность
Поваренная соль, изображенная на рисунке ниже, содержит два настолько реактивных элемента, которые редко встречаются в природе в одиночку.Вместо этого они вступают в химические реакции с другими элементами и образуют соединения. Поваренная соль — это соединение, называемое хлоридом натрия (NaCl). Он образуется, когда атом натрия (Na) отдает электрон, а атом хлора (Cl) принимает его. Когда это происходит, натрий становится положительно заряженным ионом (Na +), а хлор становится отрицательно заряженным ионом (Cl-). Два иона притягиваются друг к другу и присоединяются к матрице взаимосвязанных ионов натрия и хлорида, образуя кристалл соли.
Поваренная соль (хлорид натрия).
В: Почему натрий отдает электрон?
A: Атом элемента группы 1, такого как натрий, имеет только один валентный электрон. Он «стремится» отказаться от этого электрона, чтобы иметь полный внешний энергетический уровень, потому что это даст ему наиболее стабильное расположение электронов. Вы можете увидеть, как это происходит в анимации по следующему URL-адресу и на рисунке ниже. Элементы группы 2 с двумя валентными электронами почти так же реактивны, как элементы группы 1, по той же причине.
http://www.visionlearning.com/img/app/library/objects/Flash/VLObject-1349-030213040210.swf
В: Почему хлор принимает электрон от натрия?
A: Атом элемента группы 17, такого как хлор, имеет семь валентных электронов. Он «стремится» получить дополнительный электрон, чтобы заполнить свой внешний энергетический уровень и обрести стабильность. Элементы 16-й группы с шестью валентными электронами почти так же реактивны по той же причине.
Атомы элементов группы 18 имеют восемь валентных электронов (или два в случае гелия).Эти элементы уже имеют полный внешний энергетический уровень, поэтому они очень стабильны. В результате они редко, если вообще когда-либо, реагируют с другими элементами. Элементы в других группах различаются по своей реакционной способности, но, как правило, они менее реакционны, чем элементы в группах 1, 2, 16 или 17.
Q: Найдите кальций (Ca) в периодической таблице (см. Рисунок выше). Как вы думаете, насколько реактивным является кальций, исходя из его положения в таблице? Назовите еще один элемент, с которым может реагировать кальций.
A: Кальций — это элемент 2 группы с двумя валентными электронами.Следовательно, он очень реактивен и отдает электроны в химических реакциях. Вероятно, он вступит в реакцию с элементом с шестью валентными электронами, который «хочет» получить два электрона. Это может быть элемент группы 6, такой как кислород.
Валентные электроны и электричество
Валентные электроны также определяют, насколько хорошо — если вообще — атомы элемента проводят электричество. Медные провода в кабеле на рисунке ниже покрыты пластиком. Медь — отличный проводник электричества, поэтому ее используют для проводов, по которым проходит электрический ток.Пластик содержит в основном углерод, который не может проводить электричество, поэтому его используют в качестве изоляции проводов.
Q: Почему медь и углерод различаются по способности проводить электричество?
A: Атомы металлов, таких как медь, легко отдают валентные электроны. Их электроны могут свободно перемещаться и переносить электрический ток. Вы можете подробно увидеть, как это происходит, по указанному ниже URL-адресу. С другой стороны, атомы неметаллов, таких как углерод, удерживают свои электроны.Их электроны не могут свободно перемещаться и переносить ток.
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/conins.html
Некоторые элементы, называемые металлоидами, могут проводить электричество, но не так хорошо, как металлы. Примеры включают кремний и германий в группе 14. Оба становятся лучшими проводниками при более высоких температурах. Эти элементы называются полупроводниками.
В: Сколько валентных электронов имеют атомы кремния и германия? Что происходит с их валентными электронами, когда атомы подвергаются воздействию электрического поля?
A: Атомы этих двух элементов имеют четыре валентных электрона.Когда атомы подвергаются воздействию электрического поля, валентные электроны удаляются от атомов и позволяют току течь.
Резюме
- Валентные электроны — это электроны на внешнем энергетическом уровне атома, которые могут участвовать во взаимодействиях с другими атомами.
- Поскольку валентные электроны так важны, атомы могут быть представлены электронными точечными диаграммами, на которых показаны только их валентные электроны.
- Из-за количества валентных электронов в атомах они могут быть инертными или высокореактивными.Для тех атомов, которые являются реактивными, количество валентных электронов также определяет, склонны ли они отдавать или приобретать электроны в химических реакциях.
- Металлы, которые легко отдают электроны, могут проводить электричество. Неметаллы, которые притягивают электроны, обычно не могут. Металлоиды, такие как кремний и германий, могут проводить электричество, но не так хорошо, как металлы.
Узнать больше
Посмотрите видео по следующему URL-адресу и ответьте на приведенные ниже вопросы.
http://www.youtube.com/watch?v=iuj_hw_MFN8 (9:41)
Оценка ниже
Валентный электрон
Валентный электрон8
29 902Валентность | химия | Britannica
Валентность , также обозначается как валентность , в химии свойство элемента, определяющее количество других атомов, с которыми атом элемента может соединяться.Этот термин, введенный в 1868 году, используется для обозначения как силы комбинации элемента в целом, так и числового значения силы комбинации.
Подробнее по этой теме
химическая связь: валентность
Химики XIX века установили большой объем эмпирической информации, ведущей к осознанию того, что закономерности существуют в …
Далее следует краткое рассмотрение валентности.Для полной обработки, см. химическая связь: теория валентной связи.
Объяснение и систематизация валентности было серьезной проблемой для химиков 19 века. В отсутствие какой-либо удовлетворительной теории его причины большая часть усилий была сосредоточена на разработке эмпирических правил для определения валентностей элементов. Характерные валентности элементов были измерены в терминах числа атомов водорода, с которыми атом элемента может соединяться или которые он может заменять в соединении.Однако стало очевидно, что валентности многих элементов в разных соединениях различаются. Первый большой шаг в разработке удовлетворительного объяснения валентности и химической комбинации был сделан американским химиком Г.Н. Льюис (1916) с идентификацией химической связи органических соединений с парой электронов, удерживаемых совместно двумя атомами и служащей для удержания их вместе. В том же году природу химической связи между электрически заряженными атомами (ионами) обсуждал немецкий физик В.Коссель. После развития подробной электронной теории периодической системы элементов теория валентности была переформулирована в терминах электронных структур и межатомных сил. Эта ситуация привела к введению нескольких новых понятий — ионной валентности, ковалентности, степени окисления, координационного числа, металлической валентности — соответствующих различным режимам взаимодействия атомов.
Понимание элементов — Урок — TeachEngineering
Быстрый просмотр
Уровень оценки: 6 (5-7)
Требуемое время: 15 минут
Зависимость урока: Нет
Тематические области: Химия, Физические науки
Ожидаемые характеристики NGSS:
Резюме
Студенты изучают периодическую таблицу и свойства элементов.Они изучают основное определение элемента и 18 элементов, которые составляют большую часть материи во Вселенной. Периодическая таблица описывается как один из методов организации элементов. Также рассмотрены концепции физических и химических свойств. Эта инженерная программа соответствует научным стандартам нового поколения (NGSS).Инженерное соединение
Инженеры используют свойства материи, чтобы решить, какие материалы использовать при создании и строительстве вещей.Например, металлы обладают определенными свойствами, которые позволяют им сгибаться или не сгибаться, расширяться и сжиматься, а также удерживать определенное количество веса. Инженеры также используют химические свойства различных элементов для разработки смесей и веществ для новых лекарств и продуктов.
Цели обучения
- Различают физические и химические свойства.
- Опишите расположение элементов в периодической таблице элементов.
- Опишите, как инженеры используют знания о физических и химических свойствах элементов при выборе материалов для продуктов.
Образовательные стандарты
Каждый урок или задание TeachEngineering соотносится с одним или несколькими научными предметами K-12, образовательные стандарты в области технологий, инженерии или математики (STEM).
Все 100000+ стандартов K-12 STEM, охватываемых TeachEngineering , собираются, обслуживаются и упаковываются Сетью стандартов достижений (ASN) , проект Д2Л (www.achievementstandards.org).
В ASN стандарты иерархически структурированы: сначала по источникам; например , по штатам; внутри источника по типу; например — естественные науки или математика; внутри типа по подтипу, затем по классу, и т. д. .
NGSS: научные стандарты нового поколения — наука| Ожидаемые характеристики NGSS | ||
|---|---|---|
МС-ПС1-1.Разработайте модели для описания атомного состава простых молекул и расширенных структур. (6-8 классы) Вы согласны с таким раскладом? Спасибо за ваш отзыв! | ||
| Нажмите, чтобы просмотреть другие учебные программы, соответствующие этим ожиданиям от результатов. | ||
| Этот урок посвящен следующим аспектам трехмерного обучения NGSS: | ||
| Наука и инженерная практика | Основные дисциплинарные идеи | Сквозные концепции |
| Разработайте модель для прогнозирования и / или описания явлений. Соглашение о выравнивании: Спасибо за ваш отзыв! | Вещества состоят из атомов разных типов, которые по-разному сочетаются друг с другом. Атомы образуют молекулы размером от двух до тысяч атомов. Соглашение о выравнивании: Спасибо за ваш отзыв! Твердые вещества могут быть образованы из молекул или они могут быть расширенными структурами с повторяющимися субъединицамиСоглашение о выравнивании: Спасибо за ваш отзыв! | Явления времени, пространства и энергии можно наблюдать в различных масштабах, используя модели для изучения слишком больших или слишком маленьких систем. Соглашение о выравнивании: Спасибо за ваш отзыв! |
Какое альтернативное выравнивание вы предлагаете для этого контента?
Больше подобной программы
Строительные блоки материиСтуденты изучают атомы и их структуру (протоны, электроны, нейтроны) — строительные блоки материи.Они видят, как научные открытия об атомах и молекулах влияют на новые технологии, разработанные инженерами.
Атомы GumdropСтуденты используют мармеладки и зубочистки, чтобы делать модели атома лития. Используя эти модели, они исследуют состав атомов, включая их относительный размер.
Разделительные смесиСтуденты узнают, как классифицировать материалы как смеси, элементы или соединения и определять свойства каждого типа. Также вводится концепция разделения смесей, поскольку почти каждый элемент или соединение в природе находится в нечистом состоянии, таком как смесь двух или более веществ, и…
Предварительные знания
Студенты должны знать основные свойства и структуру атома.
Введение / Мотивация
Мы хотим узнать больше о свойствах вещества или объекта, чтобы мы могли определить, какие инструменты и материалы использовать при проектировании и создании вещей в качестве инженеров.Например, мелки и маркеры обладают разными свойствами, но они оба дают цвет. Каковы свойства мелка? (Напишите ответы на доске. Возможные ответы: твердая, сухая, восковая текстура, тает, разные цвета и т. Д.) Хорошо, каковы свойства маркера? (Запишите ответы на доске в новом списке. Возможные ответы: гладкий кончик, сладкий запах, кислый запах, разные цвета, влажный и т. Д.) Мы решаем, будем ли мы раскрашивать картинку мелком или маркером, в зависимости от на конечный результат, который мы хотим.Конечным результатом также является то, как инженеры выбирают, какие материалы они будут использовать для разработки чего-либо.
Свойства вещества можно разделить на две категории: физические и химические. В объекте можно наблюдать физические свойства, такие как размер, форма, цвет и даже температуру кипения. Химические свойства — это способность соединяться с другим веществом и образовывать новое, например, когда вода и железо соединяются, образуя ржавчину. Перечисленные нами свойства — физические или химические? Это физические свойства, потому что они не превращаются во что-то другое.
И физические, и химические свойства основаны на поведении элементов, составляющих объект. Элемент — это нечто, состоящее из атомов того же типа, которые состоят из протонов, электронов и нейтронов. Например, свинец элемента состоит из всех атомов свинца и ничего больше. Хотя существует более 100 элементов, 18 из них составляют большую часть известной вселенной. Некоторые из этих 18 элементов, о которых вы, возможно, уже слышали: водород, гелий, углерод, кислород, азот, натрий, магний, фосфор и сера.Можете ли вы придумать что-нибудь, в котором есть один из этих элементов или их комбинация? Итак, вода и воздух состоят из элементов, которые мы только что перечислили. Фактически, водород составляет 90% всего вещества во Вселенной. Углерод — это элемент, содержащийся во всем живом.
Элементы можно расположить по-разному; однако наиболее распространенным способом является то, что мы называем периодической таблицей элементов. Элементы расположены в периодической таблице в зависимости от их свойств (как физических, так и химических, хотя в основном химических).Периодическая таблица организует элементы на основе двух основных вещей: количество оболочек, которые элемент имеет для своих электронов, определяет строки (периоды), в которых размещается элемент, а количество электронов в самой внешней оболочке элемента определяет столбец ( group), где размещается элемент. Точка или группа, в которую помещен элемент, многое говорят нам о свойствах этого элемента. Сегодня мы узнаем об этом больше.
Инженеры учитывают физические и химические свойства материалов при проектировании практически всего, включая здания и новые лекарства.Инженеры хотят проектировать крепкие здания. Они также хотят, чтобы лекарства были безопасными и эффективными. Например, металлы обладают определенными свойствами, которые позволяют им сгибаться или не сгибаться, расширяться и сжиматься, а также удерживать определенное количество веса. Если бы инженеры проектировали мост через реку, они бы выбрали металл, который был бы прочным и несколько гибким. Тем не менее, они будут следить за тем, чтобы не выбирать металл, который слишком сильно расширяется или сжимается при различных погодных условиях.Это потому, что если мост слишком сильно увеличится или уменьшится в размерах, он может обрушиться, что может привести к травмам людей и повреждению окружающих конструкций.
Предпосылки и концепции урока для учителей
Материя часто определяется физическими свойствами. Физические свойства — это атрибуты, которые можно наблюдать в объекте. Некоторые примеры свойств включают цвет, запах, размер, вес, текстуру, плавучесть, точку кипения, точку плавления, точку замерзания и форму.Материя также определяется химическими свойствами. Это атрибуты, которые влияют на химическое состояние вещества. Например, одним химическим свойством может быть способность соединяться с другим элементом в химической реакции.
Рисунок 1. Первые 18 элементов периодической таблицы.
Элементы
Элемент — это вещество, которое не может быть расщеплено химическими реакциями. Самая маленькая частица элемента — это атом, состоящий из протонов, электронов и нейтронов.Например, чистое золото состоит из атомов золота и ничего больше. Если вы добавите или вычтите протон из ядра атома, вы создадите совершенно новый элемент. Например, если вы вычесть один протон из атома золота, у вас будет платина. Если вы добавляете или вычитаете нейтрон из ядра атома, то новый элемент не создается, вместо этого вы создаете новый изотоп . Углерод-14 является изотопом углерода, имеет два дополнительных нейтрона, радиоактивен и используется для датирования углерода.
Было открыто или создано более 100 элементов, но в этом уроке основное внимание уделяется первым 18 элементам, которые составляют большую часть материи Вселенной. Самые легкие элементы — водород и гелий. Также считается, что водород был первым элементом, появившимся на Земле.
В настоящее время более 20 элементов не получены естественным путем, а были искусственно синтезированы человеком. Элементы можно классифицировать по-разному, включая название, символ, атомный номер, атомную массу, точку кипения и точку плавления; однако наиболее распространенной таблицей элементов является таблица Менделеева, в которой элементы организованы по химическим свойствам.
На рис. 1 перечислены первые 18 элементов периодической таблицы.
Периодическая таблица
Периодическая таблица Менделеева была впервые создана в 1869 году химиком Дмитрием Менделеевым. Это диаграмма известных элементов, организованная в виде большой сетки со строками и столбцами. Элементы размещены в строках, которые называются периодами из-за их схожих характеристик. Все элементы в периоде имеют одинаковое количество оболочек для своих электронов. Элементы в верхнем ряду имеют одну оболочку, во втором ряду — две оболочки и так далее по таблице максимум семь.Учащиеся могут узнать больше о периодической таблице с помощью связанного с ней занятия Инженерия и Периодическая таблица, где они будут также работать в качестве инженеров-аниматоров, чтобы создать персонажа супергероя на основе одного из элементов.
Элементы также помещены в столбцы или групп , которые имеют одинаковое количество электронов на их внешних оболочках. Элементы в первом столбце имеют один электрон на своей внешней оболочке, во втором столбце — два электрона и так далее. Некоторые особые группы существуют в периодической таблице, включая благородные газы в группе 18 (или 8, если не считать переходных элементов), которые имеют полные внешние валентные оболочки.Это означает, что им не нужны электроны для завершения оболочки, и поэтому они очень нереактивны. Кроме того, всем галогенам в группе 17 (или 7) не хватает одного электрона, чтобы заполнить их внешние оболочки. Все эти элементы связываются с водородом с образованием кислот, таких как соляная кислота.
Рис. 2. Периодическая таблица природных элементов. Copyright
Copyright © Департамент внутренних дел США, Геологическая служба США http://pubs.usgs.gov/circ/c1143/html/fig9.jpg
Сопутствующие мероприятия
Закрытие урока
Сегодня мы говорили о физических и химических свойствах элементов и о том, насколько они важны для инженеров.Кто помнит, в чем разница между физическими и химическими свойствами? (Выслушайте ответы студентов.) Что ж, физические свойства — это те, которые можно наблюдать в объектах, такие как размер, форма, цвет и даже температура кипения или плотность. Химические свойства имеют дело с химическим состоянием объектов, например с их способностью соединяться с другими веществами в реакциях. Мы также узнали, что элементы расположены в периодической таблице на основе физических и химических свойств (хотя в основном химических).То, как элементы расположены в строках и столбцах в периодической таблице, говорит нам о них больше.
Важно, чтобы инженеры использовали свои знания о свойствах элементов и материалов при создании новых технологий. Давайте выберем один предмет в этом классе и перечислим его свойства. Представьте, на что был бы похож этот объект, если бы он был сделан из совершенно других материалов. Это то, что могут сделать инженеры при создании конструкции, улучшающей существующую технологию.
Словарь / Определения
химическое свойство: характеристика вещества, влияющая на химическую структуру вещества.
элемент: Вещество, которое не может быть разрушено химическими реакциями.
изотоп: любые атомы химического элемента с одинаковым атомным номером и почти идентичным химическим поведением, но с разным числом нейтронов в ядре.
физическое свойство: характеристика вещества, такая как точка кипения, точка плавления, точка замерзания, плотность, цвет или запах.
Оценка
Оценка перед уроком
Вопрос для обсуждения : Задайте классу несколько вопросов, чтобы заставить учащихся задуматься о предстоящем уроке.После запроса ответов объясните, что на эти вопросы будут даны ответы во время урока.
- Что такое атом? (Ответ: фундаментальный строительный блок материи. Каждый атом состоит из отрицательно заряженных электронов и ядра, состоящего из положительно заряженных протонов и нейтрально заряженных (ни положительно, ни отрицательно заряженных) нейтронов.)
- Назовите один атом, который вы можете найти в этом классе.
Определите это : В небольших группах предложите учащимся участвовать в открытом обсуждении.Напомните им, что все идеи следует с уважением выслушивать. Спросите у студентов:
- Как бы вы описали «свойство» объекта? (Ответы могут быть разными. Возможные ответы: запахи, без запаха, липкие, большие, маленькие, красные и т. Д.)
Оценка после введения
Словарь : Попросите учащихся записать следующие словарные слова на листе бумаги или в своих научных журналах, а затем разработайте свои собственные определения этих слов на основе того, что они уже выучили.Условия использования:
- элемент (Вещество, которое не может быть расщеплено химическими реакциями.)
- физическое свойство (характеристика вещества, такая как точка кипения, точка плавления, точка замерзания, плотность, цвет или запах.)
- химическое свойство (характеристика веществ, влияющая на химическую структуру вещества).
Итоги урока Оценка
Инженерная модернизация Подобно закрытию урока, попросите учащихся (действующих в качестве инженеров) выбрать предмет в классе (доску, стул, стол и т. Д.) И спроектировать предмет, который может заменить его, используя материалы, отличные от материала, из которого он изготовлен. товар в настоящее время изготовлен.Попросите учащихся перечислить преимущества переделки и решить, лучше ли их замена оригинала. Напомните учащимся, что инженеры часто переделывают уже существующие элементы, чтобы улучшить их.
Мероприятия по продлению урока
Исследование : Назначьте каждому учащемуся отдельный элемент из периодической таблицы (предпочтительно из первых 18) и попросите их изучить, где этот элемент присутствует (то есть какие предметы в классе состоят из этого элемента и т. Д.)). Попросите учащихся подсчитать, сколько строк в периодической таблице имеют их элементы, чтобы увидеть, сколько оболочек имеют элементы для их электронов. Попросите учащихся подсчитать столбцы (слева в таблице), в которых расположены их элементы в таблице, чтобы увидеть, сколько электронов находится во внешней оболочке элементов.
Другие игры с элементами: Попросите учащихся поиграть в игры с элементами в лаборатории Джефферсона: http://education.jlab.org/indexpages/elementgames.php
Рекомендации
Pearson Education, Inc., Сеть семейного образования, «Протон Дон», по состоянию на 31 августа 2006 г. http://www3.funbrain.com/cgi-bin/pt.cgi?A1=s&A2=1&ACOMMON=1&submit=Play+Proton+Don
Thomas Jefferson National Accelerator Facility — Office of Science Education, Science Education, Games & Puzzles, «Element Games», по состоянию на 31 августа 2006 г. http://education.jlab.org/indexpages/elementgames.html
Министерство внутренних дел США, Геологическая служба США, Publications Warehouse, 16 августа 2006 г., по состоянию на 12 сентября 2006 г.http://pubs.usgs.gov/circ/c1143/html/fig9.jpg
Winter, Mark, Университет Шеффилда, «WebElementsTM Periodic Table Scholar Edition», по состоянию на 12 сентября 2006 г.
Авторские права
© 2006 Регенты Университета Колорадо.Авторы
Брайан Кей; Дарья Котыс-Шварц; Малинда Шефер Зарске; Джанет ЙоуэллПрограмма поддержки
Комплексная программа преподавания и обучения, Инженерный колледж, Университет Колорадо в БоулдереБлагодарности
Содержание этой учебной программы по цифровой библиотеке было разработано за счет гранта Фонда улучшения послесреднего образования (FIPSE), U.


 Знаете ли вы, что такое индекс?
Знаете ли вы, что такое индекс?
 Умеете ли вы определять валентность?
Умеете ли вы определять валентность?

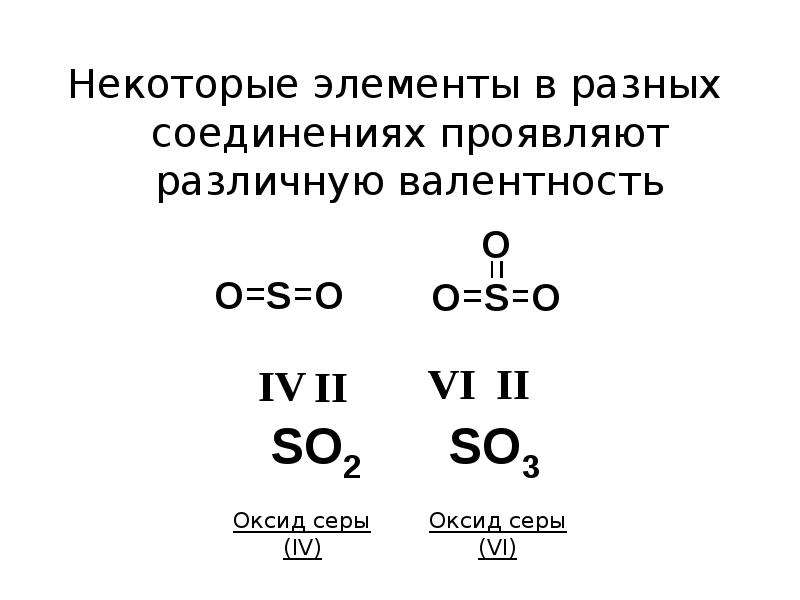 Соберите молекулу воды.
Соберите молекулу воды.


 Следовательно, общее число единиц валентности углерода тоже должно быть равно 4, так как общие единицы валентности элементов в бинарных соединениях должны быть равны. Для этого Вова разделил 4 на индекс углерода, который равен 1, получилось, что валентность углерода равна 4.
Следовательно, общее число единиц валентности углерода тоже должно быть равно 4, так как общие единицы валентности элементов в бинарных соединениях должны быть равны. Для этого Вова разделил 4 на индекс углерода, который равен 1, получилось, что валентность углерода равна 4.