Химия 8 класс примеры химических и физических явлений – Урок №5. Физические и химические явления
Конспект «Физические и химические явления»
«Физические и химические явления
(химические реакции)»
Ключевые слова конспекта: Физические явления, химические явления, химические реакции, признаки химических реакций, значение физических и химических явлений.
Физические явления — это явления, при которых обычно изменяется только агрегатное состояние веществ. Примеры физических явлений — плавление стекла, испарение или замерзание воды.
Химические явления — это явления, в результате которых из данных веществ образуются другие вещества. При химических явлениях исходные вещества превращаются в другие вещества, обладающие другими свойствами. Примеры химических явлений — сгорание топлива, гниение органических веществ, ржавление железа, скисание молока.

Химические явления иначе называют химическими реакциями.
Условия возникновения химических реакций
О том, что при химических реакциях одни вещества превращаются в другие, можно судить по
Для начала многих химических реакций необходимо привести в тесное соприкосновение реагирующие вещества. Для этого их измельчают и перемешивают; площадь соприкосновения реагирующих веществ при этом увеличивается. Наиболее тонкое дробление веществ происходит при их растворении, поэтому многие реакции проводят в растворах.
Измельчение и перемешивание веществ — только одно из условий возникновения химической реакции. Например. при соприкосновении древесных опилок с воздухом при обычной температуре опилки не загораются. Для того чтобы началась химическая реакция, во многих случаях необходимо нагревание веществ до определённой температуры.

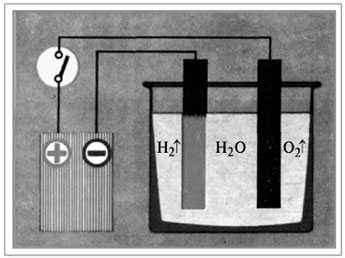
Следует различать понятия «условия возникновения» и «условия течения химических реакций». Так, например, чтобы началось горение, нагревание нужно только вначале, а затем реакция протекает с выделением теплоты и света, и дальнейшее нагревание не требуется. А в случае разложения воды приток электрической энергии необходим не только для начала реакции, но и для дальнейшего её протекания.
Важнейшие условия возникновения химических реакций — это:
- тщательное измельчение и перемешивание веществ;
- предварительное нагревание веществ до определённой температуры.
Значение физических и химических явлений
Большое значение имеют химические реакции. Они используются для получения металлов, пластмасс, минеральных удобрений, медикаментов и т. д., а также служат источником различных видов энергии. Так, при сгорании топлива выделяется теплота, которую используют в быту и в промышленности.
Все процессы жизнедеятельности (дыхание, пищеварение, фотосинтез и др.), протекающие в живых организмах, также связаны с различными химическими превращениями. Например, химические превращения веществ, содержащихся в пище (белков, жиров, углеводов), протекают с выделением энергии, которая используется организмом для обеспечения процессов жизнедеятельности.
Конспект урока «Физические и химические явления ( химические реакции)».
Следующая тема: «Атомы, молекулы и ионы».
Физические и химические явления
5 (100%) 1 vote[s]uchitel.pro
Химические явления внутри и вокруг нас
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.
Мы дальше рассмотрим примеры различных химических явлений, так что этот момент станет понятнее.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).
Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.

Итак, первым делом поговорим про фотосинтез. Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО2 + 12Н2О + свет = С6Н12О6 + 6О2 + 6Н2О.
Дыхание, наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С6
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение.
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.

Уверена, вы замечали, как летом легко дышится после грозы. И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О2 + УФ свет → 2О3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О3.
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).

Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 и MgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Интересные химические явления
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление, при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.

Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО3. Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты. А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты.
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
Будет здорово, если в комментариях вы расскажете нам, какие еще химические явления вы могли сами наблюдать в природе или у себя дома. И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Физические явления в химии (8 класс)
Составила: Филиппова Е.А.
Цель урока: формирование познавательных УУД при изучении физических и химических явлений, признаков протекания химических реакций, их практического значения через проблемное обучение и исследовательскую деятельность.
Тип урока: Урок открытия новых знаний (изучения нового материала).
Формы организации познавательной деятельности: индивидуальная, фронтальная, групповая.
Методы обучения: частично-поисковый, объяснительно-иллюстративный, исследовательский.
Технологии обучения: технология проблемного диалога, исследовательская технология
Обеспечение урока: компьютер, проектор, электронная презентация, выполненная в программе PowerPoint, раздаточный материал (памятки по ТБ, карточки — инструкции для выполнения лабораторной работы, карточки с заданием), химическое оборудования для выполнения лабораторных опытов.
УМК: Химия. 8 класс. Учебник-навигатор. ФГОС. Габриелян О.С., Сивоглазов В.И., Сладков С.А.- М.:Дрофа, 2014.
I. Этап мотивации (самоопределения) к учебной деятельностиЦель: проверка готовности учащихся к уроку
Приветствие учащихся, включение в деловой ритм. Эмоциональный настрой.
Проверка рабочих мест, готовятся к уроку.
Личностные:формирование личностного смысла обучения.
Регулятивные: готовятся к началу урока.
Коммуникативные:используют речевые средства общения.
II. Этап актуализации и фиксирования индивидуального затруднения в проблемном действии.
Цель: подготовка мышления учащихся, организация ими внутренней потребности к построению учебных действий, фиксирование индивидуального затруднения
Актуализация знаний.
Организует повторение понятий “химия”, “вещество”, “свойства веществ”.
Давайте с вами вспомним, что изучает наука химия?
Что такое свойства веществ?
На какие две группы можно разделить свойства веществ?
Хорошо, значит если свойства веществ можно разделить на физические и химические. То и явления, происходящие вокруг нас можно разделить на физические и химические?
Дают определение понятиям, описывают физические свойства вещества.
Химия- наука о веществах, их свойствах и превращениях.
Это признаки, по которым одни вещества отличаются от других.
Физические и химические.
Формулирование ответов (да, нет, возможно).
Учащиеся выдвигают гипотезы:
Познавательные: выдвижение гипотез, их обоснование, выделение того, что уже пройдено.
Коммуникативные: умение давать определение понятиям, описывать свойства веществ; воспроизводить и фиксировать затруднения
Регулятивные:формулируют ответ, осуществляют целеполагание.
Давайте посмотрим несколько слайдов.
Слайды презентации: извержение вулкана, образование инея, образование тумана, образование облаков, таяние льда, плавление металла.
Что мы можем найти общее на этих картинках?
Давайте посмотрим ещё несколько слайдов.
Слайды презентации: гниение листьев осенью, горение древесины, горение бумаги, скисание молока.
Что мы сейчас увидели, есть ли общее у этих явлений?
Создание проблемной ситуации
Как вы определили, что на первом слайде физические явления, а на втором слайде химические явления? Можно ли ответить на этот вопрос с точки зрения химии?
1) По первым слайдам презентации: извержение вулкана, образование инея, образование тумана,образование облаков, таяние льда – это физические явления.
2) По следующим слайдам презентации: гниение листьев осенью, горение древесины, горение бумаги, скисание молока — к физическим явлениям не относятся (химические).
3) делают вывод, что для ответа на вопросы знаний недостаточно.
Делают умозаключения, сравнения, выводы.
Отвечают на поставленные вопросы, опираясь на ранее полученные знания и жизненный опыт. (испытывают затруднения при объяснении сущности физических и химических явлений, выявлении признаков химических реакций, условий их протекания)
III. Этап выявления места и причины затруднения.
Цель: организация анализа учащимися возникшей ситуации и выявление причины затруднения, подведение детей к формулированию темы и постановке цели урока
Попробуйте сформулировать тему урока, т.е. что мы сегодня будем с вами изучать?
Какова цель нашего урока?
Формулируют и записывают в тетрадь тему урока: “Физические явления. Химические реакции”.
Определяют цель урока: Выявить различия между физическими и химическими явлениями, изучить признаки химических реакций.
Познавательные (общеучебные):
постановка и формулирование проблемы;самостоятельное выделение и формулирование познавательной цели.
Коммуникативные: умение слушать, учитывать позиции других людей, владеть монологической и диалогической формами речи.
IV. Этап построения проекта выхода из затруднения.
Цель: постановка цели учебной деятельности и выбор способа и средств их реализации
Составим последовательность наших шагов для достижения цели урока (формулируется в совместной беседе с учащимися).
1. Вспомнить, всё, что вы уже знаем по этой теме из физики, природоведения, из жизни.
2. Выяснить, что такое физические и химические явления.
3. Охарактеризовать признаки отличия этих явлений друг от друга.
Познавательные:(постановка и решение проблемы): создание алгоритма деятельности.
Регулятивные(планирование): планируют последовательность действий.
Коммуникативные:планируют учебное сотрудничество.
V. Этап реализации построенного проекта.
Цель: формирование умений у учащихся применения нового способа действий
Перед тем, как вы приступите к работе, вы должны разделиться на 5 групп. Каждая группа получает инструктивную карту с описанием того, что вы должны сегодня на уроке выполнить. Но прежде всего, давайте с вами вспомним правила работы в группе (слайд)
Задание № 1: Пользуясь текстом учебника, на страницах 129,135 заполните таблицу. (Происходит обсуждение вопросов в группах, результат заносится в тетрадь).
Работают с текстом учебника, анализируют информацию, заполняют таблицу.
Явления
Определение
Признаки
Физические явления
Явления, при которых вещества не превращаются в другие, а только меняется их агрегатное состояние или форма.
Изменение агрегатного состояния, формы.
Химические явления
Явления, при которых из данных веществ образуется одно или несколько новых веществ.
Изменение окраски;
Образование или растворение осадка;
Изменение запаха;
Выделение газа;
Поглощение или выделение теплоты (иногда и света).
Регулятивные: коррекция – внесение дополнений в план действия
Познавательные:
общеучебные – смысловое чтение, извлечение необходимой информации, преобразование;
логические – анализ.
Коммуникативные: умение точно формулировать свою мысль,взаимодействие в групповом коллективе для принятия эффективных совместных решений.
По окончании заполнения таблицы проверяем правильность её заполнения на доске. Заранее подготовить признаки и примеры явлений для оформления таблица на доске в распечатанном виде.
Признаки: вещество не изменяется, образуется новое вещество, меняется форма, меняется агрегатное состояние, изменение цвета, образование осадка, образование газа, появление запаха.
Примеры: плавление парафина, испарение воды, таяние снега, горение древесины, ржавление железа, скисание молока, гниение листьев.
Вывод: (делают сами учащиеся, учитель лишь корректирует)
Работа учащихся у доски. От каждой группы приглашается к доске учащийся и выполняет задание.
Явления
Признаки
Примеры
Физические явления
Изменение агрегатного состояния, формы.
Плавление парафина, кипение и испарение воды, таяние снега.
Химические явления
Изменение окраски;
Образование или растворение осадка;
Изменение запаха;
Выделение газа;
Поглощение или выделение теплоты (иногда и света).
Oбугливание крахмала, горение древесины, ржавление железа, скисание молока, гниение листьев
Регулятивные: умение исправлять ошибки.
Познавательные: умение структурировать знания, осознанно строить речевое высказывание;
логические – синтез (достраивание информации).
Коммуникативные: умение точно формулировать свою мысль, принимать решение.
VI. Этап первичного закрепления с проговариванием во внешней речи.
Цель: усвоение учащимися нового способа действия
Задание №2: На примере конкретных химических реакций рассмотрим признаки. (Напомнить правила по технике безопасности).
Выполняем лабораторные опыты и заносим результаты в таблицу. (Работа с лабораторными опытами проводится в группах, что предусматривает обсуждение результатов между членами групп.)
По инструктивным картам по группам выполняют лабораторные опыт, фиксируют в инструктивной карте наблюдаемые явления, делают вывод.
Обсуждают результаты и сверяют их с эталоном. (слайд).
Регулятивные:планирование последовательности действий.
Познавательные:логические -построение цепи рассуждения, формулирование выводов
Коммуникативные: умение точно выражать свои мысли.
Во время проверки на каждый пример необходимо задать вопрос: А где подобные признаки реакции можно видеть в нашей повседневной жизни?
Какую роль играют физические и химические явления в жизни человека?
Особое внимание уделите 5 опыту.Как доказать, является ли взаимодействие кислоты и щелочи химической реакцией?
— бутылка с минеральной водой, мама окрасила волосы, сода и уксус — для теста.
Ответы учащихся.
Использование индикатора.
VII. Этап самостоятельной проверки с самопроверкой по эталону.
Цель: исполнительная рефлексия
Задание №3: В качестве проверки усвоения изученного материла, учащиеся работают с тестом “Физически и химические явления”
После того как вы оценили друг друга, давайте вернёмся к основному вопросу нашей темы и ещё раз сделаем вывод, что такое физические и химические явления и чем они отличаются друг от друга.
Выполняют тест, осуществляют взаимопроверку по эталону, анализируют результат.
Регулятивные:планирование последовательности действий, контроль по эталону, коррекция реального действия и результата, оценка того, что усвоено и что еще нужно усвоить.
VIII. Этап включения в систему системы знаний и повторения.
Цель: повторение и закрепление изученного, выявление границы применимости нового знания и использование его в системе изученных ранее знаний.
Анализирует работу класса, нацеливает на формулирование выводов по уроку. Выставляет оценки. Предлагает разноуровневые домашние задания по выбору, комментирует предложенные задания:
1 уровень: параграфы 24-25, выучить определения, стр.105 упр.2,4; стр.108 упр.1,2,4.
2 уровень: параграфы 24-25, составить тест по изученной теме или сделать подборку стихов, загадок, пословиц о химических и физических явлениях.
3 уровень: параграфы 24-25, мини-проект “Физические и химические явления в повседневной жизни”
Подводят итог своей деятельности, высказывая, формулируют умения устанавливать значения результатов своей деятельности для удовлетворения своих потребностей, мотивов, жизненных интересов.
Коммуникативные: умение слушать, учитывать позиции других людей, владеть монологической и диалогической формами речи.
IX. Этап рефлексии учебной деятельности. Цель: самооценка учащимися результатов своей деятельности.
А теперь закончим предложения и наш урок
Сегодня я понял……
Меня удивило……
Мне захотелось……
Особенно интересно было….
Урок окончен. Спасибо за урок.
Слушают, задают вопросы на понимание и уточнение, участвуют в обсуждении,
выражают собственное мнение о работе и полученном результате.
Личностные:смыслообразование – установление учащимися связи между учебной целью, деятельностью и результатом учения.
infourok.ru
Упражнение: 1 Приведите несколько примеров хорошо известных вам химических и физических явлений. Химические явления: Горение природного газа, почернение серебряных изделий, скисание молока. Упражнение: 3 Почему процессы горения веществ относят к химическим? Приведите примеры практического применения процессов горения. Процесс горение — химический процесс, так как в результате образуются новые вещества (продукты горения). Примеры: горение метана применяют в быту для приготовления пищи, при движении автомобиля происходит горение бензина в двигателях внутреннего сгорания. Упражнение: 5 Приведите примеры веществ, используемых при создании автомобиля, и химических реакций, протекающих при его эксплуатации. Химические реакции: сгорание бензина в двигателях внутреннего сгорания. | Упражнение: 2 Стальные детали в результате длительного пребывания во влажной атмосфере покрываются ржавчиной. Как называют это явление? К физическим или химическим явлениям его отнесете? Почему? Ржавление, коррозия. Явление относится к химическим, так как образуется новое вещество – ржавчина. Упражнение: 4 Назовите вещества, применяемые вами в быту, но не встречающиеся в живой и неживой природе. Синтетические моющие средства: стиральные порошки, пасты, мыло. |
reshebnikxim.narod.ru
Урок по химии «Физические и химические явления» (8 класс)
Открытый урок в 8 классе
Тема: «Физические и химические явления»
Учитель химии: Лопухова Анастасия Дмитриевна
МБОУ «Кировская ОШ № 1»
пгт. Кировское
2015 г.
Тема: «Физические и химические явления»
Цель урока:
Образовательная:
Формировать умение наблюдать явления, узнавать их и делать выводы на основе наблюдений;
Формировать умение проводить эксперимент в целях бережного отношения к здоровью;
Формировать умение объяснять значение явлений в жизни природы и человека
Способствовать усвоению понятий «физические явления», «химические явления», «признаки химических реакций», «условия протекания реакций»
Воспитательная:
Воспитание убеждённости в познаваемости химической составляющей картины мира
Формирование эстетического вкуса при наблюдении красоты явлений природы
Воспитание бережного отношения к своему здоровью
Развивающая:
Развивать познавательную активность,
Развивать умение наблюдать окружающий мир, задумываться над его сутью, возможностью влияния на происходящие вокруг нас процессы.
Развивать навыки работы с компьютером
Тип урока: усвоение новых знаний и умений
Форма: фронтальное обучение, работа в группах
Вид деятельности: проведение лабораторной работы. (Л/р № 2 «Ознакомление с физическими и химическими свойствами веществ»)
План урока
1. Актуализация знаний и умений
2. Изучение нового материала
3. Закрепление пройденного материала
4. Контроль и оценка знаний учащихся
5. Обобщение и систематизация знаний
6. Домашнее задание
7. Рефлексия
Ход урока
1.Актуализация знаний и умений учащихся
Вопрос – проблема:
Мы часто сталкиваемся с понятием «явление». А что, на ваш, взгляд означает данное слово?
Явление – это изменение или процесс.
2.Опишите явления, с которыми вы сталкиваетесь, когда:
а) кипятите воду;
б) едите мороженное;
в) кладете сахар в чай;
г) готовите «шипучку» (напиток, который готовят, растворяя в теплой воде соду, лимонную кислоту и сахар)
2.Новый материал
Из курса природоведения и физики вы знаете, что с телами и веществами происходят разнообразные изменения.
Прежде чем приступить к изучению темы урока, я предлагаю вам выполнить следующее задание, не торопитесь с ответами, выполните задание до конца.
Задание:
Рассмотрите внимательно картинки и попробуйте ответить на следующие вопросы:
Где можно наблюдать явления, представленные на рисунках и картинках?
Дайте название каждому явлению. Какие вещества участвуют в представленных явлениях? Что происходит с каждым веществом в происходящем явлении? Запишите в рабочих тетрадях и заполните следующую таблицу:
№ п/п
Название явления
Вещество, участвующее в явлении
Изменения, происходящие с веществом
1
2
3 …
При каких явлениях образуются новые вещества?
Как и по каким признакам можно разделить представленные явления?
Физическими явлениями считаются те, при которых вещество не превращается в другое, например: таяние льда, кипение воды, увеличение объема нагреваемого предмета, свечение раскаленных тел, прохождение электрического тока в металлах, распространение запахов в воздухе, притяжение железа к магниту, растворение жира в бензине.
Химическими явлениями считаются те, при которых одни вещества превращаются в другие.
Признаки химического явления:
Выпадение осадка;
Выделение газа;
Изменение окраски;
Растворение осадка;
Выделение или поглощение тепла;
Появление запаха.
В ходе физических и химических явлений происходят изменения с веществами.
Химические реакции
Вспомнить:
Процесс, при котором происходит превращение одних веществ в другие, отличающихся от исходных составом и свойствами, называется химической реакцией
Мир химических реакций чрезвычайно разнообразен. Некоторые химические реакции протекают незаметно, то есть, без внешних признаков. Есть реакции, которые протекают со взрывом или выделением света. Чтобы лучше ориентироваться в мире реакций, нужно уметь давать им характеристику. Разберем основные направления характеристики химических реакций.
Химическая реакция
Идет, течет или протекает
Реагирующие (исходные) Продукты реакции
вещества
Условия протекания реакции Признаки реакции
Записать:
Реагирующие вещества (исходные) – в-ва, присутствующие вначале р-ции.
Продукты реакции – вещества, образующиеся в ходе реакции.
Условия протекания реакции – то, что необходимо выполнить, чтобы реакция началась и продолжала протекать.
Признаки реакции:
Так как в результате химической реакции образуются новые вещества, обладающие другими свойствами, не схожими со свойствами исходных веществ, то внешние качественные характеристики смеси меняются.
Реакция горения, как пример химического явления
Работа в группах
Задания:
Опишите реакцию горения угля, как пример химического явления по заданным характеристикам.
УГЛЕРОД и КИСЛОРОД УГЛЕКИСЛЫЙ ГАЗ
ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТ РЕАКЦИИ
УСЛОВИЯ ПРОТЕКАНИЯ РЕАКЦИИ: ВОЗДУХ, НАГРЕВАНИЕ
ПРИЗНАКИ РЕАКЦИИ: ВЫДЕЛЕНИЕ ТЕПЛА
В реакции участвовали углерод и кислород. Образовался оксид углерода (углекислый газ). Для этого потребовался воздух и нагревание. При горении выделяется энергия.
С + О2 →СО2
Реакция горения – это процесс взаимодействия веществ с кислородом, в результате которого образуются оксиды, и выделяется энергия.
Чтобы остановить пожар необходимо прекратить доступ кислорода к горящему объекту. Для этого его накрывают плотной тканью или засыпают песком.
В результате любой реакции горения выделяется энергия. Это свойство используют в домашних условиях для обогрева и приготовления пищи.
3.Закрепление нового материала.
Лабораторная работа № 2
Тема: «Ознакомление с физическими свойствами веществ»
Цель: Сформировать понятие «химические явления», «физические явления», «химическая реакция ». Научиться отличать физические явления от химических на основе их признаков.
Реактивы: BaCl2; h3SO4; Ca(OH)2; HCl; Na2CO3 (сода), растит. масло.
БЖД: Соблюдать осторожность при работе с кислотами.
Ход работы
Задание № 1: Добавить в пробирку с водой каплю растительного масла, размешать. Произошли ли какие-нибудь изменения? Наблюдения записать в таблицу.
Задание № 2: Смешать в пробирке хлорид бария и раствор серной кислоты.
Произошли ли какие-нибудь изменения?
Наблюдения записать в таблицу.
Задание № 3: В пробирку с водой вставить газоотводную трубочку и подуть.
Произошли ли какие-нибудь изменения?
Наблюдения записать в таблицу.
Задание № 4: В пробирку с раствором гидроксида кальция добавить карбонат натрия (соду). Произошли ли какие-нибудь изменения?
Наблюдения записать в таблицу.
Задание № 5: В пробирку с водой добавить соду, размешать. Произошли ли какие-нибудь изменения?
Наблюдения записать в таблицу.
Задание № 6: В пробирку с раствором соляной кислоты добавить соду. Произошли ли какие-нибудь изменения?
Наблюдения записать в таблицу.
Таблица:
№ п/п
Последовательность действий
Наблюдения
Выводы
(в выводах указать какое явление вы пронаблюдали)
1
2
3
4
5
6
Общий вывод к работе:
4. Контроль и оценка знаний
Тестирование учащихся
(Обведите кружком букву правильного ответа)
В-1
В-2
Из нижеперечисленных явлений укажите:
Химические явления
а) Растворение сахара в воде;
б) Разложение воды электрическим током на водород и кислород;
в) Образование черного налёта на серебряных изделиях;
г) Образование кристалликов соли при упаривании раствора
Физические явления
а) Растворение сахара в воде;
б) Разложение воды электрическим током на водород и кислород;
в) Образование черного налёта на серебряных изделиях;
г) Образование кристалликов соли при упаривании раствора
Из списка условий протекания и признаков химической реакции выберите:
Признаки реакции
а) Появление запаха;
б) Нагревание;
в) Выделение газообразных веществ;
г) Контакт веществ;
д) Изменение цвета;
е) Действие электрическим током;
ж) Выпадение или растворение осадка;
з) Хорошее настроение;
и) Выделение или поглощение тепла и (или) света;
к) Облучение светом;
л) Общение друг с другом
Условия протекания реакции
а) Появление запаха;
б) Нагревание;
в) Выделение газообразных веществ;
г) Контакт веществ;
д) Изменение цвета;
е) Действие электрическим током;
ж) Выпадение или растворение осадка;
з) Хорошее настроение;
и) Выделение или поглощение тепла и (или) света;
к) Облучение светом;
л) Общение друг с другом
Обобщение и систематизация знаний
Подведение итогов урока
Учитель делает вывод о необходимости умения наблюдать, проводить эксперимент, изучать вещества и происходящие с ними явления, об умении делать выводы для познания окружающей природы, о тесной связи происходящих явлений и возможности познания тайн природы для сохранения её и практического применения человеком.
Заключительное слово учителя:
« … , я могу только выразить вам своё пожелание, чтобы вы могли с честью выдержать сравнение со свечой, т.е. могли бы быть светочем для окружающих, и чтобы во всех ваших действиях вы подражали красоте пламени, честно и произвольно выполняя свой долг перед человечеством». (Майкл Фарадей)
Домашнее задание
§ 3, задание после параграфа.
Рефлексия
сегодня я узнал…
было трудно…
я понял, что…
я научился…
я смог…
было интересно узнать, что…
меня удивило…
мне захотелось… и т.д.
infourok.ru
Конспект урока химии 8 класса «Физические и химические явления. Химические реакции»
Тема урока «Физические и химические явления. Химические реакции »
8 класс. Химия. «Первоначальные химические понятия»
УМК
1. Программа курса химии для 8-9 классов общеобразовательных учреждений
Москва.:«Просвещение», 2008 г. Автор Н.Н. Гара. к учебнику Г.Е. Рудзитис Ф.Г. Фельдман
2. Учебник с приложением на электронном носителе
Рудзитис Г. Е.Химия. Неорганическая химия. 8 класс : учеб. для общеобразоват. учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман. — 13-е изд. — М.: Просвещение , 2009.
3. Рабочая тетрадь. 8 классы. Автор: Габрусева Н. И.
Оборудование
Для лабораторных опытов: спички, парафиновая свеча, закрепленная на огнеупорной пластине, пробирка с кристаллической содой в штативе для пробирок и флакон с раствором уксусной кислоты (5 – 7%), магниевая лента (стружки), сахарная пудра, конц. серная кислота, раствора глины, раствор медного купороса, раствор щелочи. Лабораторная посуда: колба, ложки для сжигания, воронки химические, фарфоровые ложки-шпатели, бумажные фильтры.
Маршрутная карта с заданиями, таблицами для внесения наблюдений, сопровождавших лабораторные опыты и для рефлексии.
Место урока
Урок в № 5 в главе 1.
Предыдущие уроки: «Предмет химии», «Вещества и их свойства», П.Р. №1 «Правила техники безопасности при работе в химическом кабинете. Ознакомления с лабораторным оборудованием», «Чистые вещества и смеси», «П.Р №2 Очистка загрязненной и поваренной соли».
Следующие уроки: «Молекулы и атомы», «Простые и сложные вещества»
Предметные результаты обучения
Метапредметные результаты обучения
-Давать определения физических и химических явлений.
-описывать самостоятельно проведенные эксперименты, используя для этого язык химии.
-уметь описывать и характеризовать физические и химические явления.
-наблюдать и сравнивать свойства веществ, — структурировать изученный материал.
-планировать и проводить химический эксперимент.
— иметь представление о признаках и условиях протекания химических явлений (реакций).
— владеть универсальными способами деятельности: наблюдение, эксперимент, учебное исследование,
-использовать универсальные способы деятельности по решению проблемы и основных интеллектуальных операций.
-уметь определять средства, необходимые для реализации идей.
-уметь определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике
-использовать различные источники для получения химической информации.
-развивать способности к наблюдениям, систематизации информации, способности выделять главное существенное
Тип урока: Урок открытия новых знаний.
Методы обучения: активные методы обучения: эвристическая беседа, лабораторная работа в исследовательском варианте, работа в группе.
Формы работы: групповая, в парах, фронтальная, индивидуальная.
Обучающиеся сидят в группах по 4-6 человек (в зависимости от наполняемости класса)
Цель урока: Создание условий для усвоения учащимися знаний о физических и химических явлениях, признаках и условиях протекания химических реакций, учить наблюдать и выполнять химический эксперимент.
Задачи урока:
Обеспечить достижение предметных результатов обучения
Образовательные задачи.
. Усвоить понятия «физические явления», «химические явления», химическая реакция.
2. Изучить признаки и условия протекания химических реакций.
Сформировать умения:
— Способствовать формированию умений проводить и анализировать лабораторные исследования, вырабатывать практические умения работать с реактивами, оборудованием в соответствии с правилами по технике безопасности.
-Формировать умение наблюдать явления, узнавать их и делать выводы на основе наблюдений;
-Формировать умение проводить эксперимент в целях бережного отношения к здоровью;
-Формировать умение объяснять значение явлений в жизни природы и человека;
Воспитательные задачи.
-Воспитание убеждённости в познаваемости химической составляющей картины мира;
-Формирование эстетического вкуса при наблюдении красоты явлений природы;
-Воспитание бережного отношения к своему здоровью.
Создать условия для:
1. формирования ценностного отношения к исследовательской деятельности как основному способу получения знаний в химии;
2.развития коммуникативных умений;
3. воспитания ответственности и аккуратности при проведении лабораторных опытов;
4.воспитания позитивного отношения к химии;
Развивающие задачи.
Создать условия для развития следующих УУД:
1) Познавательных:
• Общеучебные универсальные действия:
а. Осознанное и произвольное построение речевого высказывания.
б. Смысловое чтение, определение основной и второстепенной информации.
в. Выбор наиболее эффективных способов решения задач.
г. Рефлексивные УУД (самоконтроль и самооценка).
д. Структурирование знаний.
• Знаково-символические действия: написание уравнений реакций.
• Логические универсальные действия:
а. Анализ объектов с целью выделения признаков, установление причинно-следственных связей.
б. Умение анализировать, строить план исследования, наблюдать и делать выводы на основе эксперимента, делать дедуктивные и индуктивные умозаключения.
в. Умение проводить и описывать эксперимент.
г. Выдвижение гипотез, их обоснование.
• Постановка и решение проблемы.
2) Личностных: самостоятельное создание способов решения проблем поискового характера.
3) Коммуникативных:
а. Умение точно выразить свои мысли, владение диалогической речью,
б.Сотрудничество в группе.
4) Регулятивных.
а. Целеполагание. Планирование (построение плана изучения физических и химических явлений).
б. Контроль в форме сличения результата действия с заданным эталоном.
в. Оценка и саморегуляция.
Критерии достижения цели урока: ученик должен
ЗНАТЬ:
• понятия химические и физические явления, химическая реакция;
• признаки и условия протекания химических реакций;
УМЕТЬ:
• описывать и характеризовать химические и физические явления;
• дифференцировать химические и физические явления;
• наблюдать и сравнивать свойства веществ;
ВЛАДЕТЬ: навыками проведения эксперимента и правилами ТБ;
Планируемые результаты обучения.
Обеспечить достижение метапредметных результатов обучения: создать условия (учебные ситуации) для развития коммуникативных, регулятивных и познавательных УУД.
Обеспечить достижение личностных результатов обучения:
сформировать позитивное эмоциональное отношение обучающихся к изучаемым на уроке химическим явлениям, развитие умения управлять своей познавательной деятельностью, готовности к решению задач на выявление сущности того или иного явления природы.
ХОД УРОКА
1 этап. Самоопределение к деятельности.
Организационный момент. (1 минута)
Деятельность учителя:
Один из героев французского писателя Мольера всю жизнь не знал, что он говорит прозой. Многие, впрочем, и сейчас этого не знают, как не знают и того, что всю жизнь имеют дело с химией. А что такое химия?
2 этап. Актуализация знаний и фиксация затруднений в деятельности (5 минут)
Задание: Разделите картинки на две группы. Обоснуйте их распределение (На парты по группам выданы картинки с физическими и химическими явлениями, учащиеся обсуждают наблюдения, делают выводы.)
Озвучивается ответ каждой группы.
Учитель задает вопросы — учащиеся отвечают.(организует обсуждение результатов работы каждой группы)
Учитель: Что объединяет все картинки?
Учащиеся: На всех картинках показаны явления.
Учитель: Что происходит при различных явлениях?
Учитель: как вы думаете – все ли явления в природе одинаковы, по сути? Поднимите, пожалуйста, руки те, кто считает, что все явления, по сути, сходны или одинаковы, а теперь те, кто считает, что явления отличаются. Кто может объяснить свой выбор? (задание вызывает интеллектуальное затруднение)
Деятельность обучающихся: обсуждение ответа на вопрос в группах.
В ходе беседы обсуждаются ответы учащихся – ход обсуждения сводится к объяснению нового материала на основе жизненного опыта учащихся.
Учащиеся сами приходят к выводу:
Различают два вида явлений в природе: явления, при которых у веществ изменяется форма, агрегатное состояние или температура. Явления, при которых происходит изменение окраски веществ, выделение газа, образование осадка, выделение тепла.
Деятельность учителя:
Задание для групп (1 минута). Предложите свою формулировку темы урока, не изменяя содержание.
Озвучивается ответ каждой группы.
3 этап. Постановка учебной задачи (3 минуты)
Деятельность учителя: Как можно сформулировать тему урока?
Деятельность обучающихся: учащиеся сами формулируют тему урока
Тема урока: Физические и химические явления. Химические реакции
Учитель: Итак, мы изучаем физические и химические явления.
Давайте теперь на практике попробуем определить, какие явления являются физическими, а какие химическими. (Целеполагание и определение путей достижения цели)
Предположим, вы хотите узнать о физических и химических явлениях абсолютно все.
Вариант 1. Какие цели вы поставите перед собой на этот урок?
Вариант 2. Что вы хотели бы узнать о физических и химических явлениях? Чему научиться?
Варианты ответов учащихся:
1. Изучить понятия «физические«химические» явления (химическая реакция)
2. Изучить признаки и условия протекания химических явлений (реакций)
3. Уметь отличать физические и химические явления (дифференцировать)
4. Узнать значение физических и химических явлений
(Возможны различные формулировки целей обучающимися).
Цели записываются на доске, предварительно структурируются учителем. Если важное направление работы на уроке не называется, можно использовать прием «Мне хочется добавить…» («К целям, которые вы сформулировали, мне хотелось бы добавить еще одну»).
4 этап. Построение проекта выхода из затруднения.
(проектирование) (23 минуты)
Деятельность учителя:
Учитель:
Какими способами будем достигать перечисленные вами цели?
Деятельность обучающихся:
Учащиеся:
Проводить лабораторные опыты. Наблюдать. Делать выводы о «физических «химических» явлениях.
Изучать новые понятия.
Делать схематические рисунки, используя термины. заполнять таблицы.
Находить и анализировать информацию в учебнике и дополнительных источниках.
Сравнивать, дифференцировать физические и химические явления.
Выделять признаки химических явлений
Задавать вопросы учителю.
Размышлять, высказывать предположения.
Учитель: Запишите на полях еще одну цель (цель+) лично для себя. Сегодня эта цель будет связана с вашей работой в группе. Сформулируйте ее сами. «На протяжении урока я…» маршрутная карта задание № 2
Примеры: буду высказывать свое мнение по каждому вопросу; услышу все, что будут говорить ребята в группе; один раз выступлю от группы и т.д.
Работа в группах. Реализация построенного проекта.
Учитель организует работу в группах, контролирует выполнение эксперимента и правил ТБ). Теперь вам предстоит провести лабораторные опыты самостоятельно по группам, соблюдая правила охраны труда. Работать будете по маршрутной карте задание № 3
Деятельность обучающихся: выполняют эксперименты. Самостоятельно делают выводы о явлениях).Обсуждают результаты наблюдений.
Демонстрационные опыты:
Содержание опыта
Наблюдения, сопровождающие опыт
Вывод о явлении
Горение магниевой ленты (стружки)
Вспышка света, образование белого дыма (порошка)
химическое
Растворение сахарной пудры
Образование сиропа
физическое
Обугливание сахара концентрированной серной кислотой
Появление запаха
жженого сахара, почернение сахара и увеличение его объёма (подъём за счёт выделяемого газа)
химическое
Фильтрование раствора глины
Глина на фильтре, фильтрат бесцветный прозрачный
физическое
Взаимодействие раствора медного купороса с раствором щелочи
Образование осадка голубого цвета
химическое
Горение парафиновой свечи
Выделение тепла, света, образование нового вещества с новыми свойствами.
химическое
Гашение соды уксусом
Образование нового вещества-газа.
химическое
После проведения опытов по группам проводится беседа о наблюдаемых явлениях, по плану: какое явление наблюдаем (физическое/химическое), по каким признакам определили. Высказывают свое мнение учащиеся группы.
Учитель: По каким признакам вы определяли, какое явление – химическое или физическое происходит?
Ученики высказывают свое мнение. В результате беседы подводится итог – признаки химических реакций (явлений), которые записывается учащимися в рабочую тетрадь по заданиям в маршрутной карте.
Задание индивидуально. Маршрутная карта задание № 4
Используя схему на странице 11 учебника дайте определение:
Физическими явлениями называют-
Химическими явлениями называют-
Дополни схему. Делают записи в тетрадях.
Учащиеся сами называют и записывают признаки химических реакций (явлений).
1. Выделение тепла (иногда света),
2. Изменение окраски,
3. Появление запаха,
4. Образование осадка,
5. Выделение газа.
Отвечают на вопросы по маршрутной карте.
Ответь на вопрос: Что происходит при химических реакциях (дают определение)
После ответов на вопросы по маршрутной карте делают выводы: какие же условия должны быть выполнены для того, чтобы началась химическая реакция?
Задание в парах. Маршрутная карта задание №4
Ответь на вопрос: почему кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв?
Ответь на вопрос: произойдет ли разложение сахара, если прекратить его нагревание?
Анализ рисунка маршрутная карта задание №4
Перечисли, условия возникновения и течения химических реакций используя страницу 12 в учебнике.
Сообщение ученика (опережающее д/з):
На протяжении всей жизни мы постоянно сталкиваемся с физическими и химическими явлениями. Природные физические явления для нас столь привычны, что мы уже давно не придаём им особого значения. Химические реакции постоянно протекают в нашем организме. Энергия, которая выделяется при химических реакциях, постоянно используется в быту, на производстве, при запуске космических кораблей. Многие материалы, из которых изготовлены окружающие нас вещи, не взяты в природе в готовом виде, а изготовлены с помощью химических реакций.
Индивидуальное задание. Проверка в парах. Обсуждение в парах.
Используя, страницу учебника №12 заполни таблицу. Маршрутная карта задание № 5
5 этап. Первичное закрепление (3 минуты)
Деятельность учителя:
Учитель: Надеюсь, теперь вы легко сможете определить, о каком явлении идёт речь. Давайте попробуем выполнить задание индивидуально. Проверка в парах. По образцу. Маршрутная карта задание № 6
Деятельность обучающихся:
Какое из перечисленных явлений не является физическим?
замерзание воды
плавление алюминия
горение бензина
испарение воды
Какое из перечисленных явлений не является химическим?
ржавление железа
подгорание пищи
горение бензина
испарение воды.
Деятельность учителя:
Чему, как правило, посвящена заключительная часть урока?
Ученики: Проверить, достигнуты ли результаты, и оценить их.
Вернемся к целям урока (записаны на доске). Все ли цели достигнуты теперь? Это результаты нашей совместной работы.
Задание группам. Вспомните и запишите способы, с помощью которых вы достигали поставленных целей.
Вариант 1. Общий перечень в каждой группе
Вариант 2. Каждая группа выбирает одну из целей и записывает пути ее достижения.
Озвучивают группы по очереди.
Теперь необходимо оценить качество достижения результатов.
Этап Самостоятельная работа с самопроверкой по эталону ( 5 минут)
Деятельность обучающихся:
Маршрутная карта задание № 7
Учитель: Проанализируйте результаты проверочной работы. Что выполнено верно? Над чем еще предстоит поработать?
Запишите индивидуальное домашнее задание. Какие понятия необходимо повторить? Какие умения отработать еще раз?
Запишите домашнее задание Дифференцированное. (одно из трех заданий по выбору)
Деятельность обучающихся: Маршрутная карта задание № 8
6 этап. Рефлексия деятельности (итог урока) ( 5 минут)
Учитель: Вспомните весь ход урока, свои мысли, чувства, действия. Прочитайте цель+, записанную в начале урока в маршрутной карте и связанную с работой в группе. Подумайте, удалось ли вам ее выполнить и насколько успешно.
Учитель совместно с учащимися оценивает урок и принимает их предложения и пожелания:
– ребята, чему каждый из вас научился на сегодняшнем уроке?
– освоены ли понятия: физическое явление, химическое явление?
– были ли моменты непонимания?
– смогли ли мы их разрешить в ходе разговора?
– что вам понравилось или не понравилось на уроке и почему?
– какой результат вы получили?
Деятельность обучающихся: Маршрутная карта задание № 9
Учитель: Сегодня на уроке мы с вами продолжили знакомство с основными понятиями химии. Надеюсь, к данному моменту все справились с задачей, поставленной перед вами в начале урока. Работали все хорошо, если у кого-либо остались ещё вопросы или сомнения есть время их разрешить. Объявляются оценки за работу на уроке, собираются листы с выполненными тестовыми заданиями.
Приложение1. Маршрутная карта.
Разделите картинки на две группы. Обоснуйте их распределение.

1 2


3 4


5 6


8 7


10


12


13 14
Маршрутная карта
1.Цель урока общая: _________________________________________
2.Цель учащихся личная_______________________________________
Этапы достижения цели:
3. Проведите лабораторные опыты самостоятельно по группам, соблюдая правила охраны труда.
Демонстрационные опыты:
№ п/п
Содержание опыта
Наблюдения, сопровождающие опыт
Вывод о явлении
1
Горение магниевой ленты (стружки)
2
Растворение сахарной пудры
3
Обугливание сахара конц. серной кислотой
4
Фильтрование раствора глины
5
Взаимодействие раствора медного купороса с раствором щелочи
6
Горение парафиновой свечи
7
Гашение соды раствором уксуса
4. Используя схему на странице №11 учебника дайте определение:
Физическими явлениями называют-
Химическими явлениями называют-
Дополни схему. Сделай записи в тетради.
Явления
ЯВЛЕНИЯ
Признаки химических реакций (явлений)
1.
2.
3.
4.
5.
*Ответь на вопрос: Что происходит при химических реакциях-
* Используя, страницу 11 в учебнике ответьте на вопросы: почему кусковой сахар трудно поджечь, но измельчённый и распылённый в воздухе он сгорает за считанные доли секунды, образуя своеобразный взрыв?
*Ответь на вопрос: произойдет ли разложение сахара, если прекратить его нагревание?
*Рассмотри рисунок и проанализируй:
*Перечисли, условия возникновения и течения химических реакций используя страницу 12 в учебнике.
5. Используя страницу учебника №12 заполни таблицу.
Примеры явлений
Значение этих физических и химических явлений
Физических
1)………….
2)…………..
Химических
1)………….
2)…………..
6. Выполни задание. Обменяйтесь тетрадями и проверьте задание друг у друга по образцу.
Какое из перечисленных явлений не является физическим?
замерзание воды
плавление алюминия
горение бензина
испарение воды
Какое из перечисленных явлений не является химическим?
ржавление железа
подгорание пищи
горение бензина
испарение воды.
7.
7.1. Выбрать один правильный ответ из четырёх предложенных.
1. К химическим явлениям относится…
А) сгорание угля
Б) испарение воды
В) образование росы на траве
Г) плавление алюминия
2. К физическим явлениям относится
А) выделение газа при взаимодействии соды с уксусом
Б) испарение уксуса
В) сгорание бензина в двигателе
Г) обугливание древесины
7.2. Верны ли следующие суждения?
А. Помутнение известковой воды при пропускании через неё углекислого газа – это химическое явление.
Б. Химические явления ведут к образованию новых веществ.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
7.3. Установите соответствие между процессом и явлением. Ответ запишите в виде последовательности букв и цифр, например, А1, Б2 и т.п.
1) замерзание водоёмов зимой
2) изменение окраски листьев деревьев осенью
3) таяние шоколада
4) фотосинтез
А – физические явления Б – химические явления
7.4. ХИМИЧЕСКОЕ ИЛИ ФИЗИЧЕСКОЕ ЯВЛЕНИЕ?
Объясните, почему указанное явление следует отнести к физическим или химическим?
1) Свечение электрической лампочки_______________________________
______________________________________________________________
2) Таяние мороженого__________________________________________
______________________________________________________________
3) Проволока сплющивается от удара с молотком_____________________
______________________________________________________________
4) Горение дров_________________________________________________
_______________________________________________________________
5) Дробление сахара____________________________________________
_____________________________________________________________
6) Почернение медной проволоки ___________________________________
______________________________________________________________
7) Пропускание воды резиновыми сапогами___________________________
7.5.
Был проведён следующий опыт. Закрыли пробирку пробкой со вставленной в неё трубкой. Опустили конец трубки в стакан с водой. Рукой нагрели пробирку. Объем воздуха в ней увеличился, и часть воздуха из пробирки вышла через трубку, что можно наблюдать благодаря выделению пузырьков воздуха. При охлаждении пробирки объём воздуха уменьшился, и вода вошла в пробирку.
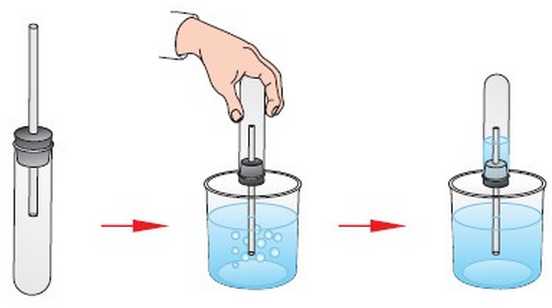
О каком явлении идёт речь? О физическом или химическом. Ответ обоснуйте______________________________________________________
8.домашнее задание (на выбор)
8.1. §3, с.13, упр. 11 – 13.
Изобразить 1 физическое или 1 химическое явление, дать объяснение явления.
8.2. спирт + кислород —> вода + углекислый газ
исходные вещества конечные вещества
(реагенты) (продукты реакции)
Объясни суть данной химической реакции :
8.3. Вследствие фотосинтеза ежегодно из атмосферы поглощается около 300 млрд т углекислого газа, выделяется 200 млрд т кислорода и образуется 150 млрд т органических веществ .Можно ли сказать что в процессе фотосинтеза происходят химические явления(реакции). Обоснуйте свой ответ.
8.4. Изучите конспект урока и попытайтесь сами написать по пять физических и химических явлений, используя свой собственный опыт.
8.5.Попытайтесь составить тест по теме “Физические и химические явления”;
9. Продолжить предложение:( на выбор).
сегодня я узнал…
было интересно…
было трудно…
я выполнял задания…
я понял, что…
теперь я могу…
я почувствовал, что…
я приобрел…
я научился…
у меня получилось …
я смог…
я попробую…
меня удивило…
урок дал мне для жизни…
мне захотелось…
infourok.ru
Урок-исследование по химии в 8-м классе по теме «Физические и химические явления»
Разделы: Химия
Цели урока: способствовать формированию знаний учащихся о физических и химических явлениях;
обучающие: содействовать формированию у учащихся знаний, позволяющих выявить чёткие различия между физическими и химическими явлениями; о признаках и условиях протекания химических реакций;
развивающие: развитие умений проводить и анализировать лабораторные исследования, вырабатывать практические умения работать с реактивами, оборудованием в соответствии с правилами по ТБ. Установление межпредметных связей.
воспитательные: содействовать воспитанию стойкого позитивного интереса к предмету, гордости за отечественную науку.
Тип урока: урок изучения нового материала и первичного закрепления знаний.
Форма урока: беседа с демонстрационными и лабораторными опытами.
Оборудование: компьютер, экран, наборы для лабораторной работы, демонстрационные опыты, мультимедийная презентация, учебник «Химия 9» О.С. Габриелян, (Приложение 1)
Ход урока
Здравствуйте ребята и гости нашего урока. Сегодня мы проведем урок- исследование.
Эпиграф: (СЛАЙД № 2)
Химии никоим образом научиться невозможно, не видав самой
практики и не принимаясь за химические операции.
М.В. Ломоносов
— Как вы понимаете эти слова?
Для того чтобы проводить опыты, нужно знать какие вещества необходимо взять.
— Какие классы неорганических веществ вы знаете?
— Назовите их. (СЛАЙД № 3)
— Молодцы!
Вы знаете вещества, знаете их состав, строение. Но наши знания будут неполными, если мы не изучим явления происходящие с ними.
— Какие явления могут происходить с веществом парафин, мы назовем, после того как понаблюдаем за горящей свечой. (СЛАЙД № 4)
- плавление парафина
- затвердевание парафина
- горение парафина.
Изменение агрегатного состояния- это признак какого явления?
— Физического явления.
— Как будет называться явление, связанное с горением?
— Химическое явление.
Сформулируйте тему урока.
Физические и химические явления (СЛАЙД № 5)
Что хотели бы узнать и чему научиться на уроке:
- определить-
- познакомиться-
- выявить-
- отметить-
(СЛАЙД № 6)
Учащиеся самостоятельно называют, что они хотят получить для себя с урока.
Учитель предлагает названные пункты включить в план урока.
ПЛАН УРОКА
1.
- определить- сущность физических и хим. явлений
- познакомиться-с видами хим. реакций
- выявить- признаки хим. реакций
- отметить- условия протекания реакций
(СЛАЙД № 7)
2. Д/ з
3. Рефлексия
Знакомство с новой темой:
Начнем знакомство с физическими явлениями
С ними вы знакомились на уроках физики. Назовите признаки физических явлений.
Дети называют, учитель показывает демонстрационные опыты некоторых из них.
Сформулируйте определение физического явления.
Физическое явление— явление, которое не сопровождается образованием новых веществ, оно проявляется в изменении формы тела или агрегатного состояния. (СЛАЙД № 8)
Назовите признаки химических явлений. Сейчас мы это еще раз проверим
Знакомство с химическими явлениями (Реакциями).
ИНСТРУКТАЖ ПО ТБ
Работа в группах
У вас на столе лежат конверты с заданиями, вам необходимо их выполнить, соблюдая ТБ
И полученные результаты занести в таблицу
1 вариант
Опыт 1. «Взаимодействие мыльного раствора с раствором уксусной кислоты»
В пробирку налить 2 мл мыльного раствора, а затем к нему добавить несколько капель уксусной кислоты, результат наблюдения занести в соответствующую графу таблицы.
Опыт 2. «Взаимодействие раствора уксусной кислоты с кусочком мела»
В пробирку налить 2 мл раствора уксусной кислоты, а затем опустить в нее кусочек мела. Наблюдаемый результат занести в графу таблицы.
Опыт 3. «Взаимодействие сырого картофеля с раствором йода»
На свежий срез картофеля капнуть капельку раствора йода, наблюдаемый результат занести в таблицу.
2 вариант
Опыт 1. «Взаимодействие молока с раствором лимонной кислоты»
В пробирку налить 2 мл молока, а затем добавить несколько капель лимонной кислоты и перемешать стеклянной палочкой, результат наблюдения занести в соответствующую графу таблицы.
Опыт 2. «Взаимодействие пищевой соды с раствором уксусной кислоты»
В пробирку насыпать немного пищевой соды, а затем добавить несколько капель раствора уксусной кислоты, результат наблюдения занести в таблицу.
Опыт 3. «Взаимодействие картофельного крахмала с раствором йода»
В пробирку налить 2 мл раствора крахмала, а затем добавить несколько капель йода, наблюдаемый результат занести в таблицу.
Полученные результаты, произошедшие с веществами, занесите в таблицу.
|
название опыта |
Результат |
|
Взаимодействие мыльного раствора с раствором уксусной кислоты |
|
|
Взаимодействие раствора уксусной кислоты с кусочком мела |
|
|
Взаимодействие сырого картофеля с раствором йода |
|
|
Название опыта |
результат |
|
Взаимодействие молока с раствором лимонной кислоты |
|
|
Взаимодействие пищевой соды с раствором уксусной кислоты |
|
|
Взаимодействие картофельного крахмала с раствором йода |
|
Проверка полученных результатов
Формулируют определение химической реакции (явления)
Химическое явление — явление, в результате которого происходит образование нового вещества.
(СЛАЙД №9)
Физкультпауза
Таблички с текстом развешаны на стенах, нужно сгруппировать их в 2 группы- физические явления и химические явления. (Дети встают и расходятся по классу, выбирая табличку)
Приложение 5
Закрепление (СЛАЙД № 10)
1. Унылая пора! Очей очарованье!
Приятна мне твоя прощальная краса —
Люблю я пышное природы увяданье.
В багрец и золото одетые леса.
(А.С.Пушкин)2. И трещат сухие сучья,
Разгораясь жарко.
Освящая тьму ночную
Далеко и жарко!
(И Суриков.)3. В декабре, в декабре
Все деревья в серебре.
Нашу речку, словно в сказке
За ночь вымостил мороз…
(С.Я.Маршак)4. А если медь в печи нагреть.
То станет тяжелее медь
С окалиною вместе.
Не верите – так взвесьте…
(Е. Ефимовский)5. Что за звездочки резные
На пальто и на платке?
Все сквозные, вырезные,
А возьмешь – вода в руке?
(Е. Благинина)6. На рукомойнике моем
Позеленела медь.
Но так играет луч на нем,
Что весело смотреть.
(А Ахматова)7. Световых частиц поток
Падает на зеленый листок,
Листок кислород выделяет,
Углекислый газ поглощает.
(Из ответа ученика )8. Когда металл в крутые формы льем,
Мне верится, что оживут в металле
Горячие полдневные поля.
Кипит металл и ждут его поля.
(А. Кравцов)
(Правильные ответы: Х Х Ф Х Ф Х Х Ф.)
Обратимся к схеме химических явлений, какой из признаков мы не наблюдали?
— Появление или поглощение теплоты.
Для его подтверждения мы просмотрим видеофрагмент «Вулкан». (СЛАЙД № 11),
Приложение 2
— Что мы наблюдали в ходе видеофрагмента?
— Дым, пламя огня, раскаленная лава.
Как называются эти реакции в химии, вы узнаете из учебника.
РАБОТА С УЧЕБНИКОМ (О.С. Габриелян. § 26 с.90-91)
Записать определение эндотермической и экзотермической реакции в тетрадь. (СЛАЙД № 12)
— Какие условия необходимо выполнить, чтобы произошла химическая реакция?
Просмотр видеофрагмента «Восстановление оксида меди водородом» (СЛАЙД № 13)
Приложение 3
Условия протекания химической реакции
1. Соприкосновение веществ
2. Нагревание (СЛАЙД № 14)
3. Присутствие катализатора
4. Поверхность соприкосновения
Закрепление (карточка)
Приложение 4
Домашнее задание
(СЛАЙД № 15)
26, термины записать в тетрадь.(задание для всех)
По выбору учащихся 2. Привести примеры химических явлений, которые встречаются в трудовой деятельности ваших родителей, в домашнем хозяйстве.
3. Сделать подборку стихов, загадок, пословиц о химических и физических явлениях.
Рефлексия
(СЛАЙД № 16)
В ходе урока вы пытались овладеть самым главным в процессе познания – умением находить истину с помощью доказательств, то есть проводить исследования. Многие ученые прошлых веков опирались в своих изысканиях лишь на интуицию и в результате нередко ошибались.
Вы же с помощью опытов нашли свою истину.
1. Сегодня я понял …
2. Теперь я могу…
3. Я приобрел….
4. Меня удивило …
5. Я попробую …
6. Мне захотелось…
8.04.2010
xn--i1abbnckbmcl9fb.xn--p1ai

