Урок введение химия 8 класс: Химия 8 класс
Урок химии 8 класс: «Предмет химии»
Прием Ассоциации Ребята, какие ассоциации у вас вызывает слово химия.обсудить в парах сообщаем тему урока
Знаю | Хочу узнать | Узнал |
Выходим на цель урока, решив ребус.
Прием «Карусель»используя различные ресурсы, найдите ответы на вопросы: Почему химию относят к наукам
2. Почему химию относят к естественным наукам
3.Чем наука химия отличается от других естественных наук? Обсудите эти вопросы сначала в паре, затем в группе. Запишите свои ответы. Передайте постер по кругу в другую группу. Поставьте «+» если согласны, «-» — если несогласны, «?» — если есть дополнения. Выслушать ответы учащихся.
Что мы выяснили о химии. Запишите в тетрадь определение химии и ее задачи и значение.
На экране пронумерованные картинки стаканов: стеклянного, форфорового, пластикового, бумажного, металлического
Тело (ПО одно — стакан)___________________
Вещества (ПО много: стекло, металл, пластик и др.)____________
1 2
3 4
Составьте вопрос к следующим картинкам
(ПО Тела много
Вещество 1 — бумага)
Допишите в тетрадь определения:
Вещества –это……………………………………………
Тела – это………………………………………………….
Прием «Верно-неверно». Верно ли утверждение
Стекло – это вещество.
Линейка – это вещество
Железо – это тело
Сахар – это тело
Стол – это вещество
Папка –это тело
Резина – это вещество
Если «верно» поднимают зеленые стикеры, если «неверно» — красные
Химия.
 8 класс. Технологические карты
8 класс. Технологические картыПособие предназначено для учителей химии, работающих в общеобразовательных организациях по учебнику «Химия. 8 класс» О. С. Габриеляна.
Содержит технологические карты уроков, в которых представлены обобщенные планируемые образовательные результаты (предметные, метапредметные, личностные), организационная структура и ход уроков.
Пособие адресовано учителям химии, кроме того, оно может быть использовано в учебном процессе для химико-методической подготовки студентов, а также в системе повышения квалификации педагогов.
Содержание
- Предисловие
- Введение
- Урок 1. Химия — часть естествознания. Предмет химии. Вещества
- Урок 2. Превращения веществ. Роль химии в жизни общества. Краткий очерк истории развития химии
- Урок 3. Периодическая система химических элементов Д. И. Менделеева.

- Урок 4. Химические формулы. Относительная атомная и молекулярные массы. Массовая доля элемента в соединении
- Атомы химических элементов
- Урок 5. Основные сведения о строении атомов
- Уроки 6–7. Строение электронных оболочек атомов
- Урок 8. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
- Урок 9. Взаимодействие атомов элементов-неметаллов между собой
- Урок 10. Ковалентная полярная химическая связь
- Урок 11. Металлическая химическая связь
- Урок 12. Атомы химических элементов. Диагностическая работа
- Простые вещества
- Урок 13. Простые вещества-металлы
- Урок 14. Простые вещества-неметаллы
- Урок 15. Количество вещества
- Урок 16. Молярный объем газов
- Урок 17. Решение задач с использованием понятий «количество вещества», «постоянная Авогадро», «молярная масса», «молярный объем газов»
- Урок 18.
 Обобщение и систематизация знаний по теме «Простые вещества»
Обобщение и систематизация знаний по теме «Простые вещества»
- Соединения химических элементов
- Урок 19. Степень окисления
- Уроки 20–21. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
- Уроки 22–23. Основания
- Уроки 24–25. Кислоты
- Уроки 26–27. Соли
- Урок 28. Кристаллические решетки
- Урок 29. Чистые вещества и смеси
- Урок 30. Массовая и объемная доли компонентов смеси (раствора)
- Урок 31. Обобщение и систематизация знаний по теме «Соединения химических элементов»
- Урок 32. Соединения химических элементов. Диагностическая работа
- Изменения, происходящие с веществами
- Урок 33. Физические явления в химии
- Урок 34. Химические реакции
- Урок 35. Химические уравнения
- Уроки 36–37. Расчеты по химическим уравнениям
- Урок 38.
 Реакции разложения
Реакции разложения - Урок 39. Реакции соединения
- Урок 40. Реакции замещения
- Урок 41. Реакции обмена
- Урок 42. Типы химических реакций на примере свойств воды
- Урок 43. Обобщение и систематизация знаний по теме «Изменения, происходящие с веществами»
- Урок 44. Изменения, происходящие с веществами. Диагностическая работа
- Химический практикум № 1. Простейшие операции с веществом
- Урок 45. Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами. Практическая работа
- Урок 46. Признаки химических реакций. Практическая работа
- Урок 47. Приготовление раствора сахара и расчет его массовой доли в растворе. Практическая работа
- Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции
- Урок 48.
 Растворы. Растворимость веществ
Растворы. Растворимость веществ - Урок 49. Электролитическая диссоциация
- Урок 50. Основные положения теории электролитической диссоциации
- Урок 51. Ионные уравнения
- Уроки 52–53. Кислоты, их классификация и свойства
- Уроки 54–55. Основания, их классификация и свойства
- Уроки 56–57. Оксиды, их классификация и свойства
- Уроки 58–59. Соли, их классификация и свойства
- Урок 60. Генетическая связь между классами веществ
- Уроки 61–62. Обобщение и систематизация знаний по теме «Растворение. Растворы. Свойства растворов электролитов»
- Урок 63. Растворение. Растворы. Свойства растворов электролитов. Диагностическая работа
- Уроки 64–65. Окислительно-восстановительные реакции
- Урок 48.
- Химический практикум № 2. Свойства электролитов
- Урок 66. Решение экспериментальных задач. Практическая работа
- Список литературы
Урок химии в 8 классе
Урок химии в 8 классе
Автор: edu1
Методическая копилка — Химия
Разработка урока по теме: «Типы химических реакций.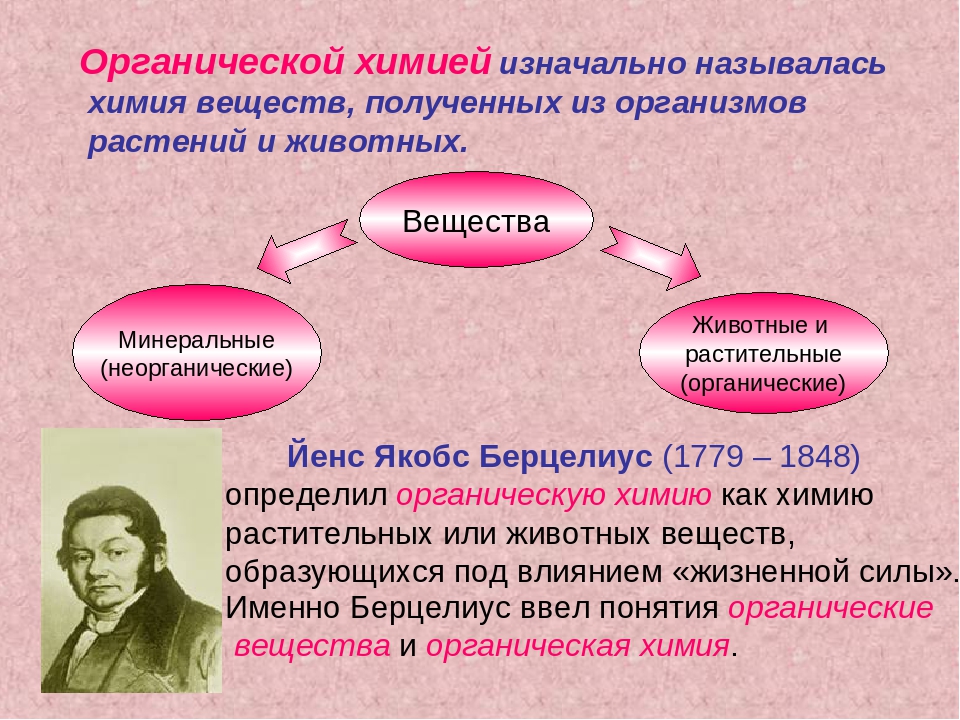 Реакции обмена.» 8 класс
Реакции обмена.» 8 класс
Цели урока:
Образовательная—
актуализация знаний обучающихся о типах химических реакций, классификации веществ, номенклатуре основных классов неорганических соединений, введение понятия о реакциях обмена, их значимости в повседневной жизни человека.Развивающая – развитие научного мышления обучающихся через установление причинно-следственных связей, эксперимент и анализ эмпирических данных, умений анализировать результаты наблюдаемых опытов.
Воспитательные-формирование исследовательской компетенции обучающихся при изучении типов химических реакций.
Задачи:
1) обобщить и систематизировать знания о типах химических реакций, закрепить умения составлять уравнения химических реакций и расставлять коэффициенты в уравнениях химических реакций.
2) сформировать комплекс общеучебных познавательных умений — логически мыслить, анализировать, сравнивать, обобщать, делать выводы, аргументировать и отстаивать свою точку зрения.
3)совершенствовать коммуникативные и организационные умения (правильное использование химической терминологии и символики, потребности вести диалог, выслушивать оппонента, способности открыто выражать и аргументированно отстаивать свою точку зрения).
Место урока в школьном курсе: урок изучается в разделе «Изменения, происходящие с веществами», является последним из типов химических реакций, изучаемых в этом разделе.
Планируемые результаты:
урок должен помочь обучающимся 8 класса сформировать следующие универсальные учебные действия:
1)Личностные УУД: определиться в выборе индивидуальных образовательных потребностей; научиться общаться со сверстниками, отстаивать свою точку зрения в процессе беседы, показывать свою убежденность в вопросах значения химических знаний в повседневной жизни; оценивать жизненные ситуации и поступки с точки зрения общечеловеческих норм.
2)Регулятивные УУД: организовывать свое рабочее место под руководством учителя; определять цель и составлять план выполнения задания; развивать практические навыки и умения при решении повседневных проблем связанных с химией.
3)Познавательные УУД: научиться выполнять творческие задания для самостоятельного получения и применения знаний; устанавливать причинно-следственные связи; выдвигать гипотезы и обосновывать их; формулировать проблемы.
4)Коммуникативные УУД: участвовать в диалоге на уроке и в жизненных ситуациях; сотрудничать с одноклассниками в поиске и сборе информации; принимать решения и реализовывать их; точно выражать свои мысли.
Форма учебного процесса: классный урок.
Тип урока: комбинированный.
Оборудование: мультимедийный проектор, электронная презентация, экран, карточки с заданиями, оценочные карты, рефлексивные карты, демонстрационное оборудование (штатив с порбирками, пробиркодержатель, растворы соляной кислоты, серной кислоты, гидроксида натрия, хлорида бария, карбонат натрия, индикатор), чёрный и белый экраны, фишки)
Хронометраж урока:
- Организационный момент ……………………………… 1 мин.

- Актуализация опорных знаний ………………………… 3 мин.
- Мотивация знаний ………………………………………..2 мин.
- Изучение нового материала …………………………….. 15 мин. (физкультминутка)
- Первичное закрепление знаний ………………………… 4 мин.
- Рефлексия ………………………………………………….3 мин.
- Подведение итогов урока.
Информация о домашнем задании …………………….. 2 мин.
Ход урока.
I. Организационный момент.(1 мин)
Приветствие.
Мы – умные, мы – дружные,
Мы – внимательные, мы – старательные,
Мы отлично учимся, всё у нас получится!
II.Актуализация опорных знаний (3 мин)
Учитель:
— Эти явления знаете вы
В жизни нашей встречаются они,
А отличают эти явления – взаимные превращения,
И образуются всегда – новые вещества.
— Что же это за явления?
Обучающиеся:
— Химические реакции (слайд)
На предыдущих уроках вы познакомились с тремя типами химических реакций. По числу вступивших в реакцию веществ и, образовавшихся продуктов реакции, вспомним. «СЛАЙД 3,4»
По числу вступивших в реакцию веществ и, образовавшихся продуктов реакции, вспомним. «СЛАЙД 3,4»
III.Мотивация знаний
- Сравним уравнения химических реакций. «СЛАЙД 5»
- Fe + H
- FeO + H2SO4 → FeSO4 + H2O
- Как вы думаете, в чём проявляется сходство и различие этих уравнений химических реакций? (Сходства: одинаковое количество исходных веществ и продуктов реакции, продуктом является соль,
- Fe + H
Различия: исходными веществами одной из реакций являются сложные вещества-2, а другой — простое и сложное вещество (1), реакции относятся к разным типам.)
Обратили вы внимание на состав веществ?
Что происходит во втором случае? (обмен составными частями)
Совершенно верно происходит обмен.
Сформулируйте тему урока?
Записать тему урока в тетради. «СЛАЙД 6»
«СЛАЙД 6»
IV. Сообщение нового материала.
Попробуйте сформулировать определение реакций обмена? Если вы испытываете затруднения, обратитесь к тексту параграфа 32 на с. 165.
«СЛАЙД 7» (записать в тетрадь)
Проведём с вами небольшой эксперимент. Я называю вещества, а вы записывайте в тетрадь формулы веществ и составляете уравнения химических реакций, которые я буду демонстрировать!
Демонстрационный опыт №1 «Взаимодействие соляной кислоты с карбонатом натрия».
К какому классу соединений относится кабонат натрия?
«СЛАЙД 9» Вспомним правила техники безопасности при работе с кислотами.
Назвать признак химической реакции? (выделение пузырьков газа). Какой это газ?
Записать уравнение химической реакции (1 обучающийся у доски, остальные в тетради). «СЛАЙД 10»
Как мы обозначим выделение газа?
Демонстрационный опыт №2 «Взаимодействие раствора гидроксида натрия с сульфатом меди».
«СЛАЙД 11»
Каким был раствор сульфата меди? Что произошло после того, как я добавила раствор гидроксида натрия
Расставьте коэффициенты в уравнении химической реакции, назовите образовавшиеся соединения:
CuSO4 + NaOH → Cu(OH)2↓+ Na2SO4
Cu(OH)2 + HCl → CuCl2 + H2O
По какому признаку вы определили, что протекает химическая реакция?(образовался осадок голубого цвета)
Записать уравнение химической реакции на доске.
Демонстрационный опыт №3 Взаимодействие серной кислоты с раствором хлорида бария.
«СЛАЙД 13»Назовите признак, по которому вы определили, что химическая реакция произошла? (Выпадение осадка белого цвета).
Как узнать, выпадет осадок или нет в результате реакции обмена?
Работа с таблицей растворимости на форзаце учебника. !!!
-Необходимо вспомнить определение такого класса неорганических соединений, как СОЛИ?
Демонстрационный опыт №4 Взаимодействие соляной кислоты с раствором гидроксида натрия в присутствии индикатора – фенолфталеина.
ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие следить за составом среды или за протеканием химической реакции
Физкультминутка
Если выделится газ-
Это раз;
И получится вода —
Это два;
А еще — нерастворимый
Осаждается продукт…
«Есть осадок», — говорим мы.
Это третий важный пункт.
Химик «правила обмена»
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
Давайте подумаем!!! Где в быту мы встречаемся с реакциями обмена?
«СЛАЙД 13»
- Разрыхлители теста.
- Определение качества воды.
- Устранение жесткости воды.
- Определение качества продуктов питания.
- Определение массовой доли уксусной кислоты в ее растворе.

И это далеко не полный перечень областей применения реакций обмена. Т.Е сделайте вывод: жизнь современного человека немыслима без реакций обмена!!!
|
№ |
Реагенты |
Продукты реакции |
Признак протекания химической реакции |
|
1 |
HCl + Na2СO3→ |
NaCl + H2СO3 (СО2↑+ Н2О) |
выделение газа |
|
2 |
HCl+ Сu(OH)2 → |
CuCl2 + H2O |
образование воды |
|
3 |
H2SO4 + BaCl2 → |
HCl + BaSO4 ↓ |
выпадение осадка |
|
4 |
NaCl+ H2SO4→ |
→ ? + ? |
Будет идти реакция? |
V. Закрепление изученного материала.
Закрепление изученного материала.
«СЛАЙД 14» Работа в парах с последующей взаимопроверкой. «СЛАЙД 15»
Кто может нам объяснить?
Кто справился с заданием без ошибок? (поднимите руку.)
Кто из вас испытал затруднения при выполнении? Почему?
Молодцы ребята!
VI. .Подведение итогов. Рефлексия
- Написано на доске:
- «Суди себя сам. Это самое трудное. Себя судить куда труднее, чем других. Если ты сумеешь правильно судить себя, значит ты поистине мудр.»
Релаксация. Закройте глаза и вспомните приятные моменты нашего урока. Я рада, что на протяжении всего урока вы были внимательны. Я хочу, чтобы все, кто работал хорошо – улыбнулись мне, а кто чувствует в себе потенциал работать ещё лучше – поаплодировали себе.
- У вас на столе лежат карты, для анализа нашего с вами урока. Предлагаю вам заполнить карту, для того, чтобы………………..для этого вы можете воспользоваться выражениями, указанными на слайде презентации «СЛАЙД 18»
|
Плюс (что понравилось на уроке) |
|
|
Минус (что не понравилось, непонятно) |
|
|
Интересно (любопытно, что ещё хотелось бы узнать) |
VI. Домашнее задание. (инструктаж по его выполнению).
Домашнее задание. (инструктаж по его выполнению).
§32, № 2-5 с.168
«Исследовательская работа»
1.Запишите формулы химических веществ, которые применяются в быту:
- Уксус-
- Пищевая сода-
- Кальцинированная сода-
- Медный купорос-
- Марганцовка-
- Хлористый кальций-
- Магнезия жжёная-
- Аккумуляторная кислота-
2.Проведите реакции между веществами:
|
Нужно взять |
Наблюдение |
Идет ли реакция? |
Уравнение реакции |
|
1. Железный гвоздь и раствор медного купороса |
|||
|
2. |
|||
|
3. Сода + уксус |
|||
|
4. Сода + хлористый кальций (апт.) |
|||
|
5.Монетка + р-р поваренной соли |
Информационные ресурсы
- Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М.: Дрофа, 2009.
- Габриелян О.С. Учебник для общеобразовательных учреждений. Химия. 8 класс. М.: Дрофа, 2009.
- Габриелян О.С., Воскобойникова Н.П., Яшукова А.
 В. Настольная книга учителя. 8 класс. М.: Дрофа, 2007.
В. Настольная книга учителя. 8 класс. М.: Дрофа, 2007. - Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001.
Физкультминутка «Реакции обмена»
Слоганы
Упражнения
Реакции обмена
Правое плечо вверх — вниз;
Вы словно перемена.
Левое плечо вверх – вниз.
Их признаки запомним навсегда!
Руки к плечам согнутые в локтевом суставе и повороты в плечевом суставе вперед – назад;
Нам газа запах сладок,
Руки вверх – 2 раза;
И выпавший осадок,
Руки вниз – 2 раза;
И абсолютно новая вода!
Руки согнуты в локтях впереди, вращение в локтевом суставе вперед и назад.
Физкультминутка « Периодическая система»
Слоганы
Упражнения
Раз – два – руки в горизонтали,
Обе руки в горизонтальной плоскости одновременно вправо – влево;
Три – четыре – руки по вертикали.
Обе руки одновременно резким движением поднимаются вверх и опускаются вниз.
Помни, период – это горизонталь,
Руки на пояс, наклоны туловища вправо и влево;
Ну а группа – это вертикаль!
Руки на пояс, прыжки на месте.
Домашнее задание
«Исследовательская работа»
1.Запишите формулы химических веществ, которые применяются в быту:
- Уксус-
- Пищевая сода-
- Кальцинированная сода-
- Медный купорос-
- Марганцовка-
- Хлористый кальций-
- Магнезия-
- Аккумуляторная кислота-
2.Проведите реакции между веществами:
|
Нужно взять |
Наблюдение |
Идет ли реакция? |
Уравнение реакции |
|
1. |
|||
|
2. Заварить крахмал + йод |
|||
|
3. Сода + уксус |
|||
|
4. Сода + хлористый кальций (апт.) |
|||
|
5.Монетка + р-р поваренной соли |
Признаки протекания химических реакций
|
Реагенты |
Продукты реакции |
Признак протекания химической реакции |
|
|
1 |
|||
|
2 |
|||
|
3 |
|
реакции соединения |
реакции разложения |
реакции замещения |
реакции обмена |
Рефлексия
|
Плюс (что понравилось на уроке) |
|
|
Минус (что не понравилось, непонятно) |
|
|
Интересно (любопытно, что ещё хотелось бы узнать) |
__Фамилия Имя___________________________________________________
Бланк ответов
Задание 1
Задание 2
Задание 3
Задание для самостоятельного выполнения
|
Оценка |
Открытый урок химии в 8 классе на тему «Типы химических реакций» | Официальный сайт МОУ СОШ №7 г.
 Коряжмы
КоряжмыАвтор: Нагишева Ольга Викторовна, учитель химии МОУ «СОШ №7».
Цели урока:
деятельностная: сформировать познавательные универсальные учебные действия при изучении типов химических реакций.
предметно-дидактическая: сформировать понятия: реакции соединения, реакции разложения, реакции замещения, реакции обмена; сформировать знание о признаках химических реакций, научить определять тип реакции по числу и составу продуктов и реагентов реакции.
Планируемые образовательные результаты урока
личностные: убеждаются в познаваемости мира.
метапредметные:
регулятивные: умение планировать и регулировать свою деятельность, владение основами самоконтроля и самооценки;
коммуникативные: готовность получать необходимую информацию, продуктивно взаимодействовать со своими партнерами и учителем;
познавательные: умение определять понятия, устанавливать аналогии, строить логические рассуждения и делать выводы, производить поиск информации, анализировать и оценивать её достоверность.
предметные: знать определения «типы химических реакций», «признаки классификации реакций», «реакции соединения, разложения, замещения, обмена», «закон сохранения массы веществ».
Тип урока:
1. По ведущей дидактической цели: урок изучения нового материала, последовательного изучения ключевых вопросов темы.
- По способу организации: синтетический урок
- По ведущему методу обучения: проблемный урок
Метод обучения: самостоятельная работа, работа с карточками, взаимоконтроль
Основные вопросы урока:
- Типы химических реакций по числу и составу продуктов и реагентов
- Реакции соединения.
- Реакции разложения.
- Реакции замещения.
- Реакции обмена.
Оборудование: учебник, карточки, презентация
Ход урока:
Организационный момент
— Добрый день! Всё, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. И задача человека, изучив этот мир, постараться использовать полученные знания во благо.
— Сегодня мы продолжим знакомство с этим удивительным и волшебным миром.
-О чем же пойдет речь на сегодняшнем уроке?
-Чтобы ответить на этот вопрос, попробуйте отгадать загадку: » Она идет, она прошла, никто не скажет, что пришла. Она (химическая реакция).
Актуализация
На доске корзина “Химические реакции”
— Ребята, чтобы отправиться дальше в страну знаний, нам с вами необходимо взять с собой багаж. На доске перед вами корзина «Химические реакции». Она пуста. Давайте заполним ее.
-Что мы знаем о химических реакциях? (говорят мнения, учитель прикрепляет над корзиной таблички с вариантами ответов:
— Итак, что такое химические реакции — это превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции).
— Как мы можем отразить химическую реакцию на письме? (с помощью химического уравнения)
— А что такое химическое уравнение? В чем отличие от реакции? (запись химической реакции с помощью формул и математических знаков)
— Какой закон мы используем при составлении химического уравнения? (закон сохранения массы веществ)
— Сформулируйте этот закон (Масса веществ вступивших в химическую реакцию равна массе веществ, образовавшихся в результате ее)
— Кто открыл закон сохранения массы веществ? (М.В.Ломоносов в 1748г)
— Как закон сохранения массы отображается в уравнении? (уравниваем с помощью коэффициентов)
— Скажите, какими признаками сопровождаются химические реакции? (образование осадка или газа, изменение цвета, выделение или поглощение теплоты, появление запаха)
— Ребята, мы с вами разобрали понятие химические реакции.
— Сегодня, по мере выполнения заданий, баллы за правильные ответы вы заносите в оценочные листы . В конце урока, мы подсчитаем сумму баллов, и вы получите отметки за работу на уроке. Напишите фамилию и имя на листах.
В конце урока, мы подсчитаем сумму баллов, и вы получите отметки за работу на уроке. Напишите фамилию и имя на листах.
Работа у доски
На доске написаны реакции. Учитель вызывает к доске 2 учащихся и предлагает выполнить задание.
— Вспомним, как реализуется закон сохранения массы веществ в химических реакциях.
Задание. Расставить коэффициенты и объяснить.
- Al + CuCl2 → AlCl3 + Cu
- N2 + O2 → NO
- P + O2 → P2O5
- NaOH + H3PO4 → Na3PO4 + H2O
- H2O → H2 + O2
- Al2O3 + HCl→ AlCl3 + H2O
- KOH +H2SO4 → K2SO4 + H2O
- Al + O2 → Al2O3
2 ученика работают у доски, уравнивая по 4 реакции
— Остальным учащимся предлагаю выполнить задание на карточке №1, ответив вопрос:
Карточка №1
Выполняется ли закон сохранения массы в следующих схемах химических реакций? (Нужно ответить ДА или НЕТ)
|
Схемы химических реакций |
Да/Нет |
|
1. Ca + Cl2→ CaCl2 |
|
|
2. 2C + O2 → 2CO |
|
|
3. Fe(OH)2 → FeO + H2O |
|
|
4. CaCO3 → CaO + CO2 |
|
|
5. 2Zn + HCl → ZnCl2 + H2 |
|
|
6. Fe + CuCl2 → Cu + FeCl2 |
|
|
7. АgNO3 + NaCl → AgCl + NaNO3 |
|
|
8. Na2SO4 + BaCl2 → NaCl + BaSO4 |
Учитель проверяет выполненные задания. Ответы на карточку №1 написаны на слайде.
Учащиеся сверяют свои ответы с эталоном (ответы «да» или «нет»)
— У всех совпало с ответом?
— Почему в некоторых уравнениях закон не сохраняется? (учитель выводит на экран схемы с коэффициентами, учащиеся определяют ошибки)
— Посчитайте количество правильных ответов и занесите в лист. 1 уравнение – 1 балл (максимально – 4 баллов)
— Посмотрите, пожалуйста, на уравнения реакций на доске. Найдите ошибки, если есть.
Изучение нового материала
Учитель предлагает решить проблему: почему в срезанных вечером зеленных культурах (салат, петрушка, укроп и др.) содержится больше питательных веществ, чем в срезанных их в утреннее время? (Зная условия протекания реакций фотосинтеза. Можно утверждать, что к вечеру происходит максимальное накопление углеводов в листьях, а к утру они частично расходуются на процесс дыхания. Вечерняя зелень полезнее утренней.)
— В природе существует огромное число реакций. Как же удержать в памяти всё это многообразие и ориентироваться в нем?
Учитель напоминает учащимся о многообразии живых организмов, о разнообразии видов растений и животных
Вопрос классу: как поступали ученые — биологи в подобном случае? (Ученики вместе с учителем вспоминают основы классификации и систематики видов животных и растений. Приводят примеры.)
ΙΙ. – Итак, в любой науке применяется метод классификации, позволяющей по общим признакам разделить всё множество объектов на группы. (Учащиеся вспоминают, что им известно о классификации простых веществ по свойствам на металлы и неметаллы)
- 1. Что может помочь нам в изучении многообразия химических реакций? (Классификация химических реакций)
- 2. Что такое классификация? (Деление на группы)
- 3. Верно. Так что же будет являться целью нашего сегодняшнего урока? (Изучение типов химических реакций и их классификация)
Учитель. Используя эти знания, мы сегодня продолжим изучать химические реакции и познакомимся с типами химических реакций и их классификацией.
Запишите тему урока в тетрадь (открывается тема урока)
(учащиеся записывают это в тетрадях.)
На экране появляется, на котором представлены несколько химических реакций:
2H2 + O2 -> 2H2O; CaO + H2O -> Ca(OH)2 Cu(OH)2 -> CuO + H2O; 2HgO -> 2Hg + O2
— можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
— различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
Введение понятия реакции соединения.
Обсуждаются вопросы:
— что объединяет все эти реакции? — в чём их отличие?
— как одним словом мы можем назвать процесс, который протекает?
Учащиеся приходят к выводу, что идет процесс соединения веществ (реакции соединения), но в первом и втором случаях вступают в реакцию простые вещества, в третьем и четвертом — сложные вещества. Во всех реакциях образуется одно сложное вещество.
Учитель предлагает учащимся попытаться вывести определение этого типа реакций (наиболее подготовленные учащиеся делают это легко) и, используя буквы А, В, С, вывести уравнение реакции соединения в общем виде:
A + B -> AB AB + CB -> AB2C
Введение понятий реакции разложения, замещения, обмена.
По такой же схеме, как и реакции соединения, изучаются реакции разложения, замещения, обмена.
После изучения всех типов реакций проводится обобщение материала. Итак, мы узнали, как классифицируют химические реакции.
соединения разложения замещения обмена
— А сейчас откройте учебник на стр.41. (Схема «Типы химических реакций»). Посмотрите, пожалуйста, на схему. В ней описаны типы химических реакций, написаны примеры уравнений каждого типа. На протяжении урока вы будете работать с этой таблицей.
Закрепление
1.1.. Работают с уравнениями реакции предложенными учителем( у всех групп одинаковые), каждая группа работает по принципу оформления своих уравнений на листах при помощи картинок или рисунков и записи уравнений, предложенных учителем.
Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы реакций
Карточка №2
|
Тип реакции |
Уравнение реакции |
|
а) |
а) CuCl2 + Zn → |
|
б) |
б) Cu(OH)2 → |
|
в) |
в) KI + Pb(NO3)2 → |
|
г) |
г) Ca + O2 → |
1.2. Презентация работ учащимися
1.3. Оценивание группами по очереди друг друга.
Раздает и поясняет задания, помогает, группам справиться с работой
Если определили правильно, то ставим себе 8 баллов (4 –за написание 4-х уравнений, 4 –за схемы).
2. Найдите ошибки в предложенных реакциях, укажите их количество и исправьте (работа индивидуальная)
а) H2 + O2 = H2O – реакция соединения
б) 2KCl + AgNO3 = KNO3 + AgCl↓ – реакция обмена
в) Mg(OH)2 + HNO3 = Mg(NO3)2 + 2H2O – реакция обмена
г) Cu + HCl = CuCl2 + H2 – реакция замещения
д) FeCl3 + 3NaOH = Fe(OH)3 +3NaCl – реакция замещения
е) Na2O + H2O = 2NaOH — реакция замещения
— Обменяйтесь карточками, проверьте ответы одноклассников по образцу. Посчитайте баллы 1 уравнение – 1 балл ( всего -6 баллов)
— Занесите баллы в оценочный лист и подсчитайте общую сумму баллов и определите отметки за урок.
Учитель выводит критерии отметок:
18-15 баллов – отметка «5»
14-11 баллов – отметка «4»
10-7 баллов – отметка «3»
— Поднимите руку, у кого «5». А «4» есть?
Подведение итога и рефлексия
Учитель подводит итог урока
— Ребята, как вы думаете, достигли ли мы цели урока?
— Сможете ли вы по числу и составу реагентов и продуктов определить тип химической реакции?
— Сейчас еще раз проверим. О каких реакциях идет речь?
Зачитываются загадки.
Ты было сложным, я простым, мы встретились однажды,
В тебе я атом заместил, мы подружились даже.
И сразу изменился мир: я сложным стал, а ты простым. (замещения)
Нас было много, мы соединились,
В одно большое вместе превратились.
Такое процесс объединения – реакция … (соединения)
Когда два сложных вещества в реакцию вступают,
Меняются фрагментами (себя не обижают),
И происходят с ними тут простые перемены
Такой процесс мы назовем реакцией … (обмена)
Домашнее задание: п.16 –всем,
На оценку «5» — из учебника выписать по 3 примера на каждый тип реакции,
на оценку «4» — из учебника выписать по 2примера на каждый тип реакции,
на оценку «3» — из учебника выписать 1 пример на каждый тип реакции
Перед уходом детей учитель предлагает учащимся проанализировать свое эмоциональное состояние:
— Сдайте, пожалуйста, оценочные листы.
— Спасибо за работу на уроке!
Химия 8 класс ФГОС Программа Оржековского П.А 68 часов (2 часа в неделю) | |||||
| ♦ Уроки 1-10 | ♦ Уроки 11-22 | ♦ Уроки 23-34 | ♦ Уроки 35-46 | ||
| |||||
| ♦ Уроки 1-10 | |||||
| Тема 1. Первоначальные химические понятия. На изучение темы 25 часов. | |||||
| Урок 1. Введение. Предмет химии. | |||||
| Урок 2. Практическая работа № 1. | |||||
| Урок 3. Построение теоретических знаний. | |||||
| Урок 4. Чистые вещества и смеси. Методы разделения и очистки веществ. | |||||
| Урок 5. Урок закрепления и применения знаний и умений. | |||||
| Урок 6. Характеристика химических реакций. | |||||
| Урок 7. Сущность химической реакции. Закон сохранения массы веществ. | |||||
| Урок 8. Развитие представлений о простом и сложном веществе. Химические элементы. Знаки химических элементов. | |||||
| Урок 9. Массовая доля элемента в веществе. Закон постоянства состава. | |||||
| Урок 10. Относительные атомные массы химических элементов. | |||||
| ♦ Уроки 11-22 | |||||
| Урок 11. Относительная молекулярная масса вещества. Закон Авогадро. | |||||
| Урок 12. Химическая формула | |||||
| Урок 13. Валентность химических элементов. | |||||
| Урок 14. Валентность химических элементов | |||||
| Урок 15. Названия веществ (номенклатура веществ). | |||||
| Урок 16. Молярная масса вещества. | |||||
| Урок 17. Урок закрепления и применения знаний и умений. | |||||
| Урок 18. Урок закрепления и применения знаний и умений. | |||||
| Урок 19. Уравнения химических реакций | |||||
| Урок 20. Урок закрепления и применения знаний и умений. Уравнения химических реакций. | |||||
| Урок 20. Расчет количества вещества по уравнению реакции. | |||||
| Урок 21. Обобщение учебного материала. | |||||
| Урок 22. Контрольная работа № 1 «Первоначальные химические понятия». | |||||
| ♦ Уроки 23-34 | |||||
| Тема 2. Вещества и их превращения. На изучение темы 16 часов. | |||||
| Урок 23. Становление в науке представлений о простых веществах-металлах и неметаллах. | |||||
| Урок 24. Металлы в природе. Первоначальные представления о химических свойствах металлов. | |||||
| Урок 25. История открытия кислорода. Состав воздуха. | |||||
| Урок 26. Аллотропные модификации кислорода. Получение кислорода и озона. | |||||
| Урок 27. Химические свойства кислорода. Применение кислорода. | |||||
| Урок 28. Практическое занятие № 2. Получение кислорода и изучение его свойств. | |||||
| Урок 29. Урок закрепления и применения знаний и умений. | |||||
| Урок 30. Расчеты по уравнению химической реакции. | |||||
| Урок 31. Урок закрепления и применения знаний и умений. | |||||
| Урок 32. История открытия водорода. Получение и физические свойства водорода. | |||||
| Урок 33. Химические свойства водорода. Применение водорода. | |||||
| Урок 34. Практическое занятие № 3. Получение водорода и изучение его свойств. | |||||
| ♦ Уроки 35-46 | |||||
| Урок 35. Углекислый газ. | |||||
| Урок 36. Оксид и гидроксид кальция. Свойства и применение. | |||||
| Урок 37. Повторение и обобщение темы. | |||||
| Урок 38. Контрольная работа № 2. | |||||
| Тема 3. Классы неорганических веществ . На изучение темы 14 часов. | |||||
| Урок 39. Кислотные оксиды. | |||||
| Урок 40. Кислоты. | |||||
| Урок 41. Классификация кислот. особые свойства некоторых кислот. | |||||
| Урок 42. Основные оксиды. | |||||
| Урок 43. Основания. | |||||
| Урок 44. Реакция нейтрализации. Соли. | |||||
| Урок 45. Химические свойства солей. | |||||
| Урок 46. Растворы. Массовая доля растворенного вещества. | |||||
| ♦ Уроки 47-58 | |||||
| Урок 47. Классификация неорганических веществ. | |||||
| Урок 48. Генетическая связь между классами неорганических веществ. | |||||
| Урок 49. Урок закрепления и применения знаний и умений. | |||||
| Урок 50. Практическое занятие № 4. Решение экспериментальных задач по теме «Свойства основных классов веществ». | |||||
| Урок 51. | |||||
| Урок 52. | |||||
| Тема 4. Периодический закон и периодическая система Д.И. Менделеева. На изучение темы 12 часов | |||||
Из опыта преподавания пропедевтического курса химии «Химическая азбука» в 5 классе
Случилось так, что волею судьбы я несколько лет тому назад была поставлена в ситуацию преподавания пропедевтического курса химии в 5, 6 и 7 классах. До этого мне приходилось вести пропедевтику химии только в 7 классе, используя в качестве УМК линию О.С.Габриеляна, а вот в пятом классе – нет. Радовало меня только то, что интересующая область знаний достаточно широко была представлена в курсе «Природоведения» 5 класса Андреевой Аллы Евгеньевны (А.Е.Андреева. Природоведение. 5 класс. Учебник для общеобразовательных учреждений. Под редакцией Д.И.Трайтака, Н.Д.Андреевой, изд-во «Мнемозина», 2008).
Я понимала, что пропедевтический курс по химии– это то, что интересно мне, а значит, будет интересно и детям, что это та платформа, которая даст мне возможность разработать пропедевтический развивающий курс «Химическая азбука», планы о котором я вынашивала долгие годы работы в школе. У меня появилась уверенность в том, что идея осуществима, и почти сразу же опыт преподавания химии в пятом классе.
У многих специалистов в этой области, при общении со мной на тему пропедевтики в 5-7 классах, возникает первый вопрос такой: «А чем ваш курс отличается от других?»
Для того, что бы понять это, давайте рассмотрим методические проблемы химического образования:
— изучение химии начинается с 8 класса, тогда, когда интерес к процессу познания окружающего мира существенно снижается и на первое место выходит интерес к процессу социализации;
— перегруженность новыми элементами знаний в I триместре курса «Химия-8» и как следствие, психологический барьер у детей: «Не пониманию, не хочу, не буду»;
— Считается, что химия – экспериментальная наука, следовательно, нужно, как можно больше, показывать детям опытов, а химическую символику и номенклатуру они освоят в процессе практической деятельности.
Результат: детям нравятся опыты, но записать то, что они наблюдают при этом химическими символами для большинства из них остаётся большой проблемой.
Любой язык и его буквенная символика, русский, английский и химический, в том числе, требует времени для усвоения, понимания, осмысления.
Русскую азбуку дети начинают осваивать в 3-4 года, математическую «азбуку»- символику — в 3-4 года, английскую азбуку – 6-7 лет, а то и раньше, реже в 10 лет.
Понятия химической азбуки – нет, но есть химический язык, тот же знаковый символический аппарат…
Продолжительность изучения предметов в школе: русский язык, математика, английский язык – 10- 12 лет, а химия – 4 года.
Результат методики преподавания химии нам всем хорошо известен…
Вывод: если большая часть учащихся в классе не усваивает новые элементы знаний, то это проблема не только учителя и детей, а и методистов тоже.
Чем же мой курс отличается от других? Отвечаю: «Номенклатурным подходом. А по содержанию мало чем. Да я и не ставила такой цели: блеснуть оригинальностью. Здесь, главное разгрузить программу химии 8 класса и сформировать знание химической символики, понять предназначение таблицы Д.И.Менделеева и научить ориентироваться в ней».
Второй вопрос специалистов в этой области: «А зачем вам это надо?»
«Повторяю. Я была вынуждена этим заниматься, поскольку была поставлена в условия работы в школе с углубленным изучением химии и биологии, и пропедевтика химии стояла в учебном плане как самостоятельный учебный предмет».
Сейчас я благодарю за это судьбу и людей, с которыми мне пришлось сотрудничать на тот период времени, потому что главное, что я вынесла из этого «проекта», так это то, что химию, как и любую другую науку, можно преподавать, начиная с любого возраста, и главное здесь, не что, а как.
Так реально ли изучать химию, например со второго класса? Реально! Только опять же главное, — не что изучать, а как изучать!
Здесь важно знание возрастных особенностей детей и использование приемлемых методов обучения («метод от слабого к сильному и обратно», «метод нескольких попыток», «метод добровольности», «метод упорядочения по степеням сложности» и т.д.)
Успешному решению данной задачи помогают различные по форме и по содержанию уроки: урок – сказка, урок – путешествие, урок – загадка, урок – игра, урок – исследование, урок – открытие нового знания, урок – викторина, урок – концерт, практическая работа в парах или группах.
Сложно ли учащимся 5 класса, спрошу я вас, построить шаро-стержневую модель циклической формы молекулы глюкозы или молекулу бензола с помощью конструктора? Что вы, это для них легко! Мы с ними строили даже фрагмент белковой молекулы из 10-15 аминокислот. Сколько радости у ребят бывает, когда каждый из них делает частичку труда их общего дела. А это уже та ситуация, в которой предстоит жить и работать нынешним ученикам: «знания стали «производиться» большими коллективами людей, нуждающихся в средствах организации, сотрудничества, также и с теми, кому адресованы результаты труда». То есть, одна из задач ФГОС решается при выполнении этого задания достаточно успешно!
Учащиеся 5 класса вполне успешно могут усвоить теорию относительности с помощью мультфильма «38 попугаев» Бориса Заходера в постановке Ивана Уфимцева и научиться определять по таблице Д.И.Менделеева относительную атомную массу химических элементов и относительную молекулярную массу соединений, рисовать схему строения атома и записывать формулу состава атома. Они с огромным нетерпением ждут практических работ и с удовольствием овладевают навыками измерения массы вещества, объёма воды, получения раствора, выпаривания, кристаллизации веществ и т.д. И всё это для них имеет большую значимость, чем для восьмиклассников. Поверьте мне. Я не перестаю удивляться, как мы химики могли прошляпить такой плодотворный возраст, 10-11 лет, когда интерес к науке, знаниям вообще, и способность к развитию являются физиологической потребностью детей. А в 14-15 лет возникают совсем другие физиологические потребности…
Программа пропедевтического развивающего курса «Химическая азбука» для учащихся 5 классов рассчитана на изучение предмета один раз в неделю, 34 часа в год и включает в себя 6 тем:
- «Химическая азбука»,
- «Химический эксперимент»,
- «Строение атома»,
- «Вещества. Смеси веществ»,
- «Отличие физических и химических явлений»
- «Химия на службе человека»
Повторюсь, что особенностью данного развивающего курса является то, что он включает в себя химический тренинг по закреплению знаний химической символики. 30 символов химических элементов в процессе различных игр заучиваются наизусть по-русски, по-латински и так, как символ произноситься при чтении химической формулы. Под данную программу я разработала рабочую тетрадь (программу действий) для учащихся.
Этот курс 5 класса имеет продолжение в 6 классе под названием «Азбука химических соединений».
А что в 7 классе?.. Возможны такие варианты программ:
- Чернобельская Г.М., Дементьев А.И. Введение в химию: Мир глазами химика. 7 класс. Учебное пособие для общеобразовательных учерждений. М.: Владос, 2003.
- О.С. Габриелян, И.Г. Остроумов. Введение в химию. Вещества.7 класс: Учебник для общеобразовательных учреждений. М.: «Сиринъ према», 2006.
- Н.Е.Дерябина. Введение в химию. 7 класс. Учебник — тетрадь.
Моя задумка – «Азбука химических реакций».
Главное! Весь курс с 5 до 7 класса должен быть концентрический, т.к. «Повторение — мать учения».
химия может уйти из старших классов — Российская газета
Может ли виртуальная реальность заменить реальные колбы и пробирки? Как изменится ЕГЭ по химии? Почему этот предмет рискует исчезнуть из старшей школы? Самые острые проблемы обсуждались на Всероссийском съезде учителей и преподавателей химии в МГУ имени М.В. Ломоносова.
Нынешний год официально назван в честь Периодической таблицы химических элементов: открытые уроки, лекции, яркие эксперименты… Школьников и студентов ждет масса «активностей». А специалисты тем временем бьют тревогу: уровень базовой химической грамотности у старшеклассников ухудшается из года в год. Сухие цифры: 40 процентов десятиклассников не смогли набрать больше 10 баллов во время исследования качества образования, которое проводил Рособрнадзор. Максимально возможный балл — 52 — не набрал вообще никто из 25 тысяч участников. А 80 процентов не смогли «перешагнуть» даже половинный рубеж. По сути, у большинства ребят была или «двойка», или вообще «кол».
— Я была экспертом и проверила около восьми тысяч ответов, — рассказывает доцент Нижегородского института развития образования Лидия Асанова. — К сожалению, официальные результаты полностью совпали с моими впечатлениями. Картина нерадостная. Школьники ошибаются при нахождении молярной массы вещества, переводе массы из килограмма в граммы, сравнении отрицательных температур. У многих не сформированы навыки вычислений с использованием понятий «массовая доля элемента», «процент».
Причина? Сегодня в старших классах химию изучают на базовом уровне всего час в неделю, на углубленном — три часа. Ни того, ни другого, как признаются учителя, недостаточно. Но скоро и этого может не быть. По новым образовательным стандартам (ФГОС) химия у 10-11 классов станет предметом по выбору.
— Старшие классы начнут учиться по новым образовательным стандартам в 2020 году. В них химия обозначена как один из предметов естественно-научного цикла. Можно будет изучать на выбор физику, химию, биологию или естествознание, — говорит учитель школы №1505 Галина Шипарева. — ФГОС старшей школы несколько московских школ уже апробировали. В итоге уже сегодня некоторые старшеклассники химию как предмет не изучают даже на базовом уровне. Если мы здесь ничего не сделаем, химия уйдет из школы, как ушла когда-то астрономия.
К чему это может привести? Как минимум, к проблемам в вузах. К примеру, школьник изучает профильную математику и физику, сдает по ним ЕГЭ, а химию «задвинул» подальше. В техническом вузе, куда он поступит, от курса химии ему все равно не уйти. Причем вузовская программа не делает скидку на то, кто какой ЕГЭ сдавал. Поступил? Покажи хорошую базовую подготовку. Не «тянешь»? Отчисляйся…Проблемы появляются и с другими предметами. Для медицинских вузов, например, все типичнее картина, когда сдававшие биологию и химию школьники сильно «проседают» по физике.
Что делать? Возможно, ситуацию удастся выправить. В 2019 году в министерстве просвещения должна быть утверждена концепция преподавания химии в школе. Кроме того, новые образовательные стандарты в этом году снова серьезно обновятся: в них будет предельно ясно прописано, что и в каком классе должен знать ученик.
Вслед за принятой концепцией преподавания химии, за образовательными стандартами будут меняться и учебные планы, и учебники, и экзамены. В следующем учебном году, например, государственная итоговая аттестация в девятых классах будет проходить по-новому, с реальными химическими опытами.
Старшеклассники смогут выбрать, например, биологию, при этом химию не изучать даже на базовом уровне
— Одно из заданий — подтверждение химических свойств вещества, находящегося в пробирке. Ученику предложат несколько реактивов, из которых он должен выбрать те, с которыми это вещество будет реагировать. Необходимо проанализировать состав веществ, спрогнозировать их свойства, составить алгоритм действий, провести опыты и описать наблюдения, — рассказал руководитель комиссии разработчиков КИМ для ГИА по химии Дмитрий Добротин. — Причем весь эксперимент с реактивами будет проходить строго под контролем специалиста — эксперта-наблюдателя, который и будет следить за соблюдением правил техники безопасности.
Правда, и тут могут быть проблемы: в России сегодня пять тысяч школ (в основном сельских), которые не имеют химических лабораторий. И это не говоря уже об устаревшем оборудовании, о проблемах с реактивами, их низким качеством или вовсе нехваткой… Частично проблему может решить виртуальная реальность. 3D-лаборатории сейчас активно входят в образовательный процесс. Но учителя подчеркивают: без реальной практики — никуда.
— Виртуальные лаборатории — это здорово. Их можно использовать на начальном этапе, чтобы поднять мотивацию учеников, — говорит преподаватель КИРО, учитель химии гимназии №1 города Курчатова Оксана Осетрова. — Но я практик. И считаю, что ребята, которые идут на экзамен по химии осознанно, должны уметь проводить эксперимент руками, знать все оборудование и технику безопасной работы. Вместе с тем я сторонник новых технологий. Например, мы постоянно проводим онлайн-уроки с аспирантами и студентами МГУ. Это увлеченные своим делом исследователи. Дети тянутся за ними, продолжают потом общаться в соцсетях, активно интересоваться предметом. В итоге 8-9 из 25 учеников сознательно идут на ЕГЭ по химии. Это очень хорошо. И если раньше они поступали в основном в медвузы, то теперь все чаще выбирают специальности, связанные с новыми видами производства, с нефтегазовым комплексом.
Главная проблема на школьном уровне, по мнению Оксаны Осетровой, — педагогические кадры. Средний возраст учителя — «50+». Молодые приходят, но им нужны хорошие наставники. И все это на фоне того, что требования к подготовке выпускников резко возросли. ЕГЭ по химии позволяет вузам выбирать самых сильных абитуриентов со всей страны — это действительно сложный экзамен. Однако далеко не каждый педагог в силах подготовить ребенка так, чтобы он выдержал высокую конкуренцию.
— Чаще всего у ребят «проседают» физическая и органическая химия. Вызывают трудность задачи, которые требуют пространственного воображения, — говорит замдекана химфака МГУ по дополнительному образованию Владимир Миняйлов. — Еще одна «проблемная» область — практика. Надо рассказывать, как применять знания в реальных жизненных ситуациях. Организовывать экскурсии на предприятия, в научные лаборатории и классические университеты. Если же натаскивать ученика только на решение типовых задач, в отрыве от того, как они работают на практике, дети просто не будут понимать, зачем им нужен этот предмет. Сегодня они задают этот вопрос постоянно.
Соединений: Учителя (Научный путь: Общественное телевидение Айдахо)
Основы химии
Чтобы получить дополнительную информацию для учителей, взгляните на этот краткий обзор основ химии и этот краткий обзор химических соединений и связей.
В серии Tales from the Periodic Table музей Exploratorium представляет коллекцию получасовых видеороликов, показывающих, как элементы объединяются в соединения. Попробуйте просмотреть видео о соединениях натрия, водорода и углерода.
На сайтеScience Spot есть ссылки на сайты по всем темам химии, которые могут вам понадобиться.
Планы уроков и многое другое
PBS предлагает полный план урока и видео, чтобы научить студентов разнице между соединениями и смесями. Студенты узнают, что для разрыва связей в соединении необходимо химическое изменение, но смеси можно разделить с помощью физических процедур.
Также от PBS есть план урока для обучения учащихся начальной школы химическим реакциям, в которых два вещества соединяются, образуют новые связи и превращаются в третье вещество.Затем посмотрите это видео для учителей о том, как лучше всего научить учеников таким понятиям, как химические реакции, например, образование ржавчины на велосипеде. В нем исследуются неправильные представления студентов об атомах, молекулах, соединениях и реакциях и обсуждаются методы обучения, позволяющие воплотить эти концепции в жизнь.
Американское химическое общество (ACS) имеет множество ресурсов для учителей начальной и средней школы по различным темам. Ознакомьтесь с Inquiry In Action для 3–6 классов, в котором представлены обзоры химии, планы уроков, молекулярные анимации и упражнения.В программе Science Activities for Kids для 3–5 классов есть эксперименты и практические занятия, а также планы уроков по химическим реакциям. Химия средней школы предлагает полные планы уроков для 6-8 классов по различным темам химии, включая химические реакции и ионные / ковалентные связи.
Вы захотите взглянуть на сайт ACS для детей, Adventures in Chemistry, где есть разделы, посвященные экспериментам и химии таких предметов, как жевательная резинка, клей, сода и подтяжки.Для младших школьников ознакомьтесь с Азбукой химии, где вы найдете стихотворение, видео и научное задание для каждой буквы алфавита.
Американская ассоциация учителей химии разработала планы уроков для классов начальной и средней школы, включая мероприятия по изучению химических реакций и молекулярных связей.
Для 5-7 классов учителя NOVA (от PBS) разработали план урока, в котором ученики исследуют физические и химические изменения и применяют полученные знания в повседневной жизни.
Jefferson Lab имеет широкий спектр ресурсов для учителей, включая справочные материалы, практические занятия, видео и рабочие листы для использования в классе.
ВScience Kids есть планы уроков химии с экспериментами, предназначенные для обучения студентов концепциям химии с помощью забавных практических занятий. Взгляните на урок о полимерах, химических соединениях, образованных из повторяющихся групп молекул.
Science Kids: Chemistry предлагает забавные видеоролики, эксперименты и планы практических уроков, которые помогут узнать о химических соединениях и их свойствах.
Интерактивные материалы и видео
Вам понравится потрясающий интерактивный ресурс GoReact Музея науки и промышленности. Студенты становятся виртуальными химиками, объединяя атомы для создания соединений. Комбинируя атомы из периодической таблицы в зоне реакции, они узнают о свойствах элементов, наиболее распространенных химических соединениях и практическом использовании соединений, которые они создают. Более продвинутые студенты могут комбинировать атомы на основе ионных связей или точек Льюиса.Может использоваться как индивидуальное, так и групповое занятие.
Интерактивные периодические таблицы, содержащие информацию о каждом элементе и соединении, могут быть очень полезны. Найдите такие таблицы в PBS Learning Media и Jefferson Lab. Более простая версия с картинками включает в себя визуальное измерение, которое учителя могут найти полезным при знакомстве с периодической таблицей.
ионных и ковалентных связей визуально демонстрируются этой анимированной иллюстрацией того, как атомы связываются вместе, разделяя или передавая электроны.
Посмотрите интерактивное видео о соединениях и смесях на сайте BBC Bitesize. Детям понравятся звуковые эффекты, когда они попытаются создать и разорвать химические связи. Онлайн-викторина включена.
Посетите сайт учителей, посвященный химическим формулам, полный интерактивных заданий, учебных пособий и онлайн-головоломок, игр и викторин для учащихся 5-х классов и выше. Разработан, чтобы помочь студентам называть соединения, писать формулы, понимать ионные связи и знакомиться с периодической таблицей.
Learn Chemistry, образовательный веб-сайт Британского Королевского химического общества, содержит коллекцию видео для учителей, демонстрирующих способы преподавания химии ученикам начальной школы с упором на химию в повседневной жизни. Включает раздаточные материалы и учебные пособия.
Вопросы науки »5-е — Физические науки — химия и вещества
5 класс Физические науки Химия и вещества Написал:
Кристин Линдблад
Клэр Пуассонье
Ванесса Скарлетт
При вводе от:
Лани Грегори-Браун
Брендан Кэрролл
Джейми Персун
Разработано совместно с K-12 Alliance / WestEd
Все уроки физики и литература для 5-х классов можно скачать здесь
Скачать Complete Grade 5 Physical ScienceСкачать 5 класс Физические науки: химия и материя — введение и концептуальное описание в формате PDF Оценка 5 Физические науки: химия и материя
Введение и концептуальное описание
Введение: Модуль по физике 5 класса фокусируется на материи и ее свойствах.В этом модуле рассматриваются все стандарты содержания естественных наук Калифорнии для 5-го класса. К концу модуля студенты будут знать: элементы и их комбинации составляют все различные типы материи в мире, вся материя состоит из атомов, которые могут объединяться в молекулы, каждый элемент состоит из одного типа атомов и что элементы организованы в периодической таблице по своим химическим свойствам, различия в химических и физических свойствах веществ используются для разделения смесей и идентификации соединений, а изменения вещества происходят из-за нагрева, охлаждения и перемешивания.Модуль для 5 класса по физическим наукам представлен учащимся посредством серии исследований, экспериментов, активного обучения, вопросов и оценок. Оценки включают: до-, пост- и 4 формирующих оценивания.
Описание концептуального потока: Концептуальное описание потока для 5-го класса по физическим наукам: Matter основано на концепциях, представленных на концептуальной диаграмме потока, путем описания концепции (концепций), рассматриваемой в каждом уроке, и ссылок, которые соединяют каждый урок с другим. .Уроки связаны с предыдущим уроком и уроком, который следует за ним, посредством концептуальной сюжетной линии, чтобы обеспечить развитие понимания учащимися по мере того, как учащиеся переходят от одной концепции к другой.
После того, как учащиеся завершили предварительную оценку , они начинают изучение физических наук с урока 1 «Ящики для наблюдений». На этом уроке студенты узнают, что материя окружает нас повсюду и может быть описана. Студенты также узнают, что материя обладает физическими свойствами (например,g., цвет, относительный размер, форма, текстура, состав, узоры и запах), которые можно наблюдать, описывать и использовать для идентификации вещества.
На предыдущем уроке студенты узнали о наблюдаемых физических свойствах материи. В уроке 2 «Три состояния материи» студентов узнают, что физические свойства материи можно наблюдать на макро- и микроуровнях. На макроуровне твердые тела сохраняют свою форму, жидкости принимают форму своего контейнера, а газы расширяются, заполняя контейнер.На микроуровне расстояние между частицами и их движение определяют, является ли вещество твердым, жидким или газообразным. Студенты делают модели трех состояний вещества из зеленого горошка.
На уроке 2 студенты узнали, что физические свойства материи можно наблюдать. В уроке 3 «Измерение материи» студентов узнают, как измерить некоторые физические свойства материи с помощью научных инструментов: градуированного цилиндра, весов и линейки. Затем студенты будут проводить количественные наблюдения за физическими свойствами материи, такими как длина, масса и объем.
В Уроке 3 учащиеся познакомились с массой и объемом как двумя физическими свойствами материи. Плотность — еще одно физическое свойство материи. В уроке 4 «Плотность» студентов узнают, что плотность — это физическое свойство материи, которое определяется как соотношение между массой и объемом. Студенты изучают, насколько плотно молекулы вещества упакованы в заданном пространстве, на практике с коричневым сахаром. Студенты также исследуют плотность жидкостей через активность жидких слоев.
После урока 4 учащиеся выполняют Formative Assessment № 1 . Эта оценка соответствует целям обучения уроков 1–4 и предоставляет учителю, ученикам и родителям обратную связь о том, что ученики узнали в начале раздела. Учитель может использовать информацию из этого формирующего оценивания, чтобы определить, необходимы ли дополнительные инструкции для понимания учащимся концепций, представленных в Уроках 1–4, прежде чем переходить к следующему разделу модуля.
В Уроке 4 студенты узнали, что материя обладает физическими свойствами. Студенты также знают, что физические свойства могут изменяться. В уроке 5 «Физические изменения» студентов узнают, как физические свойства вещества могут изменяться, но при этом вещество остается прежним.
В Уроке 5 ученики узнали, что когда материя меняет состояние или фазу, она остается той же самой субстанцией. Когда вода меняет состояние или фазу, меняются ее физические свойства. В уроках 6 «Демонстрация кубика льда» учеников узнают, что нагрев или охлаждение (добавление или отвод энергии) может вызвать физические изменения.Материя изменяется физически во время фазового перехода, однако это все та же самая субстанция.
После урока 6 учащиеся выполняют формирующее оценивание № 2 . Эта оценка согласована с учебными целями уроков 5–6 и предоставляет учителю, ученикам и родителям обратную связь о понимании учениками фазового перехода. Учитель может использовать информацию из этого формирующего оценивания, чтобы определить, необходимы ли дополнительные инструкции для понимания учащимся концепций, представленных в Уроках 5-6.
В Уроке 6 ученики узнали, что материя может измениться и что изменение состояния — это физическое изменение. Теперь ученики узнают о другом физическом изменении: смесях и растворах. В уроке 7 «Смеси и растворы» студентов узнают о другом физическом изменении, которое может привести к получению смеси или раствора. Студенты узнают, что смеси — это основная категория, а решения — это специализированные смеси. Раствор равномерно перемешивается.
В Уроке 7 ученики узнали, что смеси и растворы можно разделять на исходные компоненты различными методами.В Уроке 8 «Записка о выкупе» учащиеся узнают, что химические и физические свойства веществ используются для разделения смесей и идентификации соединений.
После урока 8 учащиеся проходят формативное оценивание №3. Эта оценка согласована с учебными целями уроков 7–8 и предоставляет учителю, ученикам и родителям обратную связь о том, как ученики понимают смеси и решения. Учитель может использовать информацию из этого формирующего оценивания, чтобы определить, необходимы ли дополнительные инструкции для понимания учащимися концепций, представленных в Уроках 7-8.
В уроке 9 «Черные ящики» студентов связывают то, что они узнали о свойствах материи, со структурой материи. Материя обладает наблюдаемыми физическими свойствами как на макро, так и на микроуровне. Все сделано из чего-то меньшего, включая материю. Материя состоит из элементов. Способы соединения элементов образуют различные типы материи.
В Уроке 9 студенты сделали наблюдения, которые привели их к выводам о том, что находится внутри черных ящиков.В уроке 10 «Атомы: модель Бора» студентов исследуют материю на микроуровне и рассматривают основную единицу вещества — атом. Студенты узнают, что атомы состоят из протонов, нейтронов и электронов. Химические свойства вещества основаны на структуре вещества. Количество протонов в атоме определяет тип элемента.
В Уроке 10 ученики узнали, что существуют разные виды атомов. В уроке 11 «Создание молекул» студентов узнают, что большую часть времени атомы путешествуют не в одиночку.Атомы связываются с другими атомами, образуя молекулы. Когда атомы связаны со всеми атомами одного и того же типа, они называются элементами, потому что они представляют собой чисто один тип атомов. Иногда атомы разных типов связаны друг с другом. Когда это происходит, образуется молекула соединения . Химические формулы — это сокращенные записи, которые химики используют для обозначения типа и количества атомов в молекуле. Студенты используют мармеладки для изготовления моделей молекул.
На уроке 11 студенты узнали о молекулах и соединениях.В уроке 12 «Соленое мороженое» студентов узнают, что соли — это соединения металлов и неметаллов. Соли обладают такими свойствами, как твердость, хрупкость, высокая температура плавления и растворимость в воде.
На уроке 12 ученики узнали, что вещества можно идентифицировать по их химическим свойствам и по тому, как они реагируют с другими веществами. В уроке 13 «Кухонная химия» студентов будут наблюдать химические реакции и разрабатывать эксперименты с одной переменной с кухонными химикатами.
На Уроке 13 ученики познакомились с химическими реакциями. В Уроке 14, «Химические изменения» представлены примеров химических реакций, чтобы помочь ученикам понять индикаторы химических изменений. Когда одно вещество взаимодействует с другим веществом, может произойти химическое изменение.
После урока 12 учащиеся выполняют формирующее оценивание № 4 . Эта оценка соответствует учебным целям уроков 9–14 и обеспечивает обратную связь с учителем, учащимися и родителями о понимании учащимися состояний материи, структуры материи и химических свойств материи.Учитель может использовать информацию из этого формирующего оценивания, чтобы определить, необходимы ли дополнительные инструкции для понимания учащимися концепций, представленных в Уроках 10–14.
На Уроке 14 ученики узнали индикаторы химических изменений. Существует пять индикаторов того, что произошло химическое изменение: образование газа (пузырьки), изменение цвета, изменение температуры, образование осадка или образование света. В уроке 15 «Таинственные порошки» студентов применяют свои знания об индикаторах химических изменений для идентификации таинственных порошков.
В Уроке 15 студенты узнали об атомных моделях и о том, что физические свойства материи можно использовать для организации веществ в сетке. В Уроке 16 «Таблица Менделеева» учащиеся узнают, что в таблице Менделеева элементы, упорядоченные по периодам и семействам, основаны на их химических свойствах
После Урока 16 учащиеся выполняют Формирующее оценивание № 5 . Эта оценка соответствует учебным целям уроков 14–16 и предоставляет учителям, ученикам и родителям обратную связь о понимании учениками химических изменений.Учитель может использовать информацию из этого формирующего оценивания, чтобы определить, необходимы ли дополнительные инструкции для понимания учащимися концепций, представленных в Уроках 14–16.
В Уроке 16 студенты заметили, что существует три типа элементов: металлы, полуметаллы (или металлоиды) и неметаллы. Все металлы обладают схожими химическими свойствами. В уроке 17 «Свойства металлов» студентов узнают, что металлы обладают общими химическими свойствами, то есть могут связываться с неметаллами с образованием солей и физических свойств, т.е.э., блеск, пластичность, теплопроводность и электропроводность.
На протяжении всего модуля ученики узнали, что элементы и их комбинации составляют все различные типы материи в мире, вся материя состоит из атомов, которые могут объединяться в молекулы, каждый элемент состоит из одного типа атомов и что элементы организованы в периодической таблице. В уроке 18 «Реклама элементов» студентов демонстрируют свое понимание того, что элементы Периодической таблицы, объединенные различными способами, составляют всю материю во Вселенной.Металлы обладают такими свойствами, как блеск, теплопроводность и электрическая проводимость, а также пластичность. Неметаллы хрупкие, практически не имеют металлического блеска и плохо проводят тепло и электричество.
После Урока 18 учащиеся проходят заключительную аттестацию, чтобы определить свое общее понимание концепций, представленных в этом модуле.
Скачать концептуальный алгоритм химии и материи PDF
| 0 | Начало работы | Упражнения | с.68 |
| Проверьте свое понимание | стр.72 | ||
| 1 | Урок 1 | Упражнения | стр.72 |
| Прогноз | стр.73 | ||
| Интерпретировать | с.74 | ||
| Применить | стр.75 | ||
| Применить | стр.76 | ||
| Оцените свое понимание | стр.76 | ||
| Определить | с.77 | ||
| Сравнение и контраст | стр.77 | ||
| Упражнения | с.78 | ||
| Связь | стр.79 | ||
| Оцените свое понимание | с.79 | ||
| 2 | Упражнения | стр. 80 | |
| Оцените свое понимание | стр.82 | ||
| Применить | стр.83 | ||
| Упражнения | с.85 | ||
| Оцените свое понимание | стр.85 | ||
| 3 | Металлы | Упражнения | стр.88 |
| Применить | стр.91 | ||
| Оцените свое понимание | с.91 | ||
| Упражнения | с.93 | ||
| Оцените свое понимание | стр.95 | ||
| 4 | Неметаллы и металлоиды | Упражнения | стр.96 |
| Применить | с.98 | ||
| Оцените свое понимание | с.98 | ||
| Упражнения | стр.99 | ||
| Упражнения | с.103 | ||
| Применить | с.103 | ||
| Оцените свое понимание | с.105 | ||
| 5 | Радиоактивные элементы | Упражнения | с.106 |
| Упражнения | с.107 | ||
| Оцените свое понимание | с.108 | ||
| Упражнения | с.109 | ||
| Оцените свое понимание | с. 110 | ||
| Упражнения | стр.111 | ||
| Оцените свое понимание | с.113 | ||
| Учебное пособие | стр.115 | ||
| Стандартизированная подготовка к тесту | стр.117 |
Теория атома — вводная химия — 1-е канадское издание
- Изложите современную атомную теорию.
- Узнайте, как устроены атомы.
Наименьший кусок элемента, который поддерживает идентичность этого элемента, называется атомом. Отдельные атомы чрезвычайно малы. Чтобы построить линию длиной 1 см, потребуется около пятидесяти миллионов атомов подряд. Точка в конце печатного предложения состоит из нескольких миллионов атомов. Атомы настолько малы, что трудно поверить, что вся материя состоит из атомов, но это так.
Представление о том, что атомы играют фундаментальную роль в химии, формализовано современной атомной теорией, впервые изложенной английским ученым Джоном Далтоном в 1808 году.Состоит из трех частей:
- Вся материя состоит из атомов.
- Атомы одного и того же элемента одинаковы; атомы разных элементов разные.
- Атомы объединяются в целочисленных отношениях с образованием соединений.
Эти концепции составляют основу химии.
Хотя слово атом происходит от греческого слова, означающего «неделимый», теперь мы понимаем, что сами атомы состоят из более мелких частей, называемых субатомными частицами .Первым был обнаружен электрон, крошечная субатомная частица с отрицательным зарядом. Его часто обозначают как e — , с правым надстрочным индексом, показывающим отрицательный заряд. Позже были обнаружены две более крупные частицы. Протон — более массивная (но все же крошечная) субатомная частица с положительным зарядом, представленная как p + . Нейтрон — это субатомная частица с массой примерно такой же, как у протона, но без заряда. Он представлен как n или n 0 .Теперь мы знаем, что все атомы всех элементов состоят из электронов, протонов и (за одним исключением) нейтронов. Таблица 3.1 «Свойства трех субатомных частиц» суммирует свойства этих трех субатомных частиц.
Таблица 3.1 Свойства трех субатомных частиц
| Имя | Символ | Масса (прибл .; кг) | Заряд |
|---|---|---|---|
| Протон | п. + | 1.6 × 10 −27 | 1+ |
| нейтрон | n, n 0 | 1,6 × 10 −27 | нет |
| Электрон | e — | 9,1 × 10 −31 | 1− |
Как эти частицы расположены в атомах? Они не расположены случайным образом. Эксперименты Эрнеста Резерфорда в Англии в 1910-х годах указали на ядерную модель атома.Относительно массивные протоны и нейтроны собираются в центре атома, в области, называемой ядром атома (множество ядер , ). Электроны находятся вне ядра и проводят время, вращаясь в космосе вокруг ядра. (См. Рисунок 3.1 «Структура атома».)
Рисунок 3.1 Структура атома
В центре атома протоны и нейтроны, образующие ядро, а электроны вращаются вокруг ядра.
Современная атомная теория утверждает, что атомы одного элемента одинаковы, а атомы разных элементов различны.Что отличает атомы разных элементов? Фундаментальной характеристикой, которой обладают все атомы одного и того же элемента, является количество протонов . Все атомы водорода имеют в ядре один и только один протон; все атомы железа имеют в ядре 26 протонов. Это количество протонов настолько важно для идентичности атома, что его называют атомным номером элемента. Таким образом, атомный номер водорода равен 1, а атомный номер железа — 26. Каждый элемент имеет свой собственный характерный атомный номер.
Однако атомы одного и того же элемента могут иметь разное количество нейтронов. Атомы одного и того же элемента (то есть атомы с одинаковым числом протонов) с разным числом нейтронов называются изотопами. Большинство природных элементов существуют в виде изотопов. Например, большинство атомов водорода имеют в своем ядре единственный протон. Однако небольшое количество (примерно один из миллиона) атомов водорода имеет в своих ядрах протон и нейтрон. Этот конкретный изотоп водорода называется дейтерий.Очень редкая форма водорода имеет в ядре один протон и два нейтрона; этот изотоп водорода называется тритием. Сумма количества протонов и нейтронов в ядре называется массовым числом изотопа.
У нейтральных атомов такое же количество электронов, как и у протонов, поэтому их общий заряд равен нулю. Однако, как мы увидим позже, так будет не всегда.
Пример 1
- Ядра наиболее распространенных атомов углерода содержат шесть протонов и шесть нейтронов.Каковы атомный номер и массовое число этих атомов углерода?
- Изотоп урана имеет атомный номер 92 и массовое число 235. Каково количество протонов и нейтронов в ядре этого атома?
Решение
- Если в ядре атома углерода шесть протонов, его атомный номер равен 6. Если у него также шесть нейтронов в ядре, то массовое число равно 6 + 6, или 12.
- Если атомный номер урана 92, то это количество протонов в ядре.Поскольку массовое число равно 235, то количество нейтронов в ядре равно 235 — 92, или 143.
Проверьте себя
Число протонов в ядре атома олова — 50, а число нейтронов в ядре — 68. Каковы атомный номер и массовое число этого изотопа?
Ответ
Атомный номер = 50, массовое число = 118
Обращаясь к атому, мы просто используем название элемента: термин натрия относится как к элементу, так и к атому натрия.Но постоянно использовать имя элемента может быть неудобно. Вместо этого химия определяет символ для каждого элемента. Атомарный символ — это одно- или двухбуквенное сокращение имени элемента. По соглашению первая буква символа элемента всегда заглавная, а вторая буква (если есть) — строчная. Таким образом, символ водорода — H, символ натрия — Na, а символ никеля — Ni. Большинство символов происходит от английского названия элемента, хотя некоторые символы происходят от латинского названия элемента.(Символ натрия Na происходит от его латинского названия natrium .) В таблице 3.2 «Названия и символы общих элементов» перечислены некоторые общие элементы и их символы. Вам следует запомнить символы в Таблице 3.2 «Имена и символы общих элементов», так как именно так мы будем представлять элементы в химии.
Таблица 3.2 Названия и символы общих элементов
Имя элемента Символ
| Имя элемента | Символ | |||
|---|---|---|---|---|
| Алюминий | Al | Меркурий | Hg | |
| Аргон | Ar | молибден | Пн | |
| Мышьяк | как | Неон | Ne | |
| Барий | Ba | Никель | Ni | |
| Бериллий | Be | Азот | N | |
| висмут | Bi | Кислород | O | |
| Бор | B | Палладий | Pd | |
| Бром | Br | фосфор | -п. | |
| Кальций | Ca | Платина | Pt | |
| Углерод | С | Калий | К | |
| Хлор | Класс | Радий | Ra | |
| Хром | Cr | Радон | Rn | |
| Кобальт | Co | Рубидий | руб. | |
| Медь | Cu | Скандий | Sc | |
| Фтор | F | Селен | SE | |
| Галлий | Ga | Кремний | Si | |
| Германий | Ge | Серебро | Ag | |
| Золото | Au | Натрий | Na | |
| Гелий | He | Стронций | Sr | |
| Водород | H | сера | S | |
| Йод | I | Тантал | Ta | |
| Иридий | Ir | Олово | Sn | |
| Утюг | Fe | Титан | Ti | |
| Криптон | Кр | Вольфрам | Вт | |
| Свинец | Пб | Уран | U | |
| Литий | Li | Ксенон | Xe | |
| Магний | мг | Цинк | Zn | |
| Марганец | Mn | Цирконий | Zr |
Элементы сгруппированы вместе в специальной таблице, называемой периодической таблицей.Простая периодическая таблица показана на рисунке 3.2 «Простая периодическая таблица», а более обширная представлена в главе 17 «Приложение: Периодическая таблица элементов». Элементы в периодической таблице перечислены в порядке возрастания атомного номера. Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы.Неметаллы находятся в правом верхнем углу таблицы Менделеева, на одной стороне жирной линии, разделяющей правую часть таблицы. Все остальные элементы — металлы.
Рисунок 3.2 Простая периодическая таблица
Есть простой способ представить изотопы с помощью атомных символов. Используем конструкцию
, где X — символ элемента, A — массовое число, а Z — атомный номер. Таким образом, для изотопа углерода, который имеет 6 протонов и 6 нейтронов, символ
., где C — символ элемента, 6 — атомный номер, а 12 — массовое число.
Пример 2
- Что означает изотоп урана с атомным номером 92 и массовым числом 235?
- Сколько протонов и нейтронов в 26 Fe?
Решение
- Обозначение этого изотопа — .
- В этом атоме железа 26 протонов и 56 — 26 = 30 нейтронов.
Проверьте себя
Сколько протонов в 11 N?
Ответ
11 протонов
Также принято указывать массовое число после названия элемента, чтобы указать на конкретный изотоп. Углерод-12 представляет собой изотоп углерода с 6 протонами и 6 нейтронами, а уран-238 представляет собой изотоп урана с 146 нейтронами.
Основные выводы
- Химия основана на современной атомной теории, которая утверждает, что вся материя состоит из атомов.
- Сами атомы состоят из протонов, нейтронов и электронов.
- Каждый элемент имеет свой атомный номер, равный количеству протонов в его ядре.
- Изотопы элемента содержат разное количество нейтронов.
- Элементы представлены атомным символом.
- Периодическая таблица — это таблица, в которой упорядочены все элементы.
Упражнения
Перечислите три утверждения, из которых состоит современная атомная теория.
Объясните, как устроены атомы.
Что больше, протон или электрон?
Что больше, нейтрон или электрон?
Каков заряд каждой из трех субатомных частиц?
Где находится большая часть массы атома?
Нарисуйте схему атома бора, в ядре которого есть пять протонов и шесть нейтронов.
Нарисуйте схему атома гелия, в ядре которого есть два протона и два нейтрона.
Определите атомный номер . Какой атомный номер у атома бора?
Какой атомный номер у гелия?
Определите изотоп и приведите пример.
В чем разница между дейтерием и тритием?
Какая пара представляет собой изотопы?
а)
b) 26 F и 25 M
c) 14 S и 15 P
14.Какая пара представляет собой изотопы?
a) 20 C и 19 K
b) 26 F и 26 F
c) 92 U и 92 U
15. Дайте полные обозначения каждого атома, включая атомный номер и массовое число.
а) атом кислорода с 8 протонами и 8 нейтронами
б) атом калия с 19 протонами и 20 нейтронами
в) атом лития с 3 протонами и 4 нейтронами
16.Укажите полные обозначения каждого атома, включая атомный номер и массовое число.
а) атом магния с 12 протонами и 12 нейтронами
б) атом магния с 12 протонами и 13 нейтронами
в) атом ксенона с 54 протонами и 77 нейтронами
17. Америций-241 — изотоп, используемый в детекторах дыма. Каков полный символ этого изотопа?
18. Углерод-14 — изотоп, используемый для проведения радиоактивных испытаний на датирование ранее живого материала.Каков полный символ этого изотопа?
19. Приведите атомарные символы для каждого элемента.
а) натрий
б) аргон
в) азот
г) радон
20. Дайте атомные символы для каждого элемента.
а) серебро
б) золото
в) ртуть
г) йод
21. Дайте название элементу.
а) Si
б) Мн
в) Fe
г) Cr
22.Дайте название элементу.
а) Ф
б) Класс
в)
рублейг) Я
ответы
1.
Вся материя состоит из атомов; атомы одного и того же элемента одинаковы, а атомы разных элементов различны; атомы объединяются в целочисленных отношениях с образованием соединений.
3.
Протон больше электрона.
5.
протон: 1+; электрон: 1-; нейтрон: 0
7.
9.
Атомный номер — это количество протонов в ядре. Бор имеет атомный номер пять.
11.
Изотопы — это атомы одного и того же элемента, но с разным числом нейтронов. являются примерами.
13.
а) изотопы
б) неизотопы
в) неизотопы
15.
а)
б) 19 К
в)
17.
95 А
19.
а) Na
б) Ар
в) №
г) Rn
21.
а) кремний
б) марганец
в) железо
г) хром
Мой любимый способ представить Периодическую таблицу ⋆ Блог Sunrise Science
Звучит очень странно, но мне очень нравится Периодическая таблица. Я считаю, что это один из самых интересных инструментов в науке, и мне нравится воплощать его в жизнь для моих учеников.Я создал много ресурсов вокруг Периодической таблицы, потому что, будучи молодым студентом, я никогда особо не ценил ее полезность. Я действительно учился в колледже и аспирантуре.
Это упражнение «Периодические люди» стало любимым уроком и определенно моим любимым способом представить концепцию Периодической таблицы как таблицы закономерностей! Это упражнение было адаптировано из Отделения химии школ Окленда. Исходное упражнение включает в себя очень полезную, но более упрощенную версию карточек «Периодические люди».Где-то по пути я нашел самый симпатичный набор из них, который был перерисован художницей по имени Рене Кимпел. Она разместила их в своем блоге для бесплатного скачивания. К сожалению, мне не удалось снова найти Рене и ее блог, чтобы отдать ей должное (если вы знаете об этом блоге или где можно найти перерисованных Периодических людей, оставьте это в разделе комментариев ниже!).
Это практическое задание на основе запросов, о котором учащиеся знакомятся с помощью увлекательной подсказки:
Вы были выбраны для выполнения этой совершенно секретной миссии.Ваша миссия, если вы решите ее принять, — работать с «набросками» подозрительных персонажей в списке секретных агентов. Они являются частью семьи секретных агентов, но самый смертоносный из них никогда не был нарисован. Ваша задача состоит в том, чтобы расположить наброски по шаблону, чтобы вы могли нарисовать пропавшего секретного агента.
В группах по двое или трое учащиеся придумают способ расположить 17 рисунков «Периодических людей» в таблице, которая учитывает закономерности. Есть узоры, идущие вверх и вниз и поперек слева направо! Эти модели включают размер тела (от худого до толстого), количество усиков (от 1 до 8), количество пальцев (от 1 до 18), количество рук (от 1 до 3), выражение лица (от очень грустного до супер радует) и выкройки кузова (9 разных).Эти паттерны являются синонимами основных паттернов самой Периодической таблицы — количество электронных оболочек увеличивается при движении вниз по столбцу, число валентных электронов увеличивается, перемещаясь слева направо по строке, электроотрицательность возрастает при перемещении слева направо поперек столбца. элементы основной группы и т. д.
Если вы уже изучали атомную структуру, ваши ученики могут сами распознать эти «персонифицированные» паттерны! Количество плеч представляет собой количество электронных оболочек, количество антенн представляет количество валентных электронов, количество пальцев представляет собой атомный номер.В этом году один из моих студентов даже заметил то, чего я раньше не замечал: количество пальцев на каждой руке представляет собой количество электронов в каждой конкретной электронной оболочке (K, L и M). Я дал себе секрет ДАВЛЕНИЕ ПЯТЬ, когда он мне на это указал!
Но не волнуйтесь, вы можете использовать это замечательное занятие, даже если вы еще не учили этим шаблонам! В любом случае, у меня есть отличная активность в моем магазине TPT, которая отлично работает до (при обучении атомной структуре) или после этого! (Ознакомьтесь с моей деятельностью по манипулированию диаграммами атомов Бора.)
Вы можете получить это Периодическое действие с людьми, включая карточки с людьми, заметки учителя и ключ ответа в таблице, нажав ЗДЕСЬ! И я также добавил цифровую версию упражнения в Google Slides! Загрузите ресурс, чтобы получить ссылку «Сделать копию»!
Аудиокнига
По следующим ссылкам вы попадете на видеопрезентации, которые включают аудио-повествование каждого раздела первой версии книги «Введение в химию» Марка Бишопа.
Химия — Первые главы
|
1 |
2
| 3 |
4 |
5 |
6 |
7
| 8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18
Глава 1. Введение в химию
Раздел 1.1: Введение в химию
Раздел 1.2: Рекомендации по изучению химии
Раздел 1.3: Научный метод
Раздел 1.4: Измерение и единицы
Раздел 1.5: Отчетные значения измерений
Глава 2: Структура вещества и химические элементы
Раздел 2.1: Твердые вещества, жидкости и газы
Раздел 2.2: Химические элементы
Раздел 2.3: Периодическая таблица элементов
Раздел 2.4: Структура элементов
Раздел 2.5: Общие элементы
Глава 3: Химические соединения
Раздел 3.1: Классификация материалов
Раздел 3.2: Соединения и химические связи
Раздел 3.3: Молекулярные соединения
Раздел 3.4: Обозначение бинарных ковалентных соединений
Раздел 3.5: Ионные соединения
Глава 4: Введение в химические уравнения
Раздел 4.1: Химические реакции и химические уравнения
Раздел 4.2: Растворимость ионных соединений и реакции осаждения
Глава 5: Кислоты, основания и кислотно-основные реакции
Раздел 5.1: кислоты
Разделы 5.2 и 5.3: Номенклатура кислот и краткое изложение химической номенклатуры
Раздел 5.4: Сильные и слабые основания
Раздел 5.5: pH, кислотные и основные растворы
Раздел 5.6: Кислотно-основные реакции Аррениуса
Раздел 5.7: Кислоты и основания Бренстеда-Лоури
Глава 6: Реакции окисления-восстановления
Раздел 6.1: Введение в окислительно-восстановительные реакции
Раздел 6.2: Число окисления
Раздел 6.3: Типы химических реакций
Раздел 6.4: Гальванические элементы
Глава 7: Энергетические и химические реакции
Раздел 7.1: Энергия
Раздел 7.2: Химические изменения и энергия
Раздел 7.3: Озон: загрязнитель и защитник
Раздел 7.4: Хлорфторуглероды: история химического успеха пошла не так
Глава 8: Преобразование единиц
Раздел 8.1: Анализ единиц
Раздел 8.2: Округление и значащие числа
Раздел 8.3: Плотность и расчеты плотности
Раздел 8.4: Процентные и процентные расчеты
Раздел 8.5: Краткое описание процесса модульного анализа
Раздел 8.6: Преобразование температуры
Глава 9: Химические расчеты и химические формулы
Раздел 9.1: Типичная проблема
Раздел 9.2: Связь массы с количеством частиц
Раздел 9.3: Молярная масса и химические соединения
Раздел 9.4: Взаимосвязи между массами элементов и соединений
Раздел 9.5: Определение эмпирических и молекулярных формул
Глава 10: Химические расчеты и химические уравнения
Раздел 10.1: Стехиометрия уравнения
Раздел 10.2: Реальные приложения стехиометрии уравнения
Раздел 10.3: Молярность и стехиометрия по уравнениям
Глава 11: Современная теория атома
Раздел 11.1: Таинственный электрон
Раздел 11.2: Многоэлектронные атомы
Глава 12: Молекулярные структуры
Раздел 12.1: Новый взгляд на молекулы и образование ковалентных связей
Раздел 12.2: Рисование структур Льюиса
Раздел 12.3: Резонанс
Раздел 12.4: Молекулярная геометрия на основе структур Льюиса
Глава 13: Газы
Раздел 13.1: Газы и их свойства
Раздел 13.2: Расчет идеального газа
Раздел 13.3: Стехиометрия по уравнениям и идеальные газы
Раздел 13.4: Закон частичных давлений Дальтона
Глава 14: Жидкости: конденсация, испарение и динамическое равновесие
Раздел 14.1: Переход от газа к жидкости и от жидкости к газу — Введение в динамическое равновесие
Раздел 14.2: Кипячение жидкостей
Раздел 14.3: Притяжение частиц
Глава 15. Динамика решения
Раздел 15.1: Почему Решения Форма
Раздел 15.2: Жиры, масла, мыло и моющие средства
Раздел 15.3: Насыщенные растворы и динамическое равновесие
Раздел 15.4: Растворы газов в жидкостях
Глава 16. Процесс химических реакций
Раздел 16.1: Теория столкновений: модель процесса реакции
Раздел 16.2: Скорость химических реакций
Раздел 16.3: Обратимые реакции и химическое равновесие
Раздел 16.4: Нарушение равновесия
Глава 17: Введение в органическую химию, биохимию и синтетические полимеры
Раздел 17.1: Органические соединения
Раздел 17.2: Важные вещества в продуктах питания
Раздел 17.3: Пищеварение
Раздел 17.4: Синтетические полимеры
Глава 18: Ядерная химия
Раздел 18.1: Ядро и радиоактивность
Раздел 18.2: Использование радиоактивных веществ
Раздел 18.3: Атомная энергия
По следующим ссылкам вы попадете на видеопрезентации, которые включают аудиозаписи каждого раздела «Введения в химию» Марка Бишопа, посвященного первым атомам.
Атомы-Первые главы
|
1 |
2
| 3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
Глава 1. Введение в химию
Раздел 1.1: Введение в химию
Раздел 1.2: Рекомендации по изучению химии
Раздел 1.3: Научный метод
Раздел 1.4: Измерения и единицы
Раздел 1.5: Отчетные значения измерений
Глава 2: Структура вещества и химические элементы
Раздел 2.1: Анализ единиц
Раздел 2.2: Округление и значащие числа
Раздел 2.3: Плотность и расчеты плотности
Раздел 2.4: Процентные и процентные расчеты
Раздел 2.5: Краткое описание процесса модульного анализа
Раздел 2.6. Преобразование температуры
Глава 3: Структура вещества и химические элементы
Раздел 3.1: Твердые вещества, жидкости и газы
Раздел 3.2: Химические элементы
Раздел 3.3: Периодическая таблица элементов
Раздел 3.4: Структура элементов
Раздел 3.5: Общие элементы
Раздел 3.6: Связь массы с числом частиц
Глава 4: Современная теория атома
Раздел 4.1: Энергия
Раздел 4.2: Таинственный электрон
Раздел 4.3: Многоэлектронные атомы
Глава 5: Химические соединения
Раздел 5.1: Классификация материалов
Раздел 5.2: Соединения и химические связи
Раздел 5.3: Ионные соединения
Раздел 5.4: Молекулярные соединения
Раздел 5.5: Построение структур Льюиса
Раздел 5.6: Резонанс
Раздел 5.7: Молекулярная геометрия на основе структур Льюиса
Глава 6: Подробнее о химии Соединения
Раздел 6.1: Ионная номенклатура
Раздел 6.2: Бинарная ковалентная номенклатура
Раздел 6.3: Кислоты
Разделы 6.4 и 6.5: Номенклатура кислот и краткое изложение химической номенклатуры
Раздел 6.6: Молярная масса и химические соединения
Раздел 6.7. Взаимосвязи между массами элементов и соединений
Раздел 6.8: Определение эмпирических и молекулярных формул
Глава 7. Введение в химические уравнения
Раздел 7.1: Химические реакции и химические уравнения
Раздел 7.2: Жидкая вода и водные растворы
Раздел 7.3: Реакции осаждения
Раздел 7.4: Химические изменения и энергия
Глава 8: Кислоты, основания и кислотно-основные реакции
Раздел 8.1: Сильные и слабые основания
Раздел 8.2: pH, кислотные и основные растворы
Раздел 8.3: Кислотно-основные реакции Аррениуса
Раздел 8.4: Кислоты и основания Бренстеда-Лоури
Глава 9: Реакции окисления-восстановления
Раздел 9.1: Введение в реакции окисления-восстановления
Раздел 9.2: Числа окисления
Раздел 9.3: Типы химических реакций
Раздел 9.4: Гальванические элементы
Глава 10: Химические расчеты и химические уравнения
Раздел 10.1: Стехиометрия уравнения
Раздел 10.2: Реальные приложения стехиометрии уравнений
Раздел 10.3: Молярность и стехиометрия по уравнению
Глава 11: Газы
Раздел 11.1: Газы и их свойства
Раздел 11.2: Расчет идеального газа
Раздел 11.3: Стехиометрия по уравнениям и идеальные газы
Раздел 11.4: Закон частичных давлений Дальтона
Глава 12: Жидкости: конденсация, испарение и динамическое равновесие
Раздел 12.1: Переход от газа к жидкости и от жидкости к газу — Введение в динамическое равновесие
Раздел 12.2: Кипячение жидкостей
Раздел 12.3: Притяжение частиц
Глава 13: Динамика решения
Раздел 13.1: Зачем нужны решения Форма
Раздел 13.2: Жиры, масла, мыло и моющие средства
Раздел 13.3: Насыщенные растворы и динамическое равновесие
Раздел 13.4: Растворы газов в жидкостях
Глава 14: Процесс химических реакций
Раздел 14.1: Теория столкновений: модель процесса реакции
Раздел 14.2: Скорость химических реакций
Раздел 14.3: Обратимые реакции и химическое равновесие
Раздел 14.4: Нарушение равновесия
Глава 15: Введение в органическую химию, биохимию и синтетические полимеры
Раздел 15.1: Органические соединения
Раздел 15.2: Важные вещества в продуктах питания
Раздел 15.3: Пищеварение
Раздел 15.4: Синтетические полимеры
Глава 16. Ядерная химия
Раздел 16.1: Ядро и радиоактивность
Раздел 16.2: Использование радиоактивных веществ
Раздел 16.3: Атомная энергия
Что такое химия? — Урок для детей — класс естественных наук [2021]
Что такое материя?
Все, что угодно, имеет значение.Материя определяется как все, что имеет массу и занимает место. Вы материя; деревья, дома, камни, вода и даже воздух, которым вы дышите, — это материя. Однако не все, что является существительным, является материей. Время, сны, тепло или свет не имеют значения. У них нет массы и они не занимают места. Они не сделаны из материи.
Из чего сделана материя?
Вы когда-нибудь рвали лист бумаги? Насколько маленькую можно порвать бумагу? Если бы вы могли и дальше разделять эту бумагу на настолько мелкие куски, что их нельзя было увидеть даже в микроскоп, вы бы дошли до самой мельчайшей возможной частицы, которая не могла делиться дальше.Эта самая маленькая частица называется атомом . Атом представляет собой конкретный элемент , такой как водород, кислород или углерод. Существует менее 100 природных элементов, из которых состоит вся материя Вселенной в различных комбинациях. На самом деле бумага содержит водород, кислород и углерод.
Может быть, ты что-то построил с Лего? Материя состоит из атомов, как будто вы делаете что-то из строительных блоков. Некоторые блоки бывают разных размеров, цветов или имеют разное количество колышков для крепления.Атомы — это строительные блоки материи, и атом каждого элемента отличается. Когда атомы водорода, кислорода и углерода соединяются особым образом, получается молекула бумаги. (Молекулы — это комбинации атомов). Если его смешать по-другому, можно получить сахар. Вот как работает химия.
Как используется химия?
Представьте себе кубик льда. Это твердое вещество, и когда вы помещаете его в жидкую воду, оно плавает.Несмотря на то, что это все еще вода, расположение молекул во льду иное. Переход от твердого тела к жидкости или от жидкости к газу называется физическим изменением. Химическое изменение означает, что атомы перегруппировались, чтобы образовать новое вещество. Если обгорел лист бумаги, это уже не бумага, а дым и пепел. Это химическое изменение.
Химики наблюдают и создают химические изменения для создания новых веществ.Химики производят лекарства, чистящие средства, пищевые консерванты, удобрения, химикаты для разжигания огня и химикаты для тушения пожара, краски, клеи и даже такие вещи, как ароматизаторы в вашей любимой жевательной резинке или газированной воде! Химия иногда может вызвать проблемы, такие как создание чего-то, что является ядом, но она также может решить многие проблемы, такие как уничтожение микробов или получение чистой воды.
Краткое содержание урока
Химия — это наука, которая изучает и производит изменения в материи , которая составляет все во Вселенной и на Земле.Материя состоит из атомов и молекул, и каждый атом элемента отличается, как кислород или углерод. Атомы соединяются по-разному, образуя молекулы, и когда атомы перестраиваются, происходит химическое изменение.



 Обобщение и систематизация знаний по теме «Простые вещества»
Обобщение и систематизация знаний по теме «Простые вещества» Реакции разложения
Реакции разложения Растворы. Растворимость веществ
Растворы. Растворимость веществ
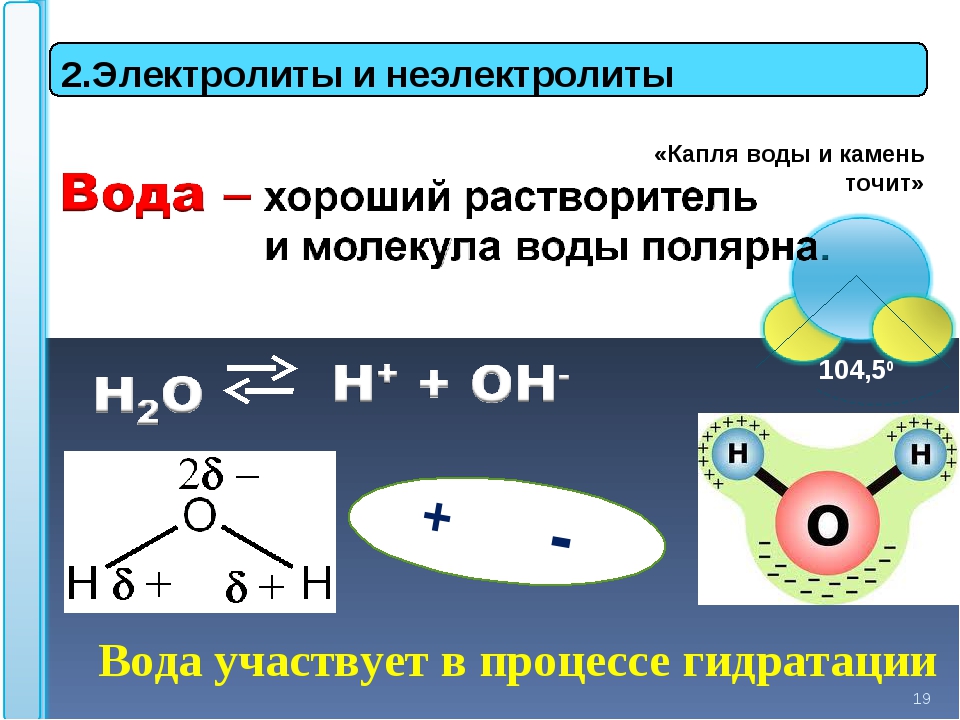
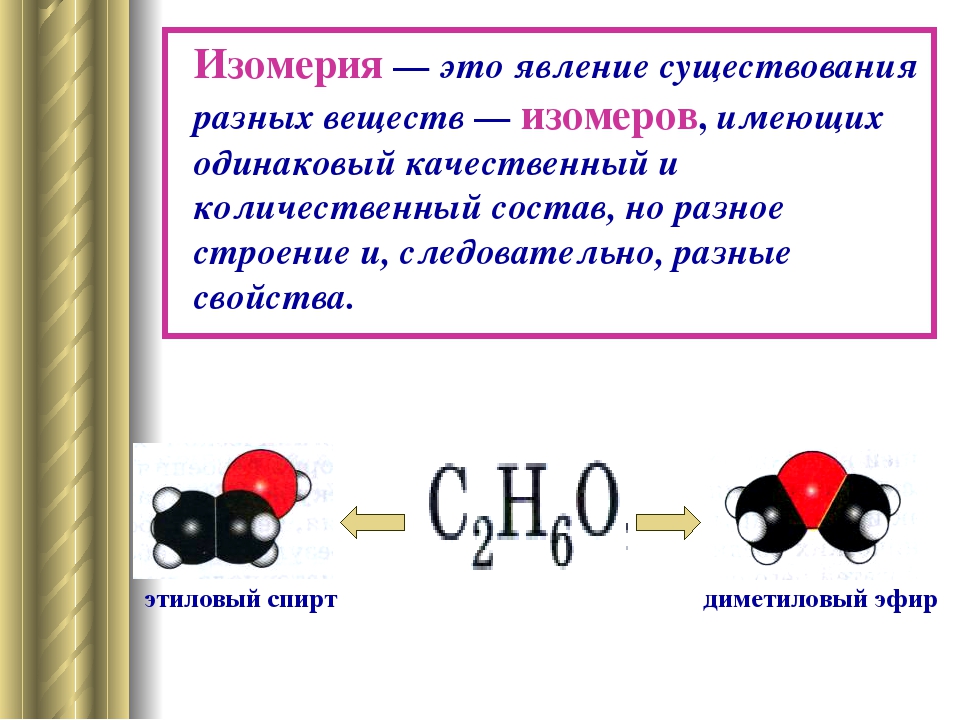 Заварить крахмал + йод
Заварить крахмал + йод В. Настольная книга учителя. 8 класс. М.: Дрофа, 2007.
В. Настольная книга учителя. 8 класс. М.: Дрофа, 2007. Железный гвоздь и раствор медного купороса
Железный гвоздь и раствор медного купороса