Физика 7 класс атомы и молекулы: Строение вещества — урок. Физика, 7 класс.
Физика Конспект: Молекулы и атомы
Конспект по физике для 7 класса «Молекулы и атомы»: ВЫ УЗНАЕТЕ: Что такое молекулы и атомы. Каковы размеры молекул и атомов. ВСПОМНИТЕ: Из чего состоит вещество?
Атомы — это те кирпичики материи, из которых построен окружающий нас мир. Современная наука утверждает, что всего в природе существует 92 различных атома, ещё около 2Ь атомов новых элементов учёные искусственно создали в своих лабораториях. Все атомы систематизированы на основе периодического закона, открытого Д. И Менделеевым.
МОЛЕКУЛЫ
Размеры атомов очень малы. Если увеличить яблоко до размеров земного шара, то размер атома увеличится до размера яблока. Но как из кирпича, дерева, стекла можно построить множество различных зданий, так как из атомов можно построить более сложные соединения — молекулы.
Например, молекула воды (а) состоит из трёх атомов: двух атомов водорода и одного атома кислорода.
Названия различных атомов принято обозначать латинскими буквами. Из курса химии вы узнаете, что воду обозначают символом Н2О. Здесь Н — атом водорода, О — атом кислорода.
Из курса химии вы узнаете, что воду обозначают символом Н2О. Здесь Н — атом водорода, О — атом кислорода.
Молекула кислорода (б) состоит из двух одинаковых атомов кислорода и обозначается О2.
Молекулы одного вещества одинаковы. Например, молекула воды всегда одна и та же: и в воде, и в снежинке, и в паре.
РАЗМЕРЫ МОЛЕКУЛ
Молекулы очень малы. В разное время для определения размера молекул ставились разнообразные эксперименты. Один из них провёл английский учёный Рэлей.
В чистый широкий сосуд наливают воду и на её поверхность помещают каплю оливкового масла. Капля растекается но поверхности воды, и образуется круглая плёнка.
Постепенно площадь плёнки увеличивается, но затем растекание прекращается, и площадь больше не изменяется.
Рэлей предположил, что молекулы масла в этом опыте располагаются в один ряд, т. е. толщина плёнки совпадает с размером одной молекулы. Толщина пленки (или диаметр молекулы) в данном случае равна отношению объёма капли к площади плёнки. Учитывая значения, полученные в этом опыте, получаем
Когда говорят о размерах молекул или атомов, то в качестве единицы длины используют не метр, а ангстрем (обозначается А), равный 1010 м, или нанометр, равный 109 м. Например, размер молекулы воды равен примерно 3 ангстремам (3 А), а размер атома золота равен примерно 1 ангстрему (1 А).
Размеры молекул и атомов очень малы. Если опоясать земной шар верёвкой вдоль экватора, то её длина окажется во столько раз больше ширины вашей ладони, во сколько раз ширина ладони больше диаметра атома. Интересен и такой пример: известно, что на специальном оборудовании можно получить листки золота толщиной менее 0.01 мкм. Но даже у такого тонкого листка количество атомных слоёв составляет порядка сотни.
КАК УВИДЕТЬ МОЛЕКУЛЫ И АТОМЫ
Из-за очень малых размеров молекулы нельзя увидеть невооружённым глазом или в обычные микроскопы. Только при помощи электронного микроскопа удалось сфотографировать наиболее крупные из них.
Сам мир молекул и атомов очень разнообразен. Если размер самых маленьких молекул достигает порядка 10–10 м, то крупные молекулы могут достигать «больших» размеров микрометров (10–6 м). Примерами таких молекул являются белки — это молекулы живой природы, которые состоят из огромного числа атомов.
Сами атомы также не являются неделимыми частицами. Современные технологии позволяют расщеплять атомы и создавать новые элементы.
НАНОТЕХНОЛОГИИ
Человечество подошло к новой эре — эре нанотехнологий.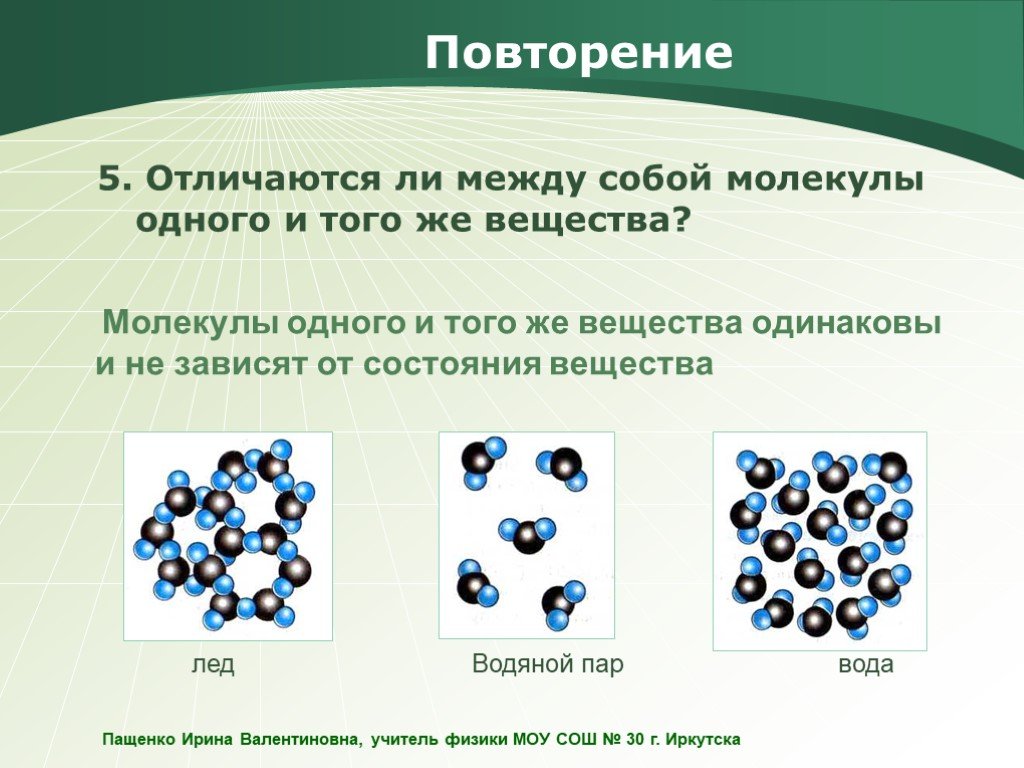 Нанотехнологии — это область знаний, позволяющая создавать материалы из относительно небольшого числа атомов. Физики в настоящее время научились работать с отдельными атомами и создавать из них новые материалы, обладающие качественно новыми физическими, химическими и биологическими свойствами. Как ожидается, нанотехнологии позволят решить многие важные для человечества задачи.
Нанотехнологии — это область знаний, позволяющая создавать материалы из относительно небольшого числа атомов. Физики в настоящее время научились работать с отдельными атомами и создавать из них новые материалы, обладающие качественно новыми физическими, химическими и биологическими свойствами. Как ожидается, нанотехнологии позволят решить многие важные для человечества задачи.
Примером одной из наноструктур является фуллерен, который получил своё название в честь архитектора Б. Фуллера, придумавшего подобные структуры для использования их в apxитектуpe.
Фуллерен внешне напоминает футбольным мяч, который состоит из заплаток пяти и шестиугольной формы. Бели представить, что в вершинах этого многогранника находятся атомы углерода, то получится самый стабильный фуллерен С60. Удивительные свойства молекулы фуллерена, связанные с их структурой и прочностью, позволили использовать их для решения самых разных практических задач в технике и медицине.
ДЛЯ СПРАВКИ:
Дмитрий Иванович Менделеев (1834 1907). Великий русский химик, открывший периодический закон химических элементов, разносторонний учёный, педагог и общественный деятель.
Великий русский химик, открывший периодический закон химических элементов, разносторонний учёный, педагог и общественный деятель.
Джон Уильям Стретт лорд Рэлей (1842-1919). Английский физик, член Лондон с кого королевского общества. Диапазон его научных интересов был очень широк акустика, теория колебаний, оптика, электричество и т. д.
Роберт Броун (1773-1858). Английский ботаник. Основные работы посвящены морфологии и систематике растений
Вы смотрели Конспект по физике для 7 класса «Молекулы и атомы»: Что такое молекулы и атомы. Каковы размеры молекул и атомов. Из чего состоит вещество? Вернуться к Списку конспектов по физике (оглавление).
Атомы и молекулы – формула, число и масса для сообщения по теме
4.6
Средняя оценка: 4.6
Всего получено оценок: 140.
4.6
Средняя оценка: 4.6
Всего получено оценок: 140.
Тема урока – атомы и молекулы. Представление о том, что материя состоит из неких элементарных блоков (атомов) зародилось в Древней Греции, в трудах философов-материалистов. {-27}} кг$.
{-27}} кг$.
Из сравнения этих величин видно, что масса молекулы кислорода равна сумме масс двух атомов кислорода, но о размерах сказать тоже самое нельзя. Разница в один порядок. Дело в том, что атомы в молекулах находятся на определенном расстоянии друг от друга. В твердых телах это расстояние наименьшее, в газах – наибольшее.
20-й век
Опыты Томсона (1897 г.) и Резефорда (1911 г.) привели к революции: атом более не был элементарной частицей материи. Появилась планетарная модель, согласно которой атом состоял из массивного ядра и вращающегося вокруг него электрона. Позднее Резерфордом и его учениками было установлено, что ядра в свою очередь состоят из протонов (частица с теми же зарядом и массой, что у водорода H-1) и нейтронов (нейтральных частиц, обладающих массой).
Со временем от планетарной модели отказались. К этому привело противоречие: в классическом представлении вращающиеся электроны должны испускать энергию и в конечном итоге падать на ядро атома. {-27}$. Что это за вещество?
{-27}$. Что это за вещество?
Решение
$M = {m \over N_a} = {97,1 \over 1,66} = 58,5 моль$
Поскольку вещество двухатомное, то 58,5 моль – это сумма молярных масс двух различных атомов. Такую сумму дают молярные массы Na и Cl. Из этого следует, что искомое вещество – хлорид натрия, т.е. соль. Такую же формулу имеет минерал Галит.
Что мы узнали?
В ходе урока были рассмотрены строение атома и молекул, а также проведено сравнение масс некоторых молекул и атомов и их размеров. Для закрепления пройденного материала были решены две простые задачи.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 140.
А какая ваша оценка?
Вертикальная наука 7 класса
Субатомные частицы и строение атома
Приблизительно 13,7 миллиарда лет назад Вселенная родилась в результате Большого взрыва. Начиная с сингулярности (единой точки в пространстве), Вселенная подвергается экспоненциальному расширению, образуя невероятно плотную и высокоэнергетическую кварк-глюонную плазму. По мере расширения Вселенной температура падает. Примерно через секунду после Большого взрыва Вселенная остыла до температуры 10 000 000 000 К, и кварки начали связываться друг с другом, образуя протоны и нейтроны. Примерно через десять секунд после Большого взрыва прекращается создание антиматерии, электроны и позитроны прекращают уничтожать друг друга, и во Вселенной доминируют материя и высокоэнергетические фотоны. Примерно через три минуты после Большого взрыва температура падает до 1 000 000 000 К, и протоны и нейтроны начинают объединяться в атомные ядра (процесс, известный как нуклеосинтез). Семнадцать минут спустя Вселенная слишком остыла, чтобы продолжать сплавлять атомные ядра вместе для создания более тяжелых элементов. На данный момент Вселенная состоит из плазмы атомных ядер (в основном водорода, гелия и дейтерия, со следовыми количествами лития и бериллия) и свободных электронов.
Начиная с сингулярности (единой точки в пространстве), Вселенная подвергается экспоненциальному расширению, образуя невероятно плотную и высокоэнергетическую кварк-глюонную плазму. По мере расширения Вселенной температура падает. Примерно через секунду после Большого взрыва Вселенная остыла до температуры 10 000 000 000 К, и кварки начали связываться друг с другом, образуя протоны и нейтроны. Примерно через десять секунд после Большого взрыва прекращается создание антиматерии, электроны и позитроны прекращают уничтожать друг друга, и во Вселенной доминируют материя и высокоэнергетические фотоны. Примерно через три минуты после Большого взрыва температура падает до 1 000 000 000 К, и протоны и нейтроны начинают объединяться в атомные ядра (процесс, известный как нуклеосинтез). Семнадцать минут спустя Вселенная слишком остыла, чтобы продолжать сплавлять атомные ядра вместе для создания более тяжелых элементов. На данный момент Вселенная состоит из плазмы атомных ядер (в основном водорода, гелия и дейтерия, со следовыми количествами лития и бериллия) и свободных электронов.
Протоны, нейтроны и электроны
Протоны, нейтроны и электроны — субатомные частицы, из которых состоят атомы. Протоны — это положительно заряженные частицы с массой 1,6726 × 10–27 кг, а нейтроны — нейтральные частицы (не имеющие электрического заряда) с массой 1,6929 × 10–27 кг. Протоны и нейтроны примерно одинакового размера… оба порядка 2 × 10–15 м в поперечнике. Электроны – это отрицательно заряженные частицы, масса которых равна 9.11×10-31 кг. Протон примерно в 1836 раз массивнее электрона, а нейтрон примерно в 1839 раз массивнее. Электроны настолько малы, что до сих пор мы не могли оценить их размер (и они могут быть даже точечными частицами без физического размера).
Основной структурой атома является ядро, состоящее из связанных вместе протонов и нейтронов, окруженных облаком электронов. Поскольку электроны заряжены отрицательно, а протоны положительно заряжены, электроны и протоны притягиваются друг к другу. Именно это удерживает электроны атома близко к ядру атома (иначе электроны просто улетели бы). Однако, поскольку электроны заряжены отрицательно, они отталкивают друг друга, точно так же, как северные полюса двух магнитов отталкивают друг друга, а их северный и южный полюса притягиваются. Это предотвращает слишком близкое сближение электронов. Положительно заряженные протоны также отталкиваются друг от друга, но они удерживаются вместе в ядре атома вместе с нейтронами сильным ядерным взаимодействием.
Типы атомов
Существует множество различных типов атомов. Тип атома определяется количеством протонов в ядре атома. Атом с одним протоном в ядре — это атом водорода, атом с двумя протонами в ядре — это атом гелия, а атом с тремя протонами в ядре — это атом лития. (Атом углерода имеет шесть протонов в ядре, атом кислорода имеет восемь протонов, а атом плутония имеет 94 протона!) Далее в этом разделе вы узнаете больше о различных типах атомов, перечисленных в периодической таблице.
(Атом углерода имеет шесть протонов в ядре, атом кислорода имеет восемь протонов, а атом плутония имеет 94 протона!) Далее в этом разделе вы узнаете больше о различных типах атомов, перечисленных в периодической таблице.
Самый маленький и легкий атом – это атом водорода. Он состоит из одного протона, вокруг которого вращается один электрон. Одним из самых больших и тяжелых атомов является атом плутония (это самый тяжелый атом в природе). Плутоний-244 состоит из ядра с 94 протонами и 150 нейтронами, вокруг которых вращаются 94 электрона. Нейтроны помогают удерживать ядро вместе. Без них протоны в ядре были бы раздвинуты их положительными зарядами. Когда количество протонов и электронов в атоме одинаково, то атом нейтрален (не имеет электрического заряда).
| атом | количество протонов | число нейтронов | количество электронов | радиус ядро (10-15 м) | радиус атом (10-15 м) | масса атом (10-27 кг) |
|---|---|---|---|---|---|---|
| водород-1 (Н) | 1 | 0 | 1 | 0,9 | 25 000 | 001,67 |
| гелий-4 (Не) | 2 | 2 | 2 | 1,7 | 31 000 | 006,65 |
| углерод-12 (С) | 6 | 6 | 6 | 2,4 | 70 000 | 019,93 |
| кислород-16 (О) | 8 | 8 | 8 | 2,7 | 60 000 | 026,56 |
| натрий-23 (Na) | 11 | 12 | 11 | 3,0 | 180 000 | 038. 18 18 |
| железо-56 (Fe) | 26 | 30 | 26 | 4.1 | 140 000 | 092,88 |
| золото-197 (Au) | 79 | 118 | 79 | 6,2 | 135 000 | 327,07 |
| плутоний-244 (Pu) | 94 | 150 | 94 | 6,7 | 175 000 | 405,28 |
Представьте, что протон размером с шарик (около 12,7 мм в диаметре). Тогда ядро атома кислорода будет размером с мячик для настольного тенниса (пинг-понга). Если вы поместите ядро кислорода в пустое поле, самый дальний электрон в атоме кислорода окажется на расстоянии почти пяти футбольных полей (435 м). И хотя никому не известен физический размер электрона, он будет намного меньше мельчайшей пылинки.
И хотя никому не известен физический размер электрона, он будет намного меньше мельчайшей пылинки.
Если бы этот атом кислорода был частью молекулы воды (h3O), то молекула воды была бы почти в одну милю в поперечнике (около 1,5 км), а следующая ближайшая молекула воды находилась бы на расстоянии около 2,8 км в жидком состоянии. Потребуется стопка из 250 000 молекул воды в жидком состоянии, чтобы она была равна толщине одного листа бумаги. Толщина этого листа бумаги будет около 700 000 км (435 000 миль), что почти в 17,5 раз больше расстояния вокруг Земли или более чем в 1,8 раза больше расстояния от Земли до Луны. Для сравнения, ядро атома золота было бы немного меньше мяча для софтбола (около 9см), а самый дальний электрон в атоме золота будет находиться на расстоянии около 1 км. Если бы атомы золота были сложены встык (без промежутков между ними), потребовалось бы 370 000 атомов, чтобы получить толщину одного листа бумаги.
Поскольку более 99,97% его массы находится в ядре, атом кислорода представляет собой почти полностью пустое пространство.
Большинство типов атомов могут существовать в нескольких различных формах. Если количество протонов и электронов не равно, то атом имеет электрический заряд и называется «ионом». Атом водорода уникален тем, что в природе он существует как положительный ион и отрицательный ион. Атом водорода также имеет три встречающихся в природе «изотопа». Водород-1 является наиболее распространенным изотопом (водород-1 составляет 99,9885% всех атомов водорода на Земле). В его ядре находится один протон. Водород-2 (обычно известный как дейтерий) представляет собой атом водорода, так как в его ядре все еще есть один протон, но также есть и один нейтрон. Водород-3 встречается очень редко. В его ядре один протон и два нейтрона. По сути, ионы различаются в зависимости от количества электронов, которые имеет атом, а изотопы зависят от количества нейтронов, которые имеет атом, а тип атома зависит от количества его протонов.
Водород-3 встречается очень редко. В его ядре один протон и два нейтрона. По сути, ионы различаются в зависимости от количества электронов, которые имеет атом, а изотопы зависят от количества нейтронов, которые имеет атом, а тип атома зависит от количества его протонов.
| ионы и изотопы | количество протонов | число нейтронов | количество электронов |
|---|---|---|---|
| ион гидрона (H+) | 1 | 0 | 0 |
| ион гидрида (H-) | 1 | 0 | 2 |
| изотоп водорода-1 | 1 | 0 | 1 |
| изотоп водорода-2 | 1 | 1 | 1 |
| изотоп водорода-3 | 1 | 2 | 1 |
| изотоп углерода-12 | 6 | 6 | 6 |
| изотоп углерода-13 | 6 | 7 | 6 |
| изотоп углерода-14 | 6 | 8 | 6 |
| оксид-ион (O2-) | 8 | 8 | 10 |
| изотоп кислорода-16 | 8 | 8 | 8 |
| ион двухвалентного железа/железа(II) (Fe2+) | 26 | 30 | 24 |
| ион трехвалентного/железа(III) (Fe3+) | 26 | 30 | 23 |
| изотоп железа-56 | 26 | 30 | 26 |
Некоторые изотопы радиоактивны. Это означает, что изотоп нестабилен и со временем распадется (распадется) на более стабильные изотопы. Скорость распада радиоактивного изотопа измеряется его «периодом полураспада». Хорошо известные радиоактивные изотопы включают углерод-14 (используемый для радиоуглеродного датирования археологических находок), а также уран-235 и плутоний-239 (оба используются в качестве расщепляющегося материала в ядерном оружии).
Это означает, что изотоп нестабилен и со временем распадется (распадется) на более стабильные изотопы. Скорость распада радиоактивного изотопа измеряется его «периодом полураспада». Хорошо известные радиоактивные изотопы включают углерод-14 (используемый для радиоуглеродного датирования археологических находок), а также уран-235 и плутоний-239 (оба используются в качестве расщепляющегося материала в ядерном оружии).
Электронные облака и квантовая механика
Электроны в атоме притягиваются к протонам в ядре атома электромагнитной силой. Одно время ученые считали, что эти электроны движутся по круговым орбитам вокруг ядра, подобно тому, как планеты вращаются вокруг Солнца в Солнечной системе. Однако эта модель (известная как модель Бора и введенная в 1913 г.) не могла полностью объяснить многие из наблюдаемых явлений поведения атомов. Только в 1924 году, когда впервые было высказано предположение, что электроны ведут себя как частицы и волны, была разработана современная модель атома.
Классическая механика, которую студенты изучают в средней школе и даже большей части колледжа, обычно достаточна для описания поведения макроскопических объектов. Только когда вы начнете переходить к масштабам атомов и молекул, классическая механика станет недостаточной, а квантовая механика станет необходимой. Хотя подробное обсуждение квантовой механики выходит далеко за рамки этого раздела, важно ознакомиться с некоторыми ключевыми понятиями. Во-первых, субатомные частицы ведут себя и как частицы, и как волны. Во-вторых, электроны не существуют в определенных положениях; положение электрона может быть описано только распределением вероятностей, и вместо того, чтобы существовать на круговой орбите, электрон существует в облаке вероятных положений. В-третьих, состояние электрона определяется набором квантовых чисел: энергией (n), орбитальным угловым моментом (l), магнитным моментом (m) и спином (s) электрона. В-четвертых, поскольку эти свойства электрона квантуются (ограничены конкретными дискретными значениями), электрон не может иметь любое количество энергии… он должен иметь определенный уровень энергии, чтобы n было целым числом. И в-пятых, никакие два электрона не могут иметь одинаковые четыре квантовых числа в одном атоме.
И в-пятых, никакие два электрона не могут иметь одинаковые четыре квантовых числа в одном атоме.
Электрон атома водорода не существует ни в одном месте в данный момент времени. Вместо этого он существует в облаке возможных местоположений. Это «облако» называется атомной орбиталью.
Физическая область в пространстве, где электрон может находиться вокруг ядра атома, называется атомной орбиталью. Каждая атомная орбиталь соответствует определенному энергетическому уровню. Чем выше энергетический уровень, тем дальше от ядра, вероятно, находится электрон, и тем меньше энергии требуется, чтобы отделить электрон от атома. Когда мы говорим о «радиусе» атома, мы имеем в виду расстояние, на котором самые удаленные электроны (электроны с наивысшим энергетическим уровнем) находятся от ядра.
Ядерные реакции
В результате Большого взрыва образовались атомы водорода (H-1), гелия (He-4) и дейтерия (H-2) со следовыми количествами лития (Li) и бериллия (Be). Подсчитано, что через 1 миллион лет после Большого взрыва Вселенная состояла примерно из 75% водорода, 25% гелия и 0,01% дейтерия. Так откуда же взялись более тяжелые атомы, такие как углерод, кислород или железо? Чтобы создать другой тип атома, вам нужно изменить количество протонов в ядре атома. Для этого нужна ядерная реакция.
Так откуда же взялись более тяжелые атомы, такие как углерод, кислород или железо? Чтобы создать другой тип атома, вам нужно изменить количество протонов в ядре атома. Для этого нужна ядерная реакция.
Ядерное деление берет ядро тяжелого атома и расщепляет его, чтобы создать два более легких атома. Для расщепления ядра атома требуется огромное количество энергии. Сильное ядерное взаимодействие, которое удерживает вместе протоны и нейтроны, невероятно велико (намного, намного, намного сильнее, чем сила тяготения, которая удерживает нас на планете Земля, или электромагнитная сила, которая удерживает вместе молекулы воды и электроны на ядре в атоме). . Ядерное деление — это реакция, которая питает наши атомные электростанции и большую часть нашего ядерного оружия.
Ядерный синтез берет ядра двух легких атомов и сплавляет их вместе, чтобы создать один более тяжелый атом. Столкновение двух атомных ядер требует огромного количества энергии. Ядро атома заряжено положительно. По мере того, как два ядра сближаются, электромагнитная сила, раздвигающая их, становится все сильнее. Чтобы столкнуть вместе два атомных ядра, требуется огромное давление, обнаруженное глубоко внутри звезды. Но как только два ядра вступят в «контакт» друг с другом, сильное ядерное взаимодействие соединит их вместе. Ядерный синтез — это реакция, которая питает активные звезды, включая наше Солнце. Более тяжелые атомы, такие как углерод, кислород и железо, были созданы внутри звезд, а затем распространились по Вселенной, когда эти звезды взрываются сверхновыми.
По мере того, как два ядра сближаются, электромагнитная сила, раздвигающая их, становится все сильнее. Чтобы столкнуть вместе два атомных ядра, требуется огромное давление, обнаруженное глубоко внутри звезды. Но как только два ядра вступят в «контакт» друг с другом, сильное ядерное взаимодействие соединит их вместе. Ядерный синтез — это реакция, которая питает активные звезды, включая наше Солнце. Более тяжелые атомы, такие как углерод, кислород и железо, были созданы внутри звезд, а затем распространились по Вселенной, когда эти звезды взрываются сверхновыми.
Заметки об атомах и молекулах
В 430 г. до н.э. Демокрит постулировал, что материя состоит из очень маленьких частиц, называемых «атомос», что означает «неделимый». Позднее Антуан Лавуазье из своих экспериментальных наблюдений установил законы химических соединений.
Законы химического соединения:
Закон сохранения массы: Этот закон гласит, что общая масса реагентов равна общей массе продуктов. В любой химической реакции общая масса вещества до и после реакции одинакова, хотя его вещество претерпевает физические изменения.
В любой химической реакции общая масса вещества до и после реакции одинакова, хотя его вещество претерпевает физические изменения.
Закон определенных пропорций: Согласно закону определенных пропорций, в химическом веществе элементы всегда присутствуют в определенных пропорциях по массе.
Закон кратных пропорций : Когда два элемента объединяются, образуя разные соединения, то вес одного из них постоянен, а другой имеет простое соотношение.
Атом: После ряда экспериментов Дальтон пришел к выводу, что вся материя должна состоять из мельчайших частиц, которые не могут быть далее разделены. Он назвал их атомами.
Определение атома: Мельчайшая частица элемента называется атомом.
Постулаты Дальтона:
- Материя состоит из атомов.
- Атомы неделимы и неразрушимы.

- Атомы данного элемента одинаковы по массе и свойствам.
- Соединения образуются комбинацией двух или более различных видов атомов и. Химическая реакция – это перегруппировка атомов.
- Атомы разных элементов имеют разные массы и химические свойства.
Недостатки атомной теории Дальтона:
- Согласно современной атомной теории атомы делимы и состоят из частиц. Тремя основными субатомными частицами являются протон, нейтрон и электрон.
- Предположение, что атомы данного элемента одинаковы по массе и по свойствам, неприменимо для изотопов элемента.
Примеры : Хлор имеет 2 изотопа с массовыми числами 35 и 37.
Элементы и символы: Дальтон предложил схему обозначения элементов
Символы элементов Дальтона
Берцелиус — Символы Элементов: Берцелиус Предложил сокращать названия элементов, используя одну или две буквы.
Первая буква символа всегда в верхнем регистре. Некоторые элементы были представлены начальным алфавитом своего названия. Например,
Углерод представлен как C
Бор как B
Кислород как O
Сера как S
Азот записан как N и
Водород как H
Символами некоторых элементов были первые два алфавита, где второй алфавит в нижнем регистре.
Примеры: Алюминий представлен как Al
Хлор как Cl.
Элемент представлен либо первой, либо первой и любой другой буквой его латинского имени. Есть некоторые исключения при написании символов для некоторых элементов. Эти имена произошли от латыни. Как правило, первая и вторая буквы их латинских названий используются для обозначения символов этих элементов.
Примеры:
Элемент | Символ | Латинское название |
Сурьма | Сб | Стибиум |
Медь | Медь | Купрум |
Золото | Золото | Аурум |
Железо | Fe | Феррум |
Свинец | Пб | Пламбум |
Меркурий | рт. | Гидрагирум |
Калий | К | Калиум |
Серебро | Аг | Аргентум |
Натрий | На | Натрий |
Олово | Сн | Станнум |
Атомная масса:
Атомная масса — это масса атома.
Относительная атомная масса атома элемента – это число раз, во сколько атом этого элемента тяжелее 1/12 90 636 90 637 массы атома углерода-12.
Молекула: Молекула — это мельчайшая частица элемента или соединения, которая может существовать независимо.
Примеры:
H 2 O, O 2 , O 3 и т. д.
Отдельный водород не является молекулой. Когда этот водород связывается с другим водородом (H 2 ) или с другими элементами, такими как кислород (H 2 O), образуется молекула.
Атомность: Количество атомов, составляющих молекулу, называется атомарностью.
Молекула, содержащая только один атом, называется одноатомной
Пример: благородные газы, такие как гелий (He), неон (Ne), аргон (Ar) и т. д.
Молекула, содержащая два атома, называется двухатомной 2 ), хлор (Cl 2 ), азот (N 2 ) и т. д.
Молекула, содержащая три атома, называется трехатомной.
Пример: O 3 , H 2 O.
Молекула, содержащая четыре атома, называется тераатомной.
Пример: фосфор (P 4 ).
Молекула, содержащая большее количество атомов, называется многоатомной.
Пример: сера (S 8 ).
Соединение: Элементы объединяются в соединения. Таким образом, молекула соединения состоит из двух или более элементов.
Пример: вода (H 2 O), глюкоза (C 6 H 12 O 6 ), оксид кальция (CaO), хлорид натрия (NaCl) и т.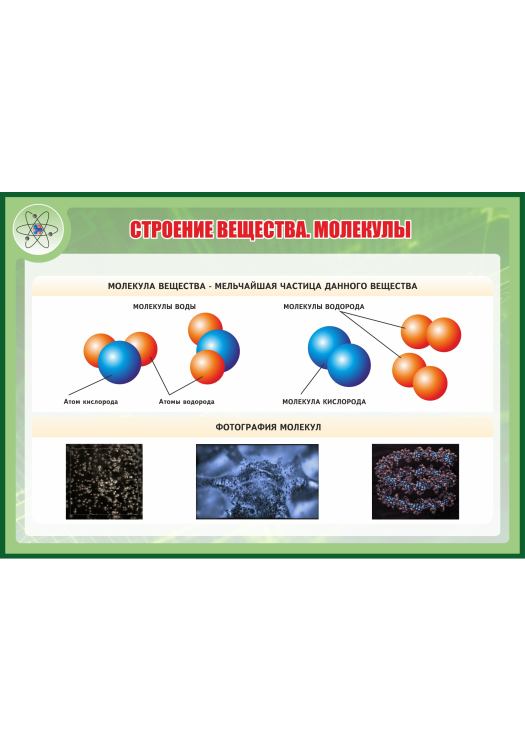 д.
д.
Различия между молекулами и молекулами соединение: Молекула образуется при химическом соединении двух или более атомов. Соединение образуется при химическом соединении различных элементов. Таким образом, молекула соединения состоит из двух или более элементов.
Все соединения являются молекулами, но не все молекулы являются соединениями.
Пример: Молекулярный водород (H 2 ) представляет собой молекулу, но не соединение. Молекула водорода состоит из двух атомов водорода. Вода представляет собой соединение. Вода состоит из двух атомов кислорода и одного атома кислорода, эти атомы объединяются, образуя соединение, известное как вода. Мельчайшая частица воды называется молекулой.
Поваренная соль представляет собой соединение натрия и хлора, где натрий является положительно заряженной частицей, а хлор — отрицательно заряженной частицей, каждая из которых называется ионом.
Ион:
Ион — заряженная частица.
Катион:
Положительно заряженная частица в молекуле называется катионом.
Пример: Na + , Ca +2 .
Анион:
Анион представляет собой отрицательно заряженную частицу в молекуле.
Пример: F — , Cl — .
Различия между Катион и Анион:
Анион | |
Пример: Na + , K + . |
Пример: Cl –, Br –. |
Валентность: Объединяющая способность элемента называется валентностью.
Способность атомов объединяться в молекулы с одинаковыми или разными элементами определяется как валентность.
Атом содержит менее четырех электронов на внешней оболочке; валентность атома равна числу электронов, находящихся на валентной оболочке.
Примеры:
У натрия один электрон на внешней оболочке, поэтому валентность натрия равна 1.
У кальция на внешней оболочке два электрона, поэтому валентность кальция равна 2.
Алюминий имеет три электрона на внешней оболочке, поэтому валентность алюминия равна 3.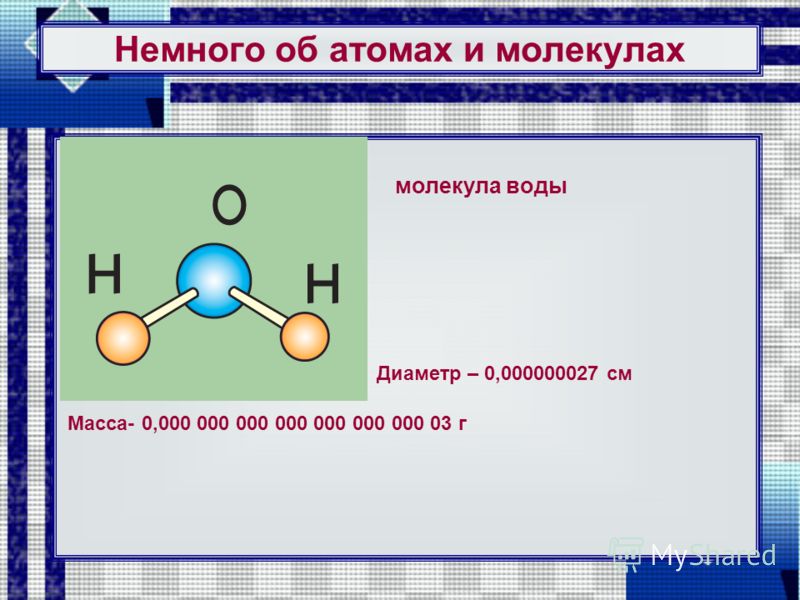
Если на внешней оболочке больше четырех электронов, то валентность = 8 — число электронов во внешней оболочке.
Вопрос: Найдите валентность хлора?
Решение: Атомный номер хлора 17
Электронная конфигурация хлора = 2 8 7
Валентность = 8 — 7 = 1
Валентность хлора 1
Формула простых соединений:
Шаги для написания формулы простого соединения типа H 2 O:
- Напишите символы составляющих элементов.
- Запишите валентность каждого элемента под его символом.
- Перекрестите валентности составляющих элементов и расставьте в качестве нижних индексов, чтобы получить желаемую формулу.
Пример: Вода
Упражнение 1: Activity2:
Шаги для написания формул простых/сложных ионных соединений, таких как Na 2 O и (NH 4 ) 2 (SO 4 ) 2 2 (SO 4 ) 2 2 (SO 4 ) 2 0 2 (SO 4 ) 0 2 (SO 4 ). ионы вместе с зарядами на них. Всегда за катионом следует анион.
ионы вместе с зарядами на них. Всегда за катионом следует анион.
Пример: Сульфат аммония
Learner.org разработал интерактивное моделирование, чтобы узнать об образовании различных ионных соединений с использованием их катионов и анионов из доступного списка ионов.
Перейти к Activity
Компания Unnes.ac разработала интерактивную симуляцию элементов, соединений и материи. А также о различных агрегатных состояниях вещества, а именно твердом, жидком и газообразном. Это также поможет вам узнать об атомной теории Дальтона, различных законах химического соединения с помощью примеров, связанных с нашей повседневной жизнью. Далее викторина с интересными вопросами.



 ст.
ст.