Презентация изомерия и ее виды 10 класс: Презентация на тему «Изомерия» 10 класс
Изомерия органических соединений. 10 класс
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Изомерия органических соединений
Основные понятия,общее представление о видах
изомерии
2. Историческая справка
Юстус Либих(1803-1873)
Фридрих Вёлер
(1800-1882гг.)
3. «Серебряные соли»
Изоциановая кислотаH−N=C=O
Соль Ag-N=C=O
Гремучая кислота
Н−C≡N→О
Соль Ag-О-N=C
4. Историческая справка
Берцелиус Йенс Якоб(1779-1848гг.)
Бутлеров Александр
Михайлович
(1828-1886)
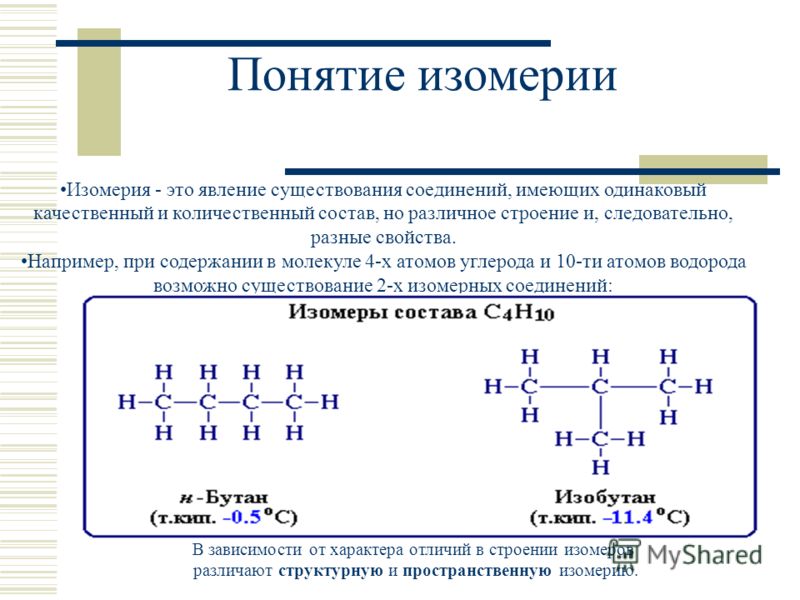
Вещества, которые имеют один и тот же качественный
и количественный составы, но отличаются по своему
строению и свойствам, называются изомерами, а
явление существования таких веществ носит название
изомерии
СН3
СН2
СН2
СН3
БУТАН (С4Н10)
(t кип.
 = — 0,5 С)
= — 0,5 С)СН3
СН
СН3
СН3
ИЗОБУТАН (С4Н10)
(t кип. = -11,7 С)
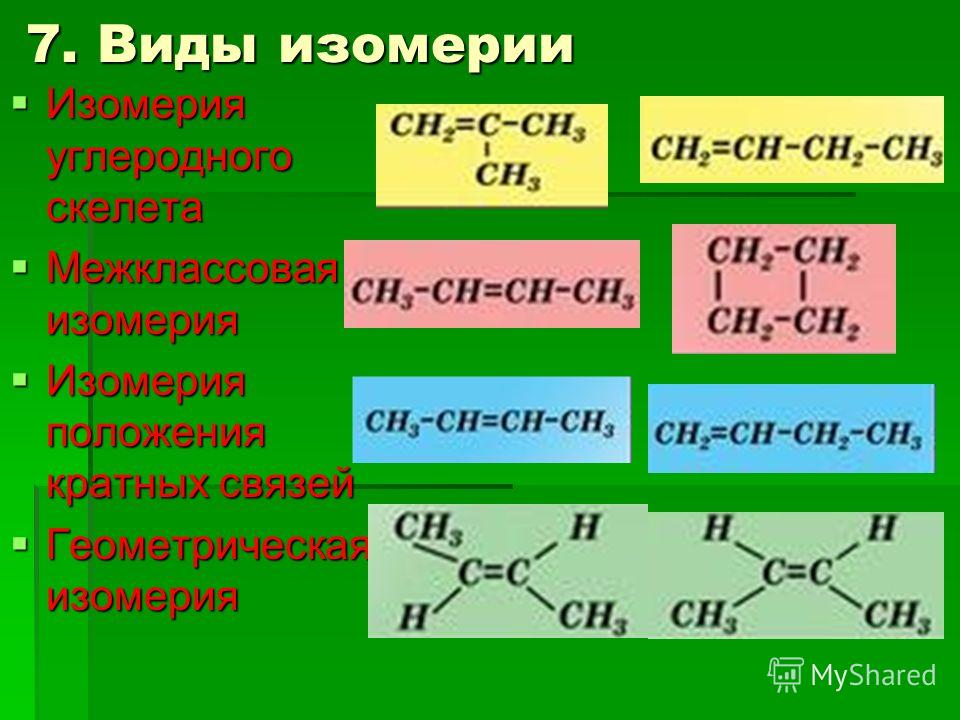
6. Виды изомерии
1.Структурная1.1.Углеродного
скелета
2.Пространственная
2.1.Геометрическая
1.2.Межклассовая
2.2.Оптическая
1.3.Положения:
— кратных связей
— функциональных групп
— заместителей
2.3.Конформационная
7. Структурная изомерия
Структурными называют изомеры, имеющиеразличный порядок соединения атомов или связей в
молекуле.
Виды структурной
изомерии
1.2. Межклассовая
изомерия
1.1.Изомерия
углеродного
скелета
1.3. Изомерия положения кратной связи (С≡С,
С≡С) или
функциональной группы (ОН и др.)
Виды пространственной
изомерии (стереоизомерии)
2.3 Конформационная
2.1.Геометрическая
2.2.Оптическая
*
Модель молекулы этилена
10. 2.1 Геометрическая
Например, для бутена-2, если одинаковыегруппы атомов у атомов углерода при
двойной связи находятся по одну сторону
от плоскости С=С – связи, то молекула
является цис- изомером.
 Если по разные
Если по разныестороны — транс- изомером.
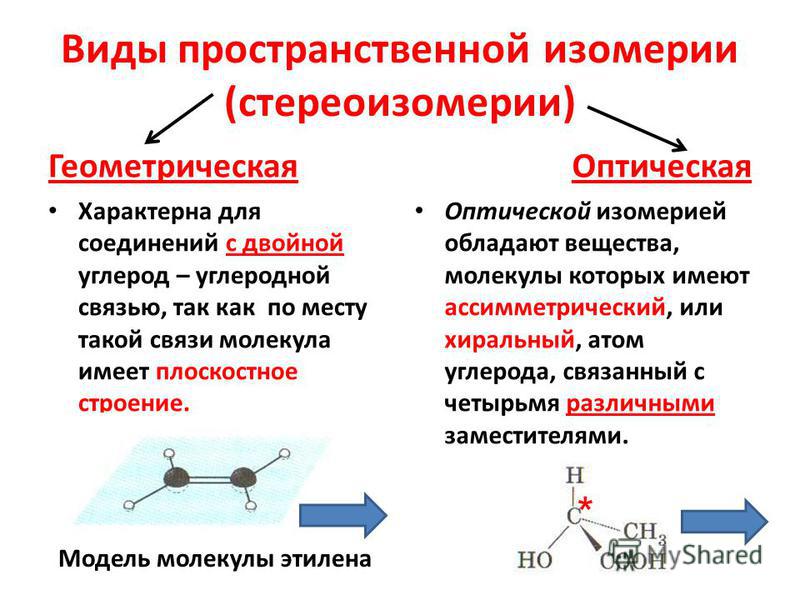
11. 2.2 Оптическая
С греческого хирос – рука – образецнессимметричной фигуры
12. 2.3 Конформационная
13. Что такое изомерия?
— явление существованияизомерных соединений
Какие виды изомерии вы
запомнили?
15. Какие вещества называются изомерами?
— вещества, имеющиеодинаковый качественный и
количественный состав, но
разное строение и разные
свойства
16. Вывод:
Изомеры – соединения, молекулыкоторых содержат атомы одних и
тех же химических элементов, но
отличаются своей формой и
взаимным расположением атомов.
English Русский Правила
Презентация «Изомерия» — Химия — Презентации
Перед вами два вещества. Сравните их.Что общего в их строении и составе и что отличает их друг от друга? Сделайте вывод: одно и тоже это вещество или эти вещества разные.
СН3 – СН2 – СН2 – СН2 – О – Н
Бутиловый спирт
СН3 – СН2 – О – СН2 – СН3
Диэтиловый эфир
С 4 Н 10 О
Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов обуславливает явление изомерии
ИЗОМЕРИЯ
греч. isos – одинаковый, meros – часть
isos – одинаковый, meros – часть
одно из важнейших понятий в органической химии
Вещества, имеющие одинаковый количественный и качественный состав молекул, но отличающиеся по своей структуре и свойствам, называются изомерами
Изомерия была впервые обнаружена Ю.Либихом в 1823, который установил, что серебряные соли гремучей и изоциановой кислот: Ag-О-N=C
и Ag-N=C=O имеют одинаковый состав, но разные свойства.Термин «Изомерия» в 1830 ввел И. Берцелиус, предположивший, что различия в свойствах соединений одинакового состава возникают из-за того, что атомы в молекуле расположены в неодинаковом порядке.
Представления об изомерии окончательно сформировались после создания А.М.Бутлеровым теории химического строения (1860-е).
Изомерия
Структурная
Пространственная
Изомерия
положения
Межклассовая
изомерия
Изомерия
углеродного
скелета
Геометрическая
изомерия
Оптическая
изомерия
СТРУКТУРНАЯ ИЗОМЕРИЯ ИЛИ ИЗОМЕРИЯ ЦЕПИ
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы.
А
В
Б
Правело построения структурных изомеров
С 6 Н 14 гексан
1.Запишите линейную цепь состоящую из 6-ти атомов углерода
2. Укоротите цепь на один атом углерода и мысленно делите полученную цепь пополам.
3. Проставьте атом углерода к любому атому в цепи кроме крайнего, не заходя за пунктирную линию.
4. Еще раз укоротите цепь, разделите ее пунктирной линией и проставьте атомы углерода к любому из атом углерода в цепи кроме крайних не заходя за пунктирную линию.
5. Просмотрите как еще можно расставить атомы углерода в цепи и расставьте их с учетом пунктирной линии.
6. Осталось расставить атомы водорода с учетом валентности атома углерода.
С – С – С – С – С – С
С – С – С – С – С
С
С – С – С – С – С
С
С – С – С – С
С С
С
С – С – С – С
С
С увеличением числа атомов углерода в молекуле число изомеров быстро растёт .
Насыщенные углеводороды, содержащие от одного до трех атомов углерода ( метан, этан, пропан ), не имеют изомеров.
С увеличением числа атомов углерода в цепи число изомеров непропорционально растет
Углеводород
Число изомеров
Бутан
2
Пентан
3
Гексан
5
Гептан
9
Октан
18
Нонан
35
Декан
75
Пентадекан
4347
Определите на какое число изомеров отличаются между собой гептан и октан
Два соединения одинакового состава считают изомерами, если их молекулы нельзя совместить в пространстве так, чтобы они полностью совпадали. Совмещение, как правило, проделывают мысленно.
Определите какие из приведенных веществ являются гомологами, а какие изомерами:
Н
г) Н 3 С – СН – С – СН 3
СН 3 Н
а) Н 3 С – СН 2 – СН 2 – СН 3
Н
б) Н 3 С – СН 2 – С – СН 3
СН 3
д) Н 3 С – СН 2 СН 3
СН 2 СН 2
СН 3
в) Н 3 С – С – СН
3СН 3
е) Н 3 С – (СН 2 ) 3
СН 3
ж) Н 2 С = С – СН 2 – СН 2 – СН 3
Н
Изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета.
Н 3 С – СН 2 – СН 2 – СН 2 – СН 2 – СН 2
ОН
Н 2 С = СН – СН 2 – СН 2 – СН 3
Пентен — 1
Гексанол — 1
Н 3 С – СН 2 – СН 2 – СН 2 – СН – СН 3
ОН
Н 3 С – СН = СН – СН 2 – СН 3
Гексанол — 2
Пентен — 2
Н 3 С – СН 2 – СН 2 – СН – СН 2 – СН 3
ОН
Гексанол — 3
Последовавший затем синтез всех изомеров бутанола и определение их свойств стали убедительным подтверждением теории.
Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола .
Изомеры бутена и дихлорбензола
Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами
.Примером служат три изомера для соединения С3Н8О, два из них – спирты, а третье – простой эфир
Межклассовая изомерия обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих различным классам.
CH 2 СН CH 2 CH 3
Бутен- 1
H 2 C CH 2
H 2 C CH 2
Циклобутан
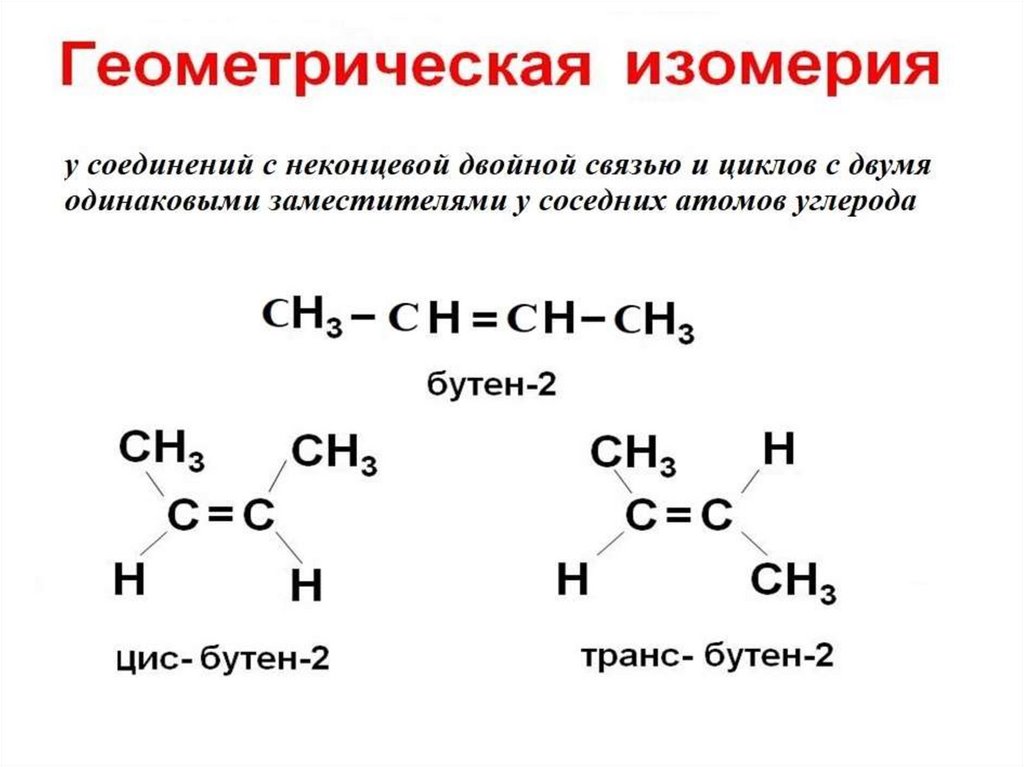
Цис-транс-изомерия наблюдается в соединениях, содержащих кратные связи или плоские циклы. В отличие от простой связи, кратная связь не позволяет вращать вокруг нее отдельные фрагменты молекулы.
Для того чтобы определить тип изомера, через двойную связь мысленно проводят плоскость и далее анализируют то, как размещаются заместители относительно этой плоскости
Оптическая изомерия возникает в тех случаях, когда два изомера, представляют собой зеркальное отражение друг друга. Таким свойством обладают молекулы, которые могут быть представлены в виде одиночного атома углерода, имеющего четыре различных заместителя
Если при совмещении молекул в пространстве совпадения не происходят, то молекулы данных веществ являются изомерами
Если при совмещении молекул происходит совпадение всех атомов в молекуле данного вещества в пространстве, то вы имеете дело с одним и тем же веществом
1. Какие виды изомерии вы знаете?
2. Чем отличается пространственная изомерия от структурной?
Чем отличается пространственная изомерия от структурной?
Изомерия и ее виды
Изомерия и ее видыРеклама
1 из 16
Верхний вырезанный слайд
Скачать для чтения офлайн
Наука
Приложение по всем видам изомерии .
Реклама
Реклама
Изомерия и ее виды
- Тематика- Изомерия и ее виды
- Органическая химия — это раздел химии, включающий научное изучение строения, свойств и реакции органических соединений и органических материалов, т.е. вещества в его различных формах, содержащих углерод атомы. Изучение строения включает в себя множество физических и химические методы определения хим. состав и химическое строение органических соединения и материалы.
- Что такое изомерия?
Органические соединения, имеющие одинаковую молекулярную
формула, но другие структуры известны как изомеры.
Это явление известно как изомерия.
 Другими словами, органические соединения, имеющие
та же молекулярная формула, но разное расположение
атомы углерода в них, известны как изомеры.
Другими словами, органические соединения, имеющие
та же молекулярная формула, но разное расположение
атомы углерода в них, известны как изомеры. - Этот тип изомерии подразделяется на 6 типов- 1. Цепная изомерия. 2. Позиционная изомерия. 3. Функциональная изомерия. 4. Изомерия кольцевой цепи. 5. Метамерия Изомерия. 6. Таутомерия Изомерия СТРУКТУРНАЯ ИЗОМЕРИЯ
- 1. ЦЕПНАЯ ИЗОМЕРИЯ Одна и та же молекулярная формула представляет два или более соединения. Отличается характером углеродной цепи (прямая или разветвленная). Например, C4h20 (бутан) имеет два изомера, а именно бутан и 2- метилпропан. БУТАН 2-МЕТИЛПРОПАН
- 2. ПОЗИЦИОННАЯ ИЗОМЕРИЯ Одна и та же молекулярная формула представляет два или более соединения. Различается положением одной и той же функциональной группы Например, у бутена есть два изомера, а именно бут-1-ен и Бут-2-ен. БУТ-1-ЕНЕ БУТ-2-ЕНЕ
- 3. ФУНКЦИОНАЛЬНАЯ ИЗОМЕРИЯ
Одна и та же молекулярная формула представляет два или более
соединения.
 Отличается характером функциональной группы.
Например, C3H602 имеет два изомера, а именно пропановую кислоту и
Метилэтаноат.
ПРОПАНОВАЯ АКД МЕТИЛЭТАНОАТ
Отличается характером функциональной группы.
Например, C3H602 имеет два изомера, а именно пропановую кислоту и
Метилэтаноат.
ПРОПАНОВАЯ АКД МЕТИЛЭТАНОАТ - 4. МЕТАМЕРИЯ ИЗОМЕРИЯ Одна и та же молекулярная формула представляет собой два или более соединений. различаются по природе алкильных групп, присоединенных к одному и тому же функциональная группа. Пример, диэтиловый эфир и метилпропиловый эфир являются метамерными изомеры. ДИЭТИЛОВЫЙ ЭФИР МЕТИЛПРОПИЛОВЫЙ ЭФИР
- 5. ИЗОМЕРИЯ КОЛЬЦЕВОЙ ЦЕПИ Одна и та же молекулярная формула представляет собой два или более соединений. Различается способом соединения атомов углерода. Изомеры имеют открытую или замкнутую цепь. Например, пропен и циклопропан являются изомерами кольцевой цепи. ПРОПЕН ЦИКЛОПРОПАН
- 6. ТАУТОМЕРИЯ ИЗОМЕРИЯ
Одна и та же молекулярная формула представляет два или более
соединения.
Они находятся в динамическом равновесии друг с другом. Может быть
присутствует во многих формах, таких как нитроформная и аци-форма,
Кетоформная и энольная формы и др.
 Например, нитроэтан и изонитроэтан являются таутомерными
изомеры.
НИТРОЭТАН (нитроформа) ИЗОНИТРОЭТАН (ациформа)
Например, нитроэтан и изонитроэтан являются таутомерными
изомеры.
НИТРОЭТАН (нитроформа) ИЗОНИТРОЭТАН (ациформа) - СТЕРЕОИЗОМЕРИЯ Этот тип изомерии отличается пространственным расположением атомов или группы. Он бывает двух видов – 1. Геометрическая изомерия. 2. Оптическая изомерия.
- 6. ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ Одна и та же молекулярная формула представляет собой два или более соединений. Отличается пространственным расположением атомов или групп вокруг углерод- углеродная двойная связь. Он бывает двух типов. Если одна и та же группа находится на одной стороне, то это называется «цис». изомеры, а если он находится на противоположных сторонах, то он называется транс-изомером. Например, цис-2-бутен и транс-2-бутен представляют собой «цис» и «транс» изомеры.
- 6. ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Оптические изомеры названы так из-за их влияния на
плоскополяризованный свет.
Оптические изомеры, которые не накладываются друг на друга зеркальными отображениями.
 друг друга, называются энантиомерами.
Пример, d-аланин и l-аланин, молочная кислота и т. д.
друг друга, называются энантиомерами.
Пример, d-аланин и l-аланин, молочная кислота и т. д. - 1. http//:www.google.com 2. http//:en.wikipedia.org 3. http//:www.chemguide.co.uk 4. Наука для десятого класса «ХИМИЯ» Лахмир Сингх и Манджит Каур. 5. Краткая «ХИМИЯ» для XII класса ISC Селены. Издатели.
- Презентация… Сушмита Сингх Скай Сил Сухрид Бисвас Сумали Дас Сумьядип Майти
Примечания редактора
- ДИЭТИЛОВЫЙ ЭФИР МЕТИЛПРОПИЛОВЫЙ ЭФИР
- НИТРОЭТАН (нитроформ) ИЗОНИТРОЭТАН (ациформ)
Реклама 9000 3
Изомерия Power Point
Изомерия Power PointРеклама
1 из 54
Верхний вырезанный слайд
Скачать для чтения офлайн
Образование
Технологии
Подробное цифровое описание изомерии.
Реклама
Реклама
Изомерия Power Point
- ISOM RISM Е Руководство для студентов
- ИЗОМЕРИЯ СОДЕРЖАНИЕ • Предварительные знания • Типы изомерии • Структурная изомерия • Стереоизомерия • Геометрическая изомерия • Оптическая изомерия • Контрольный список
- ИЗОМЕРИЯ Прежде чем начать, было бы полезно… • знать функциональные группы, встречающиеся в органической химии • знать расположение связей вокруг атомов углерода • знать, что влияет на температуру кипения органических молекул
- ВИДЫ ИЗОМЕРИИ
ЦЕПНАЯ ИЗОМЕРИЯ
СТРУКТУРНАЯ ИЗОМЕРИЯ
Та же молекулярная формула, но
различные структурные формулы
ПОЗИЦИОННАЯ ИЗОМЕРИЯ
ФУНКЦИОНАЛЬНАЯ ГРУППА
ИЗОМЕРИЯ
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
СТЕРЕОИЗОМЕРИЯ
Тот же молекулярный
формула, но атомы
занимать разные
позиции в космосе.
 Возникает из-за ограничения
вращение двойных связей С=С…
две формы… E и Z (СНГ и
ТРАНС)
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Происходит, когда молекулы имеют
хиральный центр. Получите два ненакладывающихся зеркальных изображения.
Возникает из-за ограничения
вращение двойных связей С=С…
две формы… E и Z (СНГ и
ТРАНС)
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Происходит, когда молекулы имеют
хиральный центр. Получите два ненакладывающихся зеркальных изображения. - СТРУКТУРНАЯ ИЗОМЕРИЯ — ВВЕДЕНИЕ СОЕДИНЕНИЯ ИМЕЮТ ОДИНАКОВУЮ МОЛЕКУЛЯРНУЮ ФОРМУЛУ НО РАЗНАЯ СТРУКТУРНАЯ ФОРМУЛА Цепь разное расположение углеродного скелета схожие химические свойства немного другие физические свойства больше разветвления = более низкая температура кипения
- СТРУКТУРНАЯ ИЗОМЕРИЯ — ВВЕДЕНИЕ СОЕДИНЕНИЯ ИМЕЮТ ОДИНАКОВУЮ МОЛЕКУЛЯРНУЮ ФОРМУЛУ НО РАЗНАЯ СТРУКТУРНАЯ ФОРМУЛА Цепь разное расположение углеродного скелета схожие химические свойства немного другие физические свойства больше разветвления = более низкая температура кипения Позиционный тот же углеродный скелет та же функциональная группа функциональная группа находится в другом положении похожие химические свойства — немного разные физические свойства
- СТРУКТУРНАЯ ИЗОМЕРИЯ — ВВЕДЕНИЕ
СОЕДИНЕНИЯ ИМЕЮТ ОДИНАКОВУЮ МОЛЕКУЛЯРНУЮ ФОРМУЛУ
НО РАЗНАЯ СТРУКТУРНАЯ ФОРМУЛА
Цепь
разное расположение углеродного скелета
схожие химические свойства
немного другие физические свойства
больше разветвления = более низкая температура кипения
Позиционный
тот же углеродный скелет
та же функциональная группа
функциональная группа находится в другом положении
похожие химические свойства — немного разные физические свойства
Функциональная группа Другая функциональная группа
различные химические свойства
различные физические свойства
• Иногда в одной и той же молекуле встречается более одного типа изомерии.
 • Чем больше атомов углерода, тем больше возможных изомеров.
• Чем больше атомов углерода, тем больше возможных изомеров. - СТРУКТУРНАЯ ИЗОМЕРИЯ — ЦЕПНАЯ обусловлены различным устройством углеродного скелета схожие химические свойства немного другие физические свойства больше разветвления = более низкая температура кипения Есть два структурных изомера C4h20. Одна представляет собой молекулу с прямой цепью, в которой все атомы углерода расположены в один ряд. Другая представляет собой разветвленную молекулу, в которой три атомы углерода расположены в ряд и один атом углерода торчит из основной цепи. БУТАН прямая цепь 2-МЕТИЛПРОПАН разветвленный C4h20
- СТРУКТУРНАЯ ИЗОМЕРИЯ — ЦЕПНАЯ
РАЗЛИЧИЯ МЕЖДУ ЦЕПНЫМИ ИЗОМЕРАМИ
Химическая
Изомеры проявляют сходные химические свойства, потому что
присутствует одна и та же функциональная группа.
Физический
Такие свойства, как плотность и температура кипения, показывают тенденции в зависимости от
по степени ветвления
Точка кипения
Изомеры с прямой цепью имеют более высокие значения, чем изомеры с разветвленной цепью.
 чем больше степень разветвления, тем ниже температура кипения
разветвление снижает эффективность межмолекулярных сил
требуется меньше энергии для разделения молекул
— 0,5°С
прямая цепь
— 11,7°С
разветвленный
большее разветвление
= более низкая температура кипения
чем больше степень разветвления, тем ниже температура кипения
разветвление снижает эффективность межмолекулярных сил
требуется меньше энергии для разделения молекул
— 0,5°С
прямая цепь
— 11,7°С
разветвленный
большее разветвление
= более низкая температура кипения - СТРУКТУРНАЯ ИЗОМЕРИЯ — ПОЗИЦИОННАЯ молекула имеет одинаковый углеродный скелет молекула имеет ту же самую функциональную группу… НО функциональная группа находится в другом положении имеют схожие химические свойства / разные физические свойства Пример 1 ПОЛОЖЕНИЕ ДВОЙНОЙ СВЯЗИ В АЛКЕНАХ 1 2 ПЕНТ-1-ЕНЭ двойная связь между углероды 1 и 2 2 3 ПЕНТ-2-ЕНЭ двойная связь между углероды 2 и 3 Других изомеров с пятью C в самой длинной цепи нет, но есть три другие структурные изомеры с цепью из четырех атомов углерода плюс один в ответвлении.
- СТРУКТУРНАЯ ИЗОМЕРИЯ — ПОЗИЦИОННАЯ
молекула имеет одинаковый углеродный скелет
молекула имеет ту же самую функциональную группу… НО
функциональная группа находится в другом положении
имеют схожие химические свойства / разные физические свойства
Пример 2
ПОЛОЖЕНИЕ ГАЛОГЕНА В ГАЛОАЛКАНЕ
1
1-ХЛОРБУТАН
галоген на углероде 1
2
2-ХЛОРБУТАН
галоген на углероде 2
НО
2
не является
3-ХЛОРБУТАН
Перемещение хлора по цепи приводит к образованию новых изомеров; положение измеряется от
конец, ближайший к функциональной группе.
 .. третий пример — 2-НЕ 3-хлорбутан.
Есть еще 2 структурных изомера C4H9.Cl, но у них самая длинная цепочка из 3
.. третий пример — 2-НЕ 3-хлорбутан.
Есть еще 2 структурных изомера C4H9.Cl, но у них самая длинная цепочка из 3 - СТРУКТУРНАЯ ИЗОМЕРИЯ — ПОЗИЦИОННАЯ молекула имеет одинаковый углеродный скелет молекула имеет ту же самую функциональную группу… НО функциональная группа находится в другом положении имеют схожие химические свойства / разные физические свойства Пример 3 ОТНОСИТЕЛЬНОЕ ПОЛОЖЕНИЕ НА БЕНЗОЛОВОМ КОЛЬЦЕ 1,2-ДИХЛОРБЕНЗОЛ орто-дихлорбензол 1,3-ДИХЛОРБЕНЗОЛ мета-дихлорбензол 1,4-ДИХЛОРБЕНЗОЛ пара-дихлорбензол
- СТРУКТУРНАЯ ИЗОМЕРИЯ – ФУНКЦИОНАЛЬНАЯ ГРУППА молекулы имеют одинаковую молекулярную формулу молекулы имеют разные функциональные группы молекулы имеют разные химические свойства молекулы имеют разные физические свойства СПИРТЫ И ЭФИР АЛЬДЕГИДЫ и КЕТОНЫ КИСЛОТЫ и ЭФИРЫ
- СТРУКТУРНАЯ ИЗОМЕРИЯ – ФУНКЦИОНАЛЬНАЯ ГРУППА
СПИРТЫ И ЭФИР
Имя
СПИРТ ЭТИЛОВЫЙ
МЕТОКСИМЕТАН
Классификация
АЛКОГОЛЬ
ЭФИР
Функциональная группа
Р-ОН
Физические свойства
полярная связь ОН дает
к водородной связи.
 получить более высокую температуру кипения
и растворимость в воде
Химические свойства
База Льюиса
Широкий спектр реакций
Р-О-Р
Нет водородной связи
низкая температура кипения
нерастворим в воде
Инертный
получить более высокую температуру кипения
и растворимость в воде
Химические свойства
База Льюиса
Широкий спектр реакций
Р-О-Р
Нет водородной связи
низкая температура кипения
нерастворим в воде
Инертный - СТРУКТУРНАЯ ИЗОМЕРИЯ – ФУНКЦИОНАЛЬНАЯ ГРУППА АЛЬДЕГИДЫ и КЕТОНЫ Имя ПРОПАНАЛЬ Классификация АЛЬДЕГИД КЕТОН Р-ЧО Р-КО-Р Функциональная группа ПРОПАНОН Физические свойства полярная связь C=O дает диполь-дипольное взаимодействие полярная связь C=O дает диполь-дипольное взаимодействие Химические свойства легко окисляется до кислот одинаковое количество атомов углерода подвергаться окислению под только экстремальные условия восстановленные до 1° спирты восстановленный до 2° спиртов
- СТРУКТУРНАЯ ИЗОМЕРИЯ – ФУНКЦИОНАЛЬНАЯ ГРУППА КАРБОНОВЫЕ КИСЛОТЫ И ЭФИРЫ Имя ПРОПАНОВАЯ КИСЛОТА Классификация КАРБОНОВАЯ КИСЛОТА Функциональная группа R-COOH МЕТИЛ ЭТАНОАТ Эстер Р-КООР Физические свойства Связь ОН дает к водородной связи. получить более высокую температуру кипения и растворимость в воде Нет водородной связи нерастворим в воде Химические свойства кислый реагировать со спиртами довольно нереактивный гидролизуется до кислот
- СТЕРЕОИЗОМЕРИЯ
Молекулы имеют ОДИНАКОВУЮ МОЛЕКУЛЯРНУЮ ФОРМУЛУ, но атомы
соединены друг с другом в РАЗНОМ ПРОСТРАНСТВЕ — они
занимают другое положение в трехмерном пространстве.
 Есть два типа…
• ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
• ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Есть два типа…
• ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
• ОПТИЧЕСКАЯ ИЗОМЕРИЯ - ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Введение • • • • пример стереоизомерии обнаружен в некоторых, но не во всех алкенах происходит за счет ОГРАНИЧЕННОГО ВРАЩЕНИЯ С=С связей получить две формы…
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Введение • • • • пример стереоизомерии обнаружен в некоторых, но не во всех алкенах происходит за счет ОГРАНИЧЕННОГО ВРАЩЕНИЯ С=С связей получить две формы… СНГ (Я) Группы/атомы находятся на С ОДНОЙ СТОРОНЫ двойной связи ТРАНС (Е) Группы/атомы находятся НА ПРОТИВОПОЛОЖНЫХ СТОРОНЫ по двойной связи
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ ОГРАНИЧЕННОЕ ВРАЩЕНИЕ С=С-СВЯЗЕЙ Одинарные ковалентные связи могут легко вращаться. То, что кажется другой структурой, нет. Похоже на то, но из-за того, как написаны структуры, они одинаковы. ВСЕ ЭТИ СТРУКТУРЫ ОДИНАКОВЫ, ПОТОМУ ЧТО СВЯЗИ C-C ИМЕЮТ «СВОБОДНОЕ» ВРАЩЕНИЕ Анимация не работа в старом версии Силовая установка
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
ОГРАНИЧЕННОЕ ВРАЩЕНИЕ С=С-СВЯЗЕЙ
Связи C=C имеют ограниченное вращение, поэтому группы на обоих концах связи
«застыл» в одном положении; переключаться между ними непросто.
 Анимация не
работа в старом
версии
Силовая установка
Это дает две возможности. Две структуры не могут легко взаимозаменяемы
поэтому атомы в двух молекулах занимают разные положения в пространстве.
Анимация не
работа в старом
версии
Силовая установка
Это дает две возможности. Две структуры не могут легко взаимозаменяемы
поэтому атомы в двух молекулах занимают разные положения в пространстве. - ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Э/З или СНГ-ТРАНС Э/Я Z (зусаммен) группы/атомы с более высоким приоритетом на ОДИНАКОВАЯ сторона связи C=C E (энтгеген) группы/атомы с более высоким приоритетом на ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Э/З или СНГ-ТРАНС Э/Я Z (зусаммен) группы/атомы с более высоким приоритетом на ОДИНАКОВАЯ сторона связи C=C E (энтгеген) группы/атомы с более высоким приоритетом на ПРОТИВОПОЛОЖНЫЕ стороны связи C=C Для определения приоритета используется соглашение Кана, Ингольда и Прелога. например C2H5>Ч4>Н и I > Br > Cl > F > C > H
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ
Э/З или СНГ-ТРАНС
Э/Я
Z (зусаммен)
группы/атомы с более высоким приоритетом на
ОДИНАКОВАЯ сторона связи C=C
E (энтгеген)
группы/атомы с более высоким приоритетом на
ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
Для определения приоритета используется соглашение Кана, Ингольда и Прелога.
 например
C2H5>Ч4>Н
и
I > Br > Cl > F > C > H
например
C2H5>Ч4>Н
и
I > Br > Cl > F > C > H - ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Э/З или СНГ-ТРАНС Z (зусаммен) группы/атомы с более высоким приоритетом на ОДИНАКОВАЯ сторона связи C=C E (энтгеген) Э/Я группы/атомы с более высоким приоритетом на ПРОТИВОПОЛОЖНЫЕ стороны связи C=C Для определения приоритета используется соглашение Кана, Ингольда и Прелога. например Е C2H5>Ч4>Н Z и I > Br > Cl > F > C > H Z Е
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Э/З или СНГ-ТРАНС СНГ / ТРАНС Следует использовать только при наличии двух букв H и двух неводородные группы, присоединенные к каждому углероду. цис неводородные группы/атомы на ОДИНАКОВАЯ сторона связи C=C транс неводородные группы/атомы на ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ Э/З или СНГ-ТРАНС СНГ / ТРАНС Следует использовать только при наличии двух букв H и двух неводородные группы, присоединенные к каждому углероду. цис неводородные группы/атомы на ОДИНАКОВАЯ сторона связи C=C транс неводородные группы/атомы на ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ В АЛКЕНАХ
Э/З или СНГ-ТРАНС
СНГ /
ТРАНС
Следует использовать только при наличии двух букв H и двух
неводородные группы, присоединенные к каждому углероду.
 цис
неводородные группы/атомы на
ОДИНАКОВАЯ сторона связи C=C
транс
неводородные группы/атомы на
ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
цис
транс
цис
транс
цис
неводородные группы/атомы на
ОДИНАКОВАЯ сторона связи C=C
транс
неводородные группы/атомы на
ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
цис
транс
цис
транс - ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ Изомерия бутена Есть 3 структурных изомера C4H8, которые являются алкенами*. Из них ТОЛЬКО ONE проявляет геометрическую изомерию. бут-1-ен цис-бут-2-ен (Z) бут-2-ен транс-бут-2-ен (E) бут-2-ен 2-метилпропен * ВЫ МОЖЕТЕ ПОЛУЧИТЬ АЛКАНЫ С ФОРМУЛОЙ C4H8, ЕСЛИ АТОМЫ УГЛЕРОДА В КОЛЬЦЕ
- ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ Как узнать, существует ли он Два разных атомы/группы прикрепил Два разных атомы/группы прикрепил Два похожих атомы/группы прикрепил Два похожих атомы/группы прикрепил Два похожих атомы/группы прикрепил Два разных атомы/группы прикрепил Два разных атомы/группы прикрепил Два разных атомы/группы прикрепил ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ Как только вы получите два похожих атомы/группы, присоединенные к один конец C=C, вы не может иметь геометрических изомерия ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Вхождение
другая форма стереоизомерии
возникает, когда соединения имеют несовместимые зеркальные изображения
Изомеры
две разные формы известны как оптические изомеры или энантиомеры.
 они возникают, когда молекулы имеют хиральный центр
хиральный центр содержит асимметричный атом углерода
асимметричный углерод имеет четыре разных атома (или группы)
расположены вокруг нее четырехгранно.
они возникают, когда молекулы имеют хиральный центр
хиральный центр содержит асимметричный атом углерода
асимметричный углерод имеет четыре разных атома (или группы)
расположены вокруг нее четырехгранно. - ОПТИЧЕСКАЯ ИЗОМЕРИЯ Вхождение другая форма стереоизомерии возникает, когда соединения имеют несовместимые зеркальные изображения Изомеры две разные формы известны как оптические изомеры или энантиомеры. они возникают, когда молекулы имеют хиральный центр хиральный центр содержит асимметричный атом углерода асимметричный углерод имеет четыре разных атома (или группы) расположены вокруг нее четырехгранно. ХИРАЛЬНЫЕ ЦЕНТРЫ Есть четыре разных цвета расположены четырехгранно относительно атом углерода 2-хлорбутан проявляет оптическую изомерию потому что у второго атома углерода четыре разные атомы/группы прикреплены
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
ОБНАРУЖЕНИЕ ХИРАЛЬНЫХ ЦЕНТРОВ
Посмотрите на каждый атом углерода в цепи и посмотрите, что к нему присоединено. Для хирального центра
вам нужен асимметричный углерод с четырьмя различными атомами/группами), расположенными вокруг него тетраэдрически.
 ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ ОБНАРУЖЕНИЕ ХИРАЛЬНЫХ ЦЕНТРОВ Посмотрите на каждый атом углерода в цепи и посмотрите, что к нему присоединено. Для хирального центра вам нужен асимметричный углерод с четырьмя различными атомами/группами), расположенными вокруг него тетраэдрически. ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ Ч4Ч3Ч3Ч3Cl 1-хлорбутан Ч4Ч3СНClЧ4 2-хлорбутан С С С С 3 H вокруг него 2 H вокруг него 2 H вокруг него 2 H вокруг него НЕ хиральный НЕ хиральный НЕ хиральный НЕ хиральный С С С С 3 H вокруг него 2 H вокруг него H, Ch4, Cl, C2H5 вокруг него 3 H вокруг него НЕ хиральный НЕ хиральный ХИРАЛЬНЫЙ НЕ хиральный
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
ОБНАРУЖЕНИЕ ХИРАЛЬНЫХ ЦЕНТРОВ
Посмотрите на каждый атом углерода в цепи и посмотрите, что к нему присоединено.
 Для хирального центра
вам нужен асимметричный углерод с четырьмя различными атомами/группами), расположенными вокруг него тетраэдрически.
ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
Ч4Ч3СНClЧ4
2-хлорбутан
(Ч4)2СНЧ3Cl
1-хлор-2-метилпропанан
(Ч4)3CCl
2-хлор-2-метилпропанан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
С
С
С
С
3 H вокруг него
2 H вокруг него
H, Ch4, Cl, C2H5 вокруг него
3 H вокруг него
НЕ хиральный
НЕ хиральный
ХИРАЛЬНЫЙ
НЕ хиральный
C 3 H вокруг него
C 2 Ch4 вокруг него
C 2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
C 3 H вокруг него
C 3 Ch4 вокруг него
НЕ хиральный
НЕ хиральный
Для хирального центра
вам нужен асимметричный углерод с четырьмя различными атомами/группами), расположенными вокруг него тетраэдрически.
ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
Ч4Ч3СНClЧ4
2-хлорбутан
(Ч4)2СНЧ3Cl
1-хлор-2-метилпропанан
(Ч4)3CCl
2-хлор-2-метилпропанан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
С
С
С
С
3 H вокруг него
2 H вокруг него
H, Ch4, Cl, C2H5 вокруг него
3 H вокруг него
НЕ хиральный
НЕ хиральный
ХИРАЛЬНЫЙ
НЕ хиральный
C 3 H вокруг него
C 2 Ch4 вокруг него
C 2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
C 3 H вокруг него
C 3 Ch4 вокруг него
НЕ хиральный
НЕ хиральный
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ Пространственные различия между изомерами • существуют две формы, которые являются НЕНАЛОЖИМЫМИ ЗЕРКАЛЬНЫМИ ИЗОБРАЖЕНИЯМИ друг друга • несовместимость означает, что вы не можете поставить одну форму точно поверх другой
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Пространственные различия между изомерами
• существуют две формы, которые являются НЕНАЛОЖИМЫМИ ЗЕРКАЛЬНЫМИ ИЗОБРАЖЕНИЯМИ друг друга
• несовместимость означает, что вы не можете поставить одну форму точно поверх другой
Некоторые общие объекты являются зеркальными изображениями и накладываются друг на друга.
 накладываемые, но не зеркальные изображения
не накладываемые зеркальные изображения
ложки
книги
Руки
накладываемые, но не зеркальные изображения
не накладываемые зеркальные изображения
ложки
книги
Руки - ОПТИЧЕСКАЯ ИЗОМЕРИЯ Пространственные различия между изомерами • существуют две формы, которые являются НЕНАЛОЖИМЫМИ ЗЕРКАЛЬНЫМИ ИЗОБРАЖЕНИЯМИ друг друга • несовместимость означает, что вы не можете поставить одну форму точно поверх другой Некоторые общие объекты являются зеркальными изображениями и накладываются друг на друга. накладываемые, но не зеркальные изображения не накладываемые зеркальные изображения NB Для оптической изомерии в молекулах должны выполняться оба условия… они должны быть зеркальными отображениями и не накладываться друг на друга ложки книги Руки
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ Что такое ненакладываемое зеркальное отображение? Анимация не работа в старом версии Силовая установка
- ОПТИЧЕСКИЕ ИЗОМЕРЫ — ОТЛИЧИЕ
•
•
•
•
•
изомеры по-разному реагируют на плоскополяризованный свет.
плоскополяризованный свет колеблется только в одном направлении
один изомер поворачивает свет вправо, другой влево
вращение света измеряется с помощью поляриметра
вращение измеряется путем наблюдения за поляризованным светом, идущим к наблюдателю.

- ОПТИЧЕСКИЕ ИЗОМЕРЫ — ОТЛИЧИЕ • • • • • изомеры по-разному реагируют на плоскополяризованный свет. плоскополяризованный свет колеблется только в одном направлении один изомер поворачивает свет вправо, другой влево вращение света измеряется с помощью поляриметра вращение измеряется путем наблюдения за поляризованным светом, идущим к наблюдателю. • Если кажется, что свет повернулся направо ПРАВОСТОРОННИЙ д или + форма повернулся налево ЛАЕВОРОТАТОРЫ л или — форма
- ОПТИЧЕСКИЕ ИЗОМЕРЫ — ОТЛИЧИЕ
•
•
•
•
•
изомеры по-разному реагируют на плоскополяризованный свет.
плоскополяризованный свет колеблется только в одном направлении
один изомер поворачивает свет вправо, другой влево
вращение света измеряется с помощью поляриметра
вращение измеряется путем наблюдения за поляризованным светом, идущим к наблюдателю.
• Если кажется, что свет
повернулся направо
ПРАВОСТОРОННИЙ
д или + форма
повернулся налево
ЛАЕВОРОТАТОРЫ
л или — форма
рацемат
смесь 50-50 двух энантиомеров (dl) или (±) представляет собой рацемическую смесь.
 Противоположные оптические эффекты каждого изомера компенсируют друг друга.
Примеры
Оптическая активность широко распространена в биохимии и фармацевтике.
• Большинство аминокислот проявляют оптическую активность
• многие лекарства должны быть сделаны из одного оптического изомера, чтобы быть эффективными
— нужны меньшие дозы (безопаснее и экономичнее)
— получить меньше побочных эффектов
— улучшенная фармакологическая активность
Противоположные оптические эффекты каждого изомера компенсируют друг друга.
Примеры
Оптическая активность широко распространена в биохимии и фармацевтике.
• Большинство аминокислот проявляют оптическую активность
• многие лекарства должны быть сделаны из одного оптического изомера, чтобы быть эффективными
— нужны меньшие дозы (безопаснее и экономичнее)
— получить меньше побочных эффектов
— улучшенная фармакологическая активность - ОПТИЧЕСКАЯ ИЗОМЕРИЯ Поляриметр А Б С Д Е Ф А Б С Д Е Ф Источник света излучает свет, вибрирующий во всех направлениях Поляризационный фильтр позволяет свету вибрировать только в одном направлении Плоскополяризованный свет проходит через образец Если вещество оптически активно, оно вращает плоскополяризованный свет Анализирующий фильтр повернут так, чтобы свет достиг максимума Направление вращения измеряется приближаясь к наблюдателю Если кажется, что свет повернулся направо ПРАВОСТОРОННИЙ повернулся налево ЛАЕВОРОТАТОРЫ
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Как могут образовываться оптические изомеры
Карбонильные соединения подвергаются нуклеофильному присоединению.
 Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
Если нуклеофильный цианид-ион
атаки сверху один
образуется оптический изомер
Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
Если нуклеофильный цианид-ион
атаки сверху один
образуется оптический изомер - ОПТИЧЕСКАЯ ИЗОМЕРИЯ Как могут образовываться оптические изомеры Карбонильные соединения подвергаются нуклеофильному присоединению. Если есть два разных групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров. НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ Если нуклеофильный цианид-ион атаки сверху один образуется оптический изомер Однако атака снизу, дает несовместимое зеркальное отражение первого
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ Как могут образовываться оптические изомеры Карбонильные соединения подвергаются нуклеофильному присоединению. Если есть два разных групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров. НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ Если нуклеофильный цианид-ион атаки сверху один образуется оптический изомер Однако атака снизу, дает несовместимое зеркальное отражение первого В результате реакции образуется смесь двух оптических изомеры, потому что возможны оба режима атаки
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Как могут образовываться оптические изомеры
Карбонильные соединения подвергаются нуклеофильному присоединению.
 Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
АНИМАЦИЯ
В результате реакции образуется смесь двух оптических
изомеры, потому что возможны оба режима атаки
Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
АНИМАЦИЯ
В результате реакции образуется смесь двух оптических
изомеры, потому что возможны оба режима атаки - ОПТИЧЕСКАЯ ИЗОМЕРИЯ Синтез 2-гидроксипропановой кислоты (молочной кислоты) МОЛОЧНАЯ КИСЛОТА может быть получена из этаналя в двухстадийном процессе. 1. Нуклеофильное присоединение цианистого водорода к этаналю. 2 Гидролиз нитрильной группы HCN Н+/ч3О
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ Синтез 2-гидроксипропановой кислоты (молочной кислоты) МОЛОЧНАЯ КИСЛОТА может быть получена из этаналя в двухстадийном процессе. 1. Нуклеофильное присоединение цианистого водорода к этаналю. 2 Гидролиз нитрильной группы HCN На первом этапе нуклеофильный ион CN- может атаковать снизу или сверху альдегид. Образуется смесь двух энантиомеров. Н+/ч3О
- ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Синтез 2-гидроксипропановой кислоты (молочной кислоты)
МОЛОЧНАЯ КИСЛОТА может быть получена из этаналя в двухстадийном процессе.
 1. Нуклеофильное присоединение цианистого водорода к этаналю.
2 Гидролиз нитрильной группы
HCN
На первом этапе нуклеофильный ион CN-
может атаковать снизу или сверху альдегид.
Образуется смесь двух энантиомеров.
Кислотный гидролиз смеси обеспечивает
смесь двух форм молочной кислоты.
Н+/ч3О
1. Нуклеофильное присоединение цианистого водорода к этаналю.
2 Гидролиз нитрильной группы
HCN
На первом этапе нуклеофильный ион CN-
может атаковать снизу или сверху альдегид.
Образуется смесь двух энантиомеров.
Кислотный гидролиз смеси обеспечивает
смесь двух форм молочной кислоты.
Н+/ч3О - ОПТИЧЕСКАЯ ИЗОМЕРИЯ — ТАЛИДОМИД
Единственным очевидным различием между оптическими изомерами является их реакция на плоскость.
поляризованный свет. Однако некоторые встречающиеся в природе молекулы или специально
синтезированные фармацевтические препараты проявляют различную химическую активность.
Препарат ТАЛИДОМИД представляет собой хиральную молекулу и может существовать в виде двух энантиомеров. в
В 1960-х годах его использовали для лечения беспокойства и утренней тошноты у беременных женщин.
К сожалению, многие рожали детей с уродствами и отсутствующими конечностями.
Оказалось, что эффективным оказался только один из энантиомеров (структура справа).
и безопасно; его оптически активного аналога не было.



 Другими словами, органические соединения, имеющие
та же молекулярная формула, но разное расположение
атомы углерода в них, известны как изомеры.
Другими словами, органические соединения, имеющие
та же молекулярная формула, но разное расположение
атомы углерода в них, известны как изомеры. Отличается характером функциональной группы.
Например, C3H602 имеет два изомера, а именно пропановую кислоту и
Метилэтаноат.
ПРОПАНОВАЯ АКД МЕТИЛЭТАНОАТ
Отличается характером функциональной группы.
Например, C3H602 имеет два изомера, а именно пропановую кислоту и
Метилэтаноат.
ПРОПАНОВАЯ АКД МЕТИЛЭТАНОАТ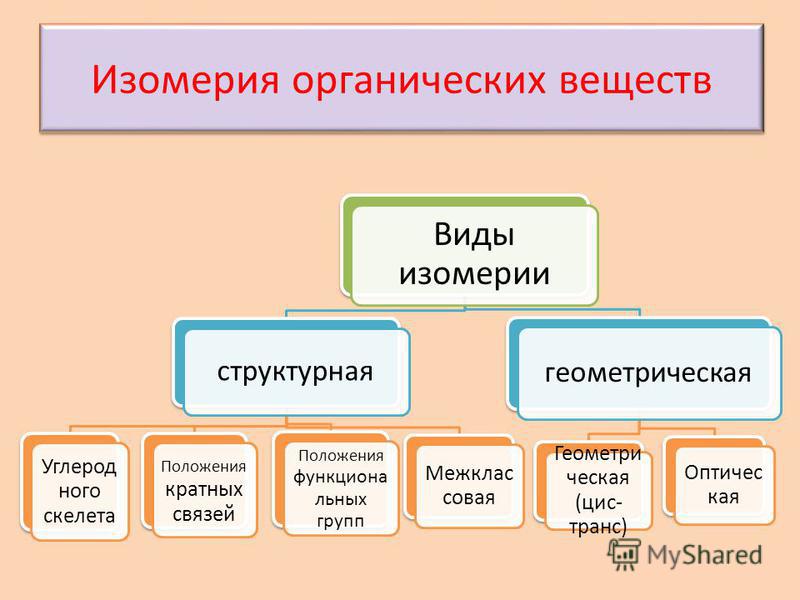 Например, нитроэтан и изонитроэтан являются таутомерными
изомеры.
НИТРОЭТАН (нитроформа) ИЗОНИТРОЭТАН (ациформа)
Например, нитроэтан и изонитроэтан являются таутомерными
изомеры.
НИТРОЭТАН (нитроформа) ИЗОНИТРОЭТАН (ациформа)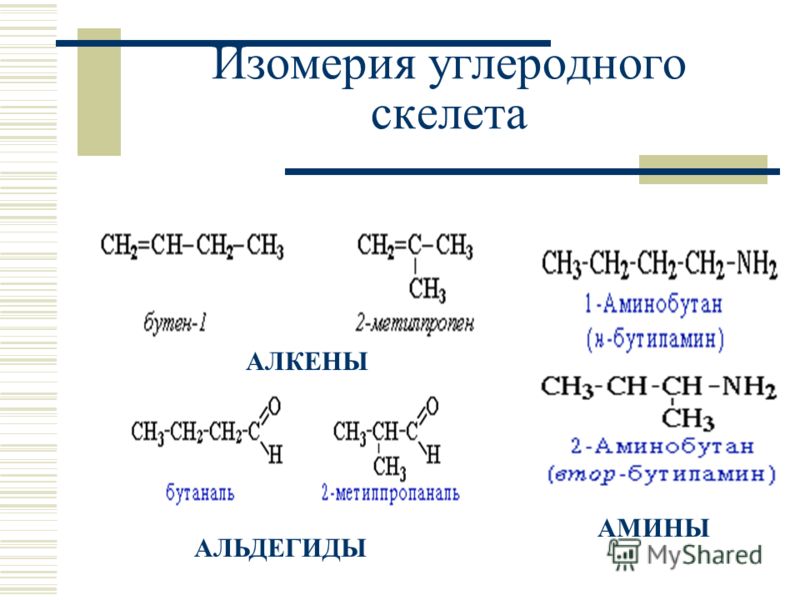 друг друга, называются энантиомерами.
Пример, d-аланин и l-аланин, молочная кислота и т. д.
друг друга, называются энантиомерами.
Пример, d-аланин и l-аланин, молочная кислота и т. д. Возникает из-за ограничения
вращение двойных связей С=С…
две формы… E и Z (СНГ и
ТРАНС)
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Происходит, когда молекулы имеют
хиральный центр. Получите два ненакладывающихся зеркальных изображения.
Возникает из-за ограничения
вращение двойных связей С=С…
две формы… E и Z (СНГ и
ТРАНС)
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Происходит, когда молекулы имеют
хиральный центр. Получите два ненакладывающихся зеркальных изображения. • Чем больше атомов углерода, тем больше возможных изомеров.
• Чем больше атомов углерода, тем больше возможных изомеров. чем больше степень разветвления, тем ниже температура кипения
разветвление снижает эффективность межмолекулярных сил
требуется меньше энергии для разделения молекул
— 0,5°С
прямая цепь
— 11,7°С
разветвленный
большее разветвление
= более низкая температура кипения
чем больше степень разветвления, тем ниже температура кипения
разветвление снижает эффективность межмолекулярных сил
требуется меньше энергии для разделения молекул
— 0,5°С
прямая цепь
— 11,7°С
разветвленный
большее разветвление
= более низкая температура кипения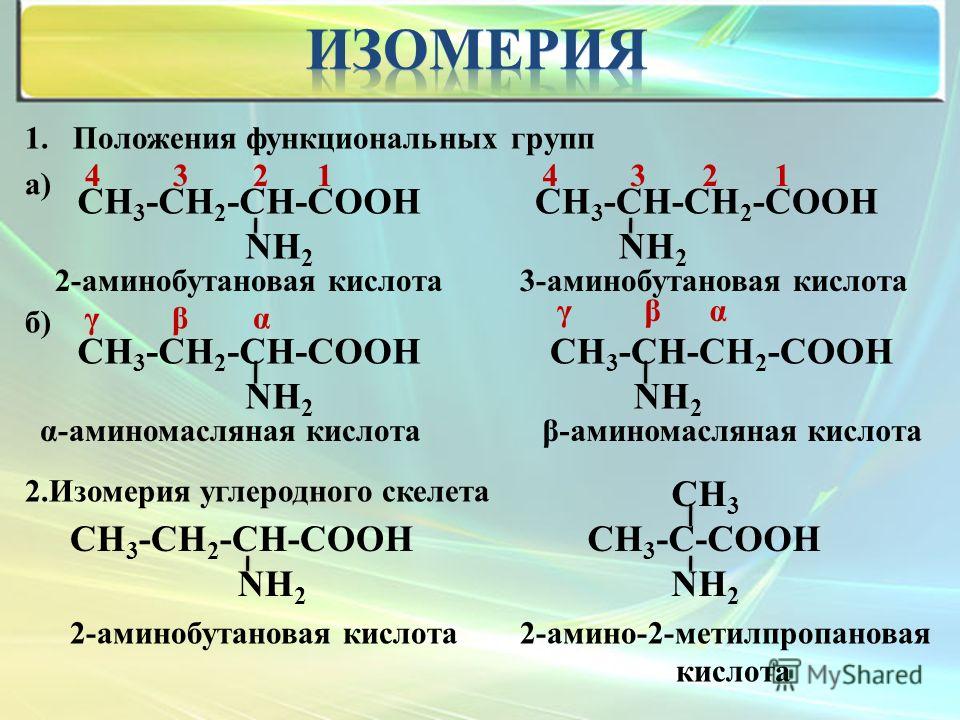 .. третий пример — 2-НЕ 3-хлорбутан.
Есть еще 2 структурных изомера C4H9.Cl, но у них самая длинная цепочка из 3
.. третий пример — 2-НЕ 3-хлорбутан.
Есть еще 2 структурных изомера C4H9.Cl, но у них самая длинная цепочка из 3 получить более высокую температуру кипения
и растворимость в воде
Химические свойства
База Льюиса
Широкий спектр реакций
Р-О-Р
Нет водородной связи
низкая температура кипения
нерастворим в воде
Инертный
получить более высокую температуру кипения
и растворимость в воде
Химические свойства
База Льюиса
Широкий спектр реакций
Р-О-Р
Нет водородной связи
низкая температура кипения
нерастворим в воде
Инертный Есть два типа…
• ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
• ОПТИЧЕСКАЯ ИЗОМЕРИЯ
Есть два типа…
• ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
• ОПТИЧЕСКАЯ ИЗОМЕРИЯ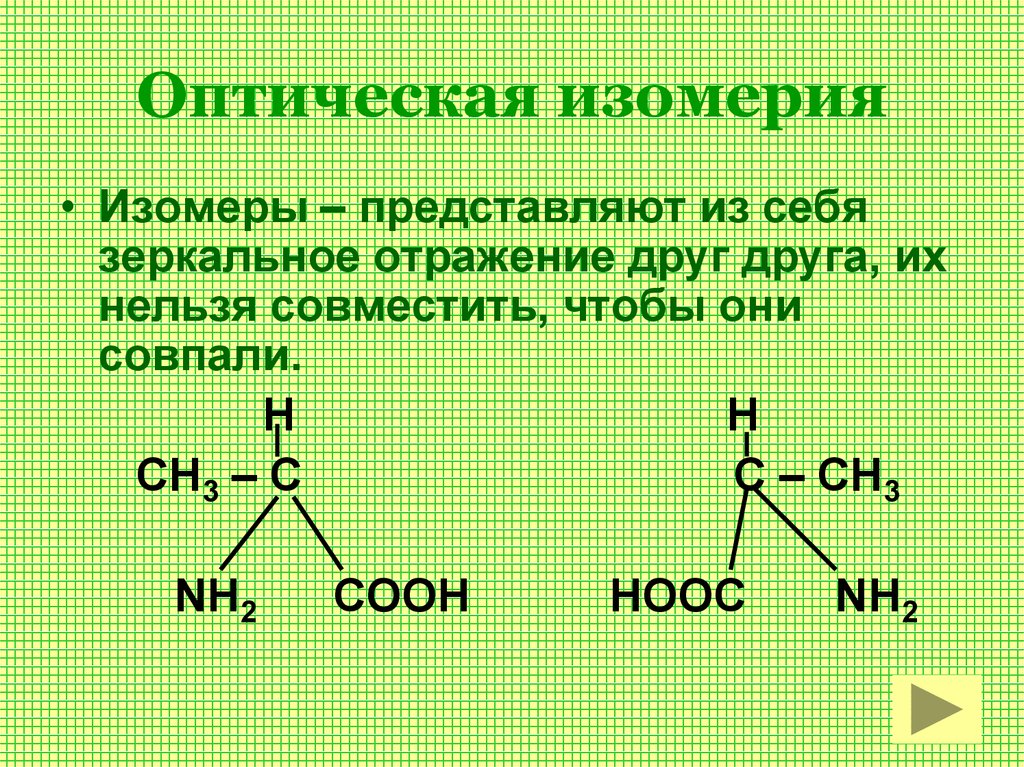 Анимация не
работа в старом
версии
Силовая установка
Это дает две возможности. Две структуры не могут легко взаимозаменяемы
поэтому атомы в двух молекулах занимают разные положения в пространстве.
Анимация не
работа в старом
версии
Силовая установка
Это дает две возможности. Две структуры не могут легко взаимозаменяемы
поэтому атомы в двух молекулах занимают разные положения в пространстве.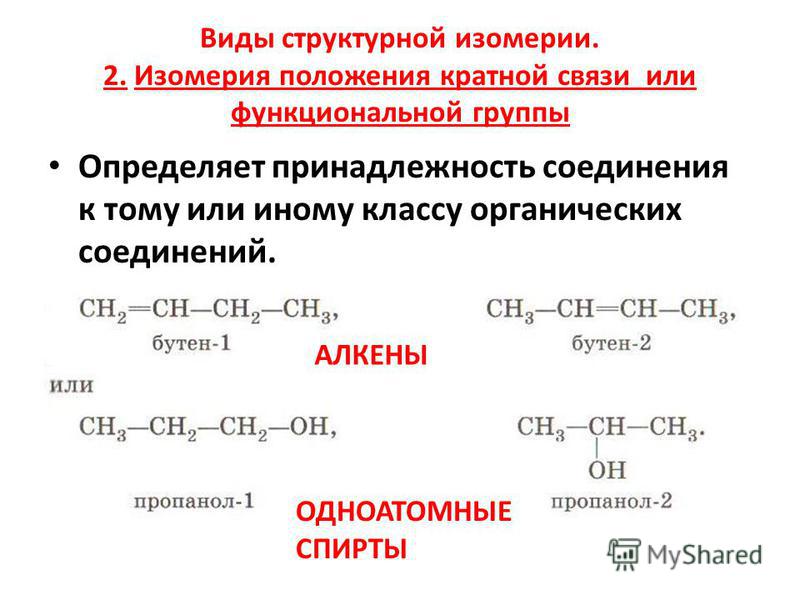 например
C2H5>Ч4>Н
и
I > Br > Cl > F > C > H
например
C2H5>Ч4>Н
и
I > Br > Cl > F > C > H цис
неводородные группы/атомы на
ОДИНАКОВАЯ сторона связи C=C
транс
неводородные группы/атомы на
ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
цис
транс
цис
транс
цис
неводородные группы/атомы на
ОДИНАКОВАЯ сторона связи C=C
транс
неводородные группы/атомы на
ПРОТИВОПОЛОЖНЫЕ стороны связи C=C
цис
транс
цис
транс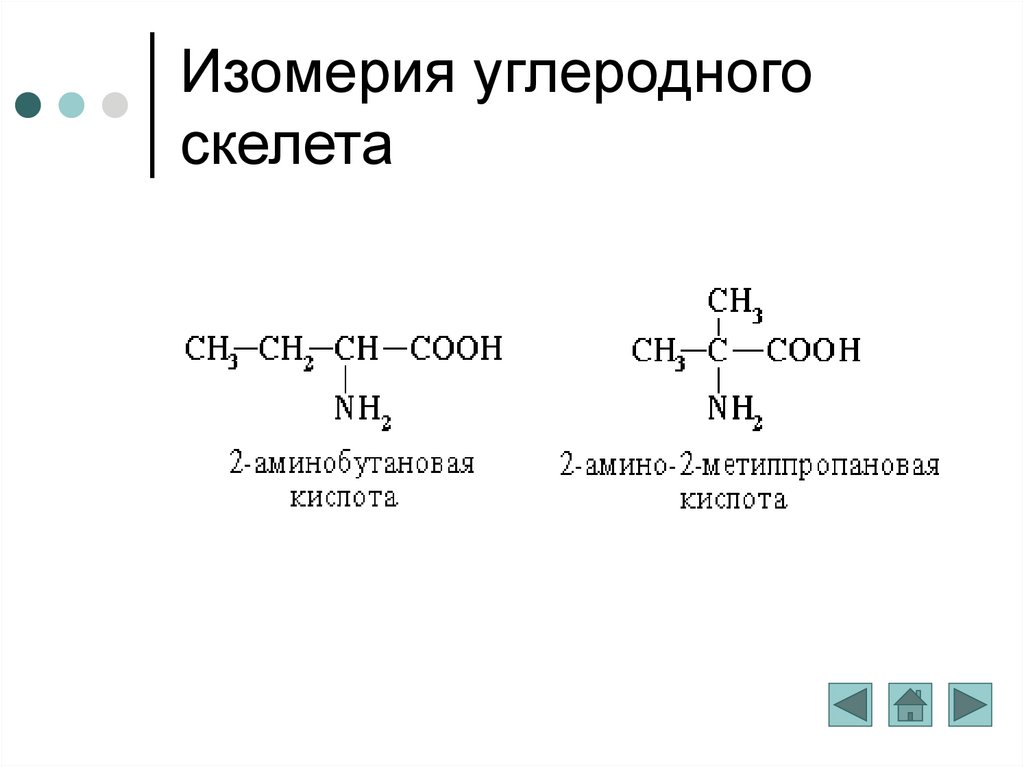 они возникают, когда молекулы имеют хиральный центр
хиральный центр содержит асимметричный атом углерода
асимметричный углерод имеет четыре разных атома (или группы)
расположены вокруг нее четырехгранно.
они возникают, когда молекулы имеют хиральный центр
хиральный центр содержит асимметричный атом углерода
асимметричный углерод имеет четыре разных атома (или группы)
расположены вокруг нее четырехгранно.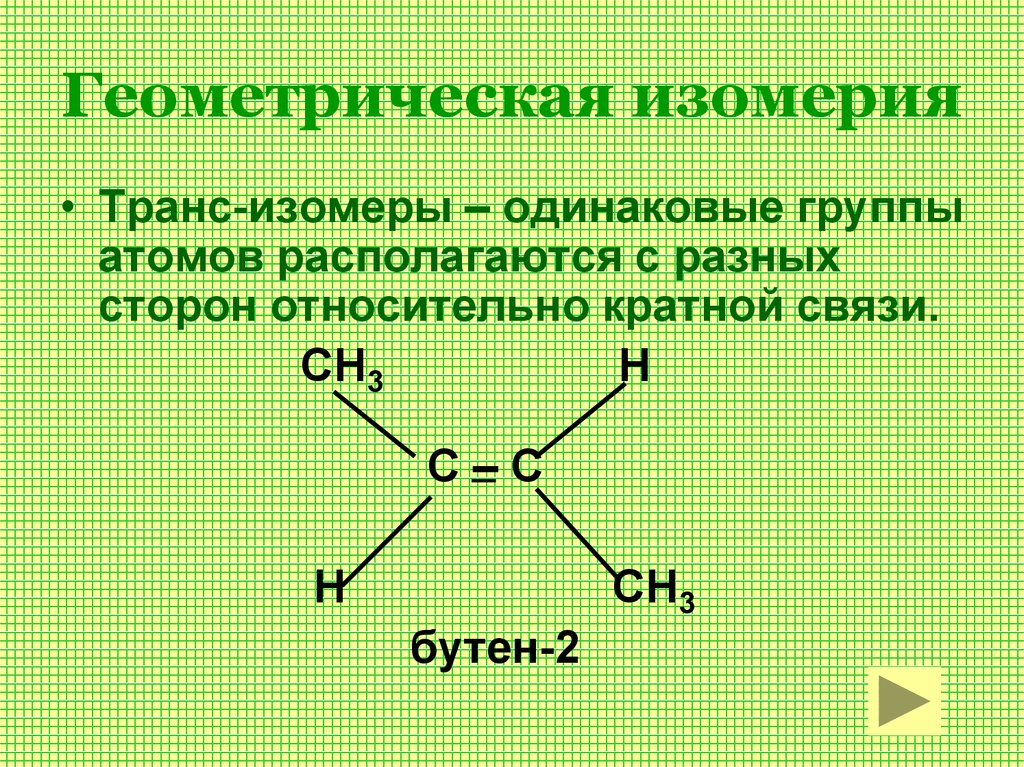 ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
 Для хирального центра
вам нужен асимметричный углерод с четырьмя различными атомами/группами), расположенными вокруг него тетраэдрически.
ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
Ч4Ч3СНClЧ4
2-хлорбутан
(Ч4)2СНЧ3Cl
1-хлор-2-метилпропанан
(Ч4)3CCl
2-хлор-2-метилпропанан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
С
С
С
С
3 H вокруг него
2 H вокруг него
H, Ch4, Cl, C2H5 вокруг него
3 H вокруг него
НЕ хиральный
НЕ хиральный
ХИРАЛЬНЫЙ
НЕ хиральный
C 3 H вокруг него
C 2 Ch4 вокруг него
C 2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
C 3 H вокруг него
C 3 Ch4 вокруг него
НЕ хиральный
НЕ хиральный
Для хирального центра
вам нужен асимметричный углерод с четырьмя различными атомами/группами), расположенными вокруг него тетраэдрически.
ЕСЛИ К УГЛЕРОДУ ПРИСОЕДИНЕНО БОЛЬШЕ ОДНОГО АТОМА/ГРУППЫ, ОН НЕ МОЖЕТ БЫТЬ ХИРАЛЬНЫМ
Ч4Ч3Ч3Ч3Cl
1-хлорбутан
Ч4Ч3СНClЧ4
2-хлорбутан
(Ч4)2СНЧ3Cl
1-хлор-2-метилпропанан
(Ч4)3CCl
2-хлор-2-метилпропанан
С
С
С
С
3 H вокруг него
2 H вокруг него
2 H вокруг него
2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
НЕ хиральный
С
С
С
С
3 H вокруг него
2 H вокруг него
H, Ch4, Cl, C2H5 вокруг него
3 H вокруг него
НЕ хиральный
НЕ хиральный
ХИРАЛЬНЫЙ
НЕ хиральный
C 3 H вокруг него
C 2 Ch4 вокруг него
C 2 H вокруг него
НЕ хиральный
НЕ хиральный
НЕ хиральный
C 3 H вокруг него
C 3 Ch4 вокруг него
НЕ хиральный
НЕ хиральный
 накладываемые, но не зеркальные изображения
не накладываемые зеркальные изображения
ложки
книги
Руки
накладываемые, но не зеркальные изображения
не накладываемые зеркальные изображения
ложки
книги
Руки
 Противоположные оптические эффекты каждого изомера компенсируют друг друга.
Примеры
Оптическая активность широко распространена в биохимии и фармацевтике.
• Большинство аминокислот проявляют оптическую активность
• многие лекарства должны быть сделаны из одного оптического изомера, чтобы быть эффективными
— нужны меньшие дозы (безопаснее и экономичнее)
— получить меньше побочных эффектов
— улучшенная фармакологическая активность
Противоположные оптические эффекты каждого изомера компенсируют друг друга.
Примеры
Оптическая активность широко распространена в биохимии и фармацевтике.
• Большинство аминокислот проявляют оптическую активность
• многие лекарства должны быть сделаны из одного оптического изомера, чтобы быть эффективными
— нужны меньшие дозы (безопаснее и экономичнее)
— получить меньше побочных эффектов
— улучшенная фармакологическая активность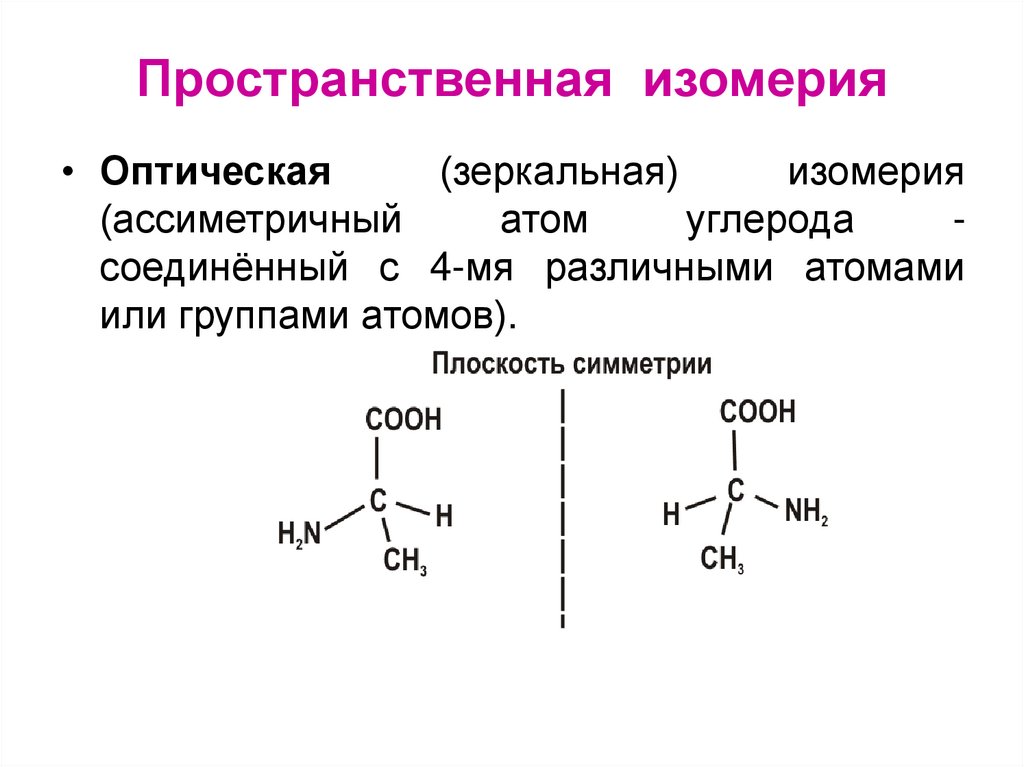 Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
Если нуклеофильный цианид-ион
атаки сверху один
образуется оптический изомер
Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
Если нуклеофильный цианид-ион
атаки сверху один
образуется оптический изомер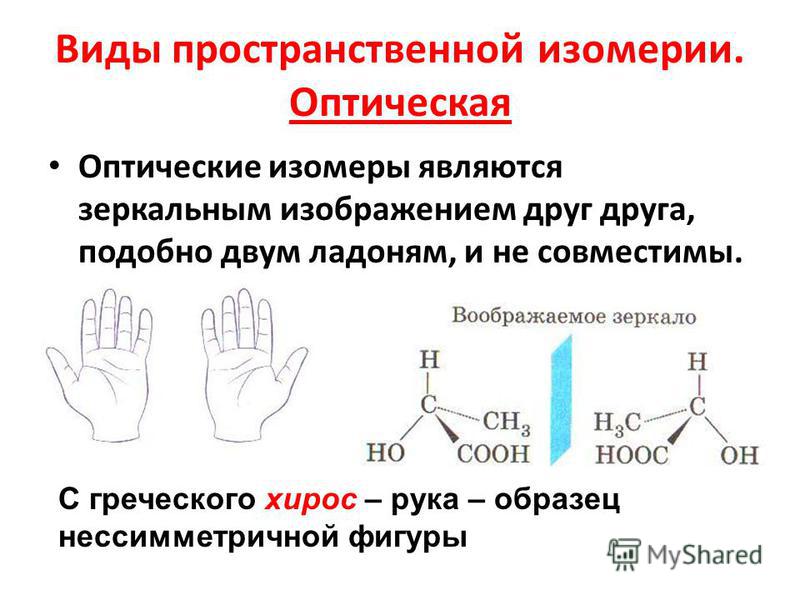 Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
АНИМАЦИЯ
В результате реакции образуется смесь двух оптических
изомеры, потому что возможны оба режима атаки
Если есть два разных
групп, присоединенных к связи С=О, возникает возможность образования оптических изомеров.
НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ HCN К ЭТАНАЛЮ
АНИМАЦИЯ
В результате реакции образуется смесь двух оптических
изомеры, потому что возможны оба режима атаки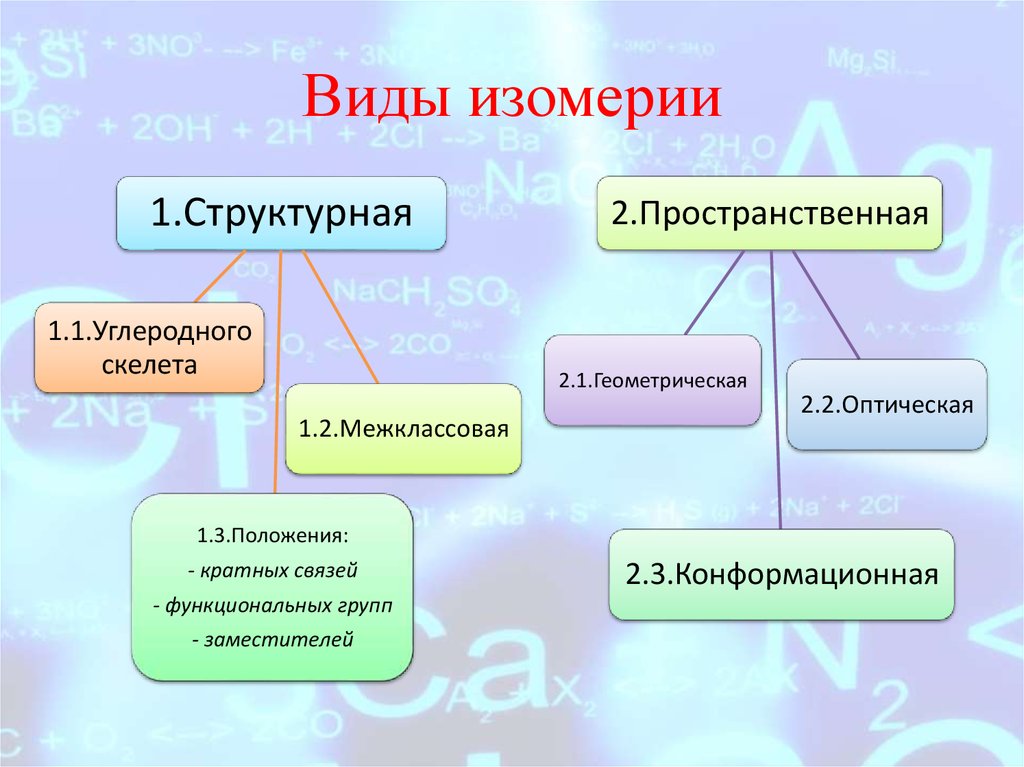 1. Нуклеофильное присоединение цианистого водорода к этаналю.
2 Гидролиз нитрильной группы
HCN
На первом этапе нуклеофильный ион CN-
может атаковать снизу или сверху альдегид.
Образуется смесь двух энантиомеров.
Кислотный гидролиз смеси обеспечивает
смесь двух форм молочной кислоты.
Н+/ч3О
1. Нуклеофильное присоединение цианистого водорода к этаналю.
2 Гидролиз нитрильной группы
HCN
На первом этапе нуклеофильный ион CN-
может атаковать снизу или сверху альдегид.
Образуется смесь двух энантиомеров.
Кислотный гидролиз смеси обеспечивает
смесь двух форм молочной кислоты.
Н+/ч3О